(2: 中国科学院大学, 北京 100049)
(3: 苏州科技大学环境科学与工程学院, 苏州 215009)
(4: 河海大学水文水资源学院, 南京 210098)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: College of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009, P. R. China)
(4: College of Hydrology and Water Resources, Hohai University, Nanjing 210008, P. R. China)
近年来,大气CH4、CO2这2种主要温室气体的浓度持续上升[1],对人类生存以及社会经济可持续发展造成了严重威胁,温室效应已成为全球最为关注的环境问题之一.淡水生态系统是重要的温室气体释放源,其释放到大气的CH4占自然源CH4总释放量的比例高达6%~16%[2],湖泊CO2释放量相当于河流中向海洋输送有机碳和无机碳总量的一半[3].尽管内陆水体仅占陆地总面积的3.7%[4],但其在全球碳循环以及气候调控中具有不可忽视的重要作用.
随着人类社会经济增长,湖泊营养化水平不断提高,蓝藻水华成为普遍的环境问题.大量增殖的蓝藻降解可能促使蓝藻水华与湖泊富营养化、气候变暖之间形成恶性循环,这种反馈包括2条途径[5-7]:一个途径是蓝藻降解释放营养物质(N、P)加剧了淡水的富营养化状态,促进了蓝藻水华的形成;另一种途径是,藻源性有机质矿化产生CH4、CO2等温室气体排放到大气中,导致全球变暖,温度升高将促进蓝藻水华暴发. Huttunen等对芬兰部分寒带富营养化湖泊CH4排放量进行研究,结果表明营养状态是影响湖泊CH4释放的重要因素[8];West等对温带湖泊研究表明,富营养化状态也对温室气体释放发挥着重要促进作用[9-10].在湖泊中,CH4由微生物分解沉积物或者缺氧水体中有机质产生[11-14].富营养化增加了藻源性有机质积累[15-16],从而促进CH4的产率[9, 17].而湖泊CO2主要受光合作用、呼吸作用、分解作用等生物理化过程共同影响,这些过程同时受气候变暖和人类活动的双重影响,使得CO2产生和排放过程变得更加复杂.一方面气候变暖可能会引发全球水循环加强,促进了内陆径流量,使得湖泊水体接收更多的陆源性有机碳,这些外源负荷在水体中降解排放出大量的CO2,进而影响湖泊碳源汇功能[18].另一方面人类活动向湖泊等内陆水体输入大量的营养盐,造成水体富营养化程度加剧,提升了湖泊水体初级生产力,促进湖泊碳循环过程中光合作用吸收大气中CO2能力[19-21].
我国多数湖泊水体富营养化程度日趋严重,不同程度的富营养化湖泊约占全国湖泊总量59.1%[22].随着湖泊富营养化程度加剧,导致蓝藻水华频繁暴发[23],造成水环境质量恶化.蓝藻打捞技术作为一种简单易行、见效快、副作用小的物理技术,已普遍应用于蓝藻原位削减控制[24].以往对于打捞蓝藻多关注于藻源性污染物的释放、蓝藻生长及氮磷方面研究[25-28],而对于蓝藻打捞人为控藻过程对湖泊温室气体通量影响目前鲜有报道.
现有湖泊CH4、CO2通量观测方法有水平衡法、静态箱观测法及涡度相关法[29].静态箱-便携式温室气体分析仪方法因可以同时观测水-气界面CH4、CO2等多种气体的通量、操作方便、分析精度高以及灵活设置采样点等优点,得以广泛应用[30-32].本研究选择我国典型富营养化浅水湖泊巢湖作为研究对象,在巢湖西北湖岸带设置2组大型围隔,运用YL-1000型大型仿生式水面蓝藻清除设备进行原位连续打捞蓝藻实验,采用静态箱-便携式温室气体分析仪方法测定大型围隔内水-气界面CH4、CO2气体通量,研究巢湖湖岸带蓝藻聚积区连续打捞过程中水-气界面CH4、CO2通量的变化规律,为进一步认识湖泊碳循环和蓝藻水华灾害防控提供科学数据支撑和理论参考.
1 材料与方法 1.1 实验位置实验设置在蓝藻水华频繁暴发的巢湖西北湖岸带,设置2个1000 m×100 m的大型全封闭围隔,分别记为打捞区、未打捞区(图 1a).两个围隔分别用6根钢管钎入湖底加以固定,用铁链固定围隔底部(图 1b).围隔用聚氯乙烯涂塑布经高温热合机结合而成,韧性及防水性能强,为防止风浪将湖水涌入围隔,围隔边缘用帆布包裹浮球,保证实验期间围隔内水体与外界水体无交换作用.

|
图 1 采样点位(a)、围隔(b)、蓝藻清除设备(c) Fig.1 Sampling sites (a), enclosure (b), cyanobacteria removal equipment (c) |
实验选择在秋季进行,具体时间为2018年10月8日-11月6日,共29 d.打捞开始前(第0天),分别在打捞区、未打捞区围隔对角线各采集3个样品,作为背景值,次日在打捞区运行YL-1000型大型仿生式水面蓝藻清除设备(ZL200910026679.0)连续打捞清除蓝藻.蓝藻清除设备采用固定式除藻方式,位于围隔内下风向,避免船桨对水体的扰动. YL-1000型蓝藻清除设备长13.5 m,宽12 m,吃水深度0.3 m,由180片鳃式过滤器(ZL200910031268.0)组成,单片鳃式过滤器由400目特制不锈钢筛网制成(筛网孔径30 μm),处理蓝藻量为1000 m3/h,汲藻泵将富藻水抽送至过滤器上端,通过无压过滤,进行藻水分离,清水透过筛网排入湖中,藻体截留在筛网表面顺势进入收集槽,浓藻浆装入藻浆袋中,运至蓝藻处理站.打捞区作业时长为每天6 h,未打捞区围隔为对照组,不进行蓝藻打捞处理.
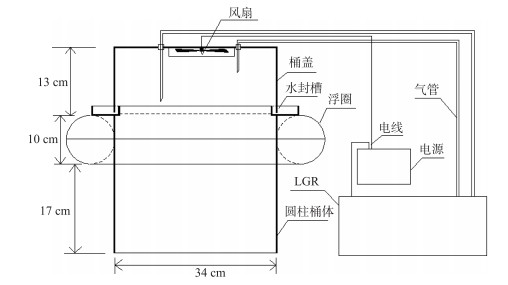
1.2.2 大型围隔内水-气界面CH4、CO2通量观测及采样本研究连续打捞蓝藻过程中水-气界面CH4、CO2通量观测时间为2018年10月8日-11月4日,观测周期为27 d,每3 d观测1次.连续打捞蓝藻后水-气界面CH4、CO2通量昼夜观测时间为2018年11月5日-11月6日,共2 d,每2 h观测1次.打捞区、未打捞区围隔对角线分别设置3个采样点.围隔区水-气界面CH4、CO2通量观测基于静态箱原理,采用便携式温室气体分析仪(915-0011-CUSTOM,Los Gatos Research,SF,USA)对箱体内积累的CH4、CO2浓度进行实时监测.本研究对静态箱的设计改进如图 2所示.改进静态箱箱体由有机玻璃圆柱桶体(体积0.02 m3,直径34 cm,高40 cm)、桶盖(直径34 cm,高13 cm)和浮圈(截面直径10 cm)组成;桶盖顶部装有风扇,使箱体中气体混合均匀;进气管和出气管粘贴固定在桶盖顶部,分别连通LGR进气口和出气口,即在持续抽出箱体内的气体进行分析的同时将分析后的气体通过管道排回箱体内,以保证箱体内部环境不因LGR的分析过程而改变,从而实现CH4、CO2浓度实时测定.为防止箱内长时间气体积累导致水-气界面气体交换受阻以及箱内温、湿度与箱外条件差异过大,影响监测结果,每个点位测量时间为10 min.每次测量前,先将套有浮圈的桶体放置于水面,然后将连接有分析仪的桶盖扣于桶体上部水封槽中,注入少量水于桶体上部水封槽中,用于水封桶体与桶盖连接处;测量完成后,将桶盖掀起放置好,再将桶体拿出水面,迅速移至下个采样点位.为了减小光照、温度和风速等气象因子对测量的影响,采样在10:00-11:30完成.采气同时,现场测定水体物理指标.采集围隔内水柱水样,储于1 L水样瓶中,并保存于带有冰盒的保温箱中,运回实验室进行水质理化指标分析.
|
图 2 静态箱示意图 Fig.2 Schematic diagram of the floating chamber |
实验期间采用便携式多参数水质分析仪(AP2000,Aquaread公司,英国)测定水体水温(T)、溶解氧(DO)、pH、氧化还原电位(ORP)、浊度(TURB)、电导率(EC).用Kestrel 4500型便携式气象仪测量采样时的瞬时风速、风向.
1.3.2 有机物指标测定高锰酸盐指数(CODMn)参照《水和废水监测分析方法(第四版)》测定[33].水样经过450℃灼烧4 h后的GF/F膜(0.7 μm)过滤,滤液用总有机碳定仪(TOC5000A,岛津)测定溶解性有机碳(DOC).水样经Millipore混合纤维素酯膜(0.22 μm)过滤,滤液用紫外可见光光度计(UV2700,岛津)进行光谱扫描,扫描波长范围为200~800 nm,间隔为1 nm;用荧光分光光度计(Fluorolog-3,HORIBA,日本)进行三维荧光光谱扫描测定.激发波长范围为200~450 nm,间隔为5 nm,发射波长范围为250~600 nm,间隔为1 nm.实验以Milli-Q超纯水为背景值. EEM-PARAFAC组分分析首先结合紫外可见光谱数据
进行内滤效应修正,三维荧光光谱数据扣除超纯水背景值以消除拉曼散射,将出现瑞利散射的置零,消除瑞利散射影响,在MATLAB 2012a中运行DOMFluor工具箱,对三维荧光光谱数据进行平行因子分析(Parallel factor,PARAFAC),并得到组分模型[34-35].
1.4 计算方法 1.4.1 CH4、CO2通量计算采用静态箱法-便携式温室气体分析仪法[32]对水-气界面测定一段时间间隔内,箱内CH4、CO2气体浓度的变化,从而计算得到CH4、CO2气体通量(正值表示排放,负值表示吸收),计算公式如下:
| $ F = \frac{{\left( {{C_2} - {C_1}} \right) \cdot h}}{{\Delta t \cdot {V_m}}} $ | (1) |
式中,F为温室气体通量,其中CH4、CO2通量单位分别为nmol/(m2 ·s)、μmol/(m2 ·s);c1、c2为t1、t2时刻的气体浓度,单位为nmol/mol;Δt为t2-t1的时间间隔,单位为s;h为箱体高度,单位m,本研究箱体高度为0.4 m;Vm为气体摩尔体积,本实验取Vm=22.4 L/mol.
1.4.2 打捞对CH4、CO2温室气体综合减排通量计算CH4、CO2温室气体综合减排通量计算公式如下:
| $ {F_{\left( {温室气体综合减排通量} \right)}} \\ = \Delta {F_{\left( {{\rm{C}}{{\rm{H}}_2}} \right)}} \cdot {K_{\left( {{\rm{C}}{{\rm{O}}_2}{\rm{equivalent }}} \right)}} + \Delta {F_{\left( {{\rm{C}}{{\rm{O}}_2}} \right)}} \cdot {K_{\left( {有机质总矿化度{\rm{C}}{{\rm{H}}_{\rm{4}}}占比} \right)}} \ \ \ \ \ \ \cdot \left( {{K_{\left( {{\rm{C}}{{\rm{O}}_2}{\rm{equivalent }}} \right)}} - 1} \right) $ | (2) |
式中,F(温室气体综合减排通量)为连续打捞蓝藻后对湖泊温室气体综合减排通量,均换成CO2当量表示,单位为μmol/(m2 ·d);ΔF(CH4)为连续打捞蓝藻后未打捞区与打捞区CH4温室气体日平均通量之差,单位为μmol/(m2 ·d);ΔF(CO2)为连续打捞蓝藻后未打捞区与打捞区CO2温室气体日平均通量之差,单位为μmol/(m2 ·d);K(CO2 equivalent)为CH4换算成CO2温室效应增温潜势系数,取为25倍[1];K(有机质总矿化度CH4占比)为有机质总矿化度CH4占比,取50%[6, 36].
1.4.3 荧光光谱参数、紫外-可见光谱参数计算荧光光谱参数、紫外-可见光谱参数计算见表 1.
| 表 1 荧光光谱参数、紫外-可见光谱参数描述[15, 37-38] Tab. 1 Description of fluorescence spectral parameter and ultraviolet-visible spectral parameter[15, 37-38] |
用Excel 2007、Origin 9.0、R-studio 0.99.903(R 3.5.1)软件进行数据处理、图形绘制.利用Matlab 2012a对三维荧光数据进行处理.使用R-studio 0.99.903(R 3.5.1)软件分析有、无打捞蓝藻对各种环境理化指标和CH4、CO2通量的显著性分析;对按打捞区和未打捞区归类、并且符合方差齐性的所有变量进行配对T检验,对不合方差齐性的变量进行2个相关性样本非参数检验;利用R-studio 0.99.903(R 3.5.1)软件中ggplot2软件包对CH4、CO2通量和各种环境理化指标之间进行Pearson相关性分析和线性逐步回归分析;R-studio 0.99.903(R 3.5.1)软件中randomForest软件包对CH4、CO2通量主要影响因子进行相对重要性分析;采用CANOCO 5.0软件对CH4、CO2通量和各种环境理化指标进行冗余分析(RDA).
2 结果与分析 2.1 打捞蓝藻对水体理化特征的影响野外采样期间,平均风速为1.5 m/s,主导风向为东风,平均气温为22℃,2组围隔平均水深为1.4 m.蓝藻打捞过程围隔内水体理化性质变化如表 2所示.实验期间围隔内水温变化范围为24.6~17.6℃,平均水温为19.4±1.8℃,第0天开始与第27天结束采样时水温相差6℃左右.打捞区打捞后pH上升,未打捞区pH无明显变化,打捞区平均pH明显高于未打捞区(P < 0.01).打捞区和未打捞区DO浓度、ORP呈明显下降变化,打捞区DO浓度、ORP低于未打捞区.实验期间,打捞区打捞蓝藻后EC下降,相反,未打捞区EC上升,前者(485±24 mS/cm)显著低于后者(525±37 mS/cm)(P < 0.05).打捞区打捞蓝藻后TURB显著下降(P < 0.01),打捞区TURB(53.9±13.6 NTU)明显低于未打捞区(71.1±7.3 NTU)(P < 0.01),打捞对水体浊度具有明显改善作用.打捞区初始Chl.a浓度为137.7 μg/L,经过连续蓝藻打捞后降低到29.6 μg/L,去除率达到78.5%;未打捞区Chl.a浓度保持较为稳定,为124.5±9.5 μg/L,打捞区与未打捞区Chl.a浓度存在显著差异(P < 0.01).打捞区打捞后SS、TN、TP浓度呈明显下降变化,未打捞区变化不明显,并且打捞区显著低于未打捞区(P < 0.01),说明连续打捞蓝藻对水体中SS、TN、TP浓度具有明显削减作用.打捞区与未打捞区DTN、DTP浓度变化均不显著(P > 0.05),其中DTN、DTP浓度分别占TN、TP浓度的32.12%、22.21%,实验区水体氮磷营养盐以颗粒态为主.蓝藻连续打捞清除过程中对打捞区围隔内颗粒态物质去除效果十分明显,水体中SS、TN、TP去除率分别为85%、45%、52%.连续打捞过程中打捞区CODMn控制效果十分明显(P < 0.01),从第0天的CODMn 27.3 mg/L下降至第27天22.6 mg/L,去除率为17.47%;打捞区与未打捞区CODMn平均浓度分别为25.3±1.4和26.5±0.5 mg/L,差异显著(P < 0.01).打捞控制水体中DOC浓度效果不显著(P > 0.05),打捞区与未打捞区中DOC浓度均呈缓慢上升趋势,但打捞区DOC浓度平均值(15.46±0.66 mg/L)低于未打捞区(16.73±1.34 mg/L).
| 表 2 连续打捞过程基本理化性质特征 Tab. 2 Basic physical and chemical properties of cyanobacteria during continuous salvaging |
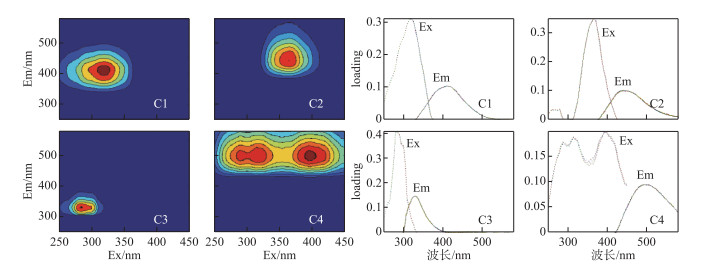
由平行因子分析法分析得到连续打捞蓝藻过程中打捞区与未打捞区水体中DOM的主要组分有4个,分别为C1、C2、C3、C4组分(图 3),同时用OpenFluor在线数据库[39]将4个组分与已发表的平行因子分析模型进行比对,激励和发射相似度评分均超过0.95.如表 3所示,C1三维荧光光谱特征的激发波长为320 nm,发射波长为410 nm,与首次在海洋中发现的海洋腐殖质样荧光峰M相似,这可能与微生物代谢类腐殖质有关[40-43]. C2在365 nm处为最大激发,440 nm处为最大发射,属于可见类腐殖质荧光峰C,与一组高分子量、陆源性芳香分子有关[44-46]. C3在285 nm激发和322 nm发射处出现特征峰值,属于类蛋白物质荧光峰B,对微生物的降解很敏感,且激发与发射波长范围恰好处于类色氨酸荧光峰范围内,含有类色氨酸基团,属于色氨酸类,可认为源于水体藻类降解[40-41, 47].在C4的三维荧光光谱中,在500 nm发射波长处存在两个激发极大值(290、395 nm),这与Kothawala等[48]观察到的类腐殖质荧光相似. DOM中组分的荧光峰最高处的荧光强度(Fmax)表明,同一组分中荧光强度越大,相对含量越高[49].
|
图 3 不同处理围隔水体DOM的三维荧光图谱 Fig.3 Fluorescence excitation-emission matrix of DOM in the control and salvaging enclosures |
| 表 3 平行因子分析4种荧光成分的激发与发射极大值的光谱特征与OpenFluor在线数据库相比 Tab. 3 Spectral characteristics of excitation and emssion maxima of fluorescent components identified by PARAFAC analyses compared to the OpenFluor online database |
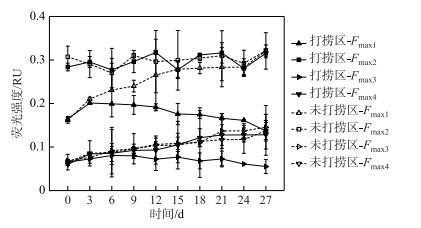
由图 4可知,打捞区微生物代谢类腐殖质(C1)强度(Fmax1)呈先上升后逐渐下降的趋势,未打捞区则呈逐渐上升的趋势,两者存在显著差异(P < 0.01),前者C1强度(0.18±0.02 RU)低于后者(0.26±0.05 RU).打捞区与未打捞区陆源类腐殖质(C2)强度(Fmax2)在连续打捞过程中两者均变化不显著(P > 0.05),两区C2组分荧光强度平均值分别为0.30±0.01、0.29±0.02 RU.打捞区原生性类蛋白(C3)强度(Fmax3)随着打捞时间的增加而逐渐降低,相反,未打捞区则呈缓慢增加的趋势,两者存在显著差异(P < 0.01),未打捞区(C3)强度(0.12±0.03 RU)约为打捞区(0.06±0.01 RU)的2倍.打捞区、未打捞区类腐殖质(C4)强度(Fmax4)均随时间增加而逐渐增加,两者之间无显著差异(P > 0.05),打捞区、未打捞区C4强度平均值均为0.10±0.02 RU.
|
图 4 不同处理围隔平行因子模型各组分(C1~C4)荧光强度随时间变化趋势 Fig.4 The variation of fluorescence intensities of C1 to C4 in the control and salvaging enclosures |
三维荧光光谱特性可用来表征水体中DOM性质以及溯源的重要参数[50].通过计算水样荧光、紫外-可见光谱参数(表 4)并结合其表征意义(表 1)可知,实验过程中打捞区与未打捞区2个大型围隔内水体HIX < 4、BIX > 1、FI > 1. 8,说明了水体中的DOM主要由内源贡献[51-53].有研究表明由紫外-可见光谱参数计算得出SR值与有机质的分子量呈反比[50, 54],实验周期内打捞区SR值随着时间增加而变大,未打捞区SR值变化较小,两者存在显著差异(P < 0.05),这与连续打捞过程中蓝藻分解释放藻源性有机质降解有关[54].打捞区SR值(5.19±0.35)高于未打捞区(4.89±0.09),表明打捞使得大分子有机质更易降解为小分子有机质[54].
| 表 4 实验期间不同处理围隔水体荧光、紫外-可见光谱参数的变化比较 Tab. 4 Comparisons of fluorescence and UV-vis parameters in different treatment groups during the study periods |
连续打捞蓝藻过程打捞区与未打捞区水-气界面CH4通量变化如图 5a所示.打捞区CH4通量随时间增加呈逐渐下降的趋势,未打捞区则变化不明显;打捞区、未打捞区CH4通量分别处于2.233~15.874、12.501~17.502 nmol/(m2 ·s)范围内,两者存在显著差异(P < 0.01);未打捞区CH4通量平均值(17.473±1.514 nmol/(m2 ·s))为打捞区(7.004±4.163 nmol/(m2 ·s))的近2倍,说明打捞移除蓝藻对水-气界面CH4通量具有重要影响.经线性拟合计算,打捞区CH4通量前9天下降速率为-9.12×10-6 nmol/(m2 ·s2)(R2=0.94),到第9天后下降速率略微变缓,为-4.21×10-6 nmol/(m2 ·s2)(R2=0.80).

|
图 5 连续打捞蓝藻过程水-气界面CH4(a)、CO2(b)通量变化特征 Fig.5 Variation characteristics of CH4 flux (a) and CO2 flux (b) on water-air interface in the control and salvaging enclosures |
蓝藻连续打捞过程大型围隔内水-气界面CO2通量变化如图 5b所示.打捞区和未打捞区CO2通量均为负值,说明水-气界面CO2通量呈吸收状态.打捞区CO2通量前18天呈上升趋势,后18天变化趋于平缓,对CO2通量变化速率分别进行线性拟合,两者CO2通量变化速率分别为4.12×10-7 μmol/(m2 ·s2)(R2=0.95)和0.12×10-7 μmol/(m2 ·s2)(R2=0.23).实验期间未打捞区CO2通量变化不明显,处于-0.371 ~-0.313 μmol/(m2 ·s)范围.打捞区CO2吸收通量(-0.200 ± 0.069 μmol/(m2 ·s))明显低于未打捞区(-0.344±0.017 μmol/(m2 ·s)),两者存在显著差异(P < 0.05),说明了蓝藻打捞显著影响水-气界面CO2吸收通量.经线性拟合计算,打捞区CO2通量前15天上升速率为1.15×10-7 μmol/(m2 ·s2)(R2=0.95),第15天后上升速率十分缓慢,为4.02×10-9 μmol/(m2 ·s2)(R2=0.02).
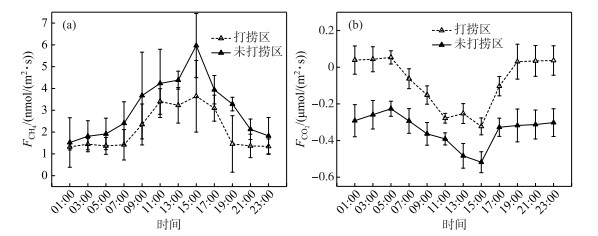
2.3.2 连续打捞蓝藻后CH4、CO2通量日变化特征蓝藻连续打捞后大型围隔内水-气界面CH4日通量变化如图 6a所示.打捞区和未打捞区CH4日通量均为正值,说明水-气界面CH4全天均呈释放状态.未打捞区CH4日平均通量(0.267±0.119 mmol/(m2 ·d))约为打捞区(0.183±0.082 mmol/(m2 ·d))的1.5倍,说明连续打捞蓝藻后对水-气界面CH4通量具有重要影响.打捞区和未打捞区白昼CH4通量均高于夜间,且CH4通量存在昼夜显著差异(P < 0.01),两者CH4通量日变化峰值均出现在15:00,分别为1.461±0.821、3.293±0.312 nmol/(m2 ·s);两者的CH4通量日变化谷值均出现在1:00,分别为1.322±0.143、1.521±0.544 nmol/(m2 ·s).
|
图 6 连续打捞后水-气界面CH4(a)、CO2(b)通量昼夜变化特征 Fig.6 Diurnal variation characteristics of CH4(a) and CO2(b) fluxes on water-air interface in the control and salvaging enclosures |
蓝藻连续打捞后大型围隔内水-气界面CO2日通量变化如图 6b所示.未打捞区CO2吸收日平均通量(-29.424±7.470 mmol/(m2 ·d))约为打捞区(-6.723±12.222 mmol/(m2 ·d))的4.4倍,说明连续打捞蓝藻后对水-气界面CO2通量具有重要影响.打捞区和未打捞区夜间CO2通量明显高于白昼,存在昼夜差异(P < 0.01),两者日变化峰值均出现在5:00,分别为0.054±0.016、-0.227±0.041 μmol/(m2 ·s);谷值均出现在15:00,分别为-0.323±0.046、-0.518±0.057 μmol/(m2 ·s).打捞区在07:00~17:00时段内CO2通量为负值,19:00-次日05:00时段内为正值,说明了打捞区CO2通量白昼、夜间分别为吸收、释放状态;未打捞区CO2通量全天呈吸收状态.
2.4 连续打捞蓝藻过程水-气界面CH4、CO2通量与水体理化指标之间的关系为探究环境因子对水-气界面CH4、CO2通量的影响,对CH4、CO2通量和环境因子进行冗余分析(RDA)(图 7),第一主轴对CH4、CO2通量方差变化的解释量为10.4%,第二主轴的解释变量为78.7%.其中EC、DOC和T与第一主轴呈显著正相关;pH和ORP与第一主轴呈负相关;C2和C4与第二主轴呈显著正相关;ORP、DTN、DTP、DO、C1、C3、COD、TURB、Chl.a、TN、TP和SS与第二主轴呈负相关.可见,水体中的Chl.a、营养盐水平、有机物、T以及pH均对打捞蓝藻过程水-气界面CH4、CO2通量有一定影响. CH4通量受Chl.a浓度影响较大,且与SS、TN、TP、TURB、CODMn、C1、C3、T呈显著正相关(P < 0.01);而CO2通量与ORP、C2、EC呈显著正相关(P < 0.01),与T、C4呈负相关.打捞区与未打捞区具有明显差别(P < 0.01),打捞区Chl.a、SS、TN、TP、CODMn、C1、C3浓度呈显著时间梯度差异,连续进行打捞蓝藻导致其浓度不断降低;未打捞区上述物质浓度均较高,且较为恒定,明显高于打捞区.对打捞区环境因子与CH4通量、CO2通量分别进行逐步回归分析得到,Chl.a、C1、C3为CH4通量最优解释变量(CH4通量=0.02 Chl.a+83.60 C1+57.20 C3-10.71,R2=0.95,P < 0.01);Chl.a、T为CO2通量最优解释变量(CO2通量=0.547-0.003 Chl.a-0.028 T,R2=0.86,P < 0.01).对未打捞区的环境因子与CH4通量、CO2通量分别进行逐步回归分析得到,C1、C3为CH4通量最佳解释变量(CH4通量=0.018 C1-0.057 C3+0.016,R2=0.61,P < 0.05);T、SS为CO2通量最佳解释变量(CO2通量=0.002 SS-0.004 T-0.432,R2=0.53,P < 0.05).

|
图 7 连续打捞下CH4、CO2通量与理化指标RDA分析 Fig.7 Redundancy analysis(RDA) of CH4, CO2 flux and physicochemical indexes under continuous salvage |
在打捞区连续打捞蓝藻过程中,CH4通量呈显著下降趋势,CH4通量与蓝藻密度呈显著正相关(R2=0.86,P < 0.01)(图 8a);打捞实验过程Chl.a浓度从137.7 μg/L削减到29.6 μg/L,CH4通量从15.874 nmol/(m2 ·s)变成2.233 nmol/(m2 ·s).而未打捞区整个实验过程CH4通量变化不大.未打捞区Chl.a浓度明显高于打捞区,且两者CH4通量存在显著差异(P < 0.01).未打捞区CH4通量明显高于打捞区,有研究表明,湖泊近岸带蓝藻水华堆积区表层水体CH4浓度高于开阔湖区[5, 7],为湖泊CH4温室气体产生的热点区域,这与本研究结果一致.对比国内相同富营养化程度的藻型湖泊研究发现,巢湖未打捞区CH4通量(17.473±1.514 nmol/(m2 ·s))明显高于太湖梅梁湾(4.862±1.243 nmol/(m2 ·s))、武汉东湖(11.124±1.510 nmol/(m2 ·s),这可能是因为未打捞区藻密度(124.5±9.5 μg/L)明显高于秋季太湖梅梁湾(60.5~69.3 μg/L)、武汉东湖(59.2±18.3 μg/L),蓝藻高密度聚积增加了水体中藻源性有机质,为产甲烷菌产甲烷提供了充足的底物.打捞过程温室气体的变化趋势可得,打捞区CH4通量前9天下降速率(-9.12×10-6 nmol/(m2 ·s2))明显快于第9天后下降速率(-4.21×10-6 nmol/(m2 ·s2)),第9天前和第9天前后CH4通量平均值分别为11.932±3.213、5.381±1.512 nmol/(m2 ·s),打捞蓝藻过程中前9天Chl.a浓度(99.9±24.0 μg/L)明显高于第9天后(52.2±14.5 μg/L),范帆等[56]对巢湖铜绿微囊藻藻团粒径研究结果表明,大型仿生式水面蓝藻清除设备对铜绿微囊藻藻团理论过滤效率达到99.81%,连续打捞蓝藻前9天可能对水体中悬浮颗粒态藻团日移除量变化速率(SS日变化速率-5.2 mg/(L ·d))明显高于第9天后(SS日变化速率-2.0 mg/(L ·d)),导致CH4通量变化速率受到产CH4的底物与场所变化速率的影响.打捞蓝藻后打捞区昼夜CH4平均通量(2.120±0.952 nmol/(m2 ·s))低于秋季太湖梅梁湾(4.862±1.243 nmol/(m2 ·s))[30, 57]、武汉东湖(11.124±1.510 nmol/(m2 ·s))[21],这由于打捞蓝藻后水体中Chl.a浓度显著削减为29.6 μg/L,低于太湖梅梁湾、武汉东湖,从而减少了水体产甲烷的底物.
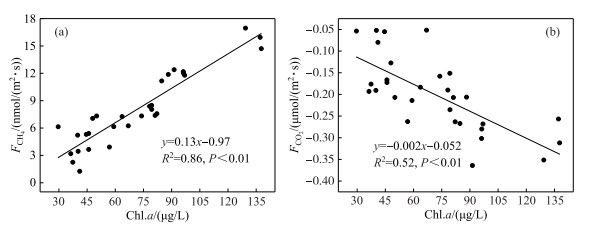
|
图 8 打捞区Chl.a浓度与水-气界面CH4(a)、CO2(b)通量的关系 Fig.8 Relationship between Chl.a concentrations in salvaging enclosures and CH4(a), CO2(b) flux at air-water interface |
经逐步线性回归分析对打捞区CH4通量与环境因子分析结果得到,打捞区Chl.a、C1、C3对水-气界面CH4通量有着重要贡献作用(贡献比分别为20.72%、27.76%、33.51%).湖泊产甲烷过程主要存在于湖泊沉积物和水体颗粒物形成的厌氧环境中[14].湖泊近岸带蓝藻聚积区中蓝藻存在两种赋存状态,一种状态沉降到表层沉积物被沉积物中产甲烷菌分解产甲烷,另一状态则形成30~300 μm粒径的颗粒态蓝藻聚积体悬浮水柱中[56],颗粒态蓝藻内部形成厌氧环境产甲烷[14].藻型湖泊蓝藻生物质堆积促进水体中产甲烷菌增殖,进而显著促进水体中甲烷浓度[11].蓝藻打捞移除水体中颗粒态蓝藻,既削减了沉积物产甲烷的底物,也减少了水体中产甲烷的底物和场所,从而降低了CH4通量.对比打捞区,Chl.a浓度不是未打捞区CH4通量的最佳解释变量,C1、C3为未打捞区CH4通量最佳解释变量,这可能是因为实验期间未打捞区Chl.a变化较小,蓝藻聚积未进行打捞处理,部分聚积蓝藻衰亡释放藻源性有机质(C1、C3)[26],从而为产甲烷提供充足的底物[11].连续打捞蓝藻过程中CODMn、DOC、DOM(C1~C4组分)等水体有机物质与CH4通量均呈显著正相关(P < 0.01), 通过随机森林分析CODMn、DOC、DOM对CH4通量重要性程度得到,CODMn、DOC、DOM重要性占比分别为27.18%、12.7%、40.11 %,其中DOM重要性占比最大,说明水体中DOM对CH4通量具有重要影响.藻类降解可产生具有很强的生物活性藻源性有机质[15, 59],这种不稳定的藻源性有机质降解可能会促使产甲烷菌产甲烷[16].有研究表明,不稳定藻源性有机质(色氨酸类)与可被微生物迅速摄取的低分子量有机酸乙酸和丁酸酯密切相关,从而显著促进产甲烷速率[60].通过对打捞区DOM中C1、C2、C3、C4组分与CH4通量进行随机森林分析得到,C1(35.81%)、C3(37.36%)组分重要性程度占比最大,C1、C3组分分别为微生物代谢类腐殖质[40-43]、类蛋白物质(类色氨酸类)[40-41, 47],说明藻源性有机质(C1、C3)对CH4通量贡献较大.
3.2 连续打捞蓝藻过程对水-气界面CO2通量的影响及其因素在打捞区连续打捞蓝藻过程中,CO2通量则呈显著上升趋势,与蓝藻密度呈显著负相关(R2=0.52,P < 0.01)(图 8b);打捞实验过程Chl.a浓度从137.7 μg/L削减到29.6 μg/L,CO2通量从-0.307 μmol/(m2 ·s)变成-0.150 μmol/(m2 ·s).而未打捞区整个实验过程CO2通量变化不大.未打捞区Chl.a浓度明显高于打捞区,且两者CO2通量存在显著差异(P < 0.01).未打捞区CO2吸收通量明显高于打捞区,打捞区打捞后显著降低了水体中Chl.a浓度,有研究已证实湖泊Chl.a浓度与CO2通量呈显著负相关[20, 55].未打捞区CO2通量(-0.344±0.017 μmol/(m2 ·s))明显低于太湖梅梁湾(-0.102±0.013 μmol/(m2 ·s))、武汉东湖(0.037±0.010 μmol/(m2 ·s))[21, 30],这可能是因为未打捞区藻密度(124.5±9.5 μg/L)明显高于秋季太湖梅梁湾(60.5~69.3 μg/L)、武汉东湖(59.2±18.3 μg/L),蓝藻高密度聚积增加了水体进行光合作用的生物量,促进CO2吸收.打捞区CO2通量前15天上升速率(1.152×10-7 μmol/(m2 ·s2))明显高于第15天后的下降速率(4.021×10-9 μmol/(m2 ·s2)),第15天前和15天后CO2通量平均值分别为-0.236±0.067、-0.145±0.014 μmol/(m2 ·s),与之相对应前15天Chl.a浓度(89.6±25.1 μg/L)明显高于第15天后(43.7±4.0 μg/L),这可能是由于连续打捞蓝藻过程中前15天蓝藻日移除生物量变化较大(Chl.a日变化速率-4.1 μg/(L ·d)),而第15天后蓝藻日移除生物量变化较缓(Chl.a日变化速率-0.87 μg/(L ·d)),导致蓝藻光合作用吸收大气中CO2通量呈如此变化.连续打捞蓝藻后打捞区昼夜CO2平均通量(-0.078±0.141 μmol/(m2 ·s))仍呈吸收状态,但吸收通量远低于未打捞区;与Chl.a浓度相近的其他湖区相比较,秋季太湖梅梁湾CO2吸收通量低于打捞区,而武汉东湖CO2呈释放状态[21, 30].打捞蓝藻后水体中蓝藻得到削减,尤其有效清除表层聚积态蓝藻,造成进行光合作用的藻细胞数量降低,降低了CO2吸收通量,从而使打捞区CO2吸收通量低于未打捞区.但由于打捞蓝藻同时也降低了死亡分解的蓝藻生物碳量,降低了CO2的释放通量;而且打捞使水体浊度显著降低,改善了水体透光率,有利于水体初级生产者的光合作用吸收CO2[58],从而使打捞区CO2通量与其他未进行蓝藻打捞的湖区存在差别.蓝藻打捞减少水体中蓝藻生物量与蓝藻自然消亡存在着本质不同,蓝藻自然消亡形成的藻源性有机质仍然存在湖泊里,造成微生物降解藻源性有机质产生温室气体,并为下一周期蓝藻水华暴发提供营养物质,形成蓝藻水华与湖泊富营养化、气候变暖之间恶性循环[6];而打捞将蓝藻生物体直接从表层水体中移除,减少了藻屑在沉积物表层的沉降,进而在一定程度上减缓恶性循环.
湖泊水体中CO2主要受两方面影响,一方面是CO2主要来源于呼吸作用和沉积物对有机质分解作用产生;另一方面是CO2主要消耗于水体中浮游植物的光合作用吸收.对打捞区CO2通量与环境因子进行逐步回归分析结果得到,CO2通量与Chl.a、T均呈显著负相关,Chl.a、T对CO2通量有着显著影响.齐天赐等[19]对巢湖水体CO2浓度时空分布特征结果表明,水体蓝藻生物量与CO2浓度呈显著负相关,这与本研究结果一致.有研究表明,浮游植物的光合作用与Chl.a、T均呈显著正相关[55, 61],蓝藻打捞过程Chl.a浓度、T均不断降低,降低了浮游植物光合作用对CO2吸收的总量.打捞区和未打捞区蓝藻生长速率分别为0.203和0.362 d-1(数据未发表),打捞区蓝藻生长速率明显低于未打捞区,这表明打捞降低了蓝藻生长速率.徐宪根等[27-28]研究打捞对蓝藻生长速率的影响,结果表明蓝藻打捞控制强度越大,蓝藻增殖速率越慢,蓝藻生物量增长趋势减缓,导致光合作用固碳量降低.对比打捞区,未打捞区CO2通量最佳解释变量为SS和T,而不是Chl.a,并且与SS呈正比,与T呈反比,水体中SS增加促进了CO2释放.这可能是因为未打捞区水体中Chl.a浓度变化较小,蓝藻聚积水体中SS主要由未衰亡和衰亡藻体组成,衰亡蓝藻被微生物降解产生CO2[6],从而对CO2通量造成影响.
3.3 连续打捞蓝藻过程对水-气界面温室气体的减排效应相比于未打捞区,连续打捞过程显著减少CH4排放(P < 0.01),同时,打捞显著减少湖泊水体CO2吸收量(P < 0.01).打捞蓝藻作业持续过程中,打捞区与未打捞区Chl.a浓度相差越来越大(图 9),两者Chl.a浓度之间的差值与打捞区CH4通量呈显著负相关(P < 0.01),同时,与打捞区CO2通量呈显著正相关(P < 0.01),说明打捞强度越大CH4通量排放越小、CO2吸收通量越少.由于CH4温室效应潜势值约为CO2的25倍[1],通过该系数可将打捞区与未打捞区CH4排放换算成等效CO2排放当量值.蓝藻生物泵通过光合作用吸收大气中CO2转化成有机质,这部分有机质将通过有氧和厌氧矿化将分别产生CO2、CH4[62],对于厌氧矿化产生CH4这部分吸收大气的CO2而言,通过这两个生物过程将其温室效应潜势值放大了24倍. Yan、Kelly等[6, 36]对湖泊有机质CO2、CH4矿化比研究结果表明,以CH4矿化形式占CO2、CH4总矿化度占比范围为20%~50%.本研究属于藻源性有机质矿化,CH4占有机质总矿化度占比取值为50%[6].根据上述蓝藻生物泵对吸收大气中CO2温室效应放大通量,来计算打捞对CO2蓝藻生物泵转化减排通量.通过连续打捞后水-气界面CH4、CO2通量昼夜观测得到,CH4日平均通量减排值为83.893±53.306 μmol/(m2 ·d),对湖泊光合作用吸收大气中CO2、厌氧矿化作用产生CH4两个生物过程日平均通量减排值为11.351±3.186 mmol/(m2 ·d).打捞蓝藻后水-气界面CH4、CO2通量两者综合日平均通量减排量值0.275±0.076 mol/(m2 ·d)(以CO2当量计),说明了打捞蓝藻对湖泊水-气界面温室气体排放具有减排作用.据统计巢湖秋季蓝藻暴发水域面积约为112.21±22.57 km2[63],以本研究打捞区和未打捞区CH4、CO2日平均值通量为依据进行计算,打捞后蓝藻暴发区域水-气界面综合温室气体排放量将减少1355.350±375.542 t/d(以CO2当量计).藻型湖泊蓝藻水华对CO2、CH4温室气体影响可能源于两方面,一方面源于水柱中蓝藻光合作用、呼吸作用、分解作用等多过程对CO2、CH4收支贡献[62];另一方面源于沉积物对藻源性有机质降解对CO2、CH4收支贡献,综合这两方面对水-气界面CO2、CH4通量收支影响[11].虽然蓝藻打捞对水-气界面CO2、CH4通量具有减排作用,但对蓝藻在沉积物、水柱中CO2、CH4通量减排贡献各是多少,目前尚不明晰,还需要进行同位素示踪实验观测计算.
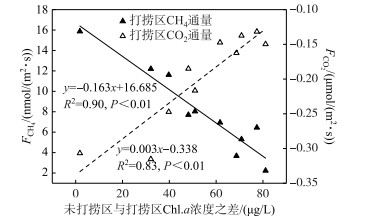
|
图 9 未打捞区与打捞区Chl.a浓度之差与CH4、CO2通量的关系 Fig.9 Relationship between Chl.a concentration reduction and CH4, CO2 flux in salvaging enclosures |
通过YL-1000型大型仿生式水面蓝藻清除设备(ZL200910026679.0)物理过滤打捞上的新鲜蓝藻可以进一步资源化利用,用于加工生产高附加值产品、肥料等.有研究表明蓝藻通过快速热解液化用于制取生物油[64-65];物理打捞的新鲜蓝藻可用于提取藻蓝蛋白等高附加值的保健营养食品[66-67];打捞的蓝藻还可以用于肥料制造的原材料[68].
4 结论1) 秋季连续打捞聚积蓝藻对水体中蓝藻生物量具有有效的削减作用,打捞后显著降低水-气界面CH4排放和CO2吸收量;蓝藻打捞在一定程度上减缓蓝藻水华与湖泊富营养化、气候变暖之间恶性循环.
2) 蓝藻打捞过程水-气界面CH4、CO2通量与水体理化指标关系密切,其中CH4通量与Chl.a、微生物代谢类腐殖质(C1)、原生性类蛋白(C3)均呈显著正相关,水体中藻源性溶解性有机质对CH4通量具有促进作用;CO2通量分别与Chl.a、T呈显著负相关,打捞过程两者主要影响湖泊蓝藻光合作用吸收大气中CO2能力.
3) 蓝藻连续打捞后对水-气界面CH4、CO2温室气体具有显著的减排作用,碳减排日平均通量为0.275±0.076 mol/(m2 ·d)(以CO2当量计).蓝藻打捞强度越大,对水-气界面CH4、CO2温室气体减排作用越大.
致谢: 采样过程中得到张开明等工作人员的协助,数据处理绘图得到徐金英、陈丙法的指导,在此表示诚挚的谢意!
| [1] |
Allen SK, Plattner GK, Nauels A et al. Climate Change 2013: The Physical Science Basis. An overview of the Working Group 1 contribution to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change (IPCC). Computational Geometry, 2007, 18(2): 95-123. DOI:10.1016/S0925-7721(01)00003-7 |
| [2] |
Bastviken D, Cole J, Pace M et al. Methane emissions from lakes: Dependence of lake characteristics, two regional assessments, and a global estimate. Global Biogeochemical Cycles, 2004, 18(4). DOI:10.1029/2004gb002238 |
| [3] |
Cole JJ, Caraco NF, Kling GW et al. Carbon dioxide supersaturation in the surface waters of lakes. Science, 1994, 265(5178): 1568-1570. DOI:10.1126/science.265.5178.1568 |
| [4] |
Verpoorter C, Kutser T, Seekell DA et al. A global inventory of lakes based on high-resolution satellite imagery. Geophysical Research Letters, 2014, 41(18): 6396-6402. DOI:10.1002/2014gl060641 |
| [5] |
Yan XC, Zhang ZQ, Ji M et al. Concentration of dissolved greenhouse gas and its influence factors in the summer surface water of eutrophic lake. J Lake Sci, 2018, 30(5): 1420-1428. [闫兴成, 张重乾, 季铭等. 富营养化湖泊夏季表层水体温室气体浓度及其影响因素. 湖泊科学, 2018, 30(5): 1420-1428. DOI:10.18307/2018.0523] |
| [6] |
Yan XC, Xu XG, Wang MY et al. Climate warming and cyanobacteria blooms: Looks at their relationships from a new perspective. Water Research, 2017, 125: 449-457. DOI:10.1016/j.watres.2017.09.008 |
| [7] |
Yan XC, Xu XG, Ji M et al. Cyanobacteria blooms: A neglected facilitator of CH4 production in eutrophic lakes. Science of the Total Environment, 2019, 651: 466-474. DOI:10.1016/j.scitotenv.2018.09.197 |
| [8] |
Huttunen JT, Alm J, Saarijärvi E et al. Contribution of winter to the annual CH4 emission from a eutrophied boreal lake. Chemosphere, 2003, 50(2): 247-250. DOI:10.1016/s0045-6535(02)00148-0 |
| [9] |
West WE, Coloso JJ, Jones SE. Effects of algal and terrestrial carbon on methane production rates and methanogen community structure in a temperate lake sediment. Freshwater Biology, 2012, 57(5): 949-955. DOI:10.1111/j.1365-2427.2012.02755.x |
| [10] |
West WE, Creamer KP, Jones SE. Productivity and depth regulate lake contributions to atmospheric methane. Limnology and Oceanography, 2016, 61(S1): S51-S61. DOI:10.1002/lno.10247 |
| [11] |
Hu WT, Tang Q, Sun W et al. Dissolved methane dynamics during the degradation of organic matter derived from cyanobacterial bloom. China Environmental Science, 2017, 37(2): 702-710. [胡万婷, 唐千, 孙伟等. 水体中蓝藻水华分解产甲烷动态过程研究. 中国环境科学, 2017, 37(2): 702-710.] |
| [12] |
Zepp FK, Holliger C, Großkopf R et al. Vertical distribution of methanogens in the anoxic sediment of rotsee (Switzerland). Applied and Environmental Microbiology, 1999, 65(6): 2402-2408. DOI:10.1128/aem.65.6.2402-2408.1999 |
| [13] |
Schwarz JIK, Eckert W, Conrad R. Community structure of Archaea and Bacteria in a profundal lake sediment Lake Kinneret (Israel). Systematic and Applied Microbiology, 2007, 30(3): 239-254. DOI:10.1016/j.syapm.2006.05.004 |
| [14] |
Zhu DL. Study on the generation, release and driving mechanism of methane in taihu and Xuanwu Lake[Dissertation]. Nanjing: Nanjing University, 2012. [祝栋林.太湖及玄武湖甲烷气体产生、释放及影响机制研究[学位论文].南京: 南京大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10284-1015574970.htm ]
|
| [15] |
Zhang YL, van Dijk MA, Liu ML et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: Field and experimental evidence. Water Research, 2009, 43(18): 4685-4697. DOI:10.1016/j.watres.2009.07.024 |
| [16] |
Zhou YQ, Zhou L, Zhang YL et al. Autochthonous dissolved organic matter potentially fuels methane ebullition from experimental lakes. Water Research, 2019, 166: 115048. DOI:10.1016/j.watres.2019.115048 |
| [17] |
West WE, McCarthy SM, Jones SE. Phytoplankton lipid content influences freshwater lake methanogenesis. Freshwater Biology, 2015, 60(11): 2261-2269. DOI:10.1111/fwb.12652 |
| [18] |
Weyhenmeyer GA, Kosten S, Wallin MB et al. Significant fraction of CO2 emissions from boreal lakes derived from hydrologic inorganic carbon inputs. Nature Geoscience, 2015, 8(12): 933-936. DOI:10.1038/ngeo2582 |
| [19] |
Qi TC, Xiao QT, Miao YQ et al. Temporal and spatial variation of carbon dioxide concentration and its exchange fluxes in Lake Chaohu. J Lake Sci, 2019, 31(3): 766-778. [齐天赐, 肖启涛, 苗雨青等. 巢湖水体二氧化碳浓度时空分布特征及其水-气交换通量. 湖泊科学, 2019, 31(3): 766-778. DOI:10.18307/2019.0315] |
| [20] |
Rudorff CM, Melack JM, MacIntyre S et al. Seasonal and spatial variability of CO2 emission from a large floodplain lake in the lower Amazon. Journal of Geophysical Research Atmospheres, 2011, 116(G4): G04007. DOI:10.1029/2011jg001699 |
| [21] |
Xing Y, Xie P, Yang H et al. Methane and carbon dioxide fluxes from a shallow hypereutrophic subtropical Lake in China. Atmospheric Environment, 2005, 39(30): 5532-5540. DOI:10.1016/j.atmosenv.2005.06.010 |
| [22] |
Li Na, Ni JQ, Li GW et al. Analysis of eutrophication status and regional differences of typical lakes in China. Acta Hydrobiologica Sinica, 2018, 42(4): 854-864. [李娜, 黎佳茜, 李国文等. 中国典型湖泊富营养化现状与区域性差异分析. 水生生物学报, 2018, 42(4): 854-864. DOI:10.7541/2018.105] |
| [23] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [24] |
Shao LL, Lu KH. Reaserch and outloook on physical methods in situ for emergency disposal of cyanobacteria bloom in source water areas. Shanghai Environmental Sciences, 2013, 32(4): 160-165. [邵路路, 陆开宏. 原位应急处理水源地蓝藻水华的物理技术研究及展望. 上海环境科学, 2013, 32(4): 160-165.] |
| [25] |
Chen BF, Feng MH, Shang LX et al. The release characteristics of algae-derived pollutants in different salvage intensities after cyanobacteria accumulation. Acta Scientiae Circumstantiae, 2016, 36(11): 4077-4086. [陈丙法, 冯慕华, 尚丽霞等. 聚积蓝藻不同打捞强度下藻源污染物释放特征研究. 环境科学学报, 2016, 36(11): 4077-4086.] |
| [26] |
Chen BF, Feng MH, Shang LX et al. Effects on cyanobacterial growth and water quality after harvesting accumulated cyanobacteria in autumn: An in situ experiment in Lake Chaohu. J Lake Sci, 2016, 28(2): 253-262. [陈丙法, 冯慕华, 尚丽霞等. 秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验. 湖泊科学, 2016, 28(2): 253-262. DOI:10.18307/2016.0203] |
| [27] |
Xu XG. Occurrence principle and controlling response of cyanobacteria bloom in the water source area of Chaohu city[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2014. [徐宪根.巢湖水源区蓝藻水华发生规律及控制响应[学位论文].北京: 中国科学院大学, 2014. http://d.wanfangdata.com.cn/Thesis_Y2615610.aspx ]
|
| [28] |
Zhou BB, Wang GX, Yang F et al. Effect of scooping out blue algae on growth of Microcystis aeruginosa. Journal of Ecology and Rural Environment, 2012, 28(3): 260-265. [周贝贝, 王国祥, 杨飞等. 人工打捞对铜绿微囊藻生长影响的模拟试验. 生态与农村环境学报, 2012, 28(3): 260-265.] |
| [29] |
Zhao Y, Zeng Y, Wu BF et al. Review of methods for measuring greenhouse gas flux from the air-water interface of reservoirs. Advances in Water Science, 2011, 22(1): 135-146. [赵炎, 曾源, 吴炳方等. 水库水气界面温室气体通量监测方法综述. 水科学进展, 2011, 22(1): 135-146.] |
| [30] |
Li XH. Study of the greenhouse gas flux of water-air interface and its spatio-temporal change in Taihu Lake[Dissertation]. Nanjing: Hohai University, 2005. DOI: 10.7666/d.y717045. [李香华.太湖水-气界面温室气体通量及时空变化特征研究[学位论文].南京: 河海大学, 2005. http://d.wanfangdata.com.cn/Thesis/Y717045 ]
|
| [31] |
Hernández PA, Mori T, Padrón E et al. Carbon dioxide emission from Katanuma volcanic lake, Japan. Earth, Planets and Space, 2011, 63(11): 1151-1156. DOI:10.5047/eps.2011.06.038 |
| [32] |
Jia L, Pu YN, Yang SJ et al. Analysis of greenhouse gas emission characteristics and their influencing factors in the algae zone of Lake Taihu. Environmental Science, 2018(5): 2316-2329. [贾磊, 蒲旖旎, 杨诗俊等. 太湖藻型湖区CH4、CO2排放特征及其影响因素分析. 环境科学, 2018(5): 2316-2329. DOI:10.13227/j.hjkx.201708123] |
| [33] |
Editorial Board of Water and Wastewater Monitoring and Analysis Methods, Ministry of Environmental Protection of the People's Republic of China. Water and Wastewater Monitoring and Analysis Methods: 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.]
|
| [34] |
Stedmon CA, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: A tutorial. Limnology and Oceanography: Methods, 2008, 6(11): 572-579. DOI:10.4319/lom.2008.6.572b |
| [35] |
Stedmon CA, Markager S. Tracing the production and degradation of autochthonous fractions of Dissolved organic matter by fluorescence analysis. Limnology and Oceanography, 2005, 50(5): 1415-1426. DOI:10.4319/lo.2005.50.5.1415 |
| [36] |
Kelly CA, Rudd JWM, Schindler DW. Carbon and electron flow via methanogenesis, SO42-, NO3-, Fe3+, and Mn4+ reduction in the anoxic hypolimnia of three lakes. Arch fuer Hydrobiol. Beihandlungen Ergeb Limnol, 1988(31): 333-344. |
| [37] |
Huguet A, Vacher L, Relexans S et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary. Organic Geochemistry, 2009, 40(6): 706-719. DOI:10.1016/j.orggeochem.2009.03.002 |
| [38] |
Chen ML, Price RM, Yamashita Y et al. Comparative study of dissolved organic matter from groundwater and surface water in the Florida coastal Everglades using multi-dimensional spectrofluorometry combined with multivariate statistics. Applied Geochemistry, 2010, 25(6): 872-880. DOI:10.1016/j.apgeochem.2010.03.005 |
| [39] |
Murphy KR, Stedmon CA, Wenig P et al. OpenFluor-an online spectral library of auto-fluorescence by organic compounds in the environment. Analytical Methods, 2014, 6(3): 658-661. DOI:10.1039/c3ay41935e |
| [40] |
Osburn CL, Wigdahl CR, Fritz SC et al. Dissolved organic matter composition and photoreactivity in prairie lakes of the US Great Plains. Limnology and Oceanography, 2011, 56(6): 2371-2390. DOI:10.4319/lo.2011.56.6.2371 |
| [41] |
Coble PG. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 1996, 51(4): 325-346. DOI:10.1016/0304-4203(95)00062-3 |
| [42] |
Lapierre JF, del Giorgio PA. Partial coupling and differential regulation of biologically and photochemically labiledissolved organic carbon across boreal aquatic networks. Biogeosciences, 2014, 11(20): 5969-5985. DOI:10.5194/bg-11-5969-2014 |
| [43] |
Murphy KR, Stedmon CA, Waite TD et al. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy. Marine Chemistry, 2008, 108(1/2): 40-58. |
| [44] |
Chen ML, Kim JH, Nam SI et al. Production of fluorescent dissolved organic matter in Arctic Ocean sediments. Scientific Reports, 2016, 6: 39213. DOI:10.1038/srep39213 |
| [45] |
Hambly AC, Arvin E, Pedersen LF et al. Characterising organic matter in recirculating aquaculture systems with fluorescence EEM spectroscopy. Water Research, 2015, 83: 112-120. DOI:10.1016/j.watres.2015.06.037 |
| [46] |
Lambert T, Bouillon S, Darchambeau F et al. Effects of human land use on the terrestrial and aquatic sources of fluvial organic matter in a temperate river basin (The Meuse River, Belgium). Biogeochemistry, 2017, 136(2): 191-211. DOI:10.1007/s10533-017-0387-9 |
| [47] |
Li PH, Chen L, Zhang W et al. Spatiotemporal distribution, sources, and photobleaching imprint of dissolved organic matter in the Yangtze estuary and its adjacent Sea using fluorescence and parallel factor analysis. PLoS ONE, 2015, 10(6): e0130852. DOI:10.1371/journal.pone.0130852 |
| [48] |
Kothawala DN, von Wachenfeldt E, Koehler B et al. Selective loss and preservation of lake water dissolved organic matter fluorescence during long-term dark incubations. Science of the Total Environment, 2012, 433: 238-246. DOI:10.1016/j.scitotenv.2012.06.029 |
| [49] |
Gan SC, Wu Y, Bao HY et al. Characterization of DOM(dissolved organic matter) in Yangtze River using 3-D fluorescence spectroscopy and parallel factor analysis. China Environmental Science, 2013, 33(6): 1045-1052. [甘淑钗, 吴莹, 鲍红艳等. 长江溶解有机质三维荧光光谱的平行因子分析. 中国环境科学, 2013, 33(6): 1045-1052.] |
| [50] |
Fu PQ, Liu CQ, Wu FC. Three-dimensional excitation emission matrix fluorescence spectroscopic characterization of dissolved organic matter. Spectroscopy and Spectral Analysis, 2005, 25(12): 2024-2028. [傅平青, 刘丛强, 吴丰昌. 溶解有机质的三维荧光光谱特征研究. 光谱学与光谱分析, 2005, 25(12): 2024-2028.] |
| [51] |
Cory RM, McKnight DM. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones indissolved organic matter. Environmental Science & Technology, 2005, 39(21): 8142-8149. DOI:10.1021/es0506962 |
| [52] |
Ohno T. Fluorescence inner-filtering correction for determining the humification index ofdissolved organic matter. Environmental Science & Technology, 2002, 36(4): 742-746. DOI:10.1021/es0155276 |
| [53] |
Huguet A, Vacher L, Relexans S et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary. Organic Geochemistry, 2009, 40(6): 706-719. DOI:10.1016/j.orggeochem.2009.03.002 |
| [54] |
Helms JR, Stubbins A, Ritchie JD et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter. Limnology and Oceanography, 2008, 53(3): 955-969. DOI:10.4319/lo.2008.53.3.0955 |
| [55] |
Jiang T, Guo JS, Li Z et al. Air-water surface greenhouse gas flux in Pengxi river at different operational stages of the Three Gorges reservoir. Chinese Journal of Environmental Science, 2012, 33(5): 1463-1470. [蒋滔, 郭劲松, 李哲等. 三峡水库不同运行状态下支流澎溪河水-气界面温室气体通量特征初探. 环境科学, 2012, 33(5): 1463-1470.] |
| [56] |
Fan F, Li WC, Ke F. Spatio-temporal distribution of Microcystis aeruginosa colony diameters in the water source region of Chaohu City. J Lake Sci, 2013, 25(2): 213-220. [范帆, 李文朝, 柯凡. 巢湖市水源地铜绿微囊藻(Microcystis aeruginosa)藻团粒径时空分布规律. 湖泊科学, 2013, 25(2): 213-220. DOI:10.18307/2013.0206] |
| [57] |
肖启涛. 太湖水-气界面温室气体(CO2、CH4、N2O)通量研究. 南京: 南京信息工程大学, 2014.
|
| [58] |
Hu CL, Wan CY, Wu SG et al. Progress in causes and ecological control of cyanobacterial bloom. Resources and Environment in the Yangtze Basin, 2010, 19(12): 1471-1477. [胡传林, 万成炎, 吴生桂等. 蓝藻水华的成因及其生态控制进展. 长江流域资源与环境, 2010, 19(12): 1471-1477.] |
| [59] |
Zhou YQ, Jeppesen E, Zhang YL et al. Chromophoric dissolved organic matter of black waters in a highly eutrophic Chinese lake: Freshly produced from algal scums?. Journal of Hazardous Materials, 2015, 299: 222-230. DOI:10.1016/j.jhazmat.2015.06.024 |
| [60] |
Drake TW, Wickland KP, Spencer RGM et al. Ancient low-molecular-weight organic acids in permafrost fuel rapid carbon dioxide production upon thaw. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(45): 13946-13951. DOI:10.1073/pnas.1511705112 |
| [61] |
Li DM, Yu Y, Zhang TQ et al. Photochemical activity of phytoplankton in Taihu Lake in spring and autumn. Research of Environmental Sciences, 2014, 27(8): 848-856. [李大命, 于洋, 张彤晴等. 太湖春季和秋季浮游植物的光合作用活性. 环境科学研究, 2014, 27(8): 848-856.] |
| [62] |
Duc NT, Crill P, Bastviken D. Implications of temperature and sediment characteristics on methane formation and oxidation in lake sediments. Biogeochemistry, 2010, 100(1/2/3): 185-196. DOI:10.1007/s10533-010-9415-8 |
| [63] |
Tang XX, Shen M, Duan HT. Temporal and spatial distribution of algal blooms in Lake Chaohu, 2000-2015. J Lake Sci, 2017, 29(2): 276-284. [唐晓先, 沈明, 段洪涛. 巢湖蓝藻水华时空分布(2000-2015年). 湖泊科学, 2017, 29(2): 276-284. DOI:10.18307/2017.0203] |
| [64] |
Yan F. Study on fast pyrolysis of biomass and steam gasification of semi-coke[Dissertation]. Wuhan: Huazhong University of Science and Technology, 2010. [鄢丰.生物质快速热解及其半焦水蒸气气化研究[学位论文].武汉: 华中科技大学, 2010. http://d.wanfangdata.com.cn/Thesis/D140967 ]
|
| [65] |
Zheng Y, Hu ZQ, Xiao B. Preliminary study on fast pyrolysis and liquefaction of algae. Environmental Science and Technology, 2011, 34(10): 58-62. [郑洋, 胡智泉, 肖波. 滇池蓝藻快速热解液化制取生物油的初步研究. 环境科学与技术, 2011, 34(10): 58-62.] |
| [66] |
Xu ZK. The development status and prospect of cyanobacteria health food. ZhongGuo BaoJian ShiPin, 2012(4): 4-5. [徐铮奎. 蓝藻类保健食品开发现状与前景. 中国保健食品, 2012(4): 4-5.] |
| [67] |
Sun J, Lu SM, Tao NP. The nutritional value and health care effect of spirulina. China Fisheries, 2006(5): 76-77. [孙洁, 陆胜民, 陶宁萍. 螺旋藻的营养价值及保健功效. 中国水产, 2006(5): 76-77.] |
| [68] |
Sun SZ, Gao TR, Xu R et al. Technological process improvement of organic fertilizer made of blue green algae mixed with tobacco residue. Journal of Yunnan Normal University: Natural Sciences Edition, 2008, 28(5): 35-38. [孙世中, 高天荣, 徐锐等. 蓝藻泥和废弃烟叶混合制作有机肥料工艺优化. 云南师范大学学报:自然科学版, 2008, 28(5): 35-38.] |
 2020, Vol. 32
2020, Vol. 32 

