(2: 中国地质大学湖北省水环境污染系统控制和治理工程技术研究中心, 武汉 430074)
(3: 中国科学院大学, 北京 100049)
(2: Hubei Provincial Engineering Research Center of Systematic Water Pollution Control, China University of Geosciences, Wuhan 430074, P. R. China)
(3: Univerisity of Chinese Academy of Sciences, Beijing 100049, P. R. China)
近年来,随着我国工农业的迅猛发展以及城市规模的不断扩大,大量生活污水、生产废水以及不合理的水产养殖尾水排入湖泊,严重污染湖泊水体,不仅加速了湖泊富营养化进程,而且严重影响湖泊生态功能.人工浮床作为一种新型的水生态修复技术,具有直接从水体中去除污染物、无需占用土地、充分利用水面、造价低廉、运行管理简便等优点[1],然而人工浮床在净化过程中依赖植物的生长,植物同化氮、磷的速度较慢,去污效率普遍偏低,限制了人工浮床技术的应用[2].
从1876年,Pasteur从消毒的葡萄汁中分离出第一株内生细菌后,关于植物内生细菌的研究大量开展[3].植物内生细菌是存在于植物组织中、不易受外部环境影响的一类微生物,具有稳定的生态环境,可持续对植物生理代谢特征产生稳定的影响[4].植物体内的内生细菌主要是外界细菌通过根区进入植物组织,但是也能通过种子、表面气孔、伤口等进入植物[5]与植物建立共生关联,成为植物内生细菌.关于内生细菌,前期研究主要集中在:内生细菌的多样性、分布及定殖[6-10];探索植物内生细菌的多种有益生理学作用及对植物的促生作用,如溶磷[11]、分泌生长素[12]、生成铁载体以及提高植物抗逆境能力等功能[13],这些功能能够促进植物吸收营养物质,加强其对营养物质的代谢,促进植物的生长;研究内生细菌增强植物抗逆性、抗病虫害的作用[14-16].目前,许多研究人员正在从事植物-内生细菌共生净化系统的研究,多项研究揭示内生细菌能增强植物生长以及具备修复受到有机污染物和无机污染物污染的土壤和水体的能力,包括提高植物对镍(Ni)、镉(Cd)、铜(Cu)、铅(Pb)、铀(U)等重金属的吸收[17-21],提高植物对土壤中碳氢化合物的降解[22],提高植物对纺织废水中化学需氧量(COD)、生化需氧量(BOD)、总溶解固体量的去除率[23],提高植物对尾水中总氮(TN)、磷酸盐(PO43-)的去除率[24].
水生植物美人蕉作为净化水质的植物在各类水生态修复工程,如生态浮床[25-26]、人工湿地[27]中广泛运用.目前,对美人蕉内生细菌以及美人蕉作为宿主植物在内生细菌影响下修复环境污染的研究鲜有报道.因此本研究以美人蕉及其内生细菌为对象,对美人蕉内生细菌进行提取-筛选-接种试验,验证以下两个假设:内生细菌是否对美人蕉生长有促生作用;内生细菌是否能强化美人蕉对水体中富营养物质的吸收,以期为水体的生态修复提供一种新思路.
1 材料与方法 1.1 内生细菌的分离纯化与筛选2018年1月于武汉市光谷三路湿地公园采集长势良好的美人蕉6株.采用表面消毒法分离植物内生细菌[28].用无菌水冲洗美人蕉数次直至无明显浑浊后无菌滤纸吸干,切取茎、根、叶进行表面消毒:70 %乙醇浸泡(1 min)→无菌水冲洗→1 %次氯酸钠浸泡(1.5 min)→0.1 %氯化汞浸泡(60 s)→无菌水反复冲洗(5~10次)后将植物组织用无菌滤纸吸干转入灭菌研钵,加入10 ml无菌水研磨,研磨至匀浆状态后静置3~5 min,将上清液适度稀释后取0.1 ml涂布于Luria-Bertani (LB)培养基上,28℃培养3~7 d后,挑取菌落(表面消毒效果检验:取最后1次冲洗植物的无菌0.1 ml水涂布于LB平板,培养后无微生物菌落生长表明样品消毒彻底).对得到的菌落不断纯化直至菌落形态单一后保存作为供试菌株. LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水100 ml,pH 7.0,121℃灭菌20 min.
对筛选出的内生细菌进行生理学特性的测定,分泌吲哚乙酸能力测定采用Salkowski比色法[29];溶磷能力测定采用无机磷固体溶磷圈法[30],用溶磷系数[(溶磷圈面积-菌落面积)/菌落面积]表征菌株溶磷能力大小;产铁载体能力采用CAS平板法[31];将菌株连续5次转接于Nfb无氮培养基[32]上定性测定固氮能力.
选择同时具有4种生物功能的3株内生细菌C01、C16、C20测定其对美人蕉的促生作用.
1.2 内生细菌对美人蕉的促生作用采购一批黄花美人蕉种子,剔除不饱满、表面有霉菌的种子.种子萌发前用浓硫酸浸泡45 min[33],无菌水冲洗15~20次.菌株C01、C16、C20在LB液体培养基中生长24 h后离心(4℃、8000转/min,20 min),倒去培养基并用无菌水调节菌液浓度OD600至1.0.将种子浸泡在菌液中4 h,对照组种子浸泡在无菌水中.
细沙洗净烘干装入塑料组培瓶(400 g),121℃灭菌60 min,再加入蒸馏水40 ml 121℃灭菌30 min用于种子萌发. C01、C16、C20、对照组试验组,每个试验组种入36颗种子(用9个组培瓶,每个组培瓶种入4颗种子),每试验组设置3个重复.放入培养箱(28℃,4000 lx)萌发生长15天后计算种子的萌发率.
将长势相同的美人蕉幼苗放入组培瓶中,于光照培养箱中(28℃,4000 lx)继续生长,每个处理9个组培瓶,每个组培瓶中1株幼苗,每7 d用5 ml OD600=1.0浓度的菌液浇灌,对照组用5 ml无菌水浇灌,并用1/2霍格兰作为植物的营养来源,28 d后测量植物的株高、根长,称量植物的鲜重.
1.3 美人蕉对污染水体的净化将已经接种内生细菌且长势相同的植物移入实验装置,实验装置模拟生态浮床,将植物悬挂种植于水箱(L×B×H=400 mm×290 mm×260 mm)上,种植植物的盆底均匀分布56个孔(直径为6 mm),盆中从下往上依次铺设两层纱网(孔径约为2 mm)、10 mm砾石(粒径约为5 mm)、100 mm石英砂(粒径约为2 mm).每个水箱中放入1个循环泵(每天定时循环2 h,流量300 L/h),可使水箱中的营养物质均匀分布,同时也使水体充氧.每个实验装置中种植两株植物,每个实验组设置3个平行.系统进自来水稳定1个月后进23 L污水,污水配方按照Prochaska等的方法配制[34].实验进水1次,期间蒸发的水量用自来水补充.前3次每3天采1次样,后3次每5天采1次样.根据GB 11894 -1989测定水体中总氮(TN)浓度,GB 11893 -1989测定水体中总磷(TP)浓度.
1.4 美人蕉生长、生理特性水质净化试验结束后收取装置中的植物,测量植物的株高、根长,地上鲜重、地下鲜重;105℃杀青1 h后75℃烘干至恒重称量地上、地下干重;考马斯亮蓝G-250法测定可溶性蛋白,蒽酮比色法测定可溶性糖[35],蒽酮提取叶绿素并测定、α-萘胺法测定根系活力参照张志良等的方法[36].
1.5 内生细菌的鉴定菌株基因提取,PCR产物的纯化和测序均由武汉市天一辉远生物科技有限公司完成.使用NCBI网站对测定的序列与数据库中的各种菌的16S rDNA序列进行对比.从GenBank中选择了近缘菌株的基因序列,应用Mega7软件进行比较后构建系统发育树.
1.6 数据处理及统计分析数据的初步整理用Excel软件完成,所有数据用平均值±标准差表示.用SPSS 22.0软件对数据进行统计分析,采用单因素方差分析对3株内生细菌的影响进行对比分析,显著性水平设为α=0.05.用Origin 2017软件绘制相关图形.
2 结果 2.1 内生细菌的筛选与鉴定从美人蕉体内分离出内生细菌,通过测定内生细菌的生理学特性筛选出3株具有代表性的菌株,即C01、C16、C20,其生理学特性见表 1.
| 表 1 3株内生细菌生理特性 Tab. 1 Physiological characteristics of three endophytic bacteria |
3株内生细菌与GenBank数据库进行比对分析,并使用Mega做出系统发育树(图 1). C01(登录号为MK 796436)与其同源性较高的菌株均属于假单胞菌属,其中与荧光假单胞菌(Pseudomonas fluorescens)同源性最高(99 %)、C16(登录号为MK 796534)、C20(登录号为MK 796533)与其同源性较高的菌株均属于肠杆菌科,其中C16与肠杆菌(Enterobacter sp.)同源性最高(99 %)、C20与欧文氏菌(Erwinia sp.)同源性最高(99 %).

|
图 1 3株内生细菌的16S rDNA序列系统发育树 Fig.1 Phylogenetic tree of three endophytic bacteria based on the 16S rDNA sequence of endophytic bacteria |
内生细菌对美人蕉种子萌发率的影响见图 2a,萌发15天后发现C01、C16、C20、对照组的萌发率分别为72.2 %、83.3 %、75.0 %、31.1 %,其中C16试验组的萌发率显著高于对照组(P < 0.05).
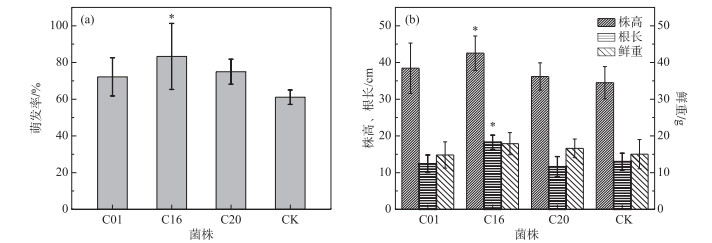
|
图 2 内生细菌对美人蕉的促生作用(*表示试验组与对照组有显著性差异(P < 0.05)) Fig.2 The promoting effect of endophytic bacteria on Canna indica |
内生细菌对美人蕉株高、根长、鲜重的影响见图 2b,其中接种C01、C16、C20内生细菌不同程度地增加了美人蕉的株高,比对照组分别增加了11.41 %、23.33 %、4.89 %,其中接种C16内生细菌的美人蕉株高显著高于对照组(P < 0.01).在植物根长方面,接种C16内生细菌显著增加了美人蕉根长,与对照组相比增加了40.44 % (P < 0.01),接种C01、C20内生细菌对根长没有促进作用.接种C16、C20内生细菌增加了美人蕉的鲜重,相对于对照组分别增加了19.13 %、10.69 %,接种C01对鲜重没有促进作用.
2.3 接种内生细菌后的美人蕉对污染水体的净化模拟生态浮床进水TN浓度为34.259±0.227 mg/L, TP浓度为6.971±0.019 mg/L,根据湖泊富营养状态分类,此进水为富营养类型.接种内生细菌的美人蕉对水质中营养物质的吸收,可以看出C01和C16处理组水体中TP浓度明显低于对照组,C20处理组水体浓度与对照组相比没有明显差异;第24天,C01、C16、C20、对照组的水体TP去除率分别为82.1 %、88.4 %、68.4 %、69.6 % (图 3).
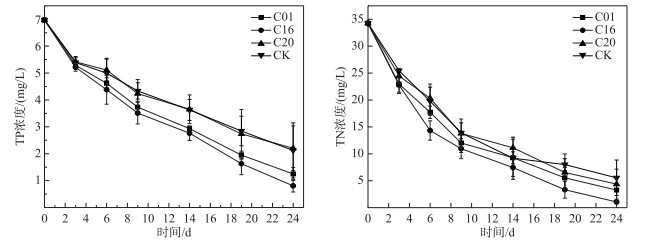
|
图 3 接种不同内生细菌的美人蕉对水体中营养物质浓度的影响 Fig.3 Effects of Canna indica inoculated with different endophytic bacteria on the concentration of nutrients in water |
C01和C16处理组水体中TN浓度明显低于对照组,在前14天C20处理组水体浓度与对照组相比没有明显差异,在后2次采样中TN浓度明显低于对照组;第24天,C01、C16、C20、对照组试验组的水体TN去除率分别是90.4 %、96.9 %、87.2 %、83.8 % (图 3).
2.4 接种内生细菌后美人蕉的生长、生理特性接种不同内生细菌的美人蕉地上鲜重、地上干重、地下鲜重、地下干重、株高、根长见表 2,C01、C16试验组的美人蕉地上鲜重、地上干重、地下鲜重、地下干重、根长都显著高于对照组.
| 表 2 接种不同内生细菌的美人蕉地上鲜重、地上干重、地下鲜重、地下干重、株高、根长 Tab. 2 The aboveground fresh weight, dry weight, underground fresh weight, dry weight, plant height and root length of the Canna indica inoculated with different endophytic bacteria |
接种内生细菌的美人蕉叶绿素含量(图 4a),C01、C16、C20、CK试验组中美人蕉叶绿素a含量分别为1.217、1.214、1.199、1.090 mg/g;叶绿素b含量分别为0.457、0.434、0.345、0.386 mg/g;总叶绿素含量分别为1.720、1.695、1.638、1.526 mg/g.
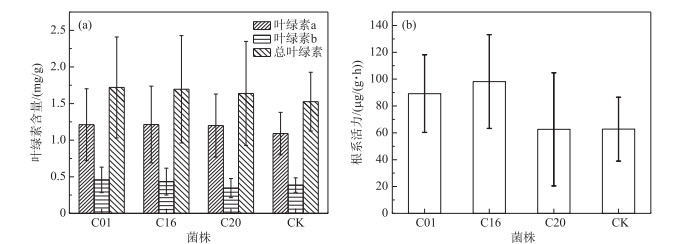
|
图 4 接种不同内生细菌的美人蕉叶绿素含量(a)和根系活力(b) Fig.4 The chlorophyll content(a) and root activity(b) of the Canna indica inoculated with different endophytic bacteria |
接种C01、C16、C20内生细菌和对照组中美人蕉根系活力分别为89.20、98.20、62.59和62.76 μg/(g ·h),接种C01、C16内生细菌可使美人蕉根系活力分别提高42.1 %、56.5 %;C20对美人蕉根系活力的影响并不明显(图 4b).
接种C01、C16、C20内生细菌以及对照组中美人蕉可溶性糖鲜重含量分别为0.332 %、1.185 %、0.580 %、0.284 %,其中接种C16的美人蕉可溶性糖含量显著高于对照组(P < 0.05),与对照组相比提高了317.3 %,接种C01、C20内生细菌的美人蕉可溶性糖含量与对照组相比分别提高了16.9 %、104.2 % (图 5a).
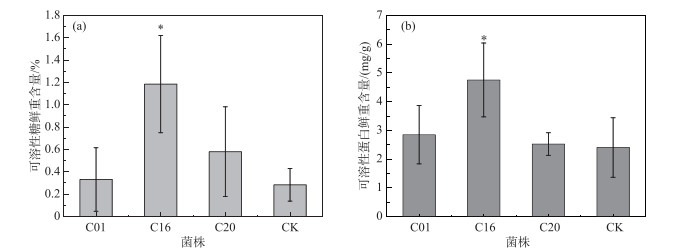
|
图 5 接种不同内生细菌的美人蕉可溶性糖(a)和可溶性蛋白(b)含量(*表示试验组与对照组有显著性差异(P < 0.05)) Fig.5 The soluble sugar(a) and soluble protein (b) content of the Canna indica inoculated with different endophytic bacteria |
接种C01、C16、C20内生细菌以及对照组中美人蕉可溶性蛋白鲜重含量分别为2.846、4.752、2.523、2.403 mg/g,其中接种C16后的美人蕉可溶性蛋白含量显著高于对照组(P < 0.01),与对照组相比提高了97.8 %,接种C01的美人蕉可溶性蛋白含量与对照组相比提高了18.4 %,接种C20对美人蕉可溶性蛋白含量的影响并不明显.
3 讨论研究表明,在高等植物中广泛存在着内生细菌,从单子叶植物到多子叶植物,从木本科植物到禾本科植物,同时对于同一物种一般能够分离出数十至数百种不等的内生细菌[37].本试验采用表面消毒法对美人蕉根、茎、叶表面进行消毒,全程在无菌条件下进行分离纯化,得到美人蕉内生细菌.通常内生细菌可以通过各种机制增强植物生长并提高植物对污染物质的吸收,这些机制包括固氮、溶解磷酸盐、产生吲哚乙酸和铁载体[38-39].经过测定内生细菌的以上几种有益生理学特性,筛选C01、C16、C20作为试验的供试菌株,接种供试菌株可使美人蕉种子的萌发率和幼苗的生物量有不同程度地增加.目前研究已证明将种子浸泡在细菌悬浮液中、将细菌接种到植物根部、将细菌菌液喷洒到植物叶面可使细菌重新定殖在植物体内[18, 22, 40], 该试验中内生细菌在植物体内的分布及浓度并没有展示,但是从宏观上观察内生细菌对美人蕉是具有促生作用的.吲哚乙酸作为研究最多的生长素,能够促进植物细胞伸长生长,有效促进植物根系伸长[41];产铁载体的内生细菌能够向寄主植物提供铁元素,或者减少环境中病原菌可利用的铁而降低病原菌的竞争力,达到促进植物生长的目的[42];固氮内生细菌与植物共生能够提高宿主植物的氮吸收与氮代谢水平[43];溶磷内生细菌具有溶解矿物磷酸盐的能力,能够增强植物对磷的吸收,从而提高植物的营养促进生长[44].内生细菌C16具有产吲哚乙酸、产铁载体、固氮、溶磷能力,其中溶磷能力相对较高,接种C16显著增加了美人蕉种子萌发率、株高和根长,说明C16对美人蕉具有促生作用.内生细菌的促生能力机制较为复杂,在目前的研究中具体哪一种促生机制占据主导地位还没有得到证实.
在吴建强的试验中已证明美人蕉体内的氮磷累积量差异主要来自于生物量的差异,美人蕉氮磷吸收量与植物生物量呈现显著相关性[45].接种内生细菌促进了美人蕉的生长,接种内生细菌后的美人蕉是否增强了美人蕉对水体中营养物质的吸收?在水质净化试验中发现,接种内生细菌C16试验组较大幅度地提高了TN、TP的去除率,C01试验组也提高了TP、TN的去除率. Hurek等研究发现固氮弧菌(Azoarcus sp.)BH72能够分泌生长素并能定殖在水稻根部并提高宿主植物营养物质的摄入量[46]. Shehzadi等分别从香蒲茎和浮萍根中分离得到Microbacterium arboresscens TYSI04和Bacillus pumilus PIPR30,并在种植香蒲的人工湿地中将两株内生细菌菌液接种于纺织废水中,结果在香蒲的根、芽中检测到内生细菌,表明了内生细菌能够通过根部在植物体内定殖,同时也证明了接种内生细菌能够提高香蒲的生物量和对废水的净化效率[23]. Ashraf等将3种内生细菌的混合菌液接种于种植双稃草(Leptochloa fusca)的人工湿地中治理制革厂尾水,结果在接种内生细菌的植物根际、根内、茎内都检测到内生细菌的存在,且内生细菌增加了双稃草的根长、鲜重和干重,同时与对照组(未种植双稃草和未接种内生细菌)相比有植物组人工湿地中化学需氧量(COD)、生化需氧量(BOD)、油脂的去除率分别提高了36 %、55 %、40 %;有植物并接种内生细菌人工湿地中化学需氧量、生化需氧量、油脂的去除率分别提高了97.5 %、98 %、97.9 % [47].这些试验也证明了接种内生细菌能够促进植物的生长和提高污染物质的吸收.以植物为主的水体修复技术,关键在于植物生长吸收去除水体中的污染负荷,起到净化水体的效果,所以植物生长状况直接影响修复效率的高低.接种内生细菌C16试验组起初增加美人蕉种子的萌发率和幼苗的株高和根长,试验结束时该组美人蕉地上、下鲜重,地上、下干重以及根长都显著高于对照组,证明美人蕉生物量有所增长.与此同时,根系活力作为植物生长发育的重要生理指标,根系发达程度不同,对污染物质的吸收和吸附作用强度不同[48].接种C16没有显著增加单位重量的根系活力,但是美人蕉的根系根长和地下鲜重显著高于对照组.可溶性糖和可溶性蛋白是植物体内重要的物质,可溶性糖能够以类似植物激素的方式作为一种信号分子调控植物的生长、发育、成熟和衰老,可溶性蛋白直接影响植物对生物胁迫的响应以及植株的生长[49]. C16试验组可溶性糖、可溶性蛋白含量显著高于对照组.由此可见接种内生细菌C16的美人蕉的生长状况优于对照组,进一步解释了接种C16的美人蕉TN、TP的去除率高于对照组这一试验结果.
从“植物内生细菌”的概念提出,内生细菌不断在植物体内分离出来.宋歌等从绦柳种分离筛选出能降解多氯联苯的内生细菌并经鉴定为肠杆菌属[50].刘辉等从杨树中分离出一株荧光假单胞菌,经过实验证明其有溶磷能力并能促进柳树的生长[51].本文根据16S rDNA序列分析,C01菌株为荧光假单胞菌,C16菌株为肠杆菌,C20菌株为欧文氏菌.美人蕉体内分离出的内生细菌的种群具有广泛的分布性.
根据试验报道感染内生细菌的植物比未感染内生细菌的植物竞争能力强[52].内生细菌的几种有益生理学特性对植物的生长和发育有着积极的贡献.本试验中证明了接种内生细菌的美人蕉生长状况更好,对氮磷的吸收能力更强,但是存在两个不足之处(1)试验根据前人的方法将内生细菌接种到美人蕉种子和幼苗根部,通过美人蕉的生长状况推测内生细菌侵染了美人蕉,并未测定内生细菌在植物体内的分布情况;(2)试验只与未接种内生细菌的美人蕉作为比较,缺乏与自然状况下生长的美人蕉的比较.因此,在今后的试验中笔者会进一步探讨不同接种方式下内生细菌在美人蕉体内的分别情况以及接种内生细菌的美人蕉在实际工程中的应用前景.
4 结论美人蕉体内分离出内生细菌,经过筛选并用接种C01、C16、C20于美人蕉的种子、幼苗,通过小型浮床试验,表明内生细菌C16为肠杆菌,具有促进美人蕉生长的作用,并在水质净化中接种内生细菌C16的美人蕉具有较强的TN、TP去除率.内生细菌和美人蕉协同作用有望为人工浮床技术修复富营养化水体提供一种新思路.
| [1] |
Wang KY, Zheng SS, Guo ZL. Advance in improving the removal efficiency of nitrogen and phosphorus of ecological floating bed system. Wetland Science, 2012, 10(1): 116-120. [汪开英, 郑水生, 郭宗楼等. 提高生态浮床系统脱氮除磷效率研究进展. 湿地科学, 2012, 10(1): 116-120. DOI:10.3969/j.issn.1672-5948.2012.01.016] |
| [2] |
Deng ZQ, Yan BX, Li XH et al. Research progress of application of artificial floating beds technology. Environmental Pollution & Control, 2013, 35(5): 88-92. [邓志强, 阎百兴, 李旭辉等. 人工浮床技术开发与应用研究进展. 环境污染与防治, 2013, 35(5): 88-92. DOI:10.3969/j.issn.1001-3865.2013.05.019] |
| [3] |
Hallmann J, Quadt-Hallmann A, Mahaffee WF et al. Bacterial endophytes in agricultural crops. Canadian Journal of Microbiology, 1997, 43(10): 895-914. DOI:10.117/0095244305054674 |
| [4] |
Lodewyckx C, Vangronsveld J, Porteous F et al. Endophytic bacteria and their potential applications. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606. DOI:10.1080/0735-260291044377 |
| [5] |
Kobayashi DY, Palumbo JD. Bacterial endophytes and their effects on plants and uses in agriculture. Microbial Endophytes, 2000: 199-236.
|
| [6] |
Fisher PJ, Petrini O, Scott HML. The distribution of some fungal and bacterial endophytes in maize(Zea mays L.). New Phytologist, 1992, 122(2): 299-305. DOI:10.1111/j.1469-8137.1992.tb04234.x |
| [7] |
McInroy JA, Kloepper JW. Survey of indigenous bacterial endophytes from cotton and sweet corn. Plant & Soil, 1995, 173(2): 337-342. DOI:10.1007/bf00011472 |
| [8] |
Sturz AV, Christie BR, Nowak J. Bacterial endophytes:Potential role in developing sustainable systems of crop production. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30. DOI:10.1080/07352680091139169 |
| [9] |
Baldani JI, Olivares FL, Hemerly AS et al. Nitrogen-fixing endophytes: Recent advances in the association with graminaceous plants grown in the tropics, Biological Nitrogen Fixation for the 21st Century. Dordrecht: Springer Netherlands, 1998: 203-206. DOI: 10.1007/978-94-011-5159-7_90.
|
| [10] |
Lamb TG, Tonkyn DW, Kluepfel DA. Movement of Pseudomonas aureofaciens from the rhizosphere to aerial plant tissue. Canadian Journal of Microbiology, 1996, 42(11): 1112-1120. DOI:10.1139/m96-143 |
| [11] |
Zhang G, Mao Q, He Z et al. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates from Oryza rufipogon in Lingshui. Chinese Journal of Applied & Environmental Biology, 2006, 12(4): 457-460. |
| [12] |
Liu L, Sun L, Zhang RY et al. Diversity of IAA-producing endophytic bacteria isolated from the roots of Cymbidium goeringii. Biodiversity Science, 2010, 18(2): 195-200. DOI:10.3724/SP.J.1003.2010.195 |
| [13] |
Saikkonen K, Faeth SH, Helander M et al. FUNGAL ENDOPHYTES:A continuum of interactions with host plants. Annual Review of Ecology & Systematics, 1998, 29(1): 319-343. DOI:10.2307/221711 |
| [14] |
Chen C, Bauske EM, Musson G et al. Biological control of Fusarium wilt on cotton by use of endophytic bacteria. Biological Control, 1995, 5(1): 83-91. DOI:10.1006/bcon.1995.1009 |
| [15] |
van Peer R. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of carnation by Pseudomonas sp. strain WCS417r. Phytopathology, 1991, 81(7): 728-734. DOI:10.1094/Phyto-81-728 |
| [16] |
Li QQ, Luo K, Lin W et al. Isolation of tomato endophytic antagonists against Ralstonia solanacearum. Acta Phytopathologica Sinica, 2003, 33(4): 364-367. [黎起秦, 罗宽, 林纬等. 番茄青枯病内生拮抗细菌的筛选. 植物病理学报, 2003, 33(4): 364-367. DOI:10.3321/j.issn:0412-0914.2003.04.016] |
| [17] |
Deng QW, Wang YD, Ding DX et al. Construction of the Syngonium podophyllum-Pseudomonas sp. XNN8 symbiotic purification system and investigation of its capability of remediating uranium wastewater. Environmental Science and Pollution Research, 2017, 24(6): 5134-5143. DOI:10.1007/s11356-016-6392-z |
| [18] |
Afzal M, Yousaf S, Reichenauer TG et al. The inoculation method affects colonization and performance of bacterial inoculant strains in the phytoremediation of soil contaminated with diesel oil. International Journal of Phytoremediation, 2012, 14(1): 35-47. DOI:10.1080/15226514.2011.552928 |
| [19] |
Ma Y, Rajkumar M, Luo YM et al. Inoculation of endophytic bacteria on host and non-host plants-Effects on plant growth and Ni uptake. Journal of Hazardous Materials, 2011, 195(1): 230-237. DOI:10.1016/j.jhazmat.2011.08.034 |
| [20] |
Luo SL, Chen L, Chen JL et al. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation. Chemosphere, 2011, 85(7): 1130-1138. DOI:10.1016/j.chemosphere.2011.07.053 |
| [21] |
Sun LN, Zhang YF, He LY et al. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland. Bioresour Technol, 2010, 101(2): 501-509. DOI:10.1016/j.biortech.2009.08.011 |
| [22] |
Afzal M, Khan S, Iqbal S et al. Inoculation method affects colonization and activity of Burkholderia phytofirmans PsJN during phytoremediation of diesel-contaminated soil. International Biodeterioration & Biodegradation, 2013, 85(1/2): 331-336. DOI:10.1016/j.ibiod.2013.08.022 |
| [23] |
Shehzadi M, Afzal M, Khan MU et al. Enhanced degradation of textile effluent in constructed wetland system using Typha domingensis and textile effluent-degrading endophytic bacteria. Water Research, 2014, 58(58C): 152-159. DOI:10.1016/j.watres.2014.03.064 |
| [24] |
Ijaz A, Shabir G, Khan QM et al. Enhanced remediation of sewage effluent by endophyte-assisted floating treatment wetlands. Ecological Engineering, 2015, 84(2): 58-66. DOI:10.1016/j.ecoleng.2015.07.025 |
| [25] |
Bu FP, Luo GY, Xu XY et al. Canna indica and Acorus calamus ecological floating beds for purification of micro-polluted source water. China Water & Wastewater, 2010, 26(3): 14-17. [卜发平, 罗固源, 许晓毅等. 美人蕉和菖蒲生态浮床净化微污染源水的比较. 中国给水排水, 2010, 26(3): 14-17.] |
| [26] |
Jing LD, Ao HY, Liu JT et al. Simulation study on in situ purification of lake inlets with artificial floating bed. J Lake Sci, 2011, 23(5): 708-718. [景连东, 敖鸿毅, 刘剑彤等. 人工浮床运用于入湖河流原位净化模拟研究. 湖泊科学, 2011, 23(5): 708-718. DOI:10.18307/2011.0507] |
| [27] |
Wang QJ, Li L, Li ZW. Removal of nitrogen and phosphorus by four plants of subsurface constructed wetlands. Environmental Pollution & Control, 2008, 30(2): 33-36. [王全金, 李丽, 李忠卫. 四种植物潜流人工湿地脱氮除磷的研究. 环境污染与防治, 2008, 30(2): 33-36. DOI:10.3969/j.issn.1001-3865.2008.02.010] |
| [28] |
Hu QP, Xu JG, Liu HL et al. Isolation and identification of endogenetic bacteria in tomato stems and screening of antagonistic bacteria to Pseudomonas solanacearum. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10): 2039-2043. [胡青平, 徐建国, 刘会龙等. 番茄茎内生细菌的分离鉴定及青枯病拮抗菌的筛选. 西北植物学报, 2006, 26(10): 2039-2043. DOI:10.1016/S1872-2075(06)60070-8] |
| [29] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied & Environmental Microbiology, 1995, 61(2): 793-796. DOI:10.0000/PMID16534942 |
| [30] |
Feng RZ, Feng YH, Yao T et al. The screening of phosphobacteria and solubilizing phosphate ability in the rhizosphere of alfalfa and wheat. Journal of Gansu Agricultural University, 2005, 40(5): 604-608. [冯瑞章, 冯月红, 姚拓等. 春小麦和苜蓿根际溶磷菌筛选及其溶磷能力测定. 甘肃农业大学学报, 2005, 40(5): 604-608. DOI:10.3969/j.issn.1003-4315.2005.05.007] |
| [31] |
Alexander DB, Zuberer DA. Use of chrome azurol S reagents to evaluate siderophore production by rhizosphere bacteria. Biology & Fertility of Soils, 1991, 12(1): 39-45. DOI:10.1007/BF00369386 |
| [32] |
Krause A, Ramakumar A, Bartels D et al. Complete genome of the mutualistic, N2-fixing grass endophyte Azoarcus sp. strain BH72. Nature Biotechnology, 2006, 24(11): 1384-1390. DOI:10.1038/nbt1243 |
| [33] |
Zhou YQ, Li CA, Li SY. The germination condition of Canna L.' seeds. Journal of Yuxi Normal University, 2007, 23(12): 5-8. [周元清, 李春安, 李淑英. 美人蕉种子硬实与萌芽条件的研究. 玉溪师范学院学报, 2007, 23(12): 5-8. DOI:10.3969/j.issn.1009-9506.2007.12.002] |
| [34] |
Prochaska CA, Zouboulis AI. Treatment performance variation at different depths within vertical subsurface-flow experimental wetlands fed with simulated domestic sewage. Desalination, 2009, 237(1/2/3): 367-377. DOI:10.1016/j.desal.2008.01.028 |
| [35] |
Wang LL, Luan BH, Liu XQ et al. Relationship between the contents of nutrients and chlorophylls in leaves of different grape varieties and their resistance to Apolygus lucorum (Hemiptera:Miridae). Acta Entomologica Sinica, 2017, 60(5): 570-575. [王丽丽, 栾炳辉, 刘学卿等. 葡萄叶片中营养物质和叶绿素含量与其对绿盲蝽抗性的关系. 昆虫学报, 2017, 60(5): 570-575. DOI:10.16380/j.kcxb.2017.05.009] |
| [36] |
Zhang ZL, Qu WJ eds. Guidance of plant physiology experiments. Beijing: Higher Education Press, 2003: 27-49. [张志良, 瞿伟菁. 植物生理学实验指导. 北京: 高等教育出版社, 2003: 27-49.]
|
| [37] |
Tan RX, Zou WX. Endophytes:a rich source of functional metabolites (1987 to 2000). Natural Product Reports, 2001, 18(4): 448-459. DOI:10.1039/b100918o |
| [38] |
Verma SC, Ladha JK, Tripathi A. Evaluation of plant growth promoting and colonization ability of endophytic diazotrophs
|
| [39] |
Lee S, Flores-Encarnación M, Contreras-Zentella M et al. Indole-3-acetic acid biosynthesis is deficient in Gluconacetobacter diazotrophicus strains with mutations in cytochrome c biogenesis genes. Journal of Bacteriology, 2004, 186(16): 5384-5391. DOI:10.1128/JB.186.16.5384-5391.2004 |
| [40] |
Rajkumar M, Ae N, Freitas H. Endophytic bacteria and their potential to enhance heavy metal phytoextraction. Chemosphere, 2009, 77(2): 153-160. DOI:10.1016/j.chemosphere.2009.04.047 |
| [41] |
Yuan BH, Liao XR, Zheng XJ et al. Metabolism and function of 1AA in plant cell. Bulletin of Biology, 2005, 40(4): 21-23. [苑博华, 廖祥儒, 郑晓洁等. 吲哚乙酸在植物细胞中的代谢及其作用. 生物学通报, 2005, 40(4): 21-23. DOI:10.3969/j.issn.0006-3193.2005.04.010] |
| [42] |
Sun L, Shao H, Liu L et al. Diversity of siderophore-producing endophytic bacteria of Cymbidium goeringii roots. Acta Microbiologica Sinica, 2011, 51(2): 189-195. [孙磊, 邵红, 刘琳等. 可产生铁载体的春兰根内生细菌多样性. 微生物学报, 2011, 51(2): 189-195.] |
| [43] |
Yang B, Chen Y, Li X et al. Research progress on endophyte-promoted plant nitrogen assimilation and metabolism. Acta Ecologica Sinica, 2013, 33(9): 2656-2664. [杨波, 陈晏, 李霞等. 植物内生细菌促进宿主氮吸收与代谢研究进展. 生态学报, 2013, 33(9): 2656-2664. DOI:10.5846/stxb201202050147] |
| [44] |
Huang J, Sheng XF, He LY. Biodiversity of phosphate-dissolving and plant growth-promoting endophytic bacteria of two crops. Acta Microbiologica Sinica, 2010, 50(6): 710-716. [黄静, 盛下放, 何琳燕. 具溶磷能力的植物内生促生细菌的分离筛选及其生物多样性. 微生物学报, 2010, 50(6): 710-716.] |
| [45] |
Wu JQ, Wang M, Wu J. An experimental study on nitrogen and phosphorus uptake abilities of four plants cultivated on floating-bed. Shanghai Environmental Sciences, 2010(4): 164-168, 184. [吴建强, 王敏, 吴健. 4种浮床植物吸收湖泊水体氮磷能力试验研究. 上海环境科学, 2010(4): 164-168, 184.] |
| [46] |
Hurek T, Reinhold-Hurek B. Azoarcus sp. strain BH72 as a model for nitrogen-fixing grass endophytes. Journal of Biotechnology, 2003, 106(2/3): 169-178. DOI:10.1016/j.jbiotec.2003.07.010 |
| [47] |
Ashraf S, Afzal M, Naveed M et al. Endophytic bacteria enhance remediation of tannery effluent in constructed wetlands vegetated with Leptochloa fusca. International Journal of Phytoremediation, 2018, 20(2): 121-128. DOI:10.1080/15226514.2017.1337072 |
| [48] |
Cheng LF, Zhang X, Fan LY et al. Research progress on roots of wetland plants in constructed wetland. Shanxi Forestry Science and Technology, 2017, 46(2): 40-45. [程丽芬, 张欣, 樊兰英等. 人工湿地水生植物根系研究进展. 山西林业科技, 2017, 46(2): 40-45. DOI:10.3969/j.issn.1007-726X.2017.02.011] |
| [49] |
Zhao JT, Li XF, Li H et al. Research on the role of the soluble sugar in the regulation of physiological metabolism in higher plant. Journal of Anhui Agri Sci, 2006, 34(24): 6423-6425. [赵江涛, 李晓峰, 李航等. 可溶性糖在高等植物代谢调节中的生理作用. 安徽农业科学, 2006, 34(24): 6423-6425. DOI:10.3969/j.issn.0517-6611.2006.24.008] |
| [50] |
Song G, Cai M, Du KJ. Isolation and characterization of polychlorinated biphenyl-degrading endophytic bacterium from Salix matsudana f. pendula. Chinese Journal of Ecology, 2016, 35(4): 1038-1046. [宋歌, 才满, 杜克久. 具多氯联苯降解特性绦柳内生细菌的分离筛选及其移除性能. 生态学杂志, 2016, 35(4): 1038-1046. DOI:10.13292/j.1000-4890.201604.018] |
| [51] |
Liu H, Wu XQ, Ren JH et al. Phosphate-dissolving characteristics and growth promoting effect of Pseudomoads fluorescent JW-JS1 on poplar seedlings. Scientia Silvae Sinicae, 2013, 49(9): 112-118. [刘辉, 吴小芹, 任嘉红等. 一株荧光假单胞菌的溶磷特性及其对杨树的促生效果. 林业科学, 2013, 49(9): 112-118. DOI:10.11707/j.1001-7488.20130916] |
| [52] |
Shi JY, Chen WX, Liu AY. Advances in the study of endophytes and their effects on control of plant diseases. Acta Ecologica Sinica, 2006, 26(7): 2395-2401. [石晶盈, 陈维信, 刘爱媛. 植物内生细菌及其防治植物病害的研究进展. 生态学报, 2006, 26(7): 2395-2401. DOI:10.3321/j.issn:1000-0933.2006.07.044] |
 2019, Vol. 31
2019, Vol. 31 

