(2: 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
(3: 池塘健康养殖湖北省工程实验室, 武汉 430070)
(2: Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, P. R. China)
(3: Hubei Provincial Engineering Laboratory for Pond Aquaculture, Wuhan 430070, P. R. China)
沉水植物作为水生态系统中重要的初级生产者,对水体净化以及水生态系统功能的恢复有着重要的作用.沉水植物不仅可以通过吸收水体和底泥中的营养盐来缓解水体的富营养化,也可以抑制藻类的繁殖扩散.方焰星等[1]认为沉水植物有较强的耐污与去污能力,对富营养化水体的修复效果显著.但沉水植物的生长受到很多因素的影响,包括水体营养盐浓度[2]和气候变化[3-4]等非生物因素,也包括藻类的竞争[5-6]和水生动物的牧食[7-9]等生物因素.环境因子的变化也可以对草食动物产生直接的影响,如在一定范围内的升温会导致草食性节肢动物代谢速率加快[10],进而导致牧食量的增加[11];也可以通过影响植物的理化性质间接地影响到草食动物,如以高水平CO2下生长的植物喂养草食性节肢动物,其相对消耗速率及总消耗量会更高[12-13].
基质是根生水生植物的主要营养物质来源[14-15],不同的基质类型对水生植物的生长、繁殖和扩散具有重要的影响[16].研究表明,黑藻(Hydrilla verticillata)、苦草(Vallisneria spiralis)和马来眼子菜(Potamogeton malaianus)在营养丰富的基质中生长速度更快,生长状态更好[17].沉水植物在氮、磷含量高的淤泥基质比生泥基质中相对生长速率更高,生长更迅速,但营养物质含量过高的基质类型同样也会对沉水植物的生长产生抑制作用[18].有研究表明,不同基质类型对螺类的生长也有一定影响,东风螺的水泥池养殖中不铺沙基质时的生长速度和存活率均显著低于铺沙基质,而且底沙含泥量不高于10 %时不会影响其生长,但达到30 %时初期东风螺的生长会受到不良影响[19].
沉水植物作为草食性水生动物的主要食物来源,对整个水生生态系统结构的稳定具有重要意义[20].草食性螺类作为水生食物网中的初级消费者,不仅可以刮食水生植物表面的附着藻类,减少附着藻类对沉水植物的遮蔽效应,从而有利于沉水植物的生长和扩散[21-22];也可以直接大量牧食沉水植物抑制其生长[23-24].植物在被牧食过程中,为了应对草食性动物的牧食,植物发展出了多种防御策略[25], 包括形态上的可塑性[26],组织间化合物的适应性分配[27]以及次生代谢物的合成等[28-29].其中,酚类是一种常见的且重要的次生代谢物[25],是公认的广泛存在于水生植物之中的化学防御物质[30]. Lodge[30]发现酚类含量高的水生植物可以抵御小龙虾的牧食.草食性螺类对沉水植物的牧食到底是促进沉水植物生长,还是抑制沉水植物生长,还存在着很多争议,所以螺草关系还有待深入研究.
目前国内关于水生动植物牧食关系的研究越来越多,但大部分研究主要关注水生植物,而忽略了水生动物在此过程中的生长和生理变化.同时,作为重要环境因素的基质类型对螺草牧食关系的影响还相对较少.本实验以耳萝卜螺(R. auricularia)和苦草(V. spiralis)为研究对象,研究基质类型对螺类和沉水植物牧食关系的影响,以及在牧食过程中螺类生长和元素特征的变化,以期能够阐明基质类型对水生动植物牧食关系的影响机制,为牧食理论的研究提供基础数据支持,也可为沉水植被恢复、水生生态系统稳定提供参考.
1 材料与方法 1.1 材料收集培养实验所用沉水植物苦草和水生无脊椎动物耳萝卜螺均是长江中下游地区常见物种. 2017年7月,实验前于梁子湖采集,选取大小相对一致的苦草种植于水族箱中进行培育;选取大小相对一致的耳萝卜螺放于水族箱进行培养,并用苦草饲喂.实验在华中农业大学水产基地水生生物培养室中进行.
1.2 实验设计将聚乙烯塑料盒(h=9 cm, d1=23 cm, d2=19 cm)中装满沉积物,用纱网袋(网眼大小不足以使螺逃逸)罩起来后放入开口式水族缸(1.2 m×0.6 m×0.6 m)中,并注水至40 cm深.实验设2个影响因子(基质类型和螺类牧食),6个处理组,即泥;泥+螺;泥沙(1 :1);泥沙+螺;沙;沙+螺.每个处理组设6个重复,共6个水族缸.实验所选用的3种基质的总碳和总氮含量及碳氮比见表 1.
| 表 1 3种沉积物中元素的含量 Tab. 1 The content of elements in three sediment types |
2017年7月30日挑选长势较好、无损伤、高度、大小相对一致的苦草移栽至塑料盆中,各盆里的苦草鲜重、株高和叶片数基本一致(鲜重为1.55±0.03 g,株高为19.76±0.19 cm,叶片数为9.35±0.17),每盆种植2株(60株/m2). 3天后按实验设计放入耳萝卜螺(饥饿处理1天),牧食组的每个塑料盆中放入6只耳萝卜螺(50只/m2),耳萝卜螺鲜重和形态大小基本一致(鲜重为0.126±0.003 g,壳高为1.146±0.008 cm,壳宽为0.616±0.006 cm,壳口高为0.787±0.008 cm,壳口宽为0.419±0.004 cm,体螺层长为0.983±0.007 cm).实验期间每天观察,为保证处理组螺密度的一致性,移除新生小螺.实验期间,随机选取3天测定各处理组水质指标,每天中午测定光照强度,各处理组水质指标及光照均无显著差异(表 2).
| 表 2 各处理组的水质指标 Tab. 2 Water quality indexes measured in each treatment |
实验前分别采集3种沉积物样品3份,放入烘箱75℃烘干72 h. 2017年9月2日实验结束,测定苦草鲜重、叶片数、地上与地下部分鲜重等指标.计算苦草相对生长率(Relative growth rate,RGR),公式:RGR =ln(Wf/Wi)/t,Wf和Wi分别代表实验后和实验前苦草鲜重,t代表实验天数.测定耳萝卜螺鲜重、壳高、壳宽、壳口高、壳口宽以及体螺层长等指标.测定完上述指标后将苦草和耳萝卜螺放入烘箱75℃烘干72 h,分别测定苦草的地上和地下部分干重以及耳萝卜螺干重,然后分别研磨成粉状,采用Folin-Ciocalteau方法[31]测定苦草叶片总酚含量,然后使用CHNS/O元素分析仪(vario PYRO cube,German)采用燃烧法[32]分别测定基质、苦草叶片以及耳萝卜螺的总碳和总氮含量.
1.4 数据分析本实验使用单个植株的指标进行分析.处理间各植株生长指标(即,苦草叶片数、地上生物量、地下生物量、根冠比、总生物量、相对生长率、总碳含量、总氮含量、碳氮比和总酚含量)均使用Two-way ANOVAs在α=0.05的水平下进行显著性分析,并采用Bonferroni test进行事后检验.为了检验基质类型对螺类生长(螺鲜重、壳高、壳宽、壳口高、壳口宽以及体螺层长等)和元素特征(总碳含量、总氮含量、碳氮比)的影响,使用One-way ANOVA在α=0.05的水平下进行显著性分析,并采用Tukey's HSD事后检验.所有数据分析均采用SPSS 19.0统计软件完成.
2 结果 2.1 对苦草形态和生长的影响基质类型、牧食和两者交互作用对苦草的叶片数、地上生物量、根冠比、总生物量和相对生长速率均有显著影响,而对地下生物量无显著影响(Two-way ANOVA)(表 3).
| 表 3 基质类型和牧食处理对苦草形态生长的影响* Tab. 3 The effects of sediment types and herbivory on the morphological growth of V. spiralis |
不同基质类型下,牧食对苦草的影响不同.在泥基质下,螺的牧食对苦草的叶片数、地上生物量、地下生物量、根冠比、总生物量和相对生长率均无显著影响(P>0.05)(图 1).在泥沙基质下,螺的牧食对苦草的生长有显著抑制作用,显著抑制了苦草的叶片数(减少了约37.84 %)、地上生物量(减少了约67.74 %)、总生物量(减少了约63.09 %)和相对生长率(P < 0.001),也抑制了地下部分生物量的积累(减少了约19.01 %),但并不显著(P>0.05),使根冠比显著升高(P < 0.01)(图 1).在沙基质下,螺的牧食显著抑制了苦草地上生物量(减少了约58.58 %)和总生物量(减少了约49.32 %)的积累,使苦草的相对生长率显著下降(P < 0.01),但使苦草地下生物量的积累稍有增加(P>0.05),使根冠比显著升高(P < 0.001),对叶片数无显著影响(P>0.05)(图 1).

|
图 1 不同处理组苦草总叶片数、地上生物量、地下生物量、根冠比、总生物量和相对生长率的差异 Fig.1 Total plant number of leaves, shoot biomass, root biomass, root: shoot biomass ratio, total plant biomass and relative growth rates of V. spiralis in all treatments |
不同牧食条件下,基质类型对苦草的影响有所差异.有螺牧食时,基质类型对苦草叶片数、地上生物量、地下生物量和总生物量均无显著影响(P>0.05),沙组苦草根冠比显著高于泥组和泥沙组(P < 0.01),泥组苦草的相对生长率显著高于沙组(P < 0.01)(图 1).无螺牧食时,基质类型对苦草地下生物量和根冠比无显著影响(P>0.05),但是泥沙组苦草的叶片数、地上生物量、总生物量和相对生长率均显著高于泥组和沙组(P < 0.05),泥组和沙组苦草的叶片数、地上生物量、总生物量和相对生长率无显著差异(P>0.05)(图 1).
2.2 对苦草碳氮和总酚含量的影响基质类型对苦草叶片的总碳含量、总氮含量、碳氮比和总酚含量均无显著影响,牧食显著影响了苦草的总氮含量和碳氮比,但对总碳和总酚含量无显著影响,基质类型和牧食的交互作用对总碳含量无显著影响,但对总氮含量、碳氮比和总酚含量影响显著(表 4).
| 表 4 基质类型和牧食处理对苦草总碳、总氮、碳氮比及总酚含量的影响* Tab. 4 The effects of sediment types and herbivory on total carbon content, total nitrogen content, C/N ratio and total phenols content of V. spiralis |
在任一基质下,牧食对苦草的总碳含量无显著影响(P>0.05)(图 2A).螺+泥组苦草叶片总氮含量显著低于泥组(P < 0.05),螺+泥沙组苦草叶片总氮含量显著低于泥沙组(P < 0.01),但螺+沙组与沙组苦草总氮含量无显著差异(图 2B).螺+泥组苦草叶片碳氮比显著高于泥组(P < 0.05),螺+泥沙组苦草叶片碳氮比显著高于泥沙组(P < 0.01),但螺+沙组和沙组苦草叶片碳氮比无显著差异(图 2C).而螺+泥组与泥组苦草叶片总酚含量无显著差异,螺+泥沙组与泥沙组苦草叶片总酚含量也无显著差异,但螺+沙组苦草叶片总酚含量显著低于沙组(P < 0.05)(图 2D).
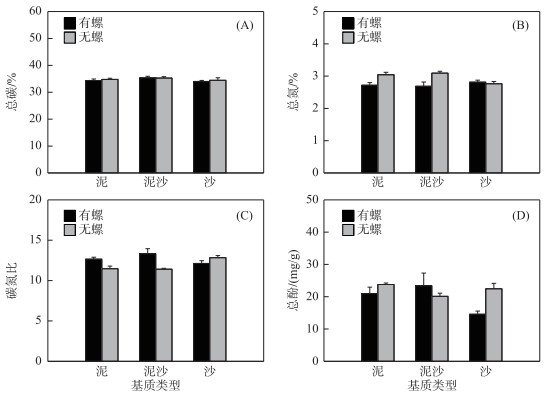
|
图 2 不同处理组苦草总碳含量、总氮含量、碳氮比和总酚含量的差异 Fig.2 Total carbon content, total nitrogen content, C/N ratio and total phenols content of V. spiralis in all treatments |
无论有无螺类牧食,沉积物类型对苦草叶片的总碳含量均无显著影响(P>0.05)(图 2A).有螺牧食时,沉积物类型对苦草叶片总氮含量无影响(P>0.05);无螺牧食时,泥沙基质苦草叶片的总氮含量显著高于沙基质(P < 0.05),沙基质与泥基质无显著差异(图 2B).有螺牧食时,沉积物类型对苦草叶片碳氮比无显著影响;无螺牧食时,沙基质苦草叶片碳氮比显著高于泥基质和泥沙基质(P < 0.05)(图 2C).有螺牧食时,泥沙基质苦草的叶片总酚含量显著高于沙组(P < 0.05);而无螺牧食时,3种基质下苦草叶片的总酚含量无显著差异(P>0.05)(图 2D).
2.3 对耳萝卜螺形态及碳氮含量的影响基质类型对耳萝卜螺的生长基本无影响(图 3).除了泥沙基质的耳萝卜螺壳宽显著小于沙基质(图 3B),各组耳萝卜螺的壳高、壳口高、壳口宽、体螺层长和干重都无显著差异(图 3).基质类型对耳萝卜螺的总碳含量、总氮含量和碳氮比均无显著影响(图 4).

|
图 3 基质类型对耳萝卜螺生长及形态的影响 Fig.3 Effects of sediment types on the growth and size of R. auricularia |
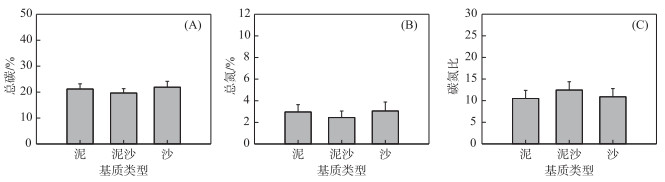
|
图 4 基质类型对耳萝卜螺元素含量的影响 Fig.4 Effects of sediment types on the element content of R. auricularia |
水生植物所吸收的营养物质主要来源于基质[33].有研究表明, 沉水植物伊乐藻(Elodea nuttallii)等一般分布在营养丰富的区域,而苦草则一般分布在营养相对贫瘠的区域[34-35],李宽意等[36]发现在无牧食损害时苦草在营养丰富(氮含量为1.49 mg/g)的基质中生长更好,何文凯等[37]认为中营养(氮含量为0.80 mg/g)的基质更适合苦草的生长.本研究结果发现,无牧食损害时苦草在中营养(氮含量为1.15 mg/g)的泥沙混合基质中生长更好(如相对生长率高、叶片数多、地上生物量更大),在高营养(氮含量为1.58 mg/g)的泥基质和低营养(氮含量为0.18 mg/g)的沙基质中生长的较慢(图 1),这与何文凯等[37]的研究结果一致.说明苦草更适于生长在中营养的基质,营养过于丰富和营养较差的基质皆不利于其生长.
萝卜螺可以牧食多种水生植物[38].本研究发现在泥沙基质和沙基质下,螺类的牧食能显著抑制沉水植物的生长,如苦草的相对生长率下降,地上生物量及总生物量显著减少等.这与Fang等[39]的结果一致:福寿螺可以大量牧食水生植物,显著抑制其生长.本研究表明螺的牧食并未对泥基质苦草的生长产生显著影响,且无螺牧食损害时泥基质苦草的总生物量是3种基质中最低的,而有螺牧食时泥基质苦草的总生物量却是3种基质中最高的,这可能是因为在遭到牧食损害时,泥基质的苦草有更充足的营养资源用于补偿生长以抵御牧食,也可能是由于基质类型和螺类牧食交互作用的结果.
朱文博[40]通过对不同底质下鄱阳湖典型沉水植被的生长研究发现,苦草对水体中营养盐的去除显著高于黑藻和马来眼子菜,并且这3种沉水植物对较高营养基质总氮的去除率均高于低营养的沙土.而本研究结果表明,无螺牧食时,较高营养的泥基质和泥沙基质下苦草叶片的总氮含量均显著高于沙基质,证明苦草在较高营养的泥基质和泥沙基质中吸附了更多的氮,这与朱文博的结果一致.
3.2 基质类型对螺类的影响Rosenblatt等[41]认为温度、CO2、食物营养及捕食者等等都能影响草食动物的生长.有研究表明海水中Pb、Cu和Zn的浓度与基质、螺类含量呈正相关,且基质中这些金属浓度与螺类含量呈正相关[42].本研究中3种基质的总碳和总氮含量存在显著差异,然而3种基质下螺的总碳和总氮含量均无显著差异.可能是因为实验周期较短,而耳萝卜螺的生长速度及化学物质的积累缓慢.
基质作为有根沉水植物的主要营养物质来源,能够影响沉水植物的营养,间接对草食动物产生影响. Dorgelo等[43]研究了食物碳氮比与螺(Potamopyrgus jenkinsi)生长速率之间的关系,发现P. jenkinsi的生长速率在碳氮比为15.90时达到最大值,且在较低的碳氮比范围内,随着碳氮比的小幅增加,螺的生长速率迅速增加.本研究中无牧食条件沙基质下苦草叶片的碳氮比(12.84)显著高于泥基质(11.47)和泥沙基质(11.41),然而3种基质下螺的形态生长并无显著差异.可能是因为食物碳氮比与螺生长速率之间的关系存在物种特异性.
3.3 基质类型对螺草关系的影响生物量的分配是植物应对不同环境压力的重要策略,植物可以通过改变对地上和地下部分生物量的分配来抵御牧食者的牧食压力,提高竞争力[44].本研究发现有螺牧食损害时,沙基质苦草的根冠比显著升高,但各处理组间的地下生物量却没有差异,说明苦草在螺类牧食压力下,没有改变生物量分配,但这可能是由于低营养基质下,苦草的营养物质含量较低造成的,而该研究中无螺类牧食时,沙基质的苦草叶片的氮含量较低,所以耳萝卜螺为了满足自身生长代谢的需求而摄食更多的苦草叶片.并且有研究证明,草食昆虫通过牧食和破坏植物能改变植物的营养含量及防御策略[45-46].结果表明在泥基质和泥沙基质下,螺的牧食均能使苦草叶片的氮含量显著减少,碳氮比显著升高,可能是因为苦草通过减少叶片氮含量降低适口性以抵御螺的牧食.但是在沙基质下,螺的牧食对苦草叶片氮含量并无显著影响.因为环境变量间可能存在交互作用,例如研究发现高CO2条件下,植物的碳水化合物会增加,但是当温度升高时这种现象就会消失[47].所以不同基质类型下牧食对叶片氮含量影响的不同也可能是由于基质类型和螺类牧食的交互作用造成的(表 4).
尽管植物氮含量被认为是一种重要的且能影响牧食的元素,但是其他营养物质含量及次生代谢产物也能影响牧食[48],而酚类就是植物增强主动防御的一种重要的次生代谢产物[49]. Choi等[50]在研究鳞翅目幼虫对高酚水生植物穗状狐尾藻(Myiophyllum spicatum)的牧食时,发现高浓度的酚类可以导致鳞翅目幼虫的生长发育变缓,从而减少牧食对狐尾藻生长的影响.研究表明,在无牧食条件下3种基质下苦草叶片的总酚含量并无显著差异,而螺的牧食对泥基质和泥沙基质下苦草叶片的总酚含量也无显著影响,但却使沙基质下苦草叶片的总酚含量显著下降.这可能与3种基质的可用性资源的丰富度有关,由表 1可以看出,沙基质的总碳和总氮含量仅分别为0.717 % ±0.044 %和0.018 % ±0.005 %,均显著低于泥基质和泥沙基质的总碳和总氮含量,并且多项研究表明,植物常会在生长和防御之间权衡,即植物增加对牧食的防御会导致其生长速率降低[51-55],而且在无牧食时3种基质下苦草的总生物量积累存在显著差异,存在牧食胁迫时3种基质下苦草的总生物量积累却没有显著差异,所以沙基质下苦草在可用性资源受限状态下遭到牧食损害后将更多的资源用于自身生长而减少了对化学防御物质——总酚合成的投资,而泥基质和泥沙基质的可用性资源资源较为丰富,在保证自身总酚含量不变的同时有充足的资源用于自身生长,故泥基质和泥沙基质下苦草在遭受牧食时叶片的总酚含量并未有显著变化.
4 结论1) 螺类牧食显著减少了泥沙和沙基质下苦草地上生物量、总生物量.无螺牧食条件下,基质类型对苦草的生长有显著影响.牧食和基质类型存在交互作用,对苦草的叶片数、地上生物量、根冠比、总生物量和相对生长率均有显著影响.
2) 有螺牧食损害时,沙基质下苦草叶片总酚含量显著少于泥沙基质.无螺牧食条件下,基质类型对苦草叶片总酚含量无显著影响,但牧食和基质类型存在交互作用,对苦草叶片总酚含量有显著影响.
3) 螺类牧食使泥和泥沙基质苦草叶片的碳氮比均显著升高,对沙基质没有显著影响;而无螺牧食条件下,泥和泥沙基质苦草叶片总氮含量均显著高于沙基质,沙基质苦草叶片的碳氮比显著高于泥和泥沙基质,但牧食和基质类型存在交互作用,对苦草叶片氮含量和碳氮比均有显著影响.
4) 基质类型对螺类的形态和生长并无显著影响(除壳宽外),对螺类的元素含量也无显著影响.由于本实验周期相对较短,除壳宽外,耳萝卜螺生长及元素特征均没有显著差异.但是,环境因子对牧食关系及牧食者和被牧食者的长期影响需要进一步系统深入地研究.
| [1] |
Fang YX, He CQ, Liang X et al. The purifying effect of polluted water by the aquatic plants. Journal of Hydroecology, 2010(3): 36-40. [方焰星, 何池全, 梁霞等. 水生植物对污染水体氮磷的净化效果研究. 水生态学杂志, 2010(3): 36-40.] |
| [2] |
Xing W, Liu H, Liu GH. Ecological stoichiometry in aquatic ecosystems:studies and applications. Plant Science Journal, 2015, 33: 608-619. [邢伟, 刘寒, 刘贵华. 生态化学计量学在水生态系统中的研究与应用. 植物科学学报, 2015, 33: 608-619. DOI:10.11913/PSJ.2095-0837.2015.50608] |
| [3] |
Zhang C, Lai SY, Gao XP et al. A review of the potential impacts of climate change on water environment in lakes and reservoirs. J Lake Sci, 2016, 28(4): 691-700. [张晨, 来世玉, 高学平等. 气候变化对湖库水环境的潜在影响研究进展. 湖泊科学, 2016, 28(4): 691-700. DOI:10.18307/2016.0401] |
| [4] |
Dong J, Gao YN, Li GB. A review:Responses of phytoplankton communities to eutrophication and climate warning in freshwater lakes. Acta Hydrobiologica Sinica, 2016, 40: 615-623. [董静, 高云霓, 李根保. 淡水湖泊浮游藻类对富营养化和气候变暖的响应. 水生生物学报, 2016, 40: 615-623. DOI:10.7541/2016.83] |
| [5] |
Li GB, Li L, Pan M et al. The degradation cause and pattern characteristics of Lake Dianchi ecosystem and new restoration strategy of ecoregion and step-by-step implementation. J Lake Sci, 2014, 26(4): 485-496. [李根保, 李林, 潘珉等. 滇池生态系统退化成因、格局特征与分区分步恢复策略. 湖泊科学, 2014, 26(4): 485-496. DOI:10.18307/2014.0401] |
| [6] |
Chen KN, Li WC, Wu QL et al. Impacts of cycanobacteria on the growth of submerged macrophytes, Dianchi Lake. J Lake Sci, 2003, 15(4): 364-368. [陈开宁, 李文朝, 吴庆龙等. 滇池蓝藻对沉水植物生长的影响. 湖泊科学, 2003, 15(4): 364-368. DOI:10.18307/2003.0411] |
| [7] |
He H, He YH, Ji YC et al. Effects of cyanobacterial accumulation and snail grazing on the growth of Vallisneria natans. Acta Ecologica Sinica, 2012, 32: 5562-5567. [何虎, 何宇虹, 姬娅婵等. 蓝藻堆积和螺类牧食对苦草生长的影响. 生态学报, 2012, 32: 5562-5567.] |
| [8] |
Li KY, Liu ZW, Li CH et al. The herbivory effects of snail Radix swinhoei on submerged plant community. Oceanologia et Limnologia Sinica, 2007, 38: 576-580. [李宽意, 刘正文, 李传红等. 螺类牧食损害对沉水植物群落结构的调节. 海洋与湖沼, 2007, 38: 576-580. DOI:10.3321/j.issn:0029-814x.2007.06.014] |
| [9] |
Yan ZH. Ecological study of Radix auricularia with Ceratophyllum demersum, Potamogeton crispus in the Baiyangdian Lake[Dissertation]. Baoding: Hebei university, 2009. [闫智恒.白洋淀耳萝卜螺与沉水植物金鱼藻和菹草的生态关系研究[学位论文].保定: 河北大学, 2009. ]
|
| [10] |
Lemoine NP, Burkepile DE, Parker JD. Variable effects of temperature on insect herbivory. Peerj, 2014, 2: e376. DOI:10.7717/peerj.376 |
| [11] |
Jamieson MA, Trowbridge AM, Raffa KF et al. Consequences of climate warming and altered precipitation patterns for plant-insect and multitrophic interactions. Plant Physiology, 2012, 160: 1719-1727. DOI:10.1104/pp.112.206524 |
| [12] |
Stiling P, Cornelissen T. How does elevated carbon dioxide (CO2) affect plant-herbivore interactions? A field experiment and meta-analysis of CO2-mediated changes on plant chemistry and herbivore performance. Glob Change Biology, 2007, 13: 1823-1842. DOI:10.1111/gcb.2007.13.issue-9 |
| [13] |
Robinson EA, Ryan GD, Newman JA. A meta-analytical review of the effects of elevated CO2 on plant-arthropod interactions highlights the importance of interacting environmental and biological variables. New Phytologist, 2012, 194: 321-336. DOI:10.1111/j.1469-8137.2012.04074.x |
| [14] |
Barko JW, Gunnison D, Carpenter SR. Sediment interactions with submerged macrophyte growth and community dynamics. Aquatic Botany, 1991, 41: 41-65. DOI:10.1016/0304-3770(91)90038-7 |
| [15] |
Carignan R, Kalff J. Phosphorus sources for aquatic weeds: water or sediments? Science, 1980, 207: 987-989.
|
| [16] |
Barko JW, Smart RM. Sediment-related mechanisms of growth limitation in submersed macrophytes. Ecology, 1986, 67: 1328-1340. DOI:10.2307/1938689 |
| [17] |
Lei ZX, Xie YF, Liu ZW. Effects of different sediments from Meiliang Bay of Taihu Lake on the growth of three submersed aquatic macrophytes. Journal of Central China Normal University:Nat Sci, 2006, 40: 260-264. [雷泽湘, 谢贻发, 刘正文. 太湖梅梁湾不同沉积物对3种沉水植物生长的影响. 华中师范大学学报:自然科学版, 2006, 40: 260-264.] |
| [18] |
Ye C, Yu HC, Song XF et al. Influence of sediment condition on growth and community structure of submerged plants. Research of Environmental Sciences, 2008, 21: 178-183. [叶春, 于海婵, 宋祥甫等. 底泥对沉水植物生长和群落结构的影响. 环境科学研究, 2008, 21: 178-183.] |
| [19] |
Yang ZW, Zheng YY, Li ZL et al. Tested on the growth and survival of Babylonia areolata culturing in cement pond different substrate. Journal of Fujian Fisheries, 2011, 33: 29-32. [杨章武, 郑雅友, 李正良等. 方斑东风螺水泥池养殖不同底质的生长与存活试验. 福建水产, 2011, 33: 29-32. DOI:10.3969/j.issn.1006-5601.2011.02.006] |
| [20] |
Lamberti GA, Moore JW. Aquatic insects as primary consumers. In: Resh HV, Rosenberg DM eds. The ecology of aquatic insects. New York: Praeger Scientific, 1984: 164-195.
|
| [21] |
Cao Y, Li W, Jeppesen E. The response of two submerged macrophytes and periphyton to elevated temperatures in the presence and absence of snails:a microcosm approach. Hydrobiologia, 2014, 738: 49-59. DOI:10.1007/s10750-014-1914-5 |
| [22] |
Underwood GJC, Thomas JD, Baker JH. An experimental investigation of interactions in snail-macrophyte-epiphyte systems. Oecologia, 1992, 91: 587-595. DOI:10.1007/BF00650335 |
| [23] |
Xiong W, Yu D, Wang Q et al. A snail prefers native over exotic freshwater plants:implications for the enemy release hypotheses. Freshwater Biology, 2008, 53: 2256-2263. |
| [24] |
Li KY, Liu ZW, Gu BH. Density-dependent effects of snail grazing on the growth of a submerged macrophyte, Vallisneria spiralis. Ecological Complexity, 2009, 6: 438-442. DOI:10.1016/j.ecocom.2009.08.001 |
| [25] |
Schoonhoven LM, van Loon JJA, Dicke M. Insect-plant biology:from physiology to evolution. New York: Oxford University Press, 2005.
|
| [26] |
Ginocchio R, Montenegro G. Effects of insect herbivory on plant architecture. In: Ariatnoutsou M, Specht RL eds. Plant-animal interactions in Mediterranean type ecosystems. Dordrecht: Kluwer Academic Publishers, 1994: 115-122.
|
| [27] |
Huang W, Siemann E, Xiao L et al. Species-specific defence responses facilitate conspecifics and inhibit heterospecifics in above-root herbivore interactions. Nature Communications, 2011, 5: 4851-4851. |
| [28] |
Agrawal AA, Weber MG. On the study of plantdefence and herbivory using comparative approaches:how important are secondary plant compounds. Ecology Letters, 2015, 18: 985-991. DOI:10.1111/ele.12482 |
| [29] |
Johnson SN, Hawes C, Karley AJ. Reappraising the role of plant nutrients as mediators of interactions between root-and foliar-feeding insects. Functional Ecology, 2009, 23: 699-706. DOI:10.1111/fec.2009.23.issue-4 |
| [30] |
Lodge DM. Herbivory on freshwater macrophytes. Aquatic Botany, 1991, 41: 195-224. DOI:10.1016/0304-3770(91)90044-6 |
| [31] |
Box JD. Investigation of the Folon-Ciocalteau phenol reagent for the determination of polyphenolic substances in natural waters. Water Research, 1983, 17: 511-525. DOI:10.1016/0043-1354(83)90111-2 |
| [32] |
Pella E, Colombo B. Study of carbon, hydrogen and nitrogen determination by combustion-gas chromatography. Mikrochimica Acta, 1973, 61: 697-719. DOI:10.1007/BF01218130 |
| [33] |
Gross EM, Lombardo P. Limited effect of gizzard sand and consumption of the macrophyte Myriophyllum spicatum by the great pond snail Lymnaea stagnalis. Hydrobiologia, 2016, 812: 131-145. |
| [34] |
Hutchinson GE. A treatise on limnology. Vol. Ⅲ. Limnological botany. New York: John Wiley & Sons, 1975: 660.
|
| [35] |
Gaudet CL, Keddy PA. Competitive performance and species distribution in shortline plant communities:A comparative approach. Ecology, 1995, 76: 280-289. DOI:10.2307/1940649 |
| [36] |
Li KY, Liu ZW, Yang HW et al. Effects snail herbivory and sediment type on the growth of Vallisneria spiralis. Acta Ecologica Sinica, 2007, 27: 4907-4912. [李宽意, 刘正文, 杨宏伟等. 螺类牧食与沉积物类型对苦草生长的影响. 生态学报, 2007, 27: 4907-4912. DOI:10.3321/j.issn:1000-0933.2007.11.062] |
| [37] |
He WK, Cao T, Ni LY et al. Growth of seven submerged macrophytes cultured on five sediment mixtures from the lake Erhai. Acta Hydrobiologica Sinica, 2017, 41: 428-436. [何文凯, 曹特, 倪乐意等. 洱海底泥特性对七种沉水植物生长的影响. 水生生物学报, 2017, 41: 428-436. DOI:10.7541/2017.53] |
| [38] |
Li KY, Liu ZW, Hu YH et al. Snail Radix swinhoei (H. Adams) herbivory on three submerged plants. Acta Ecologica Sinica, 2006, 26: 3221-3224. [李宽意, 刘正文, 胡耀辉等. 椭圆萝卜螺Radix swinhoei (H. Adams)对三种沉水植物的牧食选择. 生态学报, 2006, 26: 3221-3224. DOI:10.3321/j.issn:1000-0933.2006.10.008] |
| [39] |
Fang L, Wong PK, Lin L et al. Impact of invasive apple snails in HongKong on wetland macrophytes nutrients phytoplankton and filamentous algae. Freshwater Biology, 2010, 55: 1191-1204. DOI:10.1111/j.1365-2427.2009.02343.x |
| [40] |
Zhu WB. The growth of experiment of main submergedmacrophytes on sediments in Poyang Lake[Dissertation]. Nanchang: Nanchang Institute of Technology, 2018. [朱文博.不同底质下鄱阳湖典型沉水植被的生长研究[学位论文].南昌: 南昌工程学院, 2018. ]
|
| [41] |
Rosenblatt AE, Schmitz OJ. Climate change, nutrition, and bottom-up and top-down food web processes. Trends in Ecology & Evolution, 2016, 31: 965-975. |
| [42] |
Amin B, Nurrachmi I, Kennedy L. Concentration and distribution of heavy metals Pb, Cu and Zn in seawater, sediment and snail Telescopium telescopium around shipyards in Batam. International Seminar of Fisheries & Marine (2ndISFM 2013), Indonesia. ISFM, Pekanbaru: Universitas Riau, 2016: 76-84.
|
| [43] |
Dorgelo J, Leonards PEG. Relationship between C/N ratio of food types and growth rate in the snail Potamopyrgus jenkinsi (E. A. Smith). Journal of the North American Benthological, 2001, 20: 60-67. DOI:10.2307/1468188 |
| [44] |
Baldwin IT. Herbivory simulations in ecological research. Trends in Ecology & Evolution, 1990, 5: 91-93. |
| [45] |
Karban R, Myers JH. Induced plant responses to herbivory. Annual Review of Ecology and Systematics, 1989, 20: 331-348. DOI:10.1146/annurev.es.20.110189.001555 |
| [46] |
Nykänen H, Koricheva J. Damage-induced changes in woody plants and their effects on insect herbivore performance:A meta-analysis. Oikos, 2004, 104: 247-268. DOI:10.1111/oik.2004.104.issue-2 |
| [47] |
Zvereva EL, Kozlov MV. Consequences of simultaneous elevation of carbon dioxide and temperature for plant-herbivore interactions:a meta analysis. Glob Chang Biology, 2006, 12: 27-41. DOI:10.1111/gcb.2006.12.issue-1 |
| [48] |
Bakker ES, Wood KA, Pagès JF et al. Herbivory on freshwater and marine macrophytes:A review and perspective. Aquatic Botany, 2016, 135: 18-36. DOI:10.1016/j.aquabot.2016.04.008 |
| [49] |
Zhang SF, Zhang Z, Wang HB et al. New discovery about plant defense:plant-plant communication. Acta Ecologica Sinica, 2012, 36: 1120-1124. [张苏芳, 张真, 王鸿斌等. 植物防御的新发现:植物-植物相互交流. 生态学报, 2012, 36: 1120-1124.] |
| [50] |
Choi C, Bareiss C, Walenciak O et al. Impact of polyphenols on growth of the aquatic herbivore Acentria ephemerella. Journal of Chemical Ecology, 2002, 28: 2245-2256. DOI:10.1023/A:1021049332410 |
| [51] |
Wang Y, Huang W, Siemann E et al. Lower resistance and higher tolerance of invasive host plants:biocontrol agents reach high densities but exert weak control. Ecological Applications, 2011, 21: 729-738. DOI:10.1890/09-2406.1 |
| [52] |
Strauss SY, Rudgers JA, Lau JA et al. Direct and ecological costs of resistance to herbivory. Trends in Ecology & Evolution, 2002, 17: 278-285. |
| [53] |
Guo SM, Li JM, Li YH et al. The trade-off between growth and defense in Alternanthera philoxeroides parasitized by Cuscuta australis. Acta Ecologica Sinica, 2014, 34: 4866-4873. [郭素民, 李钧敏, 李永慧等. 空心莲子草响应南方菟丝子寄生的生长-防御权衡. 生态学报, 2014, 34: 4866-4873.] |
| [54] |
Fineblum WL, Rausher MD. Tradeoff between resistance and tolerance to herbivory damage in morning glory. Nature, 1995, 377: 517-520. DOI:10.1038/377517a0 |
| [55] |
Leimu R, Koricheva J, Larsson S. A meta-analysis of tradeoffs between plant tolerance and resistance to herbivores:combining the evidence from ecological and agricultural studies. Oikos, 2006, 112: 1-9. DOI:10.1111/oik.2006.112.issue-1 |
 2019, Vol. 31
2019, Vol. 31 

