(2: 中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012)
(3: 中国环境科学研究院, 国家环境保护湖泊污染控制重点实验室, 湖泊生态环境创新基地, 北京 100012)
(2: State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, P. R. China)
(3: State Environmental Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-environment, Chinese Research Academy of Environmental Sciences, Beijing 100012, P. R. China)
北京翠湖属于典型城市浅水湖泊,其国家湿地公园及华北湿地近年频繁暴发血红裸藻(Euglena sanguinea)水华.血红裸藻为静水水体中的常见水华种,运动能力很强,水华形成会迅速覆盖整个水面形成水膜,随着光强的变化形成浅黄绿色或铁锈红水华,常称为“朝红夕绿”、“晴红阴绿”[1],影响水体水质景观,给人类健康和周边自然环境带来危害.
目前国内外对于藻类水华的研究多集中于蓝藻、绿藻和硅藻等常见水华种类[2-4],而对于裸藻水华的关注和研究相对较少.研究表明,藻类群落结构及其动态分布是多重环境因素在时间和空间序列上变化的结果.光照、水温和营养盐是影响藻类生长过程的关键因素[5-6],其中氮、磷营养盐浓度与浮游植物种群结构和生物量密切相关[7].不同水层的光照强度差异可直接或间接地影响浮游植物细胞密度、种群结构和空间分布[8].目前关于血红裸藻水华发生发展机理的研究鲜见,赵欣胜等[9]发现血红裸藻繁殖受总磷浓度影响显著,与总氮浓度关系不显著,与水温和光照强度也存在一定的相关性.但对血红裸藻衰亡过程的研究较少.通常,藻类水华消退过程对水质的危害强于水华形成期[10-11],因此血红裸藻的生态学特征及其与衰亡机理的相关研究对水质保护具有重要意义.
本研究以北京翠湖国家湿地公园血红裸藻水华为研究对象,于2016年8月底—11月底从水华稳定期到衰亡期对湿地水质和藻密度进行定期监测,分析了血红裸藻形态、群落密度及其与环境因子的相关关系,探讨血红裸藻衰亡过程与环境因子的相关关系及主控因子,为翠湖国家湿地公园和存在相似问题水体的水质保护和裸藻水华控制研究提供科学依据.
1 材料与方法 1.1 研究区域概况北京翠湖国家城市湿地公园(40°5′47.41″~40°5′51.16″N, 116°10′34.30″~116°10′41.43″E; 海拔55.0 m)位于北京市海淀区上庄镇上庄水库北侧,是距离北京市中心最近的、唯一的国家级城市湿地公园.翠湖湿地紧邻上庄水库,水域面积近700 hm2,平均水深1.5 m,湿地水流速度偏低,且局部存在缓流区,流速小于0.05 m/s,水源主要来自天然降水和人工引自上庄水库.
1.2 样品采集本研究根据湖体形态特征及藻类水华分布现状选取代表性点位于2016年8—11月早(8:00—9:00)、中(13:00—14:00)、晚(光照强度为0时),分表、中、底3层进行采样.水样用于分析血红裸藻衰亡过程随环境因子的变化规律.
1.3 理化指标测定现场测定水温、pH、溶解氧(DO)浓度、透明度(SD)和光照强度(WI),水温、pH和DO浓度采用YSI 6400水质仪测定,SD采用透明度盘测定,光照强度采用ZDS-10W水下照度计测定.水样采集后于4℃保温箱保存,在24 h内测定浊度(NTU)、总氮(TN)、溶解性总氮(DTN)、溶解性总磷(DTP)、硝态氮(NO3--N)、铵态氮(NH4+-N)、亚硝态氮(NO2--N)等化学指标[12].
1.4 藻类鉴定及优势种分析藻类定量样品的采集参照文献[12]的方法.采集1 L水样,加入10 % (体积比)鲁哥氏液固定,静置48 h,浓缩至30 ml后计数.藻密度计算公式为:
| $ c = ({V_{\rm{c}}} \cdot n)/(V \cdot {V_{\rm{a}}}) $ |
式中,c为藻密度(cells/L);Vc为浓缩后体积(L);Va为计数体积(L);V为采样体积(L);n为计数板中的藻个数.
藻类形态样品:采集表层藻类富集水样,24 h内送至实验室镜检(显微镜Olympus BX53,40×10倍视野),观察并记录裸藻的形态变化.
以优势度表示水体中藻类的优势种群[13],其计算公式为:
| $ Y = {f_i} \cdot {p_i} $ | (2) |
式中, fi为第i种浮游植物出现的频率,pi为第i种浮游植物数量占浮游植物总数量的比例.当Y≥0.02时,该种群即为优势种群[13].
1.5 分析方法图表绘制在Origin 9.0软件中进行.冗余分析(RDA)和去趋势对应分析(DCA)均使用通用软件Canoco 4.5,生成的数据文件应用CanoDraw 4.1软件作图[14]. Pearson系数相关性检验采用SPSS 19.0统计软件完成.
2 结果与分析 2.1 血红裸藻衰亡过程的结构与形态变化优势度计算结果表明,研究期间血红裸藻具有相对较高的优势度(表 1),为翠湖藻类水华的主要优势种,且统计结果表明其出现频率最高,这与赵欣胜等[9]的研究结果相一致.部分绿球藻和鱼形裸藻优势度仅次于血红裸藻,为血红裸藻类型水华的主要伴生种.
| 表 1 主要藻种优势度 Tab.1 The dominance of main algae |
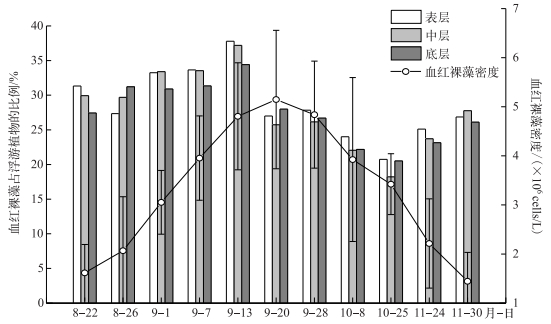
研究期间,血红裸藻密度变化呈现先增加后减小的趋势(图 1). 8月下旬到9月中旬血红裸藻密度稳定增加(稳定期);9月20日血红裸藻密度达到峰值,为5.13×106 cells/L;9月下旬至11月底(衰亡期),藻密度明显下降,11月30日藻密度最低,为1.38×106 cells/L.
|
图 1 不同水层血红裸藻密度及其占浮游植物总量的比例变化 Fig.1 Density of Euglena sanguinea in different water layers and their ratios to phytoplankton |
血红裸藻占浮游植物总量比例总体呈现表层>中层>底层的趋势(图 1),表明虽然翠湖水深平均仅有1.5 m,但血红裸藻占比在垂直分布上依然存在细微差异.血红裸藻占比的整体变化趋势大致呈现先增加后减小再略增加的趋势.其中9月13日达到最高值,为37 %,10月25日达到最低值,为19 %.表明稳定初期血红裸藻的优势较明显;衰亡初期,其占比逐渐减小;衰亡后期,由于浮游植物总量下降速率高于血红裸藻,后者占比不降反升.
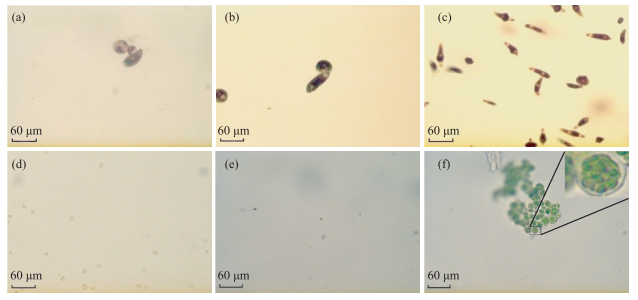
2.1.2 血红裸藻的形态变化血红裸藻衰亡过程形态特征变化明显(图 2a~e).稳定增长过程(8月)中,血红裸藻个体较大,最长可达60 μm,多成团聚集,细胞呈红色;稳定过程(9月)中,藻形态由椭圆形变成纺锤形,藻细胞长度保持不变(45~55 μm),但宽度逐渐变窄至约5 μm,藻细胞体积逐渐变小,细胞呈棕红色;衰亡初期(10月中下旬),细胞体积明显变小,多呈绿色球形,颜色明显变淡;衰亡末期(11月底),细胞体积继续变小,最小长度约3~5 μm,细胞颜色接近无色;其与室内培养的衰亡期血红裸藻(图 2f)细胞形状、大小、颜色相似.
|
图 2 血红裸藻形态变化镜检图(a:8月下旬藻样,b:9月上旬藻样,c:9月中下旬藻样,d:10月下旬藻样,e:11月下旬藻样,f:血红裸藻休眠孢子) Fig.2 Morphological changes of Euglena sanguinea (a: Late August algae, b: Early September algae, c: Mid-September algae, d: Late October algae, e: Late November algae, f: Euglena sanguine dormant spores) |
水体中浮游植物的衰亡主要受到相关物理、化学等环境因子的影响[10].本研究对引起裸藻水华的优势种血红裸藻、裸藻门与12种理化因子进行DCA和RDA梯度分析. DCA分析结果表明,各采样点表、中、底3层多度矩阵第1排序轴的梯度值均小于3,因此物种数据选用线性模型的RDA分析[14].
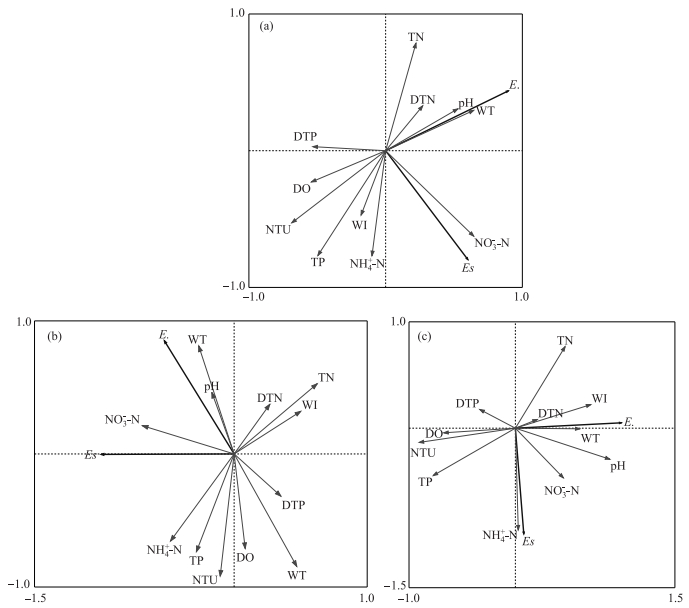
对翠湖水体不同水层血红裸藻与各项环境因子进行RDA分析(图 3).结果表明,在血红裸藻的衰亡过程中,表、中、底3层水体血红裸藻密度整体上受到水温、NH4+-N浓度、TN浓度和TP浓度的影响较大,其中NH4+-N浓度影响最为显著.表层水体血红裸藻密度与WI存在一定的正相关性,中、底层血红裸藻密度与WI呈一定负相关.
|
图 3 翠湖表层(a)、中层(b)和底层(c)水体血红裸藻与环境因子RDA分析结果 (E.:祼藻门藻密度;Es:血红裸藻密度) Fig.3 RDA analysis between Euglena sanguinea in surface water(a), middle water(b), bottom water(c) and environmental factors in Lake Cuihu(E.:Euglenophyta density, Es:Euglena sanguine density) |
应用Pearson相关性分析进一步研究翠湖优势藻种血红裸藻与环境因子间的关系(表 2),结果显示,水温、pH、NH4+-N浓度和TN浓度是影响血红裸藻密度变化的主要环境因子,与RDA分析结果相一致.
| 表 2 血红裸藻、祼藻门密度与环境因子的相关系数 Tab.2 The correlation coefficient between Euglena sanguinea density, Euglenophyta density and environmental factors |
分析结果显示,衰亡过程中血红裸藻密度与水温呈正相关(R2=0.286, P < 0.05),与其他水华藻类研究结果相一致[15-16].血红裸藻密度与NH4+-N浓度、NO3--N浓度均呈显著正相关(R2=0.577, P < 0.01;R2=0.359, P < 0.01),与TN浓度呈显著负相关(R2=0.439, P < 0.01),表明血红裸藻衰亡过程中TN浓度增加.血红裸藻密度与pH和TP浓度也均存在一定的正相关性(R2=0.272, P < 0.05;R2=0.229, P < 0.05),表明血红裸藻的衰亡影响水体pH,且该过程TP浓度降低.
3 讨论 3.1 血红裸藻衰亡过程中形态变化研究表明,藻类在适应环境的过程中会发生形态的变化,如在氮饥饿条件下,蓝藻藻丝体分化出异形胞[17-18],另一些蓝藻的营养藻丝体会分化出藻殖段,当细胞分裂多次环境适宜时又重新长出营养藻丝体[19-20];杨州等[21]发现环境因素会影响铜绿微囊藻(Microcystis aeruginosa)的群体形成;Kohata等[22]证实藻细胞色素的变化也是反映其生理状态的重要指标.本研究发现血红裸藻在生长过程中生态学特征也发生了系列变化,主要分为2个时期:稳定期,血红裸藻细胞个体较大呈红色,细胞长度稳定,宽度减小,运动速率较快;衰亡期,细胞体积明显变小颜色变浅,多呈绿色球形,运动迟缓.表明在衰亡过程中,血红裸藻不断变化形态以适应环境因子的改变.不同的细胞形态反映了其对环境条件的适宜程度.较适宜环境条件下,血红裸藻细胞颜色深红、体积较大,且运动活跃;温度过高运动相对迟缓;温度过低且营养盐贫乏时,血红裸藻细胞颜色淡不可见、体积变小且几乎不运动,形成具有透明胶被的孢子,沉入水底休眠,至来年环境条件适宜时萌发,这与谢小萍等[23]对蓝藻休眠进程研究的细胞形态变化结果相似.
3.2 血红裸藻衰亡过程与水体物理指标的关系一般认为[16],不同深度的水层因接受的光照强度存在差异,表层水体光照强度高于中层和底层,导致浮游植物在同一水体中存在垂直分层现象.有研究表明[1],裸藻运动能力非常强,光照充足时往往占据了水体的表层和次表层,致使其他藻类很难在水体表层进行光合作用,而造成血红裸藻大量增长形成红褐色裸藻水华[24].受光照强度的影响,不同水层血红裸藻分布存在一定差异,血红裸藻在浮游植物总量中的占比多呈表层>中层>底层的趋势.由于翠湖水深不足1.5 m,不同深度水体各环境因子特别是营养盐浓度差异较小,因此翠湖血红裸藻的分层现象主要受光照强度影响[25].
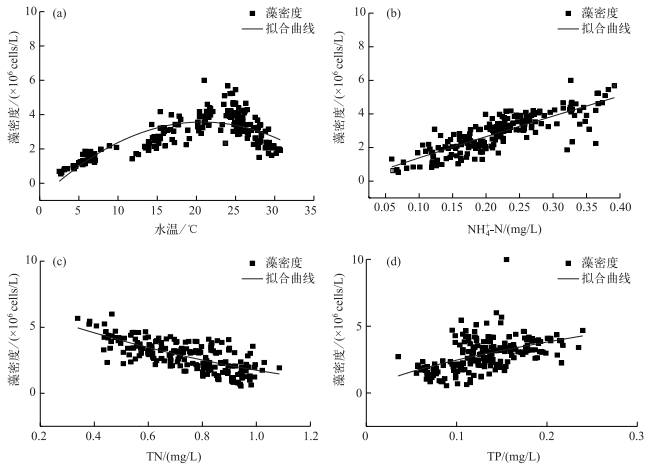
水温对藻类生长速率和生物量的影响显著[25],尤其是气温变化引起的水温变化,对藻类生长具有周期性影响[26],它可以通过控制浮游植物的光合作用和呼吸代谢速率影响藻类生物量[27]. RDA结果和Pearson相关性分析结果显示,水温与排序轴相关性极高,血红裸藻密度与水温呈显著正相关(P < 0.05),是影响裸藻水华衰亡期裸藻种群变化的主要环境因子.有研究表明,适合裸藻生存的温度范围较广,在20~35℃之间都可以形成水华,春夏之交和夏秋之交时节尤易产生[1].研究期间,血红裸藻密度在某一温度范围随WT升高明显增加,超过某一温度范围随WT升高呈现下降趋势,血红裸藻密度(CD)与水温存在明显的二次函数关系(图 4a),二者的回归方程为:
| $ CD = - \left( {0.01014{x^2} + 0.43121x - 0.90098} \right) \times {10^6}({R^2} = 0.6050,P < 0.01) $ | (3) |
|
图 4 血红裸藻与主要环境因子的拟合曲线 Fig.4 Fitting curves of Euglena sanguine density and main environmental factors |
WT在20~27℃时,血红裸藻密度可高于4×106 cells/L,且在23~27℃时出现频次最高,表明血红裸藻生长的水温阈值范围为23~27℃;WT低于23℃时血红裸藻逐渐衰亡.
研究表明,血红裸藻所形成的红褐色水华适合在中性或弱酸弱碱性的水体中生长(pH=6.5~8.5)[28],pH的波动能够影响藻类的种群结构[29].本研究发现,适宜血红裸藻生长的pH阈值范围是7.3~8.0,该区间内血红裸藻生物量较高.衰亡过程中,血红裸藻密度与pH呈显著正相关关系(R2=0.272, P < 0.05).这可能与翠湖水体水温降低且浮游植物生物量下降过程中,水中CO2溶解性增加而藻类光合作用对水体中CO2的消耗减弱,造成水体pH上升有关[30].
3.3 血红裸藻衰亡过程与营养盐关系营养盐是藻类生长的重要影响因素[27].本研究中,血红裸藻密度与NH4+-N浓度呈显著正相关(R2=0.577,n=198,P < 0.01),血红裸藻密度与NH4+-N浓度拟合为幂函数时(图 4b),拟合度最高,二者的回归方程为:
| $ CD = 1.1949 \times {10^7}{x^{0.9360}}({R^2} = 0.6974,P < 0.01) $ | (4) |
血红裸藻的衰亡过程中,随着NH4+-N浓度的下降血红裸藻密度逐渐降低,表明水体中的NH4+-N是血红裸藻生长繁殖的重要条件[31],浓度过低促进血红裸藻的衰亡,这与周涛等[32]在讨论蓝藻水华微囊藻与氮营养盐相关关系的结论一致.
TN浓度对于血红裸藻的影响较大,且呈显著负相关(R2=0.439,P < 0.01),Wu等[33]在德国Kielstau江流域的研究也发现,裸藻对氮浓度的变化反应敏感.血红裸藻密度(CD)与TN浓度拟合为二次函数时(图 4c),拟合度最高,二者的回归方程为:
| $ CD = \left( {2.1233{x^2} - 7.6923x + 7.3155} \right) \times {10^6}({R^2} = 0.4940,P < 0.01) $ | (5) |
由拟合曲线知,在血红裸藻的衰亡过程中,TN浓度逐渐增加.在稳定期血红裸藻密度大TN浓度最低,衰亡末期TN浓度最高.研究表明,藻类衰亡过程中细胞破裂会向水体释放大量的有机氮,致使TN浓度增加,血红裸藻衰亡末期TN浓度最高,这与李柯等[34]对蓝藻的研究结果相一致.
RDA分析结果显示,TP浓度与排序轴的相关性较大,是影响血红裸藻密度的又一重要因素. Pearson线性分析结果表明,血红裸藻密度与TP浓度存在一定的相关性,但其影响程度明显小于其他主要环境因子,这与赵欣胜等[9]的研究结果存在一定的差异,二者拟合为幂函数时(图 4d),拟合度最高,其回归方程为:
| $ CD = 1.0521 \times {10^7}{x^{0.6307}}({R^2} = 0.2378) $ | (6) |
拟合曲线趋势显示,在血红裸藻衰亡过程中,TP浓度逐渐减小.磷作为藻类生长过程中重要营养成分[35],其浓度的降低可能是血红裸藻衰亡的诱因之一.
4 结论北京翠湖国家湿地公园血红裸藻水华消退过程中,血红裸藻生态特征发生明显变化,形状由细长变圆球,体积由大变小,颜色由深变浅,运动速率由快变慢,最终形成具透明胶被孢子的休眠体.受光照强度影响,血红裸藻多在水体表层富集,中、底层藻密度分层现象不明显.血红裸藻的衰亡与水温、pH密切相关,其适宜水温范围为23~27℃,当水温低于23℃时血红裸藻进入衰亡期;偏碱性的水体环境有利于血红裸藻的生长繁殖;NH4+-N浓度降低对血红裸藻衰亡造成一定影响;其衰亡过程受TN浓度影响较大,受TP浓度影响相对较小.
| [1] |
Liu GX. Characteristics, hazards and control of Euglena bloom in aquaculture ponds. Chinese Aquatic Products, 2009(2): 59-60. [刘国祥. 水产养殖池塘裸藻水华的特点、危害和调控. 中国水产, 2009(2): 59-60.] |
| [2] |
Havens KE, James RT, East TL et al. N:P ratios, light limitation, and cyanobacterial dominance in a subtropical lake impacted by non-point source nutrient pollution. Environmental Pollution, 2003, 122(3): 379-390. DOI:10.1016/S0269-7491(02)00304-4 |
| [3] |
de Lange WJ, Botha AM, Oberholster PJ. Towards tradable permits for filamentous green algae pollution. Journal of Environmental Management, 2016, 179: 21. |
| [4] |
Zhu GW, Jin YW, Ren J et al. Characteristics of diatom blooms in a reservoir-water supply area and the countermeasures in Taihu Basin, China. J Lake Sci, 2016, 28(1): 9-21. [朱广伟, 金颖薇, 任杰等. 太湖流域水库型水源地硅藻水华发生特征及对策分析. 湖泊科学, 2016, 28(1): 9-21. DOI:10.18307/2016.0102] |
| [5] |
Schindler DW, Hecky RE, Findlay DL et al. Eutrophication of lakes cannot be controlled by reducing nitrogen in-put:Results of a 37-year whole-ecosystem experiment. PNAS, 2008, 105(32): 11254-11258. DOI:10.1073/pnas.0805108105 |
| [6] |
Paerl HW, Hall NS, Calandrino. Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Science of the Total Environment, 2011, 409(10): 1739-1745. DOI:10.1016/j.scitotenv.2011.02.001 |
| [7] |
Ransom HD, Sunda WG, Wayne LR et al. Nitrogen limitation in-creases brevetoxins in Karenia brevis (Dinophyceae):Implications for bloom toxicity. Journal of Phycology, 2012, 48(4): 844-858. DOI:10.1111/jpy.2012.48.issue-4 |
| [8] |
Wu TF, Zhu GW, Qin BQ et al. Prior wind field induced hydrodynamics and its influence on cyanobacterial bloom in northern bays of Lake Taihu, China. J Lake Sci, 2012, 24(3): 409-415. [吴挺峰, 朱广伟, 秦伯强等. 前期风场控制的太湖北部湖湾水动力及对蓝藻水华影响. 湖泊科学, 2012, 24(3): 409-415. DOI:10.18307/2012.0312] |
| [9] |
Zhao XS, Cui LJ, Li W et al. The environmental conditions of the occurrence of Euglena sanguinea bloom in the Cuihu Lake of Beijing. Journal of Water Ecology, 2015, 36(2): 11-17. [赵欣胜, 崔丽娟, 李伟等. 北京翠湖湿地血红裸藻水华发生的环境条件. 水生态学杂志, 2015, 36(2): 11-17.] |
| [10] |
Sun XJ, Qin BQ, Zhu GW. Release of colloidal phosphorus, nitrogen and organic carbon in the course of dying and decomposing of cyanobacteria. China Environmental Science, 2007, 27(3): 341-345. [孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放. 中国环境科学, 2007, 27(3): 341-345.] |
| [11] |
Shen AC, Xu ZA, Wu DH. Relationships between accumulation and dying of cyanobacteria and black spot. Journal of Water Ecology, 2012, 33(3): 68-72. [沈爱春, 徐兆安, 吴东浩. 蓝藻大量堆积、死亡与黑水团形成的关系. 水生态学杂志, 2012, 33(3): 68-72.] |
| [12] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods eds. Water and Wastewater Monitoring and Analysis Methods: 4th edition. Beijing: China Environmental Science Press, 2002: 11. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 11. ]
|
| [13] |
Sugiyama Y, Anegawa A, Kumagai T et al. Distribution of dissolved organic carbon in lakes of different trophic types. Limnology, 2004, 5(3): 165-176. DOI:10.1007/s10201-004-0128-3 |
| [14] |
Braak CJFT, Smilauer P. CANOCO Reference Manual and User's Guide to Canoco for Windows:Software for Canonical Community Ordination (Version 4.5). Ithaca, NY, USA: Microcomputer Power Press, 2002.
|
| [15] |
Liu X, Lu X, Chen Y. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China:An 11-year investigation. Harmful Algae, 2011, 10(3): 337-343. DOI:10.1016/j.hal.2010.12.002 |
| [16] |
Sommer U. The PEG-model of seasonal succession of planktonic events in fresh waters. Archiv für Hydrobiologie, 1986, 106(4): 433-471. |
| [17] |
Carr NG, Whitton BA. The biology of cyanobacteria. Blackwell Science Pub, 1982, 27(2): 71-76. |
| [18] |
Mohan S, Dow C, Cole JA et al. Prokaryotic structure and function:A new perspective. Quarterly Review of Biology, 1994, 69(1): 96-97. |
| [19] |
Rippka R. Recognition and identification of cyanobacteria. Methods in Enzymology, 1988, 167(167C): 28-67. |
| [20] |
Zhong ZP, Wu YH, Xu J et al. Differentiation of Hormogonia and Photosynthetic characterization of Nostoc flagelliforme. Acta Botanica Sinica, 2000, 42(6): 570-575. [钟泽璞, 吴毓寰, 徐洁等. 发状念珠藻藻殖段的分化及其光合特性的研究. 植物学报, 2000, 42(6): 570-575.] |
| [21] |
Yang Z, Kong FX, Shi XL et al. Grazing effect of Ochromonas sp. on morphological and physiological characteristics of Microcystis aeruginosa. J Lake Sci, 2008, 20(4): 403-408. [杨州, 孔繁翔, 史小丽等. 棕鞭毛虫牧食作用对铜绿微囊藻形态和生理特性的影响. 湖泊科学, 2008, 20(4): 403-408. DOI:10.18307/2008.0401] |
| [22] |
Kohata K, Watanabe M. Diel changes in the composition of photosynthetic pigment and cellular carbon and nitrogen in Chattonella Antigua (Raphidophyceae). Journal of Phycology, 2010, 24(1): 58-66. |
| [23] |
Xie XP, Li YC, Hang X et al. The effect of air temperature on the process of cyanobacteria recruitment and dormancy in Lake Taihu. J Lake Sci, 2016, 28(4): 818-824. [谢小萍, 李亚春, 杭鑫等. 气温对太湖蓝藻复苏和休眠进程的影响. 湖泊科学, 2016, 28(4): 818-824. DOI:10.18307/2016.0415] |
| [24] |
Li GF. Characteristics, dangers and regulation of Euglena bloom in freshwater pond. Modern Rural Science and Technology, 2014(10): 38. [李广凤. 淡水池塘裸藻水华的特点危害和调控. 现代农村科技, 2014(10): 38.] |
| [25] |
Cetinić I, Vilicc D, Ljubesic Z et al. Phytoplankton seasonality in a highly stratified karstic estuary (Krka, Adriatic Sea). Hydrobiologia, 2006, 555(1): 31-40. DOI:10.1007/s10750-005-1103-7 |
| [26] |
Konopka A, Brock TD. Effect of temperature on blue-green algae (cyanobacteria) in Lake Mendota. Applied & Environmental Microbiology, 1978, 36(4): 572-576. |
| [27] |
Jin JP, Yu X, Bao YX et al. The relationship between the density of cyanobacteria and the environmental factors in the east lake of Yangcheng Lake. Chinese Journal of Agricultural Meteorology, 2013, 34(3): 324-331. [金建平, 于鑫, 包云轩等. 阳澄湖东湖蓝藻密度与前期环境因子的关系. 中国农业气象, 2013, 34(3): 324-331.] |
| [28] |
Zhao YH, Yang HS. Study on a kind of Euglena algae blooms in fish pond. Journal of Hydrobiology, 1994(2): 186-188. [赵玉珩, 杨红生. 鱼池中一种裸藻水华的研究. 水生生物学报, 1994(2): 186-188.] |
| [29] |
Luan Z, Fan YW, Men XY. Environmental quality evaluation of Songhua River in Harbin using diatom assemblage. J Lake Sci, 2010, 22(1): 86-92. [栾卓, 范亚文, 门晓宇. 松花江哈尔滨段水域硅藻植物群落及其水质的初步评价. 湖泊科学, 2010, 22(1): 86-92. DOI:10.18307/2010.0112] |
| [30] |
Zhao MX, Han BP. Analysis of factors affecting cyanobacteria bloom in a tropical reservoir(Tangxi Reservoir, China). Acta Ecologica Sinica, 2005, 25(7): 1554-1560. [赵孟绪, 韩博平. 汤溪水库蓝藻水华发生的影响因子分析. 生态学报, 2005, 25(7): 1554-1561.] |
| [31] |
Yang L, Zhang M, Liu ZW. Uptake of various forms of nitrogen by phytoplankton community in spring in Lake Taihu. J Lake Sci, 2011, 23(4): 605-611. [杨柳, 章铭, 刘正文. 太湖春季浮游植物群落对不同形态氮的吸收. 湖泊科学, 2011, 23(4): 605-611. DOI:10.18307/2011.0417] |
| [32] |
Zhou T, Li ZK, Feng LL. The different roles of ammonium and nitrate in the bloom self-maintenance of Lake Taihu. China Environmental Science, 2013, 33(2): 305-311. [周涛, 李正魁, 冯露露. 氨氮和硝氮在太湖水华自维持中的不同作用. 中国环境科学, 2013, 33(2): 305-311.] |
| [33] |
Wu N, Schmalz B, Fohrer N. Distribution of phytoplankton in a German lowland river in relation to environmental factors. Journal of Plankton Research, 2010, 33(5): 807-820. |
| [34] |
Li K, Guan BH, Liu ZW. Experiments on decomposition rate and release forms of nitrogen and phosphorus from the decomposing cyanobacterial detritus. J Lake Sci, 2011, 23(6): 919-925. [李柯, 关保华, 刘正文. 蓝藻碎屑分解速率及氮磷释放形态的实验分析. 湖泊科学, 2011, 23(6): 919-925. DOI:10.18307/2011.0614] |
| [35] |
Guo YH. Dynamics of phytoplankton community structure and its relationship with environmental factors in three large water supply reservoirs in Guangdong Province[Dissertation]. Guangzhou: Jinan University, 2011. [郭跃华. 广东省三座大型供水水库浮游植物群落结构动态及其与环境因子的关系[学位论文]. 广州: 暨南大学, 2011. ]
|
 2018, Vol. 30
2018, Vol. 30 

