(2: 湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing 210008, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
湖泛是我国超富营养化湖泊当前面临的严重生态灾害之一,其黑臭水体给湖泊生态系统和城市饮用水水源地供水带来了巨大的安全隐患[1-3].湖泛水体是典型的缺氧/厌氧水体,处于水体缺氧区发展变化过程的第4个也是最后1个阶段[4],在微生物作用下产生并释放出H2S类物质被认为是该阶段水环境的主要特征[5].在我国,由于太湖等富营养化浅水湖泊湖泛现象频发与大规模蓝藻水华处于同一时期,因此在最初的一段时间内,有关湖泛的研究和认识主要集中在水体富营养化层面[1, 6-9].然而,湖泛是一种明显区别于蓝藻水华的极端环境现象.一方面,其发生根源与水体重度富营养化有关[10];另一方面,湖泛问题又超出了富营养化问题的范畴,湖泛水体视觉上呈现的黑色及其水柱显著的高Fe2+和ΣS2-(ΣS2-=S2-+HS-+H2S)浓度等特征[4, 11],让其从物理及化学层面上都明显区别于正常湖体.最近研究结果表明,黑色FeS是湖泛水体重要的致黑物质并指示着湖泛的暴发与持续[12],厌氧水体中较为丰富的Fe2+和ΣS2-为FeS的生成提供了直接的反应物[4],而湖泛表层沉积物理化状态及过程被认为与水体缺氧或湖泛的形成具有密切的关系[13-14].然而,有关表层沉积物对湖泛致黑影响因素的贡献途径及方式尚未得到充分论证,相关研究尚存在一定的不足与空白.因此,研究并揭示湖泛水环境沉积物-水界面处Fe2+和ΣS2-的迁移途径和方向,对支撑湖泛形成机制理论研究及早期预控与应急处置具有重要意义.
沉积物-水界面是湖泊底质与上覆水物质交换的最重要场所.在浓度梯度、吸附解析平衡、溶解平衡、化学平衡、微生物产能代谢、水生植物根际效应、物理和底栖动物扰动等多种物理、化学、和生物过程单独或协同作用下,溶解性离子得以通过沉积物-水界面在间隙水和上覆水间迁移,从而使沉积物在上覆水营养盐和污染物迁移中扮演污染“源”或迁移“汇”的角色.在沉积物-水界面间离子迁移领域,国内外学者进行了大量的研究.该类研究以费克第一定律(Fick‘s first law)或费克第二定律(Fick’s second law)为理论指导[15],研究手段从早期破坏性采样的方式逐步走向原位被动采样技术甚至非损伤微电极探测等技术.其研究热点主要集中在沉积物溶解氧耗散[16-18]和富营养化相关沉积物N、P营养盐释放通量估算方面[19-23],有关湖泛和缺氧水环境特征敏感物质的报道较少.近年来有研究发现:缺氧/厌氧条件下,氧化还原条件敏感的H2S及Fe2+类物质在沉积物-水界面处具有大幅度积累的典型特征[24].当前已有研究认为:湖泛形成过程中,受水体厌氧及氧化还原条件的影响,表层沉积物间隙水中Fe2+、S2-等离子存在不断积累及向上释放的风险[25].然而,有关湖泛水体沉积物-水界面处Fe2+、S2-等离子的迁移方向尚未有充分的数据加以证明,沉积物-水界面间Fe2+和ΣS2-的迁移方向及其对湖泛的贡献途径需要进一步的分析.
因此,本研究以湖泛水体沉积物间隙水为研究对象,利用膜平衡式原位间隙水采样装置(Peeper)获得沉积物原位间隙水, 并重点分析其中Fe2+和ΣS2-的分布特征,定量估算二者在沉积物-水界面间的扩散通量并分析其主要影响因素,揭示湖泛水体Fe2+/ΣS2-在沉积物-水界面处的释放规律及其环境意义,为湖泛致黑机理提供一定的理论补充.
1 材料与方法 1.1 实验设计自然状态下,湖泊湖泛的发生时间和地点都具有突发性和很大程度的不确定性,较难进行全过程跟踪监测.因此,本研究采用室内模拟太湖湖泛、在模拟过程中投放Peeper以获取原位沉积物间隙水、进而分析间隙水理化指标并进行Fe2+和ΣS2-释放通量估算的研究方法.湖泛模拟所需沉积物、上覆水和蓝藻均采集自太湖湖泛易发区月亮湾(31°24′35.82″N, 120°6′04.57″E)水域.用重力式沉积物柱状采样器(Rigo. Co.,Ø11 cm×L 50 cm)采集深度大于30 cm的原位沉积物柱状样若干,同时用25 L聚乙烯水桶采集上覆水,并采集堆积蓝藻.所有样品于当天带回实验室,并在24 h内开始湖泛模拟.湖泛模拟实验在中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室Y-型沉积物再悬浮发生装置[26]中进行.实验设置对照组和湖泛模拟组,每组分别设置3个平行处理.将事先准备好的Peeper(准备方式与过程参照文献[10])装置插入沉积物,然后将带有Peeper的沉积物装入Y-型装置中,无扰动加入采集的湖水并使水深达到与太湖平均水深相近的180 cm.向湖泛模拟组各模拟柱中分别投加经300目尼龙筛网过滤后(靠重力过滤>8 h)的蓝藻(47.5 g/柱)[6],对照处理不进行添加.控制环境温度28±1℃,进行湖泛模拟实验.实验装置及湖泛模拟如图 1所示.
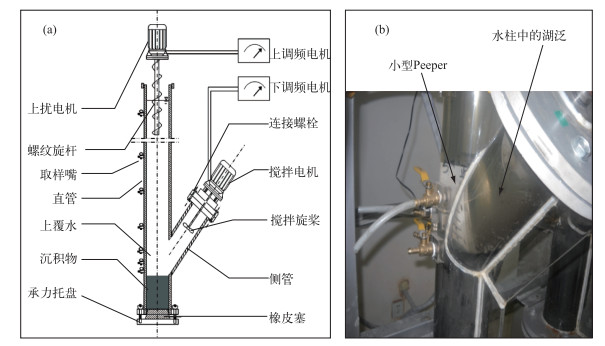
|
图 1 Y-型沉积物再悬浮模拟装置示意(a)及湖泛模拟(b) Fig.1 Side view of Y-style apparatus(a) and black bloom simulation(b) |
待湖泛发生后,从模拟装置中妥善卸下沉积物,取出Peeper并立即进行间隙水理化性质测定.用笔式锥形氧化还原电位计测定不同深度处间隙水的pH和氧化还原电位(Eh)值,并采集相应深度间隙水,用来分析其中Fe2+和ΣS2-含量.其中,Fe2+浓度采用菲咯嗪(Ferrozine)分光光度法测定[27],ΣS2-浓度采用亚甲基蓝分光光度法测定[28].对于沉积物样品,按照0~1、1~2、2~3、3~4、4~6、6~8和8~10 cm间隔分层,分析其中酸可挥发性硫化物(acid volatile sulfide,AVS)和铁形态分布特征.切样完成后取各层位沉积物鲜样利用冷扩散法[29-30]分析其中AVS含量,并用烘干法分析沉积物基本物理指标含水率和孔隙度[6].另取一部分沉积物进行真空冷冻干燥,其后用陶瓷研钵研磨至100目以下粒度,然后用改进BCR连续提取法[31-32]提取并分析其中铁形态分布.该方法可获得沉积物中金属元素的4种结合形态,即F1-可交换态及弱结合态,F2-铁锰氧化物结合态,F3-硫化物和有机物结合态,F4-残渣态.
1.3 数据处理 1.3.1 扩散通量计算沉积物-水界面间Fe2+和ΣS2-扩散通量依据费克第一定律(Fick’s first law)估算[33],计算公式为:
| $ F = {\varphi _0} \cdot {D_s} \cdot \frac{{\partial c}}{{\partial x}}{|_{x = 0}} $ | (1) |
式中,F为沉积物-水界面处离子扩散通量(常用单位mg/(m2 d));
| $ {D_s} = {\varphi _0} \cdot {D_0}\left( {{\varphi _0} \le 0.7时} \right) $ | (2) |
| $ {D_s} = \varphi _0^2 \cdot {D_0}\left( {{\varphi _0} > 0.7时} \right) $ | (3) |
不同处理间差异性利用一元方差分析(ANOVA,Turkey检验,双尾数)进行比较,不同参数间相关性利用相关性分析进行比较.方差分析和相关性分析均在SPSS 16.0软件中进行.
2 结果与分析 2.1 湖泛水体沉积物间隙水Eh、pH分布特征由于尚不具备量化判定湖泛全面暴发的标准,因此湖泊水体感观上是否变为黑色被当作现阶段判断湖泛发生与否的标志[36].在实验培养的第7 d,湖泛模拟处理组水柱水色相继变黑,发生了湖泛现象.湖泛发生后水体水色如图 1所示.待湖泛稳定发生后,将内置其中的Peeper采样器依次取出,分析间隙水中Eh和pH垂向剖面特征,结果表明(图 2):对于对照和湖泛样品,其Eh剖面变化特征类似, 2类样品均呈现出从上覆水到间隙水逐渐减小的特征,且上层沉积物间隙水Eh在沉积物-水界面之下持续降低,大约在5 cm深度以后达到相对稳定状态.与对照样品相比,湖泛样品在上覆水、界面水及表层2 cm沉积物间隙水中均处于更低Eh的还原性状态.与Eh剖面变化趋势不同,湖泛沉积物间隙水中pH剖面变化趋势与对照样品存在明显的差别.对于湖泛样品,上覆水、界面水和间隙水中pH值明显低于对照样品,各介质均处于弱酸性环境.而对照样品则呈现出上覆水中pH值较高,沉积物-水界面以下间隙水中pH值随深度增加逐渐降低,到5 cm深度及更深层沉积物中达到相对稳定状态的剖面变化趋势.该部分结果表明:发生湖泛的样品中表层沉积物及上覆水中Eh和pH值均较低,与对照样品相比, 湖泛样品沉积物-水界面体系整体处于还原性环境或状态.

|
图 2 沉积物间隙水Eh、pH剖面特征 Fig.2 Profiles of Eh and pH in pore water |
总体而言,湖泛样品和对照样品中Fe2+浓度在沉积物-水界面处及间隙水中剖面变化趋势相似,呈现出从上覆水/界面水到沉积物间隙水向下不断增加的特征,并在5 cm以下沉积物中趋于稳定(图 3a).与太湖正常湖体沉积物间隙水中Fe2+浓度的分布[10]相比,本研究获得的湖泛样品0~5 cm深度间隙水中Fe2+浓度明显偏高,而其间隙水中Fe2+浓度整体垂向分布规律与太湖湖泛区域沉积物间隙水中分布[10]相似.与对照样相比,湖泛样品上覆水及上层0~5 cm间隙水中Fe2+浓度高出0.9~10.8倍.湖泛水体沉积物-水界面处于还原态环境有利于Fe3+向Fe2+转化,这可能是导致湖泛样品中Fe2+浓度升高的主要原因.
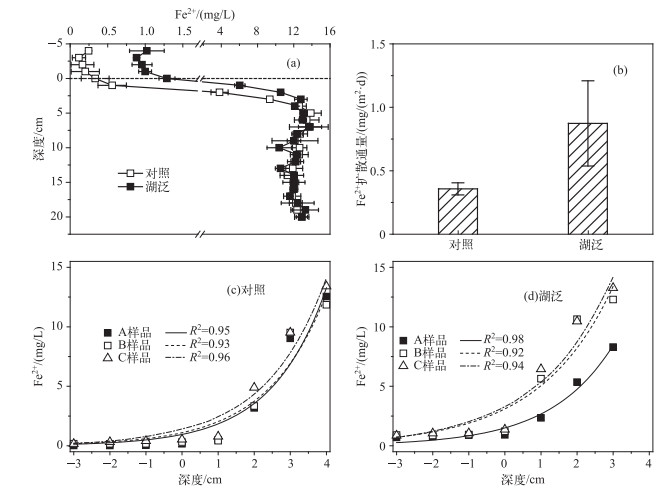
|
图 3 沉积物间隙水Fe2+剖面特征及释放规律(A, B, C代表 3个不同平行样, 下同) Fig.3 Profiles and release characteristics of Fe2+ in pore water(A, B, C represent three different parallel samples) |
由于间隙水和上覆水中Fe2+浓度存在明显的浓度梯度,这增加了间隙水中高浓度Fe2+向上覆水释放的风险.对获取的沉积物-水界面Fe2+分布信息利用费克第一定律进一步计算,得到对照和湖泛样品沉积物-水界面处Fe2+的释放通量, 结果显示,湖泛和对照样品间隙水中Fe2+均具有自沉积物通过沉积物-水界面向上覆水释放的潜力(图 3b).与对照样品相比,湖泛样品Fe2+释放通量更高,表层沉积物间隙水中Fe2+释放程度更为强烈.但与太湖湖泛水域湖泛消退20 d后沉积物-水界面Fe2+释放通量(>4 mg/(m2·d))[10]相比,本研究湖泛样品0.87 mg/(m2·d)的Fe2+释放通量明显较低.这主要是因为本研究湖泛水体上覆水中Fe2+浓度依旧较高,间隙水至上覆水中浓度梯度相对较小造成的.
2.3 间隙水ΣS2-剖面分布规律及其在沉积物-水界面间扩散特征对照样品ΣS2-浓度呈现出上覆水中较低,沉积物-水界面至8 cm深度范围内浓度较高,其后随深度增加而减小的趋势.与对照样品相比,湖泛样品中ΣS2-浓度在上覆水和沉积物间隙水中呈现出明显不同的剖面分布特征.湖泛样品ΣS2-浓度在沉积物-水界面处存在典型的峰值,并以该界面为拐点,自沉积物-水界面向上覆水和沉积物即向上和向下2个方向都呈现出明显的逐渐降低走向.从浓度上来看,对照样品和湖泛样品界面水/上覆水和沉积物间隙水中ΣS2-均达到一定的浓度,但湖泛样品中浓度总体上高于对照样品(图 4a).上层沉积物间隙水和上覆水中ΣS2-浓度明显增加,是湖泛或缺氧水体重要的化学特征之一[4],并可能为湖泛致黑物质及湖泛的最终形成提供直接的物质基础[14].
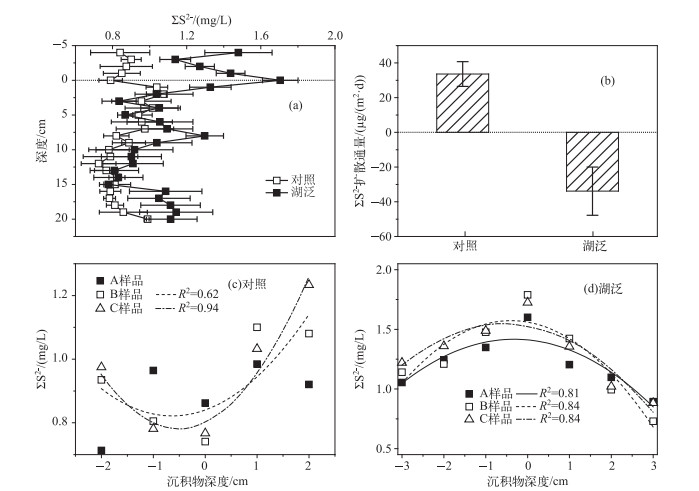
|
图 4 沉积物间隙水ΣS2-剖面特征及释放规律 Fig.4 Profiles and release characteristics of ΣS2- in pore water |
利用费克第一定律解释离子或分子在沉积物-水界面间扩散规律时,一般更多地用一次函数或指数函数进行描述,但有时二次函数更符合实际情况且具有更高的可靠性和解释能力[37].在本研究中,一次函数和指数函数均不能很好地描述沉积物-水界面间ΣS2-浓度与其相应垂向深度的关系,而二次函数解释能力较好.湖泛和对照样品沉积物-水界面ΣS2-扩散通量计算结果表明, 在对照样品中,ΣS2-在沉积物-水界面处扩散通量为正,表现出较强的自沉积物向上覆水释放的能力(图 4b).与此相对,湖泛样品中ΣS2-在沉积物-水界面处扩散通量为负值,表现为自上覆水向沉积物中迁移扩散的趋势和潜力.
2.4 沉积物AVS及Fe形态分布特征沉积物中AVS剖面分布特征(图 5a)表明, 对照样品沉积物AVS含量表现为从表层向底层逐渐增加的趋势.湖泛样品表层2 cm沉积物AVS含量明显高于对照样品.与对照样品剖面趋势不同的是,湖泛样品沉积物AVS含量在0~4 cm深度内自表层向下明显降低;而4 cm以下沉积物AVS含量随深度增加,与对照样品一致.表层沉积物样品Fe形态分布结果表明, 对于湖泛样品和对照样品,表层沉积物中Fe主要以残渣态(F4)为主,铁锰氧化物结合态(F2)为第2大结合形态,以硫化物和有机物结合态(F3)赋存的较少,可交换态和弱结合态Fe(F1)含量最少(图 5b, c).与对照样品不同的是,湖泛表层沉积物样品中F1和F3结合态含量有所增加而F2结合态含量有一定程度的减少.从该结果来看,在湖泛水体缺氧/厌氧的还原态环境下,表层沉积物中部分铁锰氧化物结合态Fe即可还原态Fe被还原而减少,该部分Fe可能转移至可交换态Fe或者硫化物与有机物结合态即可氧化态Fe,从而造成后两者含量的增加.
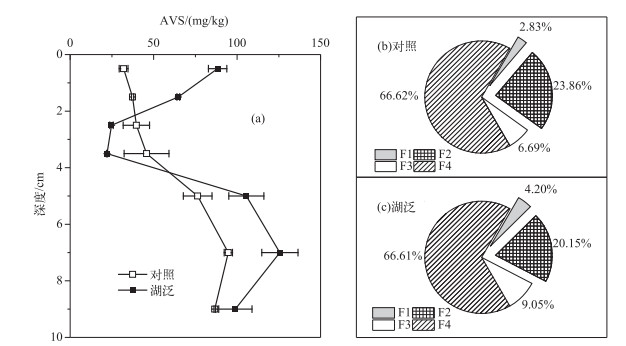
|
图 5 沉积物AVS剖面特征及表层沉积物Fe形态分布规律 Fig.5 Profiles of AVS in sediment and Fe fractions in surface sediment |
湖泊等大型水体缺氧现象的发生,给原有生态系统及结构造成严重的破坏,并引起相应水域环境敏感元素的生物地球化学循环途径和方式发生改变,进而改变了局部区域的环境状况,且有可能推进并完成一定程度的环境演替.沉积物-水界面是湖泊生态系统进行物质循环的重要场所、是沉积物和上覆水之间物质传输和交换的最主要桥梁,缺氧水体的形成和持续对沉积物-水界面处物质迁移转换具有显著的影响[24, 38-39].在本研究中,与对照样品相比,湖泛样品沉积物-水界面处Eh较低,处于典型的还原态环境,其沉积物间隙水Fe2+和ΣS2-浓度明显高于对照样品.相关性分析结果表明,Eh与Fe2+浓度呈显著负相关(r=-0.910,P=0.000 < 0.01),与ΣS2-浓度之间未呈现显著的相关关系(r=0.158,P=0.272>0.05). pH与Fe2+浓度(r=-0.579,P=0.000 < 0.01)和ΣS2-浓度(r=-0.316,P=0.025 < 0.05)均呈显著负相关.此外,湖泛样品表层沉积物AVS含量显著高于对照样品,且沉积物中Fe存在自氧化态向还原态及可交换态转化的趋势.堆积蓝藻的死亡分解,过度消耗水体溶解氧,进而使得水体逐步转向缺氧/厌氧的还原性状态,这一过程被认为是湖泛形成的重要诱发因素之一[3].水体从有氧/好氧状态变为缺氧/厌氧状态后,会引发表层沉积物一系列氧化还原反应终端电子受体的改变[40],最后走向以SO42-为主要受体的氧化还原反应控制体系[24].受此影响,沉积物-水界面处高价Fe和S逐次还原,从而造成表层沉积物处Fe2+和ΣS2-的明显积累,并使得沉积物中以高价态方式结合的S素不断被还原为终端产物而造成AVS含量的升高[41].
3.2 沉积物-水界面Fe2+和ΣS2-扩散对湖泛形成的影响上覆水中稳定存在较高浓度的Fe2+和ΣS2-被认为是湖泛水体的重要化学特征[4],它们为湖泛致黑物质的最终形成提供了重要的直接物质供给[3, 12].已有研究证明,湖泛最初发生在与沉积物相邻近的底部水体[42-43],表层沉积物是藻源性或生物源性湖泛发生的源场所[14],是湖泛得以形成的重要物源基础.在缺氧厌氧环境下,沉积物中高浓度的Fe2+和ΣS2-通过沉积物-水界面向上覆水释放并生成黑色FeS,曾被认为是湖泛最终形成的重要机制之一[25, 44].在本研究中,由Peeper获得的湖泛原位沉积物间隙水和近界面上覆水中,Fe2+浓度呈现出自表层沉积物向上覆水迅速减小的趋势.这是因为在缺氧/厌氧的环境下,湖泛样品中可还原态Fe即铁锰氧化物结合态Fe被部分还原并以Fe2+的形式进入间隙水,造成间隙水中Fe2+浓度升高,形成向上的浓度梯度.扩散通量计算结果表明,湖泛样品中Fe2+通过沉积物-水界面向上覆水释放能力较强、潜力较大.这说明表层沉积物具备向上覆水提供Fe2+的能力,并为湖泛致黑物质的形成供应Fe2+源.
然而,与Fe2+剖面特征不同,间隙水和近界面上覆水中ΣS2-浓度在沉积物-水界面处出现峰值,并以界面为中心向上覆水和沉积物中递减,上覆水中的浓度甚至高于间隙水中的浓度.扩散通量计算结果表明,湖泛样品中ΣS2-呈现出自上覆水通过沉积物-水界面向沉积物中扩散的趋势,这与湖泛水体及致黑物质中S素主要来自于沉积物向上覆水中释放的已有分析和假设相矛盾.相反地,该结果表明在湖泛水体中表层沉积物向上覆水方向的ΣS2-释放能力有限,沉积物-水界面处ΣS2-的扩散方向表现为自上覆水向沉积物的向下输移.本研究结果显示,ΣS2-浓度最高出现在沉积物-水界面处(图 4a),并以该界面为中心向上、下2个方向迅速减少,这使得最表层沉积物成为ΣS2-积累的一个热点.大量已有研究认为,沉积物中ΣS2-的形成是缺氧/厌氧条件下SO42-被还原的结果[45-47],硫酸盐还原菌(sulfate reducing bacteria, SRB)增殖过程的生物化学反应是SO42-被还原为终端还原产物ΣS2-的最重要驱动[48-49].当蓝藻累积造成缺氧现象发生并持续时,表层沉积物中SRB活动开始变得活跃,而上覆水中大量易利用的SO42-为SRB的规模增殖提供了丰富的能源物质.已有研究证明,SRB活动的复兴及其大规模增殖是湖泛发生的重要驱动因素[11].因此,湖泛样品沉积物-水界面及界面水/上覆水中高浓度ΣS2-的积累,可能是界面处SRB对界面水/上覆水中SO42-还原的结果[14].这种还原作用占据了ΣS2-积累的主导地位,并导致在沉积物-水界面处ΣS2-呈现出自上覆水向沉积物方向的浓度梯度,从而使得ΣS2-出现自沉积物-水界面向下的扩散通量.该结果表明,表层沉积物在湖泛水体ΣS2-的来源问题上扮演重要角色,上覆水中SO42-被表层沉积物中增殖的SRB还原,从而在界面水及底层上覆水中实现了ΣS2-的积累并向上覆水体扩散,为湖泛致黑物质的形成提供了重要的物源基础.
4 结论湖泛水体沉积物-水界面处Fe2+、ΣS2-浓度明显高于正常湖体,呈现出较强的Fe2+和ΣS2-积累态势.研究结果显示:湖泛体系沉积物间隙水中Fe2+具有较高的释放通量,通过沉积物-水界面向上覆水方向的释放能力强烈;湖泛体系ΣS2-在沉积物-水界面处的迁移方向整体表现为自上覆水向沉积物方向的向下扩散,表层沉积物向上释放能力有限.研究表明:缺氧/厌氧条件下表层沉积物积累的Fe2+通过沉积物-水界面向上覆水释放,为湖泛水体致黑物质物源基础之一的Fe2+提供了重要的来源;而同样的缺氧/厌氧条件下,界面水及底层上覆水中丰富的SO42-在沉积物-水界面处被还原为终端还原产物ΣS2-,为湖泛致黑物质的形成提供了另一重要物源基础.缺氧/厌氧环境下沉积物-水界面处Fe和S原有地球化学循环方式的转变,为湖泛的致黑和爆发提供了重要的物质基础,是湖泛得以形成的必要条件之一.
| [1] |
NIGLAS(NanjingInstitute of Geography and Limnology, Chinese Academy of Sciences). On the cause of cyanophyta bloom and pollution in water intake area and emergency measures in Meiliang Bay, Lake Taihu in 2007. J Lake Sci, 2007, 19(4): 357-358. [中国科学院南京地理与湖泊研究所. 太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议. 湖泊科学, 2007, 19(4): 357-358. DOI:10.18307/2007.0401.] |
| [2] |
Yang M, Yu JW, Li ZL et al. Taihu Lake not to blame for Wuxi's woes. Science, 2008, 319(5860): 158. |
| [3] |
Fan Chengxin. Progress and prospect in formation of black bloom in Lake Taihu:A review. J Lake Sci, 2015, 27(4): 553-566. [范成新. 太湖湖泛形成研究进展与展望. 湖泊科学, 2015, 27(4): 553-566. DOI:10.18307/2015.0401.] |
| [4] |
Shen QS, Zhou QL, Shang JG et al. Beyond hypoxia:Occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake. Journal of Environmental Sciences, 2014, 26(2): 281-288. DOI:10.1016/S1001-0742(13)60452-0 |
| [5] |
Diaz RJ, Rosenberg R. Spreading dead zones and consequences for marine ecosystems. Science, 2008, 321(5891): 926-929. DOI:10.1126/science.1156401 |
| [6] |
Shen Qiushi, Shao Shiguang, Wang Zhaode et al. Simulation of black bloom in Moon Bay of Lake Taihu and physical and chemical responses of water and sediment. Advances in Water Science, 2011, 22(5): 710-719. [申秋实, 邵世光, 王兆德等. 太湖月亮湾湖泛发生过程模拟及水土物化性质的响应. 水科学进展, 2011, 22(5): 710-719.] |
| [7] |
Lu Guihua, Man Qian. Analysis on the causes of forming black water cluster in Taihu Lake. Advances in Water Science, 2009, 20(3): 438-442. [陆桂华, 马倩. 太湖水域"湖泛"及其成因研究. 水科学进展, 2009, 20(3): 438-442.] |
| [8] |
Chen Hesheng. Black water aggregation in Yixing inshore water area of Taihu Lake. Advances in Science and Technology of Water Resources, 2011, 31(4): 33-37. [陈荷生. 太湖宜兴近岸水域"湖泛"现象初析. 水利水电科技进展, 2011, 31(4): 33-37. DOI:10.3880/j.issn.1006-7647.2011.04.007] |
| [9] |
Lu Guihua, Ma Qian. Monitoring and analysis on "Black Water Aggregation" in Lake Taihu, 2009. J Lake Sci, 2010, 22(4): 481-487. [陆桂华, 马倩. 2009年太湖水域"湖泛"监测与分析. 湖泊科学, 2010, 22(4): 481-487. DOI:10.18307/2010.0402] |
| [10] |
Shen Qiushi, Zhou Qilin, Shao Shiguang et al. Estimation of in-situ sediment nutrients release at the submerged plant induced black bloom area in Lake Taihu. J Lake Sci, 2014, 26(2): 177-184. [申秋实, 周麒麟, 邵世光等. 太湖草源性"湖泛"水域沉积物营养盐释放估算. 湖泊科学, 2014, 26(2): 177-184. DOI:10.18307/2014.0202] |
| [11] |
Feng ZY, Fan CX, Huang WY et al. Microorganisms and typical organic matter responsible for lacustrine "black bloom". Science of the Total Environment, 2014, 470/471: 1-8. DOI:10.1016/j.scitotenv.2013.09.022 |
| [12] |
Shen Qiushi, Fan Chengxin. Identification of black suspended particles in the algae-induced black bloom water column. J Lake Sci, 2015, 27(4): 591-598. [申秋实, 范成新. 藻源性湖泛水体显黑颗粒的元素形态分析与鉴定. 湖泊科学, 2015, 27(4): 591-598. DOI:10.18307/2015.0405] |
| [13] |
Alvisi F, Giani M, Ravaioli M et al. Role of sedimentary environment in the development of hypoxia and anoxia in the NW Adriatic shelf(Italy). Estuarine Coastal and Shelf Science, 2013, 128: 9-21. DOI:10.1016/j.ecss.2013.05.012 |
| [14] |
Shen QS, Liu C, Zhou QL et al. Effects of physical and chemical characteristics of surface sediments in the formation of shallow lake algae-induced black bloom. Journal of Environmental Sciences, 2013, 25(12): 2353-2360. DOI:10.1016/S1001-0742(12)60325-8 |
| [15] |
Berg P, Risgaard-Petersen N, Rysgaard S. Interpretation of measured concentration profiles in sediment pore water. Limnology and Oceanography, 1998, 43(7): 1500-1510. DOI:10.4319/lo.1998.43.7.1500 |
| [16] |
Higashino M, Gantzer CJ, Stefan HG. Unsteady diffusional mass transfer at the sediment/water interface:Theory and significance for SOD measurement. Water Research, 2004, 38(1): 1-12. DOI:10.1016/j.watres.2003.08.030 |
| [17] |
Bryant LD, McGinnis DF, Lorrai C et al. Evaluating oxygen fluxes using microprofiles from both sides of the sediment-water interface. Limnology and Oceanography-Methods, 2010, 8: 610-627. DOI:10.4319/lom.2010.8.0610 |
| [18] |
Beutel MW. Hypolimnetic anoxia and sediment oxygen demand in California drinking water reservoirs. Lake and Reservoir Management, 2003, 19(3): 208-221. DOI:10.1080/07438140309354086 |
| [19] |
Zhang L, Shen QS, Hu HY et al. Impacts of Corbicula fluminea on oxygen uptake and nutrient fluxes across the sediment-water interface. Water Air and Soil Pollution, 2011, 220(1-4): 399-411. DOI:10.1007/s11270-011-0763-3 |
| [20] |
Zhang L, Wang SR, Wu ZH. Coupling effect of pH and dissolved oxygen in water column on nitrogen release at water-sediment interface of Erhai Lake, China. Estuarine Coastal and Shelf Science, 2014, 149: 178-186. DOI:10.1016/j.ecss.2014.08.009 |
| [21] |
Xiang SL, Nie FH, Wu DS et al. Nitrogen distribution and diffusive fluxes in sediment interstitial water of Poyang Lake. Environmental Earth Sciences, 2015, 74(3): 2609-2615. DOI:10.1007/s12665-015-4281-2 |
| [22] |
Thornton DCO, Dong LF, Underwood GJC et al. Sediment-water inorganic nutrient exchange and nitrogen budgets in the Colne Estuary, UK. Marine Ecology Progress Series, 2007, 337: 63-77. DOI:10.3354/meps337063 |
| [23] |
Xue LQ, Hao ZC. Nutrient exchange and release experiment and its simulation study in lake water-sediment interface. Journal of Environmental Sciences-China, 2006, 18(3): 591-595. |
| [24] |
Nielsen LP, Risgaard-Petersen N, Fossing H et al. Electric currents couple spatially separated biogeochemical processes in marine sediment. Nature, 2010, 463(7284): 1071-1074. DOI:10.1038/nature08790 |
| [25] |
Liu Guofeng, He Jun, Fan Chengxin et al. Environment effects of algae-caused black spots:Impacts on Fe-Mn-S cycles in water-sediment interface. Environmental Science, 2010, 31(11): 2652-2660. [刘国锋, 何俊, 范成新等. 藻源性黑水团环境效应:对水-沉积物界面处Fe、Mn、S循环影响. 环境科学, 2010, 31(11): 2652-2660.] |
| [26] |
Fan Chengxin. A kind of method and apparatus used to simulate underwater sediments resuspension in laboraty:China, CN 1563928 A. 2005(in Chinese). [范成新. 一种室内模拟水下沉积物再悬浮状态的方法及装置. CN 1563928 A[P]. 2005. ]
|
| [27] |
Stookey LL. Ferrozine-a new spectrophotometric reagent for iron. Analytical Chemistry, 1970, 42(7): 779-781. DOI:10.1021/ac60289a016 |
| [28] |
Cline JD. Spectrophotometric determination of hydrogen sulfide in natural waters. Limnology and Oceanography, 1969, 14(3): 454-458. DOI:10.4319/lo.1969.14.3.0454 |
| [29] |
Hsieh YP, Shieh YN. Analysis of reduced inorganic sulfur by diffusion methods:Improved apparatus and evaluation for sulfur isotopic studies. Chemical Geology, 1997, 137(3/4): 255-261. |
| [30] |
Ulrich GA, Krumholz LR, Suflita JM. A rapid and simple method for estimating sulfate reduction activity and quantifying inorganic sulfides. Applied and Environmental Microbiology, 1997, 63(4): 1627-1630. |
| [31] |
Ure AM, Quevauviller P, Muntau H et al. Speciation of heavy-metals in soils and sediment-an account of the improvement and harmonization of extraction techniques undertake under the auspices of the BCR of the commission of the European communities. International Journal of Environmental Analytical Chemistry, 1993, 51(1/2/3/4): 135-151. |
| [32] |
Mossop KF, Davidson CM. Comparison of original and modified BCR sequential extraction procedures for the fractionation of copper, iron, lead, manganese and zinc in soils and sediments. Analytica Chimica Acta, 2003, 478(1): 111-118. DOI:10.1016/S0003-2670(02)01485-X |
| [33] |
Ullman WJ, Aller RC. Diffusion coefficients in nearshore marine sediments. Limnology and Oceanography, 1982, 27(3): 552-556. DOI:10.4319/lo.1982.27.3.0552 |
| [34] |
Ullman WJ, Sandstrom MW. Dissolved nutrient fluxes from the nearshore sediments of Bowling Green Bay, central Great Barrier Reef Lagoon(Australia). Estuarine Coastal and Shelf Science, 1987, 24(3): 289-303. DOI:10.1016/0272-7714(87)90051-5 |
| [35] |
Song Jinming ed. Chemistry in Chinese offshore sediments. Beijing: China Ocean Press, 1997, 6-8. [宋金明. 中国近海沉积物化学. 北京: 海洋出版社, 1997, 6-8.]
|
| [36] |
Shen Qiushi, Shao Shiguang, Wang Zhaode et al. Fade and recovery process of algae-induced black bloom in Lake Taihu under different wind conditions. Chinese Science Bulletin, 2012, 57(12): 1060-1066. [申秋实, 邵世光, 王兆德等. 风浪条件下太湖藻源性"湖泛"的消退及其水体恢复进程. 科学通报, 2012, 57(12): 1060-1066.] |
| [37] |
Xu KM, Zhang LP, Zou WB. Microelectrode study of oxygen uptake and organic matter decomposition in the sediments of Xiamen Western Bay. Estuaries and Coasts, 2009, 32(3): 425-435. DOI:10.1007/s12237-009-9153-0 |
| [38] |
Luo Shasha, Wan Guojiang. New procress in the study of Fe, Mn and S system at the sediment-water interface of lakes on Yunnan-Guizhou Plateau. Geology-Geochemistry, 1999, 27(3): 47-52. [罗莎莎, 万国江. 云贵高原湖泊沉积物-水界面铁、锰、硫体系的研究进展. 地质地球化学, 1999, 27(3): 47-52.] |
| [39] |
Wu Fengchang, Wan Guojiang, Huang Ronggui et al. Environmental impact of sulfate concentration increasing of lakes. Acta Scientiae Circumstantiat, 1998, 18(1): 28-33. [吴丰昌, 万国江, 黄荣贵等. 湖泊水体中硫酸盐增高的环境效应研究. 环境科学学报, 1998, 18(1): 28-33.] |
| [40] |
Middelburg JJ, Levin LA. Coastal hypoxia and sediment biogeochemistry. Biogeosciences, 2009, 6(7): 1273-1293. DOI:10.5194/bg-6-1273-2009 |
| [41] |
Rickard D, Morse JW. Acid volatile sulfide(AVS). Marine Chemistry, 2005, 97(3/4): 141-197. |
| [42] |
He W, Shang JG, Lu X et al. Effects of sludge dredging on the prevention and control of algae-caused black bloom in Taihu Lake, China. Journal of Environmental Sciences, 2013, 25(3): 430-440. DOI:10.1016/S1001-0742(12)60098-9 |
| [43] |
Chen Chao, Zhong Jicheng, Fan Chengxin et al. Effects of sludge dredging on black bloom:A case study of Bafang port and Lvjiang port of Taihu. China Environment Science, 2014, 34(8): 2071-2077. [陈超, 钟继承, 范成新等. 疏浚对湖泛的影响:以太湖八方港和闾江口水域为例. 中国环境科学, 2014, 34(8): 2071-2077.] |
| [44] |
Liu Guofeng, Zhong Jicheng, He Jun et al. Effects of black spot of dead-cyanobacterial mats on Fe-S-P cycling in sediments of Zhushan Bay, Lake Taihu. Environmental Science, 2009, 30(9): 2520-2526. [刘国锋, 钟继承, 何俊等. 太湖竺山湾藻华黑水团沉积物中Fe-S-P的含量及其形态变化. 环境科学, 2009, 30(9): 2520-2526.] |
| [45] |
Jorgensen BB. Sulfur cycle of a coastal marine sediment(Limfjorden, Denmark). Limnology and Oceanography, 1977, 22(5): 814-832. DOI:10.4319/lo.1977.22.5.0814 |
| [46] |
Holmer M, Storkholm P. Sulphate reduction and sulphur cycling in lake sediments:A review. Freshwater Biology, 2001, 46(4): 431-451. DOI:10.1046/j.1365-2427.2001.00687.x |
| [47] |
Leonov AV, Chicherina OV. Sulfate reduction in natural water bodies. 1. The effect of environmental factors and the measured rates of the process. Water Resources, 2008, 35(4): 417-134. DOI:10.1134/S0097807808040052 |
| [48] |
Liamleam W, Annachhatre AP. Electron donors for biological sulfate reduction. Biotechnology Advances, 2007, 25(5): 452-463. DOI:10.1016/j.biotechadv.2007.05.002 |
| [49] |
Savvichev AS, Rusanov Ⅱ, Yusupov SK et al. The process of microbial sulfate reduction in sediments of the coastal zone and littoral of the kandalaksha Bay of the White Sea. Microbiology, 2003, 72(4): 478-489. DOI:10.1023/A:1025057109690 |
 2016, Vol. 28
2016, Vol. 28 

