(2: 中国科学院大学, 北京 100049)
(3: 江苏省淡水水产研究所, 南京 210017)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017, P. R. China)
湖鲚(Coilia ectenes taihuensis)又名梅鲚, 属鲱形目(Clupeiformes)鳀科(Engraulidae)鲚属(Coilia), 是典型的浮游动物食性鱼类.浮游动物食性鱼类在维持湖泊生态系统结构与功能稳定中起重要作用, 其捕食可显著改变浮游动物群落结构, 进而通过“下行效应”影响浮游藻类群落结构[1].近年来, 太湖富营养化进程加快, 湖鲚捕捞量也从1952年的640.5 t剧增至2014年的22709 t, 现已成为太湖优势鱼种[2-3].单一种群持续增长势必会危害湖泊水生生态系统稳定性, 因此, 开展湖鲚种群控制的研究对维持湖泊健康和可持续发展至关重要[4-5].鱼类种群动态与环境中食物分布及丰度显著相关, 食物缺乏时, 鱼类新陈代谢速率降低, 生长发育和繁殖减慢, 行为迟缓, 疾病感染率明显增加, 种群呈现负增长[6].食物充足时, 鱼类生长迅速, 体质量和生理活性增高, 抵御疾病能力增强[7].因此, 进行浮游食性鱼类种群动态对湖泊渔业及对湖泊生态系统的影响研究时, 摄食生态学研究尤为关键.
胃含物分析能有效鉴定鱼类食物组成, 是研究鱼类种群和群落动态变化的基础[8], 因此受到国内外渔业学者广泛关注, Mao等研究了太湖草型湖区鱼类胃含物组成后指出, 浮游藻类是鱼类重要有机颗粒食物来源, 同时大型植物在冬季也对几种无脊椎动物和鱼类的生长有较大贡献[9].湖鲚以大型浮游动物为主要食物[10], 湖鲚的捕食削弱了浮游动物对浮游藻类的捕食压力[11], 最终导致湖泊水体透明度降低.迄今, 鲚属鱼类研究多集中于渔获量、形态差异、生长发育和繁殖等方面[12-15], 而食性差异研究较少[16-17], 不同生态湖区湖鲚食性季节变化更未见报道.本研究选取太湖两种生态湖区:草型湖区和敞水湖区, 比较湖鲚食物组成的季节差异, 可为湖鲚种质资源利用和种群控制提供基础资料, 同时为湖泊生态治理与合理的渔业管理提供依据.
1 材料与方法 1.1 样品采集与分析分别于2013年2、4、5、6、8、9、10、12月于太湖不同生态型湖区(敞水湖区(HJ1:31°13'58″~31°14'20″N, 120°13'54″~120°15'55″E)和草型湖区(HJ2:31°8'43″~31°10'21″N, 120°20'47″~120°21'42″E))进行湖鲚样品采集(图 1).样品采集时间为每月20日, 采样当天10:00—11: 00利用单船表层单囊拖网(网口10.4 m×9 m, 网目15 mm, 囊网网目6 mm, 网长4 m, 左右各一个)在实验水域捕捞1 h, 同时用刺网(浮网, 网目10 mm, 网高1.2 m, 网长20 m)补充采集大个体湖鲚样品.样品采集时, 每15 min随机选取不同体长湖鲚样品保存于15%甲醛溶液中, 用刺网捕获的较大个体, 现场度量形态参数, 并解剖取肠含物, 保存于1000 ml广口瓶中, 加15%甲醛溶液并编号.每15 min用25#(64 μm)浮游生物网过滤湖水10 L, 将滤液用5%的甲醛溶液固定, 返回实验室后分类鉴定浮游动物, 季节数据取平均值.

|
图 1 太湖湖鲚样本采集点位 Fig.1 Sampling sites of Coilia ectenes taihuensis specimen in Lake Taihu |
湖鲚标本经生物学测定后解剖获得胃含物, 水体中浮游动物和湖鲚饵料种类在显微镜下进行定量计数及分析.饵料生物损毁严重时, 根据特征残体, 尽可能鉴定到最小分类阶元.
湖鲚对食物喜好程度和摄食强度评价指标包括:出现频率F (%)=某种饵料生物出现次数/分析鱼样尾数×100%;数量百分比N%=某种饵料数/胃含物中饵料总数×100%;饱满度指数(%) =食物饵料生物重/纯体重×100%;摄食率Fr(%)=实胃尾数/总尾数×100%;肥满度系数K(%)=纯体重/(鱼体长)3×100%;充塞度分为0~5共6级, 0级表示胃内无食物, 1级表示胃内仅有少量食物, 约占胃容量1/4, 2级表示食物约占1/2, 3级表示食物约占3/4, 4级表示胃内刚好充满食物, 但不膨胀, 5级表示胃内充满食物, 并且胃壁膨大.
通过食物选择指数Ivlev指数来表征湖鲚对饵料生物的选择[18], 计算公式为:
| $ {I_i} = \left( {{R_i} - {P_i}} \right)/\left( {{R_i} + {P_i}} \right) $ |
式中, Ii为鱼类对饵料生物i的选择指数, Ri为饵料i占总饵料生物数量或生物量百分比, Pi为饵料i占水域饵料百分数. Ii值范围为-1 < Ii < 1, Ii越大, 表示湖鲚更爱摄食该饵料, 属主动摄食; Ii值介于-1~0时, 说明湖鲚回避该饵料生物, Ii=0表示随机选择.
1.3 数据处理所有结果均以平均值±标准误表示, 所有数据处理均在Microsoft Office软件中进行, 利用AutoCAD 2014绘制点位图, 利用OriginPro 8软件绘制湖鲚饵料生物组成图.
2 结果与分析 2.1 食物组成本次调查共随机采集湖鲚471尾, 448尾湖鲚用单船表层单囊拖网捕获, 体长和体质量分别介于4.8~11.3 cm和0.25~10.32 g之间, 其余23尾为刺网补充个体, 体长和体质量分别介于12.2~18.8 cm和10.12~55.68 g之间.其中, 体长为18.8 cm的湖鲚仅一尾, 出现在春季刺网捕获样品中, 夏季湖鲚样品个体总体较小.胃含物鉴定结果表明, 湖鲚食物以浮游动物为主, 枝角类由象鼻溞、网纹溞、透明薄皮溞、裸腹溞、秀体溞、低额溞、盘肠溞、长刺溞等组成; 桡足类包括哲水蚤、剑水蚤、猛水蚤、无节幼体和桡足幼体, 另外, 部分湖鲚胃中还出现轮虫、水生昆虫、小鱼虾和少量微囊藻.
湖鲚食物数量组成时空差异明显(表 1).敞水湖区湖鲚食物中甲壳纲浮游动物数量高于草型湖区, 食物中甲壳浮游动物最高比例出现在夏季, 为95.74%, 而草型湖区的仅为81.89%;湖鲚食物中, 枝角类最高比例出现在夏季, 为73.13%, 最低比例出现在冬季, 为37.36%, 桡足类恰好相反.轮虫出现在秋、冬季湖鲚食物中, 湖区间差别小.夏季草型湖区湖鲚食物中水生昆虫最多, 是敞水湖区的2.2倍; 虾出现在春、夏季湖鲚食物中, 草型湖区数量显著高于敞水湖区; 小鱼仅出现在体长>13.5 cm的湖鲚胃含物中.
| 表 1 湖鲚胃含物中饵料生物数量百分比(%) Tab.1 Diet composition in Coilia ectenes taihuensis stomach |
湖鲚食物枝角类组成中, 象鼻溞为优势种, 数量百分比介于35.59%~86.84%之间.湖鲚摄食象鼻溞数量随湖区和季节变化明显, 草型湖区明显高于敞水湖区, 冬季枝角类食物组成中, 象鼻溞比例最高, 为86.84%, 春、秋季次之, 分别为73.07%和65.92%, 夏季最小, 为43.3%.其它枝角类食物变化较小, 部分种类偶尔出现, 如僧帽溞和透明溞仅夏季出现在草型湖区.湖鲚的桡足类食物组成中, 夏季草型湖区哲水蚤和剑水蚤比敞水湖区高40.3%, 但无节幼体仅为敞水湖区的1/7.冬、春季湖鲚样品食物中出现猛水蚤, 但数量极少(图 2).
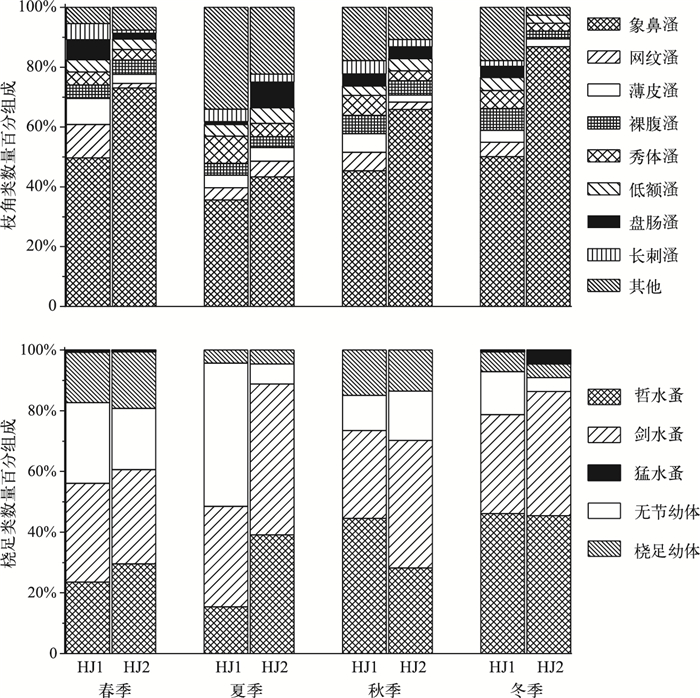
|
图 2 饵料生物组成的时空差异 Fig.2 Variations of diet compositions in different seasons and sites |
湖鲚的食物种类及数量随时空变化明显, 敞水湖区显著高于草型湖区, 夏季不同湖区湖鲚样品的食物数量差值最大, 为817.8.所有湖鲚样品中, 食物数量最大值为1522, 出现在春季敞水湖区体长为14.5 cm的湖鲚胃含物中.总体上草型湖区湖鲚摄食率高于敞水湖区, 春季草型湖区湖鲚摄食率最大(98.5%), 43尾湖鲚样中仅出现2尾空胃, 最小摄食率(60.5%)出现在冬季敞水湖区湖鲚样品中, 85尾中有34尾为空胃.饱满度指数春季最大, 秋、冬季次之, 夏季最小, 湖区间差别很小; 肥满度指数随采样湖区和季节变化不明显(表 2).
| 表 2 时空差异对太湖湖鲚相关参数的影响 Tab.2 Variations of relevant parameters of Coilia ectenes taihuensis in different seasons and sites |
总体来说, 湖鲚对大个体浮游动物有强烈的主动选择倾向, 其对僧帽溞、低额溞和大型溞的选择指数介于0.59~1.00之间; 但同时对特定小型浮游动物也表现出主动选择, 如裸腹溞, 选择指数为0.62 < Ii < 0.95.湖鲚对蚤状溞、哲水蚤和桡足幼体的选择性季节变化明显, 但受采样区域变化影响较小, 如夏、冬季主动选择桡足幼体, 春、秋季则随机选择.湖鲚回避部分浮游动物, 如对无节幼体的平均选择指数为-0.85, 对猛水蚤为-0.88.总体上, 湖鲚回避象鼻溞, 但对象鼻溞的选择性随季节变化明显.
3 讨论湖鲚是太湖鱼类群落优势种, 太湖渔业捕捞量逐年攀升与湖鲚种群快速增殖直接相关[2], 而湖鲚种群增长又与其食物资源密不可分[19].本研究中, 湖鲚食物种类随季节和湖区变化较小, 即以枝角类和桡足类为主, 体长大于13.5 cm的湖鲚胃含物中偶尔出现小型鱼和虾, 这与唐瑜等的研究结果相似[14].鱼类食物会因环境而变, Hayden等指出欧洲真白鲑(Coregonus lavaretus)夏季摄食底栖动物和浮游动物, 冬季则专食摇蚊幼虫[20], Alcaraz等指出秘鳉(Aphanius farsicus)春季主食绿藻, 其余季节摄食硅藻和昆虫, 且食性随性别、发育状态及种群数量差异显著[21].本实验中, 冬季湖鲚胃含物中桡足类数量比夏季高, 冬、春季小型鱼虾数量增多, 秋、冬季则出现轮虫, 说明湖鲚对饵料生物的选择性随季节变化明显.草型湖区水生昆虫数量多, 出现频率高, 可能与水生植物为昆虫提供食物源、栖息地、繁殖和发育场所有关[22].
影响鱼类摄食率的因素众多, 食物丰度、分布及相似生态位鱼类竞争是主要外因[23-24], 而个体发育状态为主要内因[25]. Wurtsbaugh等指出, 美洲银汉鱼(Menidia beryllina)白天随浮游动物进行水平和垂直迁移, 夜间则因浮游动物迁移至深水区而不能摄食[23].水生植物能为浮游生物、水生昆虫及小型鱼虾提供充足食物[22, 26], 能容纳更多饵料生物定居, 因此, 草型湖区湖鲚摄食率高于敞水湖区; 此外, 水生植物为细菌和附着生物提供栖息场所, 丰富了湖鲚的食物来源.本研究中, 湖鲚的摄食量、摄食率季节和湖区间差异显著, 这与Wurtsbaugh等对银汉鱼的研究结果一致[23].湖鲚肥满度小, 个体趋于“瘦小型”, 说明富营养化条件下, 食物被更多地用于种群增殖而非个体增长[27], 导致个体“小型化”.
鱼类对食物的需求和环境中食物资源决定了鱼类对食物的选择, 但鱼类对食物的选择还受其他多种因素的影响, 如食物的可得性和可见性, 鱼类的捕食力和捕食策略等[28]. Maszczyk等指出斜齿鳊(Rutilus rutilus)的食物随饵料生物密度、均匀度和个体大小差异显著[29].本研究中, 水草区湖鲚胃含物中鱼虾及大型浮游动物数量高于敞水湖区, 说明饵料生物丰度和可得性显著影响捕食者对食物的选择性.湖鲚主动摄食大型浮游动物符合最优捕食策略, 捕食者耗费相同能量, 摄取大个体食物利于捕食者种群增殖.本研究中, 湖鲚对象鼻溞、网纹溞和无节幼体的选择系数均为负值, 说明湖鲚主动回避小型浮游动物[30]; 湖鲚食物中象鼻溞数量较多, 说明食物缺乏时, 湖鲚也会摄食象鼻溞, 以确保种群稳定.湖鲚食物中桡足类少, 说明湖鲚对食物的选择与游泳能力有关, Drenner认为滤食鱼类主要摄食逃避能力弱的个体, 最终以桡足类占优势[31].本次研究中, 湖鲚对哲水蚤和桡足幼体的选择系数均为正值, 说明湖鲚的游泳能力较桡足类强.冬、春季湖鲚食物中出现猛水蚤, 可能是因气温降低, 饵料生物数量降低, 湖鲚迁移至更深水层摄食, 也可能与湖泊较浅有关[32], 但湖鲚主动回避猛水蚤(表 3).
| 表 3 时空差异对太湖湖鲚食物选择性的影响 Tab.3 Feeding selectivity of Coilia ectenes taihuensis for different zooplankton species in different seasons and sites |
湖鲚的捕食减轻了浮游动物对浮游植物的牧食压力, 藻活性升高, 生物量增加[33-34].为维护湖泊生态系统结构和功能稳定, 确保湖泊渔业可持续发展, 需合理控制湖鲚种群数量.一方面, 科学治理湖区面源污染, 严格控制工农业及生活污水排放, 降低营养盐输入, 同时于浅水湖区培植沉水植物, 防止沉积物再悬浮, 有效控制湖泊水体营养盐浓度, 抑制浮游生物生长, 通过“上行效应”控制湖鲚种群.另一方面, 增加肉食性鱼类(如鲌鱼、鳜鱼)和滤食性鱼类(如鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis))放流力度, 鲌、鳜捕食能控制湖鲚种群, 鲢、鳙滤食浮游生物, 减少湖鲚食物来源, 同时与湖鲚竞争表层生态空间, 对湖鲚种群增长起到一定抑制作用.此外, 合理捕捞策略, 针对性网具的使用, 也能有效控制湖鲚种群.湖鲚食性研究有利于从食物网层面剖析湖鲚种群增长原因, 进而通过生物操纵理论对湖鲚种群进行控制, 最终为合理湖泊渔业结构形成和湖泊环境修复提供科学依据.
4 结论湖鲚以浮游动物为主要食物, 因环境不同, 湖鲚食物中偶尔会出现轮虫、水生昆虫和小型鱼虾.食物中浮游动物以枝角类和桡足类占优势, 二者组分季节差别明显, 夏季枝角类数量较多, 冬季桡足类显著增加, 而湖区间无明显差异.湖鲚对饵料生物的选择性随季节变化明显, 冬、春季小型鱼虾数量增多, 秋、冬季出现轮虫, 冬季桡足类显著增加.湖鲚主要摄食大型浮游动物, 对大部分小型浮游动物采取回避策略, 且对游泳能力强的桡足类摄食率较低.太湖湖鲚总体肥满度偏小, 个体趋于“瘦小型”, 说明富营养化条件下, 食物被更多的用于种群增殖而非个体增长, 导致个体“小型化”.
| [1] |
Wang Yinping, Gu Xiaohong, Zeng Qingfei et al. Impacts of faeces from microcystis-dietary silver carp (Hypophthalmichthys molitrix) and tilapia (Oreochromis niloticus) on the aquatic environments and the transferring of faeces-sourced nitrogen. J Lake Sci, 2015, 27(3): 475-485. [王银平, 谷孝鸿, 曾庆飞等. 食微囊藻干粉鱼类对水环境的影响及氮素迁移转化规律. 湖泊科学, 2015, 27(3): 475-485. DOI:10.18307/2015.0315] |
| [2] |
Gu Xiaohong, Zhu Songquan, Wu Linkun et al. The natural fishery and the development countermeasures in Lake Taihu. J Lake Sci, 2009, 21(1): 94-100. [谷孝鸿, 朱松泉, 吴林坤等. 太湖自然渔业及其发展策略. 湖泊科学, 2009, 21(1): 94-100. DOI:10.18307/2009.0112] |
| [3] |
Mao Zhigang, Gu Xiaohong, Zeng Qingfei et al. Community structure and diversity of fish in Lake Taihu. Chinese Journal of Ecology, 2011, 30(12): 2836-2842. [毛志刚, 谷孝鸿, 曾庆飞等. 太湖鱼类群落结构及多样性. 生态学杂志, 2011, 30(12): 2836-2842.] |
| [4] |
Søndergaard M, Liboriussen L, Pedersen AR et al. Lake restoration by fish removal:short-and long-term effects in 36 Danish lakes. Ecosystems, 2008, 11: 1291-1305. DOI:10.1007/s10021-008-9193-5 |
| [5] |
Vijverberg J, Dejen E, Getahun A et al. Zooplankton, fish communities and the role of planktivory in nine Ethiopian lakes. Hydrobiologia, 2014, 722: 45-60. DOI:10.1007/s10750-013-1674-7 |
| [6] |
Luo Bo, Feng Jian, Jiang Buguo et al. The effects of starvation on growth, proximate composition and biochemical index of Pacific salmon (Oncorhynchus spp.).. Acta Hydrobiologica Sinica, 2010, 34(3): 541-546. [罗波, 冯健, 蒋步国等. 饥饿对太平洋鲑生长, 机体组成及血浆相关生化指标变化研究. 水生生物学报, 2010, 34(3): 541-546. DOI:10.3724/SP.J.1035.2010.00541] |
| [7] |
Zhou Liangxing, Han Dong, Zhu Xiaoming et al. Effects of ration restriction and refeeding on the growth, feeding and body composition of Cyprinus longipectoralis juveniles. Acta Hydrobiologica Sinica, 2013, 37(1): 172-176. [周良星, 韩冬, 朱晓鸣等. 限食及恢复投喂对春鲤幼鱼摄食、生长和鱼体组成的影响. 水生生物学报, 2013, 37(1): 172-176. DOI:10.7541/2013.172] |
| [8] |
Baker R, Buckland A, Sheaves M. Fish gut content analysis:robust measures of diet composition. Fish and Fisheries, 2014, 15: 170-177. DOI:10.1111/faf.12026 |
| [9] |
Mao ZG, Gu XH, Zeng QF et al. Production sources and food web of a macrophyte-dominated region in Lake Taihu, based on gut contents and stable isotope analyses. Journal of Great Lakes Research, 2014, 40: 656-665. DOI:10.1016/j.jglr.2014.05.005 |
| [10] |
Ye Jialin, Liu Zhengwen, Wang Weimin. Comparative study on the feeding of Coilia ectenes and Hyporhamphus intermedius in the Meiliang Bay of Lake Taihu. J Lake Sci, 2007, 19(2): 218-222. [叶佳林, 刘正文, 王卫民. 太湖梅梁湾刀鲚与间下鱵食性的比较. 湖泊科学, 2007, 19(2): 218-222. DOI:10.18307/2007.0217] |
| [11] |
Ramcharan CW, France RL, McQueen DJ. Multiple effects of planktivorous fish on algae through a pelagic trophic cascade. Canadian Journal of Fisheries and Aquatic Sciences, 1996, 53: 2819-2828. DOI:10.1139/cjfas-53-12-2819 |
| [12] |
Liu ES, Bao CH, Wan Q. The changes of the catch and age structure of lake anchovy and the relationship with environmental variation in Lake Taihu. Journal of Fisheries of China, 2008, 32(2): 229-235. |
| [13] |
Jiang Tao, Yang Jian, Liu Hongbo et al. A comparative study of the morphology of sagittal otolith in Coilia nasus, Coilia mystus and Coilia nasus taihuensis. Marine Sciences, 2011, 35(3): 23-31. [姜涛, 杨健, 刘洪波等. 刀鲚、凤鲚和湖鲚矢耳石的形态学比较研究. 海洋科学, 2011, 35(3): 23-31.] |
| [14] |
Tang Yu. Study on the growth character and critical age of Coilia ectenes taihuensis Yuen et Lin. Chinese Journal of Ecology, 1986, 5(3): 5-9. [唐渝. 太湖湖鲚生长特征和临界年龄的研究. 生态学杂志, 1986, 5(3): 5-9.] |
| [15] |
Dong Wenxia, Tang Wenqiao, Wang Lei. Growth characteristics of reproductive population of Coilia nasus in the Yangtze river. Journal of Shanghai Ocean University, 2014, 23(5): 669-674. [董文霞, 唐文乔, 王磊. 长江刀鲚繁殖群体的生长特性. 上海海洋大学学报, 2014, 23(5): 669-674.] |
| [16] |
Liu Ensheng. A study on diet composition of dominant fishes in Lake Taihu. Journal of Fisheries of China, 2008, 32(3): 395-401. [刘恩生. 太湖主要鱼类的食物组成. 水产学报, 2008, 32(3): 395-401.] |
| [17] |
Yu Jinlei, He Hu, Li Kuanyi et al. Seasonal variations in the diets of Coilia ectenes taihuensis Yen et Lin in Gonghu Bay of Lake Taihu. J Lake Sci, 2012, 24(5): 765-770. [于谨磊, 何虎, 李宽意等. 太湖贡湖湾鲚(Coilia ectenes taihuensis Yen et Lin)食物组成的季节变化. 湖泊科学, 2012, 24(5): 765-770. DOI:10.18307/2012.0518] |
| [18] |
Dou Shuozeng. Feeding ecology of fish-A critical review on theories, methods and their application. Oceanologia et Limnologia Sinica, 1996, 27(5): 556-561. [窦硕增. 鱼类摄食生态研究的理论及方法. 海洋与湖沼, 1996, 27(5): 556-561.] |
| [19] |
Mao Zhigang, Gu Xiaohong, Zeng Qingfei et al. Status and changes of fishery resources (2009-2010) in Lake Taihu and their responses to water eutrophication. J Lake Sci, 2011, 23(6): 967-973. [毛志刚, 谷孝鸿, 曾庆飞等. 太湖渔业资源现状(2009-2010年)及与水体富营养化关系浅析. 湖泊科学, 2011, 23(6): 967-973. DOI:10.18307/2011.0621] |
| [20] |
Hayden B, Harrod C, Kahilainen KK. Dual fuels:intra-annual variation in the relative importance of benthic and pelagic resources to maintenance, growth and reproduction in a generalist salmonid fish. Journal of Animal Ecology, 2014, 83: 1501-1512. DOI:10.1111/1365-2656.12233 |
| [21] |
Alcaraz C, Gholami Z, Esmaeili HR et al. Herbivory and seasonal changes in diet of a highly endemic cyprinodontid fish (Aphanius farsicus). Environmental Biology of Fishes, 2015, 98: 1541-1554. DOI:10.1007/s10641-015-0381-9 |
| [22] |
Yan Zhongcheng, Harry Zhong. Aquatic insects. Bulletin of Biology, 2004, 39(1): 15-18. [颜忠诚, Harry Zhong. 水生昆虫. 生物学通报, 2004, 39(1): 15-18.] |
| [23] |
Wurtsbaugh W, Li H. Diel migrations of a zooplanktivorous fish (Menidia beryllina) in relation to the distribution of its prey in a large eutrophic lake. Limnology and Oceanography, 1985, 30: 565-576. DOI:10.4319/lo.1985.30.3.0565 |
| [24] |
Chouvelon T, Violamer L, Dessier A et al. Small pelagic fish feeding patterns in relation to food resource variability:an isotopic investigation for Sardina pilchardus and Engraulis encrasicolus from the Bay of Biscay (north-east Atlantic). Marine Biology, 2015, 162: 15-37. DOI:10.1007/s00227-014-2577-5 |
| [25] |
Zhang Bo. Feeding habits and ontogenetic diet shift of hairtail fish (Trichiurus lepturus) in East China Sea and Yellow Sea. Marine Fisheries Research, 2004, 25(2): 6-12. [张波. 东、黄海带鱼的摄食习性及随发育的变化. 海洋水产研究, 2004, 25(2): 6-12.] |
| [26] |
Kluijver A, Yu J, Houtekamer M et al. Cyanobacteria as a carbon source for zooplankton in eutrophic Lake Taihu, China, measured by 13C labeling and fatty acid biomarkers. Limnology and Oceanography, 2012, 57: 1245-1254. DOI:10.4319/lo.2012.57.4.1245 |
| [27] |
Luo Bingzheng. Life history patterns and geographical variation of ecological parameters for marine fishes in the coastal waters of China. Oceanologia et Limnologia Sinica, 1992, 23(1): 63-73. [罗秉征. 中国近海鱼类生活史型与生态学参数地理变异. 海洋与湖沼, 1992, 23(1): 63-73.] |
| [28] |
Dou S. Taxonomy, biology and abundance oficefishes, or noodlefishes (Salangidae), in the Yellow River estuary of the Bohai Sea, China. Journal of Fish Biology, 1994, 45: 737-748. DOI:10.1111/j.1095-8649.1994.tb00940.x |
| [29] |
Maszczyk P, Gliwicz ZM. Selectivity by planktivorous fish at different prey densities, heterogeneities, and spatial scales. Limnology and Oceanography, 2014, 59: 68-78. DOI:10.4319/lo.2014.59.1.0068 |
| [30] |
Liu Shouhai, Xu Zhaoli, Tian Fengge et al. Study on feeding habit of Coilia mystus in Yangtze River Estuary. Journal of Shanghai Ocean University, 2012, 21(4): 589-597. [刘守海, 徐兆礼, 田丰歌. 长江口及附近水域凤鲚摄食习性的分析. 上海海洋大学学报, 2012, 21(4): 589-597.] |
| [31] |
Drenner RW, Noyelles DF, Kettle D. Selective impact of filter-feeding gizzard shad on zooplankton community structure 1. Limnology and Oceanography, 1982, 27: 965-968. DOI:10.4319/lo.1982.27.5.0965 |
| [32] |
Qin BQ. The changing environment of Lake Taihu and its ecosystem responses. Journal of Freshwater Ecology, 2015, 30: 1-3. DOI:10.1080/02705060.2014.992053 |
| [33] |
Wang Yinping, Gu Xiaohong, Zeng Qingfei et al. Growth and photosynthetic activity of Microcystis colonies after gut passage through silver carp and bighead carp. Acta Ecologica Sinica, 2014, 34(7): 1707-1715. [王银平, 谷孝鸿, 曾庆飞等. 控(微囊)藻鲢, 鳙排泄物光能与生长活性. 生态学报, 2014, 34(7): 1707-1715. DOI:10.5846/stxb201211151602] |
| [34] |
Wang YP, Gu XH, Zeng QF et al. Fate of 15N-enriched cyanobacteria feed for planktivorous fish in an enclosure experiment:a stable isotope tracer study. Fisheries Science, 2015, 81(5): 821-830. DOI:10.1007/s12562-015-0897-0 |
 2016, Vol. 28
2016, Vol. 28 

