(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
随着现代工、农业的快速发展和生活垃圾的增多,过量的氮、磷营养盐和有机污染物输入到水体中,导致严重的水体富营养化和有机污染,随着湖泊富营养化出现蓝藻水华,和工、农业产生的大量有毒污水,严重影响了江河湖泊的生态功能和水环境质量[1-3].在水体修复和污染处理领域,水生植物修复技术被认为是最经济、有效和符合生态规律的方法,在水体生态修复、重金属污染治理和有毒有机污染物处理领域都有很好的应用前景;其中沉水植物占据了湖泊中水和底质的主要界面,有机地结合了水体的两大营养库,对湖泊生态系统过程有着重要的影响[4].研究表明沉水植物可以显著降低水体中的氮、磷浓度,抑制藻类疯长,提高水体透明度[5-6],增加水体溶解氧浓度,维持水体理化特征稳定和生态系统平衡.沉水植物对减缓重金属污染和有机物污染有良好的表现,Favas等研究发现沉水植物对放射性重金属铀的富集功能最强[7],Michael等通过种植沉水植物对海洋沉积物中的多环芳烃类和多聚联苯类剧毒污染物进行原位修复,实验运行60周后,多环芳烃类污染物的降解率达到73% [8].虽然沉水植物对水体生态失衡和轻度水质污染有良好的改善作用,但是沉水植物在重度富营养化和污染严重的水体中常常面临着生长不良的瓶颈,使其改善水体生态系统和污染治理的作用受到限制.研究表明,在重度富营养化的藻型湖泊中沉水植物是无法生存的[9-10],秦伯强认为,在湖泊污染很重或者氮、磷负荷很高的情况下,以沉水植物为核心的修复策略是不合理的[11];沉水植物对有机污染物的耐受性也是有一定限度的,晏再生等[12]探究了苦草对淡水沉积物中多环芳烃类有机污染物的耐受限度,发现当污染物的投加量超过80 mg/kg时,苦草就无法正常生长,所以探究多种方法强化沉水植物修复过程是解决以上瓶颈的关键点.利用电场强化植物修复过程是一种创新的植物修复强化方法[13-14],目前已有部分学者将植物与电场进行复合研究,Chiranjeevi等[15]构建了沉水植物和挺水植物的复合群落,并引入了电场结构,这种设计改善了污水处理效果,但对水生植物的研究尚未涉及.电场对植物的生长有重要影响,研究结果显示,合适的电场强度可以刺激细胞分裂,提高酶活性,增加叶绿素合成,提高光合反应活力,进而促进植物生长发育[16-18].合适的外加电场还可以提高污染物的可溶性,加速污染物的迁移转化,提高微生物群落的多样性[19],改善水生植物的生长条件,进一步强化水生植物的生态恢复和污染修复效果. Lu等[20]初步探究了挺水植物美人蕉在人工湿地系统中对电场的生理响应,为利用电场强化挺水植物在人工湿地的污水处理效果提供了理论可行性.苦草(Vallisneria natans)为水鳖科苦草属多年生沉水植物,其对环境有较强的适应性,且其株高适中、生物学特征明显,常被用来做水体修复和污染治理的先锋物种[21],本试验选取苦草作为研究对象,通过在苦草的生长过程中施加不同强度的电场,初步探究沉水植物苦草对直流电场刺激的响应,以期为电修复与沉水植物修复的复合应用提供一定的理论依据.
1 材料与方法 1.1 实验材料实验所用苦草在8月中旬取自东太湖(30°58′N, 120°22′E),选取新生幼苗,经自来水冲洗干净后,移栽到高密度聚乙烯水桶中(直径80 cm, 高52 cm),室内环境驯化两个星期.实验所用的底泥和上覆水均取自太湖梅梁湾(31°30′N, 120°11′E),底泥过20目筛(直径50 cm,筛孔0.85 mm)去除贝壳、螺、石块、植物残体等杂物,充分搅拌均匀后使用.上覆水取清澈的湖水,经100目筛绢过滤后备用,实验用水的基本水质指标包括:酸碱度(pH值)、溶解氧、总磷(TP)、总氮(TN)和可溶性有机碳(DOC),具体见表 1,酸碱度和溶解氧分别采用sartorius PB-10酸度计和手持式溶氧仪(YSI 550A)直接测定,总磷、总碳和可溶性有机碳采用国家标准方法测定[22].实验前选取株高为11~13 cm、长势基本一致、叶片鲜绿无萎蔫的健壮苦草幼苗准备实验.
| 表 1 基本水质指标 Tab.1 Basic indicators of water quality |
实验主体部分采用加厚聚乙烯水箱(长×宽×高=61 cm×43 cm×37 cm), 水箱内放置3个聚乙烯小圆桶(直径19.8 cm,高19 cm), 每个小桶内装10 cm高的底泥,种植5棵苦草,整个装置注入过筛后的湖水,水面高度为35 cm.实验过程通过稳压直流电源(兆信,TXN-150 2D型)24 h供电,由导线和垂直插入小桶中的两根石墨棒(直径18 mm,长40 cm)对苦草提供电刺激,石墨棒贴近小桶内缘,两根石墨棒相距18 cm(以圆心记),石墨棒与苦草保持5 cm的距离,石墨棒上部露出水面,通过金属夹和导线与电源相连,6个电压水平设置为:0、0.2、0.5、1.0、1.5、3.0 V,其中0 V为对照组,插有石墨棒但不通电.在水箱上部1 m高处安装日光灯管(佛山,T5型8 W),每天光照时间为10:00-14:00,通过科德tw-k11型时控开关控制.整个装置连续运行60 d之后,测定系统参数和苦草的形态、生理指标.
1.3 分析项目与测定方法实验结束后,分别测定不同处理组的水体参数:温度、pH值、溶解氧和氧化还原电位,水温用手持温度计测量;上覆水的pH值用sartorius PB-10酸度计现场测定;上覆水的溶解氧用手持式溶氧仪(YSI 550A)原位测定,测量点以苦草叶片未覆盖区域随机取点(上午7:00左右);氧化还原电位在抽出上覆水之后、取出苦草之前,用便携式氧化还原电位仪(FJA-4型)测定,参比电极为Ag-AgCl电极;苦草种植前分别用天平称量各组的初始总鲜重,用软尺测量初始平均株高和平均叶长,株高以苦草平铺后的中心叶片尖端到根茎交合处为准,随机量取每棵苦草的最长、中等、最短3片叶长,取其平均值作为该棵苦草的平均叶长;实验结束后(上午10:00左右)将存活的所有苦草取出,流水冲洗干净,再用无菌水冲洗多遍,然后平铺在白色吸水纸上,再次称量各组苦草的总鲜重,测量每组处理的苦草平均株高和平均叶长;在每棵苦草的根茎分界处将根系剪下,浸泡在蒸馏水中,通过RHIZO 2008根系扫描仪获得根系图像和数据;总叶绿素含量采用80%丙酮提取法测定,抗逆性指标丙二醛含量用硫代巴比妥酸法测定,具体步骤参照文献[23].
1.4 数据处理实验数据用SPSS statistics 20和OriginPro 8.5软件处理与绘图,显著性检验采用单因素方差检验.
2 结果和分析 2.1 直流电场对水体参数的影响实验结束后对不同电压处理组上覆水的温度、pH值、溶解氧浓度及沉积物表层5 cm的氧化还原电位进行测量.在0~3 V电压范围内,随着电压升高,上覆水的温度在不同电压处理组间没有显著差异(P > 0.05);上覆水的pH值在不通电的情况下略偏碱性,当通电电压为1.5和3.0 V时,上覆水的pH值与对照组相比显著下降(P < 0.05),接近中性;上覆水的溶解氧浓度在通电电压为3.0 V时与对照组相比显著下降(P < 0.05),其他处理组与对照组没有显著差异(P > 0.05);沉积物表层5 cm处的氧化还原电位随着通电电压的增加表现出明显下降的趋势,各处理组间差异显著(P < 0.05),当通电电压达到3.0 V时,沉积物表层5 cm处的氧化还原电位低至-245.33 mV,表明沉积物中已经形成强烈的还原条件(表 2).
| 表 2 不同通电电压下水体参数的变化 Tab.2 Changes of waterbody parameters under different voltage intensities |
通过最终收获的苦草总鲜重与实验前的苦草总鲜重的差值(即鲜重变化量)来反映不同电压对苦草总生物量的影响.经过较低电压(0.2、0.5、1.0 V)处理的苦草的总生物量与对照组相比有明显的增加,其中当电压为0.5 V时生物量增加最大,增加量占初始生物量的108.59%;而较高电压(1.5、3.0 V)处理后的苦草生物量与对照组相比则呈现负增长趋势,3.0 V处理组的苦草生物量比初始生物量减少了55.42% (图 1).实验结束时,模拟系统内的苦草数目也发生了一定变化,其中对照组(0 V)和处理组(0.2、0.5、1.0、1.5 V)最终收获的株数与初始保持一致,同时对照组收获3枚新芽,0.5 V处理组收获4枚新芽,0.2和1.0 V处理组收获2枚新芽,1.5 V 处理组收获1枚新芽;而较高电压处理组(3.0 V)在实验结束时死亡了2棵,均未收获到新芽.

|
图 1 苦草鲜重的变化 Fig.1 Changes of the fresh weight of Vallisneria natans |
经过不同电压处理,苦草的株高和叶长也发生了不同变化(图 2).未经过通电处理的对照组苦草在实验结束后平均株高增加了20.43 cm,增加量为初始平均株高的142.89%,0.2、0.5、1.0 V电压处理组苦草平均株高显著增加(P < 0.05),其中0.5和1.0 V电压处理组苦草平均株高分别增加了380.73%和232.48%,与对照组差异极显著(P < 0.01);1.5和3.0 V电压处理组的苦草虽然有一定生长,但是平均株高增加量显著低于对照组(P < 0.05),表明1.5和3.0 V电压处理会显著抑制苦草株高的增加.不同电压处理对苦草平均叶长的影响趋势与株高基本一致,各处理组之间苦草的平均叶长差异显著(P < 0.05),0.2、0.5、1.0和1.5 V处理组的苦草平均叶长与对照组相比都显著增加,3.0 V处理组显著减少(P < 0.05).
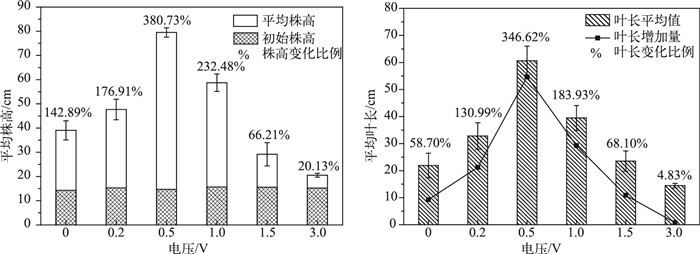
|
图 2 苦草平均株高和平均叶长的变化 Fig.2 Changes of average plant height and average length of leaves of Vallisneria natans |
根尖数在较低电压(0.2、0.5、1.0 V)的刺激下比对照组显著增加(P < 0.05),在较高电压(1.5、3.0 V)的刺激下表现出降低趋势,但与对照组差异不显著;苦草的平均根长在0.2、0.5、1.5 V电压刺激下与对照组相比显著增长(P < 0.05),1.0 V处理组的苦草平均根长也表现出增加的趋势,但与对照组相比不显著,3.0 V处理组苦草的平均根长显著小于对照组(P < 0.05),从误差值波动范围还可以观察到,在低电压处理组(0、0.2、0.5 V)苦草新生根系较多,高电压处理组(1.0、1.5、3.0 V)新生根系的生长受到抑制;各处理组的苦草根系平均直径在0.3~0.4 mm之间波动,差异不显著(P < 0.05),表明不同电压对苦草的根系直径影响不大(图 3).

|
图 3 苦草根系形态的变化 Fig.3 Changes of roots' morphological features of Vallisneria natans |
光合作用是植物体内非常重要的代谢过程,其强弱对植物生长及其抗逆性有重要的影响,光合色素是光合作用的物质基础,叶绿素含量的高低能在很大程度上反映植物的生长状态和光合能力[24].实验结果显示,当电压为0.5 V时,苦草叶片的总叶绿素含量与对照组相比显著增加(P < 0.05),表明合适的低压条件可以促进叶绿素的合成;当电压为1.5和3.0 V时,总叶绿素含量与对照组相比显著减少(P < 0.05),表明过高的电压会抑制苦草的光合作用,不利于其生长;当电压为0.2和1.0 V时,总叶绿素含量与对照组差异不显著(P > 0.05)(图 4).
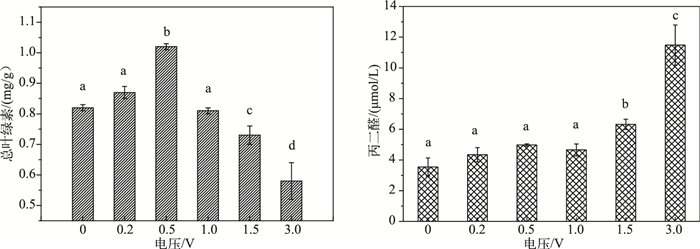
|
图 4 苦草叶片总叶绿素和丙二醛含量的变化(不同字母表示处理组差异显著,P < 0.05) Fig.4 Changes of total chlorophyll and MDA content in leaves of Vallisneria natans |
在逆境条件下,植物的细胞膜脂会加速氧化,活性氧增加,膜的结构和功能受到破坏.丙二醛是细胞膜脂过氧化的最终产物,是衡量膜脂过氧化程度的一个最重要的指标[25].在电刺激的情况下,苦草的细胞膜会发生一定程度的过氧化,通过测定丙二醛含量的变化可以反映出苦草在生理层面上对电场刺激的响应.在较低电压(0.2、0.5、1.0 V)刺激下,苦草叶片中丙二醛含量随着电压升高表现出缓慢增加的趋势,但与对照组相比没有显著差异(P > 0.05),表明苦草具有一定的耐低压性;当电压达到1.5 V时,苦草叶片中丙二醛含量快速升高,与对照组差异显著(P < 0.05),表明在此电压下苦草已经表现出明显的抗逆性,膜结构受到一定程度的破坏;当电压达到3.0 V时,丙二醛含量与对照组相比大幅度升高,与对照组差异极显著(P < 0.01),表明在此电压下苦草的叶片膜结构已经受到相当严重的破坏(图 4).
3 结论与讨论1) 本实验结果表明一定强度的电场能够促进苦草的生长,在0~1.0 V电压范围,苦草生长受到的促进作用随着电场强度的增加而增加,当电压达到3.0 V时,苦草的生长受抑制. 0.5 V电压处理组的新芽数目和根尖数达到最多,生物量增加最多,表明外加电场可以促进植物细胞的分裂和增生.已有研究表明,静电场能提高种子活力,增加植物的抗逆性[26-28],诱导ATP合成,加速酶活化,促进植物的生长发育;受微电流的刺激,植物细胞膜电位会增加,细胞分裂素产生定向迁移,促进细胞的增殖;同时微电流可以提高细胞膜的通透性,增加物质转运能力,刺激植物增长[29-30],本实验结果与这些植物电生理研究的结果相一致.
2) 苦草的丙二醛含量在1.5和3.0 V电压处理下显著增加,表明电场对植物生长发育的促进作用具有一定的阈值,强度过高的电场会紊乱植物细胞内的正常代谢反应,导致细胞膜脂过氧化,破坏细胞膜结构,甚至击穿细胞,导致细胞死亡. Janositz等观察了烟叶细胞对不同强度电场的反应,高强度电场可以击穿细胞壁,导致原生质体收缩、细胞碎裂[31].不同类型的植物对电场响应的阈值差别很大,而且还受到多种因素的共同制约,如植物组织细胞的大小、细胞壁的厚薄和处理时间等[32].沉水植物由于其完全水生的特点,对外界的刺激响应更加敏感,因此对电场刺激的阈值应该比陆生植物和挺水植物更低,Lu等[20]在利用外加电场提高人工湿地的去污能力时,发现挺水植物美人蕉对外加电场刺激反应的阈值在5~7 V之间,本实验结果证实沉水植物苦草对外加电场刺激反应的阈值在0.5~1.0 V之间,证实了沉水植物对电场刺激更敏感.
3) 上覆水的酸度随着电压的升高而增加,表明电修复技术能促进水体的酸化,时文歆等在探究污染土壤电修复过程中也发现,电修复可以促进土壤的酸化[33],导致pH值降低的原因是,当电压达到一定范围时,阳极处的水发生电解,产生的H+在电场作用下向阴极迁移,使经过之处的pH值下降.
4) 上覆水的溶解氧浓度比初始值显著降低,通电在理论上应该不会直接导致水体中的溶解氧浓度降低,因为在电解过程中阴极附近存在大量的阳离子,氧气不会在阴极发生电解,当电压达到3.0 V时氧气依然不会发生电解,此组溶解氧比对照组显著降低的现象应该是植物生长不利甚至发生腐烂大量耗氧导致的;此外通电会加速水体和沉积物中各种离子的迁移转化,可能会加大水体中氧气的消耗,此实验后续应该进一步探究通电对水体和沉积物中生化反应的影响,以证实此种推测,另外测量的时间选在早晨植物尚未进行光合作时也是导致溶解氧浓度偏低的一个原因.
5) 通电会导致沉积物(表层5 cm)中的氧化还原电位下降.付融冰等研究表明植物根系的泌氧作用可以提高根区的氧化能力[34],所以氧化还原电位可以从一定程度上反映植物根系的健康状态,如本实验中3.0 V电压处理组的沉积物形成了很强的还原环境,从侧面反映出苦草的生长受到了强烈胁迫,尤其是根系向沉积物中泌氧的能力受到强烈抑制[35],部分根系甚至有腐烂迹象.
通过模拟系统内的苦草对不同强度的外加电场的响应,可以得出在阈值范围内施加电场有助于苦草生长的结论,这为利用外加电场促进沉水植物修复和污染治理的想法提供了理论依据,本实验一些现象的机理尚有待进一步的实验探究,同时,由于实际环境复杂多变,电场与植物的复合应用离实际应用尚有一段距离,更多影响因素也有待进一步研究.
| [1] |
Qin Boqiang, Gao Guang, Zhu Guangwei et al. Lake eutrophication and its ecosystem response. Chin Sci Bull, 2013, 58(10): 855-864. [秦伯强, 高光, 朱广伟等. 湖泊富营养化及其生态系统响应. 科学通报, 2013, 58(10): 855-864.] |
| [2] |
Gao Bo, Yan Xiaoyuan, Jiang Xiaosan et al. Research progress in estimation of agricultural sources pollution of the Lake Taihu region. J Lake Sci, 2014, 26(6): 822-828. [高波, 颜晓元, 姜小三等. 太湖地区农业源污染核算研究进展. 湖泊科学, 2014, 26(6): 822-828. DOI:10.18307/2014.0602] |
| [3] |
Feng Muhua, Pan Jizheng, Ke Fan et al. Water pollution of post-mined lands in Lake Fuxian watershed in Yunnan Province. J Lake Sci, 2008, 20(6): 766-772. [冯慕华, 潘继征, 柯凡等. 云南抚仙湖流域废弃磷矿区水污染现状. 湖泊科学, 2008, 20(6): 766-772. DOI:10.18307/2008.0615] |
| [4] |
Deng Renchang, Huang Yuehua, Jiang Bo. The ecological restoration of submerged macrophyte in the shallow eutrophic lakes. Water Resources Protection, 2008, 24(1): 56-57. [邓仁昌, 黄月华, 姜波. 沉水植物在浅水富营养湖泊中的生态修复作用. 水资源保护, 2008, 24(1): 56-57.] |
| [5] |
Wu Zhenbin, Qiu Dongru, He Feng et al. Effect of rehabilitation of submerged macrophytes on mutrient level of a eutrophic lake. Chinese Journal of Applied Ecology, 2003, 14(8): 1351-1353. [吴振斌, 邱东茹, 贺锋等. 沉水植物重建对富营养化水体氮磷营养水平的影响. 应用生态学报, 2003, 14(8): 1351-1353.] |
| [6] |
Fang Yunying, Yang Xiaoe, Chang Huiqing et al. In-situ remediation of polluted water body by planting hydrophytes. Chinese Journal of Applied Ecology, 2008, 19(2): 407-412. [方云英, 杨肖娥, 常会庆等. 利用水生植物原位修复污染水体. 应用生态学报, 2008, 19(2): 407-412.] |
| [7] |
Favas PJC, Pratas J, Prasad MNV. Accumulation of uranium by aquatic plants in field conditions:Prospects for phytoremediation. Science of the Total Environment, 2014, 470: 993-1002. |
| [8] |
Michael HH, Tom SH, Tim JF et al. In situ phytoremediation of PAH-and PCB-contaminated marine sediments with eelgrass (Zostera marina). Ecological Engineering, 2009, 35: 1395-1404. DOI:10.1016/j.ecoleng.2009.05.011 |
| [9] |
Zou Lisha, Nie Zeyu, Yao Xiaoyan et al. Effects of light on submerged macrophytes in eutrophic water research progress. Chinese Journal of Applied Ecology, 2013, 24(7): 2073-2080. [邹丽莎, 聂泽宇, 姚笑颜等. 富营养化水体中光照对沉水植物的影响研究进展. 应用生态学报, 2013, 24(7): 2073-2080.] |
| [10] |
Li Huijuan, Ni Leyi. The effects of chlorophyta on the growth of submerged macrophyte Vallisneria natans:a laboratory experiment. J Lake Sci, 2007, 19(2): 111-117. [黎慧娟, 倪乐意. 浮游绿藻对沉水植物苦草生长的抑制作用. 湖泊科学, 2007, 19(2): 111-117. DOI:10.18307/2007.0201] |
| [11] |
Qin Boqiang. Principles and approach for lake ecological restoration. Acta Ecologica Sinica, 2007, 27(11): 4848-4858. [秦伯强. 湖泊生态恢复的基本原理与实现. 生态学报, 2007, 27(11): 4848-4858. DOI:10.3321/j.issn:1000-0933.2007.11.055] |
| [12] |
Yan ZS, Guo HY, Song TS et al. Tolerance and remedial function of rooted submersed macrophyte Vallisneria spiralis to phenanthrene in freshwater sediments. Ecological Engineering, 2011, 37: 123-127. DOI:10.1016/j.ecoleng.2010.07.026 |
| [13] |
Lim JM, Salido AL, Butcher DJ. Phytoremediation of lead using Indian mustard (Brassica juncea) with EDTA and electrodics. Microchemical Journal, 2004, 76: 3-9. DOI:10.1016/j.microc.2003.10.002 |
| [14] |
Chandrasekhar K, Mohan SV. Bio-electrochemical remediation of real field petroleum sludge as an electron donor with simultaneous power generation facilitates biotransformation of PAH:Effect of substrate concentration. Bioresource Technology, 2012, 110: 517-525. DOI:10.1016/j.biortech.2012.01.128 |
| [15] |
Chiranjeevi P, Rashmi C, Mohan SV. Ecologically engineered submerged and emergent macrophyte based system:An integrated eco-electrogenic design for harnessing power with simultaneous wastewater treatment. Ecological Engineering, 2013, 51: 181-190. DOI:10.1016/j.ecoleng.2012.12.014 |
| [16] |
Gao Weina, Gu Xiaoqing. The biological effects of high voltage electrostatic field on plants. Progress in Modern Biomedicine, 2006, 6(7): 60-62. [高伟娜, 顾小清. 高压静电场对植物生物学效应的研究进展. 现代生物医学进展, 2006, 6(7): 60-62.] |
| [17] |
Cao Yongjun, Xi Gang, Song Qing et al. Effects of long-term treatment with different electrostatic fields on photosynthetic and physiological indices of three crops. Journal of South China Agricultural University, 2007, 28(1): 86-90. [曹永军, 习岗, 宋清等. 不同强度静电场长期处理对3种作物几种光合生理指标的影响. 华南农业大学学报, 2007, 28(1): 86-90. DOI:10.7671/j.issn.1001-411X.2007.01.021] |
| [18] |
Cao Yongjun, Cheng Ping, Wang Yanli. Effects of some physiological index in leaves of crops when the seeds were treated with different electric field. Chinese Agricultural Science Bulletin, 2010, 26(10): 156-159. [曹永军, 程萍, 王燕鹂. 不同静电场处理种子对作物叶片几种生理指标的影响. 中国农学通报, 2010, 26(10): 156-159.] |
| [19] |
Sheng Genxiang, Zhou Haihua, Luo Qishi et al. Effects and mechanisms of direct current fields on rhizospheric soil microbial communities. Journal of Agro-Environment Science, 2008, 27(3): 920-925. [沈根祥, 周海花, 罗启仕等. 直流电场对根际土壤微生物群落的影响及其机理. 农业环境科学学报, 2008, 27(3): 920-925.] |
| [20] |
Lu SB, Song XS, Zhang T et al. Physiological and biochemical response of artificial wetland plant under electric field. Agricultural Science&Technology, 2010, 11(5): 121-124. |
| [21] |
Wang Yongping, Qin Boqiang. A comparison on morphology and anatomy of Vallisneria natans from oligotrophic and eutrophic lakes. J Lake Sci, 2011, 23(1): 56-60. [王永平, 秦伯强. 贫、富营养湖泊中苦草的形态解剖结构比较. 湖泊科学, 2011, 23(1): 56-60. DOI:10.18307/2011.0109] |
| [22] |
China EPA. Measuring and analyzing methods for water and wastewater (the fourth edition). Beijing: China Environmental Science Press, 2002, 266-268. [国家环境保护总局. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002, 266-268.]
|
| [23] |
Tang Zhangcheng ed. Experimental guide of modern plant physiology. Beijing: Science Press, 1999, 95-306. [汤章城. 现代植物生理学实验指南. 北京: 科学出版社, 1999, 95-306.]
|
| [24] |
Liu Zhenya, Liu Zhenqi. Photosynthesis inheritance of crops and the application in breeding (the first chapter). Beijing: Chinese Agriculture Press, 1993, 168-183. [刘振亚, 刘贞琦. 作物光合作用的遗传及其在育种中的应用研究进展(第1章). 北京: 中国农业出版社, 1993, 168-183.]
|
| [25] |
Zhang Chaolan, Chen Wenhui, Wei Bimao et al. Effects of Cadmium on the physiological and biochemical reactions of several kinds of wetland plants. Ecology and Environment, 2008, 17(4): 1458-1461. [张超兰, 陈文慧, 韦必帽等. 几种湿地植物对重金属镉胁迫的生理生化响应. 生态环境, 2008, 17(4): 1458-1461.] |
| [26] |
Romana R, Igor J, Nada G. Effects of weak low-frequency magnetic fields on spruce seed germination under acid conditions. Canadian Journal of Forest Research, 2011, 28(4): 609-616. |
| [27] |
Deng Hongmei, Han Hanbing, Xiong Jianping. Effect of high voltage electrostatic field on the physiological indexes of cucumber seed during germination period. Journal of Wuhan Botanical Research, 2006, 26(1): 87-89. [邓红梅, 韩寒冰, 熊建平. 高压静电场对黄瓜种子萌发期生理指标的影响. 武汉植物学研究, 2006, 26(1): 87-89.] |
| [28] |
Wu Xuhong, Sun Weimin, Zhang Hongyan et al. Biotic effects of electric field on pumpkin seeds during sprouting period and growth of seeding. Seed, 2004, 23(2): 27-30. [吴旭红, 孙为民, 张红燕等. 高压静电场对南瓜种子萌发及幼苗生长的生物学效应. 种子, 2004, 23(2): 27-30.] |
| [29] |
Wu Xuhong, Sun Weimin, Zhang Hongyan. Effects of high voltage electrostatic field on biotical effect of plant. Heilongjiang Agricultural Sciences, 2005(2): 44-46. [吴旭红, 孙为民, 张红燕. 静电场对植物的生物学效应. 黑龙江农业科学, 2005(2): 44-46.] |
| [30] |
Knorr D. Impact of non-thermal processing on plant metabolites. Journal of Food Engineering, 2003, 56: 131-134. DOI:10.1016/S0260-8774(02)00321-7 |
| [31] |
Janositz A, Knorr D. Microscopic visualization of Pulsed Electric Field induced changes on plant cellular level. Innovative Food Science&Emerging Technologies,, 2010, 11: 592-597. |
| [32] |
Ammar JB, lanoiselle JL, Lebovka NI et al. Impact of a pulsed electric field on damage of plant tissues:effects of cell size and tissue electrical conductivity. Journal of Food Science, 2011, 76(1): 90-97. DOI:10.1111/j.1750-3841.2010.01893.x |
| [33] |
Shi Wenxin, Qiu Xiaoxia, Yu Shuili et al. Study on electrokinetic remediation of heavy metal-contaminated soils and groundwater. Journal of Harbin University of Commerce (Sciences Edition), 2003, 19(6): 671-673. [时文歆, 邱晓霞, 于水利等. 重金属污染土壤和地下水的动电修复技术. 哈尔滨商业大学学报:自然科学版, 2003, 19(6): 671-673.] |
| [34] |
Fu Rongbin, Zhu Yiping, Yang Haizhen et al. DO and ORP conditions and their correlation with plant root distribution in a continuous-flow constructed wetland treating eutrophic water. Acta Scientiae Circumstantiae, 2008, 28(10): 2036-2038. [付融冰, 朱宜平, 杨海真等. 连续流湿地中DO、ORP状况及与植物根系分布的关系. 环境科学学报, 2008, 28(10): 2036-2038. DOI:10.3321/j.issn:0253-2468.2008.10.016] |
| [35] |
Wang Wenlin, Wang Guoxiang, Wan Yinjing et al. The influence of light and growth stage on oxygen diffusion capacity of Acorus calamus roots.. Acta Ecologica Sinica, 2013, 33(12): 3688-3696. [王文林, 王国祥, 万寅婧等. 光照和生长阶段对菖蒲根系泌氧的影响. 生态学报, 2013, 33(12): 3688-3696.] |
 2016, Vol. 28
2016, Vol. 28 

