(2: 中国科学院水生生物研究所, 东湖湖泊生态系统试验站, 淡水生态与生物技术国家重点实验室, 武汉 430072)
(2: Donghu Experimental Station of Lake Ecosystems, State Key Laboratory of Freshwater Ecology and Biotechnology of China, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
高等水生植物是湖泊生态系统结构和功能的重要组成部分[1-3],是维系生态系统较高生产力、多样性和稳定性的基础[4].它具有抑制藻类的生长繁殖、固定基质、降低水体浊度、改善水质等功能[5];同时也是多种水生动物的栖息地和营养来源.稳定性同位素技术是分析食物网结构和跟踪食物网能量流路径的重要手段[6-9].因此,认识水生高等植物同位素比率空间变化可为消费者食物来源示踪提供基准信息[10],对研究湖泊食物网结构、物质传递和能量流动具有重要意义.
现阶段关于湖泊水生高等植物稳定同位素比率研究少见报道.林清等分析了沉水植物龙须眼子菜(Potamogoton pectinatu)与环境之间的关系[11];陈毅风等对贵州草海湖泊系统水生植物的光合呼吸作用和有机质降解对整个湖泊体系稳定性C同位素组成的影响进行了研究[12];黄亮等测定了长江中游9个湖泊水生植物C、N、P及δ13C组成,探讨这些元素在水生植物中分布及其与所处水环境的关系[13].本研究选择太湖梅梁湾与贡湖湾两个具有不同环境条件的湖区,比较几种水生植物稳定碳、氮同位素的时空变化,探究其稳定同位素组成的变化规律及其生态学启示.
1 材料与方法 1.1 研究地点太湖(30°5′~32°8′N,119°8′~121°55′E)是中国第3大淡水湖,总面积2338km2,平均水深1.9m.太湖流域高密集的人口和较发达的经济导致大量的生活、农业和工业废物进入湖泊.因此,太湖的水环境质量日益下降,尤其近些年出现了大范围的蓝藻水华[14].梅梁湾是太湖北部最大的湖湾之一,承接了来自无锡市的污水,因此成为污染最严重的湖湾[15].贡湖湾在太湖的东北角,同样被人类活动污染比较严重,但是比梅梁湾稍好,还生长一些沉水植物[16].采样时发现,贡湖湾敞水区分布有微齿眼子菜(Potamogeton maackianus)、马来眼子菜(Potamogeton malaianus)、苦草(Vallisneria natans)、穗花狐尾藻(Myriophyllum spieatum)、金鱼藻(Ceratophyllum demeum)、轮叶黑藻(Hydrilla verticillata)、伊乐藻(Elodea nuttallii)等沉水植物[17],而梅梁湾几乎没有水生植物生长.因科研项目需要,2003年开始从贡湖湾打捞水草移栽到梅梁湾,在试验区域内形成稳定的水草群落.
1.2 样品采集和处理分别于2005年5、8、11月在太湖贡湖湾采集各种水生植物,11月同时在梅梁湾采集样品.梅梁湾水草样品从移栽处采得.将采来的植物清洗干净,风干后带回实验室,70℃下烘干粉碎,混合均匀.样品经无机酸淋洗清除无机碳,然后在Finnigan MAT公司DEUAplus/xL型稳定同位素比值质谱计上测定稳定碳、氮同位素比值[18-19].样品中稳定碳、氮同位素以δ值的形式给出,计算公式为δX=[(R待测样品/R标准物质)-1]×103,其中X为13C或15N;R为13C/12C或15N/14N.稳定碳、氮同位素值分别以相对于国际标准的PDB和大气氮的δ值报道.每测定10个样品插入1个标准样品,并随机挑选1~2个样品进行复测.样品δ13C和δ15N测定精度为±0.3 ‰.
2004年11月至2005年10月每月采1次水样,对2个湖湾的水质指标进行测定,方法参照文献[20].
1.3 数据统计分析用统计软件SPSS 19.0进行2个湖湾稳定同位素的t检验分析,然后用单因素方差分析来判断水生植物生活型和季节变化.方差分析前先进行正态分布和方差齐性检验.以P<0.05作为差异显著水平.使用Origin Pro 8.0进行绘图.
2 结果 2.1 贡湖湾、梅梁湾水质和沉积物理化特征采样期间,梅梁湾年平均水深2.2m,平均透明度26cm;贡湖湾年平均水深2.0m,平均透明度58.1cm,水草区的透明度在6、12月可以见底.两湖区水深差异不显著,透明度存在极显著差异(P<0.01).显著性检验结果表明,梅梁湾营养指标水平显著高于贡湖湾(P<0.05).梅梁湾Chl.a浓度远高于贡湖湾,按照OECD(1982)标准,梅梁湾属于富营养型,贡湖湾属于中营养型[21](表 1).
| 表 1 贡湖湾、梅梁湾的水质和沉积物理化特征 Tab.1 Water and sediment quality parameters in Gonghu Bay and Meiliang Bay |
共测定10种水生植物,包括穗花狐尾藻、微齿眼子菜、金鱼藻、马来眼子菜、苦草、伊乐藻、野菱(Trapa incisa)、荇菜(Nymphoides peltatum)、凤眼莲(Eichhornia crassipes)和芦苇(Phragmites communis)的稳定碳、氮同位素值,不同水生植物种类之间、不同采样时间和采样点之间的稳定碳、氮同位素值不同(表 2).
| 表 2 贡湖湾、梅梁湾水生植物稳定碳、氮同位素 Tab.2 δ13C and δ15N of macrophytes in Gonghu Bay and Meiliang Bay |
调查期间,贡湖湾穗花狐尾藻、微齿眼子菜、马来眼子菜的δ13C 5月最高,8月最低,金鱼藻的δ13C 8月最高,11月最低.穗花狐尾藻的δ13C变化最大,5月为-12.92 ‰ ±0.64 ‰,8月降至-17.25 ‰ ±0.41 ‰,11月升至-15.69 ‰ ±0.12 ‰;其次是马来眼子菜,5月为-16.82 ‰ ±0.96 ‰,8月为-20.53 ‰ ±0.07 ‰,11月为-20.94 ‰ ±0.37 ‰;微齿眼子菜的δ13C 5、8与11月变化不大,分别为-20.26 ‰ ±0.47 ‰、-21.88 ‰ ±0.33 ‰和-20.95 ‰ ±0.66 ‰;金鱼藻的δ13C 5月为-21.14 ‰ ±0.90 ‰,8月为-20.59 ‰ ±0.10 ‰,11月最低,为-23.01 ‰ ±0.29 ‰,与黄亮等报道的梁子湖金鱼藻的δ13C(-21.44 ‰)比较接近[13];苦草和野菱11月的δ13C值比8月低,苦草的δ13C为-22.49 ‰ ±0.10 ‰ ~-21.48 ‰ ±0.02 ‰,与长湖苦草的δ13C (-22.32 ‰)相近,但野菱比涨渡湖菱的δ13C(-24.29 ‰)偏低(图 1).
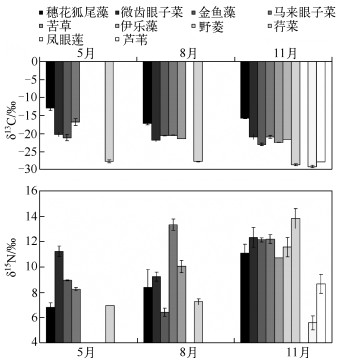
|
图 1 2005年贡湖湾水生植物稳定碳、氮同位素的季节变化 Fig.1 Temporal variations in δ13C and δ15N of aquatic plants from Gonghu Bay of Lake Taihu in 2005 (数据为平均值,误差线为标准差线,下同) (Values are means, error bars reflect standard deviation, the same below) |
微齿眼子菜、金鱼藻的δ15N从5月到8月呈下降趋势,8月到11月呈上升趋势;穗花狐尾藻的δ15N 5月最低,11月最高;马来眼子菜5月最低,8月最高;苦草、野菱5月没有数据,11月比8月高(图 1).
2.4 稳定碳、氮同位素值种类差异11月,贡湖湾芦苇、凤眼莲、野菱的δ13C偏低,微齿眼子菜、金鱼藻、马来眼子菜、苦草、伊乐藻的δ13C偏高,穗花狐尾藻的δ13C最高.梅梁湾中芦苇、凤眼莲、荇菜、苦草的δ13C偏低,马来眼子菜和穗花狐尾藻的偏高(图 2、3).
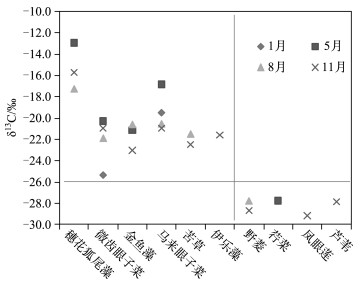
|
图 2 2005年贡湖水生植物稳定碳同位素值 Fig.2 δ13C of aquatic plant samples from Gonghu Bay of Lake Taihu in 2005 |

|
图 3 2005年11月贡湖湾(a)和梅梁湾(b)水生植物稳定碳、氮同位素值 Fig.3 δ13C and δ15N of aquatic plant samples from Gonghu Bay(a) and Meiliang Bay(b) of Lake Taihu in November of 2005 |
本研究中不同生态型植物间δ15N变化范围为5.59 ‰ ~16.14 ‰.在贡湖湾,5月穗花狐尾藻的δ15N最小(6.80 ‰),8月金鱼藻的δ15N最小(6.43 ‰),δ15N值最大为马来眼子菜的13.34 ‰,11月凤眼莲的δ15N值最小(5.59 ‰);在梅梁湾,11月凤眼莲的δ15N最大(16.14 ‰),最小为芦苇(8.52 ‰).
2.5 不同湖区稳定碳、氮同位素值的比较梅梁湾与贡湖湾2个湖区之间,穗花狐尾藻、苦草的δ13C差异显著(P<0.01),马来眼子菜、凤眼莲和芦苇的δ13C差异不显著(P>0.05);除芦苇的δ15N差异不显著外(P>0.05),穗花狐尾藻、苦草、马来眼子菜、凤眼莲的δ15N均有显著差异(P<0.01)(图 4).

|
图 4 2005年11月贡湖湾和梅梁湾中水生植物稳定碳、氮同位素值的比较 Fig.4 Comparison of δ13C and δ15N of aquatic plant samples in November of 2005 from Gonghu Bay and Meiliang Bay of Lake Taihu |
实验期间,贡湖湾和梅梁湾水体TN浓度均值分别为2.503和4.008mg/L;贡湖湾和梅梁湾水体TP浓度均值分别为0.094和0.1922mg/L.水体中TC、TN浓度的变化与沉水植物δ13C、δ15N的变化趋势一致.沉水植物δ13C、δ15N的变化不同也指示2个湖区水体环境出现明显分异[22-26].结合水体中TC、TN浓度的变化与沉水植物δ13C、δ15N变化可以减小外来污染的影响,更能直接体现湖泊水环境的变化,对湖泊生态变化的指示更有效[27-28].
沉积物中的TN和TC含量综合反映了湖泊的初级生产力,TP含量指示了流域营养物质的输入.TC、TN和TP含量可以反映人类活动的方式以及强度.梅梁湾表层沉积物中TC、TN和TP含量增加的原因是承接了来自无锡市的污水.工业废水和生活污水δ15N较高,累积到水生植物体内的δ15N也相应较高.贡湖湾水化学指标和水生植物稳定氮同位素值均明显低于梅梁湾,反映出2个湖区截然不同的同位素地球化学过程[29].
3.2 稳定碳同位素值的变化研究结果显示,水生植物δ13C值随时间、空间和种类的不同存在差异.10种水生植物的δ13C变化范围为-29.91 ‰ ±0.16 ‰ ~-12.92 ‰ ±0.64 ‰,与Keely等报道的水生植物δ13C一般在-50 ‰ ~-11 ‰范围内的结论相吻合[30].
穗花狐尾藻、微齿眼子菜、马来眼子菜的δ13C 5月最高,8月最低.这可能是因为5月植株刚长出不久,处于水面以下,8月植株生长茂盛,顶端漂浮于水面的缘故.水中CO2浓度较高,植株可直接利用游离CO2,导致δ13C降低;也可能是因为8月浮游藻类的生物量增大,与沉水植物之间形成碳源的竞争,导致水体中碳源不足,因而沉水植物没有选择性地吸收利用水体中的无机碳,弱化了沉水植物的碳分馏.
不同种类水生植物的δ13C存在差异.野菱、荇菜、凤眼莲、芦苇的δ13C值偏低,微齿眼子菜、苦草、马来眼子菜、穗花狐尾藻、金鱼藻、伊乐藻的δ13C值较高.菱、荇菜为浮叶植物,凤眼莲为漂浮植物,芦苇为挺水植物,微齿眼子菜、苦草、马来眼子菜、穗花狐尾藻、金鱼藻、伊乐藻为沉水植物.挺水植物和浮水植物的叶片暴露在大气中,大气CO2中的δ13C是影响其组成的关键因素之一,一般说来大气δ13C组成保持在-7.80 ‰左右且变化不大,因而挺水植物、浮水植物的δ13C值变化较小.由于CO2在水中的扩散仅是在空气中的10-4,而且浓度也比空气低(在15℃为6μmol).对于生长在水面以下的沉水植物,其在进行光合作用时,游离CO2是最容易利用的碳源[29],然而水中主要存在的无机碳离子形态为HCO3-,游离CO2浓度低,因而生长在其中的沉水植物可能会较多地利用HCO3-[30].研究发现,HCO3-比溶解态CO2更能富集δ13C[33],因此生长在水面以下的沉水植物比暴露在空气中的挺水植物及浮水植物的δ13C要高.并且由于沉水植物所处环境δ13C组成变化极大,导致沉水植物的δ13C变化较大,这在实验结果中得到验证.
本研究中同一时间、不同地点采集的同一种水生植物稳定碳同位素差异较大.两个湖区之间的狐尾藻、苦草δ13C值差异显著(P<0.01),这是由于沉水植物所利用的溶解无机碳的稳定碳同位素组成受许多环境因素影响,具有较大的变化范围,因而一种沉水植物生长在不同水体中就可能有不同的稳定碳同位素组成[34-35].梅梁湾受无锡市生活及工业污水影响较大,导致其富营养化程度比贡湖湾高以及水体中溶解无机碳浓度不同.由于植物从溶解无机碳中获得碳,溶解无机碳中δ13C越负,植物的δ13C也将越负,导致两个地方水生植物的稳定碳、氮同位素值有显著差异.
3.3 稳定氮同位素值的变化贡湖湾水生植物δ15N最高值基本都出现在11月,其次是5月或8月,可能原因为:一是与水体TN和总溶解氮浓度较高有关,水生植物δ15N值随水体中溶解无机氮浓度升高而升高[36-37];二是温度可能直接或间接影响同位素的分馏;三是水生植物对稳定氮同位素的选择吸收.当氮元素充足的时候,会优先选择利用14N,这样就会导致植物体内富集较低的15N[38].
梅梁湾的多数水生植物δ15N值显著高于贡湖湾,这与梅梁湾受无锡市生活及工业污水影响较大、富营养化化程度较高、水体TN浓度高于贡湖湾相一致[9].
不同生态型植物间δ15N值差异无规律可循.原因有以下几方面:一是水生植物按照生活型不同,吸收利用氮源的途径也不一样[39-40].沉水植物、挺水植物和浮叶植物能够从底泥和水体中吸收可利用氮源,但是漂浮植物只能从水体中吸收可利用氮源,这样就会导致吸收氮源含量不一样;二是水生植物可利用的氮源形式主要有铵态氮和硝态氮两种,但不同的植物对这2种氮源的吸收选择性不一样,从而导致2种氮源吸收比例不同,同时植物体吸收这2种氮源的生理机制不一样,从而产生较大分馏差异[41-43];三是不同环境中,环境因子的差异很大,这样就导致了环境中固氮细菌和消化细菌的活性不一样,产生的铵态氮和硝态氮也会相应出现差异,植物体吸收这些氮源时,稳定氮同位素值就会产生显著差异[10].
4 结论水生植物稳定碳、氮同位素值因季节、空间和种类而发生变化,总体上季节性变化规律不明显,空间变化有一定规律性:梅梁湾穗花狐尾藻、马来眼子菜、苦草、凤眼莲的δ15N明显高于贡湖湾,挺水植物芦苇的δ15N差异不显著,反映了梅梁湾较贡湖湾有较高的营养水平;贡湖湾穗花狐尾藻、苦草的δ13C值显著高于梅梁湾,其它种类没有显著差异.从种类特征来看,贡湖湾和梅梁湾中浮叶植物与挺水植物芦苇、凤眼莲、野菱的δ13C偏低,而微齿眼子菜、金鱼藻、马来眼子菜、苦草、伊乐藻、穗花狐尾藻等沉水植物的δ13C值较高,与它们所处的环境和碳源有关.
| [1] |
王兴民, 许秋瑾, 邢晓丽等. 水生高等植物对湖泊生态系统的影响. 山东科学, 2007, 20(2): 29-32. |
| [2] |
Benedict CR, Scott JR. Photosynthetic carbon metabolism of a marine grass. Plant Physiology, 1976, 57: 876-880. DOI:10.1104/pp.57.6.876 |
| [3] |
Benedict CR, Wong W. Fractionation of the stable isotopes of inorganic carbon by seagrasses. Plant Physiology, 1980, 65: 512-517. DOI:10.1104/pp.65.3.512 |
| [4] |
Heck KL, Able KW, Roman CT et al. Composition, abundance, biomass, and production of macrofauna in a new-England estuary-comparisons among eelgrass meadows and other nursery habitats. Estuaries, 1995, 18(2): 379-389. DOI:10.2307/1352320 |
| [5] |
王文林, 马婷, 李强等. 水生高等植物季相交替群落对富营养化水体净化效果调查. 环境监测管理与技术, 2006, 18(1): 16-19. |
| [6] |
Barko JW, James WF. Effects of submerged aquatic macrophytes on nutrient dynamics, sedimentation, and resuspension//The structuring role of submerged macrophytes in lakes. New York:Springer, 1998, 197-214. |
| [7] |
Fry B. Food web structure on Georges Bank northwestern Atlantic Ocean from stable carbon nitrogen and sulfur isotopic compositions. Limnology and Oceanography, 1988, 33(5): 1182-1190. DOI:10.4319/lo.1988.33.5.1182 |
| [8] |
Yoshioka T, Wada E, Hayashi H. A stable isotope study on seasonal food web dynamics in a eutrophic lake. Ecology, 1994, 75: 835-846. DOI:10.2307/1941739 |
| [9] |
Yoshii K, Melnik NG, Timoshkin OA et al. Stable isotope analyses of the pelagic food web in Lake Baikal. Limnology and Oceanography, 1999, 44(3): 502-511. DOI:10.4319/lo.1999.44.3.0502 |
| [10] |
Boon PI. Variations in the stable isotope composition of aquatic plants and their implications for food web analysis. Aquatic Botany, 1994, 48: 99-108. DOI:10.1016/0304-3770(94)90077-9 |
| [11] |
林清, 王绍令. 沉水植物稳定碳同位素组成及影响因素分析. 生态学报, 2001, 21(5): 806-809. |
| [12] |
陈毅风, 张军, 万国江. 贵州草海湖泊系统碳循环简单模式. 湖泊科学, 2001, 13(1): 22-27. DOI:10.18307/2001.0103 |
| [13] |
黄亮, 吴莹, 张经等. 长江中游若干湖泊水生植物体内C、N、P及分布. 地球学报, 2003, 24(6): 515-518. |
| [14] |
张润宇, 王立英, 吴丰昌等. 太湖春季沉积物间隙水中磷的分布特征及界面释放的影响. 生态学杂志, 2012, 31(4): 902-907. |
| [15] |
Chen YW, Qin BQ, Gao XY. Prediction of blue green algae bloom using stepwise multiple regression between algae & related environmental factors in Meiliang Bay, Lake Taihu. Journal of Lake Sciences, 2001, 13: 63-71. DOI:10.18307/20010110 |
| [16] |
Wen Z, Xie P, Xu J. Contributions of pelagic and benthic dietary sources to freshwater mussels:Evidence from stable carbon isotope analysis. Journal of Freshwater Ecology, 2009, 24: 425-430. DOI:10.1080/02705060.2009.9664314 |
| [17] |
温周瑞, 谢平, 徐军. 太湖贡湖湾虾类种类组成与时空分布特征. 湖泊科学, 2011, 23(6): 961-96. DOI:10.18307/2011.0620 |
| [18] |
蔡德陵. 黄河口区有机碳同位素地球化学研究. 中国科学:B辑, 1993, 23(10): 1105-1113. |
| [19] |
刘敏, 侯立军, 许世远等. 长江口潮滩有机质来源的C、N稳定同位素示踪. 地理学报, 2004, 59(6): 918-926. DOI:10.11821/xb200406015 |
| [20] |
温周瑞, 谢平. 太湖梅梁湾、贡湖湾水质与浮游甲壳动物密度季节变化. 长江大学学报:自然科学版, 2013(17): 36-41. |
| [21] |
Liu YQ, Xie P, Zhang DW et al. Seasonal dynamics of microcystins with associated biotic and abiotic parameters in two Bays of Lake Taihu, the third largest freshwater lake in China. Bulletin of Environmental Contamination and Toxicology, 2008, 80(1): 24-29. DOI:10.1007/s00128-007-9293-5 |
| [22] |
Cooper LW, Hopple JA, Bohlke JK et al. Stable carbon isotope ratio variations in marine macrophytes along intertidal gradients. Oecologia, 1988, 77: 238-241. DOI:10.1007/BF00379192 |
| [23] |
Hamilton SK, Lewis WM, Sippel SJ. Energy sources for aquatic animals in the Orinoco River flood plain:evidence from stable isotopes. Oecologia, 1992, 88: 324-330. |
| [24] |
Simenstad CA, Duggins DO, Quay PD. High turnover of inorganic carbon in kelp habits as a source of δ13C variability in marine food webs. Marine Biology, 1993, 116: 147-160. DOI:10.1007/BF00350742 |
| [25] |
Takahashi K, Yoshioka T, Wada E. Temporal variations in carbon isotope ratio of phytoplankton in a eutrophic lake. Journal of Plankton Research, 1990, 12: 799-808. DOI:10.1093/plankt/12.4.799 |
| [26] |
O'Leary MH. Carbon isotope fractionation in plants. Phytochemistry, 1981, 20: 553-567. DOI:10.1016/0031-9422(81)85134-5 |
| [27] |
Tichener RH, Lajtha K. Stable isotopes in ecology and environmental science. New Jersey: Blackwell Publish, 2007.
|
| [28] |
Farquhar GD. On the nature of carbon isotope discrimination in C4 species. Functional Plant Biology, 1983, 10: 205-226. |
| [29] |
Smith BN, Samuel E. Tow categories of 13C/12C taties for higher plants. Plant physiology, 1971, 47(3): 380-384. DOI:10.1104/pp.47.3.380 |
| [30] |
Keely JE, Sandquist DR. Carbon:Freshwater plants. Plant Cell Environment, 1992, 15: 1021-1035. DOI:10.1111/pce.1992.15.issue-9 |
| [31] |
Winter L. Short-term fixation of 14carbon by the submerged aquatic angiosperm Potamogeton pectinatus. Journal of Experimental Botany, 1978, 29(112): 1169-1172. |
| [32] |
Sand-Jemsen K. Photosynthetic carbon source of stream macrophytes. Journal of Experimental Botany, 1983, 29: 1169-1172. |
| [33] |
Mook WG, Bommerson SG, Staverman WH. Carbon isotope fraction between dissolved bicarbonate and gaseous carbon dioxide. Earth and Planetary Science Letters, 1974, 22: 169-176. DOI:10.1016/0012-821X(74)90078-8 |
| [34] |
Farquhar GD, Ball MC, Caemmerer S et al. Effect of salinity and humidity on δ13C value of halophytes-evidence for diffusional isotope fractionation determined by the ratio of intercellular/atmospheric partial pressure of CO2 under different environmental conditions. Oecologia, 1982, 52: 121-124. DOI:10.1007/BF00349020 |
| [35] |
Fry B, Parker PL. Animal diet in Texas seagrass meadows:δ13C evidence for the importance of benthic plants. Estuarine and Coastal Marine Science, 1979, 8: 499-509. DOI:10.1016/0302-3524(79)90031-8 |
| [36] |
Marconi M, Giordano M, Raven JA. Impact of taxonomy, geography, and depth on δ13C and δ15N variation in a large collection of macroalgae. Journal of Phycology, 2011, 47: 1023-1035. DOI:10.1111/j.1529-8817.2011.01045.x |
| [37] |
Graham MC. A study of carbon and nitrogen stable isotope and elemental ratios as potential indicators of source and fate of organic matter in sediments of the Forth Estuary Scotland. Estuarine, Coastal and Shelf Science, 2001, 52(3): 375-380. DOI:10.1006/ecss.2000.0742 |
| [38] |
徐军. 应用碳氮稳定性同位素探讨淡水湖泊的食物网结构和营养级关系[学位论文]. 武汉: 中国科学院水生生物研究所, 2005.
|
| [39] |
Hobson KA, Gloutney ML, Gibbs HL. Preservation of blood and tissue samples for stable-carbon and stable-nitrogen isotope analysis. Canadian Journal of Zoology, 1997, 75: 1720-1723. DOI:10.1139/z97-799 |
| [40] |
Toda H, Uemura Y, Okino T et al. Use of nitrogen stable isotope ratio of periphyton for monitoring nitrogen sources in a river system. Water Science and Technology, 2002, 46: 431-435. |
| [41] |
Fry B. Stable isotope ecology. New York: Springer, 2006.
|
| [42] |
Blindow I, Andersson G, Haregy A et al. Long term pattern of alternative stable states in two shallow eutrophic lakes. Freshwater Biology, 1993, 30(1): 159-167. DOI:10.1111/fwb.1993.30.issue-1 |
| [43] |
Madsen TV, Breinholt M. Effects of air contact on growth inorganic carbon sources and nitrogen uptake an amphibious freshwater macrophyte. Plant Physiology, 1995, 107: 149-154. DOI:10.1104/pp.107.1.149 |
 2016, Vol. 28
2016, Vol. 28 

