摘要
丝状绿藻过度增殖是影响草型清水态浅水湖泊中沉水植物生长及群落稳定的关键因素之一。日本沼虾(Macrobrachium nipponense)可摄食丝状绿藻,但又会通过扰动等途径增加水体营养盐,其在湖泊生态修复初始阶段对丝状绿藻的影响及其机理尚不清楚。本研究在春末夏初构建了含有密刺苦草(Vallisneria denseserrulata)和轮叶黑藻(Hydrilla verticillata)的沉水植物和丝状绿藻的处理系统,探讨了日本沼虾对两种丝状绿藻(水绵(Spirogyra sp.)和刚毛藻(Cladophora sp.))生长的影响及系统生态环境因子的响应。结果显示,引入日本沼虾显著降低了水绵和刚毛藻的盖度和生物量,减少了水体浮游藻类和附着藻类的生物量,降低了总氮和总磷浓度。尽管密刺苦草和轮叶黑藻二者对水绵和刚毛藻生物量的影响无差异显著,但在有虾存在的条件下,水体表面水绵盖度显著低于刚毛藻盖度。水绵有虾组中密刺苦草和轮叶黑藻叶片上的附着藻类生物量显著低于水绵无虾组,刚毛藻有虾组和刚毛藻无虾组附着藻生长趋势与水绵组一致。水绵有虾组的浮游藻类生物量及水体总氮浓度均显著低于刚毛藻有虾组,而无虾条件下两者无显著差异。本研究表明,春末夏初引入日本沼虾可降低丝状绿藻生物量和水体营养盐浓度,有助于维持水体的清水状态;然而,生长不同种类丝状绿藻的沉水植物清水态系统对日本沼虾的引入反应存在差异。
Abstract
The excessive proliferation of filamentous green algae has been identified as a key factor affecting the growth and community stability of submerged macrophytes in a clear water, macrophyte-dominated shallow lake. Macrobrachium nipponense grazes on filamentous green algae, but its presence can increase water nutrient levels if it disturbs the sediment. However, the effects of M. nipponense on lakes in the early stages of restoration remain unknown, particularly its impact on filamentous green algae. To address this knowledge gap, a composite system comprising two submerged macrophytes (Vallisneria denseserrulata and Hydrilla verticillata) and filamentous green algae treatments was established in late spring and early summer. This system was utilised to investigate the influence of M. nipponense on the proliferation of filamentous green algae (Spirogyra sp. and Cladophora sp.) and the associated environmental factors. The results obtained demonstrate that M. nipponense exerts a significant effect on the reduction of Spirogyra and Cladophora cover and biomass. Furthermore, M. nipponense has been shown to reduce phytoplankton and epiphyton biomass, as well as total nitrogen and total phosphorus concentrations. Although the growth type of submerged macrophytes did not have a significant effect on Spirogyra or Cladophora biomass, the presence of M. nipponense led to a greater reduction in Spirogyra cover than Cladophora cover. Furthermore, the presence of M. nipponense led to a decline in epiphyton biomass on the leaves of V. denseserrulata and H. verticillata. Significantly, the impact of M. nipponense on phytoplankton biomass and total nitrogen concentrations was more pronounced in Spirogyra treatment compared to the Cladophora treatment. In the absence of shrimp, no substantial disparities were observed between the two treatments. These findings suggest that the introduction of M. nipponense into shallow lakes during the late spring and early summer months can lead to a decline in filamentous green algal biomass and nutrient concentrations, thereby enhancing water quality. However, the responses of clear water systems with submerged macrophytes and various filamentous green algae to the introduction of M. nipponense vary.
近年来,以沉水植物恢复为核心的生物操纵技术在我国许多城市中小型富营养化湖泊中得到了成功应用,有效提升了湖泊水质和景观[1-3]。然而,重建初期的湖泊在春季和秋季经常会出现丝状绿藻(filamentous green algae,FGA)暴发生长[4-6]。丝状绿藻缠绕在沉水植物叶片上,严重时会在沉水植物上方形成藻垫(algae mats)[7-8],腐烂时会释放有害物质和营养盐,不仅会抑制沉水植物生长,还可能逆转生态修复效果[6,9-11]。因此,丝状绿藻的防治受到了广泛关注[12-15],但有效管控其暴发生长以及衰亡时的负面影响仍很难。常用的化学药剂消杀方法易导致二次污染且会伤害沉水植物[14]。因此,探索安全有效的丝状绿藻防治方法,对于保障沉水植物重建工程的长期效果至关重要。
多项研究表明,生物牧食作用对丝状绿藻的生长具有直接或间接影响[15-18],但是目前尚无原位应用生物牧食措施控制丝状绿藻暴发生长的案例报道。草食性鱼类以及螺和虾等能通过刮取或收集方式直接牧食丝状绿藻控制其增长[15-19]。然而,一些研究者认为水生草食动物对丝状藻类的控制仅在丝状藻生长的早期指数生长阶段有效[20],而成熟的丝状藻丝就难以被食用[21]。丝状绿藻的发生和持续还可能和藻类与食草动物密度之间的不匹配[22]或关键食草动物密度降低导致的自上而下控制减弱有关。不同生长型沉水植物与丝状绿藻的相互作用存在差异,也需进一步研究大型植物与丝状绿藻间的互作机制[23]。丝状绿藻(如水绵属(Spirogyra)和刚毛藻属(Cladophora))在形态、细胞结构、营养价值和适口性上存在显著差异[6,21],可能会影响水生动物对其的牧食选择性[24]。部分丝状绿藻营养价值低,甚至含有有毒脂肪酸[21,25],限制了以这些藻类为食的牧食者(如沟虾Gammarus)的生存[26]。此外,不同丝状绿藻的最适生长温度不同[6],它们会发生季节性枯萎甚至死亡,当这些藻类生长高峰期与食草性水生动物的牧食高峰期不同步时,食草性动物对丝状绿藻类的牧食就会受到限制。因此,针对丝状绿藻牧食控制中存在的生长阶段敏感性、种间选择性等问题,进一步探讨在季节转换窗口期(春末夏初)对不同丝状绿藻的生长及腐烂产生负面效应的控制效果,有利于维持水质。
日本沼虾(Macrobrachium nipponense)在我国淡水生态系统中广泛分布,其生命周期与大型沉水植物紧密相关[27-28]。基于太湖、武湖的日本沼虾食性研究发现[29-30],植物碎片、有机碎屑、水生无脊椎动物是其主要的食物。近年发现其对丝状绿藻的牧食能力较强[17,31],对于硅藻等附着藻类没有强烈的摄食需求,这使得系统中丝状绿藻生物量减少,而叶片上附着藻类生物量增加[31]。此外,日本沼虾的挖掘行为可能扰动沉积物,高密度下可导致水体浊度升高[18,32],并影响刺苦草(Vallisneria spinulosa)生长策略,最终促使浅水湖泊生态系统由清水态向浊水态转变。
本研究聚焦浅水湖泊沉水植被重建初期丝状绿藻暴发的生态防控问题。尽管研究已证实日本沼虾对丝状绿藻生长的抑制作用,但对其在不同丝状绿藻种类间的摄食差异及在不同生长型的沉水植物条件下的作用效果尚认识不足。鉴于丝状绿藻在春季往往大量繁殖,而夏季高温时会变黄腐烂形成二次污染[33-35],因此在沉水植被重建初期需警惕并有效控制丝状绿藻暴发性生长。基于我国浅水湖泊沉水植物重建常用草甸型密刺苦草(Vallisneria denseserrulata)和冠层型轮叶黑藻(Hydrilla verticillata)作为先锋种[36-38],而水绵和刚毛藻在重建初期易大量繁殖[6,39],二者作为先锋种构建的差异化生境可能对丝状绿藻产生特异性抑制。由此本研究提出以下假设:(1)日本沼虾对水绵和刚毛藻的牧食能力存在差异,导致系统生态环境因子响应不同;(2)不同生长型沉水植物对水绵和刚毛藻生长的影响存在差异,影响日本沼虾对丝状绿藻的控制效果。为验证上述假设,本研究在春末夏初构建含不同沉水植物和丝状绿藻的组合系统,探讨日本沼虾对两种丝状绿藻生长的影响及系统内浮游藻类、附着藻类和理化因子的响应变化。
1 材料与方法
1.1 实验材料
密刺苦草和轮叶黑藻均采集自湖北省武汉市沙湖。水绵(Spirogyra sp.)和刚毛藻(Cladophora sp.)为室外温室中培养的藻类。底泥采自武汉沙湖,经自然风干、充分混匀并去除大块杂质后储存备用。日本沼虾购买自当地水产养殖基地,并在含有沉水植物密刺苦草和轮叶黑藻的室外水桶中自然培育两周。选取体重均匀的个体(平均体重为(0.19±0.02)g)进行实验。实验前,对日本沼虾进行24 h的饥饿处理。
1.2 实验设计
在12个聚乙烯圆形大桶(上部直径80 cm,底部直径70 cm,高85 cm)中开展实验,桶内铺设约25 cm厚的底泥(总氮含量为1.90 mg/g,总磷含量为0.52 mg/g)。桶放置于带顶棚的室外实验水池中。每桶加入250 L曝气48 h后的自来水(总氮浓度为0.78 mg/L,总磷浓度为0.08 mg/L),并在桶中央设置200目(孔径为75 μm)尼龙网,将桶分为两部分,分别种植密刺苦草和轮叶黑藻(图1)。
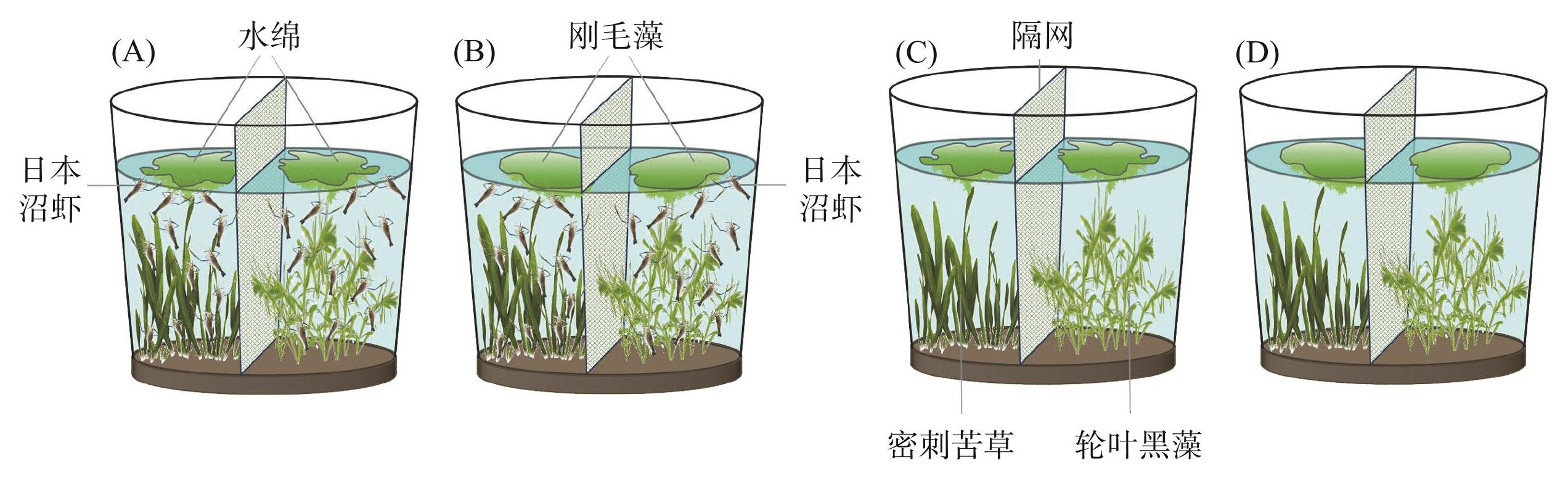
图1受控实验设计示意图:(A):水绵有虾组;(B):刚毛藻有虾组;(C):水绵无虾组; (D):刚毛藻无虾组(每个处理组设置3个重复)
Fig.1Schematic diagram of experimental design: (A) : the Spirogyra with Macrobrachium nipponense treatment; (B) : the Cladophora with M. nipponense treatment; (C) : the Spirogyra without M. nipponense treatment; (D) : the Cladophora without M. nipponense treatment (Setting 3 replicates per treatment)
加水静置48 h后,每桶隔网两侧分别种植50株高约50 cm的密刺苦草和轮叶黑藻(均带根),每侧各50株,形成12个密刺苦草和轮叶黑藻清水态系统。自然生长一周,随后在其中6个桶的两侧各加入100.0 g(鲜重,约0.8 g/L)水绵,另外6个桶的两侧则各加入100 g刚毛藻(图1)。在实验组每桶的密刺苦草侧和轮叶黑藻侧分别投放8只日本沼虾(生物量约12.00 g/m3,约7.00 g/m2)(图1)。实验期间,如发现有虾死亡,用同等大小的虾替换。
实验于2022年5月20日-7月20日间开展,共61 d。实验桶置于透明有机玻璃顶棚下,以自然光照为光源。实验期间,每10 d使用YSI设备测量一次水温,含初始值共记录7次数据,温度分别为:(19.9±0.5)、(27.5±0.3)、(26.9±0.7)、(29.7±0.3)、(32.4±0.3)、(32.5±0.3)和(30.7±0.4)℃。
1.3 采样与分析方法
水质理化指标监测:每10 d从各桶中采集表层下约10 cm处的水样250 mL,用于测定总氮(TN)、总磷(TP)和叶绿素a(Chl.a)浓度。参考《水和废水监测分析方法》(第四版)[40],TN采用碱性过硫酸钾消解紫外分光光度法测定,TP采用过硫酸钾消解紫外分光光度法测定,Chl.a则通过90%丙酮避光提取后用分光光度法测定。
植物生物量指标:(1)附着藻类生物量:分析附着生物群落生物量的两个主要指标是Chl.a和无灰干重[41]。Chl.a代表群落中自养(即有活力的藻类)部分,而无灰干重代表自养和异养(即真菌、原生动物、细菌等)部分的总和[41]。因此,本研究中附着藻类生物量以Chl.a计,附着藻类取样方法参考文献[15,42]。每隔10 d,从每个实验桶中随机选取5片密刺苦草叶片和5个类似长度的黑藻茎(带叶片),分别置于含有300 mL纯水的自封袋中。通过150 r/min的摇床处理5 min以去除叶片上的附生藻类,再用软毛刷轻轻刷洗叶片以去除残留的附着藻类,然后取50 ml混合液,经0.45 μm孔径的醋酸纤维滤膜过滤,测定Chl.a含量[40]。同时,将密刺苦草叶片和脱落的轮叶黑藻叶片分别贴于画有1cm×1cm方格的白纸上,拍照后导入AutoCAD软件计算叶片面积。(2)丝状绿藻指标:实验结束时,对水体表面的丝状绿藻进行拍照,并使用AutoCAD软件计算其盖度。同时,收集各桶中的丝状绿藻,测量其湿重[15]。(3)沉水植物指标:实验结束后,拔出每个实验桶中的密刺苦草和轮叶黑藻,清洗干净并沥干后,测定其湿重[15]。
水生动物指标:在实验周期内,每日监测日本沼虾是否有死亡,如有则替换个体类似大小的虾。最后1次采样时,对所有虾进行捕获,记录数量及体重。结果显示,水绵苦草组虾体重平均值为0.19 g/只,刚毛藻苦草组为0.20 g/只,水绵黑藻组为0.20 g/只和刚毛藻黑藻组为0.19 g/只,各组中虾的数量及体重均值无显著差异。
1.4 数据处理与分析
为探究加入日本沼虾后不同处理组对丝状绿藻生物量和盖度、沉水植物生物量的影响是否存在显著差异,首先利用Shapiro-Wilk test验证数据的正态分布和Levene's test验证方差齐性,符合正态分布和方差齐性的采用单因素方差分析(one-way ANOVA),组间差异显著则应用Bonferroni's tests进行多重比较。若数据在对数转换、平方根转换后仍不齐时采用Welch's ANOVA,组间存在差异显著时用未假定方差齐性的Games-Howell tests进行多重比较[43]。
针对水质理化指标、沉水植物叶片上附着藻类及浮游藻类指标随时间的变化趋势,本研究运用重复测量方差分析(RM-ANOVA),以时间为重复因子。在执行方差分析前,利用Shapiro-Wilk 检验验证数据的正态分布状况,运用Levene's 检验验证数据的方差齐性。同时,数据分析前还进行了Mauchly's 球形检验,以评估是否遵循球形假设。如果球形假设不成立,采用Greenhouse-Geisser系数对结果进行校正[44]。组间差异显著时采用Bonferroni's tests进行多重比较。若数据在对数转换、平方根转换后仍不齐时,组间差异显著时用未假定方差齐性Games-Howell tests进行多重比较[43]。
所有统计分析均通过SPSS 27.0软件(SPSS,USA)完成。数据以平均值±标准差形式呈现。组间存在显著性差异(P<0.05)的,在图中以不同小写英文字母标注。
2 结果与分析
2.1 藻类生长的变化
2.1.1 丝状绿藻
实验结束时,水绵无虾组和刚毛藻无虾组的丝状绿藻生物量均由0.8 g/L降至0.4 g/L以下,而水绵有虾组和刚毛藻有虾组的丝状绿藻的生物量(one-way ANOVA,df=7,F=22.0,P<0.01,图2A)和盖度(Welch's ANOVA,df =7,F=529.8,P<0.01,图2B)均下降的更低。水绵有虾组和刚毛藻有虾组中的水绵和刚毛藻的生物量显著低于无虾组(Bonferroni's tests,P<0.01,图2A),且水绵和刚毛藻的生物量之间无差异;而水绵有虾组中水绵盖度显著低于无虾组(Games-Howell tests,P<0.01,图2B),但刚毛藻有虾组和无虾组间刚毛藻盖度无显著差异,水绵有虾组水绵的盖度显著小于刚毛藻有虾组刚毛藻的盖度(Games-Howell tests,P<0.01,图2B),表明加入日本沼虾会显著抑制水绵和刚毛藻的生长。而对于水绵和刚毛藻,在有虾和无虾条件下,沉水植物种类对其生物量和盖度的影响均不显著(图2)。
2.1.2 附着藻类
重复测量方差分析结果表明,不同处理组植物叶片上的附着藻类生物量有显著差异(RM-ANOVA,df=7,F=83.5,P<0.01,图3)。比较水绵无虾组和水绵有虾组发现,有虾组密刺苦草和轮叶黑藻叶片上的附着藻类生物量均显著低于无虾组(Games-Howell tests,P<0.01,图3A),添加刚毛藻系统中附着藻类生物量的变化趋势与添加水绵系统相同(图3B)。水绵无虾组和刚毛藻无虾组附着藻类生物量均随着时间呈升高趋势;水绵有虾组和刚毛藻有虾组附着藻类生物量先升高后降低(图3)。
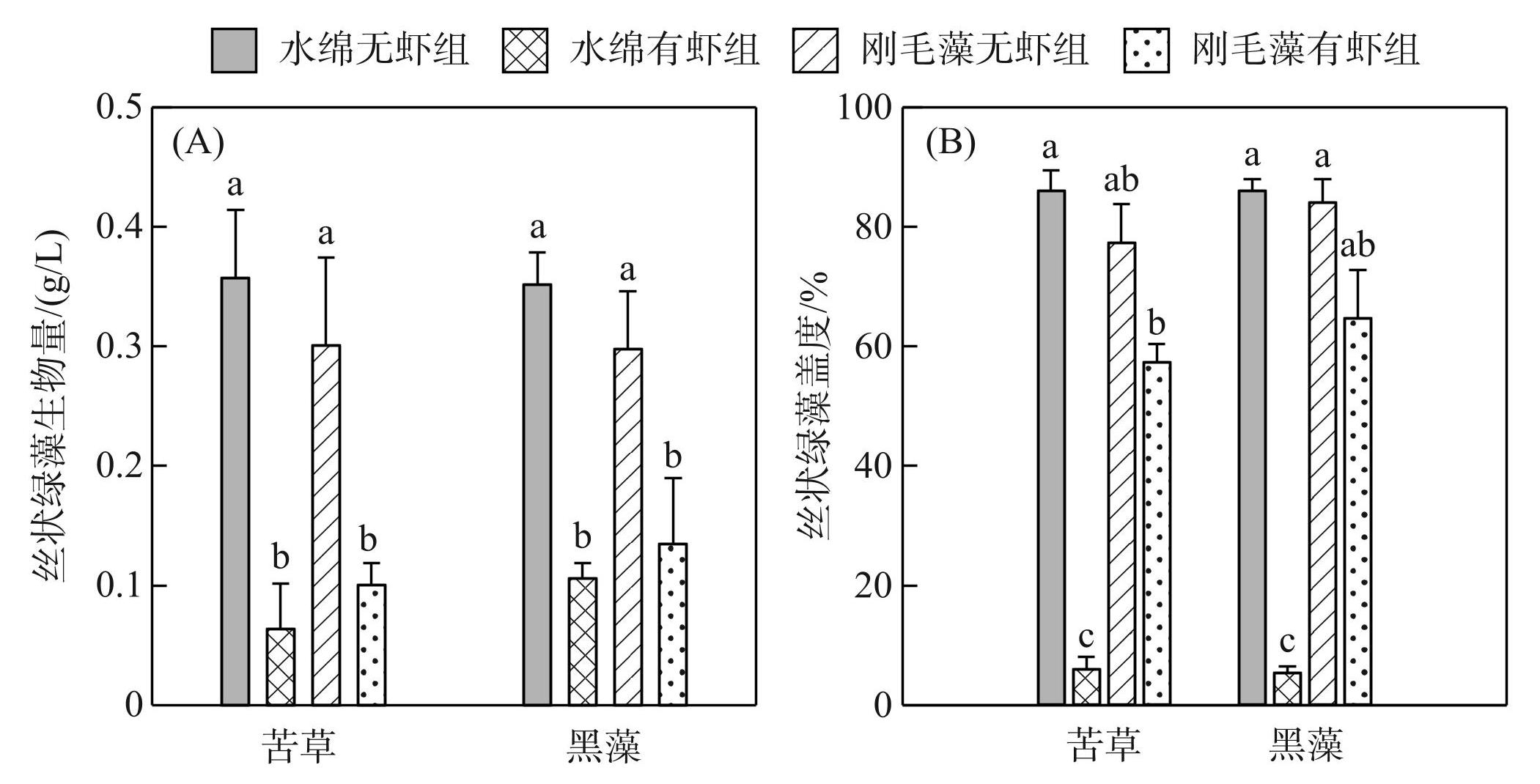
图2实验结束时不同处理组水绵和刚毛藻的生物量(A)和盖度(B)均值 (相同小写字母表示组间差异不显著,P>0.05;下同)
Fig.2Mean (±SD, n=3) biomass (A) and surface coverage (B) of filamentous green algae in different treatments at the end of the experiment (The same lowercase letter indicate no significant differences between treatments at P >0.05; the same below)
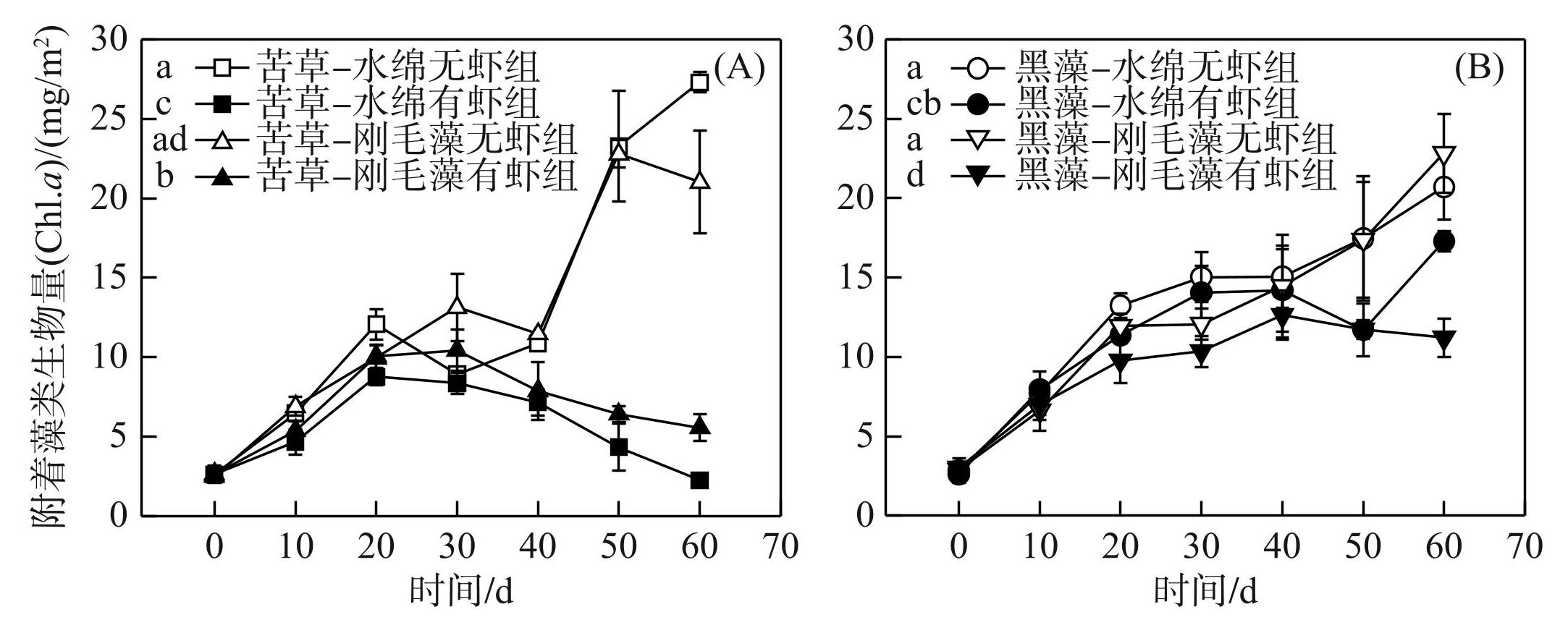
图3不同处理组水体沉水植物叶片上附着藻类生物量(叶绿素a)的动态变化 (A:不同处理组密刺苦草叶片上附着藻类生物量变化;B:不同处理组轮叶黑藻叶片上附着藻类生物量变化)
Fig.3Dynamics of epiphyton biomass (Chl.a) on the leaf of submerged macrophytes in different treatments (A: epiphyton biomass on the leaf of Vallisneria denseserrulata; B: epiphyton biomass on the leaf of Hydrilla verticillata in the different treatments)
2.1.3 浮游藻类
不同处理组水体中浮游藻类生物量有显著差异(RM-ANOVA,df=3,F=246.0,P<0.01,图4)。水绵有虾组和刚毛藻有虾组浮游藻类的生物量均显著低于无虾组(Bonferroni's tests,P<0.01,图4);而水绵有虾组中浮游藻类生物量显著低于刚毛藻有虾组(Bonferroni's tests,P<0.01,图4),水绵无虾组和刚毛藻无虾组浮游藻类的生物量无显著区别。
2.2 沉水植物变化
实验结束时,不同处理组之间沉水植物的生物量差异显著(密刺苦草和轮叶黑藻分开比较:Welch's ANOVA,df=7,F=30.1,P<0.01,图5A;密刺苦草和轮叶黑藻合并比较:one-way ANOVA,df=3,F=9.1,P<0.01,图5B)。对于密刺苦草或轮叶黑藻,不同处理组间其生物量均无显著差异(图5A)。水绵无虾组的密刺苦草和轮叶黑藻总生物量显著低于水绵有虾组(P<0.05,图5B),而刚毛藻无虾组的密刺苦草和轮叶黑藻总生物量均值低于刚毛藻有虾组,但无显著区别。
2.3 水体总氮和总磷浓度变化
不同处理组间水体TN和TP浓度均差异显著(RM-ANOVAs,df=3,FTN=55.7,FTP=31.4,PTN<0.01,PTP<0.01,图6)。有虾组水体的TN浓度均显著低于无虾组(Bonferroni's tests,P<0.05,图6A);而水绵有虾组水体中TN浓度显著低于刚毛藻有虾组(Bonferroni's tests,P<0.01,图6A),水绵无虾组和刚毛藻无虾组间水体TN浓度无显著差异。
水绵有虾组水体的TP浓度显著低于水绵无虾组(P<0.01,图6B),刚毛藻有虾组水体的TP浓度显著低于刚毛藻无虾组(P<0.01,图6B);而水绵有虾组水体的TP浓度显著低于刚毛藻有虾组(Bonferroni's tests,P<0.01,图6B),水绵无虾组水体的TP浓度显著低于刚毛藻无虾组(Bonferroni's tests,P<0.05,图6B)。
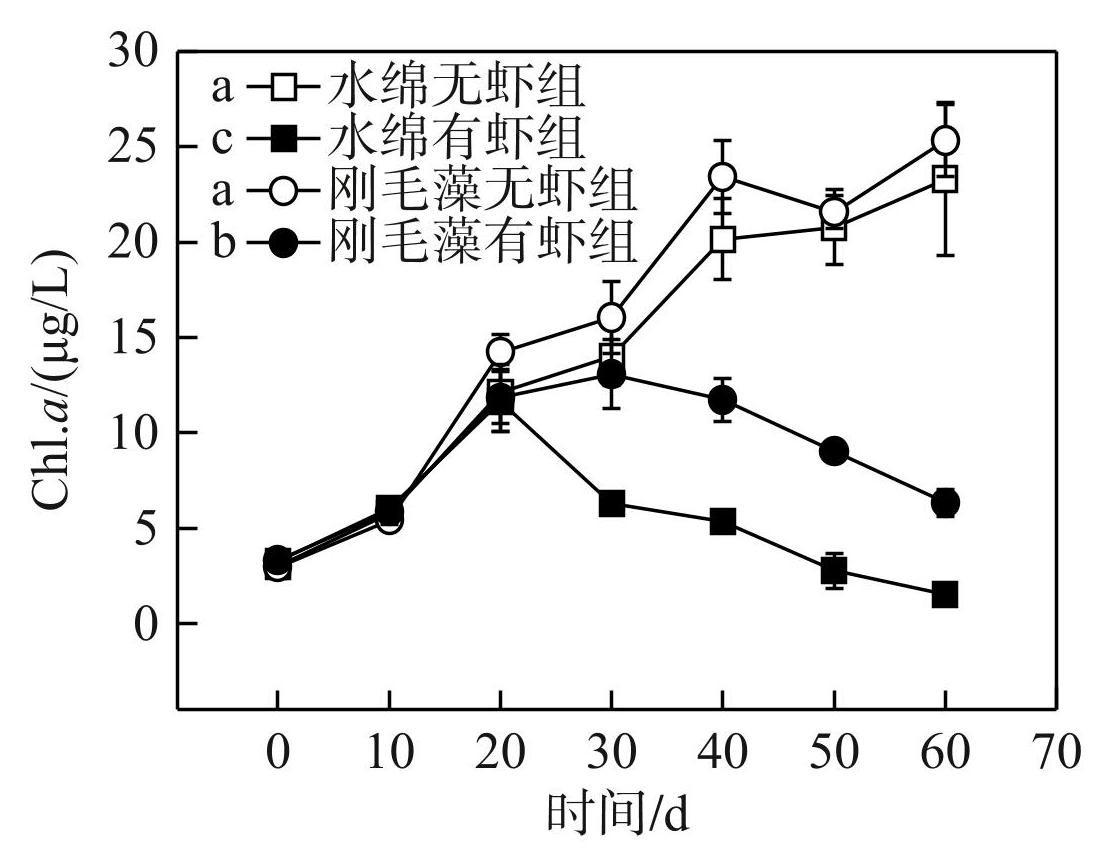
图4不同处理组浮游藻类生物量 (叶绿素a)的动态变化
Fig.4Dynamics of phytoplankton biomass (Chl.a) in the different treatments
3 讨论
本研究表明,引入日本沼虾能够显著降低草型清水态系统中水绵和刚毛藻的盖度和生物量,同时会降低浮游藻类和附着藻类的生物量,并减少系统中的TN和TP。尽管沉水植物种类对水绵和刚毛藻生物量的影响不显著,但在日本沼虾存在的条件下,系统中水绵盖度显著低于刚毛藻。进一步观察表明,水绵有虾组的浮游藻类生物量及TN、TP浓度均显著低于刚毛藻有虾组;水绵无虾组与刚毛藻无虾组之间浮游藻类生物量和TN、TP浓度无显著差异。此外,本研究还发现未引入日本沼虾的处理组中水绵和刚毛藻的生物量减少超过50%,其原因可能主要是研究期间水温从19.9℃快速上升并在多数时间超过30℃,导致水绵和刚毛藻生长受限,部分发生黄化并发生腐烂[33-35]。
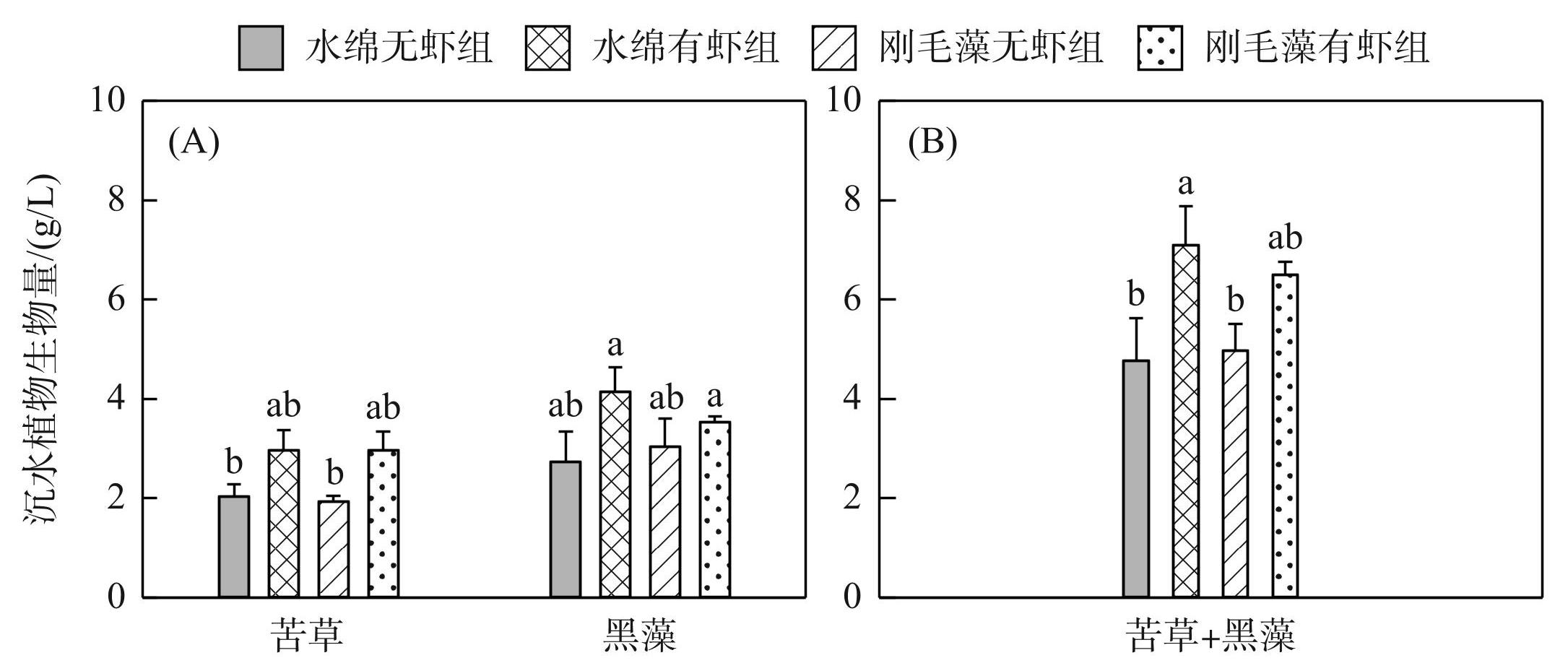
图5实验结束时不同处理组密刺苦草和轮叶黑藻的生物量均值 (A:密刺苦草和轮叶黑藻分开比较;B:密刺苦草和轮叶黑藻合并比较)
Fig.5Mean (±SD, n=3) biomass of V. denseserrulata and H. verticillata in different treatments at the end of the experiment (A: Biomass of V. denseserrulata and H. verticillata in different treatments respectively; B: Total submerged macrophytes biomass (V. denseserrulata + H. verticillate) in different treatments)
日本沼虾显著降低了水绵和刚毛藻在密刺苦草与轮叶黑藻系统中的盖度和生物量,同时减少了沉水植物叶片表面附着藻类的生物量,表明其对藻类具有显著的控制效应。先前研究显示,杂食性虾能通过直接摄食减少附着藻类生物量,且对丝状绿藻的影响程度与虾的生物量相关。例如,日本沼虾生物量达9.8 g/m2时丝状绿藻消失[18],中华锯齿米虾(Neocaridina denticulata sinensis)、Atya spp.、Xiphocaris elongata等也能够限制丝状绿藻的生长[45-46]。本研究中,日本沼虾的添加导致水绵和刚毛藻生物量及盖度显著下降,且趋势一致,证实日本沼虾对两种丝状绿藻均具有显著的控制作用。Machado等[47]发现,尽管散束刚毛藻(Cladophora vagabunda)的蛋白质和脂肪酸含量高于水绵(Spirogyra sp.),但仅饲喂水绵组的鱼体重略有增加,表明不同丝状绿藻的营养价值对于水生动物可能均较低。本研究中,实验结束时不同处理组日本沼虾的生物量无显著差异,可能表明水绵与刚毛藻对日本沼虾的营养贡献相似。由于本实验使用的成年日本沼虾,且在实验过程中有少量日本沼虾死亡现象,可能会影响关于水绵和刚毛藻对日本沼虾生长的营养价值分析。鉴于水绵与刚毛藻在形态、细胞结构及营养价值上存在差异,其对日本沼虾牧食选择性的影响机理需进一步探究。

图6不同处理组水体TN(A)和TP(B)浓度的动态变化
Fig.6Dynamics of TN (A) and TP (B) concentrations in water of different treatments
添加日本沼虾还显著降低了水体的氮、磷浓度,推测其原因为日本沼虾对藻类的利用促进了沉水植物生长(图5B),进而增强了对营养盐的吸收,尤其是在水绵组的净水效果更好(图6)。然而,一些研究表明引入草食性动物,如日本沼虾、中华锯齿米虾、黄尾鲴(Xenocypris davidi)、光倒刺鲃(Spinibarbus hollandi)和椭圆萝卜螺(Radix swinhoei)等,虽能抑制丝状绿藻生长,却往往会导致水体氮、磷浓度上升[15,24,45,48]。中华锯齿米虾亦能减少苦草叶片附着藻类生物量,促进密刺苦草生长,但是造成水体的浮游藻类、TP显著增加[45]。低密度、高比例(3∶1)的光倒刺鲃和鲢(Hypophthalmichthys molitrix)会抑制水绵生长,而高密度(80 g/m3)投放则会导致水质恶化和浮游藻类生物量增加[48]。对比分析表明,日本沼虾对水体营养盐影响的作用机制可能受沉水植物生物量的调控,在本研究中沉水植物生物量(湿重>2 kg/m2)远高于文献报道的实验中的沉水植物生物量(湿重<1 kg/m2)[18],较高的沉水植物生物量可能有效抑制了虾对沉积物的扰动作用,从而导致本研究中水体营养盐的动态变化与上述研究的结果存在差异。综上,杂食性水生动物控制丝状绿藻的同时对水质影响具有复杂性,其效果受水体中沉水植物生物量、营养负荷本底值及动物生物量影响,这可能是限制其在实践中应用的原因之一。
在本研究中,直立型轮叶黑藻与莲座型密刺苦草对水绵、刚毛藻的生长影响无显著差异。先前研究显示,丝状绿藻和丝状蓝藻(如转板藻(Mougeotia sp.)、水绵、鞘藻属(Oedogonium)、颤藻(Oscillatoria sp.))的密度与基质类型相关,例如不同形态的沉水植物物理复杂性不同,影响了丝状藻类的附着能力[23,49-51],其中微齿眼子菜(Potamogeton maackianus)能促进丝状绿藻生长[49];五刺金鱼藻(Ceratophyllum oryzetorum)、菹草(Potamogeton crispus)和轮叶黑藻有利于丝状颤藻生长,而马来眼子菜(Potamogeton malaianus)则会抑制颤藻的生长和对磷的吸收,但穗状狐尾藻(Myriophyllum spicatum)不会对颤藻的生长产生影响[23]。沉水植物对丝状绿藻的影响也与植物密度相关,例如苦草(V. natans)密度增加会抑制丝状绿藻的生长[49]。但是,Wolters等[51]指出,在人工植物上,结构复杂的附生基质覆盖面积大于简单结构基质,但在活体植物上这一现象并不明显,他们认为化感物质、养分和溶解性无机碳的竞争以及CaCO3沉积等因素可能比植物结构更为关键。此外,沉水植物能通过占据水底生态位,如直立型轮叶黑藻遮挡阳光,减少水下光照,最终可能会抑制丝状绿藻生长;而莲座型密刺苦草在水底形成密集覆盖层,可能会阻止丝状绿藻与底泥接触。在本研究中,两种植物共同生长,实验系统排除了化感作用和竞争对丝状绿藻的影响,两种沉水植物尽管生长型不同,但密度均较高且盖度相似,因此其在物理遮盖上对丝状绿藻的影响相似,可能是导致两种植物对水绵、刚毛藻的影响无差异的主要原因。
综上所述,日本沼虾能够通过牧食等方式降低水绵和刚毛藻以及浮游藻类的生物量,促进沉水植物生长,降低水体营养盐浓度。但是,日本沼虾对藻类控制和改善水质的效果受水体营养盐负荷、温度及沉水植物种类和生物量等因素影响[6,23,49]。日本沼虾的投放时机可能是关键,早期干预效果会更佳[20]。因此,在湖泊生态修复初期沉水植物生长到较高盖度时及时引入日本沼虾会减少丝状绿藻、附着藻类和浮游藻类对沉水植物的竞争,预防丝状绿藻类暴发生长,有利于维持浅水生态系统的健康与稳定。
4 结论
1)日本沼虾引入后会显著降低水体中水绵和刚毛藻的盖度和生物量,同时会显著降低浮游藻类和附着藻类的生物量,并减少系统中的TN和TP,有利于系统维持草型清水态。
2)密刺苦草和轮叶黑藻两种沉水植物对水绵和刚毛藻生长的影响无显著差异。
3)日本沼虾存在时,水绵组的浮游藻类生物量及TN、TP浓度均显著低于刚毛藻组;而在无虾条件下,水绵与刚毛藻组在浮游藻类生物量和TN、TP浓度上无显著差异,表明生长不同种类丝状绿藻的沉水植物清水态系统对日本沼虾的响应存在差异。
