摘要
富营养化削弱了湖泊原有的生态和景观功能,湖泊的污染控制和生态恢复已成为人们关注和研究焦点之一。随着富营养化治理措施的实施,湖泊浮游生物群落结构也会发生相应变化。研究湖泊生态修复前、后浮游生物群落结构的变化有助于评估湖泊生态修复效果。本研究以南京市玄武湖生态工程试验区(修复区)与未修复区为研究地点,分别对两区的浮游生物群落结构进行了季度调查,并分析了浮游生物群落结构与环境影响因子的关系。调查结果表明,浮游植物共包括8门85种,以绿藻门、硅藻门为主,浮游动物共3门48种,以轮虫为主。未修复区浮游动物、浮游植物丰度(6.43~396.37 ind./L、1.36×106~1.18×107 cells/L)与生物量(0.07~2.10 mg/L、0.45~21.73 mg/L)均高于修复区(3.20~57.53 ind./L、1.27×106~3.23×106 cells/L、0.04~0.35 mg/L、0.45~9.20 mg/L),这表明修复区大型沉水植物为主要初级生产者的生态系统结构对浮游生物的群落结构具有较大的影响。浮游生物总丰度、总生物量均为夏、秋季高于春季,冬季最低,表明浮游生物群落有明显的季节变化规律。此外,修复区浮游植物物种数、生物多样性指数均高于未修复区。冗余分析表明,蓝藻门、黄藻门与pH、水温、亚硝态氮呈现正相关关系,与透明度、溶解氧呈高度负相关关系;浮游动物与水温呈正相关关系,与总氮、溶解氧呈负相关关系。上述研究结果可为湖泊生态调控与维护提供参考依据。
Abstract
Eutrophication has markedly compromised lakes' ecological integrity and aesthetic appeal, thereby stimulating an intensified emphasis on lake management and ecological rehabilitation efforts. Implementation eutrophication management strategies is expected to induce shifts in the plankton community structure. Monitoring these changes is instrumental in assessing the efficacy of ecological restoration efforts. We conducted a seasonal investigation of the plankton community structure across the restored, lotus-dominated, and unrestored areas of Lake Xuanwu in Nanjing over four distinct seasons. Additionally, we analyzed the correlation between plankton community structure and various environmental parameters. Our findings revealed a diverse phytoplankton community comprising 85 species across 8 phyla, with Chlorophyta and Bacillariophyta predominating. The zooplankton community consisted of 48 species within 3 phyla. A comparative analysis showed higher abundance (6.43-396.37 ind./L, 1.36×106-1.18×107 cells/L) and biomass (0.07-2.10 mg/L, 0.45-21.73 mg/L) of phytoplankton and zooplankton in the unrestored basin compared to the restored basin (3.20-57.53 ind./L, 1.27×106-3.23×106 cells/L, 0.04-0.35 mg/L, 0.45-9.20 mg/L) suggesting that restoration efforts, particularly the reintroduction of submerged vegetation, have a significant impact on both the abundance and the community composition of phytoplankton and zooplankton. Seasonal variations were evident, with plankton abundance and biomass peaking in the summer and autumn and reaching their nadir in winter, indicative of dynamic shifts in the plankton community structure throughout the year. Furthermore, the number of phytoplankton species and the biodiversity index in the restored basin were higher than those in the unrestored basin. Redundancy analysis indicated that Cyanophyta and Xanthophyta exhibited positive correlations with pH, water temperature, and nitrite, while they were highly negatively correlated with transparency and dissolved oxygen. Additionally, zooplankton displayed a positive association with water temperature and a negative association with total nitrogen and dissolved oxygen. These insights offer valuable guidance for the ecological management and conservation of shallow urban lakes.
Keywords
富营养化已成为世界范围内湖泊面临的主要问题之一。湖泊稳态转换理论指出在相同的环境条件下(如营养盐负荷),浅水湖泊可能存在以大型水生植物为主的清水态和以浮游植物为主的浊水态,而这两种状态在一定的外部干扰下可以实现互相转换。当营养负荷输入过多时,清水态湖泊内的浮游植物和附着生物将迅速增长,进而抑制水生植物生长,最终导致沉水植物消失,湖泊随之变为浊水态。浅水湖泊若要从浊水稳态向清水稳态转换,关键是要实现初级生产者从浮游植物向大型水生高等植物的转换。
浮游植物是湖泊的主要初级生产者之一[1],对于水域生态系统的物质循环与能量流动具有重要影响[2]。水生态系统中浮游植物的群落组成和生物量受多种因素影响,主要包括生物因子与非生物因子等,其中生物因子主要通过上行效应与下行效应对浮游植物群落和生物量产生作用[3]。下行控制意味着某营养级受捕食者的影响,如浮游植物的多样性和生物量会受浮游动物牧食作用的影响[4-5]。相比之下,上行效应是指可增长的资源对某个营养级的调节[5]。就浮游植物而言,氮、磷、温度等水体的物理化学特征一旦发生变化,均会引起浮游植物群落的快速响应[5]。浮游动物作为浮游植物的主要牧食者,其群落组成与生物量也会受浮游植物组成与生物量的影响。浮游动物在连接初级生产者和高营养级消费者方面发挥着至关重要的作用,是碳流动与循环的重要贡献者和水体生物泵的主要驱动者之一[6]。浮游动物对富营养水体,特别是淡水水质具有很高的敏感度,因此可以用作水生生物指示剂[7]。国内外研究表明不同水域浮游动物群落结构变化的主要影响因素不同,包括非生物因素(如水温和营养状态等)和生物因素(如竞争和捕食等)[8]。例如,浮游动物受湖泊水温影响,丰度呈现典型的夏高冬低的特征[9]。目前,已有研究主要关注湖泊单一营养级生物群落及环境因子,如孙颖等调查了玄武湖浮游甲壳动物的水平分布,并分析了其分布与环境因子的关系[10];梅卓华等对该湖蓝藻水华治理后的水质和浮游植物的动态变化进行了监测[11]。然而,关于采取生态修复措施之后湖泊修复区与未修复区的浮游植物、浮游动物群落结构及其与水环境因子关系的研究较为有限。
生态修复对浮游生物群落结构的影响是当前生态学研究的热点之一,这一复杂过程涉及多种生态因素和生物间的相互作用。有研究表明,生态修复后浮游生物的种类数、丰度和生物量通常会有所上升[12]。例如,在柳溪湖的生态修复过程中[13]中,修复后浮游动物的种类和数量均明显增加,丰度与生物量也普遍升高。惠州西湖的生态修复对浮游甲壳动物群落结构有重要影响,哲水蚤、剑水蚤和枝角类丰度与透明度呈正相关关系,而与营养盐呈负相关关系[14]。生态修复不仅提高了浮游植物和浮游动物的多样性,还改善了水体的透明度和营养状态,从而提高了水质[15]。为深入了解生态修复对湖泊生态系统的影响机制,研究湖泊生态修复前后浮游生物群落结构及其与环境因子的关系将十分必要。
玄武湖修复区与未修复区在水质、生物多样性及生态服务功能等方面呈现显著差异,这些差异主要源于生态修复工程的实施。在改善水质方面,通过环保清淤等措施可有效降低底泥中的氮、磷释放[16]。在生物多样性上,围隔构建、鱼类清除和水生植被重建等生态措施显著提升水生植物的覆盖率和水体透明度,促进底栖动物多样性恢复[17]。这种多技术融合的修复模式,在国内外城市湖泊治理中展现出独特优势:相较于常规物理化学方法,玄武湖生态修复创新整合滨湖绿地景观设计与地表径流调控系统,同时将“五洲公园”历史文化理念融入生态护岸建设,形成人水共生的空间范式[18]。本研究通过季节性采样探究修复区与未修复区浮游生物群落的时空异质性及其与关键理化因子的响应机制,为城市湖泊的生态管护提供理论支撑。
1 材料与方法
1.1 采样点设置
玄武湖位于南京市玄武区,湖水主要来自紫金山北麓,湖面面积3.78 km2,平均水深1.14 m,最大水深2.1 m,属于典型的城市小型浅水湖泊[19]。玄武湖承担了多种功能,包括城市防洪排涝、生态景观、市民休闲、观光旅游以及城区河道生态补水等。这些功能使得玄武湖在水质管理和维护方面具有独特的挑战和要求。20世纪80年代,玄武湖水质就已达到超富营养程度,浮游生物的种类、丰度以及优势种等均较之前发生了明显变化[20]。近年来,为了改善水质、恢复湖泊生态、提升城市环境并促进其发展,当地管理部门通过采取底泥疏浚、截污纳管、引水工程、部分区域恢复水生植物等一系列措施对玄武湖进行综合治理。本研究中的生态修复区位于玄武湖东南湖最东南角水域,该区域自2019年开始实施生态修复工程,生态修复措施主要包括疏浚、底泥处置和水生态系统的恢复。疏浚阶段采用了带水疏浚法、干湖冲淤法及管道输送技术,清除了湖底的污染物质。底泥处置则采用了快速干化技术,确保淤泥处理后的稳定排放。生态修复阶段通过种植水生植物,如挺水植物和浮叶植物,并投放水生动物如白鲢、河蚌等,以促进水生态系统的再生和稳定化。经过数月至半年不等的修复,该区域水质和透明度得到明显改善[21]。
本研究分别于2020年冬季(1月4日)、2021年春季(2月24日)、2021年夏季(8月17日)、2021年秋季(11月2日)在南京市玄武湖进行采样。在生态工程试验区(修复区)和未修复区共设置6个采样点(图1)。
图1玄武湖地理位置及采样点分布 (修复区采样点:1#、2#、3#; 未修复区采样点:4#、5#、6#)
Fig.1Location of Lake Xuanwu and sampling sites (Restored areas: 1#, 2#, 3#; Unrestored areas: 4#, 5#, 6#)
1.2 样品采集与分析
现场用塞氏盘测定水体透明度(SD),用便携式水质分析仪YSI测定水体pH、电导率(Cond)、温度(Temp)、氧化还原电位(ORP)及溶解氧(DO)浓度。用采水器采集水面表层、水下1 m处、底层以上0.5 m处混合水样,置于容量为2.5 L的聚乙烯瓶中,低温保存带回实验室进行处理。水样采用SKALAR San ++流动分析仪测定总氮(TN)、总磷(TP);水样经醋酸纤维滤膜(0.45 μm)过滤后用SKALAR San ++流动分析仪测定氨氮(NH3-N)、硝态氮(NO-3-N)、亚硝态氮(NO-2-N)、正磷酸盐磷(PO3-4-P);将过滤水样的醋酸纤维滤膜(0.45 μm)于-20℃保存用于测定Chl.a浓度。采用丙酮萃取分光光度法测定水体Chl.a浓度[22];水样经GF/F玻璃纤维滤膜(0.7 μm)过滤后测定溶解性有机碳(DOC)。
浮游植物样品采集水面表层、水下1 m及底层以上0.5 m处的混合水样(1 L),加入10 mL鲁哥试剂固定,静置48 h后虹吸浓缩至50 mL。充分混匀后取0.1 mL浓缩液,于显微镜下鉴定并计数,每个样品至少计数3个视野[23-24]。浮游植物细胞丰度依据公式(1)计算。假设细胞密度为1.0 g/cm3,生物量通过单细胞体积(几何模型法[24])进行估算。
(1)
式中,N为样品中浮游植物细胞丰度(cells/L),A为计数框面积(mm2),AC为计数面积(mm2):计数方式为对角线、行格和全片时,计数面积分别为A/10、3A/10和A;计数方式为随机视野时,为计数的总视野面积,V浓缩为浓缩体积(L),V计数为计数框容积(L),V水样为初始水样体积(L)。
浮游动物样品采集相同位点的10 L水样,经64 μm浮游生物网过滤后,滤液用4%甲醛固定至50 mL。大型浮游动物(枝角类、桡足类)取1 mL固定液计数,小型浮游动物(原生动物、轮虫)则取0.1 mL 浮游植物浓缩液在显微镜下计数,其丰度按照公式(2)计算。生物量计算中,轮虫采用体积法(近似求积公式),枝角类和桡足类则通过体长-体重回归方程估算。
(2)
式中,N为浮游动物丰度(ind./L),n为计数所得个体数(ind.),V1为计数体积(mL),V2为浓缩样体积(mL),V3为采样量(L)。
1.3 数据处理与分析
基于Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)、McNaughton优势度指数(Y)和Margalef丰富度指数(d)评估浮游生物群落多样性,具体计算方法参照文献[26]。
所有数据处理采用Excel 2013,图表绘制使用ArcGIS 10.2与Origin 2018。统计分析通过SPSS 22.0软件实现。组间差异根据数据性质选择使用one-way ANOVA检验或非参数检验法,事后多重比较根据数据性质选择使用LSD法、Tamhane's T2法或非参数检验法。浮游生物群落结构与环境因子的相关性分析通过Canoco5软件完成。根据消除趋势对应分析(detrended correspondence analysis,DCA)结果,选择线性模型冗余分析(RDA)做进一步的排序分析。采用非限制性蒙特卡洛置换检验每个变量的显著性,自动选择出一组显著的解释变量,剔除共线性的参数(VIF≥20),进一步选择RDA 分析选取最显著的环境参数。
2 研究结果
2.1 玄武湖水质参数
根据监测结果,玄武湖修复区与未修复区水体营养盐浓度呈现明显的季节动态和空间差异。TN浓度在两类区域均无显著季节变化(P>0.05),但在未修复区整体较高(0.90~1.10 mg/L),春季浓度最低。TP浓度在修复区与未修复区均于春季达到峰值,但未修复区冬季TP浓度显著低于其他季节(P<0.05)。未修复区NO-3-N浓度在冬季显著升高,远高于其他季节,而修复区浓度全年稳定且始终较低;未修复区NH3-N浓度在夏季显著升高,最高达0.74 mg/L,修复区则无显著的季节波动。NO-2-N与PO3-4-P在两类区域中均未表现出显著的季节差异。从空间对比来看,修复区TN、NO-3-N、NH3-N浓度在4个季节均低于未修复区,其中未修复区冬季NO-3-N浓度明显升高。修复区TP浓度全年低于未修复区,但两类区域春季均出现峰值;未修复区PO3-4-P浓度虽无季节差异,但整体高于修复区。总体而言,修复区氮、磷营养盐浓度4个季节均优于未修复区(表1)。
玄武湖各区域水体的Chl.a浓度从春季至冬季均呈现下降趋势,而且修复区水体Chl.a浓度显著低于未修复区(P<0.05),表明修复区浮游植物较少,富营养化程度较低。各区域水体均为冬季Chl.a浓度最低。修复区与未修复区水体pH值整体呈弱碱性,其变化范围为6.70~8.17。冬季未修复区水体透明度略高于修复区,其余3个季节则均为修复区更高。玄武湖水温季节变化较为显著,夏季最高约为30℃,冬季最低约为5℃。玄武湖DO浓度在各区域之间差异较小,但受季节影响较大,其随时间的变化规律为冬季最高,其次为春季、秋季,夏季最低(表1)。
2.2 浮游生物物种组成
玄武湖的浮游植物种类丰富多样,共鉴定出8门85种,其中绿藻门种类最多(35种),占总种数的42.61%;硅藻门22种,占种数的26.47%;蓝藻门、隐藻门、金藻门、甲藻门、裸藻门和黄藻门物种数分别为9、6、2、4、6和1种。浮游植物种类从春到冬呈现逐渐减少的规律,春季最多为30种。同时,不同区域水体共发现浮游动物3门48种,其中轮虫种类最多,占总数的近70%,桡足类和枝角类也占一定比例。夏季浮游动物种类最为丰富(18种),冬季次之(16种),秋季再次(15种),而春季种类相对较少(14种)。修复区和未修复区浮游动物物种数量未呈现出明显的区域优势(图2)。
表1玄武湖不同区域水体理化参数(均值±标准偏差)*
Tab.1 Values of physical-chemical parameters in different areas of Lake Xuanwu (mean±SD)
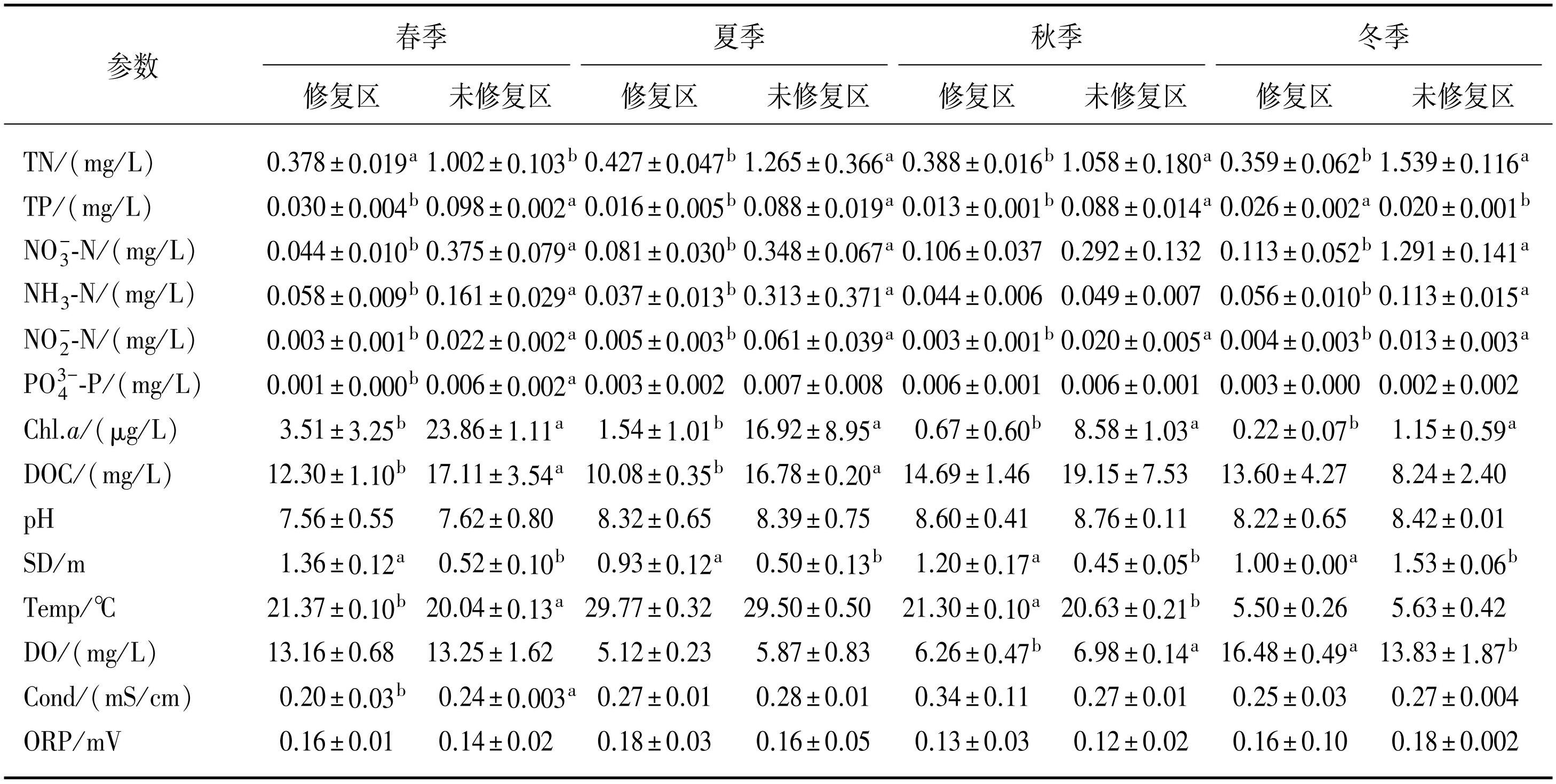
*上标不同小写字母表示修复区与未修复区该参数有显著性差异(P<0.05)。
2.3 浮游生物丰度与生物量
监测数据显示,未修复区的浮游植物丰度和生物量普遍高于修复区。修复区浮游植物丰度和生物量的季节变化范围分别为1.27×106~3.23×106 cells/L和0.45~9.20 mg/L,而未修区的变化范围扩大至1.36×106~1.18×107 cells/L和0.45~21.73 mg/L(图3)。具体而言,春季修复区与未修复区的浮游植物丰度均值分别为3.23×106和5.38×106 cells/L,生物量均值分别为8.84和9.20 mg/L。夏季修复区的浮游植物丰度和生物量分别为1.86×106 cells/L和4.18 mg/L,而未修复区分别为1.18×107 cells/L和13.36 mg/L。秋季,未修复区的浮游植物丰度(8.56×106 cells/L)和生物量(21.73 mg/L)均显著高于修复区(P<0.05,one-way ANOVA),后者分别为1.27×106 cells/L和2.86 mg/L。冬季修复区的浮游植物丰度和生物量分别为1.27×106 cells/L和0.42 mg/L,而未修复区则为1.36×106 cells/L和0.45 mg/L。就季节变化而言,夏季浮游植物总丰度最高,其次是秋季、春季,冬季最低。就生物量而言,秋季达到顶峰,其次是夏季、春季,冬季同样最低。
监测数据显示,修复区浮游动物丰度和生物量的季节变化范围分别为3.20~57.53 ind./L和0.04~0.35 mg/L,而未修区的变化范围扩大至6.43~396.37 ind./L和0.07~2.10 mg/L(图3)。从季节变化来看,浮游动物的总丰度从高到低依次为夏季、秋季、春季、冬季。就总生物量而言,秋季最高,其次是夏季和春季,冬季处于最低水平。春季修复区的浮游动物丰度均值为57.53 ind./L,生物量均值为0.15 mg/L。夏季修复区的丰度和生物量分别降至45.27 ind./L和0.12 mg/L,而未修复区的丰度和生物量则较高,分别为396.37 ind./L和0.43 mg/L。秋季,修复区的丰度和生物量回升至57.67 ind./L和0.35 mg/L,而未修复区的丰度和生物量也同样上升,但仍显著高于修复区(P<0.05),分别为226.33 ind./L和2.10 mg/L。值得注意的是,冬季修复区与未修复区中浮游动物的丰度和生物量并无显著差异(P>0.05)。
2.4 浮游生物优势种(属)
两个区域共发现浮游植物优势属25属。修复区内,春、夏、秋季的主要优势属为隐藻门的蓝隐藻属(Chroomonas)和蓝藻门的微囊藻属(Microcystis);冬季,蓝隐藻属的优势度最高(0.206),硅藻门的小环藻属(Cyclotella)次之(0.148)。相比之下,在未修复区,春季隐藻门的隐藻属(Cryptomonas)和硅藻门的针杆藻属(Synedra)优势度相对较高;夏、秋季节,蓝藻门占据绝对优势地位,如夏季的平裂藻属(Merismopedia)、微囊藻属和螺旋藻属(Spirulina)优势度均在0.110以上;秋季的螺旋藻属优势度最高(0.392),平裂藻属次之(0.248);冬季,优势属主要为隐藻门的蓝隐藻属与隐藻属,尤其是蓝隐藻属(优势度为0.657)(附表Ⅰ)。

图2玄武湖修复区与未修复区浮游植物(a~d)与浮游动物(e~h)种类组成的季节变化
Fig.2Phytoplankton (a-d) and zooplankton (e-h) species composition in restored and unrestored areas of Lake Xuanwu during four seasons
浮游动物优势种共20种。春季修复区与未修复区都以桡足类与轮虫类为优势类群,其中在未修复区轮虫优势种出现频率更高。特别是在修复区的3#采样点,桡足类无节幼体(Nauplius)显示出最高的优势度,Y值达到了0.906。相比之下,未修复区有28种优势种,远高于修复区的10种。夏季浮游动物的优势种在两个区域之间表现出明显差异。在修复区发现了跨立小剑水蚤(Microcyclops varicans)和无节幼体等桡足类,而未修复区的优势种则主要为萼花臂尾轮虫(Brachionus calyciflorus)、裂足臂尾轮虫(Brachionus diversicornis)和方形臂尾轮虫(Brachionus quadridentatus)。特别地,枝角类的简弧象鼻溞(Bosmina coregoni)仅在修复区的3#采样点被发现,其优势度为0.023。秋季修复区水体中浮游动物桡足类优势种的优势度均高于未修复区。冬季,情况又有所变化,修复区优势种以轮虫类为主,而未修复区则以桡足类的跨立小剑水蚤和无节幼体、轮虫为优势种。
2.5 浮游生物多样性指数
玄武湖浮游植物的H′、J、d值随季节和区域(修复区与未修复区)的不同而有所变化(图4)。春季浮游植物的H′值较高,而J和d值处于中等水平,范围分别为2.80~3.58、0.69~0.85、0.66~0.94。夏季浮游植物H′值略有下降,而J值有所上升,d值则略有波动。秋季H′值进一步降低,而J和d值也呈现下降趋势。冬季,H′、J、d值整体达到最低点。修复区浮游植物的H′、J、d值上普遍表现出高于未修复区的趋势,尤其在冬季,修复区的各项指标均值都显著高于未修复区(P<0.05),显示出生态修复措施的积极效果。
浮游动物的H′、J、d值存在显著的季节差异(图4)。值得注意的是,春季修复区的各项均值都低于未修复区(P<0.05)。而夏季H′值的最大值出现在修复区,最小值却出现在未修复区,同时J和d的均值都是修复区高于未修复区(P<0.05)。冬季,修复区与未修复区浮游动物的H′、J值均有所上升,但d的均值在修复区却低于未修复区。总体而言,浮游动物的H′、J、d值随着季节和环境修复状态的不同而呈现动态变化。

图3玄武湖修复区与未修复区浮游植物(a、b)和浮游动物(c、d)的丰度和生物量 (不同小写字母表示季节间差异显著,P<0.05;下同)
Fig.3Biomass and abundance of phytoplankton (a, b) and zooplankton (c, d) in restored and unrestored areas of Lake Xuanwu
2.6 浮游生物与水环境因子的关系
对玄武湖各季节6个采样点的浮游生物群落组成与环境因子进行RDA分析(图5)。选取玄武湖浮游植物8门26种优势种,与环境因子(TN、TP、SD、pH、Cond、ORP、DO、NO-3-N、NO-2-N、NH3-N、PO3-4-P、Chl.a、Temp、DOC)以及桡足类、枝角类、轮虫类的丰度进行冗余分析(图5a)。选取玄武湖浮游动物3类19种优势种,同样与上述环境因子以及蓝藻门、隐藻门、硅藻门、金藻门、裸藻门、绿藻门、甲藻门、黄藻门8个浮游植物门类的丰度进行冗余分析(图5b)。
图5a显示,轴1和轴2特征值分别为0.841和0.420,共解释了88.25%的浮游植物物种信息。轴1和轴2浮游植物物种与环境因子的相关系数分别为0.972和0.795,很好地反映了二者之间的关系。蓝藻门、黄藻门与pH、轮虫、枝角类、NO-2-N、Temp呈正相关,与SD、DO、Chl.a呈高度负相关;硅藻门、裸藻门与SD、DO呈负相关,与TP、Temp、NO-2-N、Chl.a、枝角类呈正相关;隐藻门、金藻门、绿藻门、甲藻门则与DO和Chl.a呈正相关,与pH、轮虫呈高度负相关。
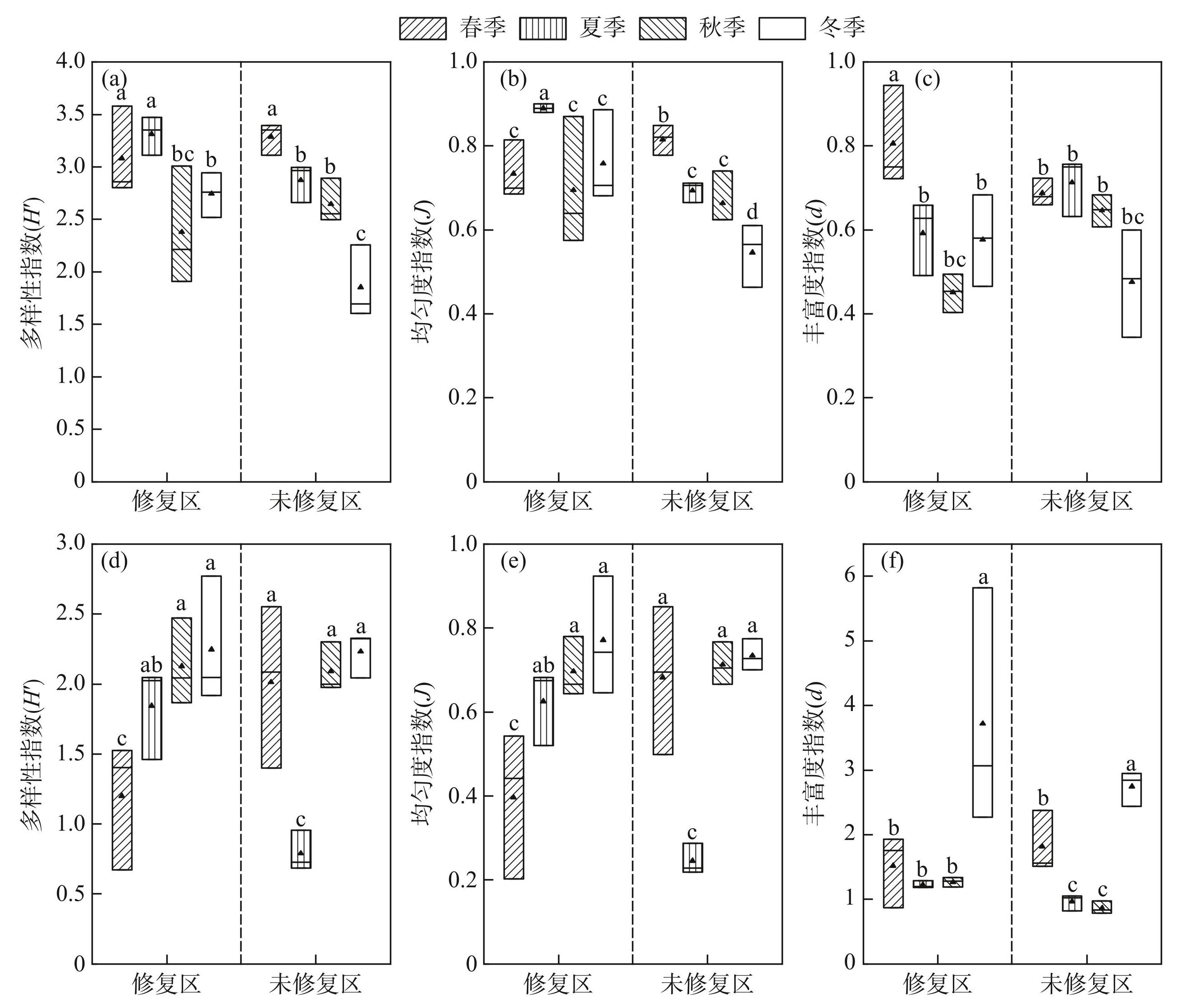
图4玄武湖修复区与未修复区浮游植物(a~c)和浮游动物(d~f))多样性指数的季节变化
Fig.4Changes of biodiversity index of phytoplankton (a-c) and zooplankton (d-f) in restored and unrestored areas of Lake Xuanwu
从图5b可以看出浮游动物与环境因子之间的紧密关系。轴1和轴2特征值分别为0.878和0.005,共解释了88.29%的浮游动物物种信息。轴1和轴2浮游动物物种丰度与环境因子的相关系数分别为0.946和0.505,能够很好地反映浮游动物与环境因子之间的关系。枝角类、轮虫类与水温、蓝藻门、黄藻门呈正相关,而与TN、DO、甲藻门呈负相关;桡足类则与Temp、甲藻门呈正相关,与DO、TN、黄藻门呈负相关。
3 讨论
本研究中,玄武湖浮游生物群落结构表现出明显的季节变化规律和区域差异。通过浮游植物群落结构分析,发现玄武湖4个季节共有85种浮游植物,其中以绿藻门和硅藻门为主。浮游植物物种数从春季到冬季呈现出下降的趋势,且不同季节和采样区域在种类、丰度和生物量上存在显著差异。从季节变化来看,夏季浮游植物丰度最高(4.72×107 cells/L),而生物量则在秋季达到峰值(82.36 mg/L)。这些变化可能与各区域营养盐浓度差异有关,特别是氮浓度。研究表明,浮游植物丰度与氮浓度呈正比,氮是光合作用和浮游植物生长的限制因素[27]。这与本研究中的TN、NO-3-N、NO-2-N、NH3-N在各个季节中修复区浓度最低、未修复区浓度最高的变化趋势一致,表明生态修复有效降低了水体营养盐浓度。春季修复区浮游植物物种数最多,以硅藻门和隐藻门为优势种,并出现了金藻门的锥囊藻,表明修复区的水质显著改善。硅藻门的舟形藻和金藻门的锥囊藻作为清洁水体的指示种[28],其出现通常意味着水体营养盐浓度低、水质清澈。这主要得益于生态修复措施有效地减少了外源污染物的输入,同时沉水植物等水生植被的生长吸收了大量的氮、磷等营养元素,并将其储存在植株体内或输送到沉积物中[29],从而降低了水体的营养盐负荷。相比之下,未修复区浮游植物以蓝藻门、隐藻门、绿藻门为主,这可能与该区域较高的营养盐浓度有关。蓝藻门和绿藻门中的部分种类能够在高营养盐条件下快速生长并形成水华,因此它们的大量存在往往指示着水体富营养化的状态。夏季未修复区浮游植物以蓝藻门和硅藻门为主,微囊藻过量繁殖形成蓝藻水华,这与汪育文等的研究一致[30],表明高氮、磷浓度是蓝藻水华的主要原因。尽管部分蓝藻能够通过生物固氮作用在低氮环境中生长[31],但玄武湖的主要优势种微囊藻并不属于固氮蓝藻类型。然而,微囊藻具有形成群体、抵御摄食、耐受不良环境因子(如高光强、紫外辐射)以及分泌藻毒素等竞争优势,这使其在特定环境中成为优势种。在修复区,优势种则以绿藻门和硅藻门为主。修复区沉水植物的生长能有效抑制沉积物再悬浮,提高水体透明度。沉水植物不仅降低了营养盐浓度,也获得了竞争优势,使得原本在高营养盐条件下占优势的蓝藻失去了优势地位,而绿藻门和硅藻门则因为能够适应这种新的环境条件而成为优势种。有研究表明,沉水植物能够显著提高水体中TN、TP和NH3-N的去除率[32]。这一过程不仅通过沉水植物自身的生物量积累来实现,还依赖于其根际微生物的协同作用。沉水植物的根系为微生物提供了附着表面和氧气,促进了根际微生物群落的生长和活性,从而强化了营养盐的生物地球化学循环(如硝化、反硝化、磷的吸附与沉淀等)[33]。这种植物-微生物的协同作用能够更高效地吸收、转化和固定水体中的氮、磷等营养物质,进一步净化水体。因此,采取以恢复沉水植物为主的生态修复措施十分必要。此外,底泥修复也是生态修复的重要一环。通过清淤等手段改善底泥质量,可短期内减少底泥中营养盐与污染物的释放[16],为沉水植物快速生长创造条件,从而进一步降低水体中的氮、磷等营养物质浓度,并对浮游生物群落结构产生影响。冬季浮游植物物种数、丰度、生物量都最低,修复区的优势种种类最多,分别为隐藻门、硅藻门、绿藻门、甲藻门,多种类型的浮游植物都有其优势种,保持了物种多样性的平衡;未修复区的优势种以隐藻门与硅藻门为主,显示出相对较低的生物多样性。尽管冬季温度降低,水生植被生物量降低,浮游植物生物量减少,但硅藻依旧作为优势种存在,其中一个原因是硅藻可以耐受较低的温度[34]。这种耐受性使得硅藻能在其他浮游植物因温度降低而减少时,依然保持一定的数量和活力。

图5浮游植物(a)和浮游动物(b) 群落组成与环境因子的冗余分析
Fig.5Redundancy analysis of phytoplankton (a) and zooplankton (b) community with environmental factors
物种多样性是衡量一定区域内生物资源丰富程度的一个客观指标,用于评价群落中物种组成的稳定程度及其数量分布的均匀程度和群落的组织结构特征,并常作为描述群落演替方向、速度和稳定程度的指标[35]。浮游植物群落多样性的研究通常使用H′、J、d等多样性指数进行评估。根据多样性指数的大小,浮游植物群落多样性可分Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5个等级进行评价[36]。玄武湖的浮游植物群落多样性在春季和夏季较高,表明春、夏季浮游植物群落结构更为复杂,物种多样性更高。可能是因为春、夏两季温度适宜,光照充足,且水体营养物质丰富[37],更有利于浮游植物生长。此外,修复区的浮游植物群落多样性通常高于未修复区,这表明修复措施可能有助于提升生物多样性。
浮游动物是水生态系统中食物链的关键环节,对水生态环境变化较为敏感。随着水体富营养化程度加剧,轮虫通常占据较大优势,而浮游甲壳动物则会减少[38],因此不少种类可以作为环境污染的指示生物,其中多肢轮虫(Polyarthra sp.)、异尾轮虫(Trichocerca sp.)、龟甲轮虫(Keratella sp.)、裸腹溞(Moina sp.)和剑水蚤(Cyclops sp.)等在富营养化较为严重的水体中会形成优势种群[39]。惠州西湖经生态修复后,浮游甲壳动物的种类有所增加,特别是枝角类和桡足类丰度有所升高,而轮虫丰度显著降低[14]。本研究中,夏季玄武湖修复区有桡足类等优势种与少量枝角类,而未修复区则以轮虫占显著优势;秋季修复区的桡足类优势种优势度同样高于未修复区,表明修复后的水环境适合甲壳类浮游动物生长。对东湖[40]和长湖[41]浮游动物的研究得到类似的结果,即轮虫在中富营养水体中具有普遍优势。浮游动物作为水体中杂食性鱼类的食物来源,枝角类与桡足类属于大型浮游动物,更容易被鱼类等捕食,而轮虫与原生动物等小型浮游动物具有一定生存优势[42]。就季节变化而言,浮游动物的物种数呈现出自夏季、冬季、秋季、春季逐渐减少的趋势,这可能与季节变化导致的环境因子(如温度、光照等)的变动有关。浮游动物的生物量不仅与水体理化因子有关,还与浮游植物的生长周期密切相关,因为浮游植物是浮游动物的主要食物之一;反之,浮游植物变量也受浮游动物牧食的影响[43]。从物种多样性来看,修复区和未修复区的浮游动物多样性指数主要集中在II级,其次是I级,Ⅲ级占比较少。春季未修复区浮游动物的物种多样性高于修复区;而夏、秋、冬季则为修复区的物种多样性更高。浮游动物群落的季节性动态是由于湖泊生态系统中非生物因素(例如营养物质、光照、温度、pH值等)和生物驱动因素(例如初级生产和捕食)的变化引起的[44]。例如,富营养化通常导致浮游动物生物量升高,浮游动物物种丰富度降低[45-46],这与本研究中夏、秋、冬季结果一致,未修复区水体TN、NO-3-N、NO-2-N、NH3-N浓度高于修复区,浮游动物平均丰度和生物量也高于修复区,然而丰富度指标却低于修复区。浮游动物空间异质性的变化与修复区的沉水植物密不可分,沉水植物为浮游动物的生长和繁殖提供了抵御鱼类捕食的避难所,增加了其存活率[47-48]。春季修复区浮游动物的丰富度指数低于未修复区,可能是由于未修复区浮游植物丰度在春季开始逐渐增加,尚未形成藻类水华或者聚集体,浮游动物在未修复区有更加丰富的食物资源[49]。夏季是浮游生物群落动态变化的重要季节。在本研究中,夏季修复区的优势种包括枝角类和桡足类,而在非修复区它们并不占优势。首先,从生境角度来看,修复区通过生态修复措施改善了水质,为浮游动物提供了更适宜的生存环境。这些生物对于水质的改善和稳定有着较高的适应性,因此在修复区能够成为优势种。其次,从鱼类捕食角度来看,非修复区的鱼类生物量较高(未发表数据),鱼类捕食压力较大,导致枝角类和桡足类的数量受到压制。相比之下,修复区通过生态修复措施可能降低了鱼类捕食压力,使得这些生物能够更好地生长和繁殖。综上所述,夏季修复区与非修复区优势种的差异可能是由生境改善和鱼类捕食压力降低等多种因素共同作用的结果。
在比较修复区和未修复区浮游生物群落变化时,发现浮游植物存在显著差异,而浮游动物却没有。这可能是由于浮游植物对生态环境的变化更为敏感,能够更快地响应生态修复措施所带来的环境变化。而浮游动物可能受到更多其他因素的影响,如捕食关系、竞争关系等,导致其群落变化相对滞后。此外,浮游动物的种类和数量可能受到浮游植物的影响,而浮游植物的变化可能尚未足够驱动浮游动物群落的显著变化。总体而言,无论是修复区还是非修复区,均存在较多浮游动物耐污种,并且两个区域均缺乏大型浮游动物。这表明玄武湖生态系统仍然面临着富营养化的压力,即使经过生态修复,该区域也仍为中营养水平。这一方面是由于周边人类活动等因素导致的营养盐输入,另一方面由于鱼类捕食压力较大。修复区与未修复区均缺乏大型浮游动物主要是由鱼类捕食压力造成的,这一现象在长江中下游湖泊中较为普遍。然而,与未修复区相比,修复区在物种多样性、水体质量、生态庇护所以及生态系统的可持续性等方面具有明显优势。这些优势有助于保护和恢复水生生物多样性,提高生态系统健康水平。
本研究中,RDA分析结果表明,蓝藻门、黄藻门与pH、轮虫、枝角类、Temp、NO-2-N呈现正相关关系,与SD、DO、Chl.a呈高度负相关关系。这表明在富营养化水体中,温度升高有利于小型物种(如蓝藻和黄藻)的增殖。这些物种能够在适宜的条件下快速繁殖,从而改变浮游生物群落结构,并提高初级生产力和群落更新速度[50]。温度升高通过降低DO饱和度和促进蓝藻生长(如微囊藻)改变浮游植物群落结构。蓝藻水华在夜间或衰亡期通过呼吸作用和有机质分解加剧DO消耗,导致水体缺氧风险升高[51]。在这一过程中,浮游植物群落不仅受到环境因子的直接影响,还受到浮游动物牧食的压力。同时,掠食性浮游动物对植食性浮游动物的摄食压力发生变化,会引发一种自上而下的营养级联效应[52]。轮虫作为一种重要的浮游动物,具有强大的生长和繁殖能力,能够在适宜条件(如温水和充足的食物,尤其是浮游植物)下迅速繁殖。这与本研究中浮游动物群落与环境因子的RDA分析结果一致,即轮虫类与Temp、蓝藻门、黄藻门呈正相关关系,与TN、DO、甲藻门呈现负相关关系。这表明轮虫在富营养化水体中的生长受到多种环境因子的影响[53],其中温度和食物资源是影响其丰度变动的重要生态因子。硅藻作为水生态中占主导地位的藻类,与温度之间存在显著的正相关关系[54]。与本研究RDA分析结果一致,体现了硅藻对水温变化的敏感性,也揭示了水温对藻类生长的重要性。隐藻门、金藻门、绿藻门、甲藻门与DO、Chl.a呈正相关关系,可能是由于这些藻类在光合作用过程中释放出较多的氧气,同时藻类生长也促进了Chl.a的增加。Chl.a浓度的升高是多种因素综合作用的结果,包括营养盐浓度的提升、水体的相对浅度、浮游动物生长周期的延长以及适宜浮游植物生长的温度等[55]。这些因素之间的相互作用,共同促进了藻类的生长和繁殖。然而,这些藻类与pH、轮虫呈高度负相关关系,可能是因为它们对特定pH值的需求或在食物链中的位置影响了它们与其他生物的关系。环境因子(如pH、温度和TP)以及空间和时间变异性,常与浮游植物和浮游动物的动态紧密相关[41]。已有研究表明,浮游植物的大量繁殖与DO的增加有关[49]。此外,浮游动物生物量不仅与蓝藻以外的浮游植物群(如金藻门、隐藻门和甲藻门)的生物量有关,还与不同浮游动物类群(尤其是桡足类)的生物量有关[43]。
浮游植物群落的变化以及捕食者活动的增加都可能对浮游动物的多样性产生影响。春季未修复区浮游植物开始快速生长,能够为浮游动物提供较多营养,促使部分种类从冬季低温导致的休眠状态中迅速恢复,且未修复区浮游动物以轮虫为主,轮虫有“隐生”的特性。环境条件恶化,如水体干涸、温度不适宜时,某些种类可以停止活动,代谢几乎无法测量,当环境适宜时又快速复苏。而修复区春季浮游植物生物量较低,且存在部分甲壳类浮游动物,当食物不充足时浮游动物生物量相对较低。本研究中,桡足类与水温、甲藻门呈正相关关系,而与DO、TN、黄藻门、蓝藻门呈负相关关系,表明甲藻是桡足类的重要食物之一,而蓝藻门或黄藻门种类越多,越不利于桡足类的生长。此外,有研究显示,DO浓度在0.4~1.4 mg/L时对桡足类的雌性成虫是致命的,但这种低氧环境对其卵或无节幼体并无影响[56]。然而,在本研究中DO浓度均高于1.4 mg/L,且桡足类以跨立小剑水蚤和无节幼体为主。除桡足类外,枝角类与轮虫也均与DO呈负相关关系,这实际上可能是由水温变化以及浮游植物与DO的关系间接导致的。随着水温的升高,水体中的DO浓度会降低,而水温较高的季节正是浮游植物与浮游动物快速繁殖的时期,浮游植物快速生长与衰亡会进一步消耗水体DO。这种季节性变化可能导致在特定条件下,浮游动物数量与DO水平呈现出负相关的结果。
4 结论
本研究通过对玄武湖生态修复区与未修复区进行季度采样,调查了浮游植物与浮游动物丰度与生物量的季节变化,比较了两类区域浮游动和植物群落结构的差异,并分析了其影响因素,结论如下:
1)玄武湖浮游植物鉴定出8门85种,其中种类数以绿藻门(35种,占42.16%)和硅藻门(22种,占26.47%)占优势;浮游动物共鉴定出3门48种,其中种类数以轮虫(33种,占69.84%)占优势。浮游植物的丰度和生物量在修复区低于未修复区,总丰度季节变化为夏季>秋季>春季>冬季,总生物量季节变化为秋季>夏季>春季>冬季。
2)浮游动物的丰度和生物量在未修复区高于修复区,总丰度的季节变化为夏季>秋季>春季>冬季,总生物量的季节变化为秋季>夏季>春季>冬季。
3)蓝藻门和黄藻门与pH、Temp、NO-2-N呈正相关关系,而与SD和DO呈高度负相关关系。在富营养化水体中,温度升高会直接降低DO的饱和溶解度,同时促进蓝藻和黄藻的增殖。尽管玄武湖夏季蓝藻水华较为轻微,对DO消耗的贡献有限,但蓝藻和黄藻的增殖仍可能通过降低水体透明度和增强光限制效应间接影响DO浓度。
4)浮游动物与Temp呈正相关关系,与TN、DO呈负相关关系。在适宜范围内温度升高有利于浮游动物生长,而生态修复后湖泊TN浓度下降,浮游植物多样性提高,浮游动物生物量随之增加。水温较高的季节是浮游植物与浮游动物快速繁殖的时期,浮游植物快速生长与衰亡会进一步消耗水体DO,导致浮游动物与DO呈负相关关系。
5 附录
附表Ⅰ见电子版(DOI:10.18307/2025.0315)。
