摘要
湖泊是温室气体甲烷(CH4)的重要释放源之一,削减湖泊CH4释放对缓解全球气候变化意义重大。沉水植物恢复作为控制湖泊富营养化的重要手段,可能同时具备削减CH4释放的效果。为验证上述假设,本研究选取江苏省南京市典型城市湖泊玄武湖作为研究对象,利用顶空-平衡法开展了为期一年的野外观测研究,并结合室内培养实验,比较了玄武湖沉水植物恢复区与未恢复区CH4释放、产生和氧化的差异以及沉水植物恢复在其中的可能作用。研究结果显示:玄武湖未恢复区水-气界面CH4扩散通量的变化范围为23.5~6076.1 μmol/(m2·d),年平均值为(1244.0±1317.6) μmol/(m2·d)。未恢复区的CH4释放主要受温度、多种营养盐(总磷、总氮、亚硝态氮、氨氮)、叶绿素a浓度等影响;恢复区的CH4扩散通量显著低于未恢复区,其年平均值仅为未恢复区的23.8%,该区域的CH4释放主要受温度、总磷等影响。沉水植物恢复可能通过以下两种途径削减了CH4释放:(1)沉水植物的恢复显著降低了各类营养盐与叶绿素a浓度(总磷、总氮和叶绿素a分别下降了80.2%、73.6%和72.2%),进而削减了CH4的排放;(2)沉水植物的恢复显著地降低了沉积物不同温度下的产甲烷潜势与其温度敏感性,同时还提高了甲烷氧化潜势,使得净CH4释放减少。本研究可为湖泊修复与碳汇能力提升的协同提供重要参考。
Abstract
Lakes are one of the major sources of emissions of greenhouse gas methane (CH4). Reducing CH4 emission from lakes is critical to mitigate global climate change. Submerged plant restoration, as an important means to control lake eutrophication, may also contribute to reducing CH4 release. To verify the above hypothesis, Lake Xuanwu, a typical urban lake in Nanjing, Jiangsu Province, was selected as the research object in this study. A one-year in-situ investigation, combined with the incubation test, was conducted to compare the differences in CH4 release, production and oxidation between the submerged plant restored and unrestored areas in Lake Xuanwu and the possible role of submerged plants in it. The results showed that the diffusion flux of CH4 at the water-air interface in the unrestored area of Lake Xuanwu ranged from 23.5 μmol/(m2·d) to 6076.1 μmol/(m2·d), with the annual mean of (1244.0±1317.6) μmol/(m2·d). The CH4 release in the unrestored area was mainly affected by temperature, various nutrients (total phosphorus, total nitrogen, nitrite and ammonia nitrogen), and chlorophyll-a concentration. The CH4 diffusion flux in the restored area was significantly lower than that in the unrestored area, and its average annual value was only 23.8% in the unrestored area. The CH4 release in this area was mainly affected by temperature and total phosphorus. Submerged plants may mitigate CH4 emissions through two pathways: (1) Submerged plant restoration significantly reduced the concentration of various nutrients and chlorophyll-a (total phosphorus, total nitrogen and chlorophyll-a decreased by 80.2%, 73.6% and 72.2%, respectively), thus reducing the emission of CH4; (2) Submerged plant restoration significantly reduced the methanogenesis potential in sediments at different temperatures and temperature sensitivity, and also increased the methane oxidation potential, resulting in less CH4 release. This study provides valuable insights into the synergistic enhancement of lake restoration and carbon sequestration capacity.
甲烷(CH4)是仅次于二氧化碳(CO2)的全球第二大温室气体,百年尺度上的全球增温潜势是CO2的27倍[1]。自工业革命以来,大气中的CH4浓度已持续增加了150%[1];最新的估算结果显示,水域生态系统贡献了全球近一半的CH4释放[2]。其中,尽管湖泊仅占地表面积的3.7%[3],但其年均CH4释放量可达150.9 Tg,约占全球总年均CH4释放量的18.6%[2]。因此削减湖泊CH4释放对缓解全球气候变化意义重大。
湖泊CH4的释放是CH4产生与氧化的净结果。产甲烷古菌在厌氧环境下利用简单有机物作为底物将其转化为CH4,生成途径包括甲基营养型、乙酸营养型与氢营养型[4]。甲基营养型产甲烷途径主要发生在海洋或其他高盐沉积物中[4],而湖泊和湿地等淡水生态系统的产甲烷过程则由氢营养型和乙酸营养型主导[5],不同途径由不同类型的微生物主导,生成的CH4经由甲烷氧化菌进一步氧化后,通过扩散、冒泡或植物介导的过程[6]传输到水体上层,最终进入大气。此外,也有研究发现湖泊上层富氧水柱中存在着CH4的积累[7-8],表明湖泊有氧水柱中可能存在着好氧产甲烷(oxic methane production,OMP)过程,然而其生态贡献相对较低[9]。
湖泊生态系统面临的另一重大环境问题是富营养化导致的蓝藻水华暴发[10]。自1980年以来,全球湖泊浮游植物数量广泛增加,在夏季,约有68%的湖泊遭受水华影响[10]。我国大部分浅水湖泊同样面临着严重的富营养化问题[11],在威胁生态系统健康、降低饮用水水质以及给人类健康带来不利影响的同时,湖泊富营养化也会显著地提高水体向大气的CH4排放量[12-14],因此缓解湖泊富营养化可能是削减CH4释放的有效措施。水生植物的恢复,特别是沉水植物的恢复可以有效地降低水体营养负荷[15],提高水体透明度[16],是缓解湖泊富营养化的重要手段,对改善湖泊生态环境、促进浊水态的藻型湖泊向清水态的草型湖泊恢复起到关键作用[17-18]。然而,水生植物恢复对CH4释放的潜在影响与机制尚不明确。有研究表明,挺水植物内部的通气组织可以作为气体传输通道[19],将沉积物中的CH4直接输送到大气;其次水生植物分解产生的凋落物会产生大量有机质[20],进一步分解后可为产甲烷微生物提供底物;此外沉水植物可能会促进有氧产甲烷前体的产生或转化[21]。但是也有学者认为水生植物抑制了湖泊CH4的释放,譬如,漂浮植物可以通过捕获CH4冒泡使CH4滞留于水柱,使其在进入大气前被氧化,从而导致水-气界面CH4通量降低[22];除此以外,水生植物也能通过根系泌氧促进CH4氧化,从而削减CH4释放[23],另外其附生的甲烷氧化菌也会促进CH4的消耗[24];同时,有研究表明,沉水植物会使沉积物CH4冒泡削减67%[25];另一项研究发现,沉水植物的去除会显著提高湖泊的CH4扩散通量[26]。水生植物恢复对湖泊CH4释放的影响必然是多方面的,然而目前的研究更多关注的是水生植物与湖泊CH4释放之间的潜在联系,进一步厘清水生植物恢复,特别是沉水植物恢复在净化水质的同时对碳汇的潜在影响至关重要。
玄武湖是南京市最大的城市湖泊,也是典型的富营养化湖泊之一[27]。湖内已设有多处以净化水质为目的的沉水植物恢复区。故本研究于2022年9月-2023年9月在玄武湖进行周年逐月采样,对比沉水植物恢复区与未恢复区的CH4溶存浓度、水-气界面扩散通量及关键驱动因子,结合CH4产生与氧化潜势分析,阐明沉水植物恢复对CH4释放影响的机理。研究结果有助于全面认识沉水植物对湖泊CH4释放的影响及驱动机制,为沉水植物恢复与湖泊碳排放削减的协同提供思路。
1 材料与方法
1.1 点位设置及样品采集
玄武湖(图1)是南京市最大的城市淡水湖泊,南北长2.4 km,东西宽2 km,湖岸呈菱形,水面面积约3.68 km2,平均水深1.14 m[28],湖底底质较厚,可达70 cm[29],湖内分布有5座岛屿。为缓解玄武湖富营养化,湖心岛与湖岸区域利用不透水围隔分隔出了几块沉水植物恢复区,其中沉水植物几乎完全覆盖,主要沉水植物包括苦草(Vallisneria natans)、轮叶黑藻(Hydrilla verticillata)、狐尾藻(Elodea canadensis)等,优势物种为苦草。综合考虑,布设翠洲(恢复区)、太平门(恢复区)以及敞水区(未恢复区)3个采样区域(图1),其中翠洲恢复区沉水植物鲜重与干重生物量分别为(4249.1±2436.1)和(313.5±184.3)g/m2,太平门恢复区沉水植物鲜重与干重生物量分别为((3328.9±2040.4)和(255.2±189.2)g/m2。3个采样区域各布设4个采样点,共计12个采样点。采样时间分别为2022年9—11月和2023年1—9月,共计12个月(2022年12月受新冠疫情影响暂停采样工作),采样时间为每月中下旬的9:00—17:00。
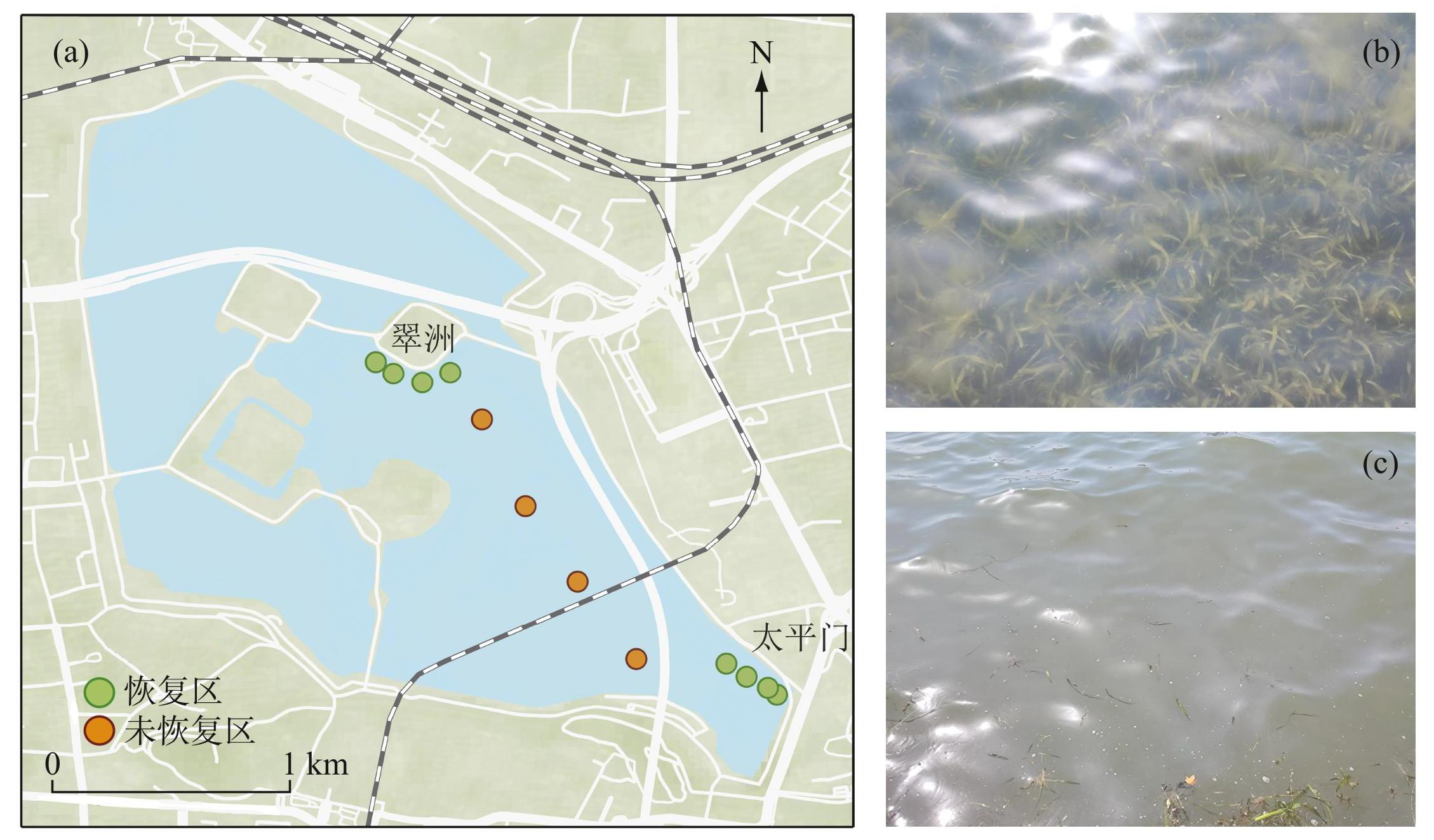
图1玄武湖采样点分布(a)及恢复区(b)与未恢复区(c)
Fig.1Distribution of sampling sites (a) , restored area (b) and unrestored area (c) in Lake Xuanwu
使用3 L有机玻璃采水器采集约0.5 m水深处的表层水样,每次采集水样前先用采样点位原水冲洗采样器内壁1~2次。使用柱状采泥器采集沉积物,收集0~5 cm沉积物样品,装入自封袋后,待采样结束后运回实验室。沉积物样品分两份:一份置于4℃冰箱中保存,用于测定CH4产生与氧化潜势;另一份置于-20℃冰箱中保存,用于分析沉积物理化性质。气体样品通过顶空-平衡法采集[30],具体方法如下:使用500 mL针筒吸取300 mL所在点位的表层水样,然后再抽取200 mL背景气体(本研究使用不含CH4、CO2和N2O的干燥高纯空气,N2∶O2=80∶20(体积比)),剧烈振荡3~5 min后,静置5 min,目标气体在针筒的气相和液相部分上达到平衡,最后平衡气体充入预先准备好的抽真空的200 mL铝箔气袋中密封。待采样结束,将气袋送回实验室分析。此外,使用YSI多参数水质仪(YSI 6600,Yellow Springs,USA)测定水体的上覆气压(P)、pH、温度(T)、盐度(SAL)、溶解氧(DO)、电导率(EC)等参数。
1.2 样品处理
1.2.1 水体的理化指标分析与细菌数测定
水样采集后立即运回实验室进行预处理与各项理化指标分析。原水样用来分析总氮(TN)、总磷(TP);使用经孔径为0.7 μm的Whatman GF/F玻璃纤维滤膜(预先450℃灼烧4 h[31])滤后的水样来分析硝态氮(NO-3-N)、氨氮(NH3-N)、亚硝态氮(NO-2-N)、正磷酸盐(PO3-4-P)、溶解态总氮(DTN)、溶解态总磷(DTP);滤膜经热乙醇法提取后分析叶绿素a浓度(Chl.a)。上述指标的分析方法均参考《水和废水监测分析方法》(第四版)[32]完成。
使用滤后水样通过总有机碳分析仪(TOC-L CPH,Shimadzu,Japan)测定水体中溶解性有机碳(DOC)与溶解性无机碳(DIC)。另外留取1 mL原水通过流式细胞仪(LSRFortessa,BD,USA)测定细菌数。
1.2.2 湖泊营养状态指数计算
湖泊营养状态指数(trophic level index,TLI)可以用来表征湖泊水体的营养水平[13],一般通过Chl.a、TN、TP、透明度(Secchi disk depth,SDD)与高锰酸盐指数(chemical oxygen demand,CODMn)计算[33],但也可以选取其中2~4个参数计算[13,33-34]。本研究利用Chl.a、TP、TN计算TLI值,确定玄武湖恢复区、未恢复区及其他城市水体的营养水平差异,计算公式见附录。
1.2.3 水体CH4溶存浓度与扩散通量计算
铝箔气袋运回实验室后,利用带三通阀门的针筒从气袋中抽取5 mL气体,利用气相色谱仪(7890B,Agilent,USA)分析气体样品中CH4的分压,通过亨利定律计算CH4在水体中的溶存浓度(,μmol/L),同时利用水-气界面温室气体的理论扩散模型计算CH4扩散通量[35],计算公式见附录。
1.2.4 沉积物的理化指标分析
取0.5 g冷冻干燥并研磨后的沉积物,加入10 mL的3 mol/L盐酸,充分震荡并静置12 h后,3000 r/min离心10 min,去除上清液。加入去离子水多次清洗、离心以去除残留的氯离子,直至沉积物呈中性。再次冻干、研磨后使用元素分析仪(EA3000,EuroVector,Italy)测定总氮(TN)和总有机碳(TOC)[36]。此外,沉积物样品通过HCl-HNO3-HF-HClO4混合酸完全消解后,采用电感耦合等离子体发射光谱仪(Prodigy,Teledyne Leeman,USA)测定总磷(TP)[37]。
1.3 甲烷产生与氧化潜势测定
本研究的两块恢复区的环境因子、CH4溶存浓度、扩散通量的差异较小,故甲烷产生与氧化潜势的测定仅选择翠洲恢复区和未恢复区的表层5 cm沉积物。此外野外实测的玄武湖水温范围为8.1~33.7℃,同时考虑到沉积物与水体的热交换[38],沉积物温度相对水温一般更低[39],故本研究将沉积物甲烷产生与氧化潜势测定的培养温度设定为5、15、25℃。
产甲烷培养实验步骤为:将混合均匀的沉积物(其中恢复区沉积物需要提前剔除残留的植物叶片、根系等)与水按照1∶3的质量体积比混合为泥浆,取约10 mL泥浆装入20 mL顶空瓶中,丁基胶塞密封,铝盖压实。为确保顶空瓶内的厌氧环境,泥浆制备、混匀及分装过程均在厌氧工作站(M500,Baker Ruskinn Concept,USA)中完成。顶空瓶放置于对应温度下的摇床中180 r/min振荡培养。所有处理组按照沉积物来源(翠洲恢复区或湖心未恢复区)与培养时间(0、5、10、15、20 d)区分,每组均设置3个重复。完成各组设定的培养时间后,顶空瓶在121℃下灭菌25 min以去除微生物活性[40],最后使用5 mL注射器对所有顶空瓶的气相进行取样,通过气相色谱仪(7890B,Agilent,USA)测定顶空气体中CH4的含量。沉积物中CH4的溶存浓度根据顶空气体的CH4浓度与液相的CH4浓度计算[41],具体计算公式见附录。
由于甲烷好氧氧化反应的吉布斯自由能更高[42],反应更容易发生,同时好氧氧化对CH4的去除贡献一般远高于厌氧氧化,故本研究关注恢复区与未恢复区甲烷好氧氧化潜势的差异。甲烷好氧氧化培养实验步骤为:将混和均匀的沉积物(处理同产甲烷培养实验)与水按照1∶3的质量体积比混合为泥浆,按此比例取约10 mL泥浆装入20 mL顶空瓶中,丁基胶塞密封,铝盖压实。通过微量注射器向每个培养瓶顶空注入10 μL高纯CH4后,放置于对应温度下的摇床中180 r/min振荡培养。所有处理组按照沉积物来源(翠洲恢复区或湖心未恢复区)与培养时间(0、1、2、3、4 d)区分,每组均设置3个重复。完成各组设定的培养时间后,顶空瓶在121℃下灭菌25 min以去除微生物活性[40],最后使用5 mL注射器对所有顶空瓶的气体进行取样,通过气相色谱仪(7890B,Agilent,USA)测定顶空气体中CH4的含量。沉积物中CH4的溶存浓度计算公式见附录。
1.4 甲烷产生、氧化的温度敏感性计算
温度敏感性(Q10)为温度变化时对应速率的变化。甲烷产生与氧化的温度敏感性为产甲烷或甲烷好氧氧化过程从较低温度上升到较高温度时,反应速率发生变化[43],计算公式见附录。
1.5 统计分析
利用IBM SPSS Statistics 25进行统计分析,通过单因素方差分析(one-way ANOVA)比较玄武湖不同区域水体环境因子、CH4浓度和通量以及沉积物产甲烷潜势与甲烷好氧氧化潜势的差异;此外,CH4浓度和通量与环境因子的Pearson相关性分析在Origin 2021中完成;采样点位分布图在ArcMap 10.8中绘制,其他图均在Origin 2021中绘制。
在初步检验CH4浓度和通量与环境因子之间的关系后,进一步采用随机森林回归分析,确定玄武湖CH4释放的关键预测因子,回归分析在R4.3.1中完成,使用“randomForest”包构建随机森林模型,其中模型纳入了所有Pearson相关性分析显示的与CH4浓度和通量呈显著关系的环境因子作为预测因子,通过“rfPermute”包计算各预测因子的显著性,并通过“A3”包完成模型的解释度计算[44]。
2 结果
2.1 玄武湖恢复区与未恢复区表层水体环境因子的变化特征
从全年尺度来看,玄武湖水温在沉水植物恢复区与未恢复区均存在明显的季节变化规律,但不同区域之间不存在显著差异(表1,P>0.05)。与水温相似,水体上覆气压在恢复区与未恢复区同样不存在显著差异。玄武湖恢复区的水体溶解氧浓度显著高于未恢复区(表1,P<0.01),其中翠洲恢复区的水体溶解氧浓度最高,年均值为(12.3±2.8)mg/L;沉水植物恢复降低了水体的电导率,恢复区电导率显著低于未恢复区(表1,P<0.01);玄武湖水体常年为碱性,pH年平均值为8.65±0.54,但是未恢复区的pH值显著低于恢复区(表1,P<0.001)。
玄武湖的营养盐浓度是外源输入与内源释放共同作用的结果。从全年尺度来看,除PO3-4-P外,恢复区水体的各类营养盐浓度均显著低于未恢复区水体(表1),沉水植物的恢复削减了恢复区水体的营养负荷,以TN、TP为例,恢复区水体TN、TP浓度较未恢复区分别降低了80.2%、73.6%。研究结果还发现靠近岸带的太平门恢复区的各类营养盐平均浓度均低于翠洲恢复区(表1)。
玄武湖水体Chl.a浓度同样表现为恢复区显著低于未恢复区,其中恢复区的年均值仅为未恢复区的28.0%。此外,未恢复区的水体DOC浓度显著低于恢复区(表1,P<0.05),而DIC浓度则无明显差异。从全年尺度来看,偏向清水态的沉水植物恢复区水体总细菌数显著低于未恢复区(P<0.001)。
表1玄武湖恢复区与未恢复区表层水体环境因子(平均值±标准差)*
Tab.1 Environmental factors (Mean ± SD) of surface water in the restored and unrestored areas of Lake Xuanwu
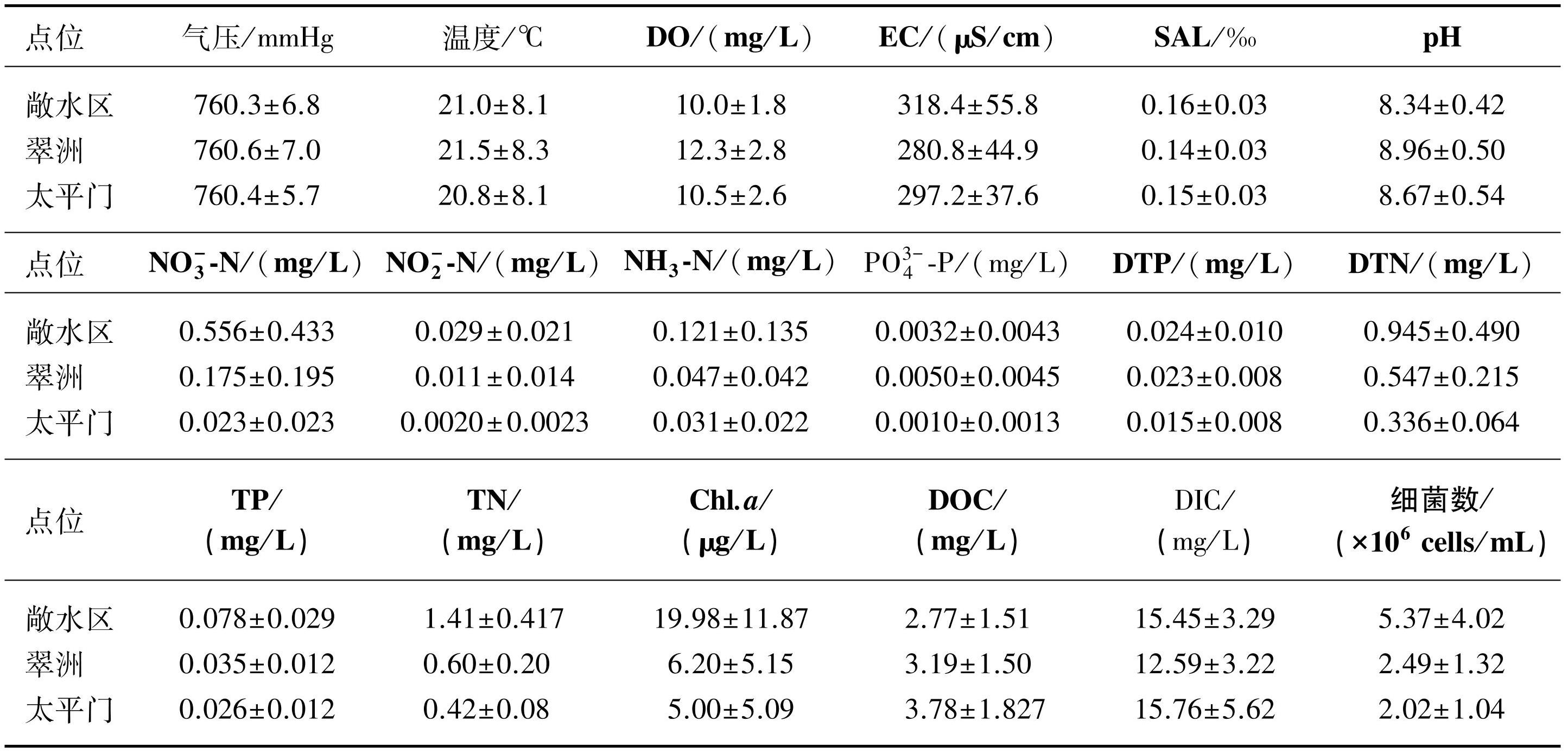
*敞水区为未恢复区,翠洲和太平门为恢复区。加粗表示恢复区与未恢复区之间存在显著差异。
2.2 玄武湖恢复区与未恢复区表层水体和的变化特征
翠洲、太平门恢复区的范围为0.007~0.941 μmol/L,9月最高,11月最低(图2a);其中翠洲恢复区的年均值为(0.268±0.144)μmol/L,太平门恢复区的年均值为(0.285±0.173)μmol/L,两个恢复区域差异不显著(P>0.05)。玄武湖未恢复区表层水体随时间的波动较恢复区更大(图2a),范围为0.0253~2.887 μmol/L,其中10月最高,5月最低(图2a)。此外,未恢复区的年均值为(0.979±0.696)μmol/L,显著高于恢复区(图2a,P<0.001)。
玄武湖水-气界面随时间的变化与相似。恢复区范围为3.7~2030.4 μmol/(m2·d),10月最高,11月最低(图2b),其中翠洲恢复区的年均值为(287.6±198.6)μmol/(m2·d),太平门恢复区的年均值为(304.1±310.4)μmol/(m2·d),两个恢复区域差异不显著(P>0.05)。未恢复区范围为23.5~6076.1 μmol/(m2·d),同样为10月最高,11月最低(图2b)。从全年尺度来看,未恢复区显著高于恢复区(图2b,未恢复区的年均值为(1244.0±1317.6)μmol/(m2·d)),尽管11月-次年5月未恢复区的略高于恢复区,但是差异并不显著(P>0.05)。总体而言,玄武湖作为典型的内陆城市湖泊,其不同区域(恢复区与未恢复区)均是CH4的释放“源”,但是恢复区的CH4排放量显著低于未恢复区(图2c、d,P<0.001)。

图2玄武湖恢复区与未恢复区和
Fig.2and in the restored and unrestored areas of Lake Xuanwu
2.3 玄武湖表层水体、与环境因子的相关性分析
从全年尺度来看,玄武湖恢复区表层水体、均与温度、pH、TP、DOC、细菌数呈显著正相关关系(图3a,P<0.05),均与气压呈显著负相关关系(图3a,P<0.05),此外还与水体溶解氧、电导率具有显著相关性(图3a,P<0.01),但并未发现与两者之间存在显著关系(图3a,P>0.05)。
玄武湖未恢复区表层水体、与各类水体理化指标的相关性与恢复区的情况类似。从全年尺度来看,未恢复区的、同样与温度呈显著正相关关系(图3b,P<0.01),同时也与TN、TP、Chl.a、DOC、细菌数等环境因子呈显著正相关关系(图3b,P<0.05)。此外,还与气压、电导率、DIC具有显著相关性(图3b,P<0.05),而则与三者均无显著关系。与恢复区不同的是,未恢复区的与更多类型的营养盐,如NO-3-N、NO-2-N呈显著正相关关系(图3b,P<0.05)。
恢复区与未恢复区的随机森林模型分别列入了9类与12类环境因子(图4),模型的解释度较高(P<0.001)。结果显示,DOC、温度、细菌数是影响玄武湖未恢复区表层水体、较为重要的环境因子(图4a,P<0.01),而恢复区表层水体的与则受温度的影响显著(图4b,P<0.01)。综上所述,温度是影响玄武湖水体CH4释放最重要的环境因子。
2.4 沉积物理化性质及甲烷产生与氧化潜势
玄武湖恢复区(翠洲)沉积物的各理化指标均小于未恢复区,但差异不显著(P>0.05),其中玄武湖恢复区沉积物的TOC为1.83%±0.62%,TN为0.231%±0.070%,对应的沉积物碳氮比(C/N)为7.95±1.20,TP为(0.914±0.140)g/kg(表2);而未恢复区沉积物的TOC和TN则分别为2.23%±0.59%和0.255%±0.061%,其沉积物C/N为8.73±1.04,TP为(0.925±0.105)g/kg(表2)。
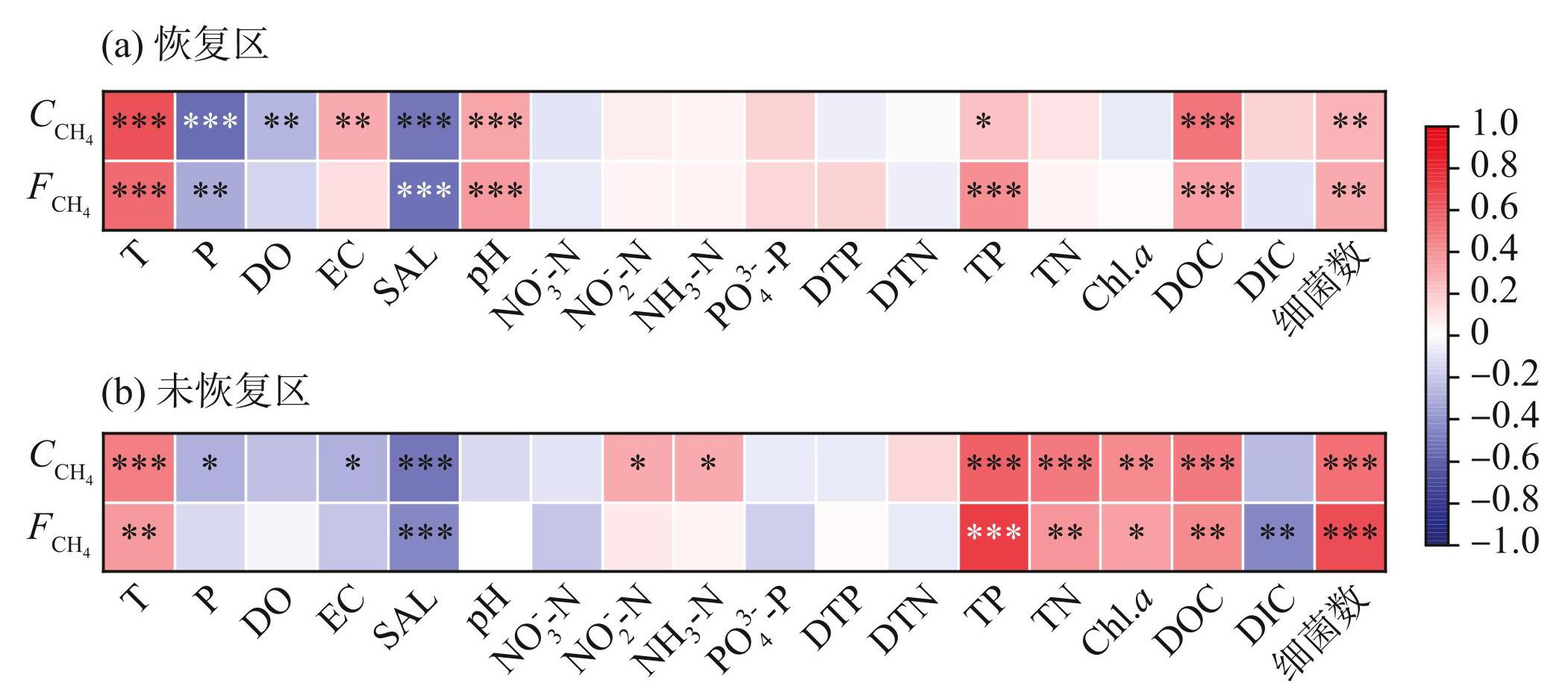
图3玄武湖表层水体、与环境因子的相关性(*P<0.05,**P<0.01,***P<0.001)
Fig.3Correlation between surface water , and environmental factors in Lake Xuanwu
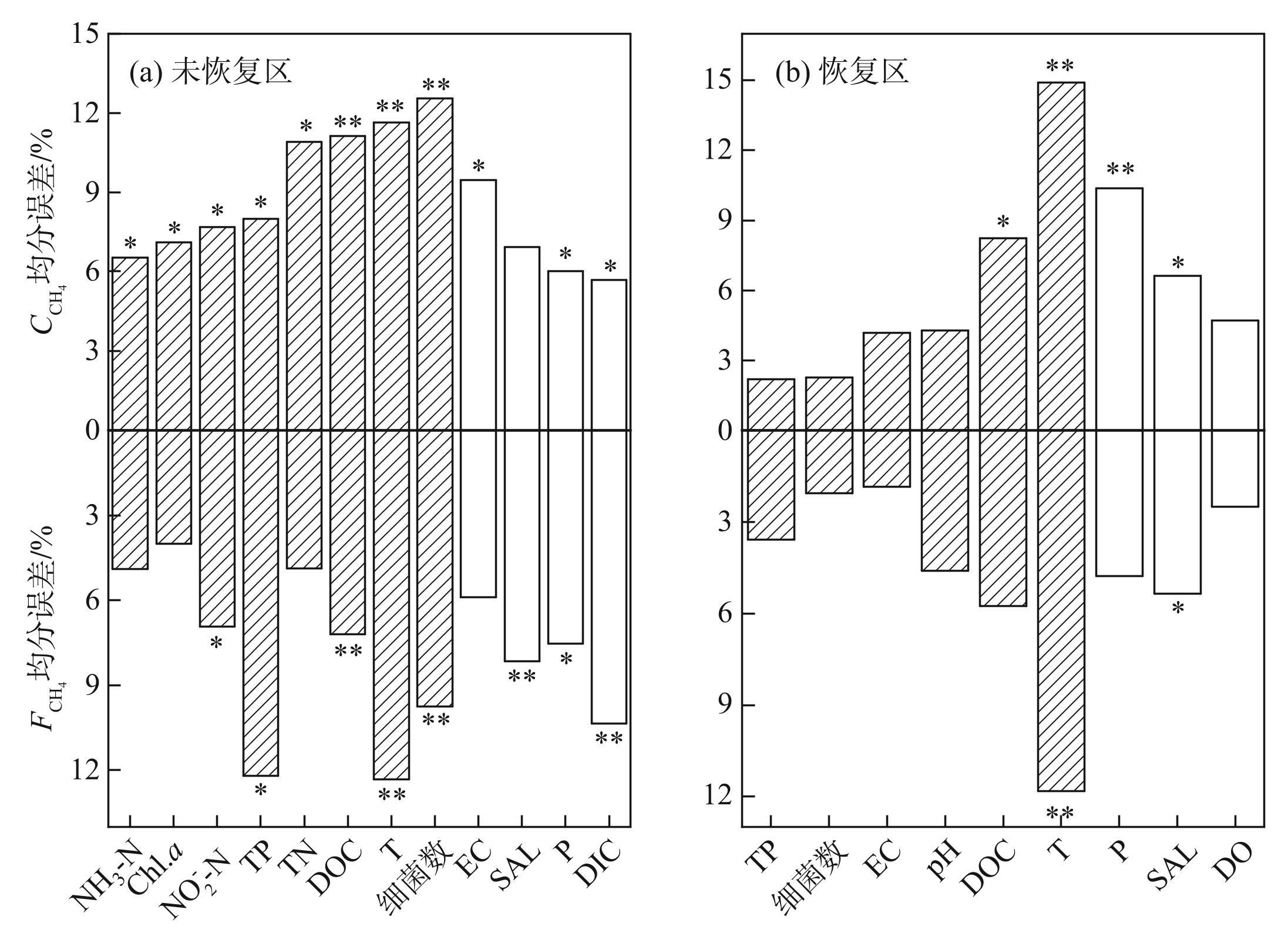
图4随机森林模型下各个特征变量对、的重要性(*表示P<0.05,**表示P<0.01,阴影表示正相关,空白表示负相关)
Fig.4The importance of each characteristic variable to and under random forest model (* indicates P<0.05, ** indicates P<0.01,shaded indicates positive correlation, and blank indicates negative correlation)
在沉积物产甲烷的培养实验中,玄武湖恢复区沉积物在5和15℃下的产甲烷潜势分别为(0.13±0.01)和(0.18±0.01)μmol/(L·d),而未恢复区沉积物在5和15℃下的产甲烷潜势则分别为(0.17±0.03)和(0.32±0.03)μmol/(L·d),在较低温度下未恢复区沉积物产甲烷潜势速率均高于恢复区,其中15℃下的产甲烷潜势存在显著差异(图5,P<0.01)。随着培养温度的提高,恢复区与未恢复区的沉积物产甲烷潜势均提高(图5),当培养温度升高至25℃时,未恢复区的沉积物产甲烷潜势较5与15℃时发生明显突变,为(15.90±0.28)μmol/(L·d),且显著高于25℃下恢复区的沉积物产甲烷潜势(图5,P<0.001),该温度下恢复区的沉积物产甲烷潜势仅为(0.73±0.02)μmol/(L·d)。
表2玄武湖恢复区与未恢复区沉积物理化性质(平均值±标准差)
Tab.2 Physicochemical properties (mean±SD) of sediments in restored and unrestored areas of Lake Xuanwu
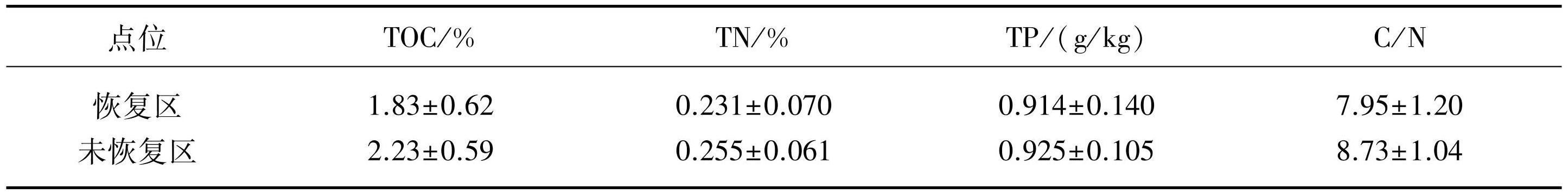
甲烷好氧氧化的培养实验中,在较低的培养温度下(5和15℃),恢复区与未恢复区的沉积物甲烷氧化过程并未显著发生或氧化量极少,其中恢复区在5和15℃的甲烷氧化潜势分别为(16.77±5.90)和(9.89±5.57)μmol/(L·d),培养温度的提高并未提高恢复区沉积物的甲烷氧化潜势;未恢复区在5和15℃的甲烷氧化潜势均高于恢复区,但差异并不显著(图5,P>0.05),分别为(6.47±3.60)和(8.76±2.24)μmol/(L·d)。此外,在25℃下,恢复区与未恢复区沉积物的甲烷好氧氧化均显著提升,其氧化潜势均相对于5或15℃时发生了明显的突变,分别为(67.18±3.50)和(60.00±3.97)μmol/(L·d)。
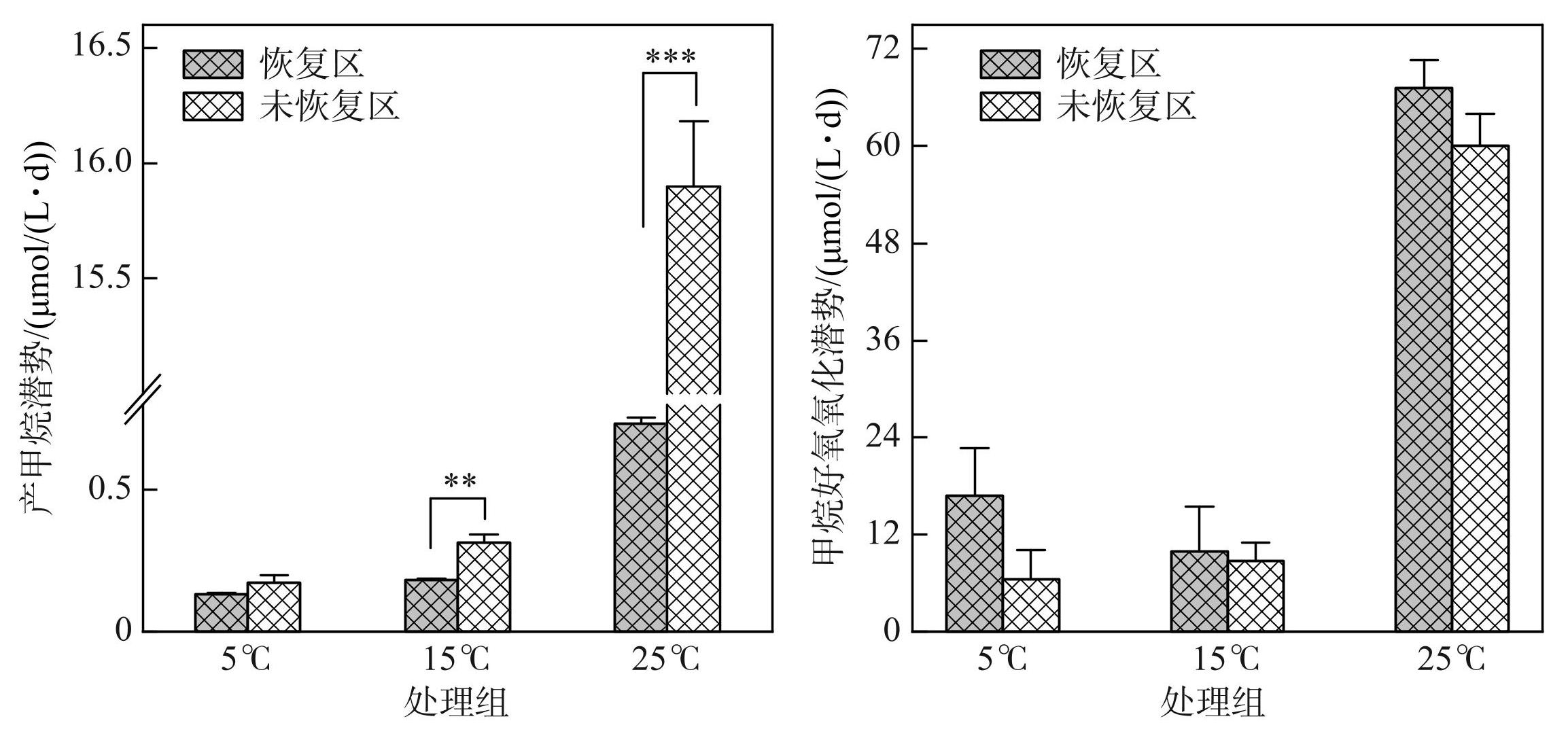
图5产甲烷与甲烷好氧氧化培养实验
Fig.5Incubation test for methanogenesis and methane aerobic oxidation
3 讨论
3.1 玄武湖与其他典型城市水体CH4释放的对比分析
城市湖泊位于城市区域或其周边地区,是城市水文生态系统的重要组成部分[45-46]。相较于自然内陆湖泊,城市内陆水域水体及沉积物有机碳含量和初级生产力更高,水深则更浅,因此同样是CH4排放热点[47]。玄武湖恢复区水-气界面的年平均值为(295.9±259.4)μmol/(m2·d),略高于较低营养水平的湖泊,如Vesijärvi湖(表3),其Chl.a浓度仅为(7.80±0.93)μg/L[48],同样也高于典型富营养化湖泊的中营养区域,如东湖、南湖、沙湖和汤逊湖(表3),但低于这些湖泊的中-富与重度富营养化区域(仅为中-富营养区的41%),而玄武湖未恢复区的则与东湖等湖泊的中-富营养区相当。
城市土地利用类型可以通过向湖泊输移更多的营养物质、有机物和细粒度沉积物来促进湖泊中甲烷生成[49]。同样是城市湖泊,什刹海和玉渊潭溶解的CH4浓度与水体CH4总通量分别是玄武湖恢复区的3.97和2.37倍(表3)。在人口集中、经济发达的大型城市,主要的人工湖泊或景观城市湖泊可能会接受更多的外源营养负荷,导致其富营养化相对更加严重,CH4释放量相对更高。相似地,在对印度两个典型城市湖泊CH4排放的测量研究[50]中发现,由于未经处理的污水直接输入(湖泊溶解氧浓度为(0.12±0.14)mg/L[50]),Bellandur湖水体的CH4溶存浓度显著高于一般的富营养化城市湖泊,是玄武湖未恢复区的192.8倍(表3),而Jakkur湖接受的外源输入则经过了污水处理厂等手段的处理(溶解氧浓度为(17.6±5.76)mg/L[50]),其水体溶解的CH4浓度则远低于Bellandur湖,与玄武湖恢复区相当,仅为什刹海和玉渊潭的10%。
表3玄武湖与其他典型城市水体的与
Tab.3 CH4 soluble concentration and diffusive flux in Lake Xuanwu and other typical urban water bodies
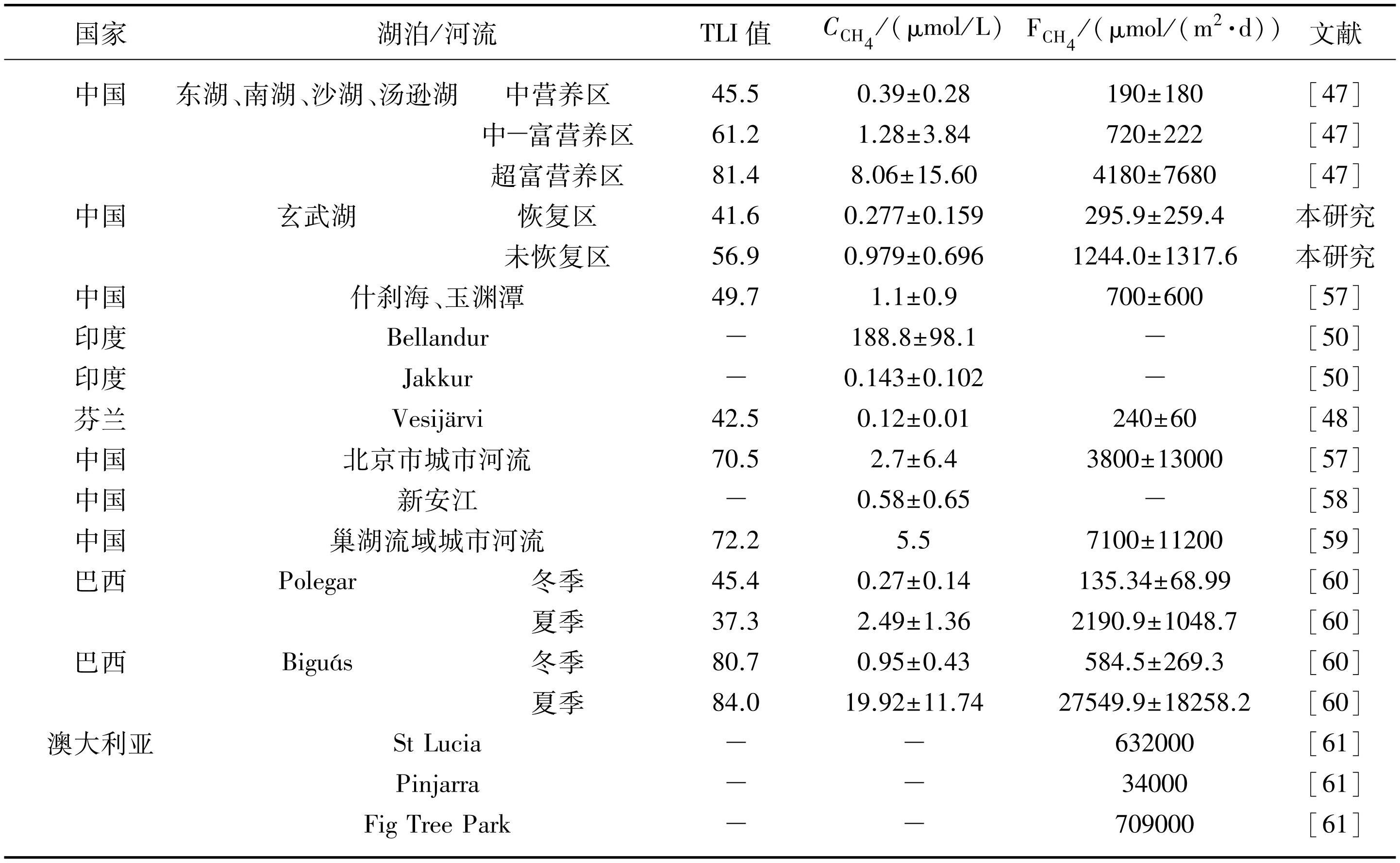
研究发现,包括玄武湖在内的城市湖泊的与TLI值呈显著正相关关系(图6,P<0.001),这表明营养水平的差异可能是造成玄武湖与其他城市湖泊CH4排放差异的重要原因。首先,营养水平的提高可能导致水体溶解氧消耗增加[51],进而产生微厌氧或低氧环境,促进CH4的生成。其次,湖泊底部的厌氧沉积物是CH4产生的主要场所[52],富营养化可能导致湖泊中生物残体大量沉积[53-54],而这些有机物质可能在厌氧条件下进一步产生CH4。总而言之,湖泊过量的营养输入可以通过调节影响CH4动态的非生物环境条件,进而显著提高湖泊内CH4的产量和水-气界面的扩散。因此,通过沉水植物恢复等生态修复过程削减水体营养水平时,还可能有效地削减了碳排放。与本研究相似,太湖围隔养殖塘在废弃水产养殖模式后,经生态恢复的第1年和第2年,其CH4排放较恢复前分别下降了34%和37%[55];此外,针对不同修复水平的城市河流的调查发现,完全修复下河流的CO2排放普遍低于部分修复或未修复的河流,仅为未修复河流的34%[56],虽然研究关注的是水体CO2的变化,但是同样可以发现生态修复对水体碳汇提升的潜在作用。
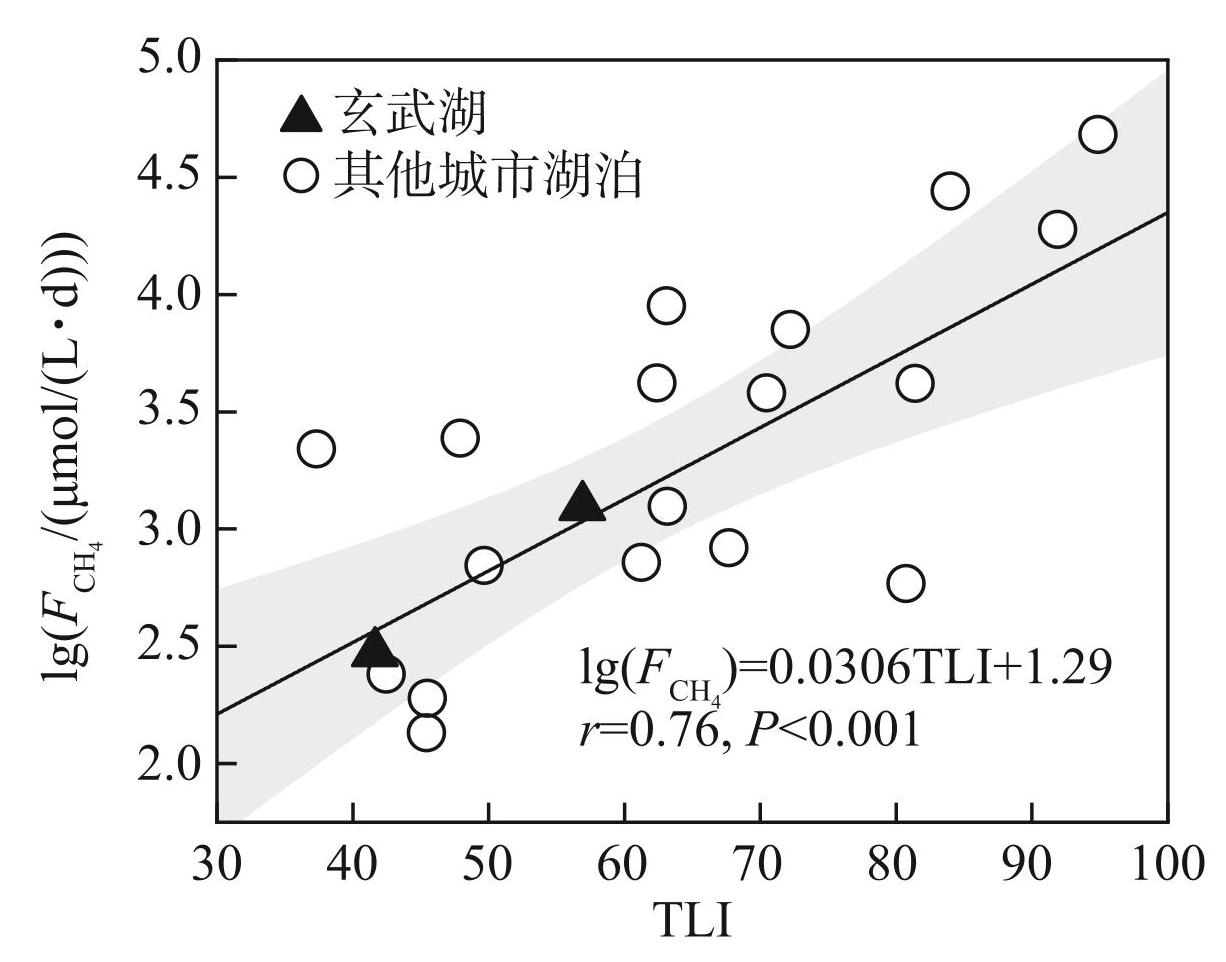
图6典型城市湖泊与TLI值的关系
Fig.6Relationship between and TLI values in typical urban lakes
3.2 沉水植物恢复对玄武湖CH4释放的影响
在玄武湖沉水植物恢复区监测到的年均值为(295.9±259.4)μmol/(m2·d),显著低于未恢复区,同时也显著低于很多文献研究报道的典型城市湖泊与城市河流(表3),加之在一年的野外观测研究中发现沉水植物恢复区CH4释放随时间的波动较未恢复区小(图2),表明沉水植物恢复在增强水体碳汇、削弱温室气体排放的季节响应上具有一定作用。本研究结果显示,沉水植物恢复可通过提高水质和优化CH4产消过程两个方面减少CH4释放。
3.2.1 水体水质
与玄武湖恢复区、未恢复区CH4排放均显著相关的环境因子包括TP、细菌数等,而溶解氧、NO-2-N、NH3-N、TN、Chl.a等环境因子在不同区域并不完全显著相关。玄武湖的周年观测结果显示,水体、与溶解氧呈负相关(图3,其中恢复区与溶解氧呈显著负相关),这与其他湖泊的研究一致[62-63]。深层厌氧沉积物或底层水柱产生的CH4向上扩散的过程中会被以氧气为电子受体的好氧CH4过程氧化去除60%~90%[64],显然水体溶解氧会显著影响CH4氧化量。虽然已有研究证明好氧甲烷氧化菌在缺氧条件下仍旧可以利用除氧气以外的电子受体[65-66],但是从反应活化能的角度看[42],氧气仍旧是CH4氧化过程中最重要的电子受体。沉水植物光合作用显著提高了玄武湖恢复区的水体溶解氧浓度,其年均值为(12.6±2.5)mg/L,是未恢复区的1.26倍,溶解氧浓度的提升有效地促进CH4氧化的同时,抑制了CH4的产生。
沉水植物恢复显著降低了水体的营养盐浓度,恢复区的TP、TN浓度相较于未恢复区分别降低了80.2%、73.6%。玄武湖恢复区和未恢复区的、均与TP浓度呈显著正相关(图3,P<0.05),说明削减湖泊TP不仅是遏制富营养化的有效手段,同时也是减少CH4释放的可能措施。事实上,有研究报道磷的控制可以削减74%的湖泊CH4释放[67]。未恢复区水体与NH3-N、NO-2-N浓度均呈显著正相关(图3),表明氮营养盐浓度的提高同样促进了未恢复区的CH4释放,但是在恢复区没有发现水体、与氮营养盐浓度的相关性(图3),这可能是受沉水植物的影响,氮营养盐降到极低水平所致,这与本研究的实测数据吻合(以NH3-N为例,恢复区水体NH3-N浓度仅为未恢复区的17.0%)。此外,在玄武湖未恢复区也发现、与Chl.a浓度存在显著正相关关系(图3,P<0.01),进一步证明了内部营养水平的提高显著增强了富营养化湖泊水-气界面CH4的扩散,而在趋向清水态的玄武湖恢复区,由于较低的营养水平,、与Chl.a浓度不存在显著相关性。整体上,湖泊富营养化水平的提高刺激了水体CH4的释放,而沉水植物恢复有效地降低了湖泊营养水平,继而削减了湖泊向大气的CH4释放量。
本研究还发现玄武湖恢复区和未恢复区的、与水体细菌数均存在显著正相关(图3,P<0.01),这表明玄武湖水柱多种微生物参与分解有机碳,为产甲烷提供了底物,而考虑到恢复区水体细菌数显著低于未恢复区,推测受营养水平的限制,偏向清水态的恢复区水体微生物相对较少,对应的与有机碳分解相关的微生物较少,故而水-气界面净CH4扩散量相对更低。
3.2.2 甲烷产生与氧化的温度敏感性
随机森林模型结果显示,温度是影响玄武湖CH4排放最重要的环境因子(图4),故本研究设计了不同温度下恢复区与未恢复区沉积物产甲烷潜势与甲烷氧化潜势的培养实验。结果表明,在不同的培养温度下,玄武湖恢复区沉积物的产甲烷潜势均低于未恢复区,沉水植物减少了沉积物界面的CH4总产生量;25℃恢复区与未恢复区的产甲烷潜势差异显著,表明沉水植物钝化了高温对微生物产甲烷的刺激作用。此外,温度提高20℃(从5℃到25℃),玄武湖恢复区与未恢复区的沉积物产甲烷潜势均显著提高,其温度敏感性Q10分别为2.48与11.94,未恢复区显著高于恢复区。沉积物产甲烷潜势的温度敏感性结果证明了未恢复区沉积物的产甲烷过程对温度的响应更加强烈;恢复区经过生态恢复后,其沉积物产甲烷潜势不仅相对于未恢复区显著下降,同时其CH4产生对温度变化的响应也显著减弱。
事实上,恢复区沉积物的TOC含量低于未恢复区(表2),这可能导致了沉水植物恢复后沉积物更低的产甲烷潜势,因为更高的沉积物TOC可能为厌氧环境下的产甲烷微生物提供了更多的潜在底物。同时,沉积物CH4的产生与有机质的不稳定性有关[68-69],故沉水植物恢复也可能通过提高沉积物有机碳中微生物难以利用的碳源(如泥炭或絮凝腐殖质等)比例来削减CH4 [43],进而导致了恢复区更低的产甲烷潜势,以及进一步导致温度敏感性降低。此外,产甲烷潜势与温度敏感性也可能受沉水植物根系分泌物的调控:沉水植物根系分泌物中的微量氧气可能促使沉积物中如NO-3、Fe3+、Mn4+、SO2-4等电子受体的可用性增加,这可以有效地抑制CH4的生成[43]。同时Fe3+、Mn4+也增强了沉积物中有机碳(OC)的保存[70],避免其快速矿化、分解,有效地实现了有机碳的保藏。
玄武湖恢复区沉积物的甲烷氧化潜势在15、25℃下均高于未恢复区,若考虑植物根系泌氧对CH4氧化过程的强化作用,则甲烷氧化潜势在恢复区与未恢复区的差异将更加显著。除根系泌氧对沉积物缺氧环境的改善外,沉水植物叶片也能为甲烷氧化菌提供生态位[23],同时它还可能通过增加甲烷氧化菌群落的α多样性来提高甲烷氧化潜势[71]。同时,研究结果显示虽然恢复区的沉积物甲烷好氧氧化潜势大于未恢复区,但是其温度敏感性却与沉积物产甲烷潜势相似,恢复区低于未恢复区(恢复区与未恢复区沉积物甲烷氧化潜势的温度敏感性Q10分别为2.00与3.05)。因此,由于温度敏感性差异导致的增温对未恢复区甲烷氧化潜势的影响可能会高于恢复区,但事实上甲烷好氧氧化潜势与底物水平、CH4浓度及O2浓度有关[43]。
简言之,全球变暖显著地增加了淡水生态系统的CH4排放[72-73],而在气候变暖加剧的今天,如何减缓水生CH4的释放速率显得尤为重要。在同样增温的气候变化背景下,湖泊在通过种植沉水植物进行生态恢复的过程中,在改善水质、缓解湖泊富营养化的基础上,还可能通过降低沉积物CH4产生的温度敏感性、提高沉积物的好氧氧化潜势来减少沉积物界面CH4的产生,从而实现生态治理与碳汇提升协同的目标。
此外,本研究还关注到恢复区的水体DOC浓度显著高于未恢复区(P<0.05),表明沉水植物恢复导致的湖泊浊水态向清水态过渡的过程中,以浮游藻类为主的有机质的快速产生与降解过程发生了转变,沉水植物恢复促进了有机质的沉积和储存[74],水体储碳能力可能进一步增强。同时,沉水植物恢复可以显著提高水体透明度[16],提高光化学降解对湖泊有机质的影响,从而影响微生物对有机物的利用,改变湖泊中有机质的生成和矿化途径[74],减少有机质向CH4转化的碳矿化过程,进而减少湖泊沉积物CH4的产生。然而DOC的动态涉及复杂的生态系统过程,后续的研究应该关注植物恢复后水体或沉积物碳组分的变化。
本研究主要关注玄武湖CH4在水-气界面的扩散通量,而忽略了冒泡通量的作用以及沉水植物恢复对湖泊CH4冒泡的物理或生物影响。此外,水生植物在进入衰亡期时,由其凋落物(根、茎、叶等)的分解、腐烂而增加的沉积物内源有机质可能会提高沉积物CH4的释放速率,虽然这种刺激的促进作用显著小于藻源有机质[75],但仍不可忽视,故合理的植物刈割或植物配置可能对CH4释放有更好的削减作用。
4 结论
在针对玄武湖沉水植物恢复区与未恢复区开展的为期一年的野外观测研究中,恢复区表层水体溶存的CH4浓度与水-气界面CH4的扩散通量仅为未恢复区的28.3%和23.8%,两者均不存在显著的时间异质性,说明在以沉水植物恢复为主导的湖泊生态恢复过程中,CH4释放得到了有效削减。
未恢复区的CH4释放主要受温度、多种营养盐(总磷、总氮、亚硝态氮、氨氮)、叶绿素a浓度等影响;而恢复区的CH4释放则主要受温度、总磷等影响。沉水植物可能通过以下两种途径导致了玄武湖恢复区与未恢复区CH4释放的显著差异:(1)沉水植物的恢复显著降低了各类营养盐与叶绿素a浓度,同时显著提高了水体溶解氧,进而削减了CH4的排放;(2)沉水植物的恢复显著地降低了沉积物的产甲烷潜势,同时也削弱了其对温度的响应,加之恢复区相对于未恢复区更高的甲烷氧化潜势,将显著减少未来增温背景下湖泊CH4的释放。
致谢:感谢杜瑛珣副研究员、苏雅玲副研究员、冯慕华副研究员以及刘静静、梅彦昆、次珍、张一泉在野外采样和数据分析方面提供的帮助。
5 附录
附录见电子版(DOI:10.18307/2025.0314)。
