摘要
微囊藻藻际中生长着大量的细菌,它们影响微囊藻的生长以及藻群体的维持,在水华的生消过程中发挥着重要作用。微囊藻的生长伴随着微囊藻群体的形成与解散,但在此过程中附生细菌群落的变化规律仍然未知。本文针对一株从太湖中分离的群体铜绿微囊藻,在不同的培养温度下监测其生长和解散过程,揭示与微囊藻群体密切相关的细菌类群。结果表明:在15~30 ℃,该群体微囊藻展示出差异化的生长周期,温度越高群体解散越快,微囊藻群体数目达到峰值的时间越短。随着D2群体的生长,>20 μm的微囊藻群体附生细菌群落从以Pseudomonadales为主转变为以Sphingomonadales为主;3~20 μm的单细胞-小群体微囊藻附生细菌群落及游离细菌群落中的优势菌群均从Pseudomonadales转变为Cytophagales。 Limnobacter只在游离细菌群落中相对丰度较高;Roseococcus只在>20 μm的D2群体附生细菌群落中有较高的相对丰度;Porphyrobacter在游离细菌群落及3~20 μm的单细胞-小群体微囊藻附生细菌群落中相对丰度较高;Mesorhizobium在3~20 μm的单细胞-小群体微囊藻附生细菌群落及>20 μm的D2群体附生细菌群落中有较高的相对丰度。对不同粒径及不同温度下的细菌群落进行Venn图及特异性-占有率(SPEC-OCCU)图分析发现,部分独有种及特化种只在15 ℃下出现,OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)和OTU682(Pseudoxanthobacter sp.)在所有温度下均为>20 μm的D2群体附生细菌群落的特化种。网络分析结果表明,>20 μm的微囊藻群体的附生细菌网络中关键节点最多。本研究揭示了微囊藻群体生长过程中藻际细菌群落组成的变化,有助于深入了解附生细菌在微囊藻群体维持及水华中的作用。
Abstract
A large number of bacteria inhabit in Microcystis phycosphere. They affect the growth and colony maintenance of Microcystis, and play important roles in the development and elimination of Microcystis blooms. Bacteria accompany the formation and disaggregation of Microcystis aeruginosa colonies during their growth, but changes in bacterial communities during the process were still unclear. In this study, Microcystis colony development and bacterial community variation in colonial Microcystis strains isolated from Lake Taihu were monitored during cultivation at different temperatures. The experimental results showed that the growth pattern of this colonial Microcystis strain to varying temperatures from 15 ℃ to 30 ℃ was different, the higher the temperature the faster the colonies disaggregate, and the shorter the time for Microcystis aeruginosa colonies to reach the peak. During the growth process of D2 colonies, the dominant bacterial communities associated with Microcystis colonies of >20 μm shifted from Pseudomonadales to Sphingomonadales; The dominant bacterial communities associated with unicellular-small Microcystis colonies of 3-20 μm changed from Pseudomonadales to Cytophagales, which were similar to those in the free-living bacterial community. On genus level, Limnobacter were dominated only in the free-living bacterial community; Roseococcus were dominated only in Microcystis colonies of >20 μm; Porphyrobacter were dominated in free-living bacterial community and unicellular-small Microcystis colonies of 3-20 μm; and Mesorhizobium were dominated in unicellular-small Microcystis colonies of 3-20 μm and Microcystis colonies of >20 μm. Venn diagrams and specificity-occupancy (SPEC-OCU) plots of bacterial communities at different particle sizes and temperatures revealed that some exclusive and specialized species only appeared at 15 ℃, OTU669 (Methylobacteriaceae), OTU722 (Brevundimonas sp.) and OTU682 (Pseudoxanthobacter sp.) were specialized species of the Microcystis colonies of >20 μm at all temperatures. Network analyses revealed that bacterial communities in Microcystis colonies of >20 μm had the most critical nodes. These results revealed variation patterns in bacterial community composition of different particle sizes during the growth process of colonial Microcystis aeruginosa. This study would contribute to a better understanding of the role of bacterial communities in Microcystis blooms.
在全球气候变化与人为干扰持续加剧的双重压力下,蓝藻水华在全球淡水生态系统中频繁暴发,其中微囊藻(Microcystis spp.)是水华蓝藻的主要优势种。微囊藻水华是淡水水体面临的重要环境问题:部分水华微囊藻会产生蓝藻毒素,具有肝毒性,对人类和动物的健康产生危害[1]。此外微囊藻水华还会导致底层缺氧,从而影响水生动植物生长,产生一系列生态问题[2]。微囊藻通常以群体的形式出现,群体形态有助于其适应不同的光照,减少被浮游动物捕食的概率,在营养匮乏等不利条件下,藻际生长的微生物可为其提供所需的营养物质,这使得群体微囊藻具有更高的竞争优势,也是微囊藻水华发生的关键机制之一[3-4]。
微囊藻的生长繁殖不仅会受到水体富营养化程度、光照、水体流动和水温等的影响[2,5-6],还会受到生活在微囊藻群体藻际中各种细菌生命活动的影响[3]。藻类及其周围胞外产物包括营养物质、化学引诱剂或抗菌物质等形成的微环境称为藻际,在藻际内的细菌接触到的藻类分泌物很大程度上导致了细菌的定殖,且可能对定殖细菌具有选择作用,因此特定藻类的附生细菌往往具有特异性[4,7-9]。已有多项研究发现微囊藻附生细菌可以诱导单细胞微囊藻形成微囊藻群体并影响微囊藻群体的大小和生长速度[4,9-12]:Dai等发现微囊藻群体的大小与附着细菌密度呈正相关,表明附着细菌有利于微囊藻群体的形成[9];Shen等将从微囊藻中分离出的细菌与单细胞微囊藻共培养后发现其可以形成群体[10];Wu等发现Chryseobacterium sp.和Pseudomonas chengduensis明显增加了铜绿微囊藻群体的大小,而Exiguobacterium indicum、Delftia sp.、Bacillus cereus和Stenotrophomonas maltophilia使群体明显变小,但对微囊藻生长速度没有影响,Aeromonas caviae 和 Sphingopyxis sp.对群体大小没有影响,但Aeromonas caviae会促进微囊藻的生长[12]。湖泊浮游细菌群落组成的变化伴随着蓝藻的组成变化[13-14]。微囊藻水华强度变化会改变水体生态系统及水环境的物理化学特征,进而影响水体中细菌群落结构组成[7]。微囊藻群体附生细菌群落的变化也受到环境因素差异的驱动[15-16],各个细菌菌株的最适生长温度不同,温度变化会改变微囊藻群体附生细菌的群落结构,如Enterobacter、Brevundimonas和Sphingomonas等在32℃下相对丰度更高[15],而附生细菌群落的变化又会影响微囊藻群体的生长。因此,微囊藻与细菌之间存在相互影响,附着在微囊藻群体上的异养细菌对藻群体的形成具有非常重要的作用。
然而,微囊藻群体在实验室内培养过程中大都解散为单细胞,因此在微囊藻群体生长过程中细菌群落的变化规律仍然不清楚。Shi等对夏季及冬季太湖4个位点的微囊藻相关细菌、颗粒附着细菌和游离细菌群落进行了UPGMA分析,发现同一取样时间、同一生境中的大多数细菌群落都聚集在一起,而同一位点的细菌群落在夏季和冬季相差较大,因此在同一体系中,对于相同的细菌种群,时间差异的影响比空间差异大[17]。探讨附生细菌在特定微囊藻生长周期内的组成变化,对于深入了解藻菌关系及微囊藻水华的形成与消退具有非常重要的作用。本研究通过一株从太湖中分离并长期在实验室培养的群体微囊藻,该群体微囊藻在培养过程中部分藻群体解散为单细胞,部分仍然可以维持群体状态,探讨在不同温度及不同粒径下细菌群落组成的变化规律,试图解析与微囊藻群体生长和解散密切相关的细菌类群,从而有助于对附生细菌在微囊藻水华生消中作用的理解。
1 材料与方法
1.1 实验材料
藻种培养和样品采集的方法与方道艳等的相同[18]。本研究所使用的铜绿微囊藻(Microcystis aeruginosa)群体D2,是2011年从太湖分离纯化得到的。取对数生长期的D2群体接种于含250 mL BG-11培养基的500 mL灭菌锥形瓶中,初始浓度为5×104 cells/mL,每组设置3个平行,置于15、20、25和30℃的光照培养箱(GZX-300BS-Ⅲ,上海新苗医疗器械制造有限公司)中培养。光照强度为50 μmol/(m2·s),光暗周期为12 h∶12 h。
实验初期,每5 d取一次样,实验后期调整至每10 d或15 d取一次样,共培养80 d。所有操作均在超净工作台(SW-CJ-1FD,苏州安泰)进行。每次取样前将藻液摇匀,每瓶取10 mL藻液,将3个平行的样品混合后用20、3及0.2 μm的滤膜(47 mm直径,Millipore,Germany)进行梯度过滤,以收集>20 μm的D2群体及其附生细菌、3~20 μm的单细胞-小群体微囊藻及其附生细菌以及0.2~3 μm的游离细菌,将滤膜于-80℃保存。
1.2 实验方法
1.2.1 叶绿素a及比增长速率
每次取3 mL藻液,使用浮游植物荧光仪Phyto-PAM(Walz,Effeltrich,Germany)测定叶绿素a浓度(Chl.a)。为了比较D2群体在不同温度下达到生物量峰值前的生长速率,根据藻的生长曲线,统一利用取样中期第40天的Chl.a浓度数据,按照如下公式,计算前40 d比增长速率(μ):
(1)
其中,N40为第40天藻液的Chl.a浓度;N0为第0天的Chl.a浓度;t为培养时间(40 d)。
1.2.2 群体数目及形态
取1 mL藻液,用倒置显微镜对D2群体进行计数,重复3个平行。同时用光学显微镜(Imager,A2x,ZEISS,Germany)观察,并用ZEN 3( blue dition)拍照软件记录D2群体的形态变化。
1.2.3 DNA提取、PCR扩增和Illumina Miseq测序
此部分内容与方道艳等的实验方法相同[18]。DNA提取采用乙基黄原酸钾(XS)法[19],引物采用338F和806R 对V3-V4可变区进行PCR扩增,PCR产物经纯化、检测定量后,构建PE 300的文库。由上海美吉生物医药科技有限公司利用Illumina公司的Miseq PE 300平台进行测序。原始数据上传至NCBI数据库中,BioProject序列号为PRJNA700808[18]。
1.3 数据处理
原始测序序列使用Trimmomatic软件(version 0.30)质控,使用FLASH软件进行拼接。使用UPARSE软件(version7.1.http://drive5.com/uparse/)根据97%的相似度对序列进行分类操作单元(Operational Taxonomic Unit,OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%[18]。对测序数据进行均一化处理,均一化序列数为32544。初步数据通过Excel2016进行整理。利用GraphPad Prism 9和R 4.3.2语言平台进行统计分析、单因素方差分析、群落组成分析、Venn图分析、物种的生境特异性分析及微生物网络分析及绘图。
物种的生境特异性分析:分别计算每个OTU的特异性和占有率,然后将其投影到特异性-占有率图(SPEC-OCCU图)上,筛选出特异性和占有率≥ 0.7 的 OTU,即它们具有生境特异性,将其定义为特化种[20]。节点的拓扑特征可由模块内连通性(Zi)和模块间连通性(Pi)定义,节点属性可根据其拓扑特征分为4类:模块中心点(module hubs,在模块内部具有高连通度,Zi >2.5且Pi≤0.62)、连接节点(connectors,在两个模块间具有高连通度,Zi≤2.5且Pi>0.62)、网路中心点(network hubs,在整个网络中具有高连通度,Zi>2.5且Pi>0.62)及外围节点(peripherals,在模块内部和模块之间均不具有高连通性,Zi≤2.5且Pi≤0.62)。除外围节点外的其余3类节点为关键节点,这些节点代表了在维持微生物群落结构稳定性上可能起重要作用的关键物种[21]。
2 结果分析
2.1 在不同温度下铜绿微囊藻群体D2的生长及形态变化
D2群体的生长和解散表现出因温度而异的特点。在15℃下D2群体数在第20天后开始缓慢增加,到第40天增加速度加快,到第65天时达到最大值,为6387个/mL(图1)。20℃下,D2群体数在第0~25天增加,第25~55天藻群体数目较为稳定,第55天后D2群体数减少。25、30℃下,D2群体数分别在第20、15天达到峰值后迅速降低。温度越高,D2群体达到峰值的时间越短:在15、20、25和30℃下D2群体数目达到峰值的时间分别为第65、25、20和15天(图1)。由图2可知,当温度为15℃时,D2群体的比增长速率最低,为0.066 d-1;当>15℃时,比增长速率升高,到25℃达到最大值(0.205 d-1)。在20和30℃时,D2群体的比增长速率比在25℃时略有降低,分别为0.188和0.197 d-1,表明25℃更适宜D2群体的生长。
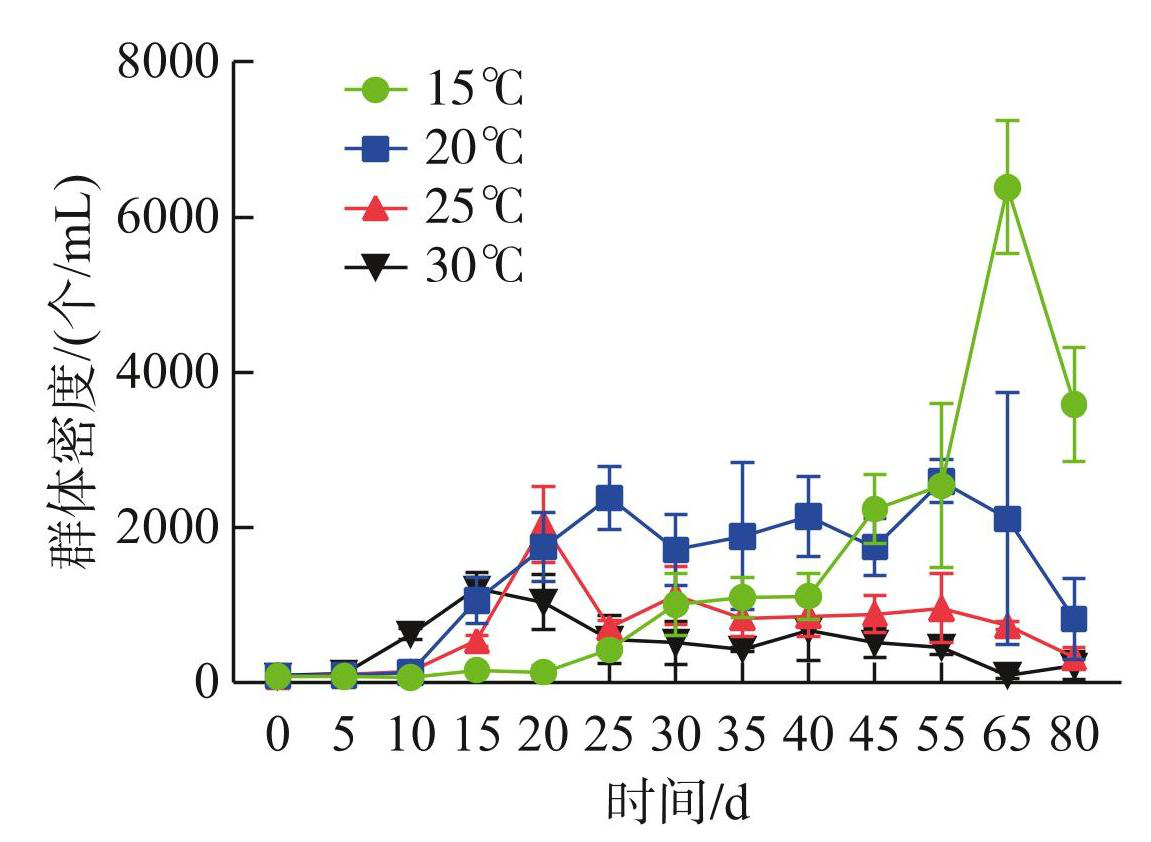
图1不同温度对D2群体培养体系中微囊藻群体数目的影响
Fig.1Effects of different temperatures on the number of Microcystis colonies in colonial D2 culture system
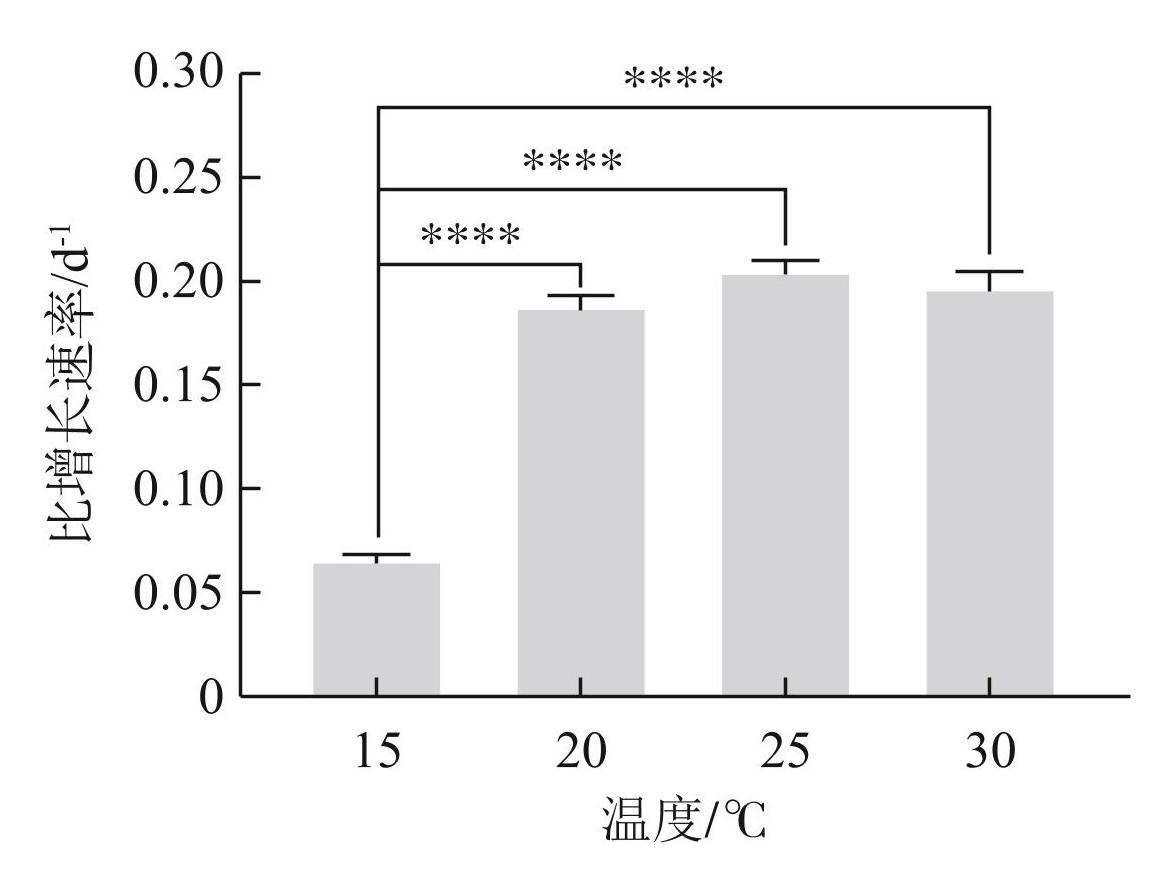
图2不同温度下D2群体的比增长速率 (one-way ANOVA,***表示P<0.0001)
Fig.2Growth rate of colonial D2 under different temperatures
在光学显微镜下发现,随着生长时间的增加,D2群体会逐渐解散,成为单细胞,且其解散程度与温度有关。在15℃下,第65天时D2群体基本没有解散。在20、25℃下,随着培养时间延长,到第45天时,D2群体中小群体的占比增加,群体变得松散,体系中逐渐出现单细胞微囊藻。在30℃下,D2群体在第15天时开始解散,在第65天时体系中出现大量单细胞(图3)。
2.2 铜绿微囊藻D2群体各粒径附生细菌群落在不同温度下随生长周期的组成变化
综合各温度下的分析发现,在不同粒径的优势细菌类群中,Sphingomonadales在游离细菌和附生在3~20 μm的微囊藻单细胞-小群体的细菌群落中相对丰度相似,分别为12.2%和12.4%,但在>20 μm的微囊藻群体的附生细菌群落中占比较高(23.07%);Caulobacterales、Rhizobiales和Rhodospirillales的相对丰度随D2群体粒径的增大而增加,在>20 μm的D2群体的附生细菌群落中相对丰度最高(16.9%、10.7%和4.6%);Sphingobacteriales和Burkholderiales在不同粒径下相对丰度相似;Pseudomonadales和Rhodobacterales在3~20 μm的微囊藻单细胞-小群体的附生细菌群落中占比最高,分别为21.6%和8.5%;Chlorobiales和Cytophagales在游离细菌群落中相对丰度最高(15.4%和33.5%)。
随着藻群体的生长,培养体系中优势菌目也会发生变化(图4)。在所有温度及粒径的D2群体附生细菌群落中,Pseudomonadales的相对丰度均呈现下降趋势。在>20 μm的微囊藻群体附生细菌群落中,Burkholderiales的相对丰度在所有温度下均呈下降趋势,Rhizobiales与之相反,总体呈现升高趋势;Sphingomonadales的相对丰度在所有温度下均呈现先升高后降低的趋势;在20、25和30℃时,Caulobacterales的相对丰度在第0~15天较高,在15℃下则为第35~65天较高;Chlorobiales的相对丰度在15℃较高,可以达到27.45%,在其余3个温度下则在0.39%~8.33%的范围内波动。在3~20 μm的单细胞-小群体微囊藻的附生细菌群落中,在所有温度下,Caulobacterales、Rhizobiales和Rhodobacterales的相对丰度均呈现先升高后下降的趋势;在20、25 和30℃下,Rhodospirillales的相对丰度在0.38%~5.05%的范围内波动,但其相对丰度在15℃下可达到27.57%,Cytophagales与其相反,在15℃下相对丰度最高,为2.35%,但在20、25 及30℃下峰值分别可达到48.73%、59.28%和53.32%;Sphingomonadales的相对丰度在15℃下呈升高趋势,在其他3个温度下均先升高后降低。在游离细菌群落中,Rhodobacterales和Sphingomonadales的相对丰度在所有温度下均呈先升高后减少的趋势;Caulobacterales的相对丰度在所有温度下均在0.24%~3.79%的范围内波动,Rhodospirillales的相对丰度均在0.08%~1.65%的范围内波动;在15℃下,Cytophagales的相对丰度在4.12%~6.83%的范围内波动,但在其余3个温度下其相对丰度最高达75.53%。

图3通过光学显微镜观察(10倍物镜)的不同温度下D2群体的生长变化
Fig.3Growth changes of colonial D2 under different temperatures as observed by optical microscopy (10×magnification)
在属水平下,部分细菌只在特定温度下出现:Blastomonas和Limnobacter只在15℃下相对丰度较高;Roseococcus在20和25℃下相对丰度较高;Mesorhizobium在20和30℃下相对丰度较高;unclassified_f__Hyphomonadaceae只在25℃下相对丰度较高,Phreatobacter只在30℃下相对丰度较高。综合各温度下的分析后,发现不同粒径下相对丰度较高的细菌类群有所区别:Limnobacter只在游离细菌群落中相对丰度较高,其相对丰度先升后降,峰值出现在第45天(2.64%)。Roseococcus只在>20 μm的D2群体附生细菌群落中有较高的相对丰度,其相对丰度在第0~15天升高,在第15~45天降低,然后升高至最大值6.61%;Porphyrobacter在游离细菌群落及3~20 μm的单细胞-小群体微囊藻附生细菌群落中相对丰度较高,且相对丰度均先升高后降低,峰值均出现在第45天,其在游离细菌群落中的相对丰度稍高。 Mesorhizobium在3~20 μm单细胞-小群体微囊藻附生细菌群落及>20 μm的D2群体附生细菌群落中有较高的相对丰度,在>20 μm的D2群体附生细菌群落中,其相对丰度随培养时间的增加而升高;而在3~20 μm的单细胞-小群体微囊藻附生细菌群落中,其相对丰度先升高后降低,且相对丰度稍低(图5)。
3个粒径下存在的细菌类别也有所不同:Lactobacillus和Acinetobacter只在3~20 μm的单细胞-小群体微囊藻附生细菌群落中存在;Nocardioides和Limnobacter在游离细菌群落及3~20 μm的单细胞-小群体微囊藻附生细菌群落中存在;unclassified_o__Rhizobiales在3~20 μm的单细胞-小群体微囊藻附生细菌群落及>20 μm的D2群体附生细菌群落中存在;unclassified_f__Microbacteriaceae、unclassified_c__Alphaproteobacteria和Propionibacterium只在>20 μm的D2群体附生细菌群落中存在;norank_f__FukuN57则存在于游离细菌群落及>20 μm的D2群体附生细菌群落中。
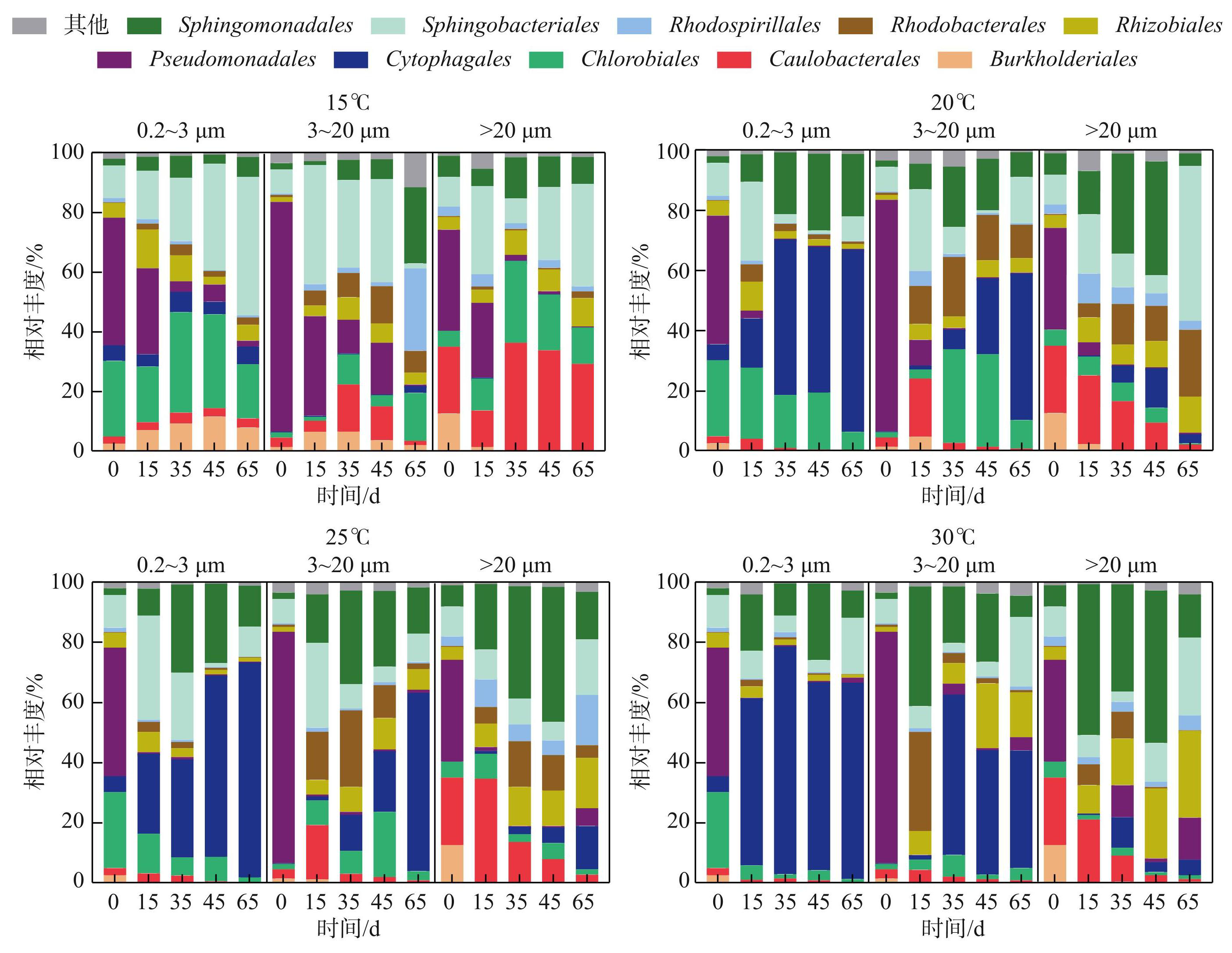
图4在不同温度、不同生长时期D2群体培养体系中不同粒径下细菌群落的相对丰度 (目水平,去除蓝藻序列)
Fig.4Relative abundance of bacteria communities in different particle sizes in colonial D2 culture system at different temperatures and growth phases (at order level, removing cyanobacteria sequences)
2.3 不同温度下铜绿微囊藻D2群体培养体系中群体微囊藻附生细菌群落中的独有种
在OTU水平下,对各温度下不同粒径的附生菌群进行Venn分析,并对只附生于>20 μm的微囊藻群体的细菌相对丰度变化进行分析,结果表明(图6):在15℃下,OTU759(Gemmatimonas sp.)、OTU751(Erythrobacteraceae)、OTU604(Rikenellaceae_RC9_gut_group sp.)、OTU706(Erythrobacteraceae)、OTU734(Ruminococcaceae_UCG-014 sp.)、OTU439(Lysinibacillus sp.)、OTU460(Anaerotruncus sp.)、OTU507(norank)、OTU701(Alphaproteobacteria)、OTU667(Alphaproteobacteria)、OTU673(Roseococcus sp.)、OTU666(Bacteroidales_S24-7_group)和OTU558(Bacteroidales_S24-7_group)只存在于>20 μm的微囊藻群体的附生细菌群落中;OTU745(Rhizobiales)、OTU744(Sphingomonas sp.)、OTU714(Arthrobacter sp.)、OTU666(Bacteroidales_S24-7_group)、OTU585(Corynebacterium_1 sp.)、OTU563(Bacteroidales_S24-7_group)和OTU501(Aeromonas sp.)为在20℃下>20 μm的微囊藻群体附生细菌群落的独有种;OTU734(Ruminococcaceae_UCG-014 sp.)、OTU692(Bacteroidales_S24-7_group)、OTU659(Alphaproteobacteria)、OTU566(Mitochondria)、OTU525(norank)、OTU494(Rhizobium sp.)、OTU439(Lysinibacillus sp.)、OTU410(Enterobacteriaceae)和OTU134(Ralstonia sp.)为在25℃下只附生于>20 μm微囊藻群体的细菌;在30℃下只附生于>20 μm微囊藻群体的细菌有:OTU714(Arthrobacter sp.)、OTU659(Alphaproteobacteria)、OTU439(Lysinibacillus sp.)和OTU410(Enterobacteriaceae)。
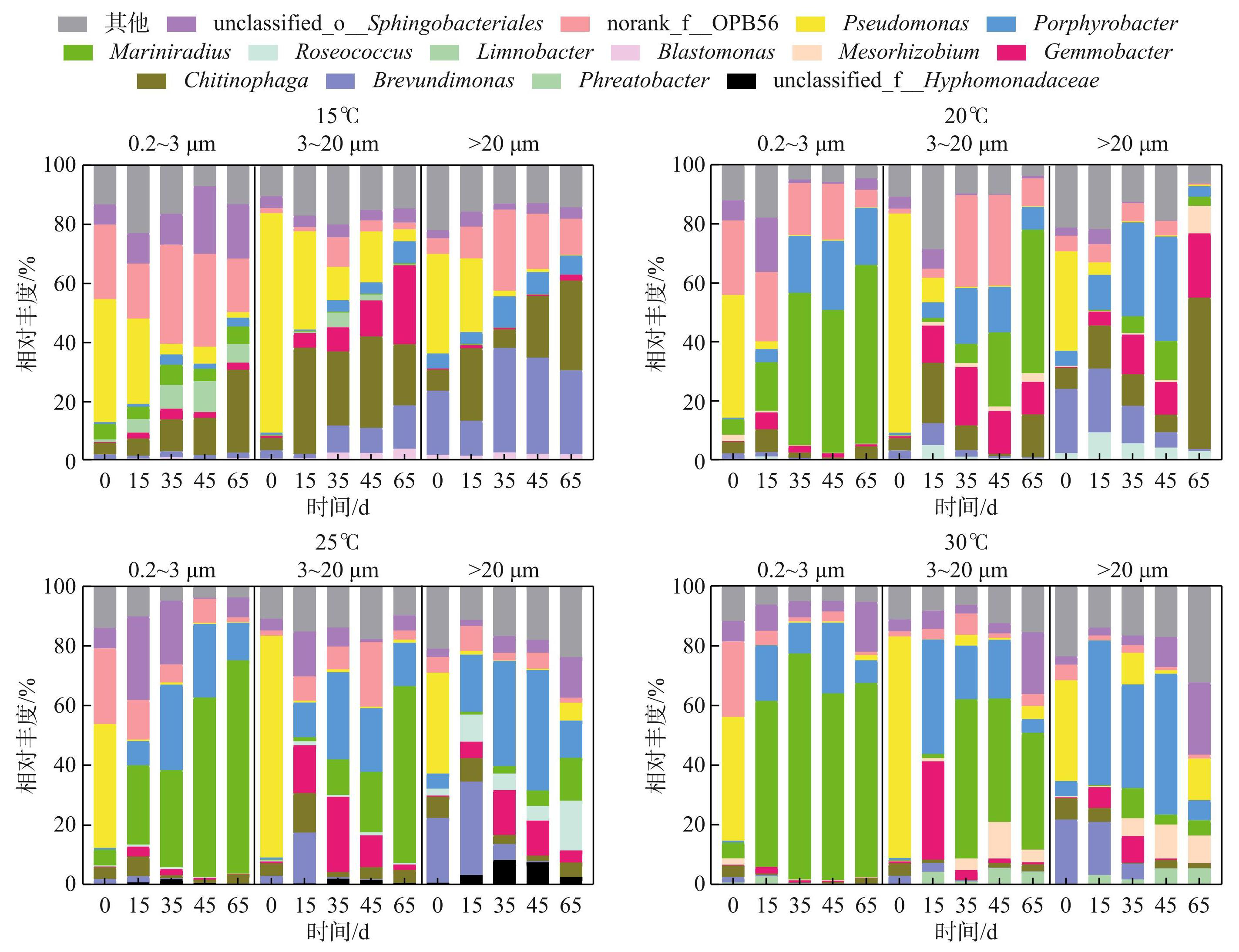
图5在不同温度、不同生长时期D2群体培养体系中不同粒径下细菌群落的相对丰度 (属水平,去除蓝藻序列)
Fig.5Relative abundance of bacteria communities in different particle sizes in colonial D2 culture system at different temperatures and growth phases (at genus level, removing cyanobacteria sequences)
部分细菌在多个温度下都只附生于>20 μm的微囊藻群体:OTU734(Ruminococcaceae_UCG-014 sp.)在15和25℃下均存在;OTU439(Lysinibacillus sp.)在15、25和30℃下均存在;OTU714(Arthrobacter sp.)在20和30℃下均存在;OTU659(Alphaproteobacteria)、OTU410(Enterobacteriaceae)在25和30℃下出现于>20 μm的D2群体附生菌群中。
2.4 铜绿微囊藻D2群体培养体系中不同粒径下附生细菌群落的特化种
对不同粒径下的细菌群落进行了生境特异性分析,并对特化种的相对丰度变化进行了分析,得到图7。在游离细菌群落中,OTU569(FukuN57)、OTU571(Ancylobacter sp.)、OTU603(Mesorhizobium sp.)、OTU676(Mariniradius sp.)、OTU655(Limnobacter sp.)、OTU259(Hydrogenophaga sp.)、OTU450(Sphingopyxis sp.)和OTU676(Mariniradius sp.)为15℃下的特化种;20℃下的特化种有9株,为OTU740(Porphyrobacter sp.)、OTU730(Sphingopyxis sp.)、OTU695(Mariniradius sp.)、OTU758(Sphingomonadales)、OTU685(Mariniradius sp.)、OTU767(Gemmatimonas sp.)、OTU259(Hydrogenophaga sp.)、OTU450(Sphingopyxis sp.)和OTU655(Limnobacter sp.);25℃和30℃下均只有一株特化种,为OTU655(Limnobacter sp.)。
在3~20 μm的单细胞-小群体微囊藻附生菌群中,OTU708(Gemmobacter sp.)、OTU454(Variibacter sp.)、OTU661(Hydrogenophaga sp.)、OTU755(Chryseobacterium sp.)、OTU390(Propionibacterium sp.)、OTU694(Nocardioides sp.)和OTU447(Phenylobacterium sp.)为15℃下的特化种;OTU540(Hyphomonas sp.)和OTU447(Phenylobacterium sp.)在20℃下为特化种;25℃下不存在特化种;30℃下,OTU689(Alphaproteobacteria)、OTU674(Alphaproteobacteria)、OTU668(Phreatobacter sp.)、OTU535(OPB56)和OTU710(Alphaproteobacteria)为特化种。

图6D2群体培养体系中不同粒径的附生菌群的Venn分析及只存在于>20 μm的 D2群体附生细菌群落的细菌相对丰度变化
Fig.6Venn analysis of bacterial communities in different particle sizes in colonial D2 culture system and changes in the relative abundance of bacteria present only in bacterial communities associated with the D2 colonies (>20 μm)
在>20 μm的D2群体附生菌群中,15℃下的特化种有:OTU659(Alphaproteobacteria)、OTU711(Alphaproteobacteria)、OTU535(OPB56)、OTU669(Methylobacteriaceae)、OTU687(Hyphomonadaceae)、OTU722(Brevundimonas sp.)和OTU682(Pseudoxanthobacter sp.);OTU511(Roseococcus sp.)、OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)、OTU682(Pseudoxanthobacter sp.)和OTU687(Hyphomonadaceae)为20℃下的特化种;25℃下的特化种包括:OTU511(Roseococcus sp.)、OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)、OTU682(Pseudoxanthobacter sp.)、OTU687(Hyphomonadaceae)、OTU455(Devosia sp.)和OTU582(Hyphomicrobium sp.);30℃培养体系中的特化种包括:OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)、OTU682(Pseudoxanthobacter sp.)、OTU455(Devosia sp.)和OTU582(Hyphomicrobium sp.)。
图7各温度下不同粒径细菌群落OTUs的SPEC-OCCU图及特化种的相对丰度分析
Fig.7SPEC-OCCU plots of OTUs and relative abundance of specialized species in bacterial communities in different particle sizes under various temperatures
各粒径附生细菌群落的特化种分析结果表明:在游离细菌群落中,OTU655(Limnobacter sp.)为不依赖于温度的特化种,OTU767(Gemmatimonas sp.)、OTU259(Hydrogenophaga sp.)和OTU450(Sphingopyxis sp.)为15和20℃下共有的特化种。在3~20 μm的单细胞-小群体微囊藻附生菌群中,OTU447(Phenylobacterium sp.)为15 和20℃下共有的特化种。在>20 μm的群体附生菌群中,OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)和OTU682(Pseudoxanthobacter sp.)不依赖温度,在所有温度下均为特化种;OTU687(Hyphomonadaceae)为15、20和25℃培养体系的共有特化种;OTU511(Roseococcus sp.)在20 和25℃下均为特化种;OTU455(Devosia sp.)和OTU582(Hyphomicrobium sp.)在25 和30℃下均为特化种。
这些特化种存在于所有粒径的附生细菌群落中,在相应的细菌群落中拥有较高的相对丰度:游离细菌群落中的特化种在游离细菌群落中的相对丰度基本在0.21%~6.06%的范围内变化,但3~20 μm的单细胞-小群体微囊藻附生菌群及>20 μm的群体附生菌群的相对丰度大多<0.4%;3~20 μm的单细胞-小群体附生菌群的特化种的相对丰度在0.03%~10.53%之间变化,在其他粒径下的相对丰度基本<0.4%;>20 μm的微囊藻群体附生菌群的特化种在>20 μm的微囊藻群体附生菌群中的相对丰度在0.09%~12.56%的范围内变化,在其他粒径下基本<1%;低温下游离细菌群落及3~20 μm的单细胞-小群体微囊藻附生菌群特化种的相对丰度较高。
2.5 铜绿微囊藻D2群体培养体系中不同粒径下的网络关键节点分析
综合各种温度处理,分析不同粒径中细菌群落的网络关系。在游离细菌群落、3~20 μm的单细胞-小群体微囊藻附生菌群和>20 μm的D2群体附生菌群相关网络的关键节点均为连接节点,分别有3、6和25个关键节点(图8)。游离细菌群落的网络关键节点为OTU561(Microcystis aeruginosa)、OTU679(Sphingomonas sp.)和OTU708(Gemmobacter sp.);3~20 μm的单细胞-小群体微囊藻附生菌群的网络关键节点包括OTU511(Roseococcus sp.)、OTU561(Microcystis aeruginosa)、OTU567(Sphingobacteriales)、OTU669(Methylobacteriaceae)、OTU708(Gemmobacter sp.)和OTU767(Gemmatimonas sp.);>20 μm的D2群体附生菌群相关网络的关键节点包括OTU447(Phenylobacterium sp.)、OTU450(Sphingopyxis sp.)、OTU511(Roseococcus sp.)、OTU512(Devosia sp.)、OTU544(Phyllobacteriaceae)、OTU556(Pseudomonas sp.)、OTU561(Microcystis aeruginosa)、OTU569(FukuN57)、OTU603(Mesorhizobium sp.)、OTU665(Alphaproteobacteria)、OTU669(Methylobacteriaceae)、OTU672(Alphaproteobacteria)、OTU676(Mariniradius sp.)、OTU679(Sphingomonas sp.)、OTU690(Phreatobacter sp.)、OTU695(Mariniradius sp.)、OTU711(Alphaproteobacteria)、OTU722(Brevundimonas sp.)、OTU729(Blastomonas sp.)、OTU737(Alphaproteobacteria)、OTU743(Devosia sp.)、OTU744(Sphingomonas sp.)、OTU754(Sphingomonas sp.)、OTU758(Sphingomonadales)和OTU771(Alphaproteobacteria)。
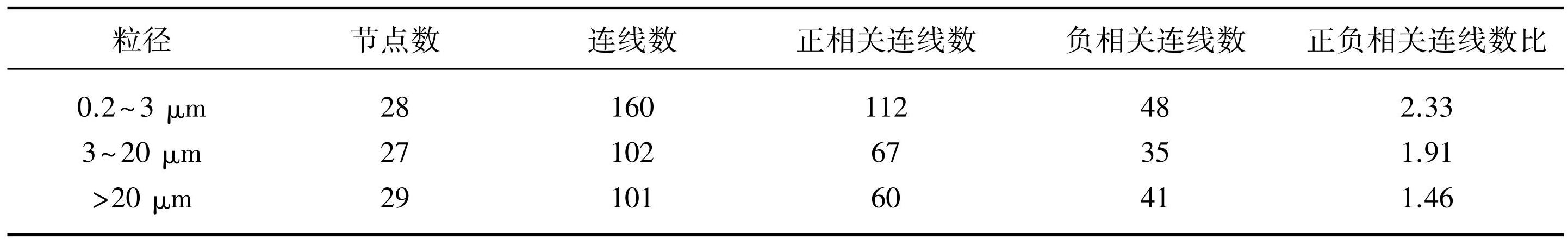
图8为OTU水平下不同粒径的微生物群落中藻菌及细菌之间的相互作用网络,从门水平上对节点进行分类。3个粒径下的节点数相差不大,游离细菌群落间的连线数最多,有160条,其中正相关的有112条,负相关的有48条;3~20 μm单细胞-小群体微囊藻和>20 μm的D2群体的微生物群落连线数相似,但3~20 μm单细胞-小群体微囊藻的微生物群落中正相关连线数较多(表1)。结果表明游离细菌群落中各物种之间的相互作用关系更加复杂。
3 讨论
3.1 不同温度对铜绿微囊藻D2群体生长的影响
富营养化湖泊中的蓝藻通常在25~30℃具有较高的生长优势[22-23]。而不同种属的蓝藻对温度的响应不同,从而决定其发生水华的时间不同[24]。有研究表明,微囊藻的最适生长温度在25℃左右[24-25],本研究也发现铜绿微囊藻D2群体在25℃下的平均比生长速率最大。 Zhu等[5]基于野外和室内实验数据,发现在温度超过20℃时,随着培养时间延长,微囊藻群体明显减小,而在15℃时没有明显变化。Duan等[26]则发现惠氏微囊藻群体和鱼害微囊藻群体在15~25℃明显增大,但当温度从25℃增加到30℃时,鱼害微囊藻群体明显减小,而惠氏微囊藻群体增大,可见温度影响微囊藻群体的形成而且具有种间差异。蓝藻水华生消过程伴随着藻群体大小变化以及藻群体生物量的改变。结合Zhu等[5]得到的高温可使微囊藻群体明显减小的研究结果,得出结论:较高的温度会促进D2群体的生长,但可能不利于群体的维持,表现为D2群体大小和数目减少,群体解散较快。
图8D2群体培养体系中细菌群落在不同粒径下的物种相关性网络分析(红色线条代表正相关,绿色线条代表负相关,物种之间的关系密切程度与连线数呈正相关)
Fig.8Species correlation network analysis of bacterial community in different particle sizes in colonial D2 culture system
3.2 温度对铜绿微囊藻D2群体各粒径附生细菌群落组成随生长周期变化的影响
Zhu等的研究表明,即使是11年前分离得到的蓝藻菌株,其附生细菌群落结构和野外蓝藻的细菌群落结构也无显著差异[27]。Li等、Xie等对从野外分离并短期培养的微囊藻群体进行宏基因组分析发现,其附生细菌群落中存在Rhizobiales、Sphingomonadales、Rhodobacterales、Gemmatimonadales、Caulobacterales、Pseudomonadales、Burkholderiales、Rhodospirillales和Flavobacteriales等常见于野外微囊藻附生细菌群落的细菌类群[28-29]。这些细菌类群在本实验所使用的D2群体的附生细菌群落中也存在,因此该实验中D2群体的附生细菌群落变化及与群体状态有关的关键细菌对野外微囊藻群体与细菌关系的研究具有一定的参考意义。
表1D2群体培养体系中细菌群落在不同粒径下的物种相关性网络特征参数(含蓝藻序列)
Tab.1 Characteristic parameters of species correlation network of bacterial community in colonial D2 culture systems in different particle sizes (including cyanobacteria sequences)
Pseudomonadales可与铜绿微囊藻进行磷交换[30],随着培养时间的增加,培养基中的营养物质浓度会逐渐减少,以此来看Pseudomonadales的相对丰度应该随生长时间的增加而升高,但实验结果却与之相反:在所有温度与粒径下,Pseudomonadales的相对丰度均急剧降低,说明Pseudomonadales在微囊藻群体形成与维持中还有未被发现的作用,且其功能受温度影响不大。Caulobacterales可以产生一种极性粘附素用于表面黏附和细胞之间的粘附[31],属于Rhodobacterales的Rhodobacteraceae在生物膜形成之初发挥了重要作用,可能会促进富氮环境中的反硝化作用,从而促进形成生物膜以及增加群落多样性[32],在3~20 μm的单细胞-小群体微囊藻的附生细菌群落中,其相对丰度在所有温度下均呈现先升高后降低的趋势,且相对丰度增加的时间与D2群体数目增长的时期基本相符,因此Caulobacterales和Rhodobacterales可能与微囊藻群体的形成有关。
Cytophagales可以降解微囊藻毒素及微囊藻细胞[33],其相对丰度随生长周期的变化趋势在不同温度下不同,但其在游离细菌群落及3~20 μm的单细胞-小群体微囊藻的附生细菌群落中的相对丰度在实验后期均较高,说明随着生长时间的增加,该菌在裂解死亡的藻细胞中发挥重要作用,有利于培养体系中的营养循环。此外>20 μm的微囊藻群体附生细菌群落中的相对丰度较其他粒径低可能是由于更大的群体抵御外界不良环境的能力更强。
Sphingomonadales是一类重要且常见的附生细菌[12],对Suaeda glauca 以及 Phragmites australis根际细菌的研究过程中发现Sphingomonadales可以大量地产生用于细菌间细胞通讯的酰化高丝氨酸内酯(Acyl-homoserine lactones,AHLs)[34],这可能有利于相关细菌在微囊藻藻际聚集,因此Sphingomonadales可能与微囊藻附生细菌群落的形成有关。其产生的鞘磷脂(glycosphingolipids,GSLs)也可能在群体维持中发挥作用[18],在所有温度下,Sphingomonadales在>20 μm微囊藻群体及3~20 μm的单细胞-小群体微囊藻附生细菌群落中的相对丰度在第15~45天较高可能与此有关。在15、20和25℃下各粒径的附生细菌群落中,Sphingobacteriales的相对丰度均在第0~15天增加,而30℃时,其相对丰度在第0~35天降低,表明Sphingobacteriales和微囊藻的相互作用可能会受到高温的影响。
3.3 铜绿微囊藻D2群体培养体系中独有种、特有种、关键物种作用分析
许多研究表明附生细菌在微囊藻群体的形成过程中发挥了重要作用。Wang等发现微囊藻群体中的2株属于γ-Proteobacteria的细菌和1株属于 Bacteroidetes的细菌在群体完全解散为单细胞后消失,之后又将从微囊藻群体中分离的附生细菌加入单细胞微囊藻中,以此了解附生细菌与微囊藻群体的关系,发现了5种可以促进微囊藻形成群体的细菌,且与细菌共培养的培养体系中紧密结合的胞外聚合物(tightly bound extracellular polymeric substances,TB-EPS)含量增加,而TB-EPS在微囊藻群体的形成中发挥重要作用[11,35]。温度可以影响微囊藻群体上附生细菌的群落结构,从而改变微囊藻与细菌之间的相互作用,进而影响水华的形成。本实验通过观察微囊藻群体的形态变化以及不同各粒径下附生细菌群落结构的改变,揭示了在不同温度下,在微囊藻群体形成与解散过程中的关键细菌,这有助于深入了解附生细菌与微囊藻群体的关系。
藻类对附生细菌具有选择作用,不同细菌对定殖的环境也有偏好,各粒径下附生细菌群落的特化种可能是藻类和细菌双向选择的结果,有研究发现群体附生细菌可能比游离细菌对微囊藻的形成产生更大的影响[36]。只在>20 μm的微囊藻群体的附生细菌群落中存在的细菌及>20 μm的微囊藻群体附生细菌群落的特化种与微囊藻群体的状态更为密切,且关键物种的缺失可能导致模块和网络的崩解,因此>20 μm的微囊藻群体附生细菌群落的独有种、特化种及关键种对微囊藻群体的形态变化有重要的作用。
研究发现部分细菌可以直接或间接影响微囊藻群体的形态(表2):Chryseobacterium sp.、Sphingomonas sp.和Pseudomonas sp.菌株可显著增加铜绿微囊藻的群体大小;Porphyrobacter sp.、Pseudomonas sp. CM-1和Sphingomonas sp. CM-2 与微囊藻群体的维持有关[10,12,35];Pseudomonas、FukuN57、Gemmobacter、Phreatobacter、Roseococcus及Mariniradius导致了微囊藻群体附生细菌群落与单细胞微囊藻附生细菌群落的差异[37];有研究发现,在高温条件下微囊藻群体更易分解为单细胞,而Mariniradius可能与此过程有关[18];Bi等发现在微囊藻群体体系中加入可以抑制蓝藻群体生长的枯草芽孢杆菌后Methylobacteriaceae的相对丰度低于对照组[38],因此猜测Methylobacteriaceae与微囊藻群体生长有关。Sphingomonadales可能影响微囊藻水华形成[15],且属于该目的Porphyrobacter可以刺激胞外聚合物的释放,而释放的EPS可以将藻类和细菌细胞聚集形成群体,促进蓝藻水华的形成,并多次被报道可能与微囊藻群体有关[10,35,39-40]。Actinobacteria的部分代谢产物可以抑制蓝藻水华的形成[41]。在营养物质枯竭或浓度较低的环境中,Gemmatimonas能促进磷向微囊藻细胞转移,而使水华维持更长的时间[42],Aeromonas sp.可诱导单细胞微囊藻形成微囊藻群体[11]。
表2与微囊藻群体形成与解散有关的细菌
Tab.2 Bacteria associated with Microcystis colonies formation and disaggregation

部分细菌与胞外多糖或生物膜形成有关:Caulobacterales产生的粘附素[31]可能有利于微囊藻细胞通过细胞黏附形成群体;大多数Hyphomonadaceae细菌都可以降解复杂的化合物,且可以附着或者形成生物膜[43]。而EPS是微囊藻群体形成所必需的,因此它们可能与微囊藻群体的形成或解散有关。
Gan等发现微囊藻毒素能明显增加微囊藻群体的大小[44],因此微囊藻毒素降解菌可能会改变微囊藻群体状态,而Rhizobiales、Hydrogenophaga、Alphaproteobacteria、Burkholderiales、Enterobacteriales、Bacillales与微囊藻毒素降解有关[45-49],因此它们可能与微囊藻群体的形态变化有关。Brevundimonas和Rhizobium是群体附生细菌群落网络的关键节点,且常见于铜绿微囊藻水华中[50-51]。研究发现Bacteroidales与微囊藻水华相关[14]。
温度会影响微囊藻的生长速度及微囊藻群体的大小、数目和解散速度:研究发现高温会促进有毒微囊藻菌株的生长并影响微囊藻群体的大小[5,26,52],低温可以诱导微囊藻群体的形成[53-54]。温度也会影响附生细菌群落的结构,而图6和图7都显示在低温条件下与微囊藻群体密切相关的细菌相对丰度更高,因此说明温度可能是通过影响相关细菌的相对丰度进而改变微囊藻群体形态。
3.3 铜绿微囊藻D2群体培养体系中主要的细菌类群在自然水体中的分布
Kim等从韩国发生蓝藻水华的8个地点采集了蓝藻样本,测序后发现Brevundimonas普遍存在于样本中[51],Sphingomonadales常见于微囊藻群体中,且可能为微囊藻藻华提供不可缺少的元素[12,14],Rhodobacterales也是微囊藻附生细菌中常见的一类,且是水华期间维生素B-12的主要提供者[55],Sphingobacteriales在游离细菌群落中的相对丰度比群体附生细菌群落中的高[56],Yang等发现在滇池铜绿微囊藻水华期间属于Chlorobiales的某一种OPB56细菌在游离细菌中占据优势[50],且在蓝藻水华期间OPB56的相对丰度显著高于非蓝藻水华期间[57-58]。Shi等发现Caulobacterales在>120 μm的微囊藻群体中丰度较高[59],Cytophagales在微囊藻群体中相对丰度较高[56]。
4 结论
1)温度影响微囊藻群体维持和解散过程:15℃下微囊藻群体可以维持很久的群体状态,直到第65天都没有解散,25和20℃下微囊藻群体维持时间相近,30℃下微囊藻群体解散最快,且温度越高微囊藻群体数目达到峰值的时间越短。
2)在属水平上的分析发现,部分细菌只在部分粒径下相对丰度较高:Limnobacter只在游离细菌群落中相对丰度较高;Roseococcus只在>20 μm的D2群体附生细菌群落中相对丰度较高;Porphyrobacter在游离细菌群落及3~20 μm的单细胞-小群体微囊藻附生细菌群落中相对丰度较高;Mesorhizobium在3~20 μm的单细胞-小群体微囊藻附生细菌群落及>20 μm的D2群体附生细菌群落中相对丰度较高。
3)不同温度培养体系中微囊藻群体状态的异同可能与培养体系中关键细菌有关:部分独有种及特化种只在15℃下出现,这可能与15℃下培养体系中群体维持时间较长有关;OTU669(Methylobacteriaceae)、OTU722(Brevundimonas sp.)和OTU682(Pseudoxanthobacter sp.)在所有温度下均为>20 μm的D2群体附生细菌群落的特化种,这表明它们与>20 μm的微囊藻群体密切相关,可能与微囊藻群体的形态变化有关。 >20 μm的微囊藻群体附生细菌群落的网络关键节点较多,表明群体附生细菌群落具有较高的稳定性。


