(2: 中国科学院海洋研究所, 青岛 266071)
(3: 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012)
(2: Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, P.R. China)
(3: State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, P.R. China)
当前河流生态系统整体性保护及策略制定是水生态学科中研究的热点与难点,实现这一目标的前提是要对河流生物多样性进行准确评估。在此背景下,如何全面科学地获取河流水生生物多样性信息,揭示其对人为干扰的响应备受生态学家的关注。大型底栖动物处于食物链的中间环节,对维系河流生态系统结构和功能稳定具有重要作用[1]。以往大型底栖动物多样性评估主要基于形态学方法,与此相比,环境DNA技术在生物多样性评估中能够提供更多关于稀有物种的信息。例如,王雨[2]对钱塘江42个山区河流点位进行研究发现,基于形态学方法共采集229种大型底栖动物,而eDNA技术注释到859种大型底栖动物,在稀有物种的检测上展现了巨大的优势。
近二十年来,受人为干扰的影响,河流大型底栖动物多样性正以前所未有的速度下降[3]。河岸带土地利用方式转变是影响河流大型底栖动物的关键要素之一[4]。研究表明,土地利用方式转变会造成水质变化[5-6]。如农业用地和建设用地面积的增加会导致外源性离子和营养盐浓度激增,造成水体盐化和富营养化[5]。此外,农业用地和建设用地还会导致土壤中抗生素浓度升高[6],并随降水形成的地表径流进入水体。外源性离子、营养盐和抗生素浓度的激增,无疑会对大型底栖动物产生影响[7-9]。然而,以往有关外源性离子、营养盐和抗生素与大型底栖动物群落之间响应关系的研究主要聚焦其中一类环境因子的影响,多环境因子通过耦合效应对生物群落产生的影响却鲜有报道。近年来,He等[10]利用变差分解分析(variance partitioning analysis,VPA)研究了海拔、坡向、水环境因子对大型底栖动物多样性的独立效应和耦合效应。研究发现,海拔和水环境因子对大型底栖动物群落组成变化的贡献率为9%;坡向和水环境因子的贡献率是8%。由此可见,该方法是揭示多环境因子对水生生物群落组成独立效应影响和耦合效应影响的有效方法之一。
山东省济南市南部山区是位于黄河流域下游的山区河流,分布有锦绣川、锦阳川和锦云川等重要河流,承担着济南市南部40万居民的供水功能[11],同时也是济南诸泉水源的重要补给。随着黄河流域下游城市群经济的迅猛发展,快速的城市化进程给脆弱的生态环境带来了巨大的压力,导致生物多样性下降[12]。因此,对该区域进行生物多样性保护是响应黄河高质量发展国家战略的必然要求。以往针对该区域的研究主要关注关键环境因子对大型底栖动物群落结构及摄食功能群的影响[13-14],而这些环境因子是否会通过耦合效应影响河流生物多样性仍是未知。鉴于此,本研究以南部山区大型底栖动物为研究对象,基于多类环境因子的调查监测,分析关键环境因子对大型底栖动物α-和β-多样性的耦合效应,以期为山区河流生物多样性保护策略的制定提供科学依据。
1 材料与方法 1.1 采样点设置济南市南部山区河流(30°05′~30°57′N, 119°28′~120°08′E)地处泰山余脉,是济南市重要的生态屏障。本文选择南部山区锦绣川、锦阳川、锦云川及三川汇合后河流开展研究,研究区涉及流域面积256 km2[15]。与黄河流域上游山区河流不同,该研究区土地利用类型以林地和草地为主;但近40年来,农业用地和建设用地比例逐渐增加[11],农业灌溉、岩矿开采和生活污水排放等已造成外源性离子、营养物质、抗生素等直接入河,生态环境急剧恶化。考虑到南部山区人为干扰程度不同,同时兼顾空间异质性,在锦绣川、锦阳川、锦云川及三川汇合后河流布设10个采样点。其中,锦绣川设置3个采样点(NS01~NS03),锦阳川3个(NS04~NS06),锦云川2个(NS07~NS08);三川汇合后河流2个(NS09~NS10)(图 1)。

|
图 1 采样点分布 Fig.1 Location of sampling sites |
2021年8月对10个采样点开展水环境因子野外监测。其中,电导率(EC,μS/cm)在野外利用便携式水质参数仪(YSI,USA)进行现场测定,以表征河流的盐化特征[16]。此外,每个采样点采集1 L地表水,在实验室进行总氮(TN,mg/L)、氨氮(NH3-N,mg/L)、硝态氮(NO3--N,mg/L)和总磷(TP,mg/L)等营养盐以及大环内酯类(MACs,ng/L)、喹诺酮(FQs,ng/L)、四环素类(TCs,ng/L)和磺胺类(SAs,ng/L)等抗生素的测定。其中,营养盐的测定参照《水和废水监测分析方法》(第四版)[17],抗生素利用三重串联液质联用仪(LC-MS/MS)采用内标法测定[18]。
1.3 生物样品的采集与测定 1.3.1 生物样品的采集同期采集水环境DNA样品用于大型底栖动物监测。在每个样点选取100~200 m作为监测河段,包含缓流区、急流区和回水区,在每个区设置1个采样断面。采集河流表层(距水面10 cm处)3 L河水,经0.25 μm滤膜(Millipore, USA)过滤,每张滤膜过滤水样300~500 mL,将过滤后5个平行样品的滤膜分别放入5 mL离心管中,置于液氮中保存带回,贮存于-80℃冰箱中以待分析。
1.3.2 DNA提取与PCR扩增利用E.Z.N.ATM Mag-Bind Soil DNA Kit(OMEGA, USA)对滤膜上富集的DNA片段进行提取,提取方法严格按照试剂盒说明书进行。
基于广泛使用的大型底栖动物通用引物mlCOIintF和dgHCO2198进行PCR扩增[19]。正向引物为mlCOIintF:5′-GGWACWGGWTGAACWGTWTAYCCYCC-3′,反向引物为dgHCO2198:5′-TAAACTTCAGGGTGACCAAARAAYCA-3′。第1轮扩增体系为30 μL,其中包括2×HieffⓇRobust PCR Master Mix 15 μL,正反向引物各1 μL,DNA模板10~20 ng,加无菌水至30 μL。PCR的扩增条件为: 94℃预变性3 min,94℃变性30 s,45℃退火20 s,65℃延伸30 s,变性、退火及延伸步骤循环20次,再于72℃进行末次延伸5 min。第2轮扩增引入Illumina桥式PCR兼容引物,将其置于无菌PCR管中(200 μL)配制与第一步相同的反应体系,遵循以下反应条件:95℃预变性3 min,94℃变性20 s,55℃退火20 s,72℃延伸30 s,2~4操作步骤循环5次,再于72 ℃最后延伸5 min。最后,在Illumina MiSeq PE300平台进行高通量测序(生工生物工程(上海)股份有限公司)。下机得到的双端序列数据(PE reads),再根据PE reads之间的overlap关系,将成对的reads拼接成一条序列。通过对获取的优质序列进行聚类,将相似度高于97% 的序列视为同种。然后选取每个OTU中最长的序列为代表序列,将该序列与GenBank检索的COI网络数据库比对,进行物种注释,以获得各样品中OTU的丰度表和物种注释结果。
1.4 数据分析首先,剔除所有子样本中相对丰度 < 0.001% 和检测频率 < 10% 的operational taxonomic units(OTUs)。然后,剔除每个监测点位5个子样本中检出率 < 50% 的OTUs;将子样本中剩余OTUs的reads数取平均,作为每个样点OTUs的reads数。最后,通过查询剩余OTUs的生物学信息,仅保留淡水底栖动物的OTUs数据,用于后续统计分析。
为研究黄河流域下游4条山区河流水化学指标的差异性,对各样点的水环境因子进行单因素方差分析(One-way ANOVA)。生物多样性之间的差异性选用Kruskal-Wallis非参数检验(K-W test)。采用相似性百分比(SIMPER)分析导致各河流差异性显著的关键物种(仅P < 0.05的物种被保留)。同时,利用Upset图探讨不同山区河流之间的共有物种和特有物种,进一步揭示山区河流中大型底栖动物的区域组成差异。选用基于距离的偏冗余分析(distance-based redundancy analysis,db-RDA)识别造成流域内大型底栖动物群落组成变异的显著性环境因子,同时结合变差分解分析(variance partitioning analysis,VPA)计算显著性环境因子对大型底栖动物群落组成变化的贡献率。基于db-RDA筛选出的关键环境因子,利用t值双标图(t-value biplot),分析每种大型底栖动物对关键环境因子的响应[20]。
为分析盐化、营养盐和抗生素三类环境因子对大型底栖动物多样性的耦合效应影响,构建逐步判别回归模型(stepwise regression model),筛选出Akaike信息校正准则(akaike information criterion corrected,AICc)变化值ΔAICc最小的模型。大型底栖动物多样性指标选取α-和β-多样性两个空间尺度的指数。其中,α-多样性指数包括Shannon-Wiener多样性指数(H′)、Marglef指数(d)和Chao1丰富度指数。β-多样性指数包括总β多样性(βSOR)及其两个组分:物种周转(species turnover,βSIM)和嵌套(species nestedness,βNES)。
数据分析中的单因素方差分析、K-W非参数检验和逐步判别回归模型在SPSS 20中完成,t值双标图在Canoco 5.0中绘制,db-RDA分析在Primer e软件中进行,SIMPER、VPA、α-和β-多样性指数的计算采用R语言操作平台(版本4.2.1)。其中,SIMPER、VPA分析和α-多样性指数的计算使用“vegan”程序包[21],β-多样性指数选用“betapart”程序包中的“beta.pair”法进行计算[22]。
2 结果与分析 2.1 环境因子特征从整个研究区来看,黄河流域下游的4条山区河流盐化程度和营养盐浓度较高(表 1)。表征盐化程度的EC平均为(500.6±38.0) μS/cm。各类营养盐指标中,TN浓度最高,为地表水劣Ⅴ类水平(>2.0 mg/L);其次为NH3-N,介于Ⅰ~Ⅲ类之间(0~1.0 mg/L);TP浓度最低,达Ⅰ类水质标准(< 0.02 mg/L)。四类抗生素中,FQs浓度最高,平均值为(2.73±0.43) ng/L;其次为SAs((1.52±0.10) ng/L);TCs和MACs浓度最低,分别为(0.67±0.24)和(0.12±0.02) ng/L。
| 表 1 黄河流域下游山区河流的环境特征(平均值±标准差)* Tab. 1 Environmental characteristics in mountainous rivers at lower Yellow River Basin (Mean±SD) |
从不同河流来看,锦绣川、锦阳川、锦云川、三川汇合后河流的污染程度及污染类型不同(表 1)。锦云川的EC、TN、NH3-N和NO3--N平均浓度最高,其中锦云川中的TN和NO3--N浓度显著高于锦绣川和三川汇合后河流(P < 0.05)。锦阳川中TP、FQs和SAs的平均浓度最高,且锦阳川中SAs的浓度显著高于锦绣川(P < 0.05)。MACs和TCs浓度分别在锦绣川和三川汇合后达到最大,但这2种污染物在各河流之间无显著差异(P>0.05)。以上三类环境因子的污染状况表明,锦云川水质最差,锦绣川水质最好。
2.2 大型底栖动物群落组成及多样性分布特征 2.2.1 大型底栖动物群落组成环境DNA共注释出大型底栖动物25种,隶属于4门5纲9目15科23属(图 2A)。其中,节肢动物门种类数最多,为16种,均为昆虫纲生物。其次是环节动物门、软体动物门和线形动物门,分别为6种(寡毛纲6种)、2种(腹足纲1种、双壳纲1种)和1种(色矛纲1种)。从不同河流来看,大型底栖动物组成也呈现出节肢动物门>环节动物门>软体动物门>线形动物门(图 2B)。
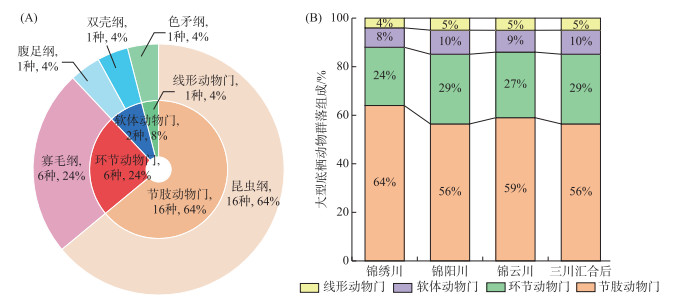
|
图 2 研究区(A)及各河流(B)大型底栖动物的群落组成 Fig.2 Community composition of macroinvertebrates in the study area (A) and each river (B) |
SIMPER分析结果表明,黄河流域下游各河流大型底栖动物群落结构差异显著(表 2)。造成锦绣川和锦阳川大型底栖动物群落结构差异显著的关键物种为昆虫纲的大蚊(Tipula abdominalis)、天角蜉(Uracanthella punctisetae)和寡毛纲的顠体虫(Aeolosoma sp.);造成锦绣川和锦云川大型底栖动物群落结构差异显著的关键物种为昆虫纲的双线环足摇蚊(Cricotopus bicinctus);造成锦绣川和三川汇合后河流大型底栖动物群落结构差异显著的关键物种为昆虫纲的刀铗多足摇蚊(Polypedilum cultellatum)和蜍蝽(Ochterus marginatus)以及寡毛纲的颤蚓(Tubifex ignotus)。造成锦阳川和锦云川大型底栖动物群落结构差异显著的关键物种为昆虫纲的双线环足摇蚊;造成锦阳川和三川汇合后河流大型底栖动物群落结构差异显著的关键物种为昆虫纲的刀铗多足摇蚊和蜍蝽。
| 表 2 大型底栖动物特征种平均丰富度及其对组内相似性贡献百分比 Tab. 2 The average abundance of characteristic species and their percentage contribution to similarity within the group |
河流共有物种和特有物种结果表明(图 3),研究区共有物种为18种,占总物种数的72%,包括节肢动物门9种、环节动物门6种、软体动物门2种和线形动物门1种。锦绣川、锦阳川、锦云川和三川汇合后河流中,仅锦绣川有1种特有物种,占总物种数的4%。黄河流域下游4条山区河流丰富的共有物种和匮乏的特有物种表明,整个流域的物种组成均质化显著。
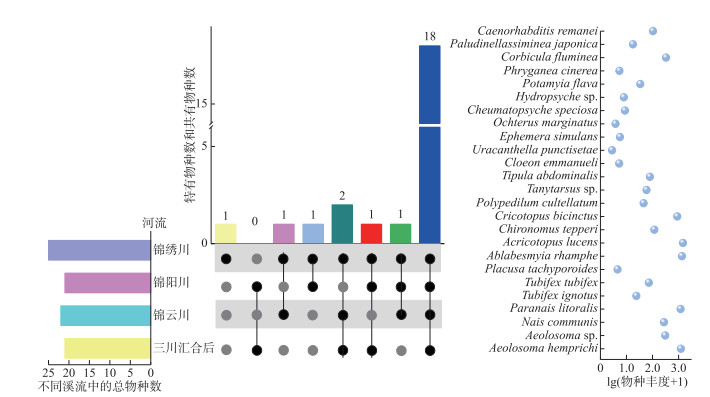
|
图 3 各山区河流的共有物种和特有物种 Fig.3 The shared and unique speciesin each mountainous river |
α-多样性结果表明,H′介于1.14~2.22之间(图 4A),均值为1.81,根据生物多样性评价标准[1],南部山区整体处于中度污染等级(1 < H′ < 2);d介于1.87~4.01之间,均值为3.23,水体为清洁等级(d>3);Chao1指数介于11.75~28.00之间,均值为19.10。K-W检验表明,生物多样性指数在各河流之间无显著差异(P>0.05)。H′和d的最大平均值出现在三川汇合后河流,分别为2.08和3.66;Chao1丰富度指数最大平均值出现在锦绣川,为24.67。从每条河流来看,锦绣川H′和d的最大值出现在下游,而Chao1丰富度指数的最大值出现在上游;锦阳川H′的最大值出现在下游,d和Chao1丰富度指数的最大值出现在上游;锦云川H′和d从上游向下游逐渐递减,Chao1丰富度指数逐渐递增。三川汇合后河流H′、d及Chao1丰富度指数的分布模式与锦云川相反。
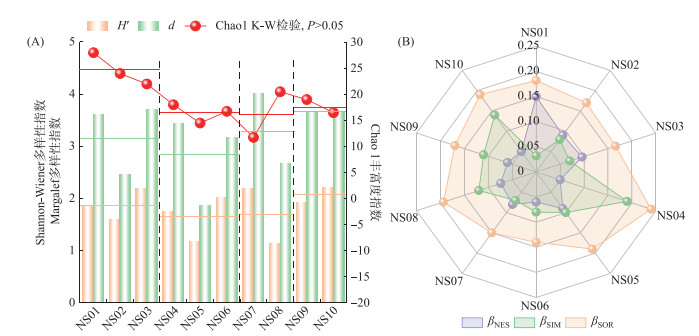
|
图 4 大型底栖动物α-多样性(A)和β-多样性(B)分布特征 (橙色、绿色和红色线分别表示H′、d和Chao1指数的均值) Fig.4 Distribution characteristics of α-diversity (A) and β-diversity (B) of macroinvertebrate (Orange, green and red lines represent the average values of H′, d and Chao1, respectively) |
β-多样性结果表明(图 4B),黄河流域下游4条山区河流60% 样点的βSIM高于βNES,说明随着环境干扰的增强,大型底栖动物群落组成的变化以物种更替(βSIM)为主。从每条河流来看,锦绣川βSIM均低于βNES,说明该河流的生物组成变化主要是由物种丧失导致的;相反,锦阳川和三川汇合后河流βSIM均高于βNES,说明这2条河流生物组成变化是由物种更替造成的。
2.3 多环境因子对大型底栖动物群落组成的影响盐化和营养盐是显著影响研究区大型底栖动物群落组成变化的主要因素(图 5)。db-RDA结果显示,EC和营养盐中的TP、NH3-N及TN对大型底栖动物群落组成变化的解释率为64.05%。其中,EC的解释率为22.86%,营养盐中TP、NH3-N和TN的解释率分别为20.12%、13.25% 和7.81% (图 5A)。VPA结果显示,盐化可与营养盐和抗生素通过耦合效应对大型底栖动物群落组成产生影响,贡献率分别为21.60% 和16.20%;抗生素和营养盐对大型底栖动物群落组成影响的贡献率为19.60% (图 5B)。
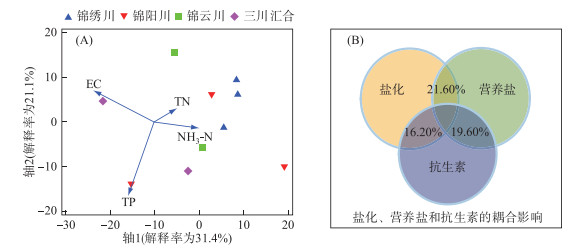
|
图 5 大型底栖动物群落的主要影响因子(A)及其影响贡献(B) Fig.5 The main factors affecting the changes of macroinvertebrate community (A) and their contribution rate (B) |
t-值双标图结果表明,不同物种对不同环境因子的响应具有显著差异(图 6)。共筛选出3种对关键环境因子具有显著响应的物种(大型底栖动物及其相应代码见附表Ⅰ)。其中,双线环足摇蚊(sp11)仅对TN一种环境因子呈显著正响应(图 6B);沿岸拟仙女虫(Paranais litoralis,sp4)对EC呈正响应(图 6A),对TN呈负响应(图 6B);正颤蚓(Tubifex tubifex,sp6)对EC和TP呈正响应(图 6A,D),对TN呈负响应(图 6B)。

|
图 6 大型底栖动物与环境因子的t-值双标图 (A~D分别表示生物对EC、TN、NH3-N和TP的响应) Fig.6 The t-value biplot of macroinvertebrate and environmental factors (A-D represent the response of organisms to EC, TN, NH3-N and TP, respectively) |
逐步判别回归模型结果表明,不同多样性指数受不同环境因子的影响(图 7)。Margalef指数(d)的变化与NH3-N、NO3--N和EC显著相关(图 7B)。随河流中NO3--N浓度升高,d与NH3-N之间的响应关系向右偏移(k值变大),说明NO3--N增强了d与NH3-N之间的正响应关系(k>0);随着EC升高,d与NH3-N之间的响应关系向右偏移(k值变大),而d与NO3--N之间的响应关系向左偏移(k值变小),说明EC增强了d与NH3-N之间的正响应关系,以及d与NO3--N之间的负响应关系。Chao1丰富度指数与营养盐中的NH3-N、NO3--N和抗生素中的TCs、MACs、SAs呈显著负相关关系(图 7C)。由此说明,以上环境因子是造成大型底栖动物稀有物种数下降的主要原因。βNES变化主要受抗生素(MACs和SAs)的影响,随MACs和SAs浓度增加,大型底栖动物的物种丧失率减缓(图 7F)。Shannon-Wiener多样性指数(H′)变化与NH3-N和NO3--N有关(图 7A),βSIM与TP有关(图 7D),βSOR与EC有关(图 7F),但环境因子与大型底栖动物多样性指数之间的响应关系并不显著(P>0.05)。
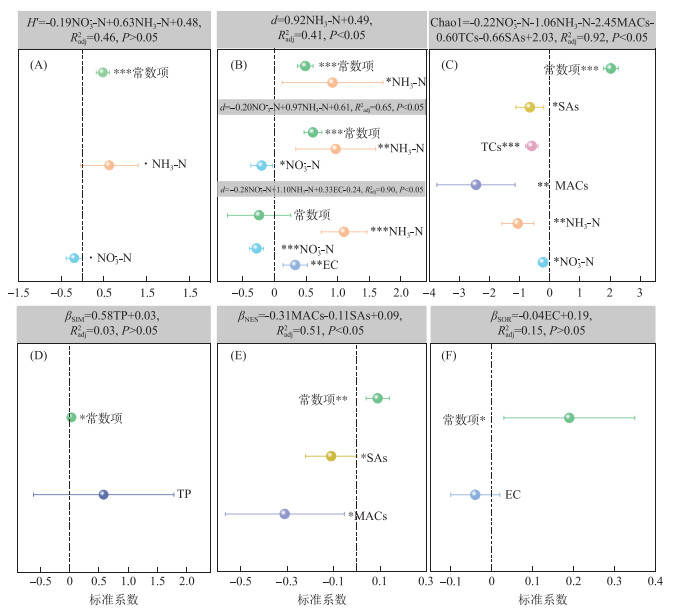
|
图 7 盐化、营养盐和抗生素对大型底栖动物多样性的耦合效应影响 (圆圈表示标准化回归系数,线表示环境因子标准化回归系数和常数项的95% 置信区间。当置信区间位于0轴同一侧时,认为该环境因子对生物多样性指数产生显著影响(P < 0.05)) Fig.7 Coupling effects of salinization, nutrients and antibiotic on macroinvertebrate diversity (The circles represent the standardized regression coefficients; the lines represent the 95% confidence intervals of the standardized environmental factors and intercept. The confidence intervals of regression coefficients of which are not crossing the zero line represent their significant effects (P < 0.05) on biodiversity indices) |
黄河流域下游4条山区河流中,大型底栖动物的群落组成具有独特性。在山区河流中,大型底栖动物中的水生昆虫往往占主导地位,而软体动物占比较低[23]。本研究区昆虫纲生物占比为64%, 软体动物仅占8% (图 2A),与黄河流域上游山区河流湟水河[24]、太湖[25]、渭河流域上游山区河流[26]以及北京市山区河流[27]中的大型底栖动物组成极为相似。驱动山区河流大型底栖动物群落组成独特性的主要因素是人为干扰。王川等[28]认为,在污染程度较轻的河流中,大型底栖动物以昆虫纲生物为主;而在污染严重的河流中,昆虫纲中的摇蚊和环节动物占优势地位。本研究证实了这一观点,黄河流域下游的4条山区河流,锦绣川水质较好,水生昆虫种类丰富、占比较高,为64%;软体动物和环节动物占比较低,分别为8% 和24% (图 2B)。昆虫纲的大蚊、天角蜉和寡毛纲的顠体虫是造成锦绣川与其他山区河流大型底栖动物群落结构差异的关键物种(表 2)。而锦阳川、锦云川和三川汇合后河流水质较差,指示种主要是昆虫纲的摇蚊幼虫(双线环足摇蚊和刀铗多足摇蚊)、半翅目幼虫(蜍蝽)以及寡毛纲的颤蚓等耐污生物。
导致黄河流域下游山区河流不同溪段大型底栖动物指示种转变的因素主要是盐化和营养盐的耦合效应。t-值双标图结果显示,2种指示种(沿岸拟仙女虫和正颤蚓)同时对盐化(EC)和营养盐(TN)呈现显著响应。其中,沿岸拟仙女虫和正颤蚓对EC呈显著正响应,对TN呈显著负响应,这一结果与前人相反。胡涛等[29]研究发现,颤蚓的生物密度和生物量与TN呈极显著幂函数正相关,而本研究正颤蚓的物种丰度却随河流TN浓度升高呈下降趋势(图 6B)。出现这一现象的原因可能是河流中高浓度的溶解性盐降低了正颤蚓对TN的耐受性。多项研究表明[30-33],溶解性盐浓度升高会阻碍不同形态氮、磷之间的转化,即使在无外源营养盐输入的情况下,也会引发河流富营养化,从而加剧大型底栖动物本地物种的生态压力的负效应,导致其对外界环境变化更加敏感。由此可见,多环境因子对大型底栖动物群落组成的耦合效应比单因子的独立效应更重要。
3.2 多环境因子对大型底栖动物不同尺度多样性的影响由多环境因子(盐化、营养盐和抗生素)导致的大型底栖动物群落组成变化,同时驱动了α-多样性的变化。Le等[34]证实,高浓度的营养盐和溶解性盐会通过改变水生生物群落组成影响其生物多样性。无论是耐污生物还是敏感生物, 均喜好在NH3-N浓度介于0.13~0.68 mg/L、EC < 249 μS/cm的环境中生存[8, 35]。黄河流域下游的济南市南部山区河流,其NH3-N浓度介于0.11~0.70 mg/L,处于大型底栖动物最佳的生存区间(表 1)。因此,d与NH3-N呈显著正响应。而EC平均为(500.6±38.0) μS/cm,是最适值的2倍。高浓度的溶解性盐会抑制微生物的硝化和反硝化速率,导致河流中过量的NO3--N因无法及时转化为其他形式的氮而对大型底栖动物产生毒性效应[31, 36]。Schäfer等[37]认为,河流中NO3--N浓度高于2.5 mg/L时就会对大型底栖动物产生低风险。而黄河流域下游的4条山区河流60% 样点中的NO3--N浓度均超过2.5 mg/L,从而限制了诸多大型底栖动物的生存。由于NH3-N的正效应无法抵消NO3--N对大型底栖动物产生的负效应,Margalef指数呈下降趋势。伴随外源营养盐的输入,河流中NO3--N浓度持续升高,这一过程进一步加剧了NO3--N对Margalef指数的负效应影响。而消耗掉的NH3-N通过外源营养物质的补充,始终处于最适浓度区间,由此,NH3-N与Margalef指数之间的正响应关系进一步增强。营养盐与抗生素对大型底栖动物α-多样性的耦合效应影响表明,这两类环境因子(NH3-N、NO3--N、TCs、SAs和MACs)均会对大型底栖动物Chao1丰富度指数产生负影响。Chao1丰富度指数是衡量河流中稀有物种多寡的指标。由于稀有物种具有种群小和分布区狭窄等特征,在面临环境变化时,有更高的灭绝风险[38]。因此,Chao1指数对营养盐和抗生素均呈现出显著负响应。
虽然db-RDA和VPA结果显示,盐化和抗生素对大型底栖动物群落组成的耦合效应影响是16.20%。但本研究并未发现这两类环境因子对大型底栖动物α-多样性的耦合效应。这可能与大型底栖动物的监测方式有关。eDNA技术本身存在一定的局限性,其产生和降解速率易受水温、pH、流速、紫外线和水域底质等诸多环境因子的影响[39]。此外,eDNA技术获取的OTUs序列需与数据库进行比对注释,若不能同步采集标本进行本地物种建库,就会导致部分数据缺失[39]。通过与前人在同流域基于形态学方法收集的大型底栖动物标本进行对比发现[12],eDNA未检测出软体动物梨形环棱螺(Bellamya purificata)和椭圆萝卜螺(Radix swinhoei)等对抗生素具有较强指示作用的生物[9]。以上物种的缺失可能在一定程度上减弱了盐化和抗生素对大型底栖动物多样性的耦合效应影响。
在多环境因子的耦合效应影响下,大型底栖动物群落还会发生同质化变化(β-多样性)。同质化过程的加剧会刺激物种多样性的丧失[40],使得物种的生态位重叠和遗传多样性下降[41-42]。黄河流域下游4条山区河流中,βSOR和βSIM变化分别受EC和TP影响。虽然二者之间的关系并不显著(P>0.05),但从一定程度说明EC和TP是导致不同样点大型底栖动物趋于同质化,促进物种周转的一个因素(图 7D)。逐步判别回归结果表明,适当地提高EC,有利于缓解黄河流域下游山区河流大型底栖动物趋于同质化的速率,同时提高大型底栖动物丰富度(d)。而黄河流域下游山区河流多环境因子与大型底栖动物Chao1丰富度指数和βNES之间的响应关系表明,当前河流中MACs和SAs浓度虽有利于缓解大型底栖动物的丧失速率,但会加剧稀有物种的灭绝速度。因此,在对受多个环境因子污染的河流进行生态修复时,不能只对其中一种环境因子进行控制。当两类环境因子对大型底栖动物的影响方向一致时,管理其中一种环境变量,可以缓解另一种环境变量对水生生物的影响;当两类环境因子对大型底栖动物的作用方向相反时,只管理其中一种环境变量,可能会加剧另一种环境变量对水生生物的影响,不利于生态修复。由此可见,多环境因子对水生生物的耦合效应影响, 应受到科研和管理部门的广泛关注。
4 结论1) 黄河流域下游山区河流不同溪段的污染类型不同。其中,锦云川的盐化和营养盐污染较为严重,锦阳川的抗生素污染严重,锦绣川水质良好。
2) 大型底栖动物群落组成受盐化、营养盐和抗生素的共同影响。其中,电导率对大型底栖动物群落组成变化的贡献率为22.86%,营养盐中的TP、NH3-N和TN的贡献率分别为20.12%、13.25% 和7.81%。此外,盐化可与营养盐和抗生素通过耦合效应对大型底栖动物群落组成产生影响,贡献率分别为21.60% 和16.20%;抗生素与营养盐通过耦合效应对大型底栖动物群落组成产生影响的贡献率为19.60%。
3) 大型底栖动物多样性受盐化、营养盐和抗生素的共同影响。其中,Margalef指数(d)与EC和营养盐中NH3-N和NO3--N浓度变化有关。EC升高会加强d与NH3-N之间的正响应关系及其与NO3--N之间的负响应关系。
5 附录附表Ⅰ见电子版(DOI: 10.18307/2024.0232)。
| 附表Ⅰ t-值双标图中大型底栖动物代码 Appendix Ⅰ Codes of macroinvertebrate species in the t-value biplot |
| [1] |
段学花, 王兆印, 徐梦珍. 底栖动物与河流生态评价. 北京: 清华大学出版社, 2010.
|
| [2] |
王雨. 环境DNA宏条形码技术监测溪流底栖动物多样性研究[学位论文]. 南京: 南京农业大学, 2020.
|
| [3] |
Rahbek C, Colwell RK. Biodiversity: Species loss revisited. Nature, 2011, 473(7347): 288-289. DOI:10.1038/473288a |
| [4] |
Firmiano KR, Castro DMP, Linares MS et al. Functional responses of aquatic invertebrates to anthropogenic stressors in riparian zones of Neotropical savanna streams. Science of the Total Environment, 2021, 753: 141865. DOI:10.1016/j.scitotenv.2020.141865 |
| [5] |
Bu HM, Meng W, Zhang Y et al. Relationships between land use patterns and water quality in the Taizi River Basin, China. Ecological Indicators, 2014, 41: 187-197. DOI:10.1016/j.ecolind.2014.02.003 |
| [6] |
Zhao FK, Yang L, Tang JF et al. Urbanization-land-use interactions predict antibiotic contamination in soil across urban-rural gradients. Science of the Total Environment, 2023, 867: 161493. DOI:10.1016/j.scitotenv.2023.161493 |
| [7] |
Zhao Q, Zhang Y, Guo F et al. Increasing anthropogenic salinisation leads to declines in community diversity, functional diversity and trophic links in mountain streams. Chemosphere, 2021, 263: 127994. DOI:10.1016/j.chemosphere.2020.127994 |
| [8] |
Cheng PX, Meng FS, Wang YY et al. Thresholds of water quality indicators for macroinvertebrate in different topographic zones of Songhua River Basin. Research of Environmental Sciences, 2020, 33(9): 2061-2073. [程佩瑄, 孟凡生, 王业耀等. 基于底栖动物的松花江流域不同地形分区水质指标阈值研究. 环境科学研究, 2020, 33(9): 2061-2073. DOI:10.13198/j.issn.1001-6929.2020.04.28] |
| [9] |
Zhu L, Zhang Y, Qu XD et al. Occurrence of antibiotics in aquatic plants and organisms from Qing River, Beijing. Research of Environmental Sciences, 2014, 27(2): 139-146. [朱琳, 张远, 渠晓东等. 北京清河水体及水生生物体内抗生素污染特征. 环境科学研究, 2014, 27(2): 139-146. DOI:10.13198/j.issn.1001-6929.2014.02.05] |
| [10] |
He FZ, Wu NC, Dong XY et al. Elevation, aspect, and local environment jointly determine diatom and macroinvertebrate diversity in the Cangshan Mountain, Southwest China. Ecological Indicators, 2020, 108: 105618. DOI:10.1016/j.ecolind.2019.105618 |
| [11] |
Wu YX, Liu FN, Chen BT. Spatial and temporal evolution and drivers of habitat quality in lower Yellow River Basin urban agglomeration. Bulletin of Soil and Water Conservation, 2023, 43(4): 396-404. [吴艳霞, 刘方南, 陈宝童. 黄河流域下游城市群生境质量时空演变及其驱动因素分析. 水土保持通报, 2023, 43(4): 396-404.] |
| [12] |
Li X, Fu Y, Dai J et al. Application of macroinvertebrate functional groups to estimate the ecosystem health in the stream of southern mountainous area of Jinan City. Journal of Shanghai Ocean University, 2023, 32(1): 126-133. [李欣, 付瑶, 代静等. 应用底栖动物功能摄食群评价济南南部山区溪流生态系统健康. 上海海洋大学学报, 2023, 32(1): 126-133. DOI:10.12024/jsou.20201203243] |
| [13] |
Ji YQ, Zhong Z, Liu H et al. Seasonal variations of macroinvertebrate community in the urban stream of southern mountainous area of Jinan city. Journal of Huzhou University, 2023, 45(2): 39-45. [季雨琦, 仲振, 刘虎等. 济南南部山区城镇溪流底栖动物群落的季节性差异. 湖州师范学院学报, 2023, 45(2): 39-45. DOI:10.3969/j.issn.1009-1734.2023.02.006] |
| [14] |
Liu LF, Wang ZG, Jiang AH et al. Analysis of rainfall-runoff relationship variation characteristics in Sanchuan watershed in Jinan city over recent 50 years. South-to-North Water Transfers and Water Science & Technology, 2018, 16(1): 22-27. [刘丽芳, 王中根, 姜爱华等. 近50年济南三川流域降雨-径流关系变化分析. 南水北调与水利科技, 2018, 16(1): 22-27. DOI:10.13476/j.cnki.nsbdqk.20180004] |
| [15] |
刘莉莉. 济南南部山区河流生态修复与景观设计研究[学位论文]. 泰安: 山东农业大学, 2016.
|
| [16] |
US Environmental Protection Agency. A field-based aquatic life benchmark for conductivity in Central Appalachian streams. Washington DC: Office of Research and Development, National Center for Environmental Assessment, 2011.
|
| [17] |
国家环境保护总局. 水和废水监测分析方法: 第四版. 北京: 中国环境科学出版社, 2002.
|
| [18] |
Zhang XJ, Bai YW, Zhang Y et al. Occurrence, distribution and ecological risk of antibiotics in surface water in the Liaohe River Basin, China. Environmental Science, 2017, 38(11): 4553-4561. [张晓娇, 柏杨巍, 张远等. 辽河流域地表水中典型抗生素污染特征及生态风险评估. 环境科学, 2017, 38(11): 4553-4561. DOI:10.13227/j.hjkx.201704206] |
| [19] |
Leray M, Yang JY, Meyer CP et al. A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity: Application for characterizing coral reef fish gut contents. Frontiers in Zoology, 2013, 10: 34. DOI:10.1186/1742-9994-10-34 |
| [20] |
Zang XM, Zhang Y, Lin JN et al. Impact of talc ore mining on periphyton community structure and water environment. Environmental Science, 2017, 38(9): 3721-3730. [臧小苗, 张远, 林佳宁等. 滑石矿开采对着生藻群落结构和水环境的影响. 环境科学, 2017, 38(9): 3721-3730. DOI:10.13227/j.hjkx.201701124] |
| [21] |
Diniz-Filho JAF, Soares TN, Lima JS et al. Mantel test in population genetics. Genetics and Molecular Biology, 2013, 36(4): 475-485. DOI:10.1590/S1415-47572013000400002 |
| [22] |
Baselga A, Orme CDL. Betapart: An R package for the study of beta diversity. Methods in Ecology and Evolution, 2012, 3(5): 808-812. DOI:10.1111/j.2041-210x.2012.00224.x |
| [23] |
Chi SY, Wang R, Wei M et al. Community structure and diversity of macroinvertebrates in the upper and middle reaches of Jinsha River based on the monitoring data from 2010-2019. Acta Ecologica Sinica, 2022, 42(21): 8723-8738. [池仕运, 王瑞, 魏秘等. 金沙江上中段大型底栖无脊椎动物群落结构特征和多样性分析. 生态学报, 2022, 42(21): 8723-8738. DOI:10.5846/stxb202103250790] |
| [24] |
Hao Y, Shang GX, Ding S et al. Autumn macroinvertebrate community structure and identification of key environmental factors in the Huangshui River Basin. Journal of Hydroecology, 2023, 44(2): 64-72. [郝韵, 尚光霞, 丁森等. 湟水河流域秋季大型底栖动物群落结构及关键影响因子识别. 水生态学杂志, 2023, 44(2): 64-72. DOI:10.15928/j.1674-3075.202110210364] |
| [25] |
Zhang Y, Liu L, Cai YJ et al. Benthic macroinvertebrate community structure in rivers and streams of Lake Taihu Basin and environmental determinants. China Environmental Science, 2015, 35(5): 1535-1546. [张又, 刘凌, 蔡永久等. 太湖流域河流及溪流大型底栖动物群落结构及影响因素. 中国环境科学, 2015, 35(5): 1535-1546.] |
| [26] |
Yin XW, Li QN, Zhu MH et al. Community structure and biological integrity of macroinvertebrates in the wet and dry seasons of Wei River basin, China. Acta Ecologica Sinica, 2015, 35(14): 4784-4796. [殷旭旺, 李庆南, 朱美桦等. 渭河丰、枯水期底栖动物群落特征及综合健康评价. 生态学报, 2015, 35(14): 4784-4796. DOI:10.5846/stxb201311112712] |
| [27] |
He YX, Li K, Ren YF et al. Characteristics of macrobenthos community structure and their relationships with environmental factors in rivers of Beijing in spring. Environmental Science, 2020, 41(6): 2951-2962. [贺玉晓, 李珂, 任玉芬等. 春季北京市河流大型底栖动物群落结构特征及影响因子分析. 环境科学, 2020, 41(6): 2951-2962. DOI:10.13227/j.hjkx.201911161] |
| [28] |
Wang C, Yue XJ, Xie SG et al. Community structure of zoobenthos and bioassessment of water quality in Yuexi stream in spring. Journal of Neijiang Normal University, 2010, 25(12): 59-64. [王川, 岳兴建, 谢嗣光等. 越溪河春季底栖动物的群落结构及水质评价. 内江师范学院学报, 2010, 25(12): 59-64.] |
| [29] |
Hu T, Wei KJ, Zhang GR et al. Macroinvertebrate communities and bioassessment of water quality in Miyun Reservoir, Beijing. Journal of Hydroecology, 2018, 39(4): 79-88. [胡涛, 魏开建, 张桂蓉等. 密云水库大型底栖动物群落结构及水质生物学评价. 水生态学杂志, 2018, 39(4): 79-88. DOI:10.15928/j.1674-3075.2018.04.011] |
| [30] |
Alexander AC, Culp JM, Baird DJ et al. Nutrient-insecticide interactions decouple density-dependent predation pressure in aquatic insects. Freshwater Biology, 2016, 61(12): 2090-2101. DOI:10.1111/fwb.12711 |
| [31] |
Townsend CR, Uhlmann SS, Matthaei CD. Individual and combined responses of stream ecosystems to multiple stressors. Journal of Applied Ecology, 2008, 45(6): 1810-1819. DOI:10.1111/j.1365-2664.2008.01548.x |
| [32] |
Gonzalez-Silva BM, Jonassen KR, Bakke I et al. Nitrification at different salinities: Biofilm community composition and physiological plasticity. Water Research, 2016, 95: 48-58. DOI:10.1016/j.watres.2016.02.050 |
| [33] |
Caraco NF. Disturbance of the phosphorus cycle: A case of indirect effects of human activity. Trends in Ecology & Evolution, 1993, 8(2): 51-54. DOI:10.1016/0169-5347(93)90158-L |
| [34] |
Le TDH, Schreiner VC, Kattwinkel M et al. Invertebrate turnover along gradients of anthropogenic salinisation in rivers of German regions. Science of the Total Environment, 2021, 753: 141986. DOI:10.1016/j.scitotenv.2020.141986 |
| [35] |
Zhao Q, Jia XB, Xia R et al. A field-based method to derive macroinvertebrate benchmark for specific conductivity adapted for small data sets and demonstrated in the Hun-Tai River Basin, Northeast China. Environmental Pollution, 2016, 216: 902-910. DOI:10.1016/j.envpol.2016.06.065 |
| [36] |
Bernhardt ES, Palmer MA. The environmental costs of mountaintop mining valley fill operations for aquatic ecosystems of the Central Appalachians. Annals of the New York Academy of Sciences, 2011, 1223: 39-57. DOI:10.1111/j.1749-6632.2011.05986.x |
| [37] |
Schäfer RB, Kühn B, Malaj E et al. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology, 2016, 61(12): 2116-2128. DOI:10.1111/fwb.12811 |
| [38] |
Dai D, Xing H, Yang JR et al. Advances in mechanisms of rare species maintenance and plant-soil feedback in plant communities. Biodiversity Science, 2021, 29(12): 1687-1699. [戴冬, 邢华, 杨佳绒等. 植物群落稀有种维持机制与土壤反馈的研究进展. 生物多样性, 2021, 29(12): 1687-1699. DOI:10.17520/biods.2021141] |
| [39] |
Li M, Wei TT, Shi BY et al. Biodiversity monitoring of freshwater benthic macroinvertebrates using environmental DNA. Biodiversity Science, 2019, 27(5): 480-490. [李萌, 尉婷婷, 史博洋等. 环境DNA技术在淡水底栖大型无脊椎动物多样性检测中的应用. 生物多样性, 2019, 27(5): 480-490. DOI:10.17520/biods.2018227] |
| [40] |
Finderup NT, Sand-Jensen K, Dornelas M et al. More is less: Net gain in species richness, but biotic homogenization over 140 years. Ecology Letters, 2019, 22(10): 1650-1657. DOI:10.1111/ele.13361 |
| [41] |
Olden JD, LeRoy Poff N, Douglas MR et al. Ecological and evolutionary consequences of biotic homogenization. Trends in Ecology & Evolution, 2004, 19(1): 18-24. DOI:10.1016/j.tree.2003.09.010 |
| [42] |
Olden JD, Rooney TP. On defining and quantifying biotic homogenization. Global Ecology and Biogeography, 2006, 15(2): 113-120. DOI:10.1111/j.1466-822x.2006.00214.x |
 2024, Vol. 36
2024, Vol. 36 

