(2: 西安建筑科技大学资源工程学院, 西安 710055)
(3: 辽宁省汤河水库管理局有限责任公司, 辽阳 111000)
(4: 大连理工大学海洋科学与技术学院, 盘锦 124221)
(2: School of Resource Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, P.R. China)
(3: Liaoning Tanghe Reservoir Management Co., Ltd, Liaoyang 111000, P.R. China)
(4: School of Ocean Science and Technology, Dalian University of Technology, Panjin 124221, P.R. China)
湖库沉积物在一定条件下会释放大量的氮、磷、重金属和硫化物等污染物到上覆水体中,并扩散迁移到整个湖库水体,可引发严重的内源性污染,从而影响整个湖库的水环境质量[1-3]。酸可挥发性硫化物(acid volatile sulfide, AVS)是指沉积物中可以被酸提取的硫化物,包括游离态硫化物、FeS、Fe3S4及其它二价金属硫化物,其含量直接反映沉积物间隙水中硫化物向上覆水体扩散的风险[4]。另外,AVS含量也控制着重金属在沉积物和间隙水中的分配关系,从而影响沉积物中重金属的生态风险。在提取AVS的同时,一部分与硫化物结合的重金属离子(如Cd2+、Cu2+、Ni2+、Pb2+、Zn2+)从沉积物释放到提取液中,这类重金属被称之为同步提取重金属(simultaneously extracted metals, SEM)[5]。AVS和SEM之间的关系被广泛用于评价沉积物重金属生态风险[6-8],当AVS浓度小于SEM浓度时,沉积物中重金属的生物可利用性较高,且容易扩散至上覆水,使得沉积物中因重金属污染诱发的生态风险加大。反之,沉积物中大部分还原态金属可以与AVS结合形成难溶性沉淀,使得沉积物因重金属污染诱发生态风险降低。
沉积物的硫酸盐还原过程直接影响着AVS浓度,水体中硫酸盐浓度控制着硫酸盐的还原效率[9]。相对于海洋中高硫酸盐浓度(约28 mmol/L),一般淡水环境中硫酸盐浓度较低(约50~450 μmol/L)[10-12],但一些湖库(如红枫湖、博斯腾湖、阿哈水库等)水体中硫酸盐浓度明显高于该范围(约980~5860 μmol/L),可认为是富硫型湖库[13-15]。由于富硫型湖库中硫酸盐还原过程所需的电子受体SO42-充足,导致AVS的生成量高,在一定程度上能降低湖库重金属生态风险,但大部分研究侧重于探讨湖库营养状态与重金属生态风险之间的关系,而忽略了硫酸盐还原作用对湖库重金属生态风险的影响[16-17]。随着流域人类活动的加剧,湖库水体中的硫酸盐浓度逐年升高,演变为富硫型湖库[18]。在此背景下,这些湖库的重金属生态风险仍需进一步探究。
水库又称之为“人工湖泊”,但其在控制流域面积、水位变化及纵向生态分区等方面与天然湖泊有着明显的差异性[19]。水库“蓄浊排清”的运行方式使得来自流域内的污染物在库区内呈现出明显累积特征,坝前深水区累积了大量的颗粒污染物,成为诱发水库内源污染的主要原因[20-22]。我国东北地区四季分明,水库在夏季因水体热分层易导致底层水体出现缺氧状态。另外,冬季低气温形成的冰盖阻隔了氧气的输入,水体底层也容易出现缺氧状态[23]。因此,我国东北地区水库底层水体普遍会出现较长时间的缺氧状态,容易诱发沉积物中重金属和硫化物释放迁移到水体中。随着水库库龄的增长,沉积物污染物的累积效应在水库中越来越突出。因此,沉积物污染状况成为影响水库水环境质量安全的重大隐患。
本文以我国东北地区大型水源水库——汤河水库为研究对象,该水库长期保持优良水质,营养状态为中营养型,但水库曾经遭受过酸性矿山废水(acid mine drainage, AMD)排放影响,沉积物呈现出较为活跃的硫酸盐还原过程,间隙水中AVS含量高,属于富硫型水库[9]。水库所在汤河流域位于鞍山-本溪成矿带区域,流域内各类重金属的土壤背景值较高,历史上来自流域的外源性重金属输入对水库水质影响较大[24]。本研究的主要目的为:(1)揭示汤河水库沉积物基本理化性质及重金属总量的分布状况;(2)探究富硫型水库沉积物中AVS及SEM的空间分布特征及其主要影响因素;(3)评价汤河水库不同区域内沉积物重金属生态风险。研究成果不仅可以为水源水库内源污染治理提供科学依据,还丰富了我国关于湖库沉积物中硫化物及重金属生态风险的研究成果。
1 材料与方法 1.1 研究区域概况与采样点位布置汤河水库(41°07′05″~41°08′45″N, 123°18′15″~123°25′24″E)位于辽宁省辽阳市,坐落于太子河支流、汤河干流上,是一座以防洪、供水为主,兼顾发电、养殖等功能的大(Ⅱ)型水利枢纽工程。水库于1969年12月完成并投入使用,坝址以上控制流域面积1228 km2,总库容为7.23亿m3,兴利库容为3.70亿m3,日供水量约33万m3,是鞍山市和辽阳市近300万人口的集中式供水水源。水库水质长期保持在我国地表水环境质量标准Ⅱ类,水质优良。汤河水库主要的入库河流有西支流下达河、东支流二道河及后台河。1980s后期,后台河流域曾出现过大规模镍黄铁矿和硫化铜矿的开采行为,开矿产生的酸性矿山废水中含有高浓度的SO42-和Fe、Mn、Ni、Cu等重金属离子。这不仅造成汤河水库水体中的SO42-浓度逐年升高,还造成重金属在水库沉积物中被大量富集。虽然流域内的矿场在21世纪初被关停,但在汛期时废弃矿井水位的上升会导致酸性矿山废水的溢出,流入东支流库区,依然持续地影响着水库水质[25-26]。水库在每年的4—9月处于热分层期,水库底部等温层出现严重缺氧现象,尤其在低水位运行年份频繁发生底层水体硫化物污染事件,造成大量水库原水被弃用,导致巨大的经济损失。为了考察汤河水库不同分区内沉积物污染状况,根据水库库区纵向水深差异性(图 1),分别在坝前深水区(T1、T2)、东支流库区(T3、T4)、西支流库区(T5、T6)设置6个采样点,研究水库不同分区内沉积物AVS、SEM及重金属的污染状况。
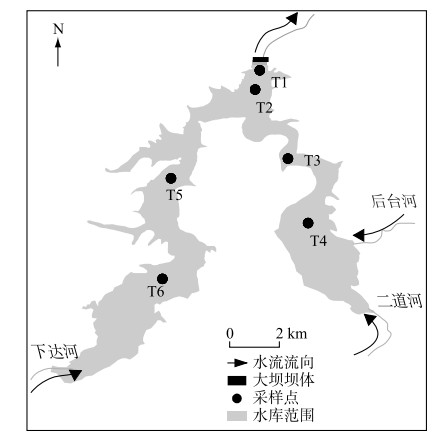
|
图 1 汤河水库沉积物采样点分布 Fig.1 Distribution of sediment sampling sites in Tanghe Reservoir |
使用箱式采泥器(Ekman-Birge,HYDRO-BIOS,德国)采集水库沉积物样品,并在现场按照2 cm间隔切割分层,每一层采集的沉积物迅速装入聚乙烯自封袋里密封,避光低温运输,带回实验室后立刻充入高纯氮气(纯度99.999%,大连大特气体有限公司)预处理防止被空气氧化,并于4℃下冷藏保存待测,并尽快完成相应实验。由于入库口T4和T6点位淤积量较少,只采集到表层8 cm的样品,其它采样点沉积物采集深度均为16 cm。各采样点水深(WD)使用便携式声呐测深仪(SM-5A,SPEEDTECH,美国)测定。
1.3 样品分析方法沉积物中重金属总量的测量使用酸提取-电感耦合等离子体法[27],并使用电感耦合等离子体发射光谱仪(ICP-OES,Agilent 5110,美国)测定重金属元素含量。沉积物中AVS采用“冷扩散法”提取[28],并采用亚甲基蓝分光光度法测定吸收液中S2-含量(DR6000,HACH,美国)[29]。经冷扩散法提取AVS后,将反应装置内溶液经离心过滤后,用2% HNO3稀释并测定SEM。SEM的测量方法与沉积物重金属总量的测量方法一致。沉积物的ΣSEM值代表Cd2+、Cu2+、Ni2+、Pb2+、Zn2+这5种同步提取重金属含量的总和,AVS和SEM含量以沉积物干重计。
沉积物中的有机质含量可用烧失量法(loss on ignition,LOI)进行确定[30]。沉积物的pH值采用中华人民共和国农业行业标准(NY/T 1121.2—2006)测定,并使用多参数水质监测仪(Multi 3430i,WTW,德国)进行测定。沉积物间隙水中SO42-和NO3-采用离子色谱法(DIONEX, ICS-1500, 美国)进行测量[31]。样品冷冻干燥后通过重量法测定沉积物含水率(moisture content,ω)。沉积物的粒径使用激光粒度分析仪(Mastersize 2000,Malvern,英国)进行测定[32]。根据粒径大小将沉积物分为:黏土(< 4 μm)、粉砂(4~63 μm)和砂(>63 μm),结合粒度频率累积曲线由仪器测量软件导出沉积物中值粒径Dv(50)。
1.4 沉积物重金属生态风险评价 1.4.1 沉积物基准法沉积物基准法SQGs(sediment quality guidelines)是根据沉积物中重金属含量来评估对底栖生物的毒性效应[33]。沉积物中不同重金属含量有两个阈值,一般认为当重金属含量低于相应的临界效应含量(threshold effects level, TEL)时,不会对生物产生毒性效应,若高于可能效应含量(probable effect level, PEL)时,则具有显著的毒性效应,介于两者之间则有可能具有毒性效应。重金属Cd、Cu、Ni、Pb和Zn所对应的TEL和PEL值如表 1所示。为进一步评估汤河水库沉积物中单个重金属的生物毒性风险,使用公式(1)计算PEL系数(probable effect level quotient, PELq)[34]。
| $ \mathrm{PELq}=C / \mathrm{PEL} $ | (1) |
| 表 1 水体沉积物中重金属元素对底栖生物产生毒性效应阈值[34] Tab. 1 Thresholds for heavy metal toxicity to benthic organisms in the freshwater sediment |
式中,C为沉积物中重金属含量(mg/kg)。当PELq < 0.1时,所评价的重金属对底栖生物不产生毒性;0.1 < PELq < 1时,有较低的毒性风险;1 < PELq < 5时,产生中风险毒性;PELq>5时,产生高风险毒性。
1.4.2 AVS与SEM关系评价法沉积物中重金属的存在形式决定着其可移动性和生物活性,当沉积物中重金属多以硫化物的形式存在时,其生物毒性有所降低[7]。因此,采用ΣSEM/AVS比值法结合ΣSEM-AVS差值法来判断重金属是否存在潜在生物毒性。当ΣSEM/AVS<1或ΣSEM-AVS < 0时,则沉积物中的重金属不产生毒性风险;当ΣSEM/AVS>1或0 < ΣSEM-AVS < 5时,说明沉积物中可能存在游离态的重金属对底栖生物产生潜在的生理毒性,沉积物中的重金属毒性为中等风险。当ΣSEM/AVS>2或ΣSEM-AVS>5时,表明沉积物中的重金属具有高等生物毒性风险。
1.5 数据处理与分析数据录入及整理采用Excel 2019完成。运用Origin 2021完成沉积物粒度分布、AVS及SEM垂向分布及生态风险评估等图形绘制;使用SPSS 22.0软件,利用Shapro-WiiK(S-W)方法对数据进行正态分布检验,并对数据进行单因素方差分析(ANOVA)和Pearson相关性分析。
2 结果与讨论 2.1 沉积物间隙水污染特征及基本理化性质汤河水库沉积物间隙水中SO42-、S2-、NO3-浓度(图 2)、沉积物LOI、pH(表 2)都具有显著的空间异质性。水库沉积物间隙水中SO42-平均浓度最大值((1038.3±203.0) μmol/L)出现在东支流入库口处的T4点位,且SO42-平均浓度从T4到坝前深水区T1点位呈现明显下降的趋势(P < 0.05)。水库西支流库区间隙水中SO42-平均浓度((326.6±107.2) μmol/L)明显低于东支流库区((955.4±147.7) μmol/L)(P < 0.05)。在所调查的沉积物样本中,间隙水SO42-平均浓度最小值((147.6±73.9) μmol/L)出现在西支流库区中部区域的T5点位。沉积物间隙水中S2-浓度空间分布与SO42-浓度呈现相反的特征,坝前深水区沉积物间隙水中S2-浓度要明显高于入库口沉积物。汤河水库沉积物间隙水中S2-平均浓度最大值出现在位于坝前深水区的T1点位((191.10±140.33) μmol/L),最小值出现在西支流库区的T6点位((0.23±0.30) μmol/L),随着距坝前距离的增加而减少。东支流库区沉积物间隙水中S2-平均浓度((42.07±50.23) μmol/L)显著高于西支流库区间隙水中S2-平均浓度((3.52±5.10) μmol/L)(P < 0.05)。坝前深水区沉积物同时积蓄了来自东支流的SO42-和西支流的LOI,二者经过硫酸盐还原过程产生了大量的S2-,这是导致坝前深水区沉积物间隙水中S2-浓度显著高于其它区域的主要原因。
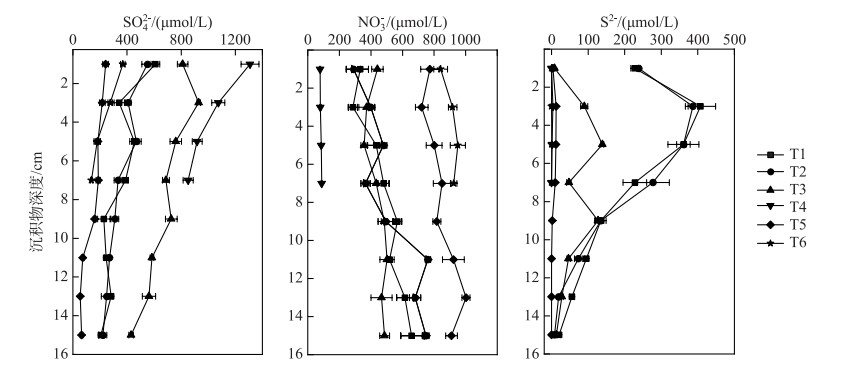
|
图 2 沉积物间隙水中SO42-、NO3-和S2-浓度的空间分布 Fig.2 Spatial distribution of SO42-, NO3- and S2- concentration in the sediment porewater |
| 表 2 汤河水库沉积物基本特征* Tab. 2 Primary properties of sediments in Tanghe Reservoir |
沉积物间隙水中NO3-平均浓度最大值出现在西支流库区T6点位((1334.5±74.8) μmol/L),NO3-平均浓度由T6至坝前深水区(T1)呈现显著减少的趋势(P < 0.05),且水库西支流库区沉积物间隙水中NO3-平均浓度((1011.4±252.5) μmol/L)也显著大于东支流库区间隙水中NO3-平均浓度((463.91±86.17) μmol/L)(P < 0.05)。间隙水NO3-平均浓度的最小值出现在位于东支流库区的T4点位((443.3±53.5) μmol/L)。这是由于汤河水库西支流所在流域人类活动较为活跃,农村居民生活污水及农业面源污染排水中含有大量有机质和营养盐,造成西支流库区沉积物LOI和间隙水中NO3-浓度显著高于东支流库区。
水库沉积物LOI平均含量具有显著的空间累积特征(P < 0.05)(表 2),最大值和最小值分别出现在坝前深水区T1和东支流库区T4点位,平均含量分别为9.48% ±0.83% 和4.81% ±0.66%;西支流库区沉积物中LOI平均含量(7.30% ±0.62%)显著高于东支流库区(6.16% ±1.10%)(P < 0.05)。沉积物pH值由水库入库口至坝前深水区逐渐减少,最大值和最小值分别出现在T6和T2点位,分别为7.75±0.08和7.19±0.08,东支流库区沉积物pH(7.23±0.17)要显著小于西支流库区沉积物pH(7.55±0.16)(P < 0.05)。这是由于东支流库区曾经遭受过酸性矿山废水排放污染,酸性矿山废水中还含有高浓度SO42-,从而导致东支流库区沉积物间隙水中SO42-浓度要显著高于其它区域。
汤河水库沉积物(0~2 cm)粒度分布具备一定的空间差异性(图 3)。应用谢帕德法进行粒度分类结果显示,沉积物样品为黏土质粉砂和砂质粉砂,沉积物中黏土含量为9.97% ~24.15%,粉砂含量为64.95% ~73.38%,砂含量为8.82% ~20.49%。沉积物黏土成分沿水库上游至下游方向呈逐渐增加趋势,坝前深水区T1点的黏土含量最高,可达24.15%。水库中值粒径范围为13.7~23.9 μm,其中水库东西支流入库口(T4、T6)的中值粒径显著高于其它区域(P < 0.05),这表明入库径流裹挟的大部分粗颗粒悬浮物首先在入库口区沉降,粒径较小的细颗粒随着水流推动流入到深水区并缓慢沉降下来。
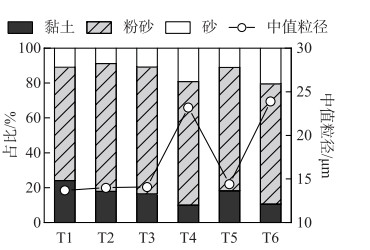
|
图 3 汤河水库沉积物(0~2 cm) 粒度空间分布 Fig.3 Spatial distribution of grain size in Tanghe Reservoir sediments (0-2 cm) |
汤河水库各分区内沉积物中重金属的空间分布特征有显著差异(附图Ⅰ)。汤河水库沉积物重金属总量平均值大小排序为Fe ((44704.1±4110.4) mg/kg)>Mn ((1599.0±722.7) mg/kg)>Zn ((137.8±16.9) mg/kg)>Cu ((62.4±10.2) mg/kg)>Pb ((55.2±8.3) mg/kg)>Ni ((49.6±7.5) mg/kg)>Cd ((0.83±0.14) mg/kg),沉积物中各类重金属含量均大于流域土壤重金属的背景值[35],表明重金属在汤河水库沉积物中出现累积。沉积物中Cd、Ni、Zn含量均呈现出入库口区(T4、T6)显著低于水库中部区域(T3、T5)的特征(P < 0.05),Mn含量呈现出入库口区显著低于坝前深水区(T1、T2)的特征(P < 0.05)。西支流库区沉积物Cd、Ni、Pb、Zn、Fe、Mn含量显著低于坝前深水区和东支流库区(P < 0.05)。Cu含量呈现出东支流库区>坝前深水区>西支流库区的特征。重金属易吸附在细颗粒中并随着水流向水库内部运移,因而坝前深水区的沉积物重金属含量相对较高[36]。东支流库区历史上由于受酸性矿山废水排放影响,导致重金属在该区域沉积物中被富集,这是造成东支流库区沉积物中重金属含量较高的主要原因。
汤河水库各点位沉积物重金属含量的垂向变化不显著(附图Ⅰ)(P>0.05)。T1和T2点位0~2 cm沉积物中Fe和Mn含量略高于下层,T3和T5点位上层Fe和Mn含量略高于中层和底层,这是由于Fe、Mn属于氧化还原敏感元素,在缺氧条件下容易被还原释放至上覆水,扩散迁移至含氧区域后又被氧化,重新沉淀下来,导致表层沉积物的Fe、Mn含量相对较高。T1和T2点位Fe、Mn最高含量出现在沉积物中部,这是由于酸性矿山废水中含有较高浓度的Fe和Mn,东支流库区历史上虽然存在酸性矿山废水排放的影响,但在设置饮用水源地保护区后,流域内关停尾矿库和矿产加工企业,有效控制了点源污染入库,随着入库酸性矿山废水排放的大量减少,坝前沉积物中Fe和Mn的累积量也逐渐降低。
2.3 沉积物AVS空间分布特征及影响因素汤河水库沉积物AVS分布具有显著的空间差异性(图 4)。AVS平均含量的最大值出现在T1点位((20.26±21.34) μmol/g),坝前深水区(T1和T2)沉积物AVS平均含量显著高于其它区域(P < 0.05)。东支流库区(T3和T4)沉积物AVS平均含量((2.85±0.93) μmol/g)也显著高于西支流库区(T5和T6)((0.84±0.82) μmol/g)(P < 0.05)。另外,坝前深水区(T1和T2)和东支流库区中部区域(T3)沉积物AVS含量同时还呈现显著的垂向分布差异性(P < 0.05)。坝前深水区分层沉积物AVS含量呈现先增加后减少的趋势,T1和T2点位分层沉积物AVS最大值分别为51.75和38.33 μmol/g,并分别出现在沉积物深度为4~6 cm和6~8 cm处,其它区域沉积物AVS含量垂向分布均无显著差异性(P>0.05)。
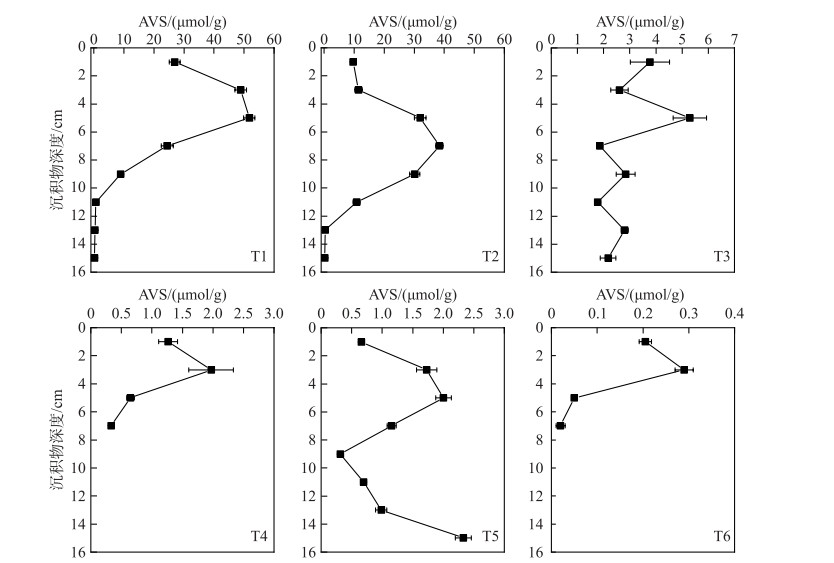
|
图 4 汤河水库沉积物AVS垂向分布 Fig.4 Vertical distribution of AVS in Tanghe Reservoir sediments |
汤河水库沉积物AVS含量与LOI含量、间隙水中SO42-和S2-浓度呈极显著正相关关系(表 3)。AVS主要包含难溶沉淀形态的S2-,是硫酸盐还原菌(sulfide reduction bacteria, SRB)驱动硫酸盐还原过程的产物。SRB属于化能异养型微生物,该微生物以SO42-为电子受体,以有机质中的乙酸盐、丙酸盐等物质为电子供体,发生硫酸盐还原反应[37]。汤河水库坝前深水区沉积物中高含量LOI(表 2)可为SRB增长提供充足的电子供体,同时坝前深水区沉积物间隙水中含有较高浓度的SO42-(图 2),可为SRB提供充足的电子受体[38-39],这些条件都有利于硫酸盐还原过程发生,从而导致汤河水库坝前区域沉积物AVS含量为全库区最高。虽然西支流库区沉积物中LOI含量更高(表 2),但由于该区域沉积物间隙水中SO42-浓度较低,硫酸盐还原所需的电子受体不足,从而造成了西支流库区沉积物中AVS含量较小。
| 表 3 汤河水库沉积物理化参数与AVS间相关性分析结果 Tab. 3 Correlation analysis between the primary properties of sediments and AVS in Tanghe Reservoir |
汤河水库沉积物AVS含量的空间差异性还与水库沉积物遭受的厌氧程度相关。水库沉积物AVS含量与水深呈现显著的正相关关系(r=0.785, P < 0.01)。这是因为深水环境会加剧水体表、底层水温的差异性,也会增加水体热分层的持续时间,这使得底层的沉积物-水界面呈现出较长时间厌氧状态,从而驱动了AVS的生产[40]。此外,沉积物中AVS含量与沉积物中值粒径呈显著负相关关系(r=-0.189, P < 0.05)。这是因为较小的粒径意味着沉积物中空隙率较低,不利于上覆水体中溶解氧向沉积物中传输,使得沉积物形成更大程度的厌氧环境[41]。汤河水库坝前深水区底部等温层呈现出长时期的厌氧状态,这是造成该区域沉积物中分布着全库区最高AVS含量的重要环境因素。
汤河水库沉积物AVS含量与间隙水中NO3-浓度呈极显著负相关关系(r=-0.791, P < 0.01)。一方面,NO3-会为硫氧化细菌(sulphide oxidation bacteria, SOB)的繁殖提供电子供体,S2-会被直接消耗[42-44]。另一方面,在厌氧条件下,NO3-会代替O2作为电子供体,将S2-氧化为SO42-,从而造成S2-的削减[45]。在二者共同作用下AVS产量会减少。在汤河水库西支流库区沉积物中积蓄了较多的NO3-(图 2),该区域沉积物中不仅硫酸盐还原强度最弱,产生的少量S2-又会被较高浓度的NO3-所氧化而削减,由此造成了西支流库区沉积物AVS含量最低(图 4)。
汤河水库沉积物AVS含量与pH值呈显著的负相关(r=-0.675, P < 0.05),研究表明适宜SRB生长的最优pH值范围为6~7[37, 46],汤河水库坝前深水区沉积物pH更接近这一范围(表 2),有利于AVS产生。汤河水库沉积物AVS含量与含水率ω呈显著正相关(r=0.551,P < 0.05),这是因为沉积物AVS中S2-比例较高,而S2-以H2S形式存在时,由于H2S具有较高溶解度(在20℃条件下H2S亨利系数为0.115 mol/(L ·atm),是同温度下O2亨利系数0.00138 mol/(L ·atm)的83倍[47]),则在沉积物中产生的H2S可以快速溶解到间隙水中,使得反应平衡向更有利于AVS方向发生。因此,沉积物的高含水率环境条件可以促进沉积物中AVS的产生。
2.4 沉积物SEM空间分布特征图 5分析了汤河水库沉积物SEM含量和单一重金属对ΣSEM贡献率,结果表明ΣSEM变化范围为1.94~2.75 μmol/g,平均含量为(2.36±0.25) μmol/g,与AVS变化趋势相比,ΣSEM总量波动较小,且较为恒定,ΣSEM含量的垂向差异性不明显(P>0.05)。整体来看,水库ΣSEM含量呈现出东支流库区>坝前深水区>西支流库区的特征(P < 0.05)的区域性差异性规律,这表明来自东支流库区的重金属污染高于西支流库区,还影响到了坝前深水区。5种SEM含量顺序为SEMZn>SEMCu>SEMNi>SEMPb>SEMCd,其中SEMZn和SEMCu的含量较高,这是由于重金属元素自然背景值的差异。SEMCu和SEMNi含量在东支流库区T3点位要显著高于西支流库区T5点位(P < 0.05),这表明曾因酸性矿山废水排放影响的东支流库区沉积物重金属出现累积现象。沉积物中不同种类SEM对ΣSEM贡献率大小的顺序与SEM含量基本一致,在5种SEM中,Zn与S2-的结合度最高,贡献可占45% 以上,而Cd的贡献率最低,小于0.5%。此外,沉积物中SEM与AVS不存在相关性(图 4),这是由于与S2-结合的重金属离子中,Fe和Mn的占比大于90%,SEM仅占一小部分[37]。汤河水库全库区沉积物中Fe和Mn含量均较高(附图Ⅰ),弱化了其它重金属对AVS空间分布差异的贡献。
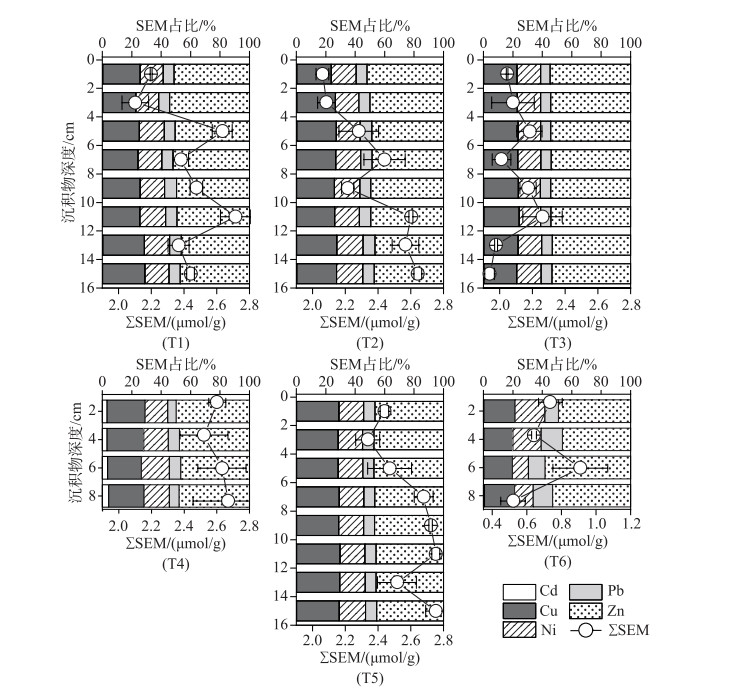
|
图 5 汤河水库沉积物ΣSEM垂向分布及单组分贡献率分布 Fig.5 Vertical distribution of ΣSEM and contribution of each SEM to ΣSEM of sediments in Tanghe Reservoir |
图 6揭示了沉积物中各种重金属元素对底栖生物产生的毒性效应,结果发现汤河水库所有区域沉积物中,重金属Cd含量全部低于其TEL值;东支流库区入库口T4点位沉积物中Pb含量低于其TEL值,西支流库区入库口T6点位沉积物中Pb和Cu含量也都低于其TEL值。由此可见,重金属Cd、Pb和Cu在该区域不会产生生物毒性。水库其它区域分层沉积物中Cu、Ni、Pb和Zn含量均介于相对应的TEL值和PEL值之间,可能会产生毒性效应。

|
图 6 沉积物重金属的毒性效应评价 Fig.6 Evaluation of toxic effects of heavy metals in sediments |
汤河水库6个点位分层沉积物中Cd的PELq值范围为0.02~0.05,均小于0.1,因此重金属Cd对水库底栖生物不产生毒性。Cu、Ni、Pb和Zn的PELq值介于0.1和1之间,具有较低的毒性风险。这4种重金属元素所产生的风险大小排序为Ni>Cu>Pb>Zn。水库各分区分层沉积物PELq值的空间变化与重金属含量的空间变化趋势基本一致。在T1~T3点位10 cm以下沉积物中重金属Ni的PELq值介于0.72~0.80之间,接近于中度毒性风险的阈值。由此可见,需要重点关注汤河水库坝前深水区和东支流中部区域10 cm以下沉积物中由重金属Ni所诱发的生物毒性风险。
2.5.2 AVS与SEM关系评价法根据ΣSEM/AVS比值法和ΣSEM-AVS差值法的分析结果(图 7)可知,坝前深水区(T1和T2)0~10 cm的沉积物中不仅ΣSEM/AVS < 1且ΣSEM-AVS < 0,表明该区域沉积物中重金属没有生态风险,但是当该区域沉积物深度超过10 cm后,T1和T2点位在深度10~16和12~16 cm处的ΣSEM/AVS>2,出现了较高的生态风险。分析其原因,虽然坝前深水区沉积物ΣSEM垂向变化特征不明显,但10 cm以下深度沉积物中AVS含量较低,从而导致沉积物中重金属离子没有足够的AVS与其结合,可以游离出更多的重金属离子,进而诱发一定的生态风险。在东支流库区中部区域T3点位,沉积物深度在8、12和16 cm时, 1 < ΣSEM/AVS < 2且0 < ΣSEM-AVS < 1,沉积物可能具有中等生态风险。在西支流库区中部区域T5点位,仅在沉积物深度14~16 cm处的ΣSEM/AVS < 1且ΣSEM-AVS < 0,其它深度沉积物的ΣSEM/AVS均大于1,特别在深度为0~2和8~12 cm的沉积物中ΣSEM/AVS>2,具有较高的生态风险。这是因为西支流库区沉积物AVS含量要显著低于东支流库区沉积物AVS含量,与重金属离子结合能力变弱,更多的游离态重金属离子被释放出来,容易产生一定的生态风险。
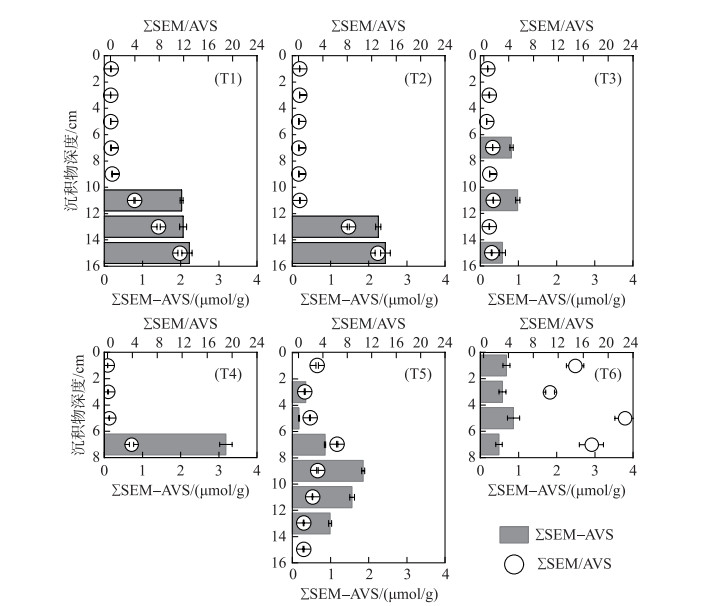
|
图 7 汤河水库沉积物ΣSEM/AVS、ΣSEM-AVS值 Fig.7 The values of ΣSEM/AVS and ΣSEM-AVS of sediments in Tanghe Reservoir |
东支流库区入库口区域T4点位分层沉积物中AVS含量较高,沉积物中ΣSEM/AVS < 1且ΣSEM-AVS < 0,表明该区域沉积物不具有生态风险。值得注意的是,西支流库区入库口区域T6点位分层沉积物中ΣSEM/AVS值的范围在10.68~22.73之间,都远高于高生态风险的阈值,故该区域沉积物具有较高生态风险。虽然流入西支流库区的下达河流域并未受到过采矿活动的影响,但该流域土壤中重金属元素背景值浓度较高[25],同时沉积物中AVS含量较低,与重金属结合能力较弱。因此,西支流库区沉积物重金属具有高生态风险。由此可见,汤河水库坝前深水区大于10 cm深度的沉积物和整个西支流库区各分层沉积物中,需重点关注由SEM诱发的生态风险。
2.6 国内其它湖库沉积物AVS和ΣSEM含量比较表 4对比了国内其它湖库沉积物AVS和ΣSEM含量[14-16, 48-54],结果发现沉积物中AVS含量与湖库营养状态不具有严格的相关性。比如沉积物AVS含量最大值出现在中营养型红枫湖(167.7 μmol/g),而最小值出现在富营养型鄱阳湖(0.89 μmol/g)。一般认为富营养型湖库易发生藻华灾害,大量的藻类繁殖增长后,其死亡沉降到沉积物中会增加沉积物有机质含量,这些有机质可为硫酸盐还原菌繁殖代谢提供电子供体,有利于AVS产生[48-49]。另一方面,藻体分解会消耗水体大量的溶解氧,使水体溶解氧浓度降低,严重的可达缺氧状态,低溶解氧环境也利于AVS产生[50]。但是,富营养湖库由于氮素浓度较高,水体和沉积物中含有较高浓度的NO3-,在低溶解氧条件下,NO3-会代替分子氧失去电子,参与沉积物间隙水中S2-的氧化,发生了NO3-还原与S2-氧化的耦合,进而削减了AVS含量,这也是导致一些富营养型湖库沉积物AVS含量较低的主要原因。对于贫营养型抚仙湖而言,水体中SO42-浓度和沉积物中有机质含量均较低,湖泊底层水体尚未出现厌氧现象,因此沉积物中的硫酸盐还原效率较低,结果是沉积物中AVS含量较低[54]。
| 表 4 国内部分湖泊水库沉积物中AVS和ΣSEM含量比较 Tab. 4 Comparison of AVS and ΣSEM contents in sediments of various lakes and reservoirs in China |
对于中营养型湖库如红枫湖、博斯腾湖、阳宗海和汤河水库[14-15, 53],水体中存在大量的SO42-,属于典型的富硫型湖库,这类湖库水体一方面可为硫酸盐还原菌繁殖代谢而发生的还原过程提供充足SO42-电子受体;另一方面,水体中较低的NO3-浓度使得NO3-还原与S2-氧化的耦合作用减弱,进而使得沉积物中S2-的净产量提高,结果导致了AVS在沉积物中被大量累积,反而呈现出比富营养化湖库更高的AVS含量。汤河水库作为典型的富硫型水库,其沉积物AVS含量与博斯腾湖沉积物AVS含量相当,低于红枫湖和阳宗海沉积物AVS含量,但高于一般富营养型湖泊(比如太湖、巢湖等)沉积物AVS含量。由此可见,除了发生硫酸盐还原反应所需的中性pH值范围、低溶解氧浓度、丰富的有机碳源等环境条件之外,富硫型湖库因为有充足的SO42-反应底物,是造成这些湖库积物中高AVS含量的决定性因素。
国内湖库沉积物中SEM的生态风险也表现出一定的差异性。富营养型湖库如东湖、巢湖、白洋淀和洋河水库沉积物中ΣSEM含量要高于中、贫营养型湖库,比如红枫湖、博斯腾湖和抚仙湖。这是由于上述富营养型湖库所在流域人类活动频繁,工业或者采矿业发达,湖库不仅面临着过量营养盐输入的问题,还遭受了重金属浓度超标的工业废水和采矿废水排放的影响,从而造成了这些湖库沉积物中重金属含量较高[14-15, 54]。中营养型阳宗海沉积物中ΣSEM含量是11.28 μmol/g, 为所有分析湖库沉积物中ΣSEM含量最大值。这是因为在阳宗海沉积物ΣSEM含量的研究中,根据流域污染源特征,增加了重金属As含量。阳宗海曾在2008年遭受过严重的As污染事件,水库水体中As浓度超标严重,从而造成了沉积物中ΣSEM含量较高,其中As所占比例较高[52]。相比国内其它湖库,汤河水库沉积物中首次出现了Ni诱发的潜在生态风险,这与汤河流域土壤中Ni具有较高背景值和流域内镍黄铁矿开采产生的酸性矿山废水排放有关。由此可见,湖库沉积物重金属生态风险与流域内土壤重金属背景值和工矿企业废水排放特征紧密关联。
湖库沉积物出现AVS和ΣSEM最大值的区域与水深有一定关联。浅水湖泊如太湖、东湖、巢湖等沉积物中AVS和ΣSEM最大值均出现在湖泊近岸区,这是由于浅水湖泊近岸区更容易接纳来自流域的污染,这些污染物随径流输入会在近岸区的沉积物中积累[55]。深水湖库如红枫湖、抚仙湖和洋河水库沉积物中AVS和ΣSEM最大值均出现在湖心区或坝前深水区,这与湖库沉积物的淤积状态有关。沉积物细颗粒中拥有较多的颗粒有机碳,对重金属具有较强的亲和力,可促使重金属通过离子交换、络合和沉淀的方式与细颗粒结合。同时,沉积物细颗粒拥有更大的比表面积可以吸附重金属[56]。因此,重金属多通过吸附在沉积物细颗粒上实现在湖库内的迁移。这些重金属等污染物随着推移质泥沙被缓慢输移到湖心区或坝前深水区,导致重金属等污染物在该区域沉积物中被累积[24]。汤河水库坝前深水区沉积物累积效应明显,该区域沉积物中积累了大量的SO42-和有机质,造成了AVS和ΣSEM的含量最大。
3 结论1) 汤河水库东支流库区受到酸性矿山废水排放的影响,导致东支流库区沉积物间隙水中SO42-和S2-浓度、沉积物重金属含量显著高于西支流库区。西支流库区受到居民生活污水排放和农业面源污染等因素影响,导致西支流库区沉积物间隙水中NO3-浓度、沉积物LOI含量和pH要显著高于东支流库区。坝前深水区沉积物间隙水中S2-浓度最高,具有典型的富硫型湖库特征, 沉积物中重金属含量高于其它区域,呈现出明显的累积特征。
2) 汤河水库坝前深水区分层沉积物中AVS含量显著高于其它区域。水库沉积物中ΣSEM含量的纵向和垂向空间分布差异不显著,其中Zn对ΣSEM的贡献率最大,占到了45% 以上。坝前深水区10 cm以下沉积物和西支流库区沉积物中SEM可诱发中等以上重金属生态风险,其中Cu、Ni、Pb和Zn均可能对底栖生物产生潜在毒性效应。水库沉积物中Ni含量有接近中等毒性效应风险的趋势,需重点关注。
3) 富硫型水库沉积物中容易出现高含量AVS,沉积物间隙水中SO42-和NO3-的浓度是决定沉积物AVS净产量的重要因素。流域内土壤重金属背景值以及工业、采矿产业排放的废水特征直接影响着诱发生态风险的重金属种类。
4 附录附图Ⅰ见电子版(DOI: 10.18307/2024.0223)。

|
附图Ⅰ 沉积物重金属含量垂向分布特征 FigureAttached1 Vertical distribution characteristics of heavy metal content in sediments |
| [1] |
Fairbairn DJ, Karpuzcu ME, Arnold WA et al. Sediment-water distribution of contaminants of emerging concern in a mixed use watershed. Science of the Total Environment, 2015, 505: 896-904. DOI:10.1016/j.scitotenv.2014.10.046 |
| [2] |
Fan CX. Advances and prospect in sediment-water interface of lakes: A review. J Lake Sci, 2019, 31(5): 1191-1218. [范成新. 湖泊沉积物——水界面研究进展与展望. 湖泊科学, 2019, 31(5): 1191-1218. DOI:10.18307/2019.0514] |
| [3] |
Xu SG, Wang TX. Review of research on accumulation process and effect of internal pollution of reservoir. Advances in Science and Technology of Water Resources, 2015, 35(5): 162-167. [许士国, 汪天祥. 水库内源污染蓄积过程及影响研究综述. 水利水电科技进展, 2015, 35(5): 162-167.] |
| [4] |
Chen M, Li XH, He YH et al. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake. Water Research, 2016, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| [5] |
Schroeder H, Duester L, Fabricius AL et al. Sediment water (interface) mobility of metal(loid)s and nutrients under undisturbed conditions and during resuspension. Journal of Hazardous Materials, 2020, 394: 122543. DOI:10.1016/j.jhazmat.2020.122543 |
| [6] |
Carlson AR, Phipps GL, Mattson VR et al. The role of acid-volatile sulfide in determining cadmium bioavailability and toxicity in freshwater sediments. Environmental Toxicology and Chemistry, 1991, 10(10): 1309-1319. DOI:10.1002/etc.5620101010 |
| [7] |
Di Toro DM, Mahony JD, Hansen DJ et al. Acid volatile sulfide predicts the acute toxicity of cadmium and nickel in sediments. Environmental Science & Technology, 1992, 26(1): 96-101. DOI:10.1021/es00025a009 |
| [8] |
Chandler GT, Schlekat CE, Garman ER et al. Sediment nickel bioavailability and toxicity to estuarine crustaceans of contrasting bioturbative behaviors-an evaluation of the SEM-AVS paradigm. Environmental Science & Technology, 2014, 48(21): 12893-12901. DOI:10.1021/es5025977 |
| [9] |
Guan HP, Chen XQ, Jin Y et al. Hypolimnetic oxygen depletion by sediment-based reduced substances in a reservoir formerly affected by acid mine drainage. Ecological Indicators, 2023, 151: 110301. DOI:10.1016/j.ecolind.2023.110301 |
| [10] |
Pallud C, Van Cappellen P. Kinetics of microbial sulfate reduction in estuarine sediments. Geochimica et Cosmochimica Acta, 2006, 70(5): 1148-1162. DOI:10.1016/j.gca.2005.11.002 |
| [11] |
Feng JN, Hsieh YP. Sulfate reduction in freshwater wetland soils and the effects of sulfate and substrate loading. Journal of Environmental Quality, 1998, 27(4): 968-972. DOI:10.2134/jeq1998.00472425002700040034x |
| [12] |
Hansel CM, Lentini CJ, Tang YZ et al. Dominance of sulfur-fueled iron oxide reduction in low-sulfate freshwater sediments. The ISME Journal, 2015, 9(11): 2400-2412. DOI:10.1038/ismej.2015.50 |
| [13] |
Liu F, Qin FX, Hu JW et al. Acid volatile sulfide and bioavailability of heavy metals in sediments from Hongfeng Lake. Acta Scientiae Circumstantiae, 2009, 29(10): 2215-2223. [刘峰, 秦樊鑫, 胡继伟等. 红枫湖沉积物中酸可挥发硫化物及重金属生物有效性. 环境科学学报, 2009, 29(10): 2215-2223. DOI:10.13671/j.hjkxxb.2009.10.018] |
| [14] |
Li JC, Wang XR. Acid volatile sulfide in sediments of Bosten Lake. Environmental Science & Technology, 2008, 31(12): 121-124. [李金城, 王晓蓉. 博斯腾湖沉积物中的酸可挥发性硫化物. 环境科学与技术, 2008, 31(12): 121-124.] |
| [15] |
Chen JG, Yang HQ, Zhang DD et al. A particular river-whiting phenomenon caused by discharge of hypolimnetic water from a stratified reservoir. PLoS One, 2015, 10(9): e0137860. DOI:10.1371/journal.pone.0137860 |
| [16] |
Yin HB, Fan CX, Cai YJ. Distribution characteristic and correlation of AVS and SEM in surface sediments of Lake Taihu. J Lake Sci, 2008, 20(5): 585-590. [尹洪斌, 范成新, 蔡永久. 太湖表层沉积物AVS与SEM分布特征及相互关系. 湖泊科学, 2008, 20(5): 585-590. DOI:10.18307/2008.0506] |
| [17] |
Yuan SF, Gong XF, Jiang L et al. Ecological risk assessment of heavy metals in sediments of Poyang Lake: SQGs and AVS-SEM Models. Chinese Journal of Soil Science, 2020, 51(1): 234-240. [袁少芬, 弓晓峰, 江良等. 鄱阳湖沉积物重金属生态风险评价: SQGs和AVS-SEM模型法. 土壤通报, 2020, 51(1): 234-240.] |
| [18] |
Zhou CQ, Peng Y, Chen L et al. Rapidly increasing sulfate concentration: A hidden promoter of eutrophication in shallow lakes. Biogeosciences, 2022, 19(17): 4351-4360. DOI:10.5194/bg-19-4351-2022 |
| [19] |
Hayes NM, Deemer BR, Corman JR et al. Key differences between lakes and reservoirs modify climate signals: A case for a new conceptual model. Limnology Oceanography Letters, 2017, 2(2): 47-62. DOI:10.1002/lol2.10036 |
| [20] |
Liu SW, Zhang XF, Lv PY et al. Effects of cascade reservoirs in the lower reaches of Jinsha River on nitrogen and phosphorus retention. J Lake Sci, 2019, 31(3): 656-666. [刘尚武, 张小峰, 吕平毓等. 金沙江下游梯级水库对氮、磷营养盐的滞留效应. 湖泊科学, 2019, 31(3): 656-666. DOI:10.18307/2019.0305] |
| [21] |
Gamier J, Billen G, Coste M. Seasonal succession of diatoms and Chlorophyceae in the drainage network of the Seine River: Observation and modeling. Limnology and Oceanography, 1995, 40(4): 750-765. DOI:10.4319/lo.1995.40.4.0750 |
| [22] |
Zhou JJ, Zhang M, Lu PY. The effect of dams on phosphorus in the middle and Lower Yangtze River. Water Resources Research, 2013, 49(6): 3659-3669. DOI:10.1002/wrcr.20283 |
| [23] |
Hu SD, Wang TX, Xu SG et al. Accumulation characteristic of nitrogen in reservoirs during the ice-covered period under superimposed influence of ice and sediments: A case study of Biliuhe Reservoir. Environmental Pollution, 2022, 312: 120025. DOI:10.1016/j.envpol.2022.120025 |
| [24] |
Zhu L, Liu JW, Xu SG et al. Deposition behavior, risk assessment and source identification of heavy metals in reservoir sediments of Northeast China. Ecotoxicology and Environmental Safety, 2017, 142: 454-463. DOI:10.1016/j.ecoenv.2017.04.039 |
| [25] |
辽宁省水利事务服务中心. 汤河水库污染源调查报告. 沈阳: 辽宁省水利事务服务中心, 2008: 34-35.
|
| [26] |
Zhang F, Wu D. Cause analysis and countermeasures of abnormal water quality in Tanghe Reservoir. Agriculture & Technology, 2010, 30(2): 67-69. [张峰, 武迪. 汤河水库局部水体水质异常原因分析与对策. 农业与技术, 2010, 30(2): 67-69.] |
| [27] |
McLaughlin MJ, Parker DR, Clarke JM. Metals and micronutrients-food safety issues. Field Crops Research, 1999, 60(1/2): 143-163. DOI:10.1016/S0378-4290(98)00137-3 |
| [28] |
Hsieh YP, Shieh YN. Analysis of reduced inorganic sulfur by diffusion methods: Improved apparatus and evaluation for sulfur isotopic studies. Chemical Geology, 1997, 137(3): 255-261. DOI:10.1016/S0009-2541(96)00159-3 |
| [29] |
Ulrich GA, Krumholz LR, Suflita JM. A rapid and simple method for estimating sulfate reduction activity and quantifying inorganic sulfides. Applied and Environmental Microbiology, 1997, 63(4): 1627-1630. DOI:10.1128/aem.63.4.1627-1630.1997 |
| [30] |
Heiri O, Lotter AF, Lemcke G. Loss on ignition as a method for estimating organic and carbonate content in sediments: Reproducibility and comparability of results. Journal of Paleolimnology, 2001, 25(1): 101-110. DOI:10.1023/A:1008119611481 |
| [31] |
国家环境保护总局. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.
|
| [32] |
He HC, Ding HY, Zhang ZK et al. Grain-size characteristics and their environmental significance of Hongze Lake sediments. Scientia Geographica Sinica, 2005, 25(5): 590-596. [何华春, 丁海燕, 张振克等. 淮河中下游洪泽湖湖泊沉积物粒度特征及其沉积环境意义. 地理科学, 2005, 25(5): 590-596. DOI:10.3969/j.issn.1000-0690.2005.05.013] |
| [33] |
MacDonald DD, Ingersoll CG, Berger TA. Development and evaluation of consensus-based sediment quality guidelines for freshwater ecosystems. Archives of Environmental Contamination and Toxicology, 2000, 39(1): 20-31. DOI:10.1007/s002440010075 |
| [34] |
Zhang T, Zhong WJ, Zeng Y et al. Sediment heavy metals quality criteria for fresh waters based on biological effect database approach. Chinese Journal of Applied Ecology, 2012, 23(9): 2587-2594. [张婷, 钟文珏, 曾毅等. 应用生物效应数据库法建立淡水水体沉积物重金属质量基准. 应用生态学报, 2012, 23(9): 2587-2594. DOI:10.13287/j.1001-9332.2012.0355] |
| [35] |
中国环境监测总站. 中国土壤元素背景值. 北京: 中国环境科学出版社, 1990.
|
| [36] |
Clark EV, Odhiambo BK, Ricker MC. Comparative analysis of metal concentrations and sediment accumulation rates in two Virginian Reservoirs, USA: Lakesmoomaw and pelham. Water Air & Soil Pollution, 2014, 225(2): 1860. DOI:10.1007/s11270-013-1860-2 |
| [37] |
Jørgensen BB. Sulfur biogeochemical cycle of marine sediments. Geochemical Perspectives, 2021, 145-307. DOI:10.7185/geochempersp.10.2 |
| [38] |
Kobler U, Wüest A, Schmid M. Effects of lake-reservoir pumped-storage operations on temperature and water quality. Sustainability, 2018, 10(6): 1968. DOI:10.3390/su10061968 |
| [39] |
Scheller S, Yu H, Chadwick GL et al. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction. Science, 2016, 351(6274): 703-707. DOI:10.1126/science.aad7154 |
| [40] |
Allen HE, Fu GM, Deng BL. Analysis of acid-volatile sulfide (AVS) and simultaneously extracted metals (SEM) for the estimation of potential toxicity in aquatic sediments. Environmental Toxicology and Chemistry, 1993, 12(8): 1441-1453. DOI:10.1002/etc.5620120812 |
| [41] |
Oehm NJ, Luben TJ, Ostrofsky ML. Spatial distribution of acid-volatile sulfur in the sediments ofCanadohta Lake, PA. Hydrobiologia, 1997, 345(1): 79-85. DOI:10.1023/A:1002971130433 |
| [42] |
Brunet RC, Garcia-Gil LJ. Sulfide-induced dissimilatory nitrate reduction to ammonia in anaerobic freshwater sediments. FEMS Microbiology Ecology, 1996, 21(2): 131-138. DOI:10.1016/0168-6496(96)00051-7 |
| [43] |
Marietou A. Nitrate reduction in sulfate-reducing bacteria. FEMS Microbiology Letters, 2016, 363(15): fnw155. DOI:10.1093/femsle/fnw155 |
| [44] |
Fuseler K, Krekeler D, Sydow U et al. A common pathway of sulfide oxidation by sulfate-reducing bacteria. FEMS Microbiology Letters, 1996, 144(2/3): 129-134. DOI:10.1016/0378-1097(96)00337-0 |
| [45] |
Nie WB, Ding J, Xie GJ et al. Simultaneous nitrate and sulfate dependent anaerobic oxidation of methane linking carbon, nitrogen and sulfur cycles. Water Research, 2021, 194: 116928. DOI:10.1016/j.watres.2021.116928 |
| [46] |
Bayraktarov E. The pH and pCO2 dependence of sulfate reduction in shallow-sea hydrothermal CO2-venting sediments (Milos Island, Greece). Frontiers in Microbiology, 2013, 4: 111. DOI:10.3389/fmicb.2013.00111 |
| [47] |
Lee J, Mather AE. Solubility of hydrogen sulfide in water. Berichte der Bunsengesellschaft für Physikalische Chemie, 1977, 81(10): 1020-1023. DOI:10.1002/bbpc.19770811029 |
| [48] |
Zheng L, Xu XQ, Xie P. Seasonal and vertical distributions of acid volatile sulfide and metal bioavailability in a shallow, subtropical lake in China. Bulletin of Environmental Contamination and Toxicology, 2004, 72(2): 326-334. DOI:10.1007/s00128-003-9000-0 |
| [49] |
Diao F, Liu YC, Xu D et al. Comparison of acid volatile sulphide, metal speciation, and diffusive gradients in thin-film measurement for metal toxicity assessment of sediments in Lake Chaohu, China. Science of the Total Environment, 2022, 837: 155438. DOI:10.1016/j.scitotenv.2022.155438 |
| [50] |
Liu C, Huang W, Gu XZ et al. The potential ecological risks and bioavailability of heavy metals in the sediments of Lake Baiyangdian. J Lake Sci, 2022, 34(6): 1980-1996. [刘成, 黄蔚, 古小治等. 白洋淀沉积物重金属潜在生态风险及生物可利用性分析. 湖泊科学, 2022, 34(6): 1980-1996. DOI:10.18307/2022.0614] |
| [51] |
陈磊. 洋河水库、石臼湖、东钱湖和宜兴三氿沉积物中酸可挥发性硫化物(AVS)分布特征[学位论文]. 合肥: 安徽农业大学, 2010.
|
| [52] |
Fan QY, He J, Xue HX et al. Distribution of AVS-SEM in the sediments of Nanhai Lake in Baotou city. Journal of Agro-Environment Science, 2007, 26(3): 910-914. [樊庆云, 何江, 薛红喜等. 包头南海湖沉积物中AVS-SEM的分布规律研究. 农业环境科学学报, 2007, 26(3): 910-914.] |
| [53] |
Yang CL, Chen GM, Li SY et al. Assessment of bioavailability of heavy metals in sediments of Yangzonghai Lake. Chinese Journal of Environmental Engineering, 2016, 10(3): 1191-1199. [杨常亮, 陈桂明, 李世玉等. 阳宗海沉积物中重金属生物有效性评估. 环境工程学报, 2016, 10(3): 1191-1199.] |
| [54] |
Li B, Xun F, Chen XC et al. Distribution characteristic and ecological risk assessment of AVS and SEM in surface sediments of Lake Fuxian. J Lake Sci, 2019, 31(1): 72-80. [李彪, 荀凡, 陈向超等. 抚仙湖表层沉积物AVS与SEM分布特征及其生态风险评估. 湖泊科学, 2019, 31(1): 72-80. DOI:10.18307/2019.0107] |
| [55] |
Su GY, Xu SG, Liu Y et al. Sediment distribution and treatment in the inflow water-level-fluctuating zone of the Biliuhe Reservoir. Water, 2022, 14(4): 580. DOI:10.3390/w14040580 |
| [56] |
Jiang X, Zhu L, Xu SG et al. Effects of seasonal stratification and suspended sediment behaviors on the mobilization of manganese and iron in a drinking water reservoir—A case of Biliuhe Reservoir, Liaoning Province. J Lake Sci, 2019, 31(2): 375-385. [姜欣, 朱林, 许士国等. 水源水库季节性分层及悬浮物行为对铁锰迁移的影响——以辽宁省碧流河水库为例. 湖泊科学, 2019, 31(2): 375-385. DOI:10.18307/2019.0207] |
 2024, Vol. 36
2024, Vol. 36 

