(2: 湖北大学生态文明建设研究院, 武汉 430062)
(3: 武汉市生态环境安全中心, 武汉 430062)
(4: 荆门市生态环境局沙洋县分局, 荆门 448299)
(2: Research Institute for Ecological Civilization Construction, Hubei University, Wuhan 430062, P.R. China)
(3: Wuhan Ecological Environment Security Center, Wuhan 430062, P.R. China)
(4: Shayang County Branch, Jingmen Ecological and Environmental Bureau, Jingmen 448299, P.R. China)
作为陆地营养物质的主要受纳场所,江河湖库经历了氮、磷等营养物质的长期富集。这导致了水体富营养化和水生态系统的退化[1]。沉水植物整株浸没于水中,不仅能吸收水体中的氮、磷等营养物质[2-3],还能吸附水体中的生物性和非生物性的悬浮物质,从而改善水质[4],提高水体透明度[5],增加水体溶解氧[6],有效缓解水体富营养化现象[7]。因此,沉水植物在湖泊水体生态修复中具有重要地位,特别是在维护水域生态平衡、调控水体水质、净化污染水体、防治湖泊富营养化等方面发挥着举足轻重的作用。菹草(Potamogeton crispus)作为秋生夏衰的沉水植物,可以弥补湖库沉水植物秋冬季节性空缺,被广泛应用于富营养化湖泊生态修复中,并逐渐成为我国长江中下游湖库中秋冬季节的优势物种[8-9]。菹草衰亡期正值初夏,进入衰亡期后,较高的水温会加速植物体腐解,其残体在水体中自然腐解会对水生生态系统产生较为复杂的负面影响,其中的氮营养盐释放规律值得重点关注[1, 10]。多形态氮素在水中扮演着重要角色,蛋白质和氨基酸等有机氮参与细胞生长代谢过程,腐解后多种无机氮的转化过程较为复杂[10]。因此,研究沉水植物季节性衰亡过程中氮素营养物质迁移规律以及其机理对于有效控制湖库季相交替期的营养循环具有重要意义。
沉水植物衰亡过程中,上覆水中的浮游细菌参与了植物残体分解的全过程,对沉水植物腐解过程的营养循环起着至关重要的作用[11-12]。一方面,浮游细菌可以分解有机物质,转化水体中的营养成分[13];另一方面,浮游细菌是极为敏感并易受环境影响的生物类群,上覆水环境的变化反过来会影响浮游细菌群落结构[14-16]。因此,常用上覆水中细菌的丰度和群落结构的变化来反映湖库的营养循环以及生态环境的情况,并作为评判生态修复的重要指标[17-19]。同时,研究浮游细菌群落结构及环境因子对其驱动作用,有助于加深对整个湖泊生态系统完整性的了解[20-22]。因此,研究沉水植物腐解期间上覆水的氮营养盐动态、浮游细菌群落的变化及其环境驱动因素,对于深入理解沉水植物腐解过程的作用机理和科学管理湖库沉水植物群落,具有举足轻重的意义。
本研究主要以菹草为对象,通过实验室模拟手段,研究了菹草残体腐解过程上覆水水质变化及环境因子对浮游细菌的的驱动作用,旨在研究上覆水中:(1)氮素(总氮、氨氮、硝态氮、亚硝态氮)在菹草残体腐解期间的动态规律;(2)腐解期间,浮游细菌群落的结构变化及环境因子对其的驱动作用。
1 材料与方法 1.1 实验设计及样品制备实验使用的菹草均采集自湖北省武汉市武昌区的沙湖,菹草采集后去除干净泥沙和杂质,然后用清水漂洗干净,待表面水分自然风干后,用剪刀剪取10 cm长的小段,混合均匀后按照每袋200 g的标准,装入信封袋,放入鼓风干燥箱105℃杀青30 min,最后在80℃烘干至恒重备用。为保证细菌接种,实验用水取自沙湖,沙湖水取回后,充分混匀静置一天后备用。
模拟实验由9个70 L的玻璃钢水箱组成(51 cm×38 cm×29 cm)。用超纯水对采集的沙湖水进行3种梯度稀释,稀释倍数分别为0倍(A组)、2倍(B组)和4倍(C组),A、B、C组水质分别对标地表水Ⅳ、Ⅲ、Ⅱ类水(表 1)。每组水样稀释至对应比例后,各取50 L装入对应水箱。每组做3个平行,共计9个水箱。每个水箱放入腐解袋,腐解袋(20 cm×20 cm)采用尼龙材质,每个腐解袋内装有200 g烘干菹草和配重鹅卵石,确保其全部没入水中,水箱上覆防蚊防尘罩。本实验不控制温度与光照,菹草自然条件腐解。分解实验持续30天,在实验开始后的第0、1、5、10、20、30天分别测定上覆水氮素浓度:总氮(TN)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N);第0、1、2、3、5、7、10、15、20、25、30天分别测定上覆水理化指标:溶解氧(DO)、温度(T)、pH、氧化还原电位(ORP)、电导率(Cond)、浊度(Turb)、总悬浮物(TSS)。
| 表 1 不同稀释比上覆水水质及其对应的地表水类别* Tab. 1 Overlying water quality at different dilution ratios and its surface water categories |
上覆水中,DO、pH、T、ORP和Cond均通过多参数分析仪测定(雷磁DZS-708),Turb采用浊度仪测定(雷磁WZS-180A)。TSS、TN、NH3-N、NO3--N和NO2--N采用国标法测定,其中,TN浓度采用碱性过硫酸钾紫外分光光度法,NH3-N浓度采用纳氏试剂光度法;NO3--N浓度采用紫外分光光度法(检出限0.08 mg/L);NO2--N浓度采用N-(1-萘基)-乙二胺光度法(检出限0.003 mg/L),每个样品均重复测定3次,测定方法参考《水和废水监测分析方法》(第四版)[23]。
1.3 细菌群落分析方法浮游细菌检测取样时,每个实验水箱采集1 L水样,摇匀后在负压状态下,经5 μm聚碳酸酯膜过滤,过滤后的水样再负压经0.2 μm聚碳酸酯膜过滤,取过滤器上0.2 μm的膜装入经灭菌的10 mL离心管内,用于浮游细菌的高通量测序。水样经聚碳酸酯膜过滤用于浮游细菌DNA提取,DNA提取样品保存在-40℃冰箱并进行Illumina高通量测序。测定区域为采用正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)。测序平台的初始数据采用美吉生信云进行后续分析。测序结果使用Fastp(v.0.19.6)进行质控,使用Flash(v.1.2.11)进行序列拼接,使用Uparse(v.7.0.1090)进行OTU聚类,使用Usearch(v.7.0)进行OTU统计,使用Qiime(v.1.9.1)生成丰度表,使用RDP Classifier(v.2.11)进行序列分类注释。
1.4 数据分析与处理使用Origin 8.0进行数据分析与处理,并绘制各项水质指标的点线图。细菌测序数据利用I-Sanger云平台完成群落结构的数据分析。聚类分析使用最大邻近距离法在基于3%的差异值水平上划分多个OTUs(operational taxonomic units,操作分类单元)[24];对OTU水平的浮游细菌群落与环境因子进行去趋势对应分析(detrended correspondence analysis,简称DCA),计算其第一排序轴的梯度范围(lengths of gradient),根据Lengths of gradient特征值选用典范对应分析(canonical correspondence analysis,简称CCA)解释环境因子对细菌群落组成的影响,并进行置换检验(permutation test);网络分析根据环境因子和细菌属水平之间的Spearman相关系数使用Gephi平台确定[25]。使用Adobe illustrate 2020修饰图像。
2 结果与讨论 2.1 腐解过程上覆水理化性质变化腐解实验从3月3日-4月3日止,共持续30天。实验过程上覆水平均温度为16.2℃。最高和最低温分别是22.1和10.3℃,实验过程中仅在开始后7天内有小幅波动,随后7~25天内的温度变化较为平缓,在第25~30天内温度骤跌至10~11℃,直至实验结束。
3组处理的上覆水中DO浓度的变化整体呈现先急剧下降,后缓慢上升的趋势,低谷均出现在实验的第10天(图 1)。DO在前10天急剧下降的主要原因是植物体开始腐解时,微生物活动参与生化反应过程,消耗掉水体中的氧气,随后腐解速度减缓,微生物活性相应减弱,上覆水复氧速度大于耗氧,因此溶解氧开始回升[26-27]。各处理组的pH值也表现相同的变化趋势,在实验开始后的7天内有明显波动并降低,并在第3天出现较小值(A组7.38、B组7.47、C组7.49),随后缓慢攀升至7.9~8.6。水生植物腐解实验常有类似现象,其原因多归结为3个方面:(1)植物残体腐解初期释放部分不稳定有机物,在微生物作用下分解出CH4、CO2、NO3--N[28-31];(2)腐解初期残体分解出大量带有羧基、酚基的大分子有机酸类[32];(3)腐解后期CH4、CO2、NO3--N等的转化速率随碳源减少而降低[26, 33],pH和DO逐渐恢复。本研究中,pH与DO的变化趋势类似。此外由于植物组织溶解、氨化、硝化、反硝化等作用因需要H+参与而呈现出弱碱性环境,随着反应的减弱,加上水体自身的酸碱度平衡作用,pH值变化恢复正常[26]。
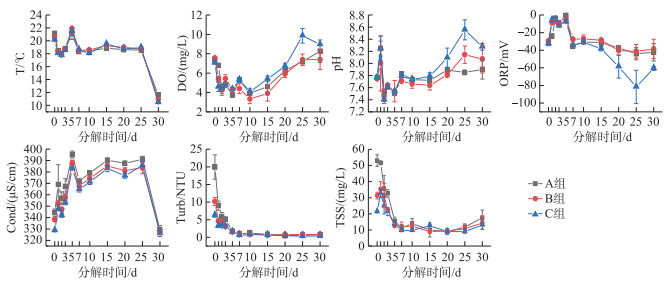
|
图 1 菹草腐解过程水的理化性质变化 (A组: 未稀释组; B组: 稀释2倍组; C组: 稀释4倍组。点为均值,误差棒为标准误SE,下同) Fig.1 Water physical and chemical properties during decomposition of Potamogeton crispus (A: the undiluted group; B: the 2-fold diluted group; C: the 4-fold diluted group. Data points are mean values, error bars are standard error, the same below) |
ORP是水体环境条件的一个综合性指标,其反映了水质体系中所有物质表现出来的宏观氧化还原性,帮助人们了解水体中可能存在的氧化还原物质及其存在量,了解水质状态[34-35]。ORP的变化影响着水体生化反应的进行,不同的氧化还原反应中,参与反应的细菌种类不同,当水体ORP高,表明溶解氧充足,需氧菌参与反应,水体和底泥中的有机物将会分解[36]。整个反应过程中,ORP均处于负值(图 1),且与DO呈现明显的反向变化趋势,实验前7天3组的ORP都波动剧烈,在第5天出现较高值(1 mV),自第10天后电位随时间而逐步降低。腐解产生的有机物逐渐聚积,消耗大量电子受体进行厌氧呼吸,导致ORP呈现还原态[37]。随着DO的逐渐恢复,ORP出现小幅抬升,厌氧活动受到抑制。在第20~25天,C组ORP的下降速度超过了其他两组。与此同时,该阶段C组的溶解氧DO和pH值均有所上升。然而,目前尚未有研究表明三者之间存在明显负相关关系,其机制原因有待进一步研究。本实验结果表明,尽管ORP的变化与DO和pH的变化似乎相反,但它们之间的负相关性并不显著(r<-0.85,P>0.05)。
水体的电导率(Cond)与水中含有导电物质的数量和浓度有关,水体中的导电物质主要是一些电解质解离出的带电离子,还有沉积物向水体中迁移的物质等[38]。与pH类似,电导率在一定程度上反映了水体的被污染程度,沉水植物的腐解过程会释放大量有机酸和营养盐,导致水体电导率升高,且电导率随污染物浓度的升高而加大。本研究中,所有实验组的电导率变化较为一致,均先在开始实验后第5天上升至最高点(A组:396 μS/cm,B组:388 μS/cm,C组:384 μS/cm),随后保持在较高水平波动。Atkinson等[39]研究表明,水柱在缺氧还原环境下,上覆水Fe、Mn浓度增多并且释放速度较快,含硫有机物的分解和硫酸盐的还原产生大量S2-。直至第25天后急剧下降至最低点(A组:330 μS/cm,B组:327 μS/cm,C组:326 μS/cm),总体呈现一个倒U型曲线。这种波动说明,腐解在25~30天时已基本完成。
浊度(Turb)和总悬浮物(TSS)的变化规律类似,仅在实验开始时有显著的组间差异,均是从实验开始的前5天就降低至较低水平,随后一直维持在较低的水平,直至实验结束(图 1)。Turb和TSS均在第5天出现较低值(0.5 NTU、9 mg/L)。其主要原因是模拟实验环境的水柱较稳定,有利于悬浮物的沉降。TSS和Turb对水体中细菌群落结构会产生显著影响,较高的TSS与Turb会显著抑制变形菌门与拟杆菌门的部分菌属[40-41],但也可有利于反硝化细菌的附着生存[42]。在湖泊中,沉水植物处于生长成熟期时的水环境Turb和TSS等都较低。当沉水植物腐解或被收割后,由于残体组织的初步分解,且缺少对水流的缓冲作用,水柱底部的沉积物会更多地卷入上覆水中,而沉积物和土壤中的微生物也会裹挟其中,进而对上覆水的浮游细菌群落结构产生扰动。
2.2 腐解过程上覆水氮素变化菹草腐解过程中,上覆水的氮素浓度动态变化如图 2所示。实验开始的前5天,原水组(A组)TN在实验开始后出现轻微下降,NH3-N浓度逐步升高,NO3--N浓度在第1天之后低于检测线浓度,NO2--N浓度略有波动,后续低于检测限浓度。然而,稀释组(B、C组)的各类氮素均在实验前5天出现了剧烈波动,均在实验第1天出现最大值,最大浓度与稀释倍数呈正相关关系,随后两组的各氮素浓度均在第5天后下降至相同水平,此后波动均无组间差异。腐解前5天各形态氮在A组和B、C组中具有明显差异,B、C组出现了剧烈的氮素冲击,并且水质越好前期的波动越剧烈。这种氮素变化的组间差异,首先源于湖水稀释后引发的各组细菌增殖数量不同,各组在第1天的细菌OTUs数出现不同(图 3),这直接导致氮素变化的组间差异;其次,在腐解第1天,组间浮游菌群结构的变化不同(图 4),有机氮矿化和硝化反硝化进程可能出现了改变;最后,B、C组在0~1 d的DO消耗量更大(图 1),这与该时段内细菌数量增加有直接联系,细菌数量增加促进了硝化和反硝化作用,因此组内出现了更加活跃的硝化与反硝化作用,导致其NO3--N和NO2--N在第1天就出现冲击现象。腐解初期A组的TN下降但NO3--N和NO2--N基本不变,这是由于上覆水中大量悬浮物沉降和原始菌群数量较少导致的(图 1和图 3a)。初始水质差异通过影响浮游菌群的数量和结构,进而导致腐解前期的上覆水氮素变化出现组间差异。

|
图 2 菹草腐解过程氮素变化 Fig.2 Nitrogen change during decomposition of Potamogeton crispus |
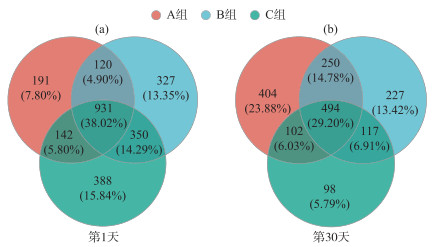
|
图 3 菹草腐解过程上覆水细菌OTUs数量 Fig.3 OTUs for the overlying water bacteria during decomposition of Potamogeton crispus |
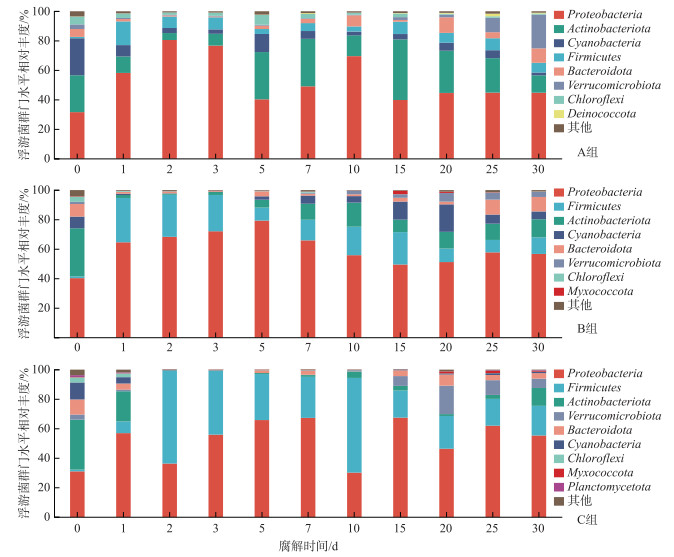
|
图 4 菹草腐解过程中不同处理组细菌门水平的相对丰度 (A组:未稀释组;B组:稀释2倍组;C组:稀释4倍组) Fig.4 Percent of community abundance on Phylum level during decomposition of Potamogeton crispus |
实验进行5天后的氮循环路径发生了改变。各组TN与B、C组NH3-N变化趋于平稳,A组NH3-N在第10天升高至最大值(1.07 mg/L)后逐步下降,各组NO3--N和NO2--N均低于检测线浓度。这种变化与上覆水理化性质改变及其对浮游菌群的影响有关。第一,残体内不稳定的有机物被分解,含碳有机物在微生物作用下释放CH4和CO2,导致pH下降[27],含氮有机物经微生物作用产生NH3和胺类物质,进入缺氧环境后逐渐积累,导致pH升高;第二,ORP在第5天后小于0 mV,并在第25天下降到-98.6 mV(图 1),还原态环境抑制了硝化过程,极少的NO3--N产物(图 2)降低反硝化过程;第三,水中的悬浮物为硝化菌和反硝化菌提供了良好的生长微区[42],由于各组的悬浮物浓度在5天后下降至近似水平(图 1),因此改变了上覆水中参与到硝化和反硝化作用的细菌数量,导致随后的腐解过程中氮素未出现类似的剧烈波动。腐解期的上覆水理化性质变化可能通过影响浮游菌群的结构,进而影响上覆水的氮素循环路径。
在富营养湖泊修复中,沉水植物季相交替期发生的腐解是水质波动的因素之一,已有研究证明,植物残体的分解会对水质造成负面影响[43-44]。植物残体分解所释放的氮素会对水体造成较大的瞬时冲击(图 2),进而对氮循环进程造成扰动[45]。本研究中,菹草腐解后产生的高浓度氨氮,不仅会对部分水生动物产生毒害作用[46-47],而且会促进蓝藻的繁殖。根据植物的发育特征,菹草可归类为冷季型沉水植物,初夏逐渐衰亡腐解。结合实验结果,随着湖泊水质逐步改善,今后在季相交替期间,更有针对性地及时对以菹草为代表的沉水植物进行收割管理,可以有效预防植物分解对上覆水水质的负面影响。
2.3 腐解过程中不同处理组上覆水细菌OTUs和群落结构变化分析OTU是系统发生学或群体遗传学研究中的分类方法,人为地将某一分类单元(品系、种、属、分组等)归为同一类。在微生物多样性分析中,根据相似度水平对所有序列进行OTU划分。通常将相似度高于97%(种水平)定义为一个OTU,即代表一个物种。
利用Venn图分析发现(图 3),腐解过程中上覆水的OTU数量出现变化。第1天的OTU总数为4923个,3个组的OTUs数分别为1384、1728和1811,其中共有OTUs数为931(占比38.02%);第30天的OTU总数为3149个,3个组的OTUs数分别为1250、1088和811,其中共有OTUs数为494(占比29.20%)。腐解前后3个组的细菌OTUs总数分别下降10%、37%和55%。第1天时,3组的共有浮游细菌OTUs数量最多(931个),分别占A、B、C 3组细菌OTUs总数的67.27%、53.88%和51.41%(图 3a);第30天时,共有的细菌OTUs数量减少至494个,分别占3组细菌OTUs总数的39.52%、45.40%和60.91%(图 3b),第1天的共有OTUs数量占比的排序与第30天的相反(第1天:A>B>C;第30天:C>B>A)。随着腐解的进行,A组独有的OTUs占比增加,在第1天占细菌OTUs总量的7.80%,第30天时占比提升至23.88%,而B、C组在第30天的独有OTUs占比的略有下降。第1天的浮游细菌OTUs的组间差异与腐解对不同水质的影响有关,水质越好,残体腐解产生的氮素冲击越大(图 2),越有利于浮游细菌的繁殖。第30天的菌群OTUs降低说明菹草残体腐解过程中,浮游细菌群落的物种数量会发生减少。根据第1天和第30天的结果对比可知,腐解期间上覆水共有细菌OTUs在组内的占比随水质的改善而提高;水质越好腐解时释放的营养物质对上覆水中的微生物群落冲击程度越大,而水质变好有利于共类细菌的生长和繁殖,此类细菌以变形菌门、厚壁菌门和拟杆菌门为主[48-49]。
不同处理组上覆水细菌门水平的相对丰度分布特征见图 4(保留前10种)。结果表明,主要优势细菌门(>80%)的种类基本不随营养状态和腐解进程而变化。不同水质不同时间的优势细菌门前6类种类相同,分别为变形杆菌门(Proteobacteria)、放线杆菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、蓝藻菌门(Cyanobacteria)、类杆菌门(Bacteroidota)和疣微菌门(Verrucomicrobiota)。变形菌门相对丰度在3组中最大,该门内的很多微生物不仅可以通过异养获能,其很多细菌属可以从太阳光中获得能量进行代谢[50],多样化的能量途径有利于变形菌门在自然界中广泛存在。放线菌、类杆菌门、蓝藻菌门和疣微菌门是湖泊水体浮游细菌群落中的常见优势类群[51-52]。
优势细菌门的排序随水质差异发生变化,主要通过影响厚壁菌门、疣微菌门、放线杆菌门和蓝藻菌门的相对丰度大小进而影响优势菌门的排序差异(图 4)。水质条件不同导致的营养盐浓度差异会对浮游细菌群落组成有较大影响。在较好水环境中,植物分解导致的营养元素升高对部分细菌分解者的数量与活性有更强的促进作用[53],但在富营养环境中,细菌的营养需求被基本满足,因此营养盐浓度的提升对其数量与活性的影响并不显著[54]。在本研究中,氮素冲击程度随水质改善而加强,厚壁菌门是参与氮循环的重要细菌[55],因此该菌门在稀释组中的相对丰度更大,相对秩次提前。然而,营养盐浓度升高也会对部分细菌产生抑制效应。放线杆菌门的相对丰度与无机氮有显著负相关关系[56],环境中无机氮含量过高会抑制该菌门的相对丰度。N、P浓度与蓝藻菌门具有耦合关系[57],氮负荷对蓝藻菌可产生营养限制[58]。这表明,氮素变化特征会影响部分优势细菌门的相对丰度大小;水质改善后,当发生植物腐解引发的氮素冲击时,浮游细菌群落结构会朝着有利于厚壁菌门占据更大相对丰度的方向变化。
在天然水体中,水生植物腐解的前期阶段包括:快速溶淋与微生物定殖。0~3天内氮素会出现短时冲击,3天后逐渐降低(图 2)。腐解开始时,营养物质通过浸出、自溶等方式进入水体中[59-60]。与原始上覆水中的浮游细菌相比,这些营养物质能促进菌群的快速生长,菌群逐渐消化一部分淋溶物质。结合实验结果可知,促进过程具有针对性,且受原始水质影响,原始水质越好,营养物质对厚壁菌门的促进效果越明显,同时该菌门细菌可促进脱氮作用,实现正反馈效果,有利于上覆水水环境的稳态恢复。此外,上覆水中氮素的急剧变化会对浮游细菌结构造成极大影响。然而,不同原始水质下植物的腐解对浮游细菌结构的影响鲜有报道。结合本实验结果,菹草残体腐解的氮冲击随水质差异而变化,短期氮素释放越多,浮游细菌相对丰度遭受氮冲击后的变化越剧烈。
2.4 环境因子与浮游细菌群落的关联分析微生物与植物的互利关系易受到环境因子影响而改变微生物群落结构[61],且浮游细菌容易受到环境因子的影响。为了定量分析环境因子与浮游细菌群落的相互关系,首先对OTU水平的浮游细菌群落与环境因子进行去趋势对应分析(DCA),以计算其第一排序轴的梯度范围。分析结果显示最大特征值大于3(梯度范围=3.667),因此选择CCA进行深入分析。以33个样本的OTUs权重组成的物种矩阵和11种环境因子组成的环境变量矩阵为基础数据,得到样本、物种、环境因子相互关系的二维CCA排序图,并依旧按照稀释比例划分为3类(A组、B组、C组)(图 5)。分析结果表明,第一排序轴CCA1和CCA2的特征值累计占总特征值的20.14%。对环境因子而言,第一和第二排序轴的相关系数都为0,分析结果可靠[62]。

|
图 5 菹草腐解过程中浮游菌群和环境因子的典范对应分析(OTU水平,数据点为样品点。点标签表示组别号、平行样号和腐解时间,例如:A2-20为A组2号样品的第20天腐解。不显著的环境变量用虚线空心箭头表示,P>0.05) Fig.5 Canonical correspondence analysis on bacterioplankton community and environmental factors during decomposition of Potamogeton crispus (OTU levels, points are sample points. Point labels indicate the group, parallel sample number and decomposed time, e.g.: A2-20 is the 20th day of decomposition for sample number 2 of group A. The dotted hollow arrow indicates that this environment variable is not significant, P>0.05) |
在排序图中(图 5),3组样本用不同点表示,样本点越接近代表它们越相似。从水质变化特征和腐解过程看,A、B、C三组基本均匀分布在第一排序轴CCA1的两侧,但被第二排序轴CCA2划分为两个时段。样本点在组间并未显示出明显的差异,但表现出明显的时间分布特征。k-mean聚类分组结果表明样本点可分为2个时段:腐解时段Ⅰ为第0~5天,腐解时段Ⅱ为第10~30天。置换检验结果表明,水质分组差异不显著(P>0.05),时段分组具有显著差异(P < 0.05)。在时段Ⅰ中,浮游菌群与T、TSS、TN、NO3--N、NO2--N呈显著正相关(P < 0.05),与DO和ORP呈显著负相关(P < 0.05);腐解进入时段Ⅱ后,菌群与环境因子的相关性发生翻转。在富营养化湖泊中,悬浮物浓度是浮游微生物群落结构与食物网变化的主要驱动因素之一[57],植物残体腐解初期不仅伴随氮素释放冲击,还包括因水柱稳定性降低导致沉积物再悬浮。腐解后期,悬浮物逐渐沉降,有机物大部分转化为无机盐离子。水质逐渐恢复正常。这说明菹草残体分解时,环境因子对上覆水浮游细菌群落的驱动作用会随腐解的进程而明显变化,但其不会随原始水质的改善而发生明显变化。
环境因子用箭头表示,箭头长短表示某环境因子对细菌群落结构变化影响的强度,线越长影响越大,反之则小。从图 5可知,在OTUs水平上,除NH3-N、Cond和pH外,其余8个环境因子(TN、ORP、NO3--N、NO2--N、T、TSS、Turb和DO)均对腐解过程中上覆水浮游细菌群落结构变化有显著影响,其中,TN、NO3--N、NO2--N较NH3-N对群落结构的影响更大;ORP和TSS相较其他水理化指标对细菌群落结构变化影响较大, 这说明环境因子对细菌群落结构变化的影响具有差异性。在富营养化水体中,氮素浓度可对部分细菌产生限制作用[58],但NH3-N对细菌群落结构无显著影响[63],这与本研究的结果一致。NH3-N的浓度变化相较于NO3--N、NO2--N更不明显(图 2),这可能是其不显著的主要原因。腐解期间3个组的NH3-N都是TN的主要组成部分(图 2),因此NH3-N对细菌群落结构的影响并不能完全忽略。张紫薇等[64]利用冗余分析(RDA)和网络分析等方法综合比较发现,DO、T、NO3--N和ORP是影响岗南水库水体微生物群落组成变化的重要驱动因素;王欢等[65]利用RDA发现pH和NO2--N是影响碧流河水库细菌群落结构变化的主要环境因素。此外,ORP是影响细菌代谢活动的主要因素,环境中ORP的变化直接影响不同细菌的活性与生存[66-67]。Nimnoi[40]研究泰国湾上游环境因子对细菌群落的影响表明,TSS对浮游菌群常见菌门有较显著负相关关系(r < -0.65, P < 0.05)。
选取浮游细菌群落中门水平相对丰度前7类细菌门的属水平间Spearman相关系数(|rs|>0.5)的数据,构建细菌属水平与环境因子的网络,研究细菌群落结构与环境因子间的关系(图 6)。图中大小变化的节点分别表示不同的环境因子,环境因子节点的大小表示环境因子对群落结构影响程度高低,从图 6可知,影响细菌属水平的环境因子相对大小为:TSS>ORP>T>Turb>TN,但T所影响的细菌属数量最少。大小不变的节点为不同菌门的细菌属,其中蓝点为变形杆菌门细菌属,红点为厚壁菌门细菌属,橘红点为疣微菌门细菌属,绿色为蓝藻菌门细菌属,橙红点为放线杆菌门细菌属,橙色点是类杆菌门细菌属;节点与节点间连线的颜色代表环境因子对细菌的作用关系:红色为正相关关系,绿色为负相关关系,连线宽度与相关系数|rs|呈正比。图 6表明,ORP与疣微菌门属细菌(g_norank_f_Verrucomicrobiaceae)、类芽孢杆菌属(g_Paenibacillus)、弯曲菌属(g_Desulfosporosinus)、多核杆菌属(g_Polynucleobacter)等呈显著正相关关系(P < 0.05),与假单胞菌属(g_Pseudomonas)、丛毛单胞菌属(g_Comamonas)、微小杆菌属(g_Exiguobacterium)等呈显著负相关关系(P < 0.05);Turb和TSS与g_Paenibacillus则呈显著负相关关系(P < 0.05),与g_norank_f_JG30-KF-CM45属细菌和福格斯氏菌属(g_Vogesella)呈显著正相关关系(P < 0.05);TN、NO3--N和NO2--N与g_CL500-29_marine_group和g_hgcl_clade属细菌呈显著正相关关系(P < 0.05),与红杆菌属(g_Rhodobacter)、假红杆菌属(g_Pseudorhodobacter)呈显著负相关关系(P < 0.05)。这一结果揭示,TSS、ORP、Turb和TN作为主要环境因子,显著影响着水体中浮游细菌群落的构成。其中,TSS和Turb与上覆水中的浮游细菌呈现出较为明显的负相关性,这与王欢等[65]的研究成果相吻合。相反,ORP与浮游细菌呈现出强烈的正相关性,这与张紫薇等[64]的研究发现保持一致。营养盐浓度可以对浮游细菌群落结构产生影响,氮素会增加异养细菌的生物量并导致其群落组成的变化[68]。浊度越低将越有利于硝化菌和反硝化菌在菌群中的生存。在自然水体中,TSS和Turb会在植物残体腐解期间逐渐升高,基于结果可知这会对水中浮游菌群产生负面影响。在ORP逐步下降的过程中,这种负面影响可能会被放大,对于浮游细菌群落产生进一步影响。此外,CCA与网络分析结果都表明,TSS、ORP和Turb与细菌群落的关系要比氮素指标更重要。
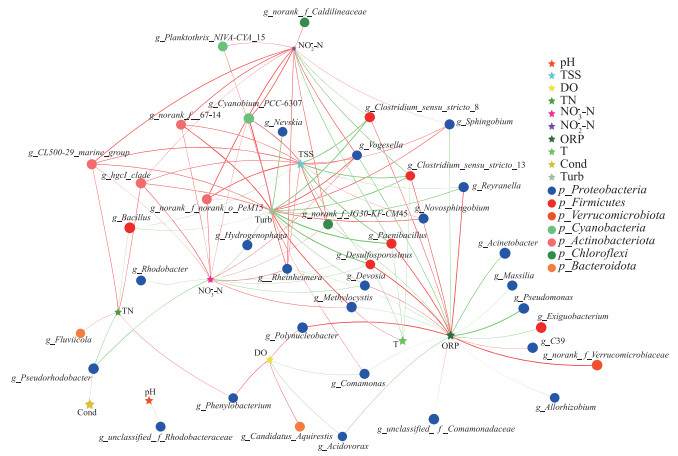
|
图 6 菹草腐解过程中细菌属水平和环境因子的网络分析(星号表示环境因子,圆点表示细菌属,红线代表正相关,绿色代表负相关,线宽数值为|rs|,P < 0.01, |rs|>0.5) Fig.6 Network analysison bacteria genus levels and environmental factors in the decay of Potamogeton crispus (Stars represent environmental factors, dots represent bacterial genera, red lines indicate positive correlation, green lines represent negative correlation, and the thickness of the line represents the absolute value of |rs|, P < 0.01, |rs|>0.5) |
湖泊的水体生态修复工程中,虽然人工修复群落已发展到多种植物搭配[69-70],但菹草仍是常用的冷季型植物,并且生长具有暴发性,易在富营养化水体中过量生长[71]。在春夏交替期时依旧面临腐解导致的水质波动问题,虽然持续时间较短,但本研究表明这种波动是值得关注的。波动程度会随水质的提升而逐渐剧烈,并对上覆水中的氮素循环及其相关浮游菌群产生影响。本研究表明,腐解引起的上覆水理化性质与氮素营养盐波动,在影响浮游菌群方面可能需要同等重视。为了降低腐解引发的负面影响,沉水植物大面积衰亡后的1~3天进行残体打捞收割是较为适宜的。在对沉水植物进行收割管理的同时,研究人员也应考虑到收割的程度与收割后环境因子的变化,以平衡植物残体可能造成的淤积问题[72]和收割后水质波动对浮游细菌群落结构的影响。这对水生态修复工程中后期的科学管理提出了挑战。
3 结论1) 上覆水水质好坏与菹草分解的短期氮冲击呈现明显关联,原始水质越好,短期氮冲击越强。
2) 菹草腐解与浮游细菌群落变化之间存在关联,菹草分解的营养盐影响了浮游细菌的群落结构。不同原始水质的浮游菌群对短期氮冲击响应程度有明显差异。
3) 变形杆菌门是整个腐解过程中的第一大优势菌群,主导腐解全过程,水质改善有利于厚壁菌门生长和繁殖,两菌门的相对丰度增加。
4) 环境因子中TSS、ORP、Turb和TN是水体浮游细菌群落结构的主要驱动因子,TSS、ORP、Turb等理化指标对水体浮游菌群的影响值得关注,环境因子对细菌群落结构的影响会随腐解进程而明显变化,但其随水质改善的变化不明显。
| [1] |
Cao PP, Liu MS, Tang JY et al. A comparative study on the decomposition processes among some aquatic plants. Acta Ecologica Sinica, 2014, 34(14): 3848-3858. [曹培培, 刘茂松, 唐金艳等. 几种水生植物腐解过程的比较研究. 生态学报, 2014, 34(14): 3848-3858. DOI:10.5846/stxb201212011724] |
| [2] |
Huang ZX, Zhang YJ, Ma HF et al. A comparative study on removal efficiency of four submerged plants on phosphorus and nitrogen in eutrophic water under different planting density. Ecological Science, 2011, 30(2): 102-106. [黄子贤, 张饮江, 马海峰等. 4种沉水植物对富营养化水体氮磷的去除能力. 生态科学, 2011, 30(2): 102-106. DOI:10.3969/j.issn.1008-8873.2011.02.02] |
| [3] |
Wu TY, Xie PJ, Yan LR et al. Repairing effect of Potamogeton crispus on heavy metal pollution in sediment. Ecological Science, 2014, 33(6): 1182-1188. [胡天印, 谢佩君, 晏丽蓉等. 菹草对底泥中重金属污染的修复效果. 生态科学, 2014, 33(6): 1182-1188.] |
| [4] |
Quan WM, Shen XQ, Yan LJ. Advances in research of biological purification of eutrophic water body. Chinese Journal of Applied Ecology, 2003, 14(11): 2057-2061. [全为民, 沈新强, 严力蛟. 富营养化水体生物净化效应的研究进展. 应用生态学报, 2003, 14(11): 2057-2061.] |
| [5] |
Chong YX, Hu HY, Qian Y. Advances in utilization of macrophytes in water pollution control. Techniques and Equipment for Environmental Pollution Control, 2003(2): 36-40. [种云霄, 胡洪营, 钱易. 大型水生植物在水污染治理中的应用研究进展. 环境污染治理技术与设备, 2003(2): 36-40.] |
| [6] |
Qin BQ. Occurrence mechanism and control countermeasures of lake eutrophication in the middle and lower reaches of the Yangtze River. Bulletin of Chinese Academy of Sciences, 2007, 22(6): 503-505. [秦伯强. 长江中下游湖泊富营养化发生机制与控制对策. 中国科学院院刊, 2007, 22(6): 503-505. DOI:10.16418/j.issn.1000-3045.2007.06.003] |
| [7] |
Krall MA, Gundlapalli AV, Samore MH. Big data and population-based decision support. Amsterdam: Elsevier, 2014: 363-381. DOI:10.1016/b978-0-12-398476-0.00013-0
|
| [8] |
Tan FX, Luo JB, Qi M et al. Seasonal variation on the diversity, niche breadth and niche overlap of aquatic plant in Changhu Lake. Resources and Environment in the Yangtze Basin, 2021, 30(5): 1121-1129. [谭凤霞, 罗静波, 祁梅等. 长湖水生植物多样性与生态位的季节性变化研究. 长江流域资源与环境, 2021, 30(5): 1121-1129. DOI:10.11870/cjlyzyyhj202105009] |
| [9] |
Zhang M, Liu ZG, Li XQ et al. Studies of the selection and application of suitable hydrophyte species on lake restoration in the middle and lower reaches of Yangtze River. Ecological Science, 2014, 33(2): 344-352. [张萌, 刘足根, 李雄清等. 长江中下游浅水湖泊水生植被生态修复种的筛选与应用研究. 生态科学, 2014, 33(2): 344-352. DOI:10.3969/j.issn.1008-8873.2014.02.023] |
| [10] |
Wang RX, Wen SF, Shan BQ et al. Water quality effect of aquatic plants decomposition and dynamic balance of element destination in Baiyangdian Lake. Acta Scientiae Circumstantiae, 2022, 42(10): 332-341. [王荣欣, 温胜芳, 单保庆等. 白洋淀水生植物腐解水质效应与元素去向动态平衡. 环境科学学报, 2022, 42(10): 332-341. DOI:10.13671/j.hjkxxb.2022.0115] |
| [11] |
Cotner JB, Biddanda BA. Small players, large role: Microbial influence on biogeochemical processes in pelagic aquatic ecosystems. Ecosystems, 2002, 5(2): 105-121. DOI:10.1007/s10021-001-0059-3 |
| [12] |
Newton RJ, Jones SE, Eiler A et al. A guide to the natural history of freshwater lake bacteria. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14-49. DOI:10.1128/MMBR.00028-10 |
| [13] |
Zhou C, Zhou Q, Zhang X. Transformation of acetaminophen in natural surface water and the change of aquatic microbes. Water Research, 2019, 148: 133-141. DOI:10.1016/j.watres.2018.10.042 |
| [14] |
Wang WJ, Sheng YQ. Influences of salinity on the bacterial community composition in overlying water of Yuniao River. Journal of Ecology and Rural Environment, 2022, 38(5): 628-635. [王文静, 盛彦清. 盐度对鱼鸟河上覆水细菌群落结构的影响. 生态与农村环境学报, 2022, 38(5): 628-635. DOI:10.19741/j.issn.1673-4831.2021.0262] |
| [15] |
Zeng J, Jiao CC, Zhao DY et al. Patterns and assembly processes of planktonic and sedimentary bacterial community differ along a trophic gradient in freshwater lakes. Ecological Indicators, 2019, 106: 105491. DOI:10.1016/j.ecolind.2019.105491 |
| [16] |
Chen M, Zhang YQ, Krumholz LR et al. Black blooms-induced adaptive responses of sulfate reduction bacteria in a shallow freshwater lake. Environmental Research, 2022, 209: 112732. DOI:10.1016/j.envres.2022.112732 |
| [17] |
Ciurli A, Zuccarini P, Alpi A. Growth and nutrient absorption of two submerged aquatic macrophytes in mesocosms, for reinsertion in a eutrophicated shallow lake. Wetlands Ecology and Management, 2009, 17(2): 107-115. DOI:10.1007/s11273-008-9091-9 |
| [18] |
Chao CX, Wang LG, Li Y et al. Response of sediment and water microbial communities to submerged vegetations restoration in a shallow eutrophic lake. Science of the Total Environment, 2021, 801: 149701. DOI:10.1016/j.scitotenv.2021.149701 |
| [19] |
Bi S, Lai H, Guo DL et al. Spatio-temporal variation of bacterioplankton community structure in the Pearl River: Impacts of artificial fishery habitat and physicochemical factors. BMC Ecology and Evolution, 2022, 22(1): 10. DOI:10.1186/s12862-022-01965-3 |
| [20] |
Rubin MA, Leff LG. Nutrients and other abiotic factors affecting bacterial communities in an Ohio River (USA). Microbial Ecology, 2007, 54(2): 374-383. DOI:10.1007/s00248-007-9209-2 |
| [21] |
Pajares S, Varona-Cordero F, Hernández-Becerril DU. Spatial distribution patterns of bacterioplankton in the oxygen minimum zone of the tropical Mexican Pacific. Microbial Ecology, 2020, 80(3): 519-536. DOI:10.1007/s00248-020-01508-7 |
| [22] |
Zhang HH, Ma ML, Huang TL et al. Spatial and temporal dynamics of Actinobacteria in drinking water reservoirs: Novel insights into abundance, community structure, and co-existence model. Science of the Total Environment, 2022, 814: 152804. DOI:10.1016/j.scitotenv.2021.152804 |
| [23] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 北京: 中国环境科学出版社, 2002.
|
| [24] |
Caporaso JG, Kuczynski J, Stombaugh J et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [25] |
Bastian M, Heymann S, Jacomy M. Gephi: An open source software for exploring and manipulating networks. Proceedings of the International AAAI Conference on Web and Social Media, 2009, 3(1): 361-362. DOI:10.1609/icwsm.v3i1.13937 |
| [26] |
Zhang LJ, Ye C, Li CH et al. The effect of submerged macrophytes decomposition on water quality. Research of Environmental Sciences, 2013, 26(2): 145-151. [张来甲, 叶春, 李春华等. 沉水植物腐解对水体水质的影响. 环境科学研究, 2013, 26(2): 145-151. DOI:10.13198/j.res.2013.02.34.zhanglj.001] |
| [27] |
Li X, Cui KP, Tang HY et al. Effect of decomposition of submerged plants(Vallisneria natans) on water quality. China Water & Wastewater, 2020, 36(7): 60-67. [李旭, 崔康平, 汤海燕等. 沉水植物苦草腐解对水体水质的影响. 中国给水排水, 2020, 36(7): 60-67.] |
| [28] |
Wu HT, Lv XG, Tang Q et al. The early-stage litter decomposition and its influencing factors in the wetland of the Sanjiang Plain, China. Acta Ecologica Sinica, 2007, 27(10): 4027-4035. [武海涛, 吕宪国, 杨青等. 三江平原典型湿地枯落物早期分解过程及影响因素. 生态学报, 2007, 27(10): 4027-4035. DOI:10.3321/j.issn:1000-0933.2007.10.010] |
| [29] |
Wang C, Wang C, Wang Z. Effects of submerged macrophytes on sediment suspension and NH4+-N release under hydrodynamic conditions. Journal of Hydrodynamics, 2010, 22(6): 810-815. DOI:10.1016/S1001-6058(09)60120-7 |
| [30] |
Carvalho P, Thomaz SM, Bini LM. Effects of temperature on decomposition of a potential nuisance species: The submerged aquatic macrophyte Egeria najas Planchom(Hydrocharitaceae). Brazilian Journal of Biology, 2005, 65(1): 51-60. DOI:10.1590/s1519-69842005000100008 |
| [31] |
Zhang J, Li CH, Ye C et al. Effects of Hydrilla verticillata decomposition on recruitment of the dormant Microcystis spp. Research of Environmental Sciences, 2012, 25(1): 43-50. [张娟, 李春华, 叶春等. 沉水植物黑藻腐解对微囊藻休眠体复苏的影响. 环境科学研究, 2012, 25(1): 43-50. DOI:10.13198/j.res.2012.01.46.zhangj.002] |
| [32] |
Ou X, Cui KP, Tang HY et al. Impacts of decomposition of Vallisneria natans on nutrient speciation concentration in two kinds of water environments. Research of Environmental Sciences, 2017, 30(10): 1553-1560. [藕翔, 崔康平, 汤海燕等. 不同水环境下苦草腐解对水质的影响. 环境科学研究, 2017, 30(10): 1553-1560. DOI:10.13198/j.issn.1001-6929.2017.02.89] |
| [33] |
Zhou LF, Zhao YW, Lu XF. Effects of aquatic plant decomposition on water quality in constructed wetland. Ecology and Environmental Sciences, 2016, 25(4): 664-670. [周林飞, 赵言稳, 芦晓峰. 不同生活型植物腐解过程对人工湿地水质的影响研究. 生态环境学报, 2016, 25(4): 664-670.] |
| [34] |
Xu Z, Wu YQ, Jin FT et al. A comparative study on determination of oxidation-reduction potential in water. Journal of Environmental Management College of China, 2017, 27(2): 83-86. [许震, 吴玉清, 金峰涛等. 水中氧化还原电位测定方法的比较研究. 中国环境管理干部学院学报, 2017, 27(2): 83-86. DOI:10.13358/j.issn.1008-813x.2017.02.22] |
| [35] |
Chen XJ, Cao XM, Jiang ST et al. Effect of redox potential regulation on metabolic flux distribution of Corynebacterium crenatum. Food Science, 2016, 37(9): 165-169. [陈小举, 操新民, 姜绍通等. 氧化还原电位调控对钝齿棒杆菌代谢通量分布的影响. 食品科学, 2016, 37(9): 165-169. DOI:10.7506/spkx1002-6630-201609031] |
| [36] |
Cui Y, Zeng HX, Zhang K. Monitoring and control technology of redox potential in aquaculture. Hebei Fisheries, 2017(4): 54-55. [崔玥, 曾海祥, 张凯. 水产养殖中氧化还原电位的监测与调控技术. 河北渔业, 2017(4): 54-55. DOI:10.3969/j.issn.1004-6755.2017.04.018] |
| [37] |
Sun HQ, Sheng SX, Yang Z et al. Analysis of black-odor factors of lake sediment and elimination strategies of key factor. Environmental Science Survey, 2019, 38(3): 12-20. [孙慧群, 盛守祥, 杨志等. 湖泊底泥黑臭因子分析及其消除的关键因子调控策略. 环境科学导刊, 2019, 38(3): 12-20.] |
| [38] |
Jiang W, Zhou C, Ji DB et al. Comparison of relationship between conduction and algal bloom in Pengxi River and modao river in Three Gorges Reservoir. Environmental Science, 2017, 38(6): 2326-2335. [姜伟, 周川, 纪道斌等. 三峡库区澎溪河与磨刀溪电导率等水质特征与水华的关系比较. 环境科学, 2017, 38(6): 2326-2335. DOI:10.13227/j.hjkx.201610183] |
| [39] |
Atkinson CA, Jolley DF, Simpson SL. Effect of overlying water pH, dissolved oxygen, salinity and sediment disturbances on metal release and sequestration from metal contaminated marine sediments. Chemosphere, 2007, 69(9): 1428-1437. DOI:10.1016/j.chemosphere.2007.04.068 |
| [40] |
Nimnoi P, Pongsilp N. Marine bacterial communities in the upper gulf of Thailand assessed by Illumina next-generation sequencing platform. BMC Microbiology, 2020, 20(1): 19. DOI:10.1186/s12866-020-1701-6 |
| [41] |
Tang XM, Xie GJ, Shao KQ et al. Influence of salinity on the bacterial community composition in Lake Bosten, a large oligosaline lake in arid northwestern China. Applied and Environmental Microbiology, 2012, 78(13): 4748-4751. DOI:10.1128/AEM.07806-11 |
| [42] |
Zhang L, Xia YQ, Liu XM et al. Effects of suspended particles on denitrification in natural water: A review. J Lake Sci, 2023, 35(1): 32-42. [张鹂, 夏永秋, 刘雪梅等. 自然水体中悬浮物对反硝化影响的研究进展. 湖泊科学, 2023, 35(1): 32-42. DOI:10.18307/2023.0101] |
| [43] |
Zhao YY, Tang N, Li ZH et al. Effect of Triarrhena lutarioriparia residue decomposion on water quality in Lake Dongting. J Lake Sci, 2021, 33(4): 1188-1195. [赵媛媛, 汤楠, 李智慧等. 洞庭湖南荻(Triarrhena lutarioriparia)腐解对水质的影响. 湖泊科学, 2021, 33(4): 1188-1195. DOI:10.18307/2021.0420] |
| [44] |
Shen QS, Zhou QL, Shang JG et al. Beyond hypoxia: Occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake. Journal of Environmental Sciences, 2014, 26(2): 281-288. DOI:10.1016/S1001-0742(13)60452-0 |
| [45] |
Liu M, Zhang SH, Zhang LS et al. Impacts of two nitrogen concentrations on nutrients release and nitrogen cycle genes abundance in biofilm during Hydrilla verticillata decomposition. J Lake Sci, 2021, 33(3): 749-760. [刘敏, 张松贺, 张丽莎等. 两种氮浓度对轮叶黑藻(Hydrilla verticillata)腐解过程营养盐释放及附着生物膜内氮循环基因丰度的影响. 湖泊科学, 2021, 33(3): 749-760. DOI:10.18307/2021.0311] |
| [46] |
Yang XW, Xu GC, Gao J et al. Effects of ammonia nitrogen stress on acute toxicity and antioxidant enzymes of Coilia nasus. Transactions of Oceanology and Limnology, 2021, 43(4): 127-132. [杨西伟, 徐钢春, 高俊等. 氨氮胁迫对刀鲚稚、幼鱼的急性毒性及抗氧化酶的影响. 海洋湖沼通报, 2021, 43(4): 127-132.] |
| [47] |
Wang TY, Cong YX, Wu ZX et al. Effects of different concentrations of ammonia-N exposure on the molting and antioxidant capacity of the Chinese Mitten Crab Eriocheir sinensis. Fisheries Science, 2023, 1-14. [王天雨, 丛亚新, 吴朝霞等. 氨氮对中华绒螯蟹蜕壳和抗氧化能力的影响. 水产科学, 2023, 1-14.] |
| [48] |
Pan M, Wang T, Hu BW et al. Mesocosm experiments reveal global warming accelerates macrophytes litter decomposition and alters decomposition-related bacteria community structure. Water, 2021, 13(14): 1940. DOI:10.3390/w13141940 |
| [49] |
Purahong W, Wubet T, Lentendu G et al. Life in leaf litter: Novel insights into community dynamics of bacteria and fungi during litter decomposition. Molecular Ecology, 2016, 25(16): 4059-4074. DOI:10.1111/mec.13739 |
| [50] |
Mukhopadhya I, Hansen R, El-Omar EM et al. IBD—What role do Proteobacteria play?. Nature Reviews Gastroenterology & Hepatology, 2012, 9(4): 219-230. DOI:10.1038/nrgastro.2012.14 |
| [51] |
Zwart G, Crump BC, Kamst-van Agterveld MP et al. Typical freshwater bacteria: An analysis of available 16S rRNA gene sequences from plankton of lakes and rivers. Aquatic Microbial Ecology, 2002, 28: 141-155. DOI:10.3354/ame028141 |
| [52] |
Han MZ, Gong YH, Zhou CY et al. Comparison and interpretation of taxonomical structure of bacterial communities in two types of lakes on Yun-gui Plateau of China. Scientific Reports, 2016, 6(1): 1-12. DOI:10.1038/srep30616 |
| [53] |
Ferreira V, Chauvet E. Synergistic effects of water temperature and dissolved nutrients on litter decomposition and associated fungi. Global Change Biology, 2011, 17(1): 551-564. DOI:10.1111/j.1365-2486.2010.02185.x |
| [54] |
Rejmánková E, Sirová D. Wetland macrophyte decomposition under different nutrient conditions: Relationships between decomposition rate, enzyme activities and microbial biomass. Soil Biology and Biochemistry, 2007, 39(2): 526-538. DOI:10.1016/j.soilbio.2006.08.022 |
| [55] |
Ospina-Betancourth C, Acharya K, Allen B et al. Enrichment of nitrogen-fixing bacteria in a nitrogen-deficient wastewater treatment system. Environmental Science & Technology, 2020, 54(6): 3539-3548. DOI:10.1021/acs.est.9b05322 |
| [56] |
Si KX, Xia CG, Wang CY et al. Distribution of Actinomycetales in sewage outlets along coast in Ningbo. Oceanologia et Limnologia Sinica, 2016, 47(2): 400-406. [司开学, 夏长革, 王朝阳等. 宁波沿海陆源排污口放线菌(Actinomycetales sp.)的分布特点. 海洋与湖沼, 2016, 47(2): 400-406. DOI:10.11693/hyhz20141200338] |
| [57] |
Wu QL, Chen YW, Xu KD et al. Intra-habitat heterogeneity of microbial food web structure under the regime of eutrophication and sediment resuspension in the large subtropical shallow Lake Taihu, China. Hydrobiologia, 2007, 581(1): 241-254. DOI:10.1007/s10750-006-0500-x |
| [58] |
Kolzau S, Dolman AM, Voss M et al. The response of nitrogen fixing cyanobacteria to a reduction in nitrogen loading. International Review of Hydrobiology, 2018, 103(1/2): 5-14. DOI:10.1002/iroh.201601882 |
| [59] |
France R, Culbert H, Freeborough C et al. Leaching and early mass loss of boreal leaves and wood in oligotrophic water. Hydrobiologia, 1997, 345(2): 209-214. DOI:10.1023/A:1002953629795 |
| [60] |
Han HJ, Zhai SJ, Hu WP. Modelling nitrogen and phosphorus transfer in Potamogeton malaianus Miq.decompostion. Environmental Science, 2010, 31(6): 1483-1488. [韩红娟, 翟水晶, 胡维平. 马来眼子菜腐烂分解氮磷转化模型研究. 环境科学, 2010, 31(6): 1483-1488. DOI:10.13227/j.hjkx.2010.06.028] |
| [61] |
Shi CQ, Hu BZ, Yu SP et al. Water purification effect of Ceratophyllum demersum L. and change of microbial community under different treatments. Acta Agriculturae Zhejiangensis, 2020, 32(6): 1070-1081. [史传奇, 胡宝忠, 于少鹏等. 不同处理条件下金鱼藻净水效果与微生物群落变化. 浙江农业学报, 2020, 32(6): 1070-1081. DOI:10.3969/j.issn.1004-1524.2020.06.15] |
| [62] |
ter Braak Cajo JF. Canonical correspondence analysis: A new eigenvector technique for multivariate direct gradient analysis. Ecology, 1986, 67(5): 1167-1179. DOI:10.2307/1938672 |
| [63] |
Zhou LN, Su RH, Ma SJ et al. Effects of nitrite, nitrate and ammonia nitrogen on anaerobic microbial community characterized by using phospholipid fatty acid PLFA method. Acta Scientiae Circumstantiae, 2016, 36(2): 499-505. [周莉娜, 苏润华, 马思佳等. 基于PLFA法分析亚硝氮、硝氮和氨氮对厌氧微生物细菌群落的影响. 环境科学学报, 2016, 36(2): 499-505. DOI:10.13671/j.hjkxxb.2015.0567] |
| [64] |
Zhang ZW, Chen ZY, Zhang TN et al. Spatiotemporal characteristics and key driving factors of microbial community evolution based on high-throughput absolute quantification sequencing in the Gangnan Reservoir. Acta Scientiae Circumstantiae, 2022, 42(2): 224-239. [张紫薇, 陈召莹, 张甜娜等. 基于高通量绝对定量测序解析岗南水库微生物群落的时空分布特征及关键驱动因素. 环境科学学报, 2022, 42(2): 224-239. DOI:10.13671/j.hjkxxb.2021.0289.] |
| [65] |
Wang H, Zhao W, Xie ZG et al. Bacterial community structure characteristics in the Biliuhe Reservoir and its key driving factors. Environmental Science, 2018, 39(8): 3660-3669. [王欢, 赵文, 谢在刚等. 碧流河水库细菌群落结构特征及其关键驱动因子. 环境科学, 2018, 39(8): 3660-3669. DOI:10.13227/j.hjkx.201711022] |
| [66] |
Xing T, Yong Y, Zhang YJ et al. Comparative analysis of nutrient release and bacterial community succession difference between sediment and withering plant. Acta Scientiae Circumstantiae, 2022, 42(2): 409-421. [邢涛, 雍毅, 张韵洁等. 底泥与衰亡植物营养释放及细菌群落演替差异的比较分析. 环境科学学报, 2022, 42(2): 409-421. DOI:10.13671/j.hjkxxb.2021.0331] |
| [67] |
Meng DL, Li J, Liu TB et al. Effects of redox potential on soil cadmium solubility: Insight into microbial community. Journal of Environmental Sciences, 2019, 75: 224-232. DOI:10.1016/j.jes.2018.03.032 |
| [68] |
Song H, Li Z, Du B et al. Bacterial communities in sediments of the shallow Lake Dongping in China. Journal of Applied Microbiology, 2012, 112(1): 79-89. DOI:10.1111/j.1365-2672.2011.05187.x |
| [69] |
Liu M, Chen KN. Purification effect of submerged macrophyte system with different plants combinations and C/N ratios. Environmental Science, 2018, 39(6): 2706-2714. [刘淼, 陈开宁. 植物配置与进水碳氮比对沉水植物塘水质净化效果的影响. 环境科学, 2018, 39(6): 2706-2714. DOI:10.13227/j.hjkx.201710209] |
| [70] |
Choudhury MI, McKie BG, Hallin S et al. Mixtures of macrophyte growth forms promote nitrogen cycling in wetlands. Science of the Total Environment, 2018, 635: 1436-1443. DOI:10.1016/j.scitotenv.2018.04.193 |
| [71] |
Deng HG, Zhang J, Wu JJ et al. Impact of decomposition of Potamogeton crispus on the total carbon, nitrogen and phosphorus concentrations in overlying water of Dongping Lake. Yellow River, 2015, 37(12): 65-68. [邓焕广, 张菊, 吴金甲等. 东平湖菹草腐烂对上覆水碳氮磷浓度的影响. 人民黄河, 2015, 37(12): 65-68. DOI:10.3969/j.issn.1000-1379.2015.12.017] |
| [72] |
刘瑜. 藻苲淀近自然湿地冷暖季水生植物水质净化作用研究[学位论文]. 北京: 北京林业大学, 2019.
|
 2024, Vol. 36
2024, Vol. 36 

