(2: 南京大学生命科学学院,南京 210019)
(3: 南京大学环境学院,南京 210023)
(4: 南京水利科学研究院,南京 210029)
(2: School of Life Science, Nanjing University, Nanjing 210023, P.R.China)
(3: School of Environment, Nanjing University, Nanjing 210023, P.R.China)
(4: Nanjing Hydraulic Research Institute, Nanjing 210029, P.R.China)
蓝藻是地球上已知的最古老的光合产氧微生物,生活史可追溯到35亿年前[1]。在漫长的进化过程中蓝藻形成了一系列特有的生理生态特征,在地球几十亿年的演变过程中扮演着重要的初级生产者的角色[2],对地球生物圈及大气圈的形成具有重要意义[3-4]。蓝藻可适应多种环境,从贫营养的海洋生态系统到富营养化的湖泊,从热带到极地均可生长[5]。同时它们还可作为海绵、硅藻、地衣等内共生体,具有极强的生存能力,大量生长引发水华时可对水生生态系统产生巨大影响[6]。
我国是世界上湖泊富营养化程度最严重的国家之一,水体富营养化是导致蓝藻水华的重要原因[7]。水华通常是指在富营养化水体中,在适宜的光照及温度条件下,藻类生物量显著高于常见水体平均值,在水体中大量生长并使水体透明度发生明显改变,有时可形成肉眼可见聚集体的现象[8]。其中,蓝藻水华尤其是微囊藻水华最为常见。在我国的淡水湖泊如太湖、巢湖、滇池等水体,每年均会发生蓝藻水华,严重影响水生态系统平衡与水生态安全[9-10]。
微囊藻(Microcystis)是构成夏季蓝藻水华的主要藻种之一[11],在野外通常以多细胞群体状态存在,内部存在大量细胞间隙,呈网孔状,在夏季可大量生长最终形成水华。引发水华的因素众多,蓝藻自身的生长特性是重要原因之一[12]。蓝藻具有很多其它藻类不具备的竞争优势,群体态蓝藻可使其避免高温高光强的伤害以及浮游动物及鱼类的捕食,并可更好地吸收与转化营养元素[13]。根据Stokes公式,同等密度条件下,群体的上浮或下沉速率更快,这使得野外群体状蓝藻可以通过浮力调节机制获取更有利的光照及营养条件[14-15]。冬季低温低光强条件下蓝藻沉降至底泥休眠,春季可重新上浮至水体中完成复苏,夏季则会大量增长直至上浮至水体表面形成肉眼可见的水华[16]。蓝藻的浮力调节机制在蓝藻复苏生长形成水华的各阶段均起着重要的作用,是蓝藻成为优势物种并最终上浮至水体表面形成水华的重要原因[17-20]。
蓝藻的浮力主要依靠气囊及细胞镇重物调节。新的研究表明光照条件下产生的大量被困于胞外多糖(EPS)内的氧气泡可促使蓝藻上浮至水体表面形成水华[21]。同时,野外蓝藻群体内部形成的细胞间隙及微环境对于蓝藻的浮力调节同样具有重要作用[22]。蓝藻群体内外微环境相互作用,共同影响着群体内部细胞间隙中的溶氧浓度,进而影响群体浮力[23]。本文主要综述了蓝藻水华形成过程中的主要浮力调节机制,从微观层面分析蓝藻浮力调节机制及蓝藻水华暴发机理,以期为蓝藻水华的预防与治理提供新思路。
1 蓝藻水华形成过程孔繁翔等认为蓝藻的生长及水华形成过程主要分4个阶段,即休眠、复苏、生物量增加以及上浮聚集形成肉眼可见的水华。水华暴发并非突发性事件,而是逐步形成的过程。当外界条件适宜时,过冬休眠的蓝藻即可复苏生长上浮至水体表面形成肉眼可见的水华[24]。蓝藻的浮力调节机制在蓝藻的复苏、生长及最终形成水华的各阶段均起着重要作用[25]。
微囊藻是构成太湖蓝藻水华的常见藻种,生活史包括秋冬季节的沉降、底泥越冬、春季复苏以及夏季大量增长。秋冬季节低温条件下,微囊藻细胞中糖类的积累可导致气囊的破裂及浮力下降,藻体沉降至底泥表面进行休眠[26]。不能生成厚壁孢子的藻体在冬季以营养体的形式存活于底泥中,可存活很久,这种过渡状态被称为“越冬”。采用同位素示踪技术研究发现夏季的微囊藻种群来源于冬季的休眠体,且底泥中蓝藻营养体常年具有光合活性[27]。
底泥蓝藻的复苏主要是指在环境条件适宜时,越冬蓝藻恢复生长并开始向上层水体迁移的过程。微囊藻在复苏过程中可恢复生长,通过合成气囊重新获得浮力上浮至上层水体。Reynolds等认为复苏的微囊藻并非原先沉降的微囊藻,而是在有利环境条件下重新生长的藻体,复苏过程中微囊藻会由无胶被的单个细胞成长为多细胞的聚集体[28]。
影响复苏的因素众多,如底泥蓝藻数量、底泥表面光照强度、水体温度、溶氧等。底泥表面光照增强、温度升高是诱使蓝藻复苏的重要条件[29]。有研究表明在温度达到15℃时蓝藻便开始向水体中迁移,其最适生长温度为20~25℃,这可能与气囊的合成速率有关。一般蓝藻的复苏会出现在溶氧较低及光照较强的底泥表面。蓝藻复苏过程类似于生物再悬浮过程,蓝藻的浮力调节机制是蓝藻能够复苏重新上浮至水体表面的关键[30]。
在春季蓝藻藻体完成复苏进入水体后,在适宜的光照、温度及气候条件下,可大量生长直至暴发形成肉眼可见的水华[31]。水华多发生在夏秋季节,温度是影响蓝藻生长及水华暴发的重要因子之一[32]。除直接影响蓝藻的生长外,在深水湖泊中,水温的升高可加剧水体分层。蓝藻可通过调节浮力获取最佳光照及营养条件,水体分层程度的加剧可增强蓝藻的优势,而无浮力调节能力的藻类如硅藻等生长受到抑制。在晴朗高温无风的天气下,蓝藻调节浮力浮至水面,聚集在水体表面遮蔽其它藻类,最终成为优势物种[33]。
光照对蓝藻生长同样具有重要作用[34-35],光合产物的产生与分解可影响蓝藻细胞内气囊的合成与分解及细胞镇重物含量,从而影响蓝藻浮力[36]。同时,在高pH及低CO2浓度条件下蓝藻更具竞争力,蓝藻的生长可改变水体pH值,形成有利于其生长的碱性水环境,加剧水华的暴发[10]。水体氧化还原电位同样可以对蓝藻生长及水华暴发产生间接或直接的影响[37-38]。光照强度较低时,蓝藻群体内部形成低氧化还原电位的微环境,利于蓝藻群体的生长[39]。
2 蓝藻浮力调节机制及影响因子蓝藻的浮力调节机制通常包括气囊的合成与破裂,细胞镇重物的合成与分解[40]。后续研究表明实验室内部单细胞蓝藻光合作用产生的氧气泡及野外蓝藻群体内部细胞间隙同样可以影响蓝藻浮力[22-24]。
2.1 气囊的调节作用 2.1.1 气囊的结构德国微生物学家Klebahn于1895年利用光学显微镜在形成水华的蓝藻细胞中发现了一种含气体并可为蓝藻提供浮力的气囊。这种气囊具有明显的折光性,在显微镜下偏红色。通过一系列的实验证实该气囊中含有气体,可为藻细胞提供浮力[41]。1965年,Bowen和Jensen运用超薄切片技术研究5种蓝藻的气囊,发现这些气囊是由众多圆柱形的囊泡叠加而成,并将其命名为气囊[42]。气囊是由蛋白质组成的一个中空结构物,其形态通常为圆柱型管状,两端为圆锥形尖端,微囊藻气囊电镜图见图 1。气囊的大小在不同生物体内存在差异,在蓝藻细胞中气囊直径大致相同,约为75 nm,壁厚约为2 nm,长度差异较大,从几十纳米到几百纳米不等,最长可超过800 nm[43]。气囊存在于多种细菌群及浮游植物体内用以调节浮力,迄今为止已经在超过150种生物体中发现了气囊,涉及5个细菌门及2个古生菌门,包括蓝藻(包括原绿藻)、紫色细菌(变形菌)的α和γ分支、绿色硫细菌、革兰氏阳性菌及浮霉菌,古生菌包括甲烷八叠球菌属及盐杆菌属。气囊的胞壁疏水,当外界压力条件达到一定阈值时气囊会发生破裂,导致浮力散失。原核生物可通过调节气囊含量调节浮力,使其在水体中进行垂直运动,在一些生物体内,这些浮力调节机制比鞭毛运动更加有效[44]。
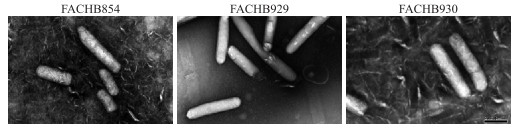
|
图 1 微囊藻FACHB854、FACHB929、FACHB930中气囊电镜图[45] Fig.1 Electronic microscopy photographs of gas vesicles from Microcystis FACHB854, FACHB929, FACHB930[45] |
气囊的最大宽度通常由细胞膨压与水深决定,其宽度由基因及构成蛋白质的氨基酸序列决定。气囊圆柱体的直径(d)可通过测量电镜图上坍塌气囊的宽度(w)由公式d=2w/π计算得出。其临界压力与平均直径呈负相关,与长度相关性较小[46]。根据工程学原理,直径较小的气囊具有更强的临界压力,但它们的体积较小所能提供的浮力也相对较小,4种蓝藻气囊长度及宽度见表 1。同时,气囊临界压力还与温度、pH、盐度等相关。由最早对嗜盐菌气囊的成分分析可知,蛋白质是气囊的组成成分。后期由长孢藻(Dolichospermum)及微囊藻的研究表明,蛋白质是组成气囊的唯一成分。运用分子标记技术分析气囊中磷酸盐含量发现其可以忽略不计,这些结果均说明其组成成分与一般的生物膜组成成分不同[47]。前期研究认为气囊只含有一种蛋白统称为气囊蛋白(GVP),后期结果表明疏水性强的蛋白质被称为GvpA蛋白,其分子量为7.5 kDa,它是构成气囊骨架的一种小型疏水蛋白质。气囊90 % 以上蛋白质由GvpA构成,另一种蛋白为GvpC蛋白,其分子量约为22 kDa,是组成气囊的次要成分,另外气囊还含有少量其他的结构蛋白,作用各不相同(表 2)。GvpA蛋白质分子构成了气囊的骨架,GvpC蛋白结合在气囊骨架上,使得气囊变得更加坚固,可以抵抗更大的压力[48]。
| 表 1 不同蓝藻气囊大小及基因簇结构[45] Tab. 1 Gas vesicle size and gene cluster structure of different cyanobacteria[45] |
气囊的分子生物学研究是从研究其组成蛋白开始的。通过对长孢藻的气囊进行氨基酸测序发现了一段拥有70个氨基酸残基的序列即GvpA蛋白,它具有很强的疏水性且保守性很强,在不同的蓝藻中具有很高的相似性。研究发现7~8个GvpA蛋白分子可通过肽键连成β-链,相邻β-链再以氢键相连,多条β-链以β转角的方式相连接形成反平行的β折叠,构成GvpA骨架[50]。研究人员在所有可形成气囊的藻种中均发现了gvpA基因,但不同藻体中所含的gvpA拷贝数不同,在长孢藻中检测到了7个拷贝数而在铜绿微囊藻(Microcystis aeruginosa)中仅检测到了3个拷贝数[51]。Walsby发现当GvpA蛋白超过细胞总蛋白的5 % 时,才可为蓝藻细胞提供足够的浮力。当气囊含量不够多时,则仅能降低藻细胞密度及藻细胞沉降速率,并不能使其浮起来[32]。
GvpC蛋白是气囊的另一重要组成蛋白,由gvpC基因编码而成。GvpC蛋白的亲水性高于GvpA蛋白,不同来源的GvpC的同源性远远小于GvpA蛋白质。研究表明绝大多数蓝藻中均只含有1个gvpC基因,只编码1种GvpC蛋白,但红色浮丝藻(Planktothrix rubescens)中的gvpC基因不只1个。GvpC蛋白由33个氨基酸残基组成,首先在眉藻属(Calothrix)中发现。不同蓝藻GvpC蛋白的差异主要表现为重复单位数量的差异,眉藻中重复了4次而在长孢藻中则重复了5次[27]。GvpC蛋白的功能主要为增强气囊骨架强度,去除了GvpC蛋白的气囊更容易塌陷,而重新装上GvpC蛋白的气囊可以恢复到先前的状态。气囊强度与GvpC蛋白重复单位数量关系密切,含有不同长度gvpC基因的藻种其气囊的直径与强度也不同。研究表明GvpC蛋白重复单位数量决定着气囊的直径,并与GvpA蛋白形成的骨架结构相互作用[52]。
在蓝藻中,最初只发现了gvpA、gvpC基因参与气囊的形成。随后对嗜盐古生菌的研究发现,共有14个基因参与了气囊的合成,且它们在基因排列上形成基因簇[53]。图 2与表 1显示了微囊藻FACHB854、FACHB929、FACHB930、FACHB910的基因簇,微囊藻气囊基因簇结构可归为4种类型分别为2gvpA+gvpC(3)、2gvpA+gvpC(4)、3gvpA+gvpC(4)、4gvpA+gvpC(3)。gvpA的数量表示gvpA的拷贝数,gvpC后括号的数字表示gvpC中重复单位数量[45]。常见蓝藻的气囊基因簇结构如表 3所示,可见大多数藻类的气囊基因簇只包含1个gvpC基因,通常位于串联多拷贝gvpA基因的下游。研究表明gvpC基因与气囊直径有关,gvpC基因越长,气囊直径越大,其能承受的压力越小[54]。gvpA、gvpF、gvpG、gvpJ、gvpL和gvpM几乎在所有产气囊的微生物中均存在,由此可推测它们属于合成气囊的必需基因,且对应编码的蛋白各有不同的作用(表 2)[55]。同时研究还表明gvpA基因的表达受光照、水体pH值以及营养盐浓度的影响,微囊藻气囊的产量随pH值的增大而增大,gvpA基因的表达受众多环境因子的调控[56-57]。
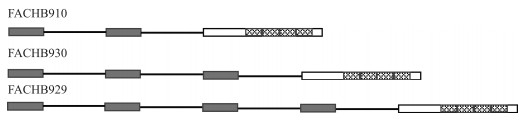
|
图 2 不同微囊藻gvpA-gvpC区域的3种结构类型 (灰色方块为gvpA基因,带菱形方格方块为gvpC基因内的保守重复序列,白色方块为gvpC基因的其他部分(依次为FACHB910、FACHB930、FACHB929)[45]) Fig.2 Three structural types of the gvpA-gvpC regions from different Microcystis strains (Gray boxes stand for gvpA genes; Hatched boxes stand for the conserved repeating units within gvpC gene; white boxes stand for other parts of gvpC (FACHB910, FACHB930, FACHB929, in order)[45]) |
气囊外壁比较坚硬,在低的压力下不会发生形变,但是一旦处于临界压力下,它们即可发生不可逆的破裂与塌陷。在自然水体中,水体中游离的气囊受大气压强(Pf)、上方水体压强(Ph)以及气囊内部气体压强(Pg)的作用。而细胞内的气囊承受的压力则包括细胞膨压(Pt)、Pf、Ph以及Pg。液体静态压随水体深度增加的速度通常为0.01 MPa/m,细胞临界膨压由嗜盐蓝藻的0.1 MPa到淡水蓝藻的0.55 MPa不等。在游离和完整细胞两种状态下,气囊所能承受的净压强(Pn)可由以下公式计算得出:Pn=Ph+Pf-Pg(游离状态),Pn=Ph+Pf+Pt-Pg(完整细胞状态)[59]。
气囊在受到较小压力时,体积变化较小,但当外界压力达到某个阈值时,气囊则会坍塌破裂。引发气囊坍塌的内外压力差的最小值被称为临界压力(Pc)。对于不同藻种而言,临界压力各不相同。通过对长孢藻、微囊藻、水华束丝藻(Aphanizomenon flos-aquae)的研究发现,蓝藻气囊的临界压力与平均半径呈负相关,与气囊的长度相关性较小[60]。深海藻类的气囊通常较窄,深水藻类气囊抗压能力高于浅水藻类。淡水蓝藻中临界压力通常在(0.2~0.4)MPa之间,而深海蓝藻气囊平均临界压力可达3.5 MPa,甚至更高[61]。Walsby研究了波罗的海中蓝藻气囊的临界压力,发现水华束丝藻气囊的临界压力为0.91 MPa,生长在深海的节球藻属(Nodularia)的临界压力为0.83 MPa,生长在浅海岸带的节球藻属的临界压力仅有0.34 MPa。而这些藻类均具有很强的浮力调节能力,水华束丝藻每天可浮动约22 m,节球藻属每天可浮动约36 m。气囊的临界压力与很多因素有关,如温度、光照、pH和盐度等,其中最重要的为细胞膨压,当膨压上升到一定阈值时气囊即会发生坍塌[53]。
2.1.4 气囊的浮力调节机制蓝藻细胞的主要组成成分包括糖类、蛋白质、核酸以及糖脂,其密度均大于水,这些物质的积累可促使细胞下沉。气囊密度小于水,当其体积达到细胞体积的3 % ~10 % 时即可为细胞提供浮力。气囊参与浮力调节主要包括气囊的合成与破裂[62]。
气囊的合成主要在分子与生理2个水平上进行,分子水平主要依靠基因调控,生理水平主要依靠光能及营养物如碳、氮、磷的供给实现对气囊合成的调节。光不仅可以为气囊的合成提供能量,而且可以作为合成气囊的环境信号。研究表明当外界光照强度增大时,假鱼腥藻(Pseudoanabaena)的gvpA基因停止表达,当光强降低时,则会恢复表达。同时,光照可影响藻细胞光合作用所得能量的大小从而影响其浮力调节。低光强条件下,藻细胞中气囊生成量增大使得藻密度小于水体密度形成上浮。而在高光强条件下,由于细胞镇重物的生成及细胞膨压的上升,使得气囊塌陷破裂导致浮力下降[63]。
Walsby等证明了高光强条件下藻细胞浮力散失的主要原因为气囊破裂,但是也不尽然。在某些藻细胞中,高光强条件下气囊停止生成及细胞镇重物的增加才是导致其浮力丧失的原因[32]。两种机制使得藻类在不同光照强度下可调节自身浮力,高光强条件下浮力散失下沉,一旦光照减弱,蓝藻则可恢复浮力上浮至水面重新获得适宜的光照条件[64]。营养条件也可影响气囊的生成,当氮磷营养物充足时,藻细胞可合成足以为其提供浮力的气囊。磷限制条件下,细胞内气囊含量下降,但仍可合成足够的气囊提供浮力。而氮限制则会严重影响蛋白质生成进而抑制气囊的合成,降低细胞浮力[65]。同时,氮磷限制还可引发藻细胞内的糖积累及细胞膨压的增大,降低藻细胞浮力。当细胞具有足够的气囊以及用于合成气囊的能量时,短暂的碳限制可降低藻细胞内的糖含量,增加细胞的浮力,但持续的碳限制则会抑制气囊的生成,导致细胞浮力的下降[66]。
2.2 细胞镇重物的浮力调节细胞镇重物的主要成分包括细胞内糖类(约1550 kg/m3)、蛋白质(约1330 kg/m3)、糖脂(约1050 kg/m3)以及核酸(约1550 kg/m3),其密度均大于水(998 kg/m3,20℃)。细胞镇重物的生成与积累可抵消气囊所产生的浮力,是蓝藻除气囊以外的另一重要浮力调节机制[58]。低光强条件下,藻体中的糖类物质通过呼吸作用被消耗或被转化为密度较低的蛋白质,此时细胞镇重物含量及细胞密度下降,引发藻体上浮获得充足的阳光。高光强条件下,蓝藻光合作用增强,多余的光合产物以淀粉形式累积,糖类占细胞干重的比例大幅增加,最终导致细胞镇重物及藻体密度的增大。当蓝藻细胞内没有新的气囊合成或当气囊所提供的浮力不足以抵消镇重物的积累时,蓝藻则会下沉[67]。
影响蓝藻胞内细胞镇重物含量的因素包括光照、温度、营养元素等。通过研究夏季湖泊中蓝藻的垂直迁移发现,蓝藻细胞中镇重物白天增加夜晚下降。白天藻类光合作用形成糖类增加藻细胞密度使其下沉,夜晚藻类呼吸作用消耗糖类降低细胞密度使其上浮,最终蓝藻可达到浮力平衡在水体中呈现漂浮状态。通过浮力调节蓝藻可完成昼夜垂直迁移,获取最佳的光照及营养条件[68]。Huang等研究了遮光与扰动对微囊藻密度及蓝藻浮力的影响,结果表明遮光叠加扰动条件下蓝藻生物量下降最大。低光条件下细胞镇重物含量下降,藻密度下降,浮力上升。除了生长率的下降,蓝藻自身的沉降作用也是导致生物量下降的重要原因[69]。
微囊藻细胞中气囊以及蛋白质含量随温度变化较小,但糖类含量随温度变化较大。当温度低于20℃时,细胞内即出现明显的糖累积,72 h内糖类含量可增加两倍。通过对气囊、蛋白质及糖类含量的研究发现低温条件下蓝藻浮力下降的主要原因之一是糖类的大量积累。糖类的积累还可增加细胞膨压,加速气囊的破裂,进一步降低蓝藻细胞的浮力。You的研究结果表明28℃时微囊藻的上浮速率为17.8℃时的5倍。高温条件下由糖类生成的蛋白质及脂类含量增大,藻细胞呼吸作用增强,蓝藻群体密度下降,浮力上升。低温条件下糖类合成蛋白质及脂类的速率下降,呼吸作用减弱,糖类积累增多,群体密度增大,浮力下降,加速蓝藻群体的下沉,这也是秋冬季节气温下降后蓝藻水华现象加速消失的重要原因之一[70]。
营养状态也可影响蓝藻细胞中气囊、细胞镇重物的含量。蓝藻短期昼夜浮力调节因子主要为光,其调节机制主要为糖的生成与消耗。长期调节因子则为细胞的营养状态,其调节作用主要依靠气囊的合成及由细胞分裂所致的气囊稀释来完成。在氮限制水体中,蓝藻浮力易于消失,而在磷限制水体中,其浮力可持续较长时间[64]。氮限制可抑制微囊藻的增殖,夏末或秋冬季节水华的显著减少被认为与水体中氮的耗竭有关,氮元素的减少也被认为是蓝藻水华暴发后反硝化作用的结果[10]。Huang的研究表明氮限制可促进藻细胞内部糖类的积累,进而影响微囊藻的比密度及下沉速率。一个光/暗循环后,碳水化合物消耗的减少可导致短时间内碳水化合物快速积累并导致藻密度的增大,细胞下沉。氮限制下,藻细胞比密度由1.060增加至1.068,与此同时低光照并不能降低藻细胞内部碳水化合物的含量,下沉的细胞不能重新获得浮力。水华暴发后期氮浓度减少导致藻细胞密度的增加,下沉速率增大是秋冬季节水华加速消失的另一重要原因[71]。Huang通过研究氮限制对野外蓝藻浮力的影响,结果表明氮的获取率与藻细胞的下沉速率呈反比,氮限制在增加藻细胞内细胞镇重物的含量的同时可减少气囊的生成。由氮缺乏引发的碳水化合物的积累是由于分解代谢消耗的减缓,特别是糖酵解作用的下降所导致的。氮限制可加速野外蓝藻群体细胞的下沉,尤其是在水华暴发后期,低温叠加水体氮浓度的下降可加速蓝藻的下沉及水华的消失[72]。沉降至水底的蓝藻可作为反硝化作用的碳源,促进水华水体中氮元素的去除[73]。
同时,氮获取率可显著影响微囊藻的耐盐性。Li的研究表明氮限制条件下,藻细胞内部细胞镇重物及胞外多糖分泌增加,可显著提升蓝藻对盐浓度的耐受能力。高氮利用率条件下采集的微囊藻与低氮利用率条件下采集的微囊藻的耐盐性分别为4.5 ‰和11.3 ‰,野外微囊藻群体的耐盐性可高达17.4 ‰。低氮条件下蔗糖、海藻糖及葡萄糖的含量是高氮条件下的2、2及31倍,低氮利用率下糖类的积累可减轻盐胁迫对微囊藻细胞的损伤,提高微囊藻的耐盐性。这也是过去二十年里,微囊藻在微咸水域生长、繁殖的频率、强度及分布趋于上升的原因[74]。一般的藻类不可同时进行固氮及光合作用,但Held的研究表明束毛藻(Trichodesmium)通过光合作用蛋白PsaC带电的可溶性铁还原蛋白直接向氮化酶提供能量,最大限度的降低了对与糖原相关的镇重物的需求,从而降低了细胞密度及下沉速率,促使束毛藻可以漂浮在水体表面同时进行固氮及光合作用,这是束毛藻特殊的调节机制。蓝藻或其它藻类是否存在同样的调节机制仍需进一步研究[75]。
细胞镇重物的增加可导致细胞膨压的升高,最终导致气囊的破裂及浮力的下降。浮力调节的3种机制包括气囊的生成破裂与细胞镇重物调节之间谁占优势取决于细胞膨压变化以及气囊的强度。不同浮力调节机制存在时间差异,气囊破裂可导致浮力迅速丧失,但气囊合成恢复浮力的过程较缓慢。而细胞镇重物的调节机制则反应迅速,可在短时间内对外界环境做出反应,藻细胞的浮力是各机制“博弈”的结果。
2.3 氧气泡对单细胞蓝藻的浮力调节Bradshaw等认为有孔虫细胞质中所含的共生体在光照条件下可产生大量氧气,所形成的氧气泡可增加有孔虫的浮力,使其上浮至水体表面。光照条件下,蓝藻光合作用同样产生大量氧气泡[76]。Dervaux等以单细胞微囊藻PCC7005、PCC7806以及PCC6803为研究对象,在实验室内部模拟了水华暴发的过程。结果发现在适当的营养及光强条件下,藻细胞光合作用产生大量氧气泡,这些氧气泡被困在EPS内不断生长,直至它们的浮力将藻细胞拉升至水体表面形成水华(图 3)。通过超声处理气囊破裂的藻细胞丧失浮力,但在藻液中添加BG-11培养基后藻细胞重新获得了浮力,光照条件下于5 h后在试管表面形成了水华。由此可见,伪空胞并非蓝藻重新获得浮力的原因,光照条件下产生的大量氧气泡则是使得蓝藻重新获得浮力形成水华的真正原因[21]。但这一研究仅针对实验室内部单细胞蓝藻的浮力调节,对于野外蓝藻群体是否存在同样的浮力调节机制仍待研究。

|
图 3 试管中由单细胞蓝藻模拟的水华 (左图为上层水华的近图,可见大量气泡生成;右图为被困于胞外多糖内部的上升气泡,箭头为气泡运动的方向[21]) Fig.3 M. aeruginosa bloom in a test tube (Close up view of the topmost foamy layer, abundant oxygen bubbles are observed (left); Trail of dense biomass around rising bubbles. The arrow indicates the direction of bubble migration (right)[21]) |
微囊藻是构成太湖蓝藻水华的主要物种,在野外通常以多细胞群体状态存在。通过显微观察可知,野外微囊藻群体内部存在大量细胞间隙并在细胞间隙中形成微环境(图 4)。除去气囊及细胞镇重物,野外蓝藻群体内部形成的细胞间隙及微环境也是影响其浮力的重要因素。目前已经开展了针对野外单个蓝藻群体浮力的相关研究,单个野外蓝藻群体的密度、体积、上浮速率的计算以及气囊、细胞镇重物、细胞间隙内部气体各自的贡献是研究的关键所在。Li等运用Stokes定律计算得出单个蓝藻群体的上浮速率,发现单个蓝藻群体上浮速率与群体大小呈正相关。太湖不同季节水华优势物种不同,且成为优势物种的原因不同。5-7月鱼害微囊藻(M. ichthyoblabe)成为水华优势物种的原因是其密度小上浮至水面导致,8-10月惠氏微囊藻(M. wesenbergii)和铜绿微囊藻(M. aeruginosa)成为水华优势物种则是由于颗粒较大产生的浮力较大导致[77]。You等通过数字内联全息显微镜对野外蓝藻群体的上浮速率进行跟踪拍摄,通过群体移动距离计算出群体的上浮速率,同时通过模型采用群体上浮速率及群体体积计算得出单个群体的密度[70]。
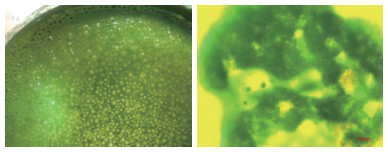
|
图 4 光照条件下蓝藻水华水体表面形成大量气泡(左)和微囊藻群体内部细胞间隙(右)[23] Fig.4 Bubbles formed at the cyanobacterial bloom surface under saturated light (left)and intercellular space in cyanobacterial colonies (right)[23] |
张永生等通过测定蓝藻水华群体胞外多糖含量以及运用外界压力破除水华群体细胞间空隙的方法,比较了细胞间空隙破除前后蓝藻水华群体气囊含量及上浮能力的变化。研究发现经过外界压力处理后的蓝藻群体内部的细胞间空隙消失的同时蓝藻细胞内气囊破裂,蓝藻浮力消失。采用超声波处理后的蓝藻群体被打散为单细胞悬液且细胞内气囊完整,成均匀的悬浊状。只有未经处理同时具有细胞间空隙及气囊的野外藻华群体可以浮至水体表面形成水华。气囊可以为蓝藻提供浮力,但其仅能使蓝藻悬浮在水中而不能浮至水体表面,而细胞间空隙才是藻华群体上浮至水面形成水华的主要浮力提供者[78]。张永生采用带密闭气压缸的装置破裂野外蓝藻气囊及群体细胞间隙,分别测定超声后单细胞中气囊及群体蓝藻细胞间隙中气体含量,运用此装置可得出气囊及细胞间隙体积,并可通过计算得出气囊及群体细胞间隙对野外蓝藻群体上浮的贡献。但野外群体细胞间隙中气体组成及外界环境因子对细胞间隙内部气体产量的影响仍不得而知[79]。
研究野外蓝藻群体细胞间隙中微环境及其对外界环境因子的响应对于从微观层面了解蓝藻成为水华优势种及蓝藻水华暴发机理具有重要意义,但目前的研究还很匮乏。微电极作为一种有效的工具已经广泛应用于各种环境样品的测定[80-86]。为了解野外蓝藻群体细胞间隙中的气体组成,于夏季太湖采集野外蓝藻水华水样,选取较大的蓝藻群体(直径1~2 mm),通过显微观察可知所采集的蓝藻群体由微囊藻属构成。通过研究环境因子对野外微囊藻群体内部微环境理化性质的影响,结果表明微囊藻群体微环境中理化性质随外界环境因子的变化迅速变化。蓝藻群体细胞间隙中溶氧浓度随光照强度的增大迅速增大,并在几秒钟内达到稳定状态。黑暗条件下则相反,溶氧浓度迅速下降至稳定状态。光照条件下,溶氧浓度随外界光照强度的增大迅速增大并在群体内部产生大量氧气(图 5)。当微囊藻群体内部细胞间隙中氧气达到饱和时,大量氧气充斥在细胞间隙中,可为群体提供额外浮力[22],这与单细胞蓝藻EPS中氧气泡提供的浮力机制一致。

|
图 5 梅梁湾水域水体表面的水华(左)和试验用微囊藻群体(右)[22] Fig.5 Cyanobacterial bloom in Meiliang Bay of Lake Taihu (left) and cyanobacterial colonies sampled from Lake Taihu for microelectrode measurement (right)[22] |
同时,野外微囊藻群体内部微环境理化性质受外界环境因子的影响,温度及光照是两大重要环境影响因子。低光照条件下,微囊藻群体细胞间隙中溶氧浓度随光照强度的增大而增大,当光照强度到达一定阈值时,溶氧浓度随光照强度的增大而减小,出现光抑制现象。光抑制现象可降低群体细胞间隙溶氧浓度进而降低群体的浮力,结合气囊及细胞镇重物可调节微囊藻群体浮力避免其受到强光伤害。温度同样可以影响群体细胞间隙溶氧浓度,实验表明25℃条件下群体细胞间隙产氧量最大,当温度上升至30℃时,群体细胞间隙溶氧浓度减小。高温高光强条件可降低微囊藻群体内部蓝藻产氧能力及细胞间隙中溶氧浓度,进而影响群体浮力[23]。结合其它浮力调节机制,最终蓝藻的浮力呈现是多方因子共同作用的结果。
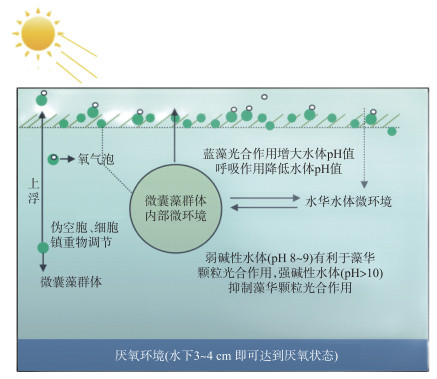
因此,当夏季蓝藻水华暴发时,蓝藻通过气囊及细胞镇重物调节浮力上升至水体表面获得充足的光照条件。光照条件下群体细胞间隙内溶氧浓度迅速上升,产生的氧气可充斥在群体内部细胞间隙中,多余的氧气可逸出群体内部形成氧气泡附着在群体表面,为蓝藻群体提供额外浮力使其漂浮在水体表面形成肉眼可见的水华。但随着时间的推移,水体表面高温高光强条件可降低群体细胞间隙溶氧浓度及其对群体浮力的贡献,结合其它浮力调节机制,蓝藻群体可下降至水体下层免受高温高光强的伤害。
群体内部pH、氧化还原电位同样随外界光照强度的增大而迅速变化,并在几秒钟达到稳定状态。群体内部理化性质的改变会进一步改变群体外部微环境的理化性质,进而影响群体内部蓝藻产氧量。群体内外理化性质相互影响,相互作用,直至达到动态平衡,形成最有利于微囊藻群体内部蓝藻产氧能力的内外微环境。群体内部细胞间隙中溶氧浓度受多种因素的影响,包括外界光照强度、水体温度、群体外部水体溶氧浓度以及群体自身因素如群体大小密度等,众多外界环境因素决定了群体内部细胞间隙中的溶氧浓度及其浮力大小[22-23]。
由图 6可见,当处在光照强度较弱的水面以下时,蓝藻可通过气囊及细胞镇重物的调节作用增大其浮力,使其上浮至光照强度较强的水体表面附近。随后,微囊藻群体细胞间隙溶氧浓度随着光照强度的增大而迅速增大,可为其提供额外浮力使其上升至水体表面形成肉眼可见的水华。同时群体内外形成有利于蓝藻生长的碱性微环境,进一步影响群体内部细胞间隙中的溶氧浓度及群体浮力。气囊的生成与破裂、细胞镇重物的合成与分解、受外界环境因子及群体内外微环境理化性质影响的胞内间隙中的氧气含量共同决定着蓝藻群体浮力的大小。
|
图 6 蓝藻群体细胞间隙微环境与外部水体微环境间相互作用关系图[23] Fig.6 The interaction between microenvironment in cyanobacterial colonies and the external water microenvironment of the colonies[23] |
通过采集野外水华的水体,测试不同深度水华水体的溶氧浓度,结果表明在距离水华水体下方3~4 cm处即可形成厌氧环境。在野外水华暴发时水下形成的厌氧环境结合风浪条件易于形成“黑水团”和“湖泛”[87-89]。湖泊中很多水华蓝藻质量密度小于水,大多表现为正向浮力,昼夜垂向运动不明显,受风浪和水动力影响更大。高温、微风可加剧蓝藻的上浮以及蓝藻水华的暴发,太湖的地理、水文、气象特征为蓝藻水华暴发提供了适宜的温度及水动力条件。在研究蓝藻浮力及蓝藻水华形成原因时,应结合野外水文及气象因素综合考虑各方面因素的影响[90]。
3 总结与展望蓝藻水华暴发包括休眠、复苏、大量增长及上浮聚集在水面形成肉眼可见水华4个阶段,是一个逐步的过程而非突发事件。引发蓝藻水华的因素众多,既包括蓝藻生长特性的内因,也包括湖泊气候、地理、水文等外因[91]。蓝藻耐高温高光强,所含藻蓝素可以使其在低光强下生长,野外风浪搅动可促进野外蓝藻的聚集生长,形成的群体状态可使蓝藻具备更大的生存优势[92-94]。蓝藻的浮力调节机制是其重要的生长机制之一,在蓝藻水华形成过程的几个阶段如春季复苏及夏季大量增长及最终上浮至水体表面形成肉眼可见水华阶段均具有重要作用。
蓝藻浮力调节机制主要包括气囊的合成与裂解及细胞镇重物的合成与分解。光照、温度、氮磷浓度、盐度等因素均可影响蓝藻胞内细胞镇重物含量,进而影响浮力。单细胞蓝藻光合作用产生的大量困于EPS的氧气泡可促使蓝藻浮至水面形成水华。野外蓝藻群体内部细胞间隙是影响其浮力的重要因素,光照条件下细胞间隙内部产生的大量氧气同样可为其提供额外浮力。群体内外微环境相互作用并影响群体内部细胞间隙中氧气含量及群体浮力,野外蓝藻群体内部形成的微环境是影响其浮力的重要原因(表 4)。
| 表 4 不同环境因子对各浮力调节因子的影响 Tab. 4 Influence of different environmental factors on buoyancy regulation factors |
研究蓝藻群体内外微环境理化性质及其对外界环境的响应可以从微观层面上探索蓝藻成为水华优势物种并最终导致蓝藻水华暴发的微生态机制。通过测定发现光照条件下野外蓝藻群体间隙中溶氧浓度最高可高于1000 μmol/L。基于此,证实了光照条件下群体内部细胞间隙中存在溶氧并可为其提供额外浮力的猜想。同时,单个蓝藻群体的上浮速率及细胞间隙中气体对其浮力所做贡献的权重同样是解决野外蓝藻群体上浮的关键问题。未来可结合各方面技术对相关问题进行进一步的探索,更定量地分析气囊、细胞镇重物及蓝藻群体内部细胞间隙产氧量各浮力调节因子对浮力所做出的贡献。同时结合野外水力学或天气等因素系统评判各环境因子对野外蓝藻群体浮力及水华暴发的影响,为科学了解及防治蓝藻水华提供新思路。
| [1] |
Wu QL, Xie P, Yang LY et al. Ecological consequences of cyanobacetrial blooms in lakes and their countermeasures. Advances in Earth Science, 2008, 23(11): 1115-1123. [吴庆龙, 谢平, 杨柳燕等. 湖泊蓝藻水华生态灾害形成机理及防治的基础研究. 地球科学进展, 2008, 23(11): 1115-1123. DOI:10.3321/j.issn:1001-8166.2008.11.001] |
| [2] |
Zhu GW, Qin BQ, Zhang YL et al. Variation and driving factors of nutrients and chlorophyll-a concentrations in northern region of Lake Taihu, China, 2005-2017. J Lake Sci, 2018, 30(2): 279-295. [朱广伟, 秦伯强, 张运林等. 2005-2017年北部太湖水体叶绿素a和营养盐变化及影响因素. 湖泊科学, 2018, 30(2): 279-295. DOI:10.18307/2018.0201] |
| [3] |
Paerl HW, Hall NS, Calandrino ES. Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Science of the Total Environment, 2011, 409(10): 1739-1745. DOI:10.1016/j.scitotenv.2011.02.001 |
| [4] |
Li W, Qin BQ, Zhu GW. Forecasting short-term cyanobacterial blooms in Lake Taihu, China, using a coupled hydrodynamic-algal biomass model. Ecohydrology, 2014, 7(2): 794-802. DOI:10.1002/eco.1402 |
| [5] |
谢平. 翻阅巢湖的历史: 蓝藻、富营养化及地质演化. 北京: 科学出版社, 2009.
|
| [6] |
Paerl HW. Mitigating harmful cyanobacterial blooms in a human- and climatically-impacted world. Life: Basel, Switzerland, 2014, 4(4): 988-1012. DOI:10.3390/life4040988 |
| [7] |
Qin BQ, Wang XD, Tang XM et al. Drinking water crisis caused by eutrophication and cyanobacterial bloom in Lake Taihu: Cause and measurement. Advances in Earth Science, 2007, 22(9): 896-906. [秦伯强, 王小冬, 汤祥明等. 太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策. 地球科学进展, 2007, 22(9): 896-906. DOI:10.3321/j.issn:1001-8166.2007.09.003] |
| [8] |
Shi XL, Yang JS, Chen KN et al. Review on the control and mitigation strategies of lake cyanobacterial blooms. J Lake Sci, 2022, 34(2): 349-375. [史小丽, 杨瑾晟, 陈开宁等. 湖泊蓝藻水华防控方法综述. 湖泊科学, 2022, 34(2): 349-375. DOI:10.18307/2022.0201] |
| [9] |
Shan K, Song LR, Chen W et al. Analysis of environmental drivers influencing interspecific variations and associations among bloom-forming cyanobacteria in large, shallow eutrophic lakes. Harmful Algae, 2019, 84: 84-94. DOI:10.1016/j.hal.2019.02.002 |
| [10] |
Wu J, Kong Q, Yang LY et al. Effect of the growth of Microcystis aeruginosa on the pH value and the nitrogen transformation in the medium. J Lake Sci, 2009, 21(1): 123-127. [吴剑, 孔倩, 杨柳燕等. 铜绿微囊藻生长对培养液pH值和氮转化的影响. 湖泊科学, 2009, 21(1): 123-127. DOI:10.18307/2009.0116] |
| [11] |
Zhu GW, Shi K, Li W et al. Seasonal forecast method of cyanobacterial bloom intensity in eutrophic Lake Taihu, China. J Lake Sci, 2020, 32(5): 1421-1431. [朱广伟, 施坤, 李未等. 太湖蓝藻水华的年度情势预测方法探讨. 湖泊科学, 2020, 32(5): 1421-1431. DOI:10.18307/2020.0504] |
| [12] |
Lürling M, van Oosterhout F. Controlling eutrophication by combined bloom precipitation and sediment phosphorus inactivation. Water Research, 2013, 47(17): 6527-6537. DOI:10.1016/j.watres.2013.08.019 |
| [13] |
Qin B, Li W, Zhu G et al. Cyanobacterial bloom management through integrated monitoring and forecasting in large shallow eutrophic Lake Taihu (China). Journal of Hazardous Materials, 2015, 287: 356-363. DOI:10.1016/j.jhazmat.2015.01.047 |
| [14] |
Qin BQ. Shallow lake limnology and control of eutrophication in Lake Taihu. J Lake Sci, 2020, 32(5): 1229-1243. [秦伯强. 浅水湖泊湖沼学与太湖富营养化控制研究. 湖泊科学, 2020, 32(5): 1229-1243. DOI:10.18307/2020.0501] |
| [15] |
Zhang M, Shi XL, Yang Z et al. Characteristics and driving factors of the long-term shifts between Microcystis and Dolichospermum in Lake Taihu and Lake Chaohu. J Lake Sci, 2021, 33(4): 1051-1061. [张民, 史小丽, 阳振等. 太湖和巢湖中微囊藻(Microcystis)与长孢藻(Dolichospermum)的长时序变化及其驱动因子. 湖泊科学, 2021, 33(4): 1051-1061. DOI:10.18307/2021.0408] |
| [16] |
Berry MA, Davis TW, Cory RM et al. Cyanobacterial harmful algal blooms are a biological disturbance to Western Lake Erie bacterial communities. Environmental Microbiology, 2017, 19(3): 1149-1162. DOI:10.1111/1462-2920.13640 |
| [17] |
Zhang YN, Zhang YB, Li N et al. Capturing the rapid intra-day change of cyanobacteria bloom by land-based hyperspectral remote sensing in Lake Taihu. J Lake Sci, 2021, 33(6): 1951-1960. [张运林, 张毅博, 李娜等. 利用陆基高光谱遥感捕捉太湖蓝藻水华日内快速变化过程. 湖泊科学, 2021, 33(6): 1951-1960. DOI:10.18307/2021.0628] |
| [18] |
Zhu GW, Qin BQ, Zhang YL et al. Flucuation of phosphorus concentration in Lake Taihu in the past 70 years and future control strategy. J Lake Sci, 2021, 33(4): 957-973. [朱广伟, 秦伯强, 张运林等. 近70年来太湖水体磷浓度变化特征及未来控制策略. 湖泊科学, 2021, 33(4): 957-973. DOI:10.18307/2021.0401] |
| [19] |
Zhang YL, Qin BQ, Zhu GW. Long-term changes in physical environments and potential implications for the eco-environment of Lake Taihu in the past four decades. J Lake Sci, 2020, 32(5): 1348-1359. [张运林, 秦伯强, 朱广伟. 过去40年太湖剧烈的湖泊物理环境变化及其潜在生态环境意义. 湖泊科学, 2020, 32(5): 1348-1359. DOI:10.18307/2020.0503] |
| [20] |
Huang YX, Zhang XQ, Yang Y et al. Processes of nutrients release from particulate organic matter derived from cyanobacterial blooms in early stage by different microflora. Ecological Science, 2017, 36(5): 55-63. [黄亚新, 张小倩, 杨燕等. 水华初期蓝藻颗粒有机物在不同菌群作用下分解释放营养盐的过程研究. 生态科学, 2017, 36(5): 55-63.] |
| [21] |
Dervaux J, Mejean A, Brunet P. Irreversible collective migration of cyanobacteria in eutrophic conditions. PLoS One, 2015, 10(3): e0120906. DOI:10.1371/journal.pone.0120906 |
| [22] |
Fang F, Yang LY, Gan L et al. DO, pH, and Eh microprofiles in cyanobacterial granules from Lake Taihu under different environmental conditions. Journal of Applied Phycology, 2014, 26(4): 1689-1699. DOI:10.1007/s10811-013-0211-4 |
| [23] |
Fang F, Gao Y, Gan L et al. Effects of different initial pH and irradiance levels on cyanobacterial colonies from Lake Taihu, China. Journal of Applied Phycology, 2018, 30(3): 1777-1793. DOI:10.1007/s10811-018-1394-5 |
| [24] |
Kong FX, Gao G. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes. Acta Ecologica Sinica, 2005, 25(3): 589-595. [孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考. 生态学报, 2005, 25(3): 589-595. DOI:10.3321/j.issn:1000-0933.2005.03.028] |
| [25] |
Reynolds CS, Rogers DA. Seasonal variations in the vertical distribution and buoyancy of Microcystis aeruginosa. Hydrobiologia, 1976, 48(1): 17-23. DOI:10.1007/BF00033486 |
| [26] |
Walsby AE. The mechanical properties of the Microcystis gas vesicle. Journal of General Microbiology, 1991, 137(10): 2401-2408. DOI:10.1099/00221287-137-10-2401 |
| [27] |
Dunton PG, Walsby AE. The diameter and critical collapse pressure of gas vesicles in Microcystis are correlated with GvpCs of different length. FEMS Microbiology Letters, 2005, 247(1): 37-43. DOI:10.1016/j.femsle.2005.04.026 |
| [28] |
Reynolds CS, Walsby AE. Water-blooms. Biological Reviews, 1975, 50(4): 437-481. DOI:10.1111/j.1469-185X.1975.tb01060.x |
| [29] |
Ibelings BW. Changes in photosynthesis in response to combined irradiance and temperature stress in cyanobacterial surface waterblooms. Journal of Phycology, 1996, 32(4): 549-557. DOI:10.1111/j.0022-3646.1996.00549.x |
| [30] |
Tao Y, Kong FX, Cao HS et al. Simulative recruitment of Microcystis from the surface sediment in Taihu Lake. J Lake Sci, 2005, 17(3): 231-236. [陶益, 孔繁翔, 曹焕生等. 太湖底泥水华蓝藻复苏的模拟. 湖泊科学, 2005, 17(3): 231-236. DOI:10.18307/2005.0307] |
| [31] |
Wallace BB, Hamilton DP. The effect of variations in irradiance on buoyancy regulation in Microcystis aeruginosa. Limnology and Oceanography, 1999, 44(2): 273-281. DOI:10.4319/lo.1999.44.2.0273 |
| [32] |
Walsby AE, Hayes PK, Boje R et al. The selective advantage of buoyancy provided by gas vesicles for planktonic cyanobacteria in the Baltic Sea. New Phytologist, 1997, 136(3): 407-417. DOI:10.1046/j.1469-8137.1997.00754.x |
| [33] |
秦伯强, 杨柳燕, 陈非洲等. 湖泊富营养化发生机制与控制技术及其应用. 科学通报, 2006, 51(16): 1857-1866. DOI:10.1360/csb2006-51-16-1857 |
| [34] |
Yuan LN, Song W, Xiao L et al. The overall orthogonal design study of multifactor interaction on the growth of Microcystis aeruginosa in the presence of adnascent Pseudomonas sp. Journal of Nanjing University (Nature Science), 2008, 44(4): 408-414. [袁丽娜, 宋炜, 肖琳等. 多环境因素全面正交作用对铜绿微囊藻生长的效应研究. 南京大学学报: 自然科学版, 2008, 44(4): 408-414. DOI:10.3321/j.issn:0469-5097.2008.04.011] |
| [35] |
Chen XF, Jiang HY, Sun X et al. Nitrification and denitrification by algae-attached and free-living microorganisms during a cyanobacterial bloom in Lake Taihu, a shallow Eutrophic Lake in China. Biogeochemistry, 2016, 131(1): 135-146. DOI:10.1007/s10533-016-0271-z |
| [36] |
马增岭. 阳光辐射变化对经济蓝藻螺旋藻形态、光合作用及生长的影响[学位论文]. 广东: 汕头大学, 2008.
|
| [37] |
Zhang M, Kong FX, Shi XL et al. Responses of Microcystis aeruginosa to reducing oxidation reduction potential under competition growth condition. J Lake Sci, 2007, 19(2): 118-124. [张民, 孔繁翔, 史小丽等. 铜绿微囊藻在竞争生长条件下对氧化还原电位降低的响应. 湖泊科学, 2007, 19(2): 118-124. DOI:10.18307/2007.0202] |
| [38] |
Wang J, Zhou TY, Gao WC et al. Growth inhibition and recovery from low oxidation reduction potential to Microcystis aeruginosa. J Lake Sci, 2012, 24(4): 528-534. [王健, 周天艺, 高文程等. 低氧化还原电位对铜绿微囊藻(Microcystis aeruginosa)生长的抑制及恢复的影响. 湖泊科学, 2012, 24(4): 528-534. DOI:10.18307/2012.0404] |
| [39] |
Weller D, Doemel W, Brock TD. Requirement of low oxidation-reduction potential for photosynthesis in a blue-green alga (Phormidium sp.). Archives of Microbiology, 1975, 104(1): 7-13. DOI:10.1007/BF00447293 |
| [40] |
Jones JG, Young DCS. Structure and organization of the gas vesicle gene cluster on the Halobacterium halobium plasmid pNRC100. Gene, 1991, 102(1): 117-122. DOI:10.1016/0378-1119(91)90549-q |
| [41] |
Klebahn H. Gasvakuolen, ein bestandteil der zellen der wasserblu tebildende phycochromaceen. Flora(Jena), 1895, 20: 241-282. |
| [42] |
Bowen CC, Jensen TE. Blue-green algae: Fine structure of the gas vacuoles. Science: New York, 1965, 147(3664): 1460-1462. DOI:10.1126/science.147.3664.1460 |
| [43] |
Reynolds CS, Oliver RL, Walsby AE. Cyanobacterial dominance: The role of buoyancy regulation in dynamic lake environments. New Zealand Journal of Marine and Freshwater Research, 1987, 21(3): 379-390. DOI:10.1080/00288330.1987.9516234 |
| [44] |
Walsby AE, Mcallister GK. Buoyancy regulation by Microcystis in Lake Okaro. New Zealand Journal of Marine and Freshwater Research, 1987, 21(3): 521-524. DOI:10.1080/00288330.1987.9516249 |
| [45] |
许敏. 微囊藻气囊基因丛的研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2006.
|
| [46] |
Beard SJ, Handley BA, Hayes PK et al. The diversity of gas vesicle genes in Planktothrix rubescens from Lake Zürich. Microbiology: Reading, England, 1999, 145(Pt 10): 2757-2768. DOI:10.1099/00221287-145-10-2757 |
| [47] |
Cheng HM, Qiu BS. Cyanobacterial gas vesicles and their regulation on the vertical distribution of cyanobacteria in water body. Plant Physiology Communications, 2006, 42(5): 974-980. |
| [48] |
Thomas RH, Walsby AE. Buoyancy regulation in a strain of Microcystis. Microbiology, 1985, 131(4): 799-809. DOI:10.1099/00221287-131-4-799 |
| [49] |
Zhang YS, Kong FX, Yu Y et al. The characteristics and buoyancy regulations of cyanobacterial gas vesicles. Acta Ecologica Sinica, 2010, 30(18): 5077-5090. [张永生, 孔繁翔, 于洋等. 蓝藻伪空胞的特性及浮力调节机制. 生态学报, 2010, 30(18): 5077-5090. DOI:10.3321/j.issn:0250-3301.2007.12.005] |
| [50] |
Villareal TA, Carpenter EJ. Buoyancy regulation and the potential for vertical migration in the oceanic Cyanobacterium Trichodesmium. Microbial Ecology, 2003, 45(1): 1-10. DOI:10.1007/s00248-002-1012-5 |
| [51] |
Zhang YS, Kong FX, Yu Y et al. Correlation analysis among characters of gas vesicle in Microcystis strains. Environmental Science, 2011, 32(8): 2273-2278. [张永生, 孔繁翔, 于洋等. 微囊藻气囊gvpA、gvpC与其物理性状之间相关性分析. 环境科学, 2011, 32(8): 2273-2278.] |
| [52] |
Lewis Oliver R. Floating and sinking in gas-vacuolate cyanobacteria1. Journal of Phycology, 1994, 30(2): 161-173. DOI:10.1111/j.0022-3646.1994.00161.x |
| [53] |
Walsby AE, Bleything A. The dimensions of cyanobacterial gas vesicles in relation to their efficiency in providing buoyancy and withstanding pressure. Microbiology, 1988, 134(10): 2635-2645. DOI:10.1099/00221287-134-10-2635 |
| [54] |
Jost M, Jones DD, Weathers PJ. Counting of gas vacuoles by electron microscopy in lysates and purified fractions of Microcystis aeruginosa. Protoplasma, 1971, 73(3): 329-335. DOI:10.1007/BF01273937 |
| [55] |
Kinsman R, Hayes PK. Genes encoding proteins homologous to halobacterial GvpS N, J, K, F&L are located downstream of gvpC in the Cyanobacterium Anabaena flos-aquae. DNA Sequence, 1997, 7: 97-106. DOI:10.3109/10425179709020156 |
| [56] |
Xu M, Xu XD, Gao H et al. High variability of the gvpA-gvpC region in Microcystis. Progress in Natural Science, 2007, 17(11): 1290-1295. DOI:10.2183/pjab/83.266 |
| [57] |
Gao H, Zhu T, Xu M et al. pH-dependent gas vesicle formation in Microcystis. FEBS Letters, 2016, 590(18): 3195-3201. DOI:10.1002/1873-3468.12370 |
| [58] |
Cheng HM, Qiu BS. Cyanobacterial gas vesicles and their regulation on the vertical distribution of cyanobacteria in water body. Plant Physiology Communications, 2006, 42(5): 974-980. [成慧敏, 邱保胜. 蓝藻的伪空泡及其对蓝藻在水体中垂直分布的调节. 植物生理学通讯, 2006, 42(5): 974-980.] |
| [59] |
Hayes PK, Walsby AE. An investigation into the recycling of gas vesicle protein derived from collapsed gas vesicles. Microbiology, 1984, 130(6): 1591-1596. DOI:10.1099/00221287-130-6-1591 |
| [60] |
Konopka AE, Staley JT, Lara JC. Gas vesicle assembly in Microcyclus aquaticus. Journal of Bacteriology, 1975, 122(3): 1301-1309. DOI:10.1128/jb.122.3.1301-1309.1975 |
| [61] |
Waaland JR, Branton D. Gas vacuole development in a blue-green alga. Science, 1969, 163(3873): 1339-1341. DOI:10.1126/science.163.3873.1339 |
| [62] |
Ibelings BW, Mur LR, Walsby AE. Diurnal changes in buoyancy and vertical distribution in populations of Microcystis in two shallow lakes. Journal of Plankton Research, 1991, 13(2): 419-436. DOI:10.1093/plankt/13.2.419 |
| [63] |
Hayes PK, Lazarus CM, Bees A et al. The protein encoded by gvpC is a minor component of gas vesicles isolated from the cyanobacteria Anabaena flos-aquae and Microcyctis sp. Molecular Microbiology, 1988, 2(5): 545-552. DOI:10.1111/j.1365-2958.1988.tb00062.x |
| [64] |
Chu ZS, Jin XC, Yang B et al. Buoyancy regulation of Microcystis flos-aquae during phosphorus-limited and nitrogen-limited growth. Journal of Plankton Research, 2007, 29(9): 739-745. DOI:10.1093/plankt/fbm054 |
| [65] |
Walsby AE, Ng G, Dunn C et al. Comparison of the depth where Planktothrix rubescens stratifies and the depth where the daily insolation supports its neutral buoyancy. New Phytologist, 2004, 162(1): 133-145. DOI:10.1111/j.1469-8137.2004.01020.x |
| [66] |
Brookes JD, Ganf GG, Green D et al. The influence of light and nutrients on buoyancy, filament aggregation and flotation of Anabaena circinalis. Journal of Plankton Research, 1999, 21(2): 327-341. DOI:10.1093/plankt/21.2.327 |
| [67] |
杨波. 蓝藻气囊的特征及其浮力对氮、磷和温度的响应机制研究[学位论文]. 长沙: 湖南农业大学, 2007.
|
| [68] |
Fu KZ, Moe B, Li X et al. Cyanobacterial bloom dynamics in Lake Taihu. Journal of Environmental Sciences: China, 2015, 32(6): 249-251. DOI:10.1016/j.jes.2015.04.003 |
| [69] |
Huang Y, Chen X, He S et al. Sinking loss should be taken into account while studying the dynamics of Microcystis under light-availability control. Journal of Hazardous Materials, 2016, 314: 270-276. DOI:10.1016/j.jhazmat.2016.04.062 |
| [70] |
You JQ, Mallery K, Hong JR et al. Temperature effects on growth and buoyancy of Microcystis aeruginosa. Journal of Plankton Research, 2018, 40(1): 16-28. DOI:10.1093/plankt/fbx059 |
| [71] |
Huang Y, Hong J, Liang C et al. Nitrogen limitation affects the sinking property of Microcystis by promoting carbohydrate accumulation. Chemosphere, 2019, 221: 665-671. DOI:10.1016/j.chemosphere.2019.01.080 |
| [72] |
Huang Y, Liu S, Shen Y et al. Nitrogen availability affects the dynamics of Microcystis blooms by regulating the downward transport of biomass. Harmful Algae, 2020, 93: 101796. DOI:10.1016/j.hal.2020.101796 |
| [73] |
Huang YY, Chen XC, Li PP et al. Pressurized Microcystis can help to remove nitrate from eutrophic water. Bioresource Technology, 2018, 248(Pt B): 140-145. DOI:10.1016/j.biortech.2017.07.015 |
| [74] |
Li L, Chen XC, Huang YY et al. The salt tolerance of the freshwater cyanobacterium Microcystis depends on nitrogen availability. Science of the Total Environment, 2021, 777: 146186. DOI:10.1016/j.scitotenv.2021.146186 |
| [75] |
Held NA, Waterbury JB, Webb EA et al. Dynamic diel proteome and daytime nitrogenase activity supports buoyancy in the cyanobacterium Trichodesmium. Nature Microbiology, 2022, 7(2): 300-311. DOI:10.1038/s41564-021-01028-1 |
| [76] |
Bradshaw JS. Ecology of living planktonic foraminifera in the north and equatorial Pacific Ocean. In: Contribution from the cushman foundation for foraminiferal research. Scripps Institution of Oceanography, La Jolla, California, 1959, 25-64. |
| [77] |
Li M, Zhu W, Guo LL et al. To increase size or decrease density? Different Microcystis species has different choice to form blooms. Scientific Reports, 2016, 6(1): 1-10. DOI:10.1038/srep37056 |
| [78] |
Zhang YS, Li HY, Kong FX. Role of colony intercellular space in the cyanobacteria bloom-forming. Environmental Science, 2011, 32(6): 1602-1607. [张永生, 李海英, 孔繁翔等. 群体细胞间空隙在微囊藻水华形成过程中的浮力调节作用. 环境科学, 2011, 32(6): 1602-1607.] |
| [79] |
张永生. 一种测定蓝藻气囊和群体细胞间空隙浮力贡献的方法, CN201510261148.5, 2015.
|
| [80] |
Dubinsky Z, Falkowski PG, Post AF et al. A system for measuring phytoplankton photosynthesis in a defined light field with an oxygen electrode. Journal of Plankton Research, 1987, 9(4): 607-612. DOI:10.1093/plankt/9.4.607 |
| [81] |
Jorgensen BB, Revsbech NP. Diffusive boundary layers and the oxygen uptake of sediments and detritus. Limnology and Oceanography, 1985, 30(1): 111-122. DOI:10.4319/lo.1985.30.1.0111 |
| [82] |
Jørgensen BB, Erez J, Revsbech P et al. Symbiotic photosynthesis in a planktonic foraminiferan, Globigerinoides sacculifer (Brady), studied with microelectrodes. Limnology and Oceanography, 1985, 30(6): 1253-1267. DOI:10.4319/lo.1985.30.6.1253 |
| [83] |
Revsbech NP, Jorgensen BB. Photosynthesis of benthic microflora measured with high spatial resolution by the oxygen microprofile method: Capabilities and limitations of the method. Limnology and Oceanography, 1983, 28(4): 749-756. DOI:10.4319/lo.1983.28.4.0749 |
| [84] |
Liu SY, Chen YP, Fang F et al. Innovative solid-state microelectrode for nitrite determination in a nitrifying granule. Environmental Science & Technology, 2008, 42(12): 4467-4471. DOI:10.1021/es800409s |
| [85] |
Chen YP, Liu SY, Fang F et al. Simultaneous determination of nitrate and dissolved oxygen under neutral conditions using a novel silver-deposited gold microelectrode. Environmental Science & Technology, 2008, 42(22): 8465-8470. DOI:10.1021/es8010157 |
| [86] |
Rink S, Kühl M, Bijma J et al. Microsensor studies of photosynthesis and respiration in the symbiotic foraminifer Orbulina universa. Marine Biology, 1998, 131(4): 583-595. DOI:10.1007/s002270050350 |
| [87] |
Xin HR, Zhu GW, Wang XS et al. Variation and driving factors of black water event intensity in Lake Taihu during 2009 to 2018. Environmental Science, 2020, 41(11): 4914-4923. [辛华荣, 朱广伟, 王雪松等. 2009-2018年太湖湖泛强度变化及其影响因素. 环境科学, 2020, 41(11): 4914-4923.] |
| [88] |
Wang CL, Zhang Y, Zhang NH et al. Analysis of meteorological factors of forming feculent and anaerobic water aggregation induced by algal bloom in Taihu Lake. Environmental Science, 2011, 32(2): 401-408. [王成林, 张咏, 张宁红等. 太湖藻源性"湖泛"形成机制的气象因素分析. 环境科学, 2011, 32(2): 401-408.] |
| [89] |
Li W, Qin BQ, Zhang YL et al. Numerical forecasting of short-term algae-induced black bloom in eutrophic shallow lake: A case study of Lake Taihu. J Lake Sci, 2016, 28(4): 701-709. [李未, 秦伯强, 张运林等. 富营养化浅水湖泊藻源性湖泛的短期数值预报方法——以太湖为例. 湖泊科学, 2016, 28(4): 701-709. DOI:10.18307/2016.0402] |
| [90] |
秦伯强, 胡维平, 陈伟民等. 太湖水环境演化过程与机理. 北京: 科学出版社, 2004.
|
| [91] |
Yang LY, Yang XY, Ren LM et al. Mechanism and control strategy of cyanobacterial bloom in Lake Taihu. J Lake Sci, 2019, 31(1): 18-27. [杨柳燕, 杨欣妍, 任丽曼等. 太湖蓝藻水华暴发机制与控制对策. 湖泊科学, 2019, 31(1): 18-27. DOI:10.18307/2019.0102] |
| [92] |
Rui Z, Yang GJ, Liu Y et al. Effects of disturbance modes on the size of Microcystis flos-aquae colonies. J Lake Sci, 2019, 31(2): 355-364. [芮政, 杨桂军, 刘玉等. 扰动方式对水华微囊藻(Microcystis flos-aquae)群体大小的影响. 湖泊科学, 2019, 31(2): 355-364. DOI:10.18307/2019.0205] |
| [93] |
阳振. 微囊藻群体形成的驱动因子研究[学位论文]. 北京: 中国科学院大学, 2010.
|
| [94] |
Han LH, Yang GJ, Liu Y et al. Effect of disturbance intensity on the growth and chlorophyll fluorescence of Microcystis flos-aquae colony in Lake Taihu. Research of Environmental Science, 2018, 31(2): 265-272. [韩丽华, 杨桂军, 刘玉等. 扰动强度对太湖水华微囊藻群体生长和叶绿素荧光的影响. 环境科学研究, 2018, 31(2): 265-272. DOI:10.13198/j.issn.1001-6929.2017.03.63] |
 2023, Vol. 35
2023, Vol. 35 

