(2: 江苏思源环境修复有限公司, 南通 226007)
(3: 中国科学院水生生物研究所, 武汉 430072)
(4: 复旦大学环境科学与工程系, 上海 200438)
(2: Jiangsu Siyuan Environmental Remediation & Restoration Co., Ltd., Nantong 226007, P.R.China)
(3: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P.R.China)
(4: Department of Environmental Science and Engineering, Fudan University, Shanghai 200438, P.R.China)
水体氮、磷营养盐过剩作为湖泊蓝藻水华暴发的根本原因在过去几十年中受到了广泛研究,其中磷一度被认为是蓝藻水华暴发的主要营养限制因子[1-3]。然而,近年来的研究显示,蓝藻更易受到氮的刺激而快速增殖。如在美国Erie湖、滇池等的调查研究发现,大气氮沉降作用和面源污染导致的水体可溶性氮增加对微囊藻(Microcystis)等非固N2蓝藻生长、水华形成与持续扩张有明显促进作用[4-10],且不同形态氮素对蓝藻生长及其竞争优势维持的影响存在明显差异[4, 6]。夏秋季节,以NH4+为主的水体中,蓝藻、甲藻和隐藻是主要类群;当水体氮素转变为以NO3-为主时,硅藻等真核藻类成为了主要优势种群[6]。在太湖和Okeechobee湖的研究也表明,微囊藻对NH4+有很强的同化能力,是水体中消耗NH4+的主要藻类。水体中NH4+在水体溶解性无机氮中的比例越大,越有利于蓝藻与其它藻类之间的竞争,蓝藻水华持续的时间也更长[6, 11]。
蓝藻虽是一种古老的光合生物,但却是所有光合生物中的佼佼者,比高等植物和绿藻有更高的光能转化效率和CO2固定效率。了解蓝藻的光合作用特征及其对不同形态氮素的同化机制,对深刻理解不同氮营养环境中蓝藻生长及其生理生态特性变化、揭示蓝藻水华的形成机理,具有重要意义。因此,本文就蓝藻光合作用的几个过程及其特征、蓝藻对5种常见氮素的同化机制和蓝藻细胞碳/氮代谢平衡的调节机制进行了详细综述,以期推动该方向的深入研究。
1 蓝藻的光合作用特征 1.1 光合作用场所蓝藻没有完整的细胞器,只能依靠细胞质的光合膜——又称类囊体膜(thylakoid membrane,TM)来完成光合作用。蓝藻TM结构呈多层片状,每层之间由膜桥相连,不同于绿藻和高等植物叶绿体中的基粒堆积结构[12]。如图 1所示,膜上镶嵌着多个参与光合作用与呼吸作用的蛋白复合体和酶,包括光系统Ⅱ(PSⅡ)、NAD(P)H脱氢酶复合体(NDH)、光系统I(PSI)、琥珀酸脱氢酶(SDH)、细胞色素bd醌醇氧化酶(Cyd)、细胞色素b6f复合体(Cytb6f)、质体醌(PQ)、质体蓝素(Pc)、细胞色素c氧化酶(Cox)和ATP合酶等,但它们并非均匀分布,而是成簇聚集。流动性是TM的显著特征,随环境条件变化而变化[12-13]。研究显示,TM流动性的改变使得PQ还原/氧化速率随温度变化,从而调节应激反应基因的表达。这种调节在光合生物适应环境条件的频繁变化(如环境温度波动、光强变化)中发挥着重要作用[13]。
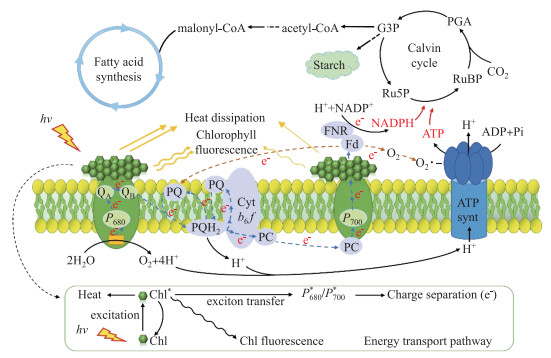
|
图 1 蓝藻光合作用过程(引自Yang等[14],略有改进) (黑色实线:物质的转运或转化过程,黑色虚线:捕光天线捕获光能后的激发能转运过程解释,蓝色虚线:线性电子传递途径,棕红色虚线:环式电子传递途径,黄线:激发能转运途径。Heat dissipation:热耗散,处于激发态的叶绿素分子在退激发过程中能量转移的一种途径;Chlorophyll fluorescence:叶绿素荧光,为叶绿素分子吸收光能后通过产生荧光转移能量的一种途径;Energy transport pathway:激发能转移途径。hv:光照;Chl:叶绿素分子;Chl*:激发态的叶绿素分子;P680:PSⅡ反应中心e-:电子,QA:质体醌QA;QB:质体醌QB;PQ:质体醌PQ库;Cytb6f:细胞色素b6f复合体;PC:质体蓝素;P700:PSI反应中心;FNR:铁氧还原蛋白NADP+还原酶;FD:铁氧还原蛋白;NADPH:烟酰胺腺嘌呤二核苷酸磷酸;ATP synt:ATP合酶;Ru5P:Ribulose 5-phosphate,5-磷酸核酮糖;RuBP:Ribulose 1, 5-diphosphate,1, 5-二磷酸核酮糖;PGA:3-phosphoglycerate,磷酸甘油酸;G3P:glyceraldehyde-3-phosphate,甘油醛-3-磷酸;acetyl-CoA:乙酰辅酶A;malonyl-CoA:丙二酰辅酶A) Fig.1 Photosynthesis process in cyanobacteria (modified from Yang et al[14]) |
光能捕获是光合作用的第一步,如何实现光能的高效捕获和传递是光合作用的关键。高等植物叶绿体中存在由包含Chl.a和Chl.b的LHCⅠ(light harvesting complex Ⅰ)与LHCⅡ(light harvesting complex Ⅱ)大分子蛋白复合体组成的外周天线捕光系统来捕获光能[15]。硅藻、褐藻等海洋藻类可利用由Chl.a、Chl.c和类胡萝卜素组成的捕光色素蛋白复合体捕获光能。而蓝藻通过类囊体膜外朝向基质一侧的超分子复合物——藻胆体(phycobilisomes,PBSs)来捕获光能,并与PSⅡ和PSI上的捕光色素分子(主要是Chl.a和类胡萝卜素)一起组成了蓝藻的光合天线系统。研究显示,在蓝藻PBSs上结合有感知不同波长光的光受体,这些光受体会根据环境光照条件调控细胞生长、趋光性、细胞聚集和光合作用等生理过程[16]。蓝藻PBSs捕获的光能会在PBSs内先进行传递,之后被转移至PSⅡ和PSI的内部天线系统,在Chl分子间进行传递。最后到达PSⅡ反应中心(P680)和PSI反应中心(P700)[16]。蓝藻PBSs由藻蓝蛋白(phycocyanin,PC)、别藻蓝蛋白(allophycocyanin,APC)和藻红蛋白(phycoerythrin,PE)与连接多肽按一定次序排列构成,多个APC组成圆柱体位于PBSs中央,PE与PC组成棒状排列在APC的外围[17-18]。光能沿着PBSs的组成结构有序地由外到内传递,因此捕获光能的传递途径为:PE→PC→APC→PSⅡ Chl→P680/P700。但一些蓝藻的PE会被藻红蓝蛋白(phycoerythrocyanin,PEC)代替,PC也被分为组成型(PCc)和诱导型(PCi)两种[17]。
PBSs不仅是蓝藻捕获光能的关键所在,它也是蓝藻光适应机制的组成部分,对蓝藻适应环境做出重要贡献。当蓝藻处于高光环境中,藻胆体可通过在TM上的移动分别与PSⅡ和PSI结合来调节能量在两个光系统之间的分配,以保证能量在2个光系统中的平衡。高光下,橙色类胡萝卜素蛋白的合成也会显著增加,以促进处于较高激发态的Chl.a和单线态O2释放能量来保护细胞免受不加区分的氧化损伤[19-20]。而低光下,编码APC的apcD4、apcB3基因大量表达,光合天线系统组成重构,可使细胞实现低光环境中光能的有效捕获[21]。低盐度环境下,Nostoc sp. ISC101的APC、PE、PC的含量增加,而高盐度会显著抑制它们的合成[22]。Pseudanabaena属等许多蓝藻的PE与PC的排列及其表达量也会随环境光强、光质的不同而发生改变,绿光下PE表达增强,橙红光下PC表达增强,从而出现互补色效应(complementary chromatic acclimation,CCA)[21]。
1.3 光化学反应和电子传递与绿藻、高等植物一样,PSⅡ是蓝藻光化学反应的发生场所,也是其光合作用的核心。如图 1所示,在能量转移到PSⅡ内部天线系统后,PSⅡ捕光色素分子由基态激发为高能态,此时处于激发态的叶绿素(Chl*)需要退激发回到基态(Chl)以重新接收光能[14]。退激发转移到PSⅡ反应中心色素P680的能量使P680由基态变为激发态P680*;与此同时,PSⅡ产氧复合体(oxygen-evolving complex, OEC)裂解H2O产生O2、e-和H+,发生电荷分离。通过解析Thermosynechococcus elongatus的PSⅡ三维结构,发现蓝藻PSⅡ单体是一个多亚基组成的跨膜蛋白复合体。PSⅡ单体含有约20个不同的蛋白亚基,包括2个脱镁叶绿素分子(Phe)、2个类胡萝卜素分子、QA、QB、非血红素Fe2+、4个Mn2+、3个Cl-、1个CO32-或者HCO3-等[23-24]。这些亚基或多或少都参与了光合作用过程。其中,2个同源叶绿素结合蛋白CP43(PsbC)和CP47(PsbB)在维持PSⅡ内部天线系统稳定中发挥作用;另外2个同源蛋白,D1(PsbA)和D2(PsbD)参与了光合原初反应过程。在PSⅡ的修复循环过程中,受损的D1蛋白会被快速降解并被新合成的D1蛋白替代[25-26],以保证PSⅡ良好的功能活性。3个外源性膜蛋白PsbO、PsbU和PsbV(也称细胞色素c550),以及细胞色素b559附着于内腔表面,它们可能参与了电子传递过程[24];此外,它们可保护OEC免受外部氧化还原组分的影响,也在H2O分子顺利进入OEC的锰族(Mn4CaO5)以及H+、O2被顺利运出膜外的过程中发挥着重要作用[27]。蓝藻PSⅡ在组成上比高等植物少了7个亚基[23]。高等植物中,PsbP、PsbQ两个膜蛋白亚基的位置在蓝藻中被PsbU和PsbV所替代,介导LHCⅡ与PSⅡ核心区域相互作用的PsbW亚基在蓝藻中也未发现[24]。虽然,目前还未发现蓝藻与高等植物的PSⅡ在光合功能上的差异,但其结构上的差异暗示二者可能存在其它功能方面的不同。
Z型电子传递链(PSⅡ→PQ→Cytb6f→Pc→PSI→Fd→FNR→NADP+)是所有光合生物体内主要的电子传递途径,蓝藻也不例外。除Z链外,还存在PGR5/PGRL1介导或NDH介导的环式电子传递链(cyclic electron flow,CEF),但PGR5/PGRL1介导的CEF在蓝藻中比较微弱[28]。越来越多的研究显示,CEF是光合生物体内一种十分重要的光保护机制,当其处于强光、弱光、高温、低温等逆境胁迫时,能保护光系统免受损伤,提高对环境的适应性。这在我们最新的研究中也得到印证,我们发现M. aeruginosa FACHB-905为了减轻高铵胁迫下PSⅡ的光损伤,NDH介导的围绕PSI的CEF被显著增强,以耗散累积的光能[20]。然而,目前还不清楚这些环式电子流是如何响应环境变化并启动的。
电子传递需要2个重要的电子传递体参与,分别是Cytb6f和PSI。Cytb6f主要参与激发能在PSⅡ与PSI间的转移、电子传递及其相关质子的跨膜运输过程,调节着胞内NADPH与ATP的比例,并保证膜两侧的质子梯度,为ATP的合成提供驱动力[29]。PSI的主要功能则是为Pc、NADP+提供一个电子氧化还原载体,与PSⅡ相互作用建立一个从H2O到NADP+的Z型电子传递链,为碳固定和氮同化过程提供还原力。不同于绿藻和高等植物体内存在的PSI单体形式,蓝藻PSI有三聚体和单体两种,二者比例与胞内阳离子或质子浓度的变化有关[30]。PSI复合体较大,但其组成并不像PSⅡ那么复杂。T. elongatus近原子分辨率、2.5Å的PSI三维结构解析发现,PSI包含有PsaA~PsaF、PsaI~PsaM、PsaX等12个蛋白亚基和127个辅因子(包括96个Chl分子、22个类胡萝卜素分子、4个脂质分子、3个[4Fe-4S]原子簇、2个叶绿素醌和1个Ca2+)[30]。其中,两个最大的蛋白亚基PsaA和PsaB组成了一个跨膜的异源PsaA/B二聚体,在PsaA/B支链组成的伪C2对称结构上结合Chl.a的单体(Ao)和Chl.a组成的二聚体——反应中心色素P700以及其它配基,共同组成PSI的光反应中心P700。与P680相比,P700的还原电位范围更宽,能产生足够低的氧化还原电位来还原NADP+。此外,Ao构成了PSI的内部天线系统,PsaF、PsaI、PsaJ、PsaK、PsaL等一些小分子亚基在维持PSI内部天线色素系统的稳定中起关键作用。状态转换是植物PSI和PSⅡ为适应环境光质、光强变化所采取的一种短期的光适应现象。近年来,有学者解析Anabaena sp. PCC7120的光系统结构时发现,PSI会与PBSs组成超分子复合体,从而在状态转换中发挥重要作用,但其作用机制目前尚不清楚[31]。
1.4 CO2的同化与浓缩如同许多高等植物,蓝藻执行C3固碳途径,即卡尔文-本森-巴沙姆循环(calvin-benson-bassham cycle,CBB)。CO2分子在核酮糖1,5-二磷酸羧化酶(Rubisco)催化下与核酮糖-1,5-二磷酸(RuBP)羧化生成3-磷酸甘油酸(3PG),随后又经历3PG还原和RuBP再生,以3-磷酸丙糖的形式将无机碳存储。但在相同CO2浓度下,蓝藻的光合速率显著高于水稻、小麦等C3植物,这与蓝藻所拥有的高效无机碳转运和碳浓缩机制有关。相比现今约419 μmol/L的大气CO2浓度,水体CO2浓度仅为5~25 μmol/L,而藻类Rubisco对CO2的亲和力高达250 μmol/L[32]。为了满足Rubisco对CO2的需求,蓝藻与C4植物一样,在进化上衍生出了特殊的环境适应机制——CO2浓缩机制(简称CCM)[33-36]。通过各种无机碳转运系统,蓝藻可使其羧体中Rubisco羧化酶活性周围的CO2浓度提升约1000倍。目前,已在蓝藻中发现了5种不同的无机碳转运系统。其中,2种为NDH复合体蛋白亚基NDH-I3和NDH-I4构成的CO2转运系统,转入的CO2需转变为HCO3-才能进入羧体中;其它3种分别为BCT1(又称Cmp转运系统)、BicA和SbtA 3种膜蛋白构成的HCO3-转运系统,可直接转运HCO3-进入羧体(图 2)[33-34]。羧体内存在大量碳酸酐酶(CA),进入羧体的HCO3-在CA催化下转变为CO2,后被Rubisco固定。但并非所有蓝藻都同时存在5种无机碳转运系统,在不同的蓝藻菌株中这些转运系统的存在和功能表现出极大的差异。Sandrini等[37]比对了20个M. aeruginosa菌株的CCM基因序列,发现所有菌株都拥有2个CO2转运系统,但有12个菌株缺少BicA或SbtA转运系统。蓝藻CCM的运转受到严格调控,CCM的运转也会导致膜两侧的离子梯度改变,因此需要膜上的Na+/H+梯度转运系统辅助,来调节膜两侧的离子浓度。对Synechocystis sp. PCC 6803研究显示,3个转录因子CyAbrB2、NdhR(CcmR)和CmpR都参与了CCM的转录调控过程[38-39]。CyAbrB2通过控制cmpABCD、sbtAB或ndhF3/ndhD3/cupA基因的转录,正向调控CCM机制。NdhR和CmpR都来自LysR家族,受小分子代谢物的调控,在低CO2条件下CmpR呈现高表达、促进CO2的浓缩。CmpR是cmp操纵子的转录激活因子,cmp操纵子编码膜上ABC型-CmpABCD转运蛋白[40]。CmpR与cmp操纵子结合区域的亲和能力受RuBP和2-磷酸乙醇酸(2-PG)的调控[41]。NdhR则主要参与CCM机制的抑制调节,在2-OG与NADP+的协同下,阻遏对CO2具有高亲和力的NDH-I3、BCT1、SbtA无机碳转型系统基因的表达[41]。
目前,已有许多学者认为,蓝藻的CCM是蓝藻水华得以持续发展的强劲动力。CCM能使蓝藻在与其他浮游植物对资源的竞争中占据优势,提高群体微囊藻对CO2的利用率[35, 42]。此外,CCM中的5个转运系统对CO2的亲和力不同,蓝藻可通过不同的调节方式启动相应的碳吸收系统来调整自身的固碳速率,以适应环境变化带来的无机碳可利用性变化[33]。在对Anabaena sp. PCC7120的最新研究显示,CyAbrB2参与了细胞异形胞的形成及其调控过程[43]。Orf等[39]在Synechocystis sp. PCC6803中研究发现,CyAbrB2还参与氮同化过程,可调节一些受NtcA控制的氮同化基因表达,如urtA、amt1、glnB、sigE和nrt操纵子。CCM在提高Rubisco催化效率和光合效率的同时,使细胞对Rubisco的氮投入减少,间接调控氮代谢过程。
2 蓝藻的光合氮同化特征蓝藻对不同形态氮素的同化机制不同,但氮同化代谢的整个过程与光合作用相偶联[44]。光合作用产生的ATP、NADPH不仅为氮的转运及同化过程提供能量和还原力,且光解H2O产生的H+形成的跨膜质子梯度是膜上各种氮转运蛋白主动运输氮素的驱动力。光合电子传递蛋白Fd还是胞内NO3-/NO2-还原为NH4+过程中的唯一电子供体。每1 mol NO3-还原为NH4+,需要消耗来自H2O裂解产生的8个e-[44]。Fd和碳同化中间产物2-酮戊二酸(2-OG)也会直接参与氮素同化主要途径——谷氨酸-谷氨酰胺(Glu-Gln)循环[44-45]。因此,氮代谢与碳同化之间也存在着对ATP、NADPH和中间代谢物上的竞争。
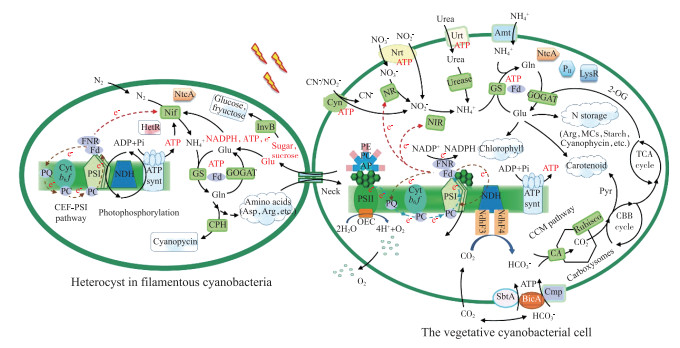
|
图 2 蓝藻光合氮同化过程(引自Yang等[20],并有补充) (Heterocyst in filamentous cyanobacteria:丝状蓝藻异形胞;CEF-PSI:cyclic electron flow around photosystem Ⅰ,围绕PSI的环式电子流;CCM:CO2-concentrating mechanism,CO2浓缩机制;Photophosphorylation:光合磷酸化;CBB cycle:calvin benson bassham cycle,卡尔文-本森-巴沙姆循环;TCA cycle:tricarboxylic acid cycle,三羧酸循环;Cyanophycin:藻青素;NecK:胞间连丝;Carboxysomes:羧体;Nrt:NO3-/NO2-的转运体;Amt:NH4+转运体;Urt:尿素转运体;Cyn:氰酸盐转运体;Glu:glutamate,谷氨酸;Gln:glutamine,谷氨酰胺;Arg:arginine,精氨酸;Asp:aspartate,天冬氨酸;NR:Fd-Nitrate reductase,Fd依赖性硝酸盐还原酶;NIR:Fd-Nitrite reductase,Fd依赖性亚硝酸盐还原酶;GS:glutamine synthetase,谷氨酰胺合成酶;GOGAT:glutamate synthetase,谷氨酸合成酶;NtcA:全局性N调控因子;PⅡ:PⅡ蛋白;LyR:LyR蛋白家族;MC:microcystin,微囊藻毒素;Chlorophyllide:脱植基叶绿素;Carotenoid:类胡萝卜素;2-OG:2-oxoglutarate,2-酮戊二酸;InvB:invertase producing glucose and fructose,转化酶;Rubisco:ribulose 1, 5 bisphosphate carboxylase/oxygenase,核酮糖1, 5-二磷酸羧化/加氧酶;CA:carbonic anhydrase,碳酸酐酶;Pyr:Pyruvate,丙酮酸盐;Cmp、Sbt:细胞膜上的HCO3-转运体;NdhF3、NdhF4:NAD(P)H脱氢酶复合体亚基;Nif:固氮酶;其它缩写词见图 1图注) Fig.2 Photosynthetic nitrogen assimilation in cyanobacteria (modified from Yang et al[20]) |
如图 2所示,环境中的NO3-/NO2-需要细胞膜上的NO3-/NO2-转运蛋白Nrt或NO2-转运蛋白Cyn通过主动运输进入细胞。之后,在Fd依赖性硝酸盐还原酶(NR)和Fd依赖性亚硝酸盐还原酶(NIR)催化下NO3-先后被还原为NO2-和NH4+,还原的终产物NH4+再进入Glu-Gln循环和氨基酸代谢,以有机氮形式被储存[44, 46]。
目前发现的NO3-/NO2-膜转运蛋白有ABC型-NrtABCD(淡水蓝藻)和NrtP(主要是海洋蓝藻)两种类型,它们被称为NO3-/NO2-透性酶,均属于可转运NO3-与NO2-的双特异性转运蛋白[47]。在NrtABCD对NO3-/NO2-转运过程中,ATP先与胞质ATP结合蛋白NrtD结合,在H2O裂解产生的质子动力驱动下,Nrt构象发生变化,使细胞周质底物结合蛋白NrtA结合的NO3-/NO2-顺利通过跨膜蛋白NrtB通道进入胞质,从而完成NO3-/NO2-的转运[48]。NrtABCD常出现在nirA操作子(nirA-nrtABCD-narB)中,但在无类囊体的蓝藻(Gloeobacter violaceus)和Synechocystis属蓝藻(如Synechocystis sp. PCC6803)中nirA 与nrtABCD-narB被隔开[44, 48]。近年来,在许多海洋蓝藻基因组中(如Trichodesmium erythraeum、Synechococcus sp. WH8102)发现了NO3-/NO2-的另一个膜转运蛋白——NrtP[47-48],它拥有比NrtABCD更高的底物亲和力(Ks约15 μmol/L),但有类似于真核生物NRT2转运蛋白的特征。NrtP也存在于高等植物、细菌和真菌当中,但目前对于蓝藻NrtP转运NO3-/NO2-的机制尚不清楚[47]。此外,NrtABCD与蓝藻的氰酸盐转运蛋白ABC型-CynABD(双特异性转运蛋白,可以转运NO2-)、HCO3-转运蛋白和ABC型-CmpABCD共同组成了一个特有的蛋白家族[44]。编码这4个蛋白的基因也参与编码了NR和NIR。我们在M. aeruginosa FACHB-905中的研究中发现,NO3-培养下细胞cmpABCD、ndhF3/ndhD3基因的表达被大幅下调[20]。从这些来看,NO3-/NO2-的转运与HCO3-的转运之间可能也存在联系。
蓝藻NR和NIR都依赖Fd作为电子供体,但NR的结构不同于细菌体内的NADH-NR和植物、真菌体内的NAD(P)H-NR。在对Synechococcus sp. PCC6803的NR结构解析中,发现它是由1个[4Fe-4S]原子族和1个Mo辅因子组成的蛋白酶,酶促反应动力学呈现高、低亲和力的双相动力学特征[49]。NIR则由1个[4Fe-4S]原子族和1血红素组成,只能接受来自Fd或黄素氧还蛋白(Fld)的e-,FAD、FMN、NADH或NADPH不能用作其电子供体,但不同物种中的NIR结构差异不大。虽然NIR由nirA操纵子编码,但在S. elongatus 的基因组中,nirB在NO3-的同化过程中高表达,它与ntcB组成1个特有的操纵子nirB-ntcB,nirB-ntcB只有在无NH4+环境下表达[23]。
蓝藻对NO2-的摄取也依赖于膜上的转运蛋白,包括上文提到的NrtABCD、NrtP以及CynABD,进入胞内的NO2-会在NIR催化下转化为NH4+,随后进入Glu-Gln循环[44, 47-48]。在中性pH环境中,弱酸性的NO2-也会以分子态的HNO2通过自由扩散进入胞内[46],但多数蓝藻生长在偏碱性环境中,且蓝藻在生长过程中溶液pH不断升高,因此这种被动运输过程程度很低,几乎可以忽略不计。
2.2 对NH4+的同化水中NH4+-N以NH4+和NH3两种形式存在,二者比例随水温、水体pH而动态变化。近年来,NH4+在我国许多湖泊中有超过NO3-成为水体中的主要氮素形式之态势[50]。蓝藻对NH4+的同化是在所有形态氮素被转运至胞内转化为NH4+后,将NH4+结合到碳骨架上而进行的无机氮到有机氮的代谢过程。其中,碳同化产物2-酮戊二酸(2-OG)为NH4+进入氨基酸代谢提供碳架。
NH3可通过自由扩散直接进入胞内。NH4+则需借助膜上Amt转运蛋白转运,转运过程不消耗ATP[51]。Amt是3个同源基因amt1、amt2和amt3编码的疏水性蛋白[52-53]。Montesinos等[52]在Synechocystis sp. PCC6803中研究发现,amt1编码的Amt1负责了95 % 以上NH4+的转运过程。同时,amt1参与了NtcA的氮同化调控过程,在Synechococcus sp. PCC7942中也观察到这一现象[54]。
细胞质中的NH4+可通过两条途径被结合到碳骨架上[53, 55]。一条是在谷氨酸脱氢酶(GDH)催化下NH4+与2-OG结合生成Glu,这条途径仅占少量部分,基因组测序显示许多蓝藻不包含编码GDH的基因[56]。虽然依赖于NADPH的GDH催化途径可能不是胞内NH4+同化的主要路径,但当胞内NH4+过剩时,该途径通过合成Glu消耗了大量NH4+,维持了类囊体与细胞质内的质子梯度[53, 55]。另一条途径是谷氨酰胺合成酶(GS)催化下,NH4+与Glu结合生成Gln,Gln在谷氨酸合成酶(GOGAT)的催化下又可与2-OG生成2分子的Glu,从而形成一个Glu-Gln循环,这是蓝藻NH4+代谢的主要途径[53]。蓝藻体内的GS有2个亚型,glnA基因编码的GSI和glnN编码的GSⅢ。GSI普遍存在于原核生物体内,而GSⅢ只存在于非固N2蓝藻中,但是不包括Prochlorococcus属和Thermosynechococcus属[55]。glnA缺失的Synechococcus sp. PCC7002突变株不仅能够正常生长,而且可以合成Gln,但缺失glnN的不同种属蓝藻的表型却存在差异[57]。通过对glnN缺失的Synechococcus sp. PCC7942突变株进行研究,发现虽然菌株可以正常生长,但却不能承受长期的氮饥饿;而glnN缺失的Synechococcus sp. PCC6803突变株在任何条件下都能正常生长,与野生型菌株并无差异。当同时缺失glnA和glnN时,Synechococcus sp. PCC6803菌株即使生长在Gln丰富的基质中也不能存活[58]。
GOGAT催化Gln到Glu是一个还原反应,需要消耗2个e-。因此,在光合生物体内存在两种分别以Fd和NADH作为电子供体的GOGAT[53]。目前,学者们已经解析了Synechocystis的Fd-GOGAT三维结构。发现它与高等植物、绿藻的Fd-GOGAT结构非常相似,包含1个[3Fe-4S]原子族和1个FMN辅基,拥有释放NH4+和2-亚氨基戊二酸还原的催化位点以及氨基转移酶的结合区域,由glsF基因编码;而NADH-GOGAT则是由gltB基因编码的大亚基和gltD基因编码的小亚基组成,目前仅在Synechocystis和Plectonema boryanum中有发现,并且它与高等植物体内单体态的NADH-GOGAT高度同源[55],这为高等植物起源的内共生假说提供了一个分子证据。虽然两种类型的GOGAT都在蓝藻生长过程中表达,且活性无明显差异,但Fd-GOGAT在氮同化过程中的作用更突出。一直以来,有学者不断尝试敲除glsF、gltB或gltD,但至今没有获得缺失GOGAT的突变株[46]。近来对S. elongatus PCC7942研究发现,GOGAT的活性在活细胞生长的不同时期表现出明显差异,这暗示蓝藻氮代谢活动在其生命周期内可能存在节律性[59]。
2.3 对尿素的同化全球尿素产量约为每年7000万t,在近40年来,尿素作为氮肥的用量增加了近100倍,在所有氮肥用量中占比超过60 % [6]。许多蓝藻可利用尿素作为氮源,即使其浓度低至0.1~0.6 μmol/L。调查显示,目前我国水体中尿素浓度为0.1~10 μmol/L[60]。蓝藻质膜上,存在1个ABC型-UrtABCDE转运蛋白,分别由urtA编码的细胞周质底物结合蛋白、urtB和urtC编码的跨膜蛋白、urtD和urtE编码的ATP结合蛋白组成,但蓝藻对尿素亲和力(Ks约为0.1 μmol/L)要低于酵母(Ks约为14 μmol/L)和细菌(Ks约为9 μmol/L)[46]。尿素很容易穿过磷脂双分子层,通过自由扩散进入胞质。进入胞内后的尿素,需要先在Ni2+依赖性的脲酶催化下被水解为NH4+才能进入氮同化过程,但大多数蓝藻的脲酶活性在NH4+存在时被抑制。尿素也是蓝藻合成与分解代谢的桥梁,精氨酸分解产生的尿素不是直接扩散到胞外,而是经脲酶水解为NH4+进一步进入氮同化过程[46]。在氮饥饿状态下,蓝藻可通过水解尿素来补充氮源。Huang等[60]研究发现,高浓度尿素氮(36.4 μmol/L以上)供应下M. aeruginosa FACHB-905的比生长速率要显著高于NO3--N供应,但较低的尿素氮(3.64 μmol/L以下)供应不能支撑藻的持续生长。Zhou等[61]对氮饥饿后的M. aeruginosa FACHB-905提供尿素,发现藻的细胞密度和Chl.a浓度快速增加,且微囊藻毒素(MC)含量与其呈正相关,说明尿素被同化后可能参与了MC的合成。
2.4 对N2的同化迄今发现的2000多种蓝藻中,约有160余种蓝藻具备固氮能力,这主要是一些丝状蓝藻,例如长孢藻(Dolichospermum)、项圈藻(Anabaenopsis)、束丝藻(Aphanizomenon)、念珠藻(Nostoc)、节球藻(Nodularia)、柱孢藻(Cylindrospermum)、束毛藻(Trichodesmium)等[62-63]。固氮蓝藻的细胞内存在固氮酶,在该酶催化下N2可被同化为NH3,再以NH4+进入Glu-Gln循环。在贫营养盐海域,束毛藻等一些固N2蓝藻是海洋氮库的重要贡献者[62]。但在太湖、巢湖等淡水湖泊,长孢藻、束丝藻等常在春季形成蓝藻水华[63]。有研究认为,固N2蓝藻固定的氮素可释放到水体中,可能为夏季非固N2蓝藻水华形成提供了氮营养条件。然而,来自不同湖泊的研究显示,蓝藻的固N2速率和固氮量并不一定与湖泊富营养化程度呈正相关。例如,国外学者在Erken湖、Clear湖和Pyramid湖等的研究显示,蓝藻固氮作用是水体氮素的主要来源[64];而张波等[65]对太湖进行研究,发现北太湖固氮作用对水体氮库的贡献相对较小,且固氮速率呈现明显的季节性差异,夏季约为春季的6倍。因此,固N2蓝藻是否对水体氮含量做出显著贡献,仍未有定论。
固氮酶是一种对O2极为敏感的金属酶类,酶的活性和结构都会受到O2的不可逆损伤[66]。为了避开光合产O2,固N2蓝藻进化出了3种固氮机制。1)细胞分化形成异形胞,提供厌氧环境,在异形胞中固氮,使固氮与光合在空间上隔离;2)形成一种介于异形胞与正常细胞之间的特定细胞——丝束,在其中实现固氮作用,这种固氮机制主要见于海洋蓝藻束毛藻中[62];3)利用细胞生长上的昼夜节律,在夜晚时段进行固氮作用,如单细胞蓝藻Crocosphaera[67]。但每个物种只拥有一种固氮机制,利用异形胞固氮是多数蓝藻的固氮方式。固氮酶存在于异形胞中,异形胞只有在细胞缺氮时形成,它具备糖脂和多聚糖组成的厚细胞壁来阻碍O2进入。蓝藻固氮酶以钼-依赖性的Nif为主,由nifB、nifD、nifE、nifH、nifK等16个基因组成的nif基因簇编码,基因表达受级联调控[66]。nifH编码的铁蛋白在固氮中最为关键,nifH的表达受光照、温度、水体无机氮含量及氮形态等的调节[62]。固氮基因表达在细胞生长过程中也存在节律性,如Anabaena sp. PCC7120的固氮基因仅在异形胞发育后期表达[68]。
虽然异形胞中的固氮作用与光合作用相隔离,但二者且存在密切联系。异形胞是由营养细胞分化而来的特殊细胞,其中无PSⅡ,Rubisco活性也被抑制,不能固定CO2,生长代谢所需的营养、各种辅助因子只能依靠周围的营养细胞供应[62]。如图 2所示,异形胞毗邻的营养细胞通过光合碳/氮同化产生的糖类、Glu等各种物质经胞间连丝被转运进异形胞,为异形胞的分化、代谢提供了碳源。而N2在异形胞中的同化产物NH4+又进入Glu-Gln循环及氨基酸代谢,产物Gln、Asp、Arg等经胞间连丝再传递给营养细胞作为氮营养供营养细胞生长[69]。这种碳/氮营养交换是固N2蓝藻生长、分化的基础。此外,固氮作用需要消耗大量ATP和还原力。固氮酶Nif每固定1 mol N2需要消耗16个ATP和8个e-。这些ATP和还原当量来自异形胞中围绕PSI的环式电子传递和光合磷酸化,以及毗邻营养细胞光合作用后输送[62, 70]。
3 蓝藻碳/氮代谢的耦合及其调控光合作用支撑了蓝藻生长、繁殖、代谢等一切生命活动,氮素作为蓝藻藻胆体、叶绿素、光系统蛋白复合体、细胞组分、核酸等合成必不可少的矿质元素,氮的同化代谢必须保持和碳同化代谢同步,以避免代谢效率低下[56]。当蓝藻处于氮或磷营养限制时,为了保证营养代谢,维持细胞生长,光合碳同化与色素合成被显著降低[71]。在正常蓝藻细胞内,C(CO2)/N(NH4+)比始终维持在5 ∶1,这主要由氮调节信号蛋白PⅡ及其辅助蛋白PipX、全局性氮转录调节因子NtcA和碳同化产物2-OG组成的调节网络来精准调控[11, 33, 46, 72]。Zhang等[56]、Forchhammer和Selim[33]对蓝藻碳/氮代谢平衡的调控机制进行了详细综述,认为细胞主要通过感知其代谢状态和信号分子发起的信号转导机制来进行不同程度的调节,以控制对碳素、氮素的摄取和同化。已知的调控途径主要依赖于信号分子发起的信号转导调节机制,包括NtcA在转录水平的直接调控,以及PⅡ和2-OG在转录与翻译水平的间接调控。
NtcA是一个全局性氮转录调控因子,可直接调控碳/氮代谢基因表达。目前已发现了多个参与碳/氮代谢基因的启动子区存在NtcA结合位点(表 1),NtcA结合后会激活或抑制它们的转录[11, 33, 44, 46, 51, 53, 55, 73-76],它们不仅参与不同形态氮的摄取、同化过程,也涉及藻胆体裂解、光合电子传递和MC的合成。
| 表 1 受NtcA调控的碳/氮同化相关的基因 Tab. 1 Genes regulated by NtcA in the carbon/nitrogen assimilation |
蓝藻NtcA最早由Flores和Herrero在Synechococcus sp. PCC7942中发现,它是由222~225个氨基酸组成的cAMP受体蛋白(CRP)家族成员[77]。蓝藻的NtcA非常保守,不同种蓝藻NtcA氨基酸序列同源性超过63 %,在C末端和N末端分别存在1个DNA结合域和1个2-OG结合域[73]。在nirA操作子(包括nirA、nrtABCD和narB)、amt1、cynABD、nrtP等基因的启动子-10盒区上游存在一段回文序列GTAN8TAC,是NtcA的识别位点[55]。NtcA可以识别并与其特异性结合,来激活下游基因的转录。胞内2-OG含量增加、PipX蛋白的高表达,也能增强NtcA与这些基因识别位点的结合效率。当细胞处于非NH4+的氮素供应时,NtcA可以激活体内大量基因转录,而且氮限制状态下这些基因的表达显著上调[55]。此外,当NtcA结合位点位于转录起始点(tsp)上游时,NtcA可以通过提高RNA聚合酶的转录效率来激活转录;而当NtcA被敲除时,细胞不能利用NO3-进行生长,胞内的NR、NIR、GS等活性显著降低[33, 54]。在Anabaena sp. PCC 7120、S. elongatus PCC7942、M. aeruginosa PCC7806中研究发现,NtcA不仅调节氮的同化过程,也参与光反应和MC的合成,如rbcLS、petH、mycA的表达受到NtcA调节[74-76]。
PⅡ、PipX和2-OG可组成一个调节网络在转录与翻译水平对碳/氮代谢进行间接调控。PⅡ通过与ATP、Mg2+、2-OG的结合,感知细胞内的碳/氮水平和氧化还原力大小,从而调节碳/氮同化进程[78]。2-OG可结合到PⅡ蛋白上,并与其相互作用使PⅡ构象发生改变,阻碍PⅡ与其它蛋白间的相互作用以此来影响PⅡ的活性和结合特性。这导致PⅡ相互作用蛋白PipX从PⅡ中解离出来,并与NtcA的识别区结合,影响NtcA对碳/氮同化相关基因的调控[59]。PⅡ的活性分别受胞内2-OG含量和NH4+浓度的正负调节,也受NtcA转录因子调控[33, 46]。同时,PⅡ也参与了许多氮同化相关蛋白和蛋白复合物的转录后调控,包括NrtABCD、NR、CynABD、CmpABCD、乙酰辅酶A羧化酶(ACC)、N-乙酰谷氨酸激酶(NAGK)和PipX蛋白等[79],这主要通过改变PⅡ的磷酸化状态,而PⅡ磷酸化状态与胞内2-OG浓度水平、环境光强和CO2分压有关[79]。PⅡ的磷酸化是蓝藻特有的,在绿藻和高等植物中并未观察到这一特征。其中,PⅡ对ACC的负向调节是在PⅡ处于完全磷酸化状态和胞内2-OG水平较低的情况下发生的[46]。许多研究显示,藻类在氮饥饿条件下胞内脂肪酸会不断累积。这一现象或许正来自于PⅡ对ACC的调节作用。ACC催化了乙酰辅酶A到丙二酰辅酶A的羧化过程,这一反应是胞内脂肪酸合成的第1步,在脂肪酸的合成中处于关键地位。ACC消耗乙酰辅酶A导致胞内2-OG水平下降,有利于完全磷酸化的PⅡ与生物素羧基载体蛋白(BCCP)的亚基相互作用。这种相互作用的结果是降低了ACC活性,抑制了丙二酰辅酶A的合成过程,导致乙酰辅酶A水平的逐渐升高,使细胞内的2-OG不断积累,而2-OG含量增加又促使2-OG与PⅡ结合[46, 59]。当PⅡ所有结合位点被占据时,PⅡ与ACC发生解离,过量的乙酰辅酶A又被用于脂肪酸的合成。
近年来的研究显示,不同形态氮素下,ntcA、pipX和glnB(编码PⅡ蛋白)基因的转录水平存在差异,其表达也受到氮含量调节[80-82]。细胞通过调控氮同化代谢过程,降低MC合成所需的前体氨基酸(如Met、Leu、Arg、Glu、Ser等),并通过控制这三个基因与mcyA/D启动子区的结合以及它们对mcyE/F基因表达的调控,来影响胞内MC合成过程[80]。Krausfeldt等[81]对采用15N标记的NO3--N、NH4+-N、尿素培养后的Microcystis做代谢组分析,发现无论采用哪一种氮素,细胞的氮代谢过程都与碳同化有关,而且不同氮素下的代谢物组成存在显著差异。这意味着,不同形态氮素下,蓝藻的碳/氮代谢平衡的调控机制可能存在差异。在前期研究中,我们也发现M. aeruginosa在NO3--N培养下会通过增强尿素-鸟氨酸循环和Arg生物合成来加大氮素以藻青素、MC的形式在胞内存储;而NH4+-N供应下,光合基因表达下调、MC含量较低,但细胞对HCO3-的转运及CCM却显著增强。然而,两种氮素下,ntcA和glnB的表达并未出现明显差异。
4 结语蓝藻水华的形成是一个极其复杂的过程,其主要原因是蓝藻自身的生理生态特性受到营养盐、光照、温度、风速、水流动力、日照时间等外部因素影响,导致蓝藻出现了大规模的增殖活动[2, 42, 83-85]。蓝藻可通过多种生理机制来调节和适应环境变化,并保持存活、不断繁殖。例如,形成胶质鞘、伪空泡等结构和形成群体来抵御风浪,帮助细胞上浮;利用低光适应、强光防护和CO2浓缩机制等保持高效光合作用;丝状蓝藻还可形成独特的异形胞进行固氮作用。但不管何种机制,光合作用、氮同化代谢是蓝藻生长并维持其生理生态特性的前提与基础。
尽管蓝藻的光合作用特征及其对不同形态氮素的同化机制已基本清楚,但目前对光合作用与不同形态氮素同化代谢的耦合关系研究还有待深入。例如,不同形态氮素下,蓝藻的光能捕获与激发能转移、光合天线系统转换、电子流分配机制如何?是否存在差异?NtcA、PⅡ、PipX和2-OG在不同氮素下如何表达?细胞光合碳/氮代谢平衡的调节机制有何不同?除2-OG外,是否还存在其它碳同化产物作为信号分子调节着胞内碳/氮代谢平衡?对这些问题研究的不够深入,制约了人们对不同氮素环境中蓝藻生长增殖与生态竞争适应策略的认识。因此,加深对蓝藻光合氮同化和不同形态氮/磷营养代谢及其分子调控机制的认识,以便针对性地提出营养盐的精细管控策略,是值得进一步深入研究的重要方向。
此外,藻类对不同营养盐的同化特征因种类不同而异[86-87],不同种属蓝藻的生理生态特性也存在不同。固N2蓝藻与非固N2蓝藻对NO3-、NO2-、NH4+、尿素等氮素的同化机制存在怎样的差异?蓝藻光合氮同化特征是否具有物种特异性?等等,也是值得深入探究的科学问题。比较不同蓝藻物种光合氮同化及其调控机制的异同,有助于认识光合氮同化对蓝藻优势维持以及生态竞争适应策略的重要性,这方面的工作可在蓝藻不同物种竞争试验的基础上,结合不同环境条件下细胞的光合生理特征与基因组、转录组及代谢组特征进行分析,以认识水华蓝藻光合氮同化的物种特异性。
| [1] |
Lewis WM, Wurtsbaugh WA, Paerl HW. Rationale for control of anthropogenic nitrogen and phosphorus to reduce eutrophication of inland waters. Environmental Science & Technology, 2011, 45(24): 10300-10305. DOI:10.1021/es202401p |
| [2] |
Burson A, Stomp M, Greenwell E et al. Competition for nutrients and light: Testing advances in resource competition with a natural phytoplankton community. Ecology, 2018, 99(5): 1108-1118. DOI:10.1002/ecy.2187 |
| [3] |
Glibert PM, Wilkerson FP, Dugdale RC et al. Phytoplankton communities from San Francisco Bay Delta respond differently to oxidized and reduced nitrogen substrates-even under conditions that would otherwise suggest nitrogen sufficiency. Frontiers in Marine Science, 2014, 1: 17. DOI:10.3389/fmars.2014.00017 |
| [4] |
Donald DB, Bogard MJ, Finlay K et al. Comparative effects of urea, ammonium, and nitrate on phytoplankton abundance, community composition, and toxicity in hypereutrophic freshwaters. Limnology and Oceanography, 2011, 56(6): 2161-2175. DOI:10.4319/lo.2011.56.6.2161 |
| [5] |
Steffen MM, Dearth SP, Dill BD et al. Nutrients drive transcriptional changes that maintain metabolic homeostasis but alter genome architecture in Microcystis. The ISME Journal, 2014, 8(10): 2080-2092. DOI:10.1038/ismej.2014.78 |
| [6] |
Glibert PM, Wilkerson FP, Dugdale RC et al. Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions. Limnology and Oceanography, 2016, 61(1): 165-197. DOI:10.1002/lno.10203 |
| [7] |
Zhan XY, Bo Y, Zhou F et al. Evidence for the importance of atmospheric nitrogen deposition to eutrophic Lake Dianchi, China. Environmental Science & Technology, 2017, 51(12): 6699-6708. DOI:10.1021/acs.est.6b06135 |
| [8] |
Zhang YL, Li H, Xu QJ et al. Effects of different forms of nitrogen on chlorophyll-a and microcystin production of Microcystis sp.. J Lake Sci, 2011, 23(6): 881-887. [张亚丽, 李涵, 许秋瑾等. 不同形态氮对微囊藻叶绿素a合成及产毒的影响. 湖泊科学, 2011, 23(6): 881-887. DOI:10.18307/2011.0609] |
| [9] |
Wu XH, Gao JY, Yan YW et al. Comparison of inorganic nitrogen and organic nitrogen on the growth and microcystin production of Microcystis aeruginosa. Acta Scientiae Circumstantiae, 2015, 35(3): 677-683. [吴轩浩, 高佳逸, 严杨蔚等. 无机氮和有机氮对铜绿微囊藻生长和产毒影响的比较. 环境科学学报, 2015, 35(3): 677-683. DOI:10.13671/j.hjkxxb.2014.0769] |
| [10] |
Xu H, Chen D, Chen J et al. Effects of nitrogen and phosphorus forms and concentrations on the growth of Microcystis aeruginosa and Scenedesmus obliquus. China Environmental Science, 2019, 39(6): 2560-2567. [许海, 陈丹, 陈洁等. 氮磷形态与浓度对铜绿微囊藻和斜生栅藻生长的影响. 中国环境科学, 2019, 39(6): 2560-2567. DOI:10.3969/j.issn.1000-6923.2019.06.039] |
| [11] |
Feng GF, Li ZY. Carbon and nitrogen metabolism of sponge microbiome. Symbiotic microbiomes of coral reefs sponges and corals. Dordrecht: Springer Netherlands, 2019: 145-169. DOI: 10.1007/978-94-024-1612-1_9.
|
| [12] |
Casella S, Huang F, Mason D et al. Dissecting the native architecture and dynamics of cyanobacterial photosynthetic machinery. Molecular Plant, 2017, 10(11): 1434-1448. DOI:10.1016/j.molp.2017.09.019 |
| [13] |
Maksimov EG, Mironov KS, Trofimova MS et al. Membrane fluidity controls redox-regulated cold stress responses in cyanobacteria. Photosynthesis Research, 2017, 133(1): 215-223. DOI:10.1007/s11120-017-0337-3 |
| [14] |
Yang XL, Liu LH, Yin ZK et al. Quantifying photosynthetic performance of phytoplankton based on photosynthesis-irradiance response models. Environmental Sciences Europe, 2020, 32(1): 1-13. DOI:10.1186/s12302-020-00306-9 |
| [15] |
Ramanan C, Ferretti M, van Roon H et al. Evidence for coherent mixing of excited and charge-transfer states in the major plant light-harvesting antenna, LHCⅡ. Physical Chemistry Chemical Physics: PCCP, 2017, 19(34): 22877-22886. DOI:10.1039/c7cp03038j |
| [16] |
Wiltbank LB, Kehoe DM. Diverse light responses of cyanobacteria mediated by phytochrome superfamily photoreceptors. Nature Reviews Microbiology, 2019, 17(1): 37-50. DOI:10.1038/s41579-018-0110-4 |
| [17] |
Peng PP, Dong LL, Sun YF et al. The structure of allophycocyanin B from Synechocystis PCC 6803 reveals the structural basis for the extreme redshift of the terminal emitter in phycobilisomes. Acta Crystallographica Section D, Biological Crystallography, 2014, 70(10): 2558-2569. DOI:10.1107/S1399004714015776 |
| [18] |
Arteni AA, Ajlani G, Boekema EJ. Structural organisation of phycobilisomes from Synechocystis sp. strain PCC6803 and their interaction with the membrane. Biochimica et Biophysica Acta: BBA - Bioenergetics, 2009, 1787(4): 272-279. DOI:10.1016/j.bbabio.2009.01.009 |
| [19] |
Paerl HW. Cyanobacterial carotenoids: Their roles in maintaining optimal photosynthetic production among aquatic bloom forming Genera. Oecologia, 1984, 61(2): 143-149. DOI:10.1007/BF00396752 |
| [20] |
Yang XL, Bi YH, Ma XF et al. Transcriptomic analysis dissects the regulatory strategy of toxic cyanobacterium Microcystis aeruginosa under differential nitrogen forms. Journal of Hazardous Materials, 2022, 428: 128276. DOI:10.1016/j.jhazmat.2022.128276 |
| [21] |
Gan F, Bryant DA. Adaptive andacclimative responses of cyanobacteria to far-red light. Environmental Microbiology, 2015, 17(10): 3450-3465. DOI:10.1111/1462-2920.12992 |
| [22] |
Iranshahi S, Nejadsattari T, Soltani N et al. The effect of salinity on morphological and molecular characters and physiological responses of Nostoc sp. ISC 101. Iranian Journal of Fisheries Sciences, 2014, 13(4): 907-917. |
| [23] |
Zouni A, Witt HT, Kern J et al. Crystal structure of photosystem Ⅱ from Synechococcus elongatus at 3.8 A resolution. Nature, 2001, 409(6821): 739-743. DOI:10.1038/35055589 |
| [24] |
Roose JL, Wegener KM, Pakrasi HB. The extrinsic proteins of photosystem Ⅱ. Photosynthesis Research, 2007, 92(3): 369-387. DOI:10.1007/s11120-006-9117-1 |
| [25] |
Komenda J, Sobotka R, Nixon PJ. Assembling and maintaining the photosystem Ⅱ complex in chloroplasts and cyanobacteria. Current Opinion in Plant Biology, 2012, 15(3): 245-251. DOI:10.1016/j.pbi.2012.01.017 |
| [26] |
Dai GZ, Qiu BS, Forchhammer K. Ammonium tolerance in the cyanobacterium Synechocystis sp. strain PCC 6803 and the role of the psbA multigene family. Plant, Cell & Environment, 2014, 37(4): 840-851. DOI:10.1111/pce.12202 |
| [27] |
Zhang M, Bommer M, Chatterjee R et al. Structural insights into the light-driven auto-assembly process of the water-oxidizing Mn4CaO5-cluster in photosystem Ⅱ. eLife, 2017, 6: e26933. DOI:10.7554/eLife.26933 |
| [28] |
Xue X, Xu HM, Wu HY et al. Research progress of cyclic electron transport in plant photosynthesis. Plant Physiology Journal, 2017, 53(2): 145-158. [薛娴, 许会敏, 吴鸿洋等. 植物光合作用循环电子传递的研究进展. 植物生理学报, 2017, 53(2): 145-158.] |
| [29] |
Dirk S, Wenk SO, Berry S et al. Role of pigments and subunits in the cytochrome b6f complex of Synechocystis PCC6803. Science Access, 2001, 3(1): 1-5. |
| [30] |
Le RK, Harris BJ, Iwuchukwu IJ et al. Analysis of the solution structure of Thermosynechococcus elongatus photosystem Ⅰ in n-dodecyl-β-D-maltoside using small-angle neutron scattering and molecular dynamics simulation. Archives of Biochemistry and Biophysics, 2014, 550(550/551): 50-57. DOI:10.1016/j.abb.2014.04.005 |
| [31] |
Watanabe M, Semchonok DA, Webber-Birungi MT et al. Attachment of phycobilisomes in an antenna-photosystem Ⅰ super complex of cyanobacteria. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(7): 2512-2517. DOI:10.1073/pnas.1320599111 |
| [32] |
Liu Q, Mi TZ, Zhen Y et al. Research progress on C4 carbon fixation pathway of diatoms. Marine Sciences, 2018, 42(7): 131-140. [刘乾, 米铁柱, 甄毓等. 硅藻C4固碳途径的研究进展. 海洋科学, 2018, 42(7): 131-140. DOI:10.11759/hykx20180314001] |
| [33] |
Forchhammer K, Selim KA. Carbon/nitrogen homeostasis control in cyanobacteria. FEMS Microbiology Reviews, 2020, 44(1): 33-53. DOI:10.1093/femsre/fuz025 |
| [34] |
Long BM, Rae BD, Rolland V et al. Cyanobacterial CO2-concentrating mechanism components: Function and prospects for plant metabolic engineering. Current Opinion in Plant Biology, 2016, 31: 1-8. DOI:10.1016/j.pbi.2016.03.002 |
| [35] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16(8): 471-483. DOI:10.1038/s41579-018-0040-1 |
| [36] |
Wu TF, Song LR, Liu YD. An induced CO2-concentrating mechanism (CCM) in Anabaena sp. strain PCC7120. Chinese Science Bulletin, 1999, 44(14): 1527-1531. [吴天福, 宋立荣, 刘永定. 蓝藻Anabaena sp. strain PCC7120中一种可诱导的CO2浓缩机制(CCM). 科学通报, 1999, 44(14): 1527-1531. DOI:10.3321/j.issn:0023-074X.1999.14.015] |
| [37] |
Sandrini G, Matthijs HCP, Verspagen JMH et al. Genetic diversity of inorganic carbon uptake systems causes variation in CO2 response of the cyanobacterium Microcystis. The ISME Journal, 2014, 8(3): 589-600. DOI:10.1038/ismej.2013.179 |
| [38] |
Klähn S, Orf I, Schwarz D et al. Integrated transcriptomic and metabolomic characterization of the low-carbon response using an ndhR mutant of Synechocystis sp. PCC 6803. Plant Physiology, 2015, 169(3): 1540-1556. DOI:10.1104/pp.114.254045 |
| [39] |
Orf I, Schwarz D, Kaplan A et al. CyAbrB2 contributes to the transcriptional regulation of low CO2 acclimation in Synechocystis sp. PCC 6803. Plant and Cell Physiology, 2016, 57(10): 2232-2243. DOI:10.1093/pcp/pcw146 |
| [40] |
Mahounga DM, Sun H, Jiang YL. Crystal structure of the effector-binding domain of Synechococcus elongatus CmpR in complex with ribulose 1, 5-bisphosphate. Acta Crystallographica Section F, Structural Biology Communications, 2018, 74(8): 506-511. DOI:10.1107/S2053230X18008841 |
| [41] |
Daley SME, Kappell AD, Carrick MJ et al. Regulation of the cyanobacterial CO2-concentrating mechanism involves internal sensing of NADP+ and α-ketogutarate levels by transcription factor CcmR. PLoS One, 2012, 7(7): e41286. DOI:10.1371/journal.pone.0041286 |
| [42] |
Ma JR, Deng JM, Qin BQ et al. Progress and prospects on cyanobacteria bloom-forming mechanism in lakes. Acta Ecologica Sinica, 2013, 33(10): 3020-3030. [马健荣, 邓建明, 秦伯强等. 湖泊蓝藻水华发生机理研究进展. 生态学报, 2013, 33(10): 3020-3030. DOI:10.5846/stxb201202140200] |
| [43] |
Higo A, Nishiyama E, Nakamura K et al. cyAbrB transcriptional regulators as safety devices to inhibit heterocyst differentiation in Anabaena sp. strain PCC 7120. Journal of Bacteriology, 2019, 201(17): e00244-e00219. DOI:10.1128/JB.00244-19 |
| [44] |
Flores E, Frías JE, Rubio LM et al. Photosynthetic nitrate assimilation in cyanobacteria. Photosynthesis Research, 2005, 83(2): 117-133. DOI:10.1007/s11120-004-5830-9 |
| [45] |
Zahn LM. Photosynthesis evolution in cyanobacteria. Science, 2017, 355(6332): 1386-1388. DOI:10.1126/science.355.6332.1386-o |
| [46] |
Esteves-Ferreira AA, Inaba M, Fort A et al. Nitrogen metabolism in cyanobacteria: Metabolic and molecular control, growth consequences and biotechnological applications. Critical Reviews in Microbiology, 2018, 44(5): 541-560. DOI:10.1080/1040841X.2018.1446902 |
| [47] |
Maeda SI, Murakami A, Ito H et al. Functional characterization of the FNT family nitrite transporter of marine picocyanobacteria. Life: Basel, Switzerland, 2015, 5(1): 432-446. DOI:10.3390/life5010432 |
| [48] |
Ohashi Y, Shi W, Takatani N et al. Regulation of nitrate assimilation in cyanobacteria. Journal of Experimental Botany, 2011, 62(4): 1411-1424. DOI:10.1093/jxb/erq427 |
| [49] |
Jepson BJN, Anderson LJ, Rubio LM et al. Tuning a nitrate reductase for function: The first spectropotentiometric characterization of a bacterial assimilatory nitrate reductase reveals novel redox properties. The Journal of Biological Chemistry, 2004, 279(31): 32212-32218. DOI:10.1074/jbc.M402669200 |
| [50] |
Wang J, Mao JZ, Xie YH et al. Water quality variation characteristics of Dianchi Lake during 2008 to 2014. Yangtze River, 2018, 49(5): 11-15. [王杰, 毛建忠, 谢永红等. 2008—2014年滇池水质时空变化特征分析. 人民长江, 2018, 49(5): 11-15.] |
| [51] |
Flores E, Herrero A. Nitrogen assimilation and nitrogen control in cyanobacteria. Biochemical Society Transactions, 2005, 33(Pt 1): 164-167. DOI:10.1042/BST0330164 |
| [52] |
Montesinos ML, Muro-Pastor AM, Herrero A et al. Ammonium/methylammonium permeases of a cyanobacterium. Identification and analysis of three nitrogen-regulated amt genes in Synechocystis sp. PCC 6803. The Journal of Biological Chemistry, 1998, 273(47): 31463-31470. DOI:10.1074/jbc.273.47.31463 |
| [53] |
IsabelMuro-Pastor M, Reyes JC, Florencio FJ. Ammonium assimilation in cyanobacteria. Photosynthesis Research, 2005, 83(2): 135-150. DOI:10.1007/s11120-004-2082-7 |
| [54] |
Vázquez-Bermúdez MF, Flores E, Herrero A. Analysis of binding sites for the nitrogen-control transcription factor NtcA in the promoters of Synechococcus nitrogen-regulated genes. Biochimica et Biophysica Acta: BBA - Gene Structure and Expression, 2002, 1578(1/2/3): 95-98. DOI:10.1016/S0167-4781(02)00506-7 |
| [55] |
Muro-Pastor MI, Florencio FJ. Regulation of ammonium assimilation in cyanobacteria. Plant Physiology and Biochemistry, 2003, 41(6/7): 595-603. DOI:10.1016/S0981-9428(03)00066-4 |
| [56] |
Zhang CC, Zhou CZ, Burnap RL et al. Carbon/nitrogen metabolic balance: Lessons from cyanobacteria. Trends in Plant Science, 2018, 23(12): 1116-1130. DOI:10.1016/j.tplants.2018.09.008 |
| [57] |
Reyes JC, Florencio FJ. A new type of glutamine synthetase in cyanobacteria: The protein encoded by the glnN gene supports nitrogen assimilation in Synechocystis sp. strain PCC 6803. Journal of Bacteriology, 1994, 176(5): 1260-1267. DOI:10.1128/jb.176.5.1260-1267.1994 |
| [58] |
Takatani N, Omata T. Effects of PⅡ deficiency on expression of the genes involved in ammonium utilization in the cyanobacterium Synechocystis sp. strain PCC 6803. Plant and Cell Physiology, 2006, 47(6): 679-688. DOI:10.1093/pcp/pcj037 |
| [59] |
Lüddecke J, Francois L, Spät P et al. PⅡ protein-derived FRET sensors for quantification and live-cell imaging of 2-oxoglutarate. Scientific Reports, 2017, 7: 1437. DOI:10.1038/s41598-017-01440-w |
| [60] |
Huang WM, Bi YH, Hu ZY. Effects of fertilizer-urea on growth, photosynthetic activity andmicrocystins production of Microcystis aeruginosa isolated from Dianchi Lake. Bulletin of Environmental Contamination and Toxicology, 2014, 92(5): 514-519. DOI:10.1007/s00128-014-1217-6 |
| [61] |
Zhou YP, Zhang XF, Li X et al. Evaluation of changes in Microcystis aeruginosa growth and microcystin production by urea via transcriptomic surveys. Science of the Total Environment, 2019, 655: 181-187. DOI:10.1016/j.scitotenv.2018.11.100 |
| [62] |
Zehr JP. Nitrogen fixation by marine cyanobacteria. Trends in Microbiology, 2011, 19(4): 162-173. DOI:10.1016/j.tim.2010.12.004 |
| [63] |
Ye LL, Zhang M, Kong FX et al. Progress and prospect of research on cyanobacteria nitrogen fixing in aquatic ecosystem. J Lake Sci, 2014, 26(1): 9-18. [叶琳琳, 张民, 孔繁翔等. 水生生态系统蓝藻固氮作用研究进展与展望. 湖泊科学, 2014, 26(1): 9-18. DOI:10.18307/2014.0102] |
| [64] |
Gophen M, Smith VH, Nishri A et al. Nitrogen deficiency, phosphorus sufficiency, and the invasion of Lake Kinneret, Israel, by the N2-fixing cyanobacterium Aphanizomenon ovalisporum. Aquatic Sciences, 1999, 61(4): 293-306. DOI:10.1007/PL00001326 |
| [65] |
Zhang B, Zhao ZH, Shen QS et al. Nitrogen fixation of water column in north Taihu Lake and its influencing factors. Environmental Engineering, 2020, 38(6): 121-125. [张波, 赵中华, 申秋实等. 北太湖水体固氮作用及其影响因子. 环境工程, 2020, 38(6): 121-125. DOI:10.13205/j.hjgc.202006019] |
| [66] |
Allen JF, Thake B, Martin WF. Nitrogenase inhibition limited oxygenation of earth's Proterozoic atmosphere. Trends in Plant Science, 2019, 24(11): 1022-1031. DOI:10.1016/j.tplants.2019.07.007 |
| [67] |
Zehr JP, Mellon MT, Zani S. New nitrogen-fixing microorganisms detected in oligotrophic oceans by amplification of nitrogenase (nifH) genes. Applied and Environmental Microbiology, 1998, 64(12): 5067. DOI:10.1128/AEM.64.12.5067-5067.1998 |
| [68] |
Kumar K. Regulation of the nitrogen fixation genes in the heterocystous cyanobacterium Anabaena sp. strain PCC 7120. International Statistical Review, 2011, 60(3): 291-319. |
| [69] |
Martin-Figueroa E, Navarro F, Florencio FJ. The GS-GOGAT pathway is not operative in the heterocysts. Cloning and expression of glsF gene from the Cyanobacterium Anabaena sp. PCC 7120. FEBS Letters, 2000, 476(3): 282-286. DOI:10.1016/S0014-5793(00)01722-1 |
| [70] |
Hoffman BM, Lukoyanov D, Yang ZY et al. Mechanism of nitrogen fixation by nitrogenase: The next stage. Chemical Reviews, 2014, 114(8): 4041-4062. DOI:10.1021/cr400641x |
| [71] |
Zhou YP, Li X, Xia QQ et al. Transcriptomic survey on the microcystins production and growth of Microcystis aeruginosa under nitrogen starvation. Science of the Total Environment, 2020, 700: 134501. DOI:10.1016/j.scitotenv.2019.134501 |
| [72] |
Espinosa J, Rodríguez-Mateos F, Salinas P et al. PipX, the coactivator of NtcA, is a global regulator in cyanobacteria. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(23): E2423-E2430. DOI:10.1073/pnas.1404097111 |
| [73] |
Domínguez-Martín MA, López-Lozano A, Clavería-Gimeno R et al. Differential NtcA responsiveness to 2-oxoglutarate underlies the diversity of C/N balance regulation in Prochlorococcus. Frontiers in Microbiology, 2018, 8: 2641. DOI:10.3389/fmicb.2017.02641 |
| [74] |
Ginn HP, Pearson LA, Neilan BA. NtcA from Microcystis aeruginosa PCC 7806 is autoregulatory and binds to the microcystin promoter. Applied and Environmental Microbiology, 2010, 76(13): 4362-4368. DOI:10.1128/AEM.01862-09 |
| [75] |
Fadi Aldehni M, Sauer J, Spielhaupter C et al. Signal transduction protein PⅡ is required for NtcA-regulated gene expression during nitrogen deprivation in the cyanobacterium Synechococcus elongatus strain PCC 7942. Journal of Bacteriology, 2003, 185(8): 2582-2591. DOI:10.1128/jb.185.8.2582-2591.2003 |
| [76] |
Ramasubramanian TS, Wei TF, Oldham AK et al. Transcription of the Anabaena sp. strain PCC 7120 ntcA gene: Multiple transcripts and NtcA binding. Journal of Bacteriology, 1996, 178(3): 922-926. DOI:10.1128/jb.178.3.922-926.1996 |
| [77] |
Flores E, Herrero A eds. Assimilatory nitrogen metabolism and its regulation. The Molecular Biology of Cyanobacteria. Dordrecht: Kluwer Academic Publishers, 2006: 487-517. DOI: 10.1007/0-306-48205-3_16.
|
| [78] |
Forchhammer K, Lüddecke J. Sensory properties of the PⅡ signalling protein family. The FEBS Journal, 2016, 283(3): 425-437. DOI:10.1111/febs.13584 |
| [79] |
Karl F. Global carbon/nitrogen control by PⅡ signal transduction in cyanobacteria: From signals to targets. FEMS Microbiology Reviews, 2004, 28(3): 319-333. DOI:10.1016/j.femsre.2003.11.001 |
| [80] |
Chen QW, Wang M, Zhang JY et al. Physiological effects of nitrate, ammonium, and urea on the growth and microcystins contamination of Microcystis aeruginosa: Implication for nitrogen mitigation. Water Research, 2019, 163: 114890. DOI:10.1016/j.watres.2019.114890 |
| [81] |
Krausfeldt LE, Farmer AT, Castro HF et al. Nitrogen flux into metabolites and microcystins changes in response to different nitrogen sources in Microcystis aeruginosa NIES-843. Environmental Microbiology, 2020, 22(6): 2419-2431. DOI:10.1111/1462-2920.15032 |
| [82] |
Wagner ND, Quach E, Buscho S et al. Nitrogen form, concentration, and micronutrient availability affect microcystin production in cyanobacterial blooms. Harmful Algae, 2021, 103: 102002. DOI:10.1016/j.hal.2021.102002 |
| [83] |
Gobler CJ, Burkholder JM, Davis TW et al. The dual role of nitrogen supply in controlling the growth and toxicity of cyanobacterial blooms. Harmful Algae, 2016, 54: 87-97. DOI:10.1016/j.hal.2016.01.010 |
| [84] |
Qin BQ. Shallow lake limnology and control of eutrophication in Lake Taihu. J Lake Sci, 2020, 32(5): 1229-1243. [秦伯强. 浅水湖泊湖沼学与太湖富营养化控制研究. 湖泊科学, 2020, 32(5): 1229-1243. DOI:10.18307/2020.0501] |
| [85] |
Wang ZS, Akbar S, Sun YF et al. Cyanobacterial dominance and succession: Factors, mechanisms, predictions, and managements. Journal of Environmental Management, 2021, 297: 113281. DOI:10.1016/j.jenvman.2021.113281 |
| [86] |
Ma XX, Wang YA, Feng SQ et al. Vertical migration patterns of different phytoplankton species during a summer bloom in Dianchi Lake, China. Environmental Earth Sciences, 2015, 74(5): 3805-3814. DOI:10.1007/s12665-015-4279-9 |
| [87] |
Liu L, Xiang A, Feng Y et al. Cyanobacteria diversity in eutrophic lake of Yunnan, China. Advanced Materials Research, 2011, 343/344: 914-919. DOI:10.4028/www.scientific.net/amr.343-344.914 |
 2023, Vol. 35
2023, Vol. 35 

