(2: 湖北工业大学土木建筑与环境学院, 河湖生态修复及藻类利用湖北省重点实验室, 武汉 430068)
(2: Key Laboratory of River and Lake Ecological Restoration and Algae Utilization of Hubei Provincial, College of Civil Architecture and Environment, Hubei University of Technology, Wuhan 430068, P. R. China)
香溪河是三峡水库在湖北境内最大的入库支流[1]。近年来,由于周边磷矿开发和频繁的人为活动导致氮、磷等营养元素不断汇入香溪河,部分河段出现了蓝藻水华问题[2]。当外源污染物沉降至水体表层沉积物后,将不断累积形成内源污染,并在一定条件下向水体释放,进一步影响香溪河水质稳定[3]。微生物是淡水生态系统中的重要组成部分,在沉积物的物质循环中发挥了重要的作用[4]。有研究表明,微生物是沉积物有机碳分解代谢的主要参与者之一[5],还能通过硝化与反硝化作用介导氮循环过程[6]。此外,微生物参与了沉积物中磷的迁移、转化等过程[7]。香溪河中微生物固氮对水体富营养化产生的贡献也不容忽视[8-9]。
有研究表明,三峡库区沉积物的总氮(TN)含量对硝化细菌群落有明显的影响,pH、硝态氮(NO3--N)和氨氮是影响反硝化细菌的主要因素[10]。总无机碳、总有机碳和叶绿素a浓度是影响三峡库区大宁河、香溪河自养微生物分布的主要环境因子[11]。沉积物TN和NO3--N含量对香溪河沉积物中氨氧化古菌和氨氧化细菌的分布有显著的影响,NO3--N与厌氧氨氧化菌的相对丰度呈显著负相关[12]。目前对于香溪河沉积物中微生物时空分布特征的研究主要集中于单一种类微生物[13],而对于沉积物中整个微生物群落的空间分布以及其对环境因子的响应尚不明确。
本研究采集了香溪河上、中、下游共计6个点位的上覆水和沉积物样品,解析了不同点位上覆水和沉积物中理化指标的空间分布特征,采用16S rDNA基因测序分析技术分析表层沉积物中微生物群落多样性和组成,研究了环境因子对微生物群落结构的影响。本研究为进一步探究周边环境对香溪河水质的影响提供了科学依据,有助于揭示香溪河主要水环境问题内在的微生物机制,为改善三峡库区水环境质量和保障流域安全提供参考。
1 材料与方法 1.1 研究区域概况香溪河位于湖北省西部,发源于神农架林区,全长97.3 km,河口距离三峡大坝34.5 km,流域面积3183 km2,自然落差1054 m[14]。自三峡大坝蓄水后,香溪河由自然河道转变为河流型水库,当三峡水库蓄水至175 m时,库湾回水长度约为42 km[15]。香溪河流域矿产资源丰富,其中磷矿储量达3.85亿t,是中国三大富磷矿区之一,磷化工已成为当地支柱产业[16]。近年来,香溪河沿岸磷矿开发地表径流及生活污水汇入香溪河流域[17],同时香溪河上游兴山县人口密度大、农业发达,农业生产中所产生的面源污染也为香溪河带来了大量的氮、磷等污染物[18]。此外,由于香溪河水流速度减慢,水体交换变少,对氮、磷等营养元素的运输能力降低,最终造成了一定程度的富营养化问题[19]。香溪河局部水域多次发生过水华,影响库区水质安全[20]。
1.2 样品采集及保存根据香溪河自然地貌特征及水流方向,自香溪河河口向上游共选择6个采样点,其中S1、S2靠近河口,属于下游点位,S3、S4为中游点位,S5、S6为上游点位。采样点位见图 1。

|
图 1 香溪河采样点位 Fig.1 Sampling sites of Xiangxi River |
2021年8月30日,用取水器分别采集了S1~S6点位的表层、中层、底层上覆水,其中表层上覆水样品采集于水面下2 m处,由于不同河段水深不同,中层、底层上覆水于不同深度处分别采集。具体而言,下游S1、S2分别在距水面30和65 m处,中游S3、S4分别在20和40 m处,上游S5、S6分别在15和30 m处。上覆水样品采集后装入500 mL聚乙烯样品瓶中,4~6 h内运回实验室,立即测定上覆水中氨氮(NH3-N)、磷酸盐(PO43-)、可溶性硫化物(∑H2S)、硫酸根(SO42-)、总氮(TN)和总磷(TP)浓度。
上覆水样品采集完毕后,再使用沉积物柱状采样器分别在每个点位采集3根柱状沉积物样品,每根柱状沉积物代表该点位1个平行样品。沉积物样品厚度不少于30 cm,以5 cm为一层进行切割,现场将各层沉积物样品装入聚乙烯封口袋中,4~6 h内运回实验室。部分新鲜沉积物样品用于测定酸可挥发性硫化物(AVS,主要成分为FeS)、铬还原性硫化物(CRS,主要成分为FeS2)、Fe(Ⅱ)和Fe(Ⅲ),另取部分新鲜沉积物样品于15 mL离心管中,10000转/min离心0.5 min后取上清液,过0.45 μm滤膜,测定间隙水中NH3-N、PO43-、∑H2S和SO42-浓度。此外,将部分沉积物自然风干后研磨,测定TN、TP和总有机碳(TOC)含量。剩余沉积物样品于-20℃保存,备用。
1.3 上覆水与沉积物理化因子测定现场使用多参数测量仪(YSI ProDss,USA)测定采样点位不同深度上覆水中溶解氧(DO)浓度、pH、电导率(σ)和Chl.a浓度。上覆水及沉积物间隙水NH3-N浓度采用纳氏试剂分光光度法测定,PO43-浓度采用钼酸铵比色法测定,TN、TP浓度则在水样中分别加入碱性过硫酸钾,121℃消解30 min,再通过紫外分光光度法和钼酸铵比色法进行测定。∑H2S浓度采用亚甲基蓝比色法测定[21],SO42-浓度采用Tabatabai的浊度比色法进行测定[22]。沉积物中AVS、CRS含量的测定采用冷扩散分级提取法,即取2 g新鲜沉积物于具塞广口瓶中,以10 % 的碱性乙酸锌为吸收液,用9 mol/L盐酸(HCl)对沉积物提取24 h,所得吸收液的硫化物浓度换算得到AVS含量。更换吸收液后,用经过Zn粒还原的Cr(Ⅱ)溶液对沉积物提取24 h,所得吸收液的硫化物浓度经换算得到CRS含量[23]。沉积物中Fe(Ⅱ)、Fe(Ⅲ)含量用Ferrozine比色法测定,在加入10 % 的盐酸羟胺溶液将Fe(Ⅲ)还原为Fe(Ⅱ)后经比色测定[24],沉积物TOC含量采用重铬酸钾-油浴法测定[21]。
1.4 沉积物微生物群落结构分析采用土壤基因组试剂盒(PowerSoil®DNA,MOBIO)对各点位的3份柱状沉积物平行样品分别提取基因组总DNA,用超微量分光光度计(Nanodrop 2000,Wilmington,USA)测定DNA浓度。采用通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3',806R5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rDNA基因的V3~V4区进行PCR扩增,扩增体系为5×FastPfuBuffer 4 μL、2.5 mmol/L dNTPs 2 μL、Forward Primer (5 μmol/L) 0.8 μL、Reverse Primer (5 μmol/L) 0.8 μL、FastPfu Polymerase 0.4 μL、DNA模板10 ng,补充ddH2O至20 μL。PCR扩增的反应体系为:94℃,5 min;30×(94℃,30 s;54℃,30 s;72℃,45 s);72℃ 10 min。修饰后的通用引物含有不同的Tag标签用以区分不同。DNA样品送测序公司进行高通量测序,Illumina测序平台产生的初始数据采用开放的软件包QⅡME(http://qiime.org/)进行分析。测得微生物数据使用R.3.4.3中的Vegan包进行数据预处理、α多样性和相对丰度的计算,并在门和属水平上选择OTU数量排名前20的微生物进行β多样性分析,使用Origin-pro 2018绘制热图完成数据的可视化,通过冗余分析(RDA)判断环境因子与微生物群落分布的关系。构建结构方程模型(structral equation modeling,SEM)分析不同理化指标与微生物丰度之间的关系,通过计算通径系数揭示各个理化因子对微生物生长和繁殖影响的强弱。
1.5 数据处理与分析用Excel 2012软件计算数据平均值、标准差,在SPSS 20软件中采用单因子方差分析(ANOVA)检验水体理化因子间差异的显著性,P < 0.05视为具有显著性差异,使用Duncan法进行事后检验。
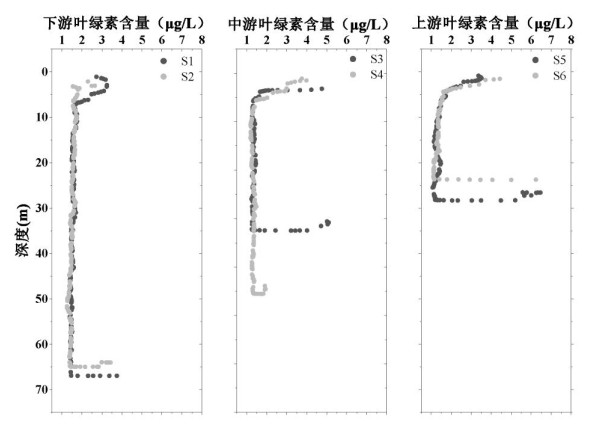
2 结果与讨论 2.1 上覆水中理化因子空间分布特征如附图Ⅰ所示,从下游河口(S1、S2)到上游点位(S5、S6)水深逐渐变浅,且不同点位的Chl.a浓度均表现为随深度先降低后增加的趋势。下游S1、S2点位表层上覆水和底层上覆水的Chl.a浓度均不超过3.75 μg/L,低于中游(S3、S4点位)的平均值4.53 μg/L和上游(S5、S6点位)的平均值4.93 μg/L。藻类可以通过光合作用产生有机物[25],藻类的沉降和死亡将导致藻源有机物累积在表层沉积物,形成以藻类为主的有机质颗粒[26]。因此,香溪河沉降的藻类为沉积物中微生物提供了潜在的有机物来源。
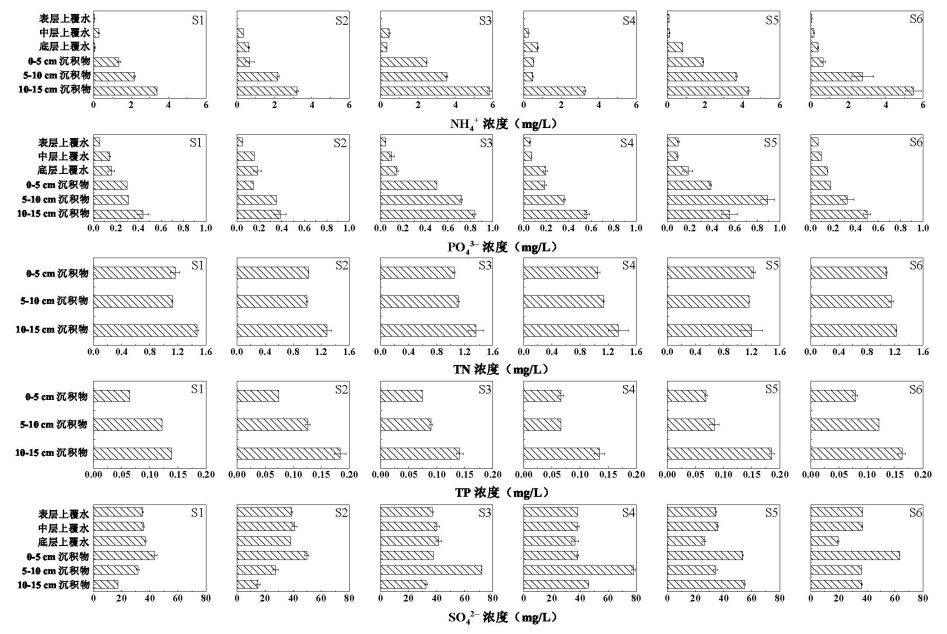
各点位表层上覆水中NH3-N浓度均不超过0.09 mg/L,随着深度增加,上覆水中NH3-N浓度逐渐升高,最大值出现在上游S5点位底层上覆水中,浓度达到0.82 mg/L(附图Ⅱ)。沉积物间隙水中NH3-N浓度显著高于上覆水(P < 0.05),其中10~15 cm间隙水NH3-N平均浓度达到4.25 mg/L,是0~5 cm沉积物间隙水的3.4倍,是底层上覆水的6倍。在6个采样点位中,下游S1、S2点位间隙水NH3-N浓度在2.04~2.30 mg/L之间,低于上游S5、S6点位的3.14 mg/L,上游沉积物间隙水中更高的NH3-N浓度为参与氮循环的微生物提供了潜在的反应底物。香溪河上游兴山县耕地面积达19.51×103 hm2,其施肥季集中在春、夏两季,农业耕作对香溪河中NH3-N浓度影响较大[27],上游农业面源污染可能是导致上游点位上覆水和间隙水中NH3-N浓度较高的重要原因之一(附图Ⅱ)。另外,此次采样正值夏季,长江干流换水量增大,含有较低营养盐浓度的干流水体大量进入下游库湾,对下游水体产生稀释作用,也会导致下游点位NH3-N浓度低于上游和中游[28]。
PO43-浓度垂向分布表现为从上覆水到间隙水逐渐上升(附图Ⅱ)。所有点位的表层上覆水中PO43-浓度均未超过0.09 mg/L,而底层上覆水达到0.15 mg/L以上;间隙水中PO43-浓度均值进一步从0.28 mg/L(0~5 cm沉积物)上升到0.55 mg/L(10~15 cm沉积物)。香溪河流域内磷化工企业分布较多,磷矿废弃地和堆积的矿渣经雨水淋溶后随地表径流流入香溪河[29],同时农业面源污染也是香溪河流域磷的主要来源之一[27]。外源磷的不断输入,最终造成了香溪河沉积物中磷的累积。
近年来,不断增加的人类活动和气候变化导致全球淡水水体中SO42-浓度不断上升,煤炭燃烧和二氧化硫的排放导致中国淡水湖泊、河流中SO42-浓度上升[30],香溪河上、中、下游上覆水中SO42-浓度在30~40 mg/L之间(附图Ⅱ),而间隙水中SO42-浓度表现出一定的空间差异,中游(S3、S4点)及上游(S5和S6点位)间隙水的SO42-浓度分别约为下游的1.7倍和1.5倍(附图Ⅱ)。SO42-为沉积物中微生物硫酸盐还原提供电子受体[31],这表明上游与中游沉积物中微生物硫酸盐还原作用可能更为强烈。
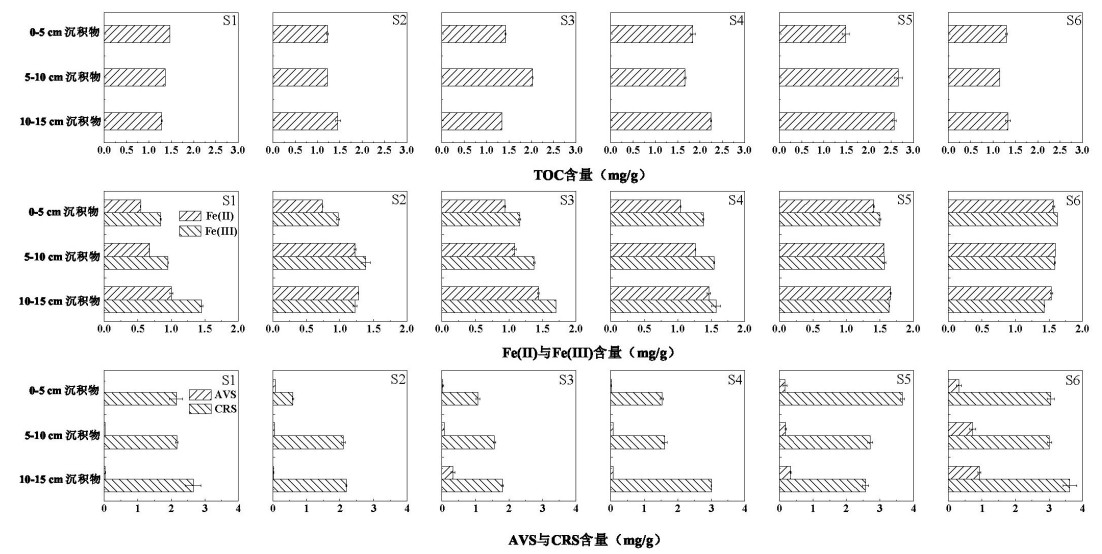
沉积物TOC含量从下游至上游逐渐升高(附图Ⅲ),下游S1和S2沉积物中TOC含量均未超过1.50 mg/g,而上游(S5和S6)达到2.08 mg/g。Fe(Ⅱ)和Fe(Ⅲ)含量自下游S1至上游S6点位逐渐升高(附图Ⅲ),10~15 cm沉积物中Fe(Ⅱ)含量从S1点位的0.91 mg/g上升至S6点位的超过1.40 mg/g,Fe(Ⅲ)含量从1.08 mg/g升高至1.55 mg/g。铁氧化菌和铁还原菌介导了沉积物中微生物铁元素循环[32],香溪河沉积物中铁元素含量的空间差异表明不同点位沉积物中参与铁循环的细菌其分布可能存在一定的差异。
沉积物AVS含量的分布存在明显的垂直差异和空间差异(附图Ⅲ)。在垂直方向上,下游S1、S2点位AVS含量低,且差异不显著(P > 0.05),中游、上游各点位AVS含量均表现为自表层沉积物向底层沉积物逐渐升高,尤其是中游S3点位,AVS含量自0~5 cm层的0.03 mg/g升高至10~15 cm层的0.33 mg/g,升高约10倍。在6个采样点位中,自下游至上游沉积物中AVS含量逐渐升高,S1、S2点位的AVS含量均不超过0.07 mg/g,远低于上游S5、S6平均值(0.44 mg/g)。CRS分布规律与AVS类似,表现为从下游至上游、自表层向深层沉积物的CRS含量逐渐上升(附图Ⅲ)。
2.2 表层沉积物中微生物群落的α多样性分析通过分析不同深度上覆水和沉积物中理化指标的分布特征发现,沉积物是香溪河上覆水中氮、磷等营养元素的重要“源”之一(附图Ⅱ)。表层沉积物是泥水界面物质迁移转化最为活跃的区域[33],其中的微生物在水生态系统的元素地球化学循环中发挥着重要的作用[34]。因此,本研究选择表层沉积物开展微生物群落结构研究。
Shannon指数和Simpson指数反映群落整体的多样性[35],Chao1指数和ACE指数反映群落的丰富度[36]。如附图Ⅳ所示,中游沉积物中微生物群落的Shannon指数、Chao1指数和ACE指数均高于上游和下游。因此,香溪河中游表层沉积物的微生物群落多样性和丰富度高于上游和下游,在整体上呈现出“中间高,两头低”的分布规律。香溪河上游河段与部分支流交汇,下游河段与长江回水交汇,上、下游水体交换较为频繁,而中部水体则相对稳定,为微生物的生长和繁殖提供了良好的环境[37],造成了香溪河不同河段表层沉积物中微生物群落α多样性的差异。此外,在采样过程中发现上游的表层沉积物以无机砂石为主,无法为异养微生物提供足够的有机底物,这可能也是中游微生物相对丰度高于其他河段的原因。
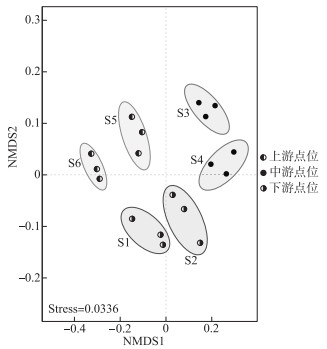
2.3 微生物群落的β多样性非度量多尺度分析(NMDS)是通过对样本的距离矩阵作降维分析简化数据结构,在特定的距离尺度下描述样本的分布特征。如图 2所示,上游点位主要出现在第二象限,中游点位主要出现在第一象限,下游点位主要出现在第三、四象限,这表明香溪河不同河段沉积物中微生物群落存在明显的空间分布差异。
|
图 2 不同点位沉积物微生物群落结构非度量多维尺度(NMDS)排序图 Fig.2 NMDS analysis of microbial community structures in sediments of different sampling sites |
图 3a列举了在门水平上相对丰度前10的微生物,其中变形菌门(Proteobacteria)占主导地位,在各点位相对丰度均超过30 %。另外,相对丰度超过5 % 的菌门包括酸杆菌门(Acidobacteriota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteriota)。其他主要微生物还有疣微菌门(Verrucomicrobiota)、厚壁菌门(Firmicutes)、硝化菌门(Nitrospirota)、脱硫菌门(Desulfobacterota)和浮霉菌门(Planctomycetota)等。

|
图 3 不同点位沉积物中微生物门水平相对丰度(a)及属水平OTU数量(b) Fig.3 Relative abundances of microbiota at the phylum level (a) and OTU numbers at the genus level (b) in sediment samples at different sampling sites |
鞘脂单胞菌属(Sphingomonas)是属水平上在香溪河沉积物中分布最广的微生物类群,各点位相对丰度均在5.6 % ~5.7 % 之间(图 3b)。有研究表明,Sphingomonas参与了沉积物有机物的好氧生物降解过程[38],推测Sphingomonas在香溪河沉积物有机物降解中发挥了重要作用。外新鞘脂菌属(Novosphingobium)能降解2~5环的多环芳烃(PAHs)[39],土生单胞菌属(Terrimonas)对PAHs也有一定的降解能力,且PAHs对其生长和繁殖有一定的促进作用[40]。本研究中Novosphingobium在下游S1点位相对丰度约为6 %,高于其他各点位的4.9 % ~5.1 %;Terrimonas在S1点位的相对丰度也高于其他点位(图 3b)。S1点位地处河口,与长江水体交换频繁,受长江影响较大,有研究表明,丰水期长江干流PAHs总量较高,会对香溪河库湾产生一定的扩散作用[41],这可能是Novosphingobium和Terrimonas在下游点位丰富度最高的原因之一。
硝化螺旋菌属(Nitrospira)是一种硝化细菌,能将NH4+-N氧化为硝态氮(NO3--N)[42]。香溪河中游S3点位0~5 cm沉积物间隙水中NH4+-N含量最高,分别是下游S2点位和上游S6点位的3倍和5倍(附图Ⅱ),这与不同点位Nitrospira的分布差异一致(图 3b),这表明中游沉积物中更高的NH4+-N浓度为Nitrospira的生长和繁殖提供了良好的生存条件。另外,有研究表明,部分Flavobacterium属微生物具有反硝化能力[43],其分布规律与Nitrospira类似,相对丰度的峰值也出现在中游S3点位(图 3b),推测Flavobacterium属微生物可能参与了香溪河沉积物的N循环过程,尤其在中游沉积物中。
水杆菌属(Aquabacterium)作为一种铁氧化细菌,能够能将Fe(Ⅱ)氧化为Fe(Ⅲ)[44]。本研究中Aquabacterium相对丰度在S6点位为6.2 %,约为其他点位的2.5倍(图 3b)。同样作为铁氧化菌[45],泉发菌属(Crenothrix)分布特征与Aquabacterium相反,其在S6点位相对丰度最低(图 3b),这表明Crenothrix与Aquabacterium在香溪河沉积物的铁氧化过程中可能存在一定的竞争关系。另外,有研究表明,Crenothrix主要分布在近海海域、河口以及深海热泉喷口处,当溶解氧浓度较高时其相对丰度升高[46]。香溪河口与长江干流交汇处水体流速较快、水体交换频繁,溶解氧浓度较高,自河口向上游溶解氧浓度逐渐降低[47],这可能是Crenothrix在河口分布较广,上游分布较少的原因。
2.4 微生物群落结构与环境因子间的关系为研究不同环境因子与微生物生长和繁殖的关系,建立路径分析模型探究各因子对微生物丰度的影响,本研究中构建以各个环境因子为影响因素的结构方程模型(图 4a),标准化的路径系数绝对值越大,相对应的理化指标对微生物丰度的影响越强烈。NH3-N和PO43-的标准化路径系数分别为-2.25和2.46,其系数的绝对值远高于其他理化指标,这说明NH3-N和PO43-对微生物丰度的影响起主导作用,NH3-N浓度与微生物丰度呈负相关,而PO43-浓度与微生物丰度呈正相关,此外,SO42-、TP和Fe(Ⅱ)对微生物丰度也有着一定影响。

|
图 4 理化因子对微生物丰度影响的结构方程模型(路径旁显示标准化的路径系数,实线和虚线分别表示P<0.05和P>0.05。箭头上数值的正负分别表示正相关关系和负相关关系)(a)及沉积物微生物群落结构与环境因子的冗余分析(b) Fig.4 Structural equation model of effects of physical and chemical parameters on the abundance of microorganism (The standardized path coefficient is displayed next to the path, and the solid line and dotted line indicate P < 0.05 and P > 0.05, respectively. The positive and negative values on the arrow indicate positive correlation and negative correlation, respectively) (a) and redundancy analysis between microbial community structure and environmental factors in sediments (b) |
采用冗余分析方法(RDA)分析属水平微生物物种丰富度与环境因子间的关系,由于许多环境因子间存在着较强的共线性,因此在进行RDA分析前先采用方差膨胀因子(variance inflation factor, VIF)分析过滤掉VIF值大于10的环境因子[48]。如图 4b所示,第1排序轴与第2排序轴的解释度分别为57.63 % 和12.63 %。环境因子向量的长短代表其对于细菌群落影响的大小,环境变量与物种箭头之间的夹角反映它们之间的相关性,锐角是正相关,夹角越小,正相关性越强,钝角是负相关,钝角越大,负相关性越强[49]。TOC、SO42-、Fe(Ⅱ)、NH3-N和TP对香溪河表层沉积物中微生物的群落结构有着显著的影响(图 4b),这一发现与周边的农业生产和磷矿开采的现状相呼应,反映了人为活动导致的环境污染对香溪河沉积物微生物群落结构的影响。具体到微生物水平来看,在属水平上与TOC含量呈正相关的是Sphingomonas、Novosphingobium和Terrimonas属(图 4b)。另外,NH3-N浓度与Nitrospira和Flavobacterium属的分布呈正相关性,这进一步印证了Nitrospira和Flavobacterium属在氮循环中发挥了一定作用。有研究表明当金属离子的浓度过高超过微生物的耐性值时,会引起微生物的群落结构发生改变[50],本研究中Fe(Ⅱ)与大多数微生物分布呈负相关(图 4a和4b),Fe(Ⅱ)对香溪河微生物群落的影响值得进一步研究。
本研究表明,香溪河上覆水中NH3-N浓度自下游至上游逐渐升高,底层沉积物中NH4+-N浓度高于表层沉积物;PO43-浓度在垂直方向上表现为自表层上覆水至底层沉积物逐渐升高。香溪河各点位底层、中层上覆水中TP浓度均超过长江干流宜昌断面夏季所监测TP浓度(1.0 mg/L)[51],可能对长江水质稳定产生一定的影响,需要加强对香溪河流域氮、磷含量的监测和控制。此外,NH3-N和PO43-的浓度是影响沉积物中微生物生长和繁殖的最主要因素。当前,国家对三峡流域水环境保护高度重视,香溪河沿岸的农业生产、磷矿开采以及周边城镇的生活污水是导致香溪河水体中氮、磷浓度波动的主要原因[52]。为了有效解决香溪河流域水环境污染问题,要坚持在农业生产中对化肥农药减量增效,对磷矿和磷化工企业进行产业升级,对农副产品加工等行业深度治理、综合利用,同时还要完善城镇和农村生活污水收集及处理设施建设,做到点面结合、综合治理。此外,硫酸根浓度的升高是淡水水体发生黑臭的重要诱因之一[53],今后的工作需加强对香溪河流域SO42-浓度水平的监控。
3 结论1) 相较于下游河段,香溪河上、中游上覆水与沉积物中N、P含量更高,上游上覆水中NH3-N平均浓度是下游的1.5倍,上游沉积物间隙水中NH3-N平均浓度为下游的1.4倍。上、中游沉积物间隙水中PO43-平均浓度分别是下游的1.5倍、1.6倍。此外,沉积物中TOC、AVS、CRS、Fe(Ⅱ)和Fe(Ⅲ)含量在上游更高。
2) 中游表层沉积物中微生物多样性和物种丰富度均高于上游和下游。各点位在门水平上和属水平上分别以变形菌门和鞘脂单胞菌属为主。参与氮循环的微生物硝化螺旋菌属和黄杆菌属主要分布在NH3-N浓度较高的中游点位;对多环芳烃(PAHs)有一定降解作用的外新鞘脂菌属和土生单胞菌属主要分布在下游河口点位;由于上游点位Fe(Ⅱ)含量较高,铁氧化菌水杆菌属主要分布在上游点位。
3) NH4+-N、TP、TOC、SO42-和Fe(Ⅱ)是影响香溪河沉积物中微生物群落结构的主要环境因子,这在一定程度上印证了香溪河流域氮、磷污染现状对沉积物中微生生物群落的影响。另一方面,不同河段沉积物中微生物群落结构的差异也可能在一定条件下改变环境因子的分布,进而影响香溪河水质稳定。今后应进一步加强香溪河流域农业生产和磷化工行业监管,完善周边区域生活污水收集与处理。
4 附录附图Ⅰ~Ⅳ见电子版(DOI:10.18307/2023.0208)。
|
附图Ⅰ 不同深度上覆水中叶绿素浓度 AttachedFigure1 Distribution of Chlorophyll-a concentration in the overlying water at different depth |
|
附图Ⅱ 上覆水与间隙水理化指标剖面特征 AttachedFigure2 Profiles of physicochemical parameters in overlying water and pore-water |
|
附图Ⅲ 表层沉积物理化指标剖面特征 AttachedFigure3 Profiles of physicochemical parameters in surface sediments |

|
附图Ⅳ 微生物群落α多样性指数 AttachedFigure4 Alpha diversity parameters of microbial community |
| [1] |
Tan L, Shen HL, Wang L et al. Trophic status of the mainstream of Three Gorges Reservoir and Xiangxi Bay and its response to hydrological conditions. Resources and Environment in the Yangtze Basin, 2021, 30(6): 1488-1499. [谭路, 申恒伦, 王岚等. 三峡水库干流与香溪河库湾水体营养状态及其对水文条件的响应. 长江流域资源与环境, 2021, 30(6): 1488-1499.] |
| [2] |
Liu XY, Song LX, Ji DB et al. Effect of the rainfall on extinction of cyanobacteria bloom and its mechanism analysis. Environmental Science, 2018, 39(2): 774-782. [刘心愿, 宋林旭, 纪道斌等. 降雨对蓝藻水华消退影响及其机制分析. 环境科学, 2018, 39(2): 774-782. DOI:10.13227/j.hjkx.201708203] |
| [3] |
Wang B, Huang TL, Li N et al. Spectral characteristics of dissolved organic matter in sediment and overlying water of water source reservoir. China Environmental Science, 2022, 42(3): 1309-1317. [王斌, 黄廷林, 李楠等. 水源水库沉积物及其上覆水DOM光谱特征. 中国环境科学, 2022, 42(3): 1309-1317. DOI:10.3969/j.issn.1000-6923.2022.03.036] |
| [4] |
Li PY, An QR, Wang XH et al. Analysis on diversity and structure of microbial community in river sediment of Siping section of Liaohe River. Environmental Science, 2022, 43(5): 2586-2594. [李鹏洋, 安启睿, 王新皓等. 辽河四平段流域河流沉积物微生物群落多样性和结构分析. 环境科学, 2022, 43(5): 2586-2594. DOI:10.13227/j.hjkx.202107032] |
| [5] |
Wu QL, Xing P, Li HB et al. Impacts of regime shift between phytoplankton and macrophyte on the microbial community structure and its carbon cycling in lakes. Microbiology China, 2013, 40(1): 87-97. [吴庆龙, 邢鹏, 李化炳等. 草藻型稳态转换对湖泊微生物结构及其碳循环功能的影响. 微生物学通报, 2013, 40(1): 87-97. DOI:10.13344/j.microbiol.china.2013.01.003] |
| [6] |
Chen ZY, Zhang ZW, Zhang TN et al. Temporal and spatial distribution characteristics and driving factors of denitrification bacterial community structure from landscape water in Hebei Province: Taking Shijiazhuang as example. Environmental Science, 2022, 43(2): 813-825. [陈召莹, 张紫薇, 张甜娜等. 河北省典型景观水体反硝化菌群落时空分布特征及驱动因素: 以石家庄为例. 环境科学, 2022, 43(2): 813-825. DOI:10.13227/j.hjkx.202104341] |
| [7] |
Li QG, Tian Y, Liu L et al. Research progress on release mechanisms of nitrogen and phosphorus of sediments in water bodies and their influencing factors. Wetland Science, 2022, 20(1): 94-103. [李乾岗, 田颖, 刘玲等. 水体中沉积物氮和磷的释放机制及其影响因素研究进展. 湿地科学, 2022, 20(1): 94-103.] |
| [8] |
She WY, Feng C, Yang J et al. Nitrogen-fixing microbial diversity and its influencing environmental variables in waters Three Gorges Reservoir. Acta Microbiologica Sinica, 2019, 59(6): 1127-1142. [佘伟钰, 冯灿, 杨渐等. 三峡库区水体中固氮微生物多样性及其影响因素. 微生物学报, 2019, 59(6): 1127-1142.] |
| [9] |
Yang Y, Wang H, Li KH et al. Community structure and function predication of bacterial communities in the upper reaches of the Three Gorges of the Yangtze River. Acta Microbiologica Sinica, 2022, 62(4): 1401-1415. [杨艳, 王浩, 李凯航等. 长江三峡上游水域细菌群落结构与功能预测. 微生物学报, 2022, 62(4): 1401-1415.] |
| [10] |
Liu M, Huang L, Gao X et al. Impact of microorganism in subsurface flow wetland on purification efficiency for slightly polluted river water in Three Gorges Reservoir Region. J Lake Sci, 2012, 24(5): 687-692. [刘明, 黄磊, 高旭等. 潜流湿地中微生物对三峡库区微污染水净化效果的影响. 湖泊科学, 2012, 24(5): 687-692. DOI:10.18307/2012.0507] |
| [11] |
Zheng JX, Hu JX, Chi SY et al. Distribution of bacterial communities in Daning River and Xiangxi River. Environmental Science & Technology, 2016, 39(8): 171-177. [郑金秀, 胡菊香, 池仕运等. 大宁河与香溪河细菌群落分布. 环境科学与技术, 2016, 39(8): 171-177.] |
| [12] |
Zhao ZH, Li YQ, Pi HT et al. Temporal and spatial distribution of anaerobic ammonium oxidizing bacteria in sediments of Xiangxi River of the Three Gorges Reservoir Area. Journal of Biology, 2021, 38(2): 70-74. [赵折红, 李月秋, 皮海廷等. 三峡库区香溪河沉积物厌氧氨氧化菌的时空分布. 生物学杂志, 2021, 38(2): 70-74.] |
| [13] |
Chen GH, Yuan YJ, Bi YH et al. Distribution characteristics of heterotrophic bacteria and phosphate-solubilizing bacteria in Xiangxi Bay. Ecological Science, 2018, 37(3): 107-113. [陈国华, 袁轶君, 毕永红等. 香溪河库湾水体异养细菌及无机磷细菌分布特征. 生态科学, 2018, 37(3): 107-113.] |
| [14] |
Yang F, Ji DB, Wang LJ et al. Vertical distribution characteristics of dissolved oxygen and chlorophyll a in typical tributaries during the impoundment period of the Three Gorges Reservoir. Environmental Science, 2020, 41(5): 2107-2115. [杨凡, 纪道斌, 王丽婧等. 三峡水库汛后蓄水期典型支流溶解氧与叶绿素a垂向分布特征. 环境科学, 2020, 41(5): 2107-2115. DOI:10.13227/j.hjkx.201909026] |
| [15] |
Tang T, Cai QH, Liu JK. Using epilithic diatom communities to assess ecological condition of Xiangxi River system. Environmental Monitoring and Assessment, 2006, 112(1/2/3): 347-361. DOI:10.1007/s10661-006-7666-6 |
| [16] |
Jiang LG, Liang B, Zhang MZ et al. Phosphorus leaching characteristics of phosphate waste rock deposited within Xiangxi River watershed. Chinese Journal of Environmental Engineering, 2015, 9(7): 3531-3537. [姜利国, 梁冰, 张梦舟等. 三峡库区香溪河流域磷矿废石磷素浸出特性. 环境工程学报, 2015, 9(7): 3531-3537.] |
| [17] |
Zheng FY, Tan L, Chen X et al. Spatial distribution of nitrogen and phosphorus, and pollution evaluation for sediment in Xiangxi Bay, Three Gorges Reservoir. Asian Journal of Ecotoxicology, 2018, 13(4): 49-59. [郑飞燕, 谭路, 陈星等. 三峡水库香溪河库湾氮磷分布状况及沉积物污染评价. 生态毒理学报, 2018, 13(4): 49-59.] |
| [18] |
Tian P, Wang LJ, Song LX et al. Water pollution characteristics and influencing factors of typical tributaries of Three Gorges Reservoir in different periods. Acta Scientiae Circumstantiae, 2021, 41(6): 2182-2191. [田盼, 王丽婧, 宋林旭等. 三峡水库典型支流不同时期的水质污染特征及其影响因素. 环境科学学报, 2021, 41(6): 2182-2191. DOI:10.13671/j.hjkxxb.2021.0101] |
| [19] |
Sang WL, Yang X, Song LX et al. Variation of temporal and spatial distributions of nutrients in Xiangxi Bay(2008-2015). Journal of Hydroecology, 2018, 39(4): 38-45. [桑文璐, 杨霞, 宋林旭等. 香溪河营养盐时空分布趋势研究. 水生态学杂志, 2018, 39(4): 38-45. DOI:10.15928/j.1674-3075.2018.04.006] |
| [20] |
Chen SM, Wang W, Zhao Y et al. Water eutrophication status and control strategy of tributaries in the Three Gorges Reservoir region. Environmental Engineering, 2019, 37(4): 32-37. [陈昭明, 王伟, 赵迎等. 三峡水库支流水体富营养化现状及防治策略. 环境工程, 2019, 37(4): 32-37. DOI:10.13205/j.hjgc.201904007] |
| [21] |
Chen M, Jiang HL. Relative contribution of iron reduction to sediments organic matter mineralization in contrasting habitats of a shallow eutrophic freshwater lake. Environmental Pollution, 2016, 213: 904-912. DOI:10.1016/j.envpol.2016.03.061 |
| [22] |
Huang JF, Ni JZ, Tong C et al. Methane production and inhibition via sulfate reduction in a brackish marsh of the Min River Estuary. Acta Scientiae Circumstantiae, 2015, 35(3): 862-872. [黄佳芳, 倪进治, 仝川等. 闽江口半咸水沼泽湿地土壤甲烷产生过程及硫酸盐还原对其抑制作用研究. 环境科学学报, 2015, 35(3): 862-872. DOI:10.13671/j.hjkxxb.2014.0850] |
| [23] |
Chen M, Li XH, He YH et al. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake. Water Research, 2016, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| [24] |
Pan XF, Yan BX, Wang LX. Research on iron in marshy rivers of the Sanjiang plain. Environmental Science, 2010, 31(9): 2042-2047. [潘晓峰, 阎百兴, 王莉霞. 三江平原河水中铁的形态研究. 环境科学, 2010, 31(9): 2042-2047. DOI:10.13227/j.hjkx.2010.09.011] |
| [25] |
Zhang HF, Wu XS, Wang B et al. Research progress of the enrichment mechanism of sedimentary organics in lacustrine basin. Acta Sedimentologica Sinica, 2016, 34(3): 463-477. [张慧芳, 吴欣松, 王斌等. 陆相湖盆沉积有机质富集机理研究进展. 沉积学报, 2016, 34(3): 463-477.] |
| [26] |
Mao XJ, Huang YL, Li N et al. Sources and distribution of phosphorus in sediments of the Jinpen Reservoir. Environmental Science, 2019, 40(6): 2738-2744. [毛雪静, 黄廷林, 李楠等. 金盆水库沉积物磷的来源及分布特征. 环境科学, 2019, 40(6): 2738-2744. DOI:10.13227/j.hjkx.201810220] |
| [27] |
Ye XC, Meng YK, Zhang YS et al. Variation characteristics of trophic states of Xiangxi River backwater area in Three Gorges Reservoir and its driving factors. Water Resources Protection, 2018, 34(4): 80-85, 92. [叶许春, 孟元可, 张永生等. 三峡库区香溪河回水区营养状态变化特征与驱动因子. 水资源保护, 2018, 34(4): 80-85, 92.] |
| [28] |
Jiang DG, Dai HC, Wang BW et al. Causing analysis on nutrients spatial difference in Xiangxi Bay of the Three Gorges Reservoir. Journal of Hydraulic Engineering, 2013, 44(5): 562-569. [蒋定国, 戴会超, 王冰伟等. 香溪河库湾春季营养盐空间差异性成因分析. 水利学报, 2013, 44(5): 562-569.] |
| [29] |
Wu XH, Li C, Chen L et al. Response mechanism of Peridiniopsis bloom to phosphorus in Xiangxi River Bay of Three Gorges Reservoir. J Lake Sci, 2017, 29(5): 1054-1060. [吴兴华, 李翀, 陈磊等. 三峡水库香溪河库湾拟多甲藻(Peridiniopsis)水华对环境中磷的响应机制. 湖泊科学, 2017, 29(5): 1054-1060. DOI:10.18307/2017.0503] |
| [30] |
Chen M, Jiao YY, Zhang YQ et al. Succession of sulfur bacteria during decomposition of cyanobacterial bloom biomass in the shallow Lake Nanhu: An ex situ mesocosm study. Chemosphere, 2020, 256: 127101. DOI:10.1016/j.chemosphere.2020.127101 |
| [31] |
Wang YX, Wu Y, Zhang HL et al. Microbial sulfur metabolism and the bioecological relationships driven by sulfur metabolism. Acta Microbiologica Sinica, 2022, 62(3): 930-948. [王亚鑫, 吴玉, 张洪琳等. 微生物硫代谢及其驱动下建立的生物生态关系. 微生物学报, 2022, 62(3): 930-948.] |
| [32] |
Wu SJ, Wang X, Ji QY et al. Iron-sulfur distribution and its environmental significance in three typical areas of western Lake Taihu. J Lake Sci, 2019, 31(4): 950-960. [吴松峻, 汪旋, 季秋忆等. 太湖西岸典型区域沉积物的硫铁分布特征及环境意义. 湖泊科学, 2019, 31(4): 950-960. DOI:10.18307/2019.0408] |
| [33] |
Zhang Q, Dong J, Ji FY et al. Spectral characteristics of dissolved organic matter in overlying water and pore water of newly-built artificial lake sediments. J Lake Sci, 2018, 30(1): 112-120. [张倩, 董靖, 吉芳英等. 新建人工深水湖泊沉积物上覆水和孔隙水中溶解性有机质的光谱特征. 湖泊科学, 2018, 30(1): 112-120. DOI:10.18307/2018.0111] |
| [34] |
Wang DS, Men B, Zhang MY. Sediment water ecotone and sediment removal of shallow lake: A case study of Baiyangdian lake in Xiongan New Area. Acta Scientiae Circumstantiae, 2020, 40(5): 1550-1559. [王东升, 门彬, 张美一. 论浅水湖泊中的水固交错带与科学清淤规划——以雄安新区白洋淀为例. 环境科学学报, 2020, 40(5): 1550-1559. DOI:10.13671/j.hjkxxb.2019.0457] |
| [35] |
Chen ZY, Zhang TN, Zhang ZW et al. Aerobic denitrifying bacteria community structure and response of aerobic denitrifying bacteria to dissloved organic matter in the sediments in Lake Baiyangdian in the spring. J Lake Sci, 2022, 34(2): 538-552. [陈召莹, 张甜娜, 张紫薇等. 白洋淀春季沉积物好氧反硝化菌群落结构特征及对溶解性有机物的响应. 湖泊科学, 2022, 34(2): 538-552. DOI:10.18307/2022.0215] |
| [36] |
Hu YX, Peng Y, Li RW et al. Plankton diversity and community characteristics in Danjiangkou Reservoir based on environmental DNA metabarcoding. J Lake Sci, 2021, 33(6): 1650-1659. [胡愈炘, 彭玉, 李瑞雯等. 基于环境DNA宏条形码的丹江口水库浮游生物多样性及群落特征. 湖泊科学, 2021, 33(6): 1650-1659. DOI:10.18307/2021.0604] |
| [37] |
Zhao YL, Zhang QQ, Liu XH et al. Impacts of three georges dam on structure and diversity of the benthic microorganism community in Xiangxi River. Journal of Hydroecology, 2017, 38(3): 45-50. [赵媛莉, 张倩倩, 刘新华等. 三峡大坝对香溪河底栖微生物群落结构和多样性的影响. 水生态学杂志, 2017, 38(3): 45-50. DOI:10.15928/j.1674-3075.2017.03.007] |
| [38] |
Asaf S, Numan M, Khan AL et al. Sphingomonas: from diversity and genomics to functional role in environmental remediation and plant growth. Critical Reviews in Biotechnology, 2020, 40(2): 138-152. DOI:10.1080/07388551.2019.1709793 |
| [39] |
Yan SD, Liu LJ, Cao YZ et al. Isolation, identification, and degradation characteristics of three effective PAHs degradation strains. Chinese Journal of Applied Ecology, 2021, 32(12): 4439-4446. [闫双堆, 刘利军, 曹燕篆等. 3株多环芳烃高效降解菌株的分离鉴定及降解特性. 应用生态学报, 2021, 32(12): 4439-4446. DOI:10.13287/j.1001-9332.202112.028] |
| [40] |
Wang Q, Zheng R, Sun XT et al. Effects of Comamonas testosteroni on PAHs degradation and bacterial community structure in Leymus chinensis rhizosphere soil. Chinese Journal of Biotechnology, 2020, 36(12): 2657-2673. [王乔, 郑瑞, 孙学婷等. 睾丸酮丛毛单胞菌对羊草根际土壤PAHs降解及细菌群落结构的影响. 生物工程学报, 2020, 36(12): 2657-2673. DOI:10.13345/j.cjb.200381] |
| [41] |
Huang YP, Jin L, Zhu C et al. Temporal-spatial distribution and risk assessment of polycyclic aromatic hydrocarbons in soil of Xiangxi Bay in Three Gorges Reservoir area. Environmental Science, 2021, 42(8): 3808-3819. [黄应平, 金蕾, 朱灿等. 三峡库区香溪河库湾土壤多环芳烃时空分布特征及风险评价. 环境科学, 2021, 42(8): 3808-3819. DOI:10.13227/j.hjkx.202012149] |
| [42] |
Shi WY, Zhang J. Research progress of Nitrobacter and Nitrospira in the nitrogen removal system. Applied Chemical Industry, 2020, 49(10): 2581-2585. [史文燕, 张健. 硝化杆菌(Nitrobacte)和硝化螺菌(Nitrospira)在脱氮系统中的研究进展. 应用化工, 2020, 49(10): 2581-2585.] |
| [43] |
Lu Y, Zeng J, Zhao J et al. Spatial characteristics of denitrifying bacterial communities in different habitats from typical steppe. Microbiology China, 2019, 46(4): 707-720. [芦燕, 曾静, 赵吉等. 典型草原区不同生境反硝化菌群的空间特征. 微生物学通报, 2019, 46(4): 707-720. DOI:10.13344/j.microbiol.china.180274] |
| [44] |
Xu L, Su JF, Ali A et al. Denitrification performance of nitrate-dependent ferrous (Fe2+) oxidizing Aquabacterium sp. XL4: Adsorption mechanisms of bio-precipitation of phenol and estradiol. Journal of Hazardous Materials, 2022, 427: 127918. DOI:10.1016/j.jhazmat.2021.127918 |
| [45] |
Bai S, Yang ML, Chen Z et al. Distribution of functional microorganisms and its significance for iron, sulphur, and nitrogen cycles in reservoir sediments. Acta Geochimica, 2021, 40(6): 961-972. DOI:10.1007/s11631-021-00492-0 |
| [46] |
Huang Y, Liu SJ, Jiang CY. Microbiologically influenced corrosion and mechanisms. Microbiology China, 2017, 44(7): 1699-1713. [黄烨, 刘双江, 姜成英. 微生物腐蚀及腐蚀机理研究进展. 微生物学通报, 2017, 44(7): 1699-1713. DOI:10.13344/j.microbiol.china.170197] |
| [47] |
Yang LN, Li ZY, Zhang XQ. Distribution characteristics of dissolved oxygen and mechanism of hypoxia in the upper estuarine zone of the Daliaohe River. Environmental Science, 2011, 32(1): 51-57. [杨丽娜, 李正炎, 张学庆. 大辽河近入海河段水体溶解氧分布特征及低氧成因的初步分析. 环境科学, 2011, 32(1): 51-57. DOI:10.13227/j.hjkx.2011.01.007] |
| [48] |
Zhang J, Shang YM, Xie JY et al. Geographic distribution and co-occurrence characteristics of soil bacterial and archaeal community in the five largest freshwater lake wetlands in China. Chinese Journal of Ecology, 2020, 39(12): 4131-4139. [张杰, 尚妍萌, 谢钧宇等. 我国五大淡水湖泊湿地土壤细菌和古菌群落的地理分布及共现性特征. 生态学杂志, 2020, 39(12): 4131-4139. DOI:10.13292/j.1000-4890.202012.038] |
| [49] |
Li B, Yang AJ, Hu X et al. Bacterial community structure in reservoir sediments under the influence of antimony ore waste water. Microbiology China, 2021, 48(9): 2956-2971. [李彬, 杨爱江, 胡霞等. 锑矿废水影响下水库沉积物中细菌群落结构特征研究. 微生物学通报, 2021, 48(9): 2956-2971. DOI:10.13344/j.microbiol.china.201128] |
| [50] |
Yu H, An YJ, Jin DC et al. Effects of chromium pollution on soil bacterial community structure and assembly processes. Environmental Science, 2021, 42(3): 1197-1204. [于皓, 安益君, 金德才等. 铬污染对土壤细菌群落结构及其构建机制的影响. 环境科学, 2021, 42(3): 1197-1204. DOI:10.13227/j.hjkx.202010209] |
| [51] |
Yang P, Lu L, Xiang CG et al. Analysis of variation trend of nitrogen and phosphorus concentrations in the main stream of the Yangtze River. Environmental Engineering, 2019, 37(2): 178175-178183. [杨盼, 卢路, 向晨光等. 长江干流氮、磷浓度变化趋势分析. 环境工程, 2019, 37(2): 178175-178183. DOI:10.13205/j.hjgc.201902033] |
| [52] |
Sun TT, Tang T, Shen HL et al. Spatial distributions of carbon, nitrogen and phosphorus in various mediums of the Xiangxi River watershed and their correlations. Resources and Environment in the Yangtze Basin, 2015, 24(5): 853-859. [孙婷婷, 唐涛, 申恒伦等. 香溪河流域不同介质中碳、氮、磷的分布特征及相关性研究. 长江流域资源与环境, 2015, 24(5): 853-859.] |
| [53] |
Cai P, Wu YC, Liu X et al. The contribution of sediment and algal to the formation of black bloom and their potential to supply the black substance in waters in Lake Taihu. J Lake Sci, 2015, 27(4): 575-582. [蔡萍, 吴雨琛, 刘新等. 底泥和藻体对太湖湖泛的诱发及水体致黑物的供应潜力. 湖泊科学, 2015, 27(4): 575-582. DOI:10.18307/2015.0403] |
 2023, Vol. 35
2023, Vol. 35 

