(2: 华中农业大学资源与环境学院, 武汉 430070)
(3: 北京师范大学环境学院, 北京 100875)
(2: Laboratory of Eco-Environmental Engineering Research, Huazhong Agricultural University, Wuhan 430070, P.R.China)
(3: School of Environment, Beijing Normal University, Beijing 100875, P.R.China)
目前我国已建成近10万座水库[1],水利水电工程极大地改变了流域生态环境格局和氮循环[2-3]。深刻认知水利水电工程的生态环境效应,成为流域生态环境、可持续发展研究领域的热点问题。氮是所有生物的重要组成部分,也是限制地球生命的主要营养元素。在自然界里,氮以分子态、无机氮和有机氮形式存在,3种形式的氮在大气、水、生物、土壤等圈层的相互转化及运动构成了氮的生物地球化学循环[4]。
自然水陆交错带具有频繁的干湿交替环境,被认为是反硝化脱氮的热区[5-7],是清除流域水体中活性氮污染的重要场所。水库消落带位于水陆交错区,是受人为水位调蓄而形成的特殊生态系统,其反自然节律的水位波动严重打破了原有土壤-植物-微生物的组成格局[8-9]。三峡水库是我国重要的战略性淡水资源库,生态环境脆弱,水环境问题复杂。三峡水库采用“冬蓄夏排”的调水运行方式,水位在175 m与145 m间波动,形成了面积约为302 km2的消落带(《2020年度三峡工程公报》)[10-11]。
近年来,三峡支流水华问题备受关注,氮污染作为水华暴发的主要原因之一成为研究热点。水位周期性涨落对消落带氮循环过程具有复杂且显著的影响。一方面消落带起着“源”与“汇”的作用[12]。另一方面消落带处于水陆交错带,是部分植物与微生物的载体,通过植物与微生物参与氮循环影响水体中的氮素。而水位波动导致的环境条件变化,又极大地影响了消落带植物和微生物,间接地影响了水体中的氮素。图 1展示了三峡水库高水位运行11年后形成的消落带生态系统景观。

|
图 1 三峡水库消落带出露期茂盛的植物群落景观(2021年8月摄于涪陵区) Fig.1 Plant community in the water-level-fluctuation zone of Three Gorges Reservoir during outcropping period(photo taken in Fuling District, August 2021) |
水陆交错带是氮素地球化学循环的热区,人为干扰和自然演化造就了水库消落带的复杂环境,这对理解氮素在消落带中的循环转化过程形成挑战。深入研究该问题,可进一步揭示氮循环功能微生物、植物和土壤间的相互作用机理,对丰富氮循环理论及水体富营养化治理实践具有指导意义。
1 三峡水库消落带氮研究概况在中国知网CNKI(China National Knowledge Infrastructure)平台上,以“消落带”和“氮”为关键词检索,以“2003—2021年”为发表时间,在“中国学术期刊网络出版总库”中,初筛出120篇文献,然后通过人工阅读题目筛选出三峡消落带氮相关中文文献共计90篇;以Web of Science为相关英文文献的检索工具,以“Web of Science核心合集”为数据源,检索条件为标题“Three Gorges”+and“nitrogen”+and“riparian zone”+or“littoral zone”+or“drawdown zone”+or “water level fluctuation zone”+or“hydro-fluctuation belt”的文章,出版日期为2003-01-01至2021-12-31,初筛出510篇文献,然后通过逐篇阅读题目摘要,筛选出在期刊上发表的三峡消落带与氮素相关的论文共63篇。三峡水库消落带氮相关文献的研究对象主要包括消落带土壤[13-16]、植物[17-18]和微生物[11, 18],涵盖土壤学、生物学和地球化学(表 1)。
| 表 1 水库消落带氮的主要研究 Tab. 1 Researches on N in the water-level-fluctuation zone of reservoirs |
此外,还开展了消落带地质地貌、水文环境、人为活动干扰等对氮素的影响研究。下面将从消落带氮的形态及主要循环过程、消落带植物对土壤氮循环的影响、消落带氮循环相关温室气体排放研究等方面展开论述。
2 消落带氮的形态及主要循环过程 2.1 消落带土壤中氮的主要存在形式和分布土壤氮含量与成土母质、气候条件、植被群落、水文条件及农耕等人为活动密切相关。消落带土壤氮的迁移转化过程主要包括氮的淋溶、氨挥发、铵的吸附和固定、有机氮矿化和硝化-反硝化等[33]。消落带作为临近水体的最后一道生态屏障带,在落干期,对进入消落带的氮等非点源污染的截留和去除具有显著作用,但是过量的外源氮素输入会引起毗邻水域的水环境问题[12]。消落带土壤在淹水条件下可向水体释放氮[12]。
消落带土壤环境中总氮(TN)的主要赋存形态是有机氮,占92% ~98% [34],但只有当微生物将土壤中的有机氮或大气中的氮矿化成铵态氮(NH4+-N)、硝态氮(NO3--N)等生物可利用氮(bioavailable nitrogen)时,才能被大多数植物吸收和利用。土壤氮素结合态可划分为可转化态氮(transformable nitrogen, TFN)和非可转化态氮(NTFN)[35]。其中消落带中的可转化氮是造成邻近水体氮素污染的关键因素,也是研究的重点。可转化态氮包括离子交换态氮(IEFN)、碳酸盐结合态氮(CFN)、铁锰氧化物结合态氮(IMOFN)和有机及硫化物结合态氮(OSFN)4种形态。其中土壤离子交换态氮在雨水淋溶及淹水条件下能向周边水体释放,同时可与其他3种可转化态氮之间相互转化[36]。CFN可酸性溶出转化为IEFN;IMOFN在氧化还原电位较低的条件下可还原溶解转化为IEFN[37-39];OSFN能够被微生物矿化转化为IEFN[40-42]。另一方面,IEFN可以被土壤矿物固定形成CFN、IMOFN[43],以及被微生物同化形成OSFN[44](图 2)。对三峡库区万州段消落带土壤可转化态氮(TFN)的研究发现,其优势组分是有机态和硫化物结合态氮(OSFN)[19, 32],含量上OSFN>IMOFN>IEFN>CFN[32]。

|
图 2 土壤可转化态氮间的相互转化 Fig.2 Interconversion of soil convertible nitrogen |
有研究分析了不同类型氮输入对三峡库区消落带紫色潮土氮赋存形态的影响,分别添加了NaNO3、NH4NO3、(NH4)2SO4、CO(NH2)2并进行了淹水-落干不同水文条件的处理,通过连续分级提取法测定土壤氮赋存形态含量。结果表明,落干期和淹水期,IEFN含量及其变化在氮添加总量中的占比均表现为NaNO3添加下最高、CO(NH2)2添加下最低,且落干期大于淹水期;OSFN含量及其变化占比则与IEFN相反。落干期和淹水期,外源氮主要表现为向OSFN转化,此外,外源氮在落干期还存在向IMOFN转化的过程。结果表明,控制落干期消落带土壤氮输入(特别是硝态氮)是预防三峡水库富营养化的有效途径[45]。
空间分布上,同一样带落干期消落带TN和多数不同形态氮的含量都随着高程的降低而降低[13, 16, 23, 46]。时间分布上,干湿交替过程中,淹没期各种形态的氮含量均下降,落干期消落带TN含量相对于淹没前会略有上升[21, 33],这增加了再次淹水后沉积物向上覆水输送氮素的风险。短期植被恢复和水淹后,土壤无机氮浓度(NO3--N和NH4+-N)显著降低[24]。也有研究表明土壤类型对消落带落干-淹水过程TN含量变化有显著影响[34]。多次水位涨落后消落带土壤TN和可溶性有机氮(DON)的含量均会有明显下降[13, 47]。
针对三峡库区开州段彭溪河消落带的相关研究发现,土壤可酸水解态氮(acid hydrolysable nitrogen, AHN)是消落带主要的有机氮组分,占TN的77.07%。氨基酸氮(amino-acid nitrogen, AAN)、铵态氮(ammonium nitrogen, AN)、氨基糖氮(amino-sugar nitrogen, ASN)和未知的可水解氮(hydrolyzable unidentified nitrogen, HUN)分别平均占AHN的34.70%、20.25%、15.52% 和29.24% [46]。AHN是彭溪河水体富营养化的主要驱动因子之一[46]。
2.2 微生物驱动的消落带氮循环过程消落带以土壤为主要载体,由代谢多样性微生物组成的复杂网络进行各种氮转化反应,形成复杂的氮循环过程。这个复杂网络决定了生物可利用氮的有效性[48]。传统的土壤氮循环过程由固氮、硝化、反硝化3个部分构成,然而一些新发现的微生物驱动的氮转化反应,也被认为在消落带氮循环过程中发挥了重要的作用。目前在河、湖、海滨岸带等水陆交错区的微生物驱动的氮循环研究较多。如Costello等指出,在河流滨岸生态系统,微生物对氮等养分的吸收、固定、转化和释放等生物地球化学循环过程的贡献至关重要[49]。Farrer等研究了固氮菌在滨海恢复中的重要生态作用[50]。Starr等的研究发现与建造30年的人工湿地相比,天然湿地中的真菌对反硝化作用的贡献约多30%,真菌生物量普遍更高。说明真菌生物量可能会限制人工湿地脱氮的恢复,真菌反硝化可能是盐沼生态系统脱氮的重要途径[51]。Zhu等在白洋淀的研究发现水陆交错带是厌氧氨氧化的热区[52]。而水库消落带与其他自然流域水陆交错带生态系统相比,最大的区别是人工水位调蓄,可能会影响某些氮转化过程的发生时间。其中固氮作用、硝化作用主要发生在消落带落干期,反硝化、厌氧氨氧化主要发生在消落带缺氧环境中,如落干初期或消落带的近水边界;完全氨氧化主要发生在消落带落干初期缺乏氨的环境中,硝酸盐异化还原为铵、亚硝酸盐依赖型厌氧甲烷氧化主要发生在长期淹水缺氧的低高程消落带区域[53-55]。
2.2.1 固氮作用(Nitrogen fixation)水库消落带的固氮作用主要发生在低水位期,即消落带出露期。固氮作用的具体过程是通过固氮微生物固氮酶的催化作用,将N2还原为NH3(N2→NH3),进而转化为有机氮化合物[56]。固氮酶有3种不同类型:铁-铁(FeFe)、钒-铁(VFe)和钼-铁(MoFe)固氮酶。它们具有相似的序列、结构和功能特性,但它们的金属辅因子(cofactor)不同[48]。土壤中的棕色固氮菌(Azotobacter vinelandii)可以编码所有3种固氮酶[57]。由于钼元素(Mo)在陆地环境系统中很少见,一定程度上限制了陆地生态系统中的固氮作用[56]。固氮酶广泛存在于细菌和古细菌中,在刚出露的消落带等生物有效氮缺失的环境中,提供了竞争优势[48]。
2.2.2 硝化作用(Nitrification)硝化过程主要发生在消落带出露期,可分为好氧氨氧化和好氧亚硝酸盐氧化2个部分(NH4+→NO2-→NO3-)。首先是好氧氨氧化:NH3在氨单加氧酶(ammonia monooxygenase, AMO)的作用下被氧化为羟胺(NH2OH),然后NH2OH在羟胺氧还酶(hydroxylamine oxidoreductase, HAO)的作用下氧化为NO并进一步被未知的酶氧化为亚硝酸盐[11, 58]。其次是好氧亚硝酸盐氧化:NO2--N在亚硝酸盐氧化还原酶(nitrite oxidoreductase, NXR)的作用下被氧化为NO3--N。
大多数氨氧化细菌属于β-变形菌纲(Betaproteobacteria)和γ-变形菌纲(Gammaproteobacteria)两类。奇古菌门(Thaumarchaeota)的古细菌,如泉古菌(Nitrosopumilus maritimus),也可以通过将NH4+-N氧化为NO2--N来进行化学自养生长[48],且在一些沙质和粉质黏土土壤中,奇古菌门(Thaumarcheota)更为丰富[59-60]。
2.2.3 反硝化作用(Denitrification)反硝化是指细菌将NO3--N通过一系列中间产物还原为N2的生物化学过程(NO3-→NO2-→NO→N2O→N2)。反硝化作用控制了消落带水不饱和土壤中微生物氮的流失[61]。有研究表明在海洋沉积物中真菌对反硝化作用去除固定氮的贡献和细菌一样[62]。
反硝化过程首先是硝酸盐还原为亚硝酸盐(NO3-→NO2-),分为异化还原和同化还原两种。如消落带土壤这种存在NO3--N的缺氧环境中,都广泛存在可以异化硝酸盐还原的细菌。该反应由膜结合硝酸还原酶(membrane-bound nitrate reductase, NAR)或周质硝酸还原酶(periplasmic nitrate reductase, NAP)催化。而同化硝酸盐还原由含有同化硝酸还原酶(assimilatory nitrate reductases, NAS)的细菌和古菌完成[63]。NAS位于细胞质中,需要耗费能量将硝酸盐转运到细胞中,所以NAS的表达在富含氨的环境中被抑制。本质上只有同化亚硝酸盐还原产生的NO2--N可以在呼吸链中进一步还原,但是同化和异化硝酸盐还原途径之间的区别并不绝对,有证据显示结核分支杆菌(Mycobacterium tuberculosis)利用NAR酶进行硝酸盐同化[64]。NO3--N还原是好氧亚硝酸盐氧化、厌氧氨氧化等其他氮循环过程中NO2--N的主要来源。
其次是NO2--N还原为NO(NO2-→NO)。在存在硝酸盐且含氧量低的土壤、沉积物等环境中,存在许多可以还原亚硝酸盐为NO的微生物,如变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)、厌氧氨氧化菌(anaerobic ammonium-oxidizing bacteria)等。这一反应可以由两种酶催化:由含血红素的亚硝酸盐还原酶(cd1 nitrite reductase, cd1-NIR;被nirS编码)和含铜的亚硝酸盐还原酶(Cu-containing nitrite reductase, Cu-NIR;被nirK编码),这2个酶在细菌和古菌中广泛存在[65]。新的研究表明,一些无法编码上述酶的微生物也可以实现亚硝酸盐还原为NO过程[66]。
再次是NO还原为N2O或N2(NO→N2O/N2)。能够产生N2O的一氧化氮还原酶(nitric oxide reductases, NOR) 被用于NO的解毒作用或呼吸作用。黄素蛋白(flavoproteins)、血红素铜氧化酶(haem copper oxidases)等多种酶都属于NOR[67]。N2O可以是反硝化的中间产物,也可以是反硝化的最终产物。
最后是N2O还原为N2(N2O→N2)。唯一已知的催化这一反应的酶是N2O还原酶(nitrous oxide reductase, NOS),而各种各样来自变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿菌门(Chlorobi)的细菌与来自于泉古菌门(Crenarchaeota)、嗜盐菌门(Halobacteria)的古细菌都能编码NOS。部分真核生物也能减少N2O,但其代谢原理尚不清楚[58]。有研究表明土壤环境中NOS编码序列的多样性被忽略[68],导致严重低估了土壤N2O的还原能力。
2.2.4 完全氨氧化(Complete ammonia oxidation, COMAMMOX)前文描述了传统认为的硝化反应是由两组微生物催化的两步过程,2015年新发现了COMAMMOX过程,即NH4+-N可以通过单一微生物的硝化作用被氧化为硝酸盐[69](NH3→NO3-)。COMAMMOX菌被证明是快滤池等特定微氧和贫营养生境中的优势硝化菌[70]。一项针对农业土壤的研究发现与AOB和AOA相比,在不添加外源氨的情况下,COMAMMOX菌可以维持amoA基因(编码氨单加氧酶)的转录[71],这都表明在低氨浓度下,COMAMMOX菌具有其他氨氧化菌所不具备的竞争优势,据此推测,在消落带落干初期缺乏氨的环境中,COMAMMOX菌可能对氨氧化过程发挥了较大作用。COMAMMOX菌还能利用甲酸盐、氢等作为替代电子供体,增强它们在各种形态氮之外的代谢灵活性[72]。
2.2.5 厌氧氨氧化(Anaerobic ammonia oxidation, ANAMMOX)早期对ANAMMOX菌的认识是在厌氧条件下,将亚硝酸盐和氨转化为氮气(NO2-+NH4+→N2)。近年来越来越多的研究证明有多种ANAMMOX菌可进行多种氮循环相关的氧化还原反应,包括NO3--N和NO2--N相互转化的氧化还原反应,NO2--N还原为NO/NH4+-N,羟胺氧化为NO,联氨的合成和分解[48]等,拥有巨大的代谢多样性。如在河岸带检测到的厌氧氨氧化与Fe3+还原的耦合过程(称为铁还原氨氧化,Feammox),可以在还原Fe3+的同时将NH4+-N氧化为N2、NO3--N或NO2--N[73]。尽管到目前为止针对ANAMMOX细菌的丰度和生物多样性已经进行了多项研究,且在很多贫氧环境中都分离到了ANAMMOX菌,但是对其生态位分化的了解仍然不够透彻[74]。针对消落带的研究表明,ANAMMOX过程控制了河岸带水饱和土壤中微生物氮的流失[61]。
2.2.6 硝酸盐异化还原为铵(Dissimilatory nitrate reduction to ammonium, DNRA)DNRA过程将NO3--N还原为NH4+-N。DNRA可能是富营养化的重要贡献者,不仅因为DNRA过程与反硝化过程(将NO3--N还原为N2)竞争NO3--N,且相比于NO3--N,NH4+-N更能促进藻类生长和富营养化[75]。DNRA反应由nrfAH基因编码的周质的细胞色素c亚硝酸盐还原酶(cytochrome c nitrite reductase, ccNIR)、八面体血红素亚硝酸盐还原酶(octahaem nitrite reductase, ONR)或八面体血红素连四硫酸盐还原酶(octahaem tetrathionate reductase, OTR)催化[48]。在海洋和湖泊沉积物等环境中,当有机碳、醋酸、硫化物等电子供体相对于硝酸盐过量时,DNRA似乎比反硝化过程更有优势[76]。在河岸沉积物中,NO2-氧化(产生用于DNRA的基质NO3-)和NO3-还原(产生用于DNRA的能量)促进了较高的DNRA速率[6]。
2.2.7 亚硝酸盐依赖型厌氧甲烷氧化(Nitrite-dependent anaerobic methane oxidation, N-DAMO)由NC10候选细菌门的甲基假丝酵母oxyfera(Candidatus methylomirabilis oxyfera)主导的N-DAMO过程在缺氧环境中将甲烷氧化与亚硝酸盐还原结合,宏观来看耦合了生物地球化学的碳、氮循环[77]。针对消落带的研究发现,N-DAMO菌群存在且丰度与累计淹水时间呈正相关,这说明在长期淹水缺氧的低高程消落带区域N-DAMO有竞争优势,且很有可能在天然CH4消耗中发挥关键作用[78]。N-DAMO细菌对潮汐流人工湿地(tidal flow constructed wetlands)中CH4氧化和N2生成的贡献率分别达到9.49% ~26.26% 和20.73% ~47.11%,说明N-DAMO菌是潮汐流人工湿地中重要的氮和甲烷汇[79]。
通过梳理总结大量有关水库、河流、湖泊等水陆交错带的研究成果,总结出如图 3所示的三峡水库消落带氮循环及其主要转化过程示意图。概括的讲主要展示了水位涨落影响下土壤-植物-微生物相互作用的氮循环主要过程。不同于其他自然生态系统的是,以三峡水库为例的大型水库生态系统由于水位的大幅度逆自然调蓄,造成“冬蓄夏排”,在植物生长季的末期突然的淹水终止了植物正常的生长过程,从而造成消落带植物在淹水后腐烂分解向水体释放的氮素,形成了潜在的“氮污染”。
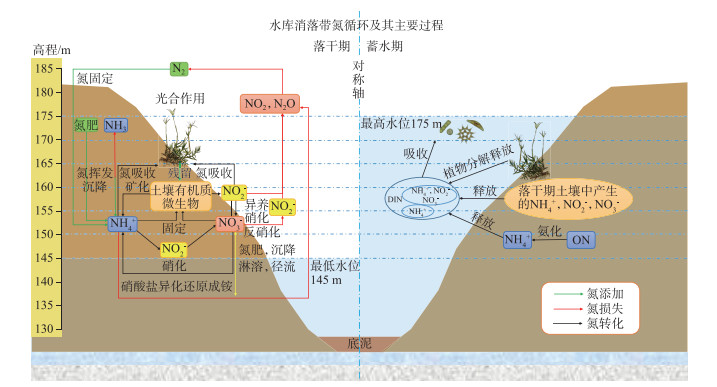
|
图 3 三峡水库消落带氮循环示意图(参考[4, 46]) Fig.3 Diagram of nitrogen cycle in the water-level-fluctuation zone of the Three Gorges Reservoir(Reference[4, 46]) |
植物主要吸收利用铵态氮和硝态氮[80]。三峡库区的逆周期人工水位调节,导致夏季水位低而冬季水位高,这给周围生态系统造成了沉重的压力,使原有的自然植被消失[24]。加上多次涨落后,消落带TN和DON的含量有明显下降,最终导致了三峡库区消落带逐渐形成了以狗牙根等耐水淹、耐贫瘠的草本植物为优势种的植被格局[81],且狗牙根等植物的生物量随消落带水位高程降低而下降[18]。演替过程对消落带氮循环的影响深远,植被类型可以通过改变土壤有机碳、土壤氮有效性和碳氮比影响氮素动态[24],不同植物对有机氮矿化的刺激也不同[82-83]。对于单株植物来说,在贫N环境中植物会从资源剥削型性状变为资源节约型性状,根、叶氮素浓度下降与根、叶氮利用率提高同步发生,且植物会通过提高根部生物量的方式来保持总无机氮的吸收量[84]。
3.2 消落带植物对氮循环的影响消落带植物在落干期恢复过程中需要吸收消落带土壤和邻近水体的营养物质[85]。三峡水库消落带优势草本植物对土壤氮养分的吸收能力存在显著种间差异,植物对土壤氮的富集系数变化范围为5.75~22.21,平均富集系数为13.82,其中苍耳的氮富集系数最高,水蓼次之;优势草本植物氮养分累积吸收量的种间差异较大,苍耳最高,为15.65 g/m2,牛鞭草和狗牙根分别仅为3.03和2.46 g/m2[86]。另一模拟控制研究显示,土壤落干32天后,狗牙根对土壤TN含量降低了3.62%,空心莲子草对土壤TN含量降低了11.75%,充分说明植物对土壤氮的吸收固定作用[87]。但植物淹没死亡后发生的腐烂分解过程,会将氮素重新释放到环境中。对三峡库区消落带植物特别是狗牙根的腐烂分解研究表明,浸泡的植物分解可能是导致三峡水库富营养化的原因之一[26-27, 88],虽然狗牙根淹没腐烂过程中养分释放较其他植物低[27],但据估计整个三峡消落带地区每年由于狗牙根叶片腐烂分解进入邻近水体的总溶解氮(TDN)的量达到49261.65 kg[26]。狗牙根长时间腐烂分解实验表明,温度越低,狗牙根的分解过程会释放更多的营养物质[88],三峡库区对水位的反季节人工调控可能加速了邻近水体的富营养化。
消落带氮循环过程还受植物根际效应的影响。消落带草本植物根系主要分布在0~10 cm土层的表层,对三峡库区消落带土壤剖面养分分布有显著影响,植物根际土壤pH低于非根际,而有机质、TN、TP、TF-N的含量均高于非根际土壤[89-90],且根长密度和根表面积密度与土壤有机质和TN含量呈显著相关[91]。这表明植物根系对营养物质有富集作用。
3.3 消落带植物与氮循环功能微生物的相互作用植被类型通过改变土壤质地、pH、温度、湿度、土壤有机碳和碳氮比来影响氮循环功能微生物群落[55, 92]。与灌木和乔木相比,草本土壤中反硝化菌群的多样性和丰度更高,这可能是因为草本植物更能提供土壤有机碳,提高土壤C ∶N,有利于反硝化菌的生长繁殖[55]。植物与微生物的竞争在根际尤其激烈。根系相关生境中的微生物可能会对根系分泌物的含量、组成和光谱产生反应,从而影响微生物群落的组成[93]。植物主要吸收无机氮,如硝酸盐(NO3-)和铵(NH4+),从而剥夺了一些微生物的底物:硝化微生物的NH4+和反硝化微生物的NO3-,直接影响植物-土壤系统中的氮循环过程[94]。根际沉积物可作为微生物酶活性的化学抑制剂,抑制硝化和反硝化作用,植物根系性状的改变影响了土壤氮素循环过程及与氮素相关的微生物活性。如植物鸭茅(Dactylis glomerata)能够生长出很发达的根系,产生大量的根沉积碳,这种有机化合物的根系沉积可以刺激反硝化或土壤有机质矿化,进而影响微生物群落及其活性[94]。
植物与微生物的关系是陆生生态系统地上与地下部分相互作用的核心,所有生物对相同养分的需求也构成了植物与土壤微生物种间竞争的基础。消落带中氮循环功能微生物对植物起的作用主要有3点:竞争作用(和植物竞争包括C、N、P在内的营养物质)、共生作用(内生固氮菌、固氮微生物和促进植物生长的根际氮循环功能微生物与植物互利共生)和分解作用(在分解凋落物、根系分泌物的过程中参与消落带营养物质循环)。每一种都可以直接或间接通过影响土壤理化特性来影响植物的生长[95]。
4 消落带氮循环相关温室气体排放研究现有的对消落带氮循环相关温室气体排放的研究主要集中于不同区域消落带CH4、CO2和N2O的释放通量和影响因素。三峡水库的研究表明,消落带出露期植物生长茂盛,土壤微生物活跃,消落带温室气体排放通量明显高于冬季淹水期[96]。消落带淹水期CH4、CO2和N2O呈弱排放,对年度温室气体排放总量贡献有限,消落带优势植物群落狗牙根等的排放通量在全年排放通量的占比不足10%,温室气体排放受到植物群落、土壤温度、水体温度、水体溶解氧、氧化还原电位及pH等影响,低温条件限制土壤微生物代谢活性是减少冬季温室气体排放通量的主要原因之一[96]。有研究监测了消落带落干期不同高程上的甲烷排放特征,结果显示甲烷平均排放通量表现为155 m >180 m >175 m >165 m,其中165 m、175 m和180 m间无显著差异,但均显著低于155 m高程上的甲烷排放通量(P < 0.05)[97]。
氮循环的N-DAMO过程在缺氧环境中将甲烷氧化与亚硝酸盐还原结合,是消落带的潜在碳氮“汇”,这一过程可能极大地减少了消落带地区的CH4排放[79]。N-DAMO菌虽然与反硝化菌竞争NO2--N,但是两者导致的NO2--N还原过程相似[98],对N2O排放的影响不大。土壤反硝化过程将NO3--N还原产生N2O,又可以进一步将N2O还原为N2。消落带N2O生产潜力主要受N2O生产菌和N2O还原菌群落结构的调节,增加消落带的持续淹没面积、减少短期淹没面积有助于降低反硝化菌产生N2O的水平[99]。消落带地区,特别是存在植物或曾作为农业用地的区域对全球N2O释放通量有重要意义,当肥沃的农田被上升的水位淹没后,可能会显著增强温室气体排放量[100-101]。消落带N2O通量的季节和空间变异显著,而日变化不显著,水深是解释N2O通量空间变化的最重要因素,消落带土壤伴随淹水深度的增加N2O呈现减少的现象,即长期积水的厌氧条件下由微生物反硝化作用产生的N2O要少于好氧条件下土壤硝化作用产生的N2O[102]。N2O通量、气温与土壤硝酸盐浓度呈分段相关;N2O通量与水中溶解氧呈正相关[101]。此外,土地利用变化、邻近水体各种污染物质、河流沉积物结构、降水、各种形态氮含量都会影响消落带的温室气体排放[103]。
5 总结及展望水库消落带氮循环研究仍存在诸多问题和挑战。由于消落带是水库建设运行后形成的新型生态系统,其生态环境状态尚未充分稳定,加上全球气候变化及人类经济社会快速发展的叠加影响,水库消落带的生态演化变幅在时间和空间尺度上都比较大[104],需要开展更为系统的物理水文、地貌形态、生态耦合过程及元素循环过程的整合研究,以突破在科学认知方面的局限性。
5.1 加强对消落带多个氮循环转化过程的研究对于消落带氮循环的研究很少涉及多个氮循环过程[75]。但是这样的系统性研究对于理解消落带氮循环过程、消落带在生物地球化学循环中的作用、邻近水体富营养化问题的解决都非常重要。建议今后在同一研究中涉及氮的固定、迁移转化、释放等多个过程,综合考虑水位涨落的不同时期对氮的各个过程的影响。同时应进一步明确AOA、AOB、COMAMMOX菌、ANAMMOX菌、DNRA菌、N-DAMO菌的群落结构与群落多样性,分析各个菌群在消落带环境中的生态位分化,对氮循环关键过程的驱动、贡献和协同作用机理。
5.2 加强对消落带土壤-植物-微生物间的相互作用研究水位涨落影响下的消落带土壤、植物、微生物间的相互作用极其复杂。有研究表明消落带水-土、水-植被和水-土-植被三种体系下的总溶解性氮含量随时间的变化[18],这在消落带土壤多个氮循环过程研究之上提出了更高的要求。目前尚不清楚消落带生态系统中哪些植物具有内生固氮菌,其固氮作用有多大。在水位波动的不同阶段,植物-土壤间的相互作用对氮的迁移转化,植物-微生物的相互作用对氮循环的影响,以及植物-土壤-微生物三者间的相互作用对氮关键过程的驱动作用尚不清晰。需要整合多种生物在氮循环过程中的竞争关系与协同作用,进一步探究其对消落带氮循环的调控机制。
5.3 加强对消落带温室气体排放的机制研究目前,围绕水库消落带温室气体净排放量评估和消落带碳足迹评价等方面,仍存在一些不确定和模糊的地方,大部分研究利用模型进行宏观尺度的估算,但缺乏消落带生态系统分门别类的温室气体长时间序列的实测资料。因此深入研究不同类型消落带的N2O、CO2、CH4释放途径、环境驱动因子和影响因素,将不同水位涨落阶段下的碳、氮循环过程耦合起来,深入分析研究消落带的温室气体总排放量及其对全球温室效应造成的影响,为减缓全球气候变化提供新的方法与科学支撑。
| [1] |
Huang Q, Liu D, Wei XT et al. Reasons for China owning largest number of water dams in the world. Journal of Hydroelectric Engineering, 2021, 40(9): 35-45. [黄强, 刘东, 魏晓婷等. 中国筑坝数量世界之最原因分析. 水力发电学报, 2021, 40(9): 35-45.] |
| [2] |
Maavara T, Chen QW, van Meter K et al. River Dam impacts on biogeochemical cycling. Nature Reviews Earth & Environment, 2020, 1(2): 103-116. DOI:10.1038/s43017-019-0019-0 |
| [3] |
Chen XL, Chen HYH, Searle EB et al. Negative to positive shifts in diversity effects on soil nitrogen over time. Nature Sustainability, 2021, 4(3): 225-232. DOI:10.1038/s41893-020-00641-y |
| [4] |
颜晓元. 土壤氮循环实验研究方法. 北京: 科学出版社, 2020.
|
| [5] |
Heiss JW, Michael HA, Koneshloo M. Denitrification hotspots in intertidal mixing zones linked to geologic heterogeneity. Environmental Research Letters, 2020, 15(8): 084015. DOI:10.1088/1748-9326/ab90a6 |
| [6] |
Wang SY, Pi Y, Song Y et al. Hotspot of dissimilatory nitrate reduction to ammonium (DNRA) process in freshwater sediments of riparian zones. Water Research, 2020, 173: 115539. DOI:10.1016/j.watres.2020.115539 |
| [7] |
Zhao S, Zhang BJ, Sun XH et al. Hot spots and hot moments of nitrogen removal from hyporheic and riparian zones: A review. Science of the Total Environment, 2021, 762: 144168. DOI:10.1016/j.scitotenv.2020.144168 |
| [8] |
Li SZ, Deng Y, Shi FN et al. Research progress on water-level-fluctuation zones of reservoirs: A review. Wetland Science, 2019, 17(6): 689-696. [李姗泽, 邓玥, 施凤宁等. 水库消落带研究进展. 湿地科学, 2019, 17(6): 689-696.] |
| [9] |
Li SZ, Chen M, Wang YC et al. Spatial and temporal distribution characteristics of soil nitrogen and phosphorus in Three Gorges water level fluctuation zone in last decade. Research of Environmental Sciences, 2020, 33(11): 2448-2457. [李姗泽, 陈铭, 王雨春等. 近10年来三峡消落带土壤氮、磷时空分布特征研究. 环境科学研究, 2020, 33(11): 2448-2457. DOI:10.13198/j.issn.1001-6929.2020.10.03] |
| [10] |
Liu MH, Xie TT, Li R et al. Carbon, nitrogen, and phosphorus ecological stoichiometric characteristics between Taxodium ascendens and soil in the water-level fluctuation zone of the Three Gorges Reservoir region. Acta Ecologica Sinica, 2020, 40(9): 3072-3084. [刘明辉, 谢婷婷, 李瑞等. 三峡库区消落带池杉-土壤碳氮磷生态化学计量特征. 生态学报, 2020, 40(9): 3072-3084.] |
| [11] |
叶飞. 三峡库区消落带土壤氮循环关键过程微生物群落特征研究[学位论文]. 北京: 中国科学院大学, 2018.
|
| [12] |
Yang D, Fan DY, Xie ZQ et al. Research progress on the mechanisms and influence factors of nitrogen retention and transformation in riparian ecosystems. Chinese Journal of Applied Ecology, 2016, 27(3): 973-980. [杨丹, 樊大勇, 谢宗强等. 消落带生态系统氮素截留转化的主要机制及影响因素. 应用生态学报, 2016, 27(3): 973-980. DOI:10.13287/j.1001-9332.201603.040] |
| [13] |
Jian ZJ, Pei SX, Guo QS et al. Temporal and spatial dynamics of soil nitrogen, phosphorus, potassium, organic matter and pH in the water level fluctuation zone of canyon landform area of the Three Gorges Reservoir, China. Chinese Journal of Applied Ecology, 2017, 28(9): 2778-2786. [简尊吉, 裴顺祥, 郭泉水等. 三峡水库峡谷地貌区消落带土壤氮磷钾、有机质含量和pH值的时空动态. 应用生态学报, 2017, 28(9): 2778-2786. DOI:10.13287/j.1001-9332.201709.016] |
| [14] |
Zhang B, Chen YP, Fang F et al. Nitrogen forms and their distribution characteristics in the soils of water-level-fluctuationg zone in the central Three Gorges Reservoir. Acta Scientiae Circumstantiae, 2012, 32(5): 1126-1133. [张彬, 陈猷鹏, 方芳等. 三峡库区淹没消落区土壤氮素形态及分布特征. 环境科学学报, 2012, 32(5): 1126-1133. DOI:10.13671/j.hjkxxb.2012.05.019] |
| [15] |
Zhu Q. Coupling soil water processes and the nitrogen cycle across spatial scales: Potentials, bottlenecks and solutions. Earth-Science Reviews, 2018, 187: 248-258. DOI:10.1016/j.earscirev.2018.10.005 |
| [16] |
Lin JJ, Yang ZY, Liu D et al. Particle size composition of sediment and nitrogen distribution in the water level fluctuating zone of tributaries of the Three Gorges Reservoir as affected by dry-wet alternation. Acta Pedologica Sinica, 2016, 53(3): 602-611. [林俊杰, 杨振宇, 刘丹等. 干湿交替下三峡支流消落带沉积物粒径组成及氮分布特征. 土壤学报, 2016, 53(3): 602-611.] |
| [17] |
Yang WH, Ren QS, Qin H et al. Characteristics of soil microbial biomass carbon, nitrogen, and phosphorus under Cynodon dactylon vegetation at different altitudes in the hydro-fluctuation belt of the Three Gorges Dam Reservoir. Acta Prataculturae Sinica, 2018, 27(2): 57-68. [杨文航, 任庆水, 秦红等. 三峡库区消落带不同海拔狗牙根草地土壤微生物生物量碳氮磷含量特征. 草业学报, 2018, 27(2): 57-68.] |
| [18] |
曲衍桦. 三峡消落带狗牙根氮磷释放及生物炭减控技术研究[学位论文]. 重庆: 重庆三峡学院, 2019.
|
| [19] |
Zhang L, Qin YW, Zheng BH et al. Nitrogen forms and its distribution character in immerged and water-level-fluctuating zone soils of the backwater reach from input river of Three Gorges Reservoir. Environmental Science, 2009, 30(10): 2884-2890. [张雷, 秦延文, 郑丙辉等. 三峡入库河流大宁河回水区浸没土壤及消落带土壤氮形态及分布特征. 环境科学, 2009, 30(10): 2884-2890. DOI:10.13227/j.hjkx.2009.10.010] |
| [20] |
徐德星. 三峡入库河流大宁河回水区沉积物和消落带土壤氮磷形态及其分布特征研究[学位论文]. 北京: 北京化工大学, 2009.
|
| [21] |
Guo SS, Fang F, Guo JS et al. Content change of organic matter, nitrogen and phosphorus in the soil of water-level-fluctuating zone of Three Gorges Reservoir area during the non-flooded period. Environment and Ecology in the Three Gorges, 2012, 34(2): 17-21. [郭松松, 方芳, 郭劲松等. 三峡库区消落带落干期间土壤有机质氮磷含量变化分析. 三峡环境与生态, 2012, 34(2): 17-21. DOI:10.14068/j.ceia.2012.02.005] |
| [22] |
Zhang TP, Huang XY, Yang Y et al. Spatial and temporal variability in nitrous oxide and methane emissions in urban riparian zones of the Pearl River Delta. Environmental Science and Pollution Research International, 2016, 23(2): 1552-1564. DOI:10.1007/s11356-015-5401-y |
| [23] |
甘龙. 三峡库区香溪河库岸氮磷污染特性及其生态修复[学位论文]. 宜昌: 三峡大学, 2018.
|
| [24] |
Ye C, Cheng X, Zhang Y et al. Soil nitrogen dynamics following short-term revegetation in the water level fluctuation zone of the Three Gorges Reservoir, China. Ecological Engineering, 2012, 38(1): 37-44. DOI:10.1016/j.ecoleng.2011.10.005 |
| [25] |
Stein LY. Insights into the physiology of ammonia-oxidizing microorganisms. Current Opinion in Chemical Biology, 2019, 49: 9-15. DOI:10.1016/j.cbpa.2018.09.003 |
| [26] |
Chen X, Zhang S, Liu D et al. Nutrient inputs from the leaf decay of Cynodon dactylon (L.) Pers in the water level fluctuation zone of a Three Gorges tributary. Science of the Total Environment, 2019, 688: 718-723. DOI:10.1016/j.scitotenv.2019.06.357 |
| [27] |
Xiao LW, Zhu B, Nsenga KM et al. Plant soaking decomposition as well as nitrogen and phosphorous release in the water-level fluctuation zone of the Three Gorges Reservoir. Science of the Total Environment, 2017, 592: 527-534. DOI:10.1016/j.scitotenv.2017.03.104 |
| [28] |
韩新宽. 三峡库区消落带土壤和人工污水处理系统中与氮转化相关的微生物研究[学位论文]. 新乡: 河南师范大学, 2015.
|
| [29] |
杨萌. 消落带温室气体排放机制研究[学位论文]. 北京: 北京林业大学, 2016.
|
| [30] |
Prosser JI, Hink L, Gubry-Rangin C et al. Nitrous oxide production by ammonia oxidizers: Physiological diversity, niche differentiation and potential mitigation strategies. Global Change Biology, 2020, 26(1): 103-118. DOI:10.1111/gcb.14877 |
| [31] |
Yoon S, Song B, Phillips RL et al. Ecological and physiological implications of nitrogen oxide reduction pathways on greenhouse gas emissions in agroecosystems. FEMS Microbiology Ecology, 2019, 95(6): fiz066. DOI:10.1093/femsec/fiz066 |
| [32] |
He LP, Liu D, Yu ZG et al. Distribution and content of transferable nitrogen in the soil of water level fluctuating zones of mainstream and its tributary of Three Gorges Reservoir areas during the dry period. Environmental Science, 2016, 37(3): 950-954. [何立平, 刘丹, 于志国等. 三峡库区干支流落干期消落带土壤可转化态氮含量及分布特征. 环境科学, 2016, 37(3): 950-954. DOI:10.13227/j.hjkx.2016.03.020] |
| [33] |
Zhang ZY, Hu HQ, Lu ZY et al. Effects of periodic flooding and drying on soil nitrogen speciation in the water-level-fluctuation zone. Journal of Hydroecology, 2020, 41(4): 63-72. [张志永, 胡红青, 鲁泽禹等. 水淹-出露对消落带土壤氮形态的影响. 水生态学杂志, 2020, 41(4): 63-72. DOI:10.15928/j.1674-3075.2020.04.009] |
| [34] |
黄昌勇, 徐建明. 土壤学. 北京: 中国农业出版社, 2010: 151-203.
|
| [35] |
Ma H, Song J, Lv X et al. Nitrogen forms and their functions in recycling of the Bohai Sea sediments. Geochimica, 2003, 32(1): 48-54. [马红波, 宋金明, 吕晓霞等. 渤海沉积物中氮的形态及其在循环中的作用. 地球化学, 2003, 32(1): 48-54. DOI:10.19700/j.0379-1726.2003.01.007] |
| [36] |
He LP, Lan B, Lu W et al. Transformation process of purple alluvial soil combined nitrogen in water level fluctuation zone of the Three Gorges Reservoir Area. Environmental Chemistry, 2020, 39(8): 2245-2252. [何立平, 兰波, 陆伟等. 三峡库区消落带紫色潮土结合态氮转化过程. 环境化学, 2020, 39(8): 2245-2252.] |
| [37] |
Li XF, Hou LJ, Liu M et al. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland. Environmental Science & Technology, 2015, 49(19): 11560-11568. DOI:10.1021/acs.est.5b03419 |
| [38] |
Ding LJ, An XL, Li S et al. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence. Environmental Science & Technology, 2014, 48(18): 10641-10647. DOI:10.1021/es503113s |
| [39] |
Yang J, Xia PH, Lin T et al. Distribution characteristics of iron speciation in sediments of Guizhou Caohai wetland under different water depths. Environmental Chemistry, 2019, 38(4): 813-821. [杨杰, 夏品华, 林陶等. 贵州草海湿地不同水深梯度下沉积物铁形态分布特征. 环境化学, 2019, 38(4): 813-821.] |
| [40] |
Liu Y, Wang CH, He NP et al. A global synthesis of the rate and temperature sensitivity of soil nitrogen mineralization: Latitudinal patterns and mechanisms. Global Change Biology, 2017, 23(1): 455-464. DOI:10.1111/gcb.13372 |
| [41] |
Osterholz WR, Rinot O, Liebman M et al. Can mineralization of soil organic nitrogen meet maize nitrogen demand?. Plant and Soil, 2017, 415(1/2): 73-84. DOI:10.1007/s11104-016-3137-1 |
| [42] |
Reussi Calvo NI, Wyngaard N, Orcellet J et al. Predicting field-apparent nitrogen mineralization from anaerobically incubated nitrogen. Soil Science Society of America Journal, 2018, 82(2): 502-508. DOI:10.2136/sssaj2017.11.0395 |
| [43] |
Nieder R, Benbi DK, Scherer HW. Fixation and defixation of ammonium in soils: A review. Biology and Fertility of Soils, 2011, 47(1): 1-14. DOI:10.1007/s00374-010-0506-4 |
| [44] |
Xu XF, Hui DF, King AW et al. Convergence of microbial assimilations of soil carbon, nitrogen, phosphorus and sulfur in terrestrial ecosystems. Scientific Reports, 2015, 5: 17445. DOI:10.1038/srep17445 |
| [45] |
He LP, Lin JJ, Duan LY et al. Effects of different types of nitrogen inputs on purple alluvial soil nitrogen fractions in riparian zone of Three Gorges Reservoir area. Research of Environmental Sciences, 2021, 34(9): 2228-2236. [何立平, 林俊杰, 段林艳等. 不同类型氮输入对三峡库区消落带紫色潮土氮赋存形态的影响. 环境科学研究, 2021, 34(9): 2228-2236. DOI:10.13198/j.issn.1001-6929.2021.05.36] |
| [46] |
Lin JJ, Tang Y, Liu D et al. Characteristics of organic nitrogen fractions in sediments of the water level fluctuation zone in the tributary of the Yangtze River. Science of the Total Environment, 2019, 653: 327-333. DOI:10.1016/j.scitotenv.2018.10.394 |
| [47] |
Huang Z, Jiang CS, Lei LG et al. Soil dissolved organic carbon and nitrogen in the water-level-fluctuating zone with different flooding durations in the Three Gorges Reservoir region. Journal of Southwest University: Natural Science Edition, 2018, 40(1): 98-106. [黄哲, 江长胜, 雷利国等. 三峡库区消落带不同淹水期土壤可溶性碳氮的研究. 西南大学学报: 自然科学版, 2018, 40(1): 98-106.] |
| [48] |
Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [49] |
Costello DM, Tiegs SD, Boyero L et al. Global patterns and controls of nutrient immobilization on decomposing cellulose in riverine ecosystems. Global Biogeochemical Cycles, 2022, 36(3). DOI:10.1029/2021GB007163 |
| [50] |
Farrer EC, van Bael SA, Clay K et al. Plant-microbial symbioses in coastal systems: Their ecological importance and role in coastal restoration. Estuaries and Coasts, 2022, 45(7): 1805-1822. DOI:10.1007/s12237-022-01052-2 |
| [51] |
Starr SF, Mortazavi B, Tatariw C et al. Poor recovery of fungal denitrification limits nitrogen removal capacity in a constructed Gulf Coast marsh. Soil Biology and Biochemistry, 2022, 170: 108692. DOI:10.1016/j.soilbio.2022.108692 |
| [52] |
Zhu GB, Wang SY, Wang WD et al. Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces. Nature Geoscience, 2013, 6(2): 103-107. DOI:10.1038/ngeo1683 |
| [53] |
朱昊彧. 反季节调节水库消落带氮循环特征及其机制[学位论文]. 重庆: 重庆交通大学, 2021. DOI: 10.27671/d.cnki.gcjtc.2021.000879.
|
| [54] |
黄轩民. 三峡水库消落带土壤碳氮磷分布及其交换通量研究[学位论文]. 重庆: 重庆大学, 2012.
|
| [55] |
Ye C, Cheng X, Zhang K et al. Hydrologic pulsing affects denitrification rates and denitrifier communities in a revegetated riparian ecotone. Soil Biology and Biochemistry, 2017, 115: 137-147. DOI:10.1016/j.soilbio.2017.08.018 |
| [56] |
Bothe H, Schmitz O, Yates MG et al. Nitrogen fixation and hydrogen metabolism in cyanobacteria. Microbiology and Molecular Biology Reviews: MMBR, 2010, 74(4): 529-551. DOI:10.1128/MMBR.00033-10 |
| [57] |
Zehr JP, Jenkins BD, Short SM et al. Nitrogenase gene diversity and microbial community structure: A cross-system comparison. Environmental Microbiology, 2003, 5(7): 539-554. DOI:10.1046/j.1462-2920.2003.00451.x |
| [58] |
Caranto JD, Lancaster KM. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(31): 8217-8222. DOI:10.1073/pnas.1704504114 |
| [59] |
Prosser JI, Nicol GW. Relative contributions of Archaea and bacteria to aerobic ammonia oxidation in the environment. Environmental Microbiology, 2008, 10(11): 2931-2941. DOI:10.1111/j.1462-2920.2008.01775.x |
| [60] |
Leininger S, Urich T, Schloter M et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils. Nature, 2006, 442(7104): 806-809. DOI:10.1038/nature04983 |
| [61] |
Wang SY, Wang W, Zhao S et al. Anammox and denitrification separately dominate microbial N-loss in water saturated and unsaturated soils horizons of riparian zones. Water Research, 2019, 162: 139-150. DOI:10.1016/j.watres.2019.06.052 |
| [62] |
Piña-Ochoa E, Høgslund S, Geslin E et al. Widespread occurrence of nitrate storage and denitrification among Foraminifera and Gromiida. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(3): 1148-1153. DOI:10.1073/pnas.0908440107 |
| [63] |
Moreno-Vivián C, Cabello P, Martínez-Luque M et al. Prokaryotic nitrate reduction: Molecular properties and functional distinction among bacterial nitrate reductases. Journal of Bacteriology, 1999, 181(21): 6573-6584. DOI:10.1128/JB.181.21.6573-6584.1999 |
| [64] |
Malm S, Tiffert Y, Micklinghoff J et al. The roles of the nitrate reductase NarGHJI, the nitrite reductase NirBD and the response regulator GlnR in nitrate assimilation of Mycobacterium tuberculosis. Microbiology: Reading, England, 2009, 155(Pt 4): 1332-1339. DOI:10.1099/mic.0.023275-0 |
| [65] |
Graf DRH, Jones CM, Hallin S. Intergenomic comparisons highlight modularity of the denitrification pathway and underpin the importance of community structure for N2O emissions. PLoS One, 2014, 9(12): e114118. DOI:10.1371/journal.pone.0114118 |
| [66] |
Kartal B. Anammox biochemistry: A tale of heme c proteins. Trends in Biochemical Sciences, 2016, 41(12): 998-1011. DOI:10.1016/j.tibs.2016.08.015 |
| [67] |
Saraiva LM, Vicente JB, Teixeira M. The role of the flavodiiron proteins in microbial nitric oxide detoxification. Advances in Microbial Physiology, 2004, 49: 77-129. DOI:10.1016/S0065-2911(04)49002-X |
| [68] |
Sanford RA, Wagner DD, Wu QZ et al. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(48): 19709-19714. DOI:10.1073/pnas.1211238109 |
| [69] |
van Kessel MAHJ, Speth DR, Albertsen M et al. Complete nitrification by a single microorganism. Nature, 2015, 528(7583): 555-559. DOI:10.1038/nature16459 |
| [70] |
Fowler SJ, Palomo A, Dechesne A et al. Comammox Nitrospira are abundant ammonia oxidizers in diverse groundwater-fed rapid sand filter communities. Environmental Microbiology, 2018, 20(3): 1002-1015. DOI:10.1111/1462-2920.14033 |
| [71] |
Xu SY, Wang B, Li Y et al. Ubiquity, diversity, and activity of comammox Nitrospira in agricultural soils. Science of the Total Environment, 2020, 706: 135684. DOI:10.1016/j.scitotenv.2019.135684 |
| [72] |
Koch H, van Kessel MAHJ, Lücker S. Complete nitrification: Insights into the ecophysiology of comammox Nitrospira. Applied Microbiology and Biotechnology, 2019, 103(1): 177-189. DOI:10.1007/s00253-018-9486-3 |
| [73] |
Ding BJ, Li ZK, Qin YB. Nitrogen loss from anaerobic ammonium oxidation coupled to Iron(Ⅲ) reduction in a riparian zone. Environmental Pollution, 2017, 231: 379-386. DOI:10.1016/j.envpol.2017.08.027 |
| [74] |
Zhang L, Okabe S. Ecological niche differentiation among anammox bacteria. Water Research, 2020, 171: 115468. DOI:10.1016/j.watres.2020.115468 |
| [75] |
Nogaro G, Burgin AJ. Influence of bioturbation on denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in freshwater sediments. Biogeochemistry, 2014, 120(1/2/3): 279-294. DOI:10.1007/s10533-014-9995-9 |
| [76] |
Kraft B, Tegetmeyer HE, Sharma R et al. The environmental controls that govern the end product of bacterial nitrate respiration. Science, 2014, 345(6197): 676-679. DOI:10.1126/science.1254070 |
| [77] |
Raghoebarsing AA, Pol A, van de Pas-Schoonen KT et al. A microbial consortium couples anaerobic methane oxidation to denitrification. Nature, 2006, 440(7086): 918-921. DOI:10.1038/nature04617 |
| [78] |
Wang Y, Huang P, Ye F et al. Nitrite-dependent anaerobic methane oxidizing bacteria along the water level fluctuation zone of the Three Gorges Reservoir. Applied Microbiology and Biotechnology, 2016, 100(4): 1977-1986. DOI:10.1007/s00253-015-7083-2 |
| [79] |
Zhang MP, Huang JC, Sun S et al. Depth-specific distribution and significance of nitrite-dependent anaerobic methane oxidation process in tidal flow constructed wetlands used for treating river water. Science of the Total Environment, 2020, 716: 137054. DOI:10.1016/j.scitotenv.2020.137054 |
| [80] |
朱兆良, 邢光熹. 氮循环——攸关农业生产、环境保护与人类健康. 北京: 清华大学出版社, 2010.
|
| [81] |
Wen ZF, Ma M, Zhang C et al. Estimating seasonal aboveground biomass of a riparian pioneer plant community: An exploratory analysis by canopy structural data. Ecological Indicators, 2017, 83: 441-450. DOI:10.1016/j.ecolind.2017.07.048 |
| [82] |
Blagodatskaya Е, Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: Critical review. Biology and Fertility of Soils, 2008, 45(2): 115-131. DOI:10.1007/s00374-008-0334-y |
| [83] |
Kuzyakov Y, Xu XL. Competition between roots and microorganisms for nitrogen: Mechanisms and ecological relevance. New Phytologist, 2013, 198(3): 656-669. DOI:10.1111/nph.12235 |
| [84] |
Cantarel AAM, Pommier T, Desclos-Theveniau M et al. Using plant traits to explain plant-microbe relationships involved in nitrogen acquisition. Ecology, 2015, 96(3): 788-799. DOI:10.1890/13-2107.1 |
| [85] |
Chen HS. Water purification ability of emergent plants for TN and TP in water-level-fluctuation zone of mountain reservoir. Journal of Zhejiang University of Water Resources and Electric Power, 2018, 30(6): 52-55. [陈海生. 山区水库消落带挺水植物对水体中总氮和总磷的降解效应. 浙江水利水电学院学报, 2018, 30(6): 52-55.] |
| [86] |
Wang Z, Xiao LW, Tan QX et al. Nitrogen and phosphorus absorption from soil by the dominant herbaceous species in the water-level-fluctuation zone of the Three Gorges Reservoir. Mountain Research, 2019, 37(2): 151-160. [王正, 肖丽微, 谭秋霞等. 三峡水库消落带优势草本植物对土壤氮磷的吸收富集特征. 山地学报, 2019, 37(2): 151-160.] |
| [87] |
Lv FL, Ouyang W, Song Y et al. Simulation study on the effects of Cynodon dactylon and Alternanthera philoxeroides on soil nitrogen and phosphorus release in the reservoir water-level fluctuation zone. Journal of Soil and Water Conservation, 2019, 33(3): 240-245, 253. [吕凤玲, 欧阳炜, 宋艳暾等. 狗牙根与空心莲对水库消落带土壤氮磷释放影响的模拟. 水土保持学报, 2019, 33(3): 240-245, 253.] |
| [88] |
Xiao LW, Zhu B. Impacts of environmental conditions on the soaking release of nitrogen and phosphorus from Cynodon dactylon (linn.) pers. in the water-level fluctuation zone of the Three Gorges reservoir region. Environmental Science, 2017, 38(11): 4580-4588. [肖丽微, 朱波. 水环境条件对三峡库区消落带狗牙根氮磷养分淹水浸泡释放的影响. 环境科学, 2017, 38(11): 4580-4588. DOI:10.13227/j.hjkx.201703195] |
| [89] |
Wang XF, Liu H, Zhang L et al. Inorganic nitrogen forms and related enzyme activity of rhizosphere soils under typical plants in the littoral zone of Pengxi River. China Environmental Science, 2015, 35(10): 3059-3068. [王晓锋, 刘红, 张磊等. 澎溪河消落带典型植物群落根际土壤无机氮形态及氮转化酶活性. 中国环境科学, 2015, 35(10): 3059-3068.] |
| [90] |
Wang XF, Yuan XZ, Liu H et al. Nutrient characteristics and nitrogen forms of rhizosphere soils under four typical plants in the littoral zone of TGR. Environmental Science, 2015, 36(10): 3662-3673. [王晓锋, 袁兴中, 刘红等. 三峡库区消落带4种典型植物根际土壤养分与氮素赋存形态. 环境科学, 2015, 36(10): 3662-3673. DOI:10.13227/j.hjkx.2015.10.014] |
| [91] |
Zhong RH, Hu JM, Bao YH et al. Soil nutrients in relation to vertical roots distribution in the riparian zone of Three Gorges Reservoir, China. Journal of Mountain Science, 2018, 15(7): 1498-1509. DOI:10.1007/s11629-017-4719-y |
| [92] |
Song K, Lee SH, Mitsch WJ et al. Different responses of denitrification rates and denitrifying bacterial communities to hydrologic pulsing in created wetlands. Soil Biology and Biochemistry, 2010, 42(10): 1721-1727. DOI:10.1016/j.soilbio.2010.06.007 |
| [93] |
Bremer C, Braker G, Matthies D et al. Impact of plant functional group, plant species, and sampling time on the composition of nirK-type denitrifier communities in soil. Applied and Environmental Microbiology, 2007, 73(21): 6876-6884. DOI:10.1128/AEM.01536-07 |
| [94] |
Legay N, Clément JC, Grassein F et al. Plant growth drives soil nitrogen cycling and N-related microbial activity through changing root traits. Fungal Ecology, 2020, 44: 100910. DOI:10.1016/j.funeco.2019.100910 |
| [95] |
van der Putten WH, Bradford MA, Pernilla BE et al. Where, when and how plant-soil feedback matters in a changing world. Functional Ecology, 2016, 30(7): 1109-1121. DOI:10.1111/1365-2435.12657 |
| [96] |
周上博. 三峡水库消落带生态工程碳汇效益评估[学位论文]. 重庆: 重庆大学, 2015.
|
| [97] |
廖秋实. 三峡水库典型消落区生态系统不同高程CH4排放研究[学位论文]. 重庆: 西南大学, 2013.
|
| [98] |
Chen H, Wang H, Wu M et al. Recent advances in microbe-driven nitrogen transformation in freshwater wetland ecosystems. Journal of Hydraulic Engineering, 2020, 51(2): 158-168. [陈宏, 王泓, 吴敏等. 淡水湿地生态系统中微生物驱动氮转化过程研究进展. 水利学报, 2020, 51(2): 158-168.] |
| [99] |
Zhao SY, Wang Q, Zhou J et al. Linking abundance and community of microbial N2O-producers and N2O-reducers with enzymatic N2O production potential in a riparian zone. Science of the Total Environment, 2018, 642: 1090-1099. DOI:10.1016/j.scitotenv.2018.06.110 |
| [100] |
Li HL, Yang M, Lei T et al. Nitrous oxide emission from the littoral zones of the Miyun Reservoir near Beijing, China. Hydrology Research, 2015, 46(5): 811-823. DOI:10.2166/nh.2014.095 |
| [101] |
Yang M, Geng XM, Grace J et al. N2O fluxes from the littoral zone of a Chinese reservoir. Biogeosciences, 2015, 12(15): 4711-4723. DOI:10.5194/bg-12-4711-2015 |
| [102] |
陈璐豪. 水位变化下三峡水库典型消落区N2O排放研究[学位论文]. 重庆: 西南大学, 2012.
|
| [103] |
Zhou SB, He Y, Yuan X et al. Greenhouse gas emissions from different land-use areas in the Littoral Zone of the Three Gorges Reservoir, China. Ecological Engineering, 2017, 100: 316-324. DOI:10.1016/j.ecoleng.2017.01.003 |
| [104] |
Yu JH, Zhang YS, Zhong JC et al. Water-level alterations modified nitrogen cycling across sediment-water interface in the Three Gorges Reservoir. Environmental Science and Pollution Research International, 2020, 27(21): 25886-25898. DOI:10.1007/s11356-019-06656-z |
 2023, Vol. 35
2023, Vol. 35 

