(2: 西藏大学理学院青藏高原湿地与流域生态系统实验室, 拉萨 850000)
(2: Laboratory of Tibetan Plateau Wetland and Watershed Ecosystem, College of Science, Tibet University, Lhasa 850000, P. R. China)
浮游植物在河流、湖泊等水生生态系统中主要充当初级生产者的角色,具有分布范围广、生活周期短等特点,其群落结构对环境条件的变化会做出直接而快速的响应,是水环境变化的重要标志[1-4]。优势种(dominant species)是群落中占优势的物种,群落结构变化主要通过优势种和优势类群的时序性变化表现[5]。相对于浮游植物其他种群,优势种群的演替和生物量的时空变化更能直观反映水质的变化过程[6]。
生态位(niche)对于研究种间关系、群落结构、物种多样性和群落动态演替等方面有重要的参考价值[7]。生态位宽度能反映物种的分布状况、衡量物种对其生境资源利用程度[8]。生态位重叠是指不同物种在同一空间分布上共同竞争资源的现象,其值能反映物种间对资源利用或环境适应能力的相似性特征和竞争关系[9]。种间联结是指物种间在空间分布上的相互关联性,即物种间相互吸引或排斥的特性,反映不同物种共同出现的可能性程度[10]。与传统的群落时空分布格局相比,种间联结性对种间关系进行量化,联结性的大小能反映物种间的正负关联程度,且总体联结性能反映群落的稳定性,有助于进一步研究种群分布格局和群落构建机制[11-12]。生态位和种间联结性研究已被广泛应用于陆地动植物生态学领域,分析多用于木本植物群落,而对浮游植物的分析还相对较少[13-14]。目前,有关拉萨河中下游浮游植物的研究主要集中在群落结构及其与环境因子的关系[15],对该流域浮游植物生态位和种间联结性的研究未见报道。因此,研究拉萨河中下游不同水文期浮游植物优势种种间相互依存和竞争关系,能填补该流域在此方面的空白,揭示青藏高原河流生态系统浮游植物种间相互作用的生态关系和浮游植物群落结构变化规律,反映浮游植物群落稳定性,对河流生态系统的管理和水环境变化的预测具有重要意义。
为了探究西藏拉萨河中下游不同水文期浮游植物群落优势种生态位及种间关系,笔者对拉萨河中下游浮游植物群落进行初步研究,分析浮游植物不同水文期优势种生态位与种间联结性,探讨浮游植物优势种种间相互作用的生态关系和对环境资源共用状况,揭示不同水文期浮游植物群落优势种生态适应性和群落演替趋势,以期为进一步研究拉萨河中下游浮游植物空间分布格局和水环境健康评价提供依据。
1 研究区概况拉萨河是雅鲁藏布江五大一级支流之一[16],位于雅鲁藏布江中游左岸,发源于念青唐古拉山南麓的澎错扎玛朵山峰下,沿途流经墨竹工卡县、达孜县,经过拉萨市,最后在拉萨市曲水县汇入雅鲁藏布江。根据河谷形态和地质状况,拉萨河大致分为上、中、下游3段。上游河段从源头的麦地藏布、色荣藏布到桑曲汇入口,长约250 km;中游河段从热振藏布到旁多扒曲汇入口,长约60 km;下游河段从旁多到曲水县境内雅鲁藏布江汇入口,长约240 km。拉萨河干流全长511 km,流域面积达32588 km2,河流发源地海拔高达5200 m,汇入雅江口海拔3580 m,全长落差1620 m,贯穿整个拉萨城区[17]。主要支流有麦曲、桑曲、乌鲁龙曲、扒曲、雪绒藏布、玛曲、彭波曲和堆龙曲等。拉萨河主要补给水源来自冰川融雪、天然降水和地表泉水。流域内的居民生活饮用水直接或间接取自于拉萨河。浮游植物群落的时空变化能反应河流水质状况,对拉萨河浮游植物的研究具有一定的社会、生态和科研价值[18]。
2 研究方法 2.1 样点设置根据国家规定的标准方法《水质-微型生物群落监测PFU法》(GB/T 12990—1991)和地表水质监测断面的布设原则以及拉萨河中下游自然环境状态,在拉萨河中下游干流及支流共设置了17个样点(图 1),于2015年5月(平水期)、2015年8月(丰水期)和2016年11月(枯水期)进行浮游植物和理化因子样品采集,具体样点和理化因子信息已在张鹏等[19]的研究中进行了详细描述,本文不再赘述。
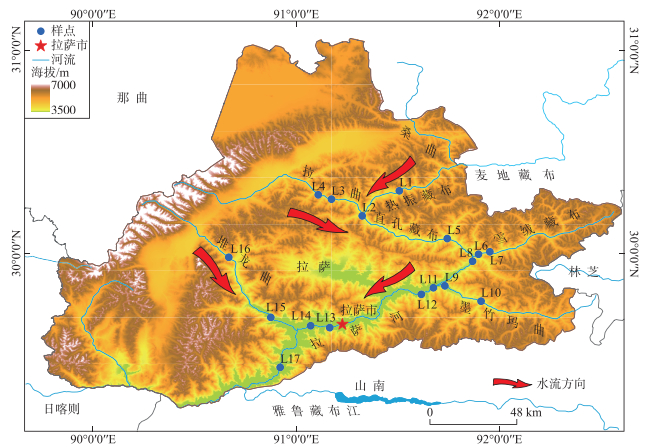
|
图 1 拉萨河中下游干流及支流样点分布 Fig.1 Distribution of the main stream and tributaries in the middle and lower reaches of Lhasa River |
浮游植物样品根据《淡水浮游生物研究方法》[20]中规定的方法进行采集和鉴定。定性样品采用25#浮游网进行采集样品,流速较快的河流断面采取上下移动的方法进行样品采集,流速度较慢的河流中约离河面0~0.5 m处,采用“∞”型过滤方法在河流中缓慢拖动约10 min。之后把采集到的样品浓缩至500 mL装入采样瓶中,并将残留在浮游网的样品用河水冲洗到采样瓶中,贴上标签作为定性样品。定量样品在0~0.5 m处采集1 L混合水样,随后立即用鲁哥氏试剂固定,样品带回实验室沉淀48 h后浓缩至50 mL,移取0.1 mL浓缩匀液至0.1 mL计数框,在10×40倍显微镜下全片计数,每个样品计数2~3次,物种鉴定在室内使用Olympus显微镜,用定量样品与活体观察相结合的方法鉴定浮游植物的种类。浮游植物的鉴定参考经典文献[21-23]。
2.3 数据处理与分析 2.3.1 优势种根据McNaughton优势度指数(Y)[24-25]确定优势种,计算公式为:
| $Y=F_i \cdot n_i / n$ | (1) |
式中,Fi为第i种出现的频率,n为同一样点中个体总数,ni为第i种的个体数。Y>0.02为优势种,Y>0.1为绝对优势种。
2.3.2 生态位宽度生态位宽度(Bi)采用Colwell等加权修正的Levins指数[26],计算公式为:
| $B_i=1 / r \sum\nolimits_{j=1}^r p_{i j}^2$ | (2) |
式中,Bi为物种的生态位宽度,pij为物种i在第j个样点的个体数占该种所有个体数的比例,pi=Nij/Ni,i表示物种,j为资源(季节或样点),Nij为种群i在季节或样点j的数量,Ni为种群i的总数量,r为采样点数。
2.3.3 生态位重叠与生态响应速率生态位重叠(Oik)指数选用Pinaka指数[27],计算公式为:
| $O_{i k}=\frac{\sum\nolimits_{j=1}^N\left(p_{i j} \cdot p_{k j}\right)}{\sqrt{\sum\nolimits_{j=1}^N p_{i j}^2 \cdot \sum\nolimits_{j=1}^N p_{k j}^2}}$ | (3) |
| $\Delta O_{i k}=\sum\nolimits_{k=1} O_{i k}-\sum\nolimits_{i=1} O_{i k}$ | (4) |
| $R=B_i / \Delta O_{i k}$ | (5) |
式中,Oik为物种i与物种k的生态位重叠指数,取值范围为[0, 1];pij为物种i利用资源状态j(季节或样点)的个体数占该种个体总数的比例;pkj为物种k利用资源状态j(季节或站位)的个体数占该种个体总数的比例。Oik>0.3时,种对之间生态位的重叠有意义,Oik>0.6时,种对有显著的生态位重叠[28]。ΔOik为相对占有资源量。当i=k时,ΔOik>0,说明该种处于发展期;ΔOik<0,表明该种处于衰退期;ΔOik=0,表明该种为中性。R表示生态响应速率。
2.3.4 种间联结性本研究采用方差比率法(variance ratio,VR)对总体关联性进行测定,结合χ2检验定性判定种间联结性,并以共同出现百分率(percentage co-occurrence,PC)为辅助参数,以增加结果的精确性和可信度[29-31]。总体关联性用方差比率法[32]计算,计算公式为:
| $\sigma_T^2=\sum\nolimits_{i=1}^s P\left(1-P_i\right)^2$ | (6) |
| $P_i=\frac{n_i}{N}$ | (7) |
| $S_T^2=\frac{1}{N} \sum\nolimits_{j=1}^N\left(T_j-t\right)^2$ | (8) |
| $V R=\frac{S_T^2}{\sigma_T^2}$ | (9) |
| $W=N \cdot V R$ | (10) |
式中,σT2表示总样点方差,Pi为物种i出现的频度,ni表示物种i出现的样点数,N表示总样点数;ST2表示总种数方差,S表示浮游植物优势种总种数,Tj表示样点j内浮游植物优势种出现的种数,t表示样点中优势种的平均数[t =(T1+T2+…+Tn)/N];当VR < 1时,物种间总体为负关联关系,当VR>1时,物种间总体为正关联关系,采用统计量W=N·VR检验VR值偏离1的显著程度,若无显著关联,则χ0.952(N) < W < χ0.052(N)的概率为90%。
种间联结性检验采用χ2值通过连续校正公式[33]计算:
| $\chi^2=\frac{N(|a d-b c|-0.5 N)^2}{(a+b)(a+c)(b+d)(c+d)}$ | (11) |
式中,a为2个物种组成的种对同时存在的样点之和,b和c分别为只出现一个物种的样点之和,d为种对共同出现频率为0的样点数。因χ2检验值无负值,利用ad-bc的符号判断物种间的正、负联结性。χ2 < 3.841(P>0.05),说明联结性不显著;3.841≤χ2≤6.635(0.01≤P≤0.05),说明联结显著;χ2>6.635 (P < 0.01),说明联结性极显著。
在χ2检验后,计算PC可进一步验证χ2检验中存在不显著的种对间的联结程度,结果更精确。PC可算出种对正联结程度,计算公式为:
| $P C=\frac{a}{a+b+c}$ | (12) |
式中,PC取值区间为[0, 1],PC取值越偏向1表示物种间联结性越强,PC值为0表示无联结性。PC能反映由χ2检验判断为不显著种对的联结性及大小,能让种对同时出现时显著程度增强。
2.3.5 数据统计和处理分析采用ArcGIS 10.5软件绘制样点图,通过Excel 2016软件计算优势度指数、生态位宽度指数、生态位重叠指数,用R语言3.6.3计算种间联结性。利用Origin 9.0作图软件绘制浮游植物群落结构图、生态位重叠指数图和相对资源占有率图,利用AI作图软件绘制种间联结性图。
3 结果与分析 3.1 优势种通过对拉萨河中下游3个水文期浮游植物进行鉴定,共发现浮游植物393种,隶属于6门8纲24目48科100属。其中,硅藻共265种,占总物种数的67.44 %;绿藻共71种,占17.95%;蓝藻共44种,占11.33%;黄藻、裸藻和金藻种类较少,分别占2.17%、0.79 %和0.32%,3个水文期浮游植物均为硅藻-绿藻-蓝藻型群落特征(图 2)。拉萨河中下游3个水文期共鉴定出优势种19种,均隶属硅藻门(表 1),其中,尖针杆藻、长平板藻、美丽双菱藻、双头针杆藻、普通等片藻、克洛脆杆藻和窗格平板藻是3个水文期的共有优势种。平水期共鉴定出浮游植物优势种14种,普通等片为平水期绝对优势种(Y>0.1);丰水期共鉴定出浮游植物优势种12种,双头针杆藻、克洛脆杆藻、窗格平板藻和普通等片藻为绝对优势种;枯水期共鉴定出浮游植物优势种12种,双头针杆藻、普通等片藻和克洛脆杆藻为绝对优势种。
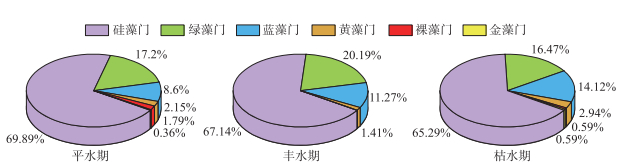
|
图 2 拉萨河中下游不同水文期浮游植物群落结构 Fig.2 Phytoplankton community structure in different hydrological periods in the middle and lower reaches of Lhasa River |
| 表 1 拉萨河中下游不同水文期浮游植物优势种出现频率(fi)及优势度(Y) Tab. 1 Occurrence frequency (fi) and dominance (Y) of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River |
拉萨河中下游3个水文期浮游植物优势种的生态位宽度如表 2所示。其中,平水期优势种的生态位宽度变化范围为0.176~0.751,生态位宽度最大的是窗格平板藻和长平板藻,生态位宽度最小的是尖针杆藻;丰水期优势种的生态位宽度变化范围为0.089~0.645,生态位宽度最大的是克洛脆杆藻(0.645),生态位宽度最小的是短小曲壳藻;枯水期优势种的生态位宽度变化范围为0.103~0.728,生态位宽度最大的是双头针杆藻,生态位宽度最小的是扭曲针杆藻。
| 表 2 拉萨河中下游不同水文期浮游植物优势种生态位宽度(Bi) Tab. 2 Niche Width (Bi) of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River |
根据各优势种在不同水文期的生态位宽度可将优势种分为3类:第1类[34]生态位宽度值较大(Bi>0.5),如平水期的窗格平板藻、双头针杆藻、长平板藻和克洛脆杆藻,这一类分布广,对资源的利用以及生态适应性强,外部环境的变化对自身的生存繁衍影响较小;第2类生态位宽度值较小(0.15≤Bi≤0.5),包含平水期的放射舟形藻和丰水期的钝脆杆藻披针形变种以及枯水期的短小舟形藻等,这一类受水体理化因子和季节变化的影响较大;第3类生态位宽度值小(Bi < 0.15),包含丰水期的短小曲壳藻和枯水期的偏肿桥弯藻、冬季等片藻和扭曲针杆藻4种,这一类生态适应性较弱,对水体环境条件变化比较敏感。
3.2.2 生态位重叠值拉萨河中下游浮游植物优势种生态位重叠值如图 3所示。3个水文期19个优势种的生态位重叠值变化范围为0.001~0.966。其中,平水期的生态位重叠值变化范围为0.024~0.855,出现15个重叠度较高(Oik>0.6)的种对,占总对数的16.48%,47对重叠度较低(0.3 < Oik≤0.6)的种对,占51.65%;重叠度低(0 < Oik≤0.3)的种对占31.87%。丰水期的生态位重叠值变化范围为0.046~0.966,重叠度较高(Oik >0.6)的种对有8对,占总对数的12.12%;重叠度较低(0.3 < Oik≤0.6)的种对有21对,占31.82%;重叠度低(0 < Oik≤0.3)的种对有37对,占56.06%。枯水期的生态位重叠值变化范围为0.001~0.710,出现7个重叠度较高(Oik >0.6)的种对,占总对数的10.61%;重叠度较低(0.3 < Oik≤0.6)的种对有20个,占30.29%;重叠度低(0 < Oik≤0.3)的种对为39个,占59.09%。3个水文期浮游植物优势种生态位重叠程度为平水期>丰水期>枯水期。总体而言,拉萨河中下游浮游植物优势种的生态位重叠程度较低。

|
图 3 拉萨河中下游不同水文期浮游植物群落优势种生态位重叠值(Oik)(种号同表 2,下同) Fig.3 Niche overlap value (Oik) of dominant species of phytoplankton community in different hydrological periods in the middle and lower reaches of Lhasa River (Species No. referred to Tab. 2, the same below) |
拉萨河中下游浮游植物群落优势种的相对资源占有量和生态响应速率结果如图 4所示。平水期,近缘针杆藻有最大的负ΔOik,表明近缘针杆藻属于衰退型且衰退空间最大,窗格平板藻有最大的正ΔOik,表明窗格平板藻属于发展型且发展空间最大,与其他优势种在资源利用上有竞争优势。丰水期,双头针杆藻有最大的发展空间,窗格平板藻有最大的衰退空间。枯水期,窗格平板藻有最大的正ΔOik,偏肿桥弯藻有最大的负ΔOik。平水期,双头针杆藻的发展趋势较为强烈(R=0.058),肘状针杆藻的发展趋势较弱(R =0.026);缢缩异极藻的衰退趋势较为强烈(R=-0.086),近缘针杆藻的衰退趋势较弱(R=-0.004)。丰水期,弧形蛾眉藻的发展趋势较为强烈(R=0.493),双头针杆藻的发展趋势较弱(R=0.026);长平板藻的衰退趋势较为强烈(R=-0.100),窗格平板藻的衰退趋势较弱(R=-0.014)。枯水期,普通等片藻的发展趋势较为强烈(R=1.619),窗格平板藻的发展趋势较弱(R=0.016);短肋羽纹藻的衰退趋势较为强烈(R=-0.763),偏肿桥弯藻的衰退趋势较弱(R=-0.009)。
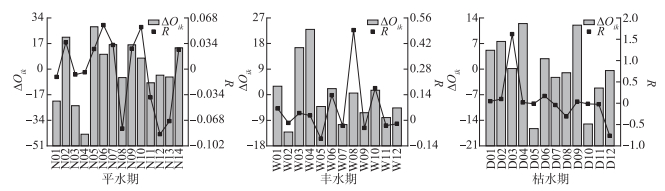
|
图 4 拉萨河中下游不同水文期浮游植物优势种相对占用资源量(ΔOik)及生态响应速率(R) Fig.4 Relative occupied resources (ΔOik) and ecological response rate (R) of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River |
由表 3可知,在拉萨河中下游的17个样点中,χ0.952=8.672,χ0.052=27.587,3个水文期VR值均大于1,平水期和丰水期统计量W均不在[χ0.952 (N),χ0.052 (N)]范围内,表明平水期和丰水期浮游植物群落优势种间总体上均呈显著正关联;枯水期统计量W在[χ0.952 (N),χ0.052 (N)]范围内,表明枯水期浮游植物群落优势种间总体上呈不显著正关联。
| 表 3 拉萨河中下游不同水文期浮游植物优势种种间总体关联性 Tab. 3 Overall correlation of phytoplankton dominant species in different hydrologic periods in the middle and lower reaches of Lhasa River |
拉萨河中下游不同水文期浮游植物群落优势种的χ2检验结果占比见表 4,平水期的χ2检验共有91个种对,其中正联结性38对,负联结性40对,群落正负联结比为0.95。丰水期的χ2检验共66个种对,其中52个种对联结性不显著,有3个显著联结种对和11个不联结的种对,正联结性30对,负联结性25对,正负联结比为1.2,群落结构相对于平水期较稳定[35]。枯水期的χ2检验共66个种对,存在40个为联结性不显著种对;正联结性32对,负联结性34对,群落正负联结比为0.94。
| 表 4 拉萨河中下游不同水文期浮游植物优势种种间联结性χ2检验 Tab. 4 χ2 test of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River |
共同出现百分率结果如图 5所示,平水期有59个联结程度较强(PC>0.6)的种对,32个联结程度一般(0.4 < PC≤0.6)的种对,分别占总对数的64.84%和35.16%;丰水期有31个联结程度较强的种对,25个联结程度一般的种对,分别占总对数的46.97%和37.88%;枯水期有10个联结程度较强的种对,约占总对数的11.15%,出现7个趋向独立(0 < PC≤0.2)的种对,约占总对数的10.59%,总体而言,拉萨河中下游3个水文期浮游植物群落优势种正联结程度为平水期>丰水期>枯水期。

|
图 5 拉萨河中下游不同水文期浮游植物优势种共同出现百分率(PC) Fig.5 Co-occurrence percentage (PC) of dominant phytoplankton species in different hydrological periods in the middle and lower reaches of Lhasa River |
拉萨河中下游浮游植物在3个水文期均以硅藻为主(67.44%),整体为硅藻-绿藻-蓝藻型群落特征,且3个水文期优势种均隶属硅藻门,拉萨河属高原河流,受海拔高度的影响,水温常年较低海拔地区低[17],水温作为浮游植物自身新陈代谢的重要驱动力[36],可通过控制浮游植物光合作用的酶促反应、呼吸作用强度以及影响自身营养盐吸收速率进而影响浮游植物的增殖[37-38]。硅藻对低水温的环境具有极强的适应性,低温环境对硅藻的繁殖及代谢影响较小[22],此次研究各样点平水期、丰水期、枯水期测得水温均值分别为12.91、12.29、5.40℃[19],3个水文期平均水温均低于15℃,低温或成为影响喜高温的蓝藻、绿藻[39]在拉萨河中下游繁衍与分布的限制因子,形成了拉萨河中下游浮游植物独特的群落特征。
生态位宽度是种群对资源的利用程度和对环境的适应能力的总体表现[40]。生态位宽度的大小主要用来解释生境变化是如何影响泛化种和特化种的分布和数量,根据其大小可分为狭生态位和广生态位[41]。广生态位藻种的活动情况是体现整个藻类群落结构和水环境状况的重要指标,双头针杆藻的生态位宽度值在3个水文期均大于0.5,在拉萨河中下游表现出较强的生态适应性,在季节更替、不稳定生境下也能在水体中占据较大生存空间,对资源的利用程度和对环境的适应能力强,属于广生态位种。而狭生态位种则分布空间狭小,冬季等片藻和扭曲针杆藻属于狭生态位种,生态位宽度值小(Bi < 0.15)且只在一个水文期成为优势种,说明对水环境条件变化比较敏感,表现出较弱的生态适应性,对环境因子有一定的依赖性,也可能是当季相对较宽生态位藻种的代谢产物[42],或其他水生植物竞争抑制了它们的生长,冬季等片藻和扭曲针杆藻仅在某一季节成为优势种且生态位宽度也较小,说明生态位宽度能反映物种分布范围,这与杨文焕等[43]的研究结果一致。平水期的窗格平板藻生态位宽度值在3个水文期中最大(Bi=0.751),根据平水期采样结果显示窗格平板藻在所设置的各样点均有分布,且数量较多,说明窗格平板藻在平水期对各类资源的利用能力较强,占据了水体中大部分资源;缢缩异极藻只在平水期成为优势种,可能与其生物学特性有关,缢缩异极藻属附生藻类[22],平水期水流速度相对平稳,苔藓、水草等水生高等植物的生长受到的影响较小,且河床上受到的水流冲刷力不大,能为其提供了相对稳定的附生空间,当种群数量增大,随水流向水体中扩散并占据一定空间,仅在平水期成为优势种。丰水期的短小曲壳藻生态位宽度值为3个水文期最低,仅为0.089,对生境耐受范围有限,可能是对某一环境因子的依赖性大,能适应的生境趋于特化,可作为水域的污染指示种[44]。浮游植物的生态位宽度一定程度上反映了该流域在不同环境条件下物种的生态习性差异,同一种优势种在不同水文期生态位宽度有较大差异,如窗格平板藻在平水期生态位宽度较高,丰水期和枯水期相对较低,这可能是由于浮游植物自身代谢机制,对环境的季节变化作出响应,来适应不断变化的生活环境。
生态位重叠是两个或两个以上生态位相似的物种生活于同一空间时分享或竞争共同资源的现象[45-46]。两个物种之间利用资源或栖息环境相似的情况下,会导致生态位重叠情况发生[47]。拉萨河中下游3个水文期浮游植物群落优势种重叠值都比较低,其中平水期重叠度较低(0.3 < Oik≤0.6),占总对数的51.65%,丰水期和枯水期重叠度低(0<Oik≤0.3)的种对分别占56.06%和59.09%,生态位重叠值总体较低,由于鉴定出的优势种均以单细胞的形式存在且个体较小,各自占据的生存空间和资源有限,优势种间对空间和资源的竞争也较弱。平水期,优势种尖针杆藻和近缘针杆藻的种对生态位重叠值最小,仅为0.024,表明在平水期尖针杆藻和近缘针杆藻共同利用资源较少,对环境适应能力的差异较大。丰水期,短小曲壳藻和普通等片藻的生态位重叠值最高(Oik =0.966),说明短小曲壳藻和普通等片藻占据的生境资源相近,表现出竞争干扰。枯水期,扭曲针杆藻和短小舟形藻的生态位重叠值最低(Oik =0.001),表明扭曲针杆藻和短小舟形藻对水环境中资源需求差异巨大,二者占据的共同生存空间小,竞争关系较弱。双头针杆藻在3个水文期的生态位宽度相对较大,与其他优势种的生态位重叠值也较高,除此之外,虽然丰水期短小曲壳藻和普通等片藻生态位宽度低,但两个种生态位重叠值最高,可能是高原河流空间异质性高所导致的[43]。总体上看,生态位重叠值为平水期>丰水期>枯水期,根据拉萨河中下游各样点水体平均水温结果来看,平水期和丰水期的水温均较枯水期高,较高的水温可能提高了优势种种群的扩散速率,从而加剧了对生境资源的种内或种间竞争。
相对资源占有量的大小能反映物种所占有空间资源能力的强弱和分布范围的广泛程度情况[48]。基于R值可进一步确定不同水文期优势种对生境条件的生态响应状况[34]。从拉萨河中下游浮游植物优势种相对资源占有量来看,生态位宽度大的藻种都具有较强的发展空间,如平水期的窗格平板藻、丰水期相对资源占有量最高的双头针杆藻(ΔOik =22.991)以及枯水期生态位宽度最宽的双头针杆藻(Bi=7.28)等;生态位宽度较小的浮游植物优势种,大多数属于衰退型种群,如平水期的近缘针杆藻、丰水期的窗格平板藻和枯水期的偏肿桥弯藻等。平水期的双头针杆藻(R=0.058)、丰水期的弧形蛾眉藻(R=0.493)和枯水期的普通等片藻(R=1.619)发展趋势较强,将会逐渐代替其他衰退型的浮游植物,生态因子的季节变化、种内或种间竞争都会直接或间接影响浮游植物群落演替[49-50]。而衰退趋势较强的浮游植物,如平水期的缢缩异极藻(R=-0.086)、丰水期的长平板藻(R=-0.100)和枯水期的短肋羽纹藻(R=-0.763)将会逐渐消亡。结合生态位宽度分析,平水期生态位宽度最大的长平板藻在丰水期呈现最为严重的衰退趋势,可能的原因是长平板藻在平水期分布范围达到了峰值,随着季节演替,到了丰水期则衰退趋势较明显。
4.2 种间联结性种间联结是植物群落重要的数量和结构特征之一,群落的种间关系能反映群落的稳定性[35]。种间关系一般被划分为正联结、负联结和无关联[51]。群落内物种种间关系越复杂,生态位分化越合理,种间关系越趋于正联结[52]。拉萨河中下游3个水文期VR值都大于1,排序为平水期>丰水期>枯水期,表明3个水文期浮游植物群落优势种总体关联性呈正关联,且平水期和丰水期呈显著正关联,表明该流域平水期和丰水期浮游植物群落内物种生态位分化较枯水期合理,物种组成相对于枯水期趋于稳定。胡洋等[53]的研究结果表明,浮游生物物种的特异性关系、物种脆弱性在冬季最小且群落稳定性最弱,本研究枯水期采样时间为11月份(冬季),刚进入枯水期不久,群落可能正处于丰水期扰动后的发展阶段。
根据χ2检验结果各区间占比显示,平水期、丰水期和枯水期优势种正关联(ad>bc)占比分别为41.76%、45.46%和48.49%,负关联(ad < bc)和无关联(ad=bc)所占比例比正关联的比例高,且联结性不显著(χ2 < 3.841)的占比最高,说明3个水文期种对间关联程度一般,分布格局相对独立且种间关系较为松散,优势种种间关联程度与生态位重叠程度也不完全一致,可能是物种组成季节变化所导致的[54]。周先叶等[55]的研究结果表明,正负关联比越高,群落结构越趋于稳定,总体上拉萨河中下游浮游植物优势种负关联种对多于正关联,表明群落种间联结不紧密、可能生态位宽度较小的浮游植物无法适应而在某个水文期种类和数量大量减少,进而影响整个水域的群落演替速率。枯水期调查的12种浮游植物优势种中,在66个种对内出现极显著负联结性χ2>6.635(ad < bc)的种对,占10.61%,即这些种对的优势种相对独立。根据水体指标测定结果,平水期、丰水期和枯水期各样点水流速度均值分别为0.91、1.16、0.62 m/s[19],可能是由于枯水期流速的降低限制了种群的扩散,优势藻种间竞争关系弱,或是枯水期水温较低而浮游植物生长代谢缓慢[56],导致枯水期物种在资源和空间上的相互依赖程度低。
根据共同出现百分率可知,平水期联结程度较强的种对(PC>0.6)占总对数的64.84%,丰水期联结性较强的种对占总对数的46.97%,枯水期联结程度较强的种对有10对,占总对数的15.15%,正联结程度较强的种对占总对数的比例为平水期>丰水期>枯水期,排列与3个水文期优势种生态位重叠程度一致,说明拉萨河中下游浮游植物群落优势种生态位重叠值与正联结程度有关,优势种种间联结性随季节更替逐渐降低,群落中各物种种间关系从平水期-丰水期-枯水期由紧密变为松散,呈现逆向演替的趋势。
5 结论拉萨河中下游浮游植物整体为硅藻-绿藻-蓝藻型群落的特征,3个水文期共鉴定出浮游植物优势种19种,同一种优势种在不同水文期生态位宽度有较大差异,双头针杆藻在3个水文期均为优势种且生态位宽度值均大于0.5,表现出较强的生态适应性,属广生态位种,短小曲壳藻种间相互竞争激烈且生境趋向于特化,可作为拉萨河中下游水域的污染指示种。优势种生态位重叠值为平水期>丰水期>枯水期,总体上优势种对资源的利用共性小,竞争态势相对均衡,丰水期优势种短小曲壳藻和普通等片藻占据的生境资源相近;长平板藻在平水期分布范围达到了峰值,随着季节演替,在丰水期表现出明显的衰退趋势;不同水文期优势种相对资源占有量与生态位宽度的变化基本一致,资源利用量较高的藻种大多数具有较强的发展空间。种间联结性分析表明,优势种正联结程度为平水期>丰水期>枯水期,优势种种间联结性随季节更替逐渐降低,拉萨河中下游3个水文期浮游植物群落优势种间负联结种对比例高且联结程度一般,群落种间联结不紧密,优势种之间以及各优势种与环境之间未达到相对的动态平衡。
| [1] |
An RZ, Pan CM, Liu Y et al. Study on the distribution pattern and coexistence mechanism of dominant summering phytoplankton population in the Basomtso. Plateau Science Research, 2020, 4(2): 27-36. [安瑞志, 潘成梅, 刘洋等. 巴松措(湖)夏季浮游植物优势种群分布格局与共存机制研究. 高原科学研究, 2020, 4(2): 27-36.] |
| [2] |
Ye R, Liu L, Wang Q et al. Biogeography of spring phytoplankton community in the coastal waters of northern Zhejiang. China Environmental Science, 2017, 37(4): 1492-1504. [叶然, 刘莲, 王琼等. 春季浙北海域浮游植物群落的空间分布. 中国环境科学, 2017, 37(4): 1492-1504. DOI:10.3969/j.issn.1000-6923.2017.04.037] |
| [3] |
Shen HT, Liu CQ. Canonical correspondence analysis of phytoplankton community and its environmental factors in the Lake Baiyangdian. J Lake Sci, 2008, 20(6): 773-779. [沈会涛, 刘存歧. 白洋淀浮游植物群落及其与环境因子的典范对应分析. 湖泊科学, 2008, 20(6): 773-779. DOI:10.18307/2008.0616] |
| [4] |
Xia T, Chen J, Cao FY et al. Niche analysis of phytoplankton in an urban river connected with the Yangtze River, Zhenjiang, China. Resources and Environment in the Yangtze Basin, 2014, 23(3): 344-350. [夏霆, 陈静, 曹方意等. 镇江通江城市河道浮游植物优势种群生态位分析. 长江流域资源与环境, 2014, 23(3): 344-350. DOI:10.11870/cjlyzyyhj201403006] |
| [5] |
Avolio ML, Forrestel EJ, Chang CC et al. Demystifying dominant species. The New Phytologist, 2019, 223(3): 1106-1126. DOI:10.1111/nph.15789 |
| [6] |
Qian KM, Chen YW, Song XL. Long-term development of phytoplankton dominant species related to eutrophication in Lake Taihu. Ecological Science, 2008, 27(2): 65-70. [钱奎梅, 陈宇炜, 宋晓兰. 太湖浮游植物优势种长期演化与富营养化进程的关系. 生态科学, 2008, 27(2): 65-70. DOI:10.3969/j.issn.1008-8873.2008.02.001] |
| [7] |
Liu Y, Zheng YY, Ao YY. Niche and interspecific association of dominant bryophytes on different substrates. Acta Ecologica Sinica, 2019, 39(1): 286-293. [刘艳, 郑越月, 敖艳艳. 不同生长基质的苔藓植物优势种生态位与种间联结. 生态学报, 2019, 39(1): 286-293. DOI:10.5846/stxb201711162042] |
| [8] |
Li XS, Yu ZH, Sun S et al. Ecological niche breadth and niche overlap of dominant species of fish assemblage in Yangtze River Estuary and its adjacent waters. Chinese Journal of Applied Ecology, 2013, 24(8): 2353-2359. [李显森, 于振海, 孙珊等. 长江口及其毗邻海域鱼类群落优势种的生态位宽度与重叠. 应用生态学报, 2013, 24(8): 2353-2359. DOI:10.13287/j.1001-9332.2013.0394] |
| [9] |
Xu CY, Yu QJ, Xu FJ et al. Niche analysis of phytoplankton's dominant species in Dianshan Lake of East China. Chinese Journal of Applied Ecology, 2012, 23(9): 2550-2558. [徐春燕, 俞秋佳, 徐凤洁等. 淀山湖浮游植物优势种生态位. 应用生态学报, 2012, 23(9): 2550-2558. DOI:10.13287/j.1001-9332.2012.0358] |
| [10] |
Xu MH, Liu M, Zhai DT et al. A review of contents and methods used to analyze various aspects of plant interspecific associations. Acta Ecologica Sinica, 2016, 36(24): 8224-8233. [徐满厚, 刘敏, 翟大彤等. 植物种间联结研究内容与方法评述. 生态学报, 2016, 36(24): 8224-8233.] |
| [11] |
Wu JM, Xu NN, Zhang WJ et al. Seasonal analysis of the niche and interspecific association of dominant species of phytoplankton in the Dinghai Moat, Zhoushan City. J Lake Sci, 2019, 31(2): 429-439. [吴佳梦, 徐娜娜, 张文珺等. 浙江舟山定海护城河浮游植物优势种生态位与种间联结性季节性分析. 湖泊科学, 2019, 31(2): 429-439. DOI:10.18307/2019.0212] |
| [12] |
Li SF, Liu WD, Su JR et al. Niches and interspecific associations of dominant tree populations at different restoration stages of monsoonal broad-leaved evergreen forest. Chinese Journal of Ecology, 2011, 30(3): 508-515. [李帅锋, 刘万德, 苏建荣等. 季风常绿阔叶林不同恢复阶段乔木优势种群生态位和种间联结. 生态学杂志, 2011, 30(3): 508-515. DOI:10.13292/j.1000-4890.2011.0072] |
| [13] |
白欢欢. 黄山松群落主要木本植物营养生态位和种间联结特征研究[学位论文]. 北京: 中国林业科学研究院, 2018.
|
| [14] |
Ma YM, Li QH, Pan SP et al. Niche and interspecific associations of Pseudoanabaena limnetica—Exploring the influencing factors of its succession stage. Ecological Indicators, 2022, 138: 108806. DOI:10.1016/j.ecolind.2022.108806 |
| [15] |
Jun S, Wang DB, Zhou JH et al. Community structures of phytoplankton and its relationship with environmental factors in the Lhasa River. Acta Ecologica Sinica, 2019, 39(3): 787-798. [君珊, 王东波, 周健华等. 拉萨河流域浮游植物群落结构特征及与环境因子的关系. 生态学报, 2019, 39(3): 787-798. DOI:10.5846/stxb201806011225] |
| [16] |
Liu JT, Li YZ, Gao ZJ et al. Hydrochemistry and relationship between groundwater and surface water in the middle and lower reaches of Lhasa River Basin. Journal of Shandong University of Science and Technology: Natural Science, 2020, 39(5): 10-20. [刘久潭, 李颖智, 高宗军等. 拉萨河流域中下游地区水化学及地表水-地下水转化关系研究. 山东科技大学学报: 自然科学版, 2020, 39(5): 10-20. DOI:10.3969/j.issn.1008-7699.2020.05.002] |
| [17] |
中国科学院青藏高原综合科学考察队. 西藏河流与湖泊. 北京: 科学出版社, 1984.
|
| [18] |
Huang L, Cao W, Wu D et al. Spatial and temporal patterns of ecosystem services and their changes on the Tibetan Plateau. Journal of Natural Resources, 2016, 31(4): 543-555. [黄麟, 曹巍, 吴丹等. 西藏高原生态系统服务时空格局及其变化特征. 自然资源学报, 2016, 31(4): 543-555. DOI:10.11849/zrzyxb.20150296] |
| [19] |
Zhang P, Liu Y, An RZ et al. Spatio-temporal niche of dominant protozoa species in the midstream and downstream of Lhasa River, Tibet, China. Scientia Silvae Sinicae, 2022, 58(1): 78-88. [张鹏, 刘洋, 安瑞志等. 西藏拉萨河中下游原生动物优势种时空生态位研究. 林业科学, 2022, 58(1): 78-88.] |
| [20] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [21] |
中国科学院青藏高原综合科学考察队. 西藏藻类. 北京: 科学出版社, 1992.
|
| [22] |
朱蕙忠, 陈嘉佑. 中国西藏硅藻. 北京: 科学出版社, 2000.
|
| [23] |
胡鸿钧, 魏印心. 中国淡水藻类系统分类及生态. 北京: 科学出版社, 2016.
|
| [24] |
McNaughton SJ. Relationships among functional properties of Californian grassland. Nature, 1967, 216(5111): 168-169. DOI:10.1038/216168b0 |
| [25] |
Habib OA, Tippett R, Murphy KJ. Seasonal changes in phytoplankton community structure in relation to physico-chemical factors in Loch Lomond, Scotland. Hydrobiologia, 1997, 350(1/2/3): 63-79. |
| [26] |
Colwell RK, Futuyma DJ. On the measurement of niche breadth and overlap. Ecology, 1971, 52(4): 567-576. DOI:10.2307/1934144 |
| [27] |
Pianka ER. The structure of lizard communities. Annual Review of Ecology and Systematics, 1973, 4: 53-74. DOI:10.1146/annurev.es.04.110173.000413 |
| [28] |
Krebs CJ. Ecological methodology. New York: Harper Collins Publishers, 1989. DOI:10.4236/jep.2011.24038
|
| [29] |
Cheng RM, Wang RL, Liu ZB et al. Interconnection among species of dominant tree populations of Castanopsis community in Three Gorges Reservoir region. Scientia Silvae Sinicae, 2013, 49(5): 36-42. [程瑞梅, 王瑞丽, 刘泽彬等. 三峡库区栲属群落主要乔木种群的种间联结性. 林业科学, 2013, 49(5): 36-42. DOI:10.11707/j.1001-7488.20130506] |
| [30] |
Dai DX, Yu CG, Liu H et al. Niche and interspecific association of major nekton in the sea area to the east of the Nanji Islands. Chinese Journal of Applied Ecology, 2019, 30(12): 4249-4258. [戴冬旭, 俞存根, 刘惠等. 南麂列岛东侧海域主要游泳动物生态位及种间联结性. 应用生态学报, 2019, 30(12): 4249-4258. DOI:10.13287/j.1001-9332.201912.033] |
| [31] |
Dong JR, Shui BN, Hu CY et al. Niche and interspecific association of the dominant fish in the south coastal waters of Wenzhou, China. Chinese Journal of Applied Ecology, 2017, 28(5): 1699-1706. [董静瑞, 水柏年, 胡成业等. 温州南部沿岸海域主要鱼类的生态位及种间联结性. 应用生态学报, 2017, 28(5): 1699-1706. DOI:10.13287/j.1001-9332.201705.028] |
| [32] |
Schluter D. A variance test for detecting species associations, with some example applications. Ecology, 1984, 65(3): 998-1005. DOI:10.2307/1938071 |
| [33] |
张金屯. 数量生态学. 北京: 科学出版社, 2004.
|
| [34] |
An RZ, Zhang P, Da Z et al. Niche and interspecific association of dominant protozoan species in different hydrological periods in Maidika Wetland, Tibet. Scientia Silvae Sinicae, 2020, 57(2): 126-137. [安瑞志, 张鹏, 达珍等. 西藏麦地卡湿地不同水文期原生动物优势种生态位及其种间联结性. 林业科学, 2020, 57(2): 126-137. DOI:10.11707/j.1001-7488.20210213] |
| [35] |
Zhang GP, Zhang F, Ru WM. Interspecific correlations among dominant populations of ligneous species in Mianshan Mountain of Shanxi. Chinese Journal of Ecology, 2006, 25(3): 295-298. [张桂萍, 张峰, 茹文明. 山西绵山植被木本植物优势种群种间关联. 生态学杂志, 2006, 25(3): 295-298. DOI:10.1016/S1872-2032(06)60052-8] |
| [36] |
Tang T, Jia XH, Jiang WX et al. Multi-scale temporal dynamics of epilithic algal assemblages: Evidence from a Chinese subtropical mountain river network. Hydrobiologia, 2016, 770(1): 289-299. DOI:10.1007/s10750-015-2603-8 |
| [37] |
Yan GH, Yin XY, Wang X et al. Effects of environmental factors on the composition of phytoplankton community in Sankou of the Yangtze River and the western Dongting Lake. China Environmental Science, 2019, 39(6): 2532-2540. [严广寒, 殷雪妍, 汪星等. 长江三口-西洞庭湖环境因子对浮游植物群落组成的影响. 中国环境科学, 2019, 39(6): 2532-2540.] |
| [38] |
Li JL, Zheng BH, Liu LS et al. Phytoplankton community structure in the Yangtze River Estuary and its relation to environmental factors. Research of Environmental Sciences, 2013, 26(4): 403-409. [李俊龙, 郑丙辉, 刘录三等. 长江口浮游植物群落特征及其与环境的响应关系. 环境科学研究, 2013, 26(4): 403-409. DOI:10.13198/j.res.2013.04.66.lijl.001] |
| [39] |
Mi WM, Shi JQ, Yang YJ et al. Changes in epilithic algae community and its relationship with environmental factors in the Meixi River, a tributary of the Three Gorges Reservoir. Environmental Science, 2020, 41(4): 1636-1647. [米文梅, 施军琼, 杨燕君等. 三峡库区支流梅溪河附石藻类群落变化及其与环境因子的关系. 环境科学, 2020, 41(4): 1636-1647. DOI:10.13227/j.hjkx.201909253] |
| [40] |
Wang ZC, Wu WJ, Zuo M et al. Niche analysis of phytoplankton community in lake Chaohu. Resources and Environment in the Yangtze Basin, 2010, 19(6): 685-691. [汪志聪, 吴卫菊, 左明等. 巢湖浮游植物群落生态位的研究. 长江流域资源与环境, 2010, 19(6): 685-691.] |
| [41] |
Liu H, Guo PJ, Chen ZJ et al. Niche and interspecific association of main crustaceans in the nearshore waters of Zhoushan. Acta Oceanologica Sinica, 2019(4): 83-93. [刘惠, 郭朋军, 陈洲杰等. 舟山近岸海域主要甲壳类的生态位及其与种间联结性. 海洋学报, 2019(4): 83-93.] |
| [42] |
Zhang X, Lu XQ, Wang L et al. Allelopathic effect of Ruppia maritima on Chlorella vulgaris and Microcystis aeruginosa. China Environmental Science, 2019, 39(4): 1589-1595. [张欣, 卢学强, 王兰等. 川蔓藻对两种常见浮游藻类的化感作用. 中国环境科学, 2019, 39(4): 1589-1595.] |
| [43] |
Yang WH, Shen H, Zhou ML et al. Seasonal variation analysis of the niche and interspecific association with respect to the dominant phytoplankton species in Nanhai Lake. China Environmental Science, 2020, 40(1): 383-391. [杨文焕, 申涵, 周明利等. 包头南海湖浮游植物优势种生态位及种间联结性季节分析. 中国环境科学, 2020, 40(1): 383-391.] |
| [44] |
Suo YZ, Liu Y, Liu YK et al. Phytoplankton pollution indicator species and water quality assessment in the middle and upper reaches of the Yarlung Tsangpo. Environmental Ecology, 2021, 3(3): 26-32. [索雨泽, 刘洋, 刘宇康等. 雅鲁藏布江中上游浮游植物污染指示种及水质评价. 环境生态学, 2021, 3(3): 26-32.] |
| [45] |
覃林. 统计生态学. 北京: 中国林业出版社, 2009.
|
| [46] |
Sagar T, Wilson P. Niches of common bryophytes in a semi-arid landscape. The Bryologist, 2009, 112(1): 30-41. |
| [47] |
Pan CM, Liu Y, An RZ et al. Phytoplankton in the Mitika Wetland, Tibet, China: 1. Spatio-temporal niche of dominant species. J Lake Sci, 2021, 33(6): 1805-1819. [潘成梅, 刘洋, 安瑞志等. 西藏麦地卡湿地的浮游植物——1.优势种的时空生态位. 湖泊科学, 2021, 33(6): 1805-1819. DOI:10.18307/2021.0616] |
| [48] |
Jiang WX, Fu XC, Tang T et al. Community structure and niche of macroinvertebrates in the Xiangxi River in Hubei, China. Chinese Journal of Applied & Environmental Biology, 2009, 15(3): 337-341. [蒋万祥, 傅小城, 唐涛等. 香溪河水系大型底栖动物的群落结构及生态位. 应用与环境生物学报, 2009, 15(3): 337-341.] |
| [49] |
He SH, Ou YT, Zhao L et al. Analysis of phytoplankton community stability and its driving factors in tributaries of Three Gorges Reservoir Area. Environmental Science, 2021(7): 3242-3252. [何书晗, 欧阳添, 赵璐等. 三峡库区支流浮游植物群落稳定性及其驱动因子分析. 环境科学, 2021(7): 3242-3252. DOI:10.13227/j.hjkx.202012096] |
| [50] |
Wang X, Li LQ, Zheng BH et al. Composition and influential factors of algal function groups in Dongting Lake. China Environmental Science, 2016, 36(12): 3766-3776. [汪星, 李利强, 郑丙辉等. 洞庭湖浮游藻类功能群的组成特征及其影响因素研究. 中国环境科学, 2016, 36(12): 3766-3776.] |
| [51] |
Roxburgh SH, Chesson P. A new method for detecting species associations with spatially autocorrelated data. Ecology, 1998, 79(6): 2180-2192. |
| [52] |
Wang NJ, Zhang WH, Lu YC et al. Interspecific association among the plants communities in the forest at Ziwuling Area in Shaanxi Province. Acta Ecologica Sinica, 2010, 30(1): 67-78. [王乃江, 张文辉, 陆元昌等. 陕西子午岭森林植物群落种间联结性. 生态学报, 2010, 30(1): 67-78.] |
| [53] |
Hu Y, Zhang YZ, Jiang XY et al. Seasonal characteristics of nestedness pattern and interaction of plankton assemblages in East Lake Taihu. J Lake Sci, 2022, 34(5): 1620-1629. [胡洋, 张亚洲, 姜星宇等. 东太湖浮游植物与浮游动物群落的嵌套性及其互作网络的季节特征. 湖泊科学, 2022, 34(5): 1620-1629. DOI:10.18307/2022.0516] |
| [54] |
An RZ, Pan CM, DZ et al. Vertical distribution characteristics of phytoplankton functional groups in Basongcuo, Tibet and their relationship with environmental factors. J Lake Sci, 2021, 33(1): 86-101. [安瑞志, 潘成梅, 达珍等. 西藏巴松错浮游植物功能群垂直分布特征及其与环境因子的关系. 湖泊科学, 2021, 33(1): 86-101. DOI:10.18307/2021.0114] |
| [55] |
Zhou XY, Wang BS, Li MG et al. Analysis of interspecific association of communities in the process of forest secondary succession in Heishiding Nature Reserve, Guangdong Province. Chinese Journal of Plant Ecology, 2000, 24(3): 332. [周先叶, 王伯荪, 李鸣光等. 广东黑石顶自然保护区森林次生演替过程中群落的种间联结性分析. 植物生态学报, 2000, 24(3): 332.] |
| [56] |
Wang SX, Wei L, Wang S et al. Seasonal changes of phytoplankton community structure and its influencing factors in lakes and reservoirs adjacent to water sources in Shanghai. J Lake Sci, 2022, 34(4): 1127-1139. [王三秀, 魏莱, 王爽等. 上海水源地毗邻湖库浮游植物群落结构的季节变化及其影响因子. 湖泊科学, 2022, 34(4): 1127-1139. DOI:10.18307/2022.0407] |
 2023, Vol. 35
2023, Vol. 35 

