(2: 中国科学院大学, 北京 100049)
(3: 湖北省十堰地质环境监测保护站, 十堰 442099)
(4: 河海大学水文水资源学院, 南京 210098)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Geological Environment Monitoring and Protection Station of Shiyan, Shiyan 442099, P. R. China)
(4: College of Hydrology and Water Resources, Hohai University, Nanjing 210098, P. R. China)
湖泊沉积物接纳了大量的有机质,是湖泊生命活动中有机质消费和转换的重要场所,同时也是湖泊碳循环中的“碳源”和“碳汇”[1]。内源的藻类、浮游动植物和其他水生生物的残体,以及外源的陆源植物碎屑、土壤有机质等在水柱中经过一系列生物地球化学过程,最终沉降在沉积物表面[2]。其中活性有机质可能对沉积物有机质(SOM)的生物地球化学过程产生“激发效应”,即不稳定有机质输入,改变原存于土壤或沉积物中更稳定有机质的矿化速率,进而影响污染物质迁移释放的行为[3]。这一现象最早发现于土壤科学,近年来在水生态系统中也发现了正的、负的以及无效应的“激发效应”。例如Fortino等[4]向池塘沉积物中加入落叶分解物,沉积物的矿化速率升高,即产生正激发效应;Wologo等[5]研究冻土中的生物对河流溶解性有机质(DOM)的影响发现,冻土中的微生物降低了河流中DOM的矿化速率,即产生负激发效应;Blanchet等[6]向河水中添加标记过的氨基酸溶液,在所有组别中未检测到激发效应。输入有机质多样性、沉积环境异质性、微生物作用过程复杂性等因素造成水生态系统中激发效应的不确定性和研究的挑战性。
藻类碎屑作为重要的SOM不稳定有机质来源,不仅可能对SOM的矿化过程产生激发效应,也会对SOM的生物地球化学过程产生影响,从而对水体的营养状态产生潜在影响。相关研究利用室内模拟实验探究蓝藻水华衰亡过程中DOM的迁移转化,发现蓝藻水华衰亡会释放大量有机质,改变上覆水的DOM组成[7]。并且,高密度蓝藻堆积加快沉积物微生物代谢进程,增加沉积物-水界面氮、磷营养盐释放通量[8]。藻屑降解使局部水体处于强还原状态,导致沉积物中铁结合态磷解析并释放到上覆水中;同时沉积物中铁氧化物和硫元素在还原状态下容易转化为Fe2+和S2-并在沉积物中富集[9],对湖泊造成潜在污染影响。
抚仙湖是我国最大的深水型淡水湖泊,虽然仍保持贫营养状态,但从1980s以来,抚仙湖流域的水质逐渐下降,综合营养状态指数上升,浮游植物生物量日益增加,2002年甚至大面积暴发蓝藻水华[10]。大量繁殖的浮游植物导致抚仙湖水体透明度急剧下降,藻屑沉降造成沉积物高负荷有机质积累问题突出。抚仙湖沉积物内源有机碳比例可达60%以上[11],且大部分来源于藻类[12],因此研究藻源性有机质输入引起的沉积环境生物地球化学过程变化具有重要意义。
目前藻类对湖泊SOM矿化及相关生物地球化学过程的影响研究相对较少[13]。本文选取抚仙湖形成蓝藻水华的优势藻种水华束丝藻(Aphanizomenon flos-aquae),利用厌氧培养装置进行不同浓度的藻屑添加培养实验,通过温室气体同位素在线检测仪探究藻屑添加对于抚仙湖矿化过程的激发效应。DOM是SOM矿化过程的重要产物,其中,发光性溶解性有机质(CDOM)作为一种光学活性物质,在水生生态系统发挥着重要作用,是水生环境中碳循环的关键组成部分[14]。通过三维荧光光谱技术和紫外可见吸收光谱技术来对藻屑堆积对间隙水和上覆水中CDOM组成和含量的影响进行半定量分析。同时通过综合探究Fe和S的生物地球化学行为,预测藻屑堆积对抚仙湖可能产生的危害。
1 材料与方法 1.1 研究区概况抚仙湖(24°21′~24°38′N,102°49′~102°57′E),位于中国西南部的云南省,海拔1722.5 m,是全球同纬度地区唯一的I类水质湖泊。其蓄水量占云南省九大高原湖泊总量的68.2%,占中国淡水湖泊总蓄水量的9.16%,换水周期约为167年。抚仙湖总面积212 km2,平均水容量189.3×108 m3,平均水深95.2 m,最深处位于北湖心,水深达158.9 m。抚仙湖有机碳累积速率在全年中最高可达133 mg C/(m2·d),最低为44 mg C/(m2·d)[11]。
1.2 样品采集与处理2019年8月4日在抚仙湖南湖心(24°45′N,102°88′E,图 1)进行采样,该位点水深83 m,表层沉积物总氮、总磷、总有机碳含量分别为2.60、1.35和15.90 mg/g(以沉积物干重表示),沉积物-水界面溶解氧浓度为170 μmol/L,溶解氧渗透深度为3.2 mm,是抚仙湖具有代表性的采样点。采用重力采泥器(Rigo,日本)采集沉积物柱状样3根,切取上层10 cm沉积物混匀,冷藏保存待用。另取少量沉积物冷冻干燥,研磨过筛(孔径为0.125 mm)进行理化性质分析(表 1)。同时采集底层水10 L,水样经0.45 μm醋酸纤维膜过滤后4℃冷藏保存作为实验用水。
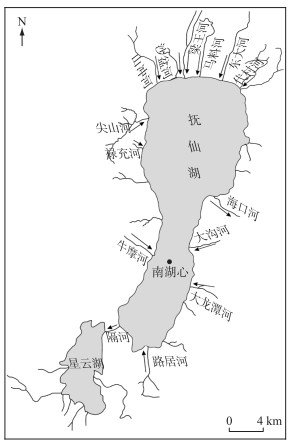
|
图 1 采样点示意图 Fig.1 Location of sampling site |
| 表 1 实验沉积物及藻屑的理化性质 Tab. 1 Physical and chemical properties of sediments and algal debris |
水华束丝藻是抚仙湖发生蓝藻水华的优势藻种[15],故选择水华束丝藻进行添加实验。水华束丝藻购买自中国科学院水生生物研究所藻种库,采用BG-11培养基(pH=7.1)于光照培养箱中培养,采用30%用13C标记的碳酸钠(99.9% Na13CO3,Sigma,德国)进行标记,光暗比设置为12 h/12 h,光照强度为20 μE/(m2·s),温度为(25±1)℃,每天摇晃一次使其避免附壁生长。在生长稳定期通过离心浓缩水华束丝藻,将浓缩物用超纯水冲洗3次,以去除多余的营养盐,然后冷冻干燥,研磨过筛(孔径为0.125 mm)制成加标藻屑。取少量藻屑进行理化指标和同位素丰度分析,其余4℃保存待用。
1.4 实验设计培养装置采用2 L厌氧培养瓶(底面积约125 cm2,图 2),根据预实验结果和仪器测量精度和范围,设置沉积物∶水∶气体(V/V)=1 ∶3 ∶36。实验设置4个组别,分别为1个未添加藻屑的对照组和3个不同藻屑添加量处理组(×1倍组、×5倍组、×10倍组),每个组别设置两组平行。其中,×1倍组的藻屑添加量为0.013 g,根据抚仙湖沉积物全年最大碳沉积速率(133 mg C/(m2·d))及藻屑含碳量计算得到,换算后接近抚仙湖全年平均藻细胞丰度118.07×104 cells/L[16]。同时根据抚仙湖发生水华时的最大浮游植物丰度(1092×104 cells/L)[10]分别设置×5倍组和×10倍组,以预测抚仙湖水质进一步恶化的环境效应。
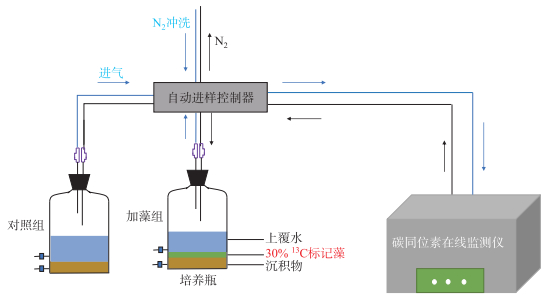
|
图 2 实验装置示意图 Fig.2 Schematic diagram of experimental device |
取100 mL混合后的沉积物与100 mL实验用水在培养瓶中均匀混合,待沉积物稳定2~3天后,将不同添加量加标藻屑与表层1 cm的沉积物搅拌均匀后,沿管壁缓缓注入室验用水,至水样总体积为300 mL。培养装置通高纯氮气20 min后,迅速密封培养瓶,以模拟湖底沉积物矿化时的缺氧环境。培养温度为抚仙湖南湖心平均水温(18±1)℃,避光培养。将处理好的培养瓶通过自动进样控制系统与碳同位素在线监测仪(G2201i,Picarro,美国)连接,实时监测培养系统中的顶空气体(CO2和CH4)。样品测定时间为10 min,样品测量间隙采用99.99%的N2冲洗5 min,避免样品交叉污染。碳同位素在线监测仪δ13CO2的5 min精度值<0.16 ‰,CO2体积分数检测范围为100×10-6~4000×10-6。
培养期间,采用注射器吸取上覆水样品,间隙水采集器(Rhizon CSS-F,荷兰)采集间隙水,上覆水和间隙水的采样位置分别位于沉积物-水界面上方和下方1 cm处。分别于第0、1、2、3、6、10、15、20、24天取5 mL上覆水与间隙水,经0.22 μm针头过滤器(MILLEX GP,德国)过滤后冷藏保存用于相关指标测量。上覆水中溶解性无机碳(DIC)的取样时间为第0、1、7、10、15、20、24天,取样后经过滤后装入2个2 mL的棕色瓶,并加入0.2%体积的饱和HgCl2冷藏保存。实验结束后收集沉积物,测量沉积物的生物酶活性和反硝化速率。
1.5 分析方法Fe2+、S2-浓度:参照《水和废水监测分析方法》(第四版),分别采用96孔酶标板采用邻菲罗啉分光光度法和对氨基二甲基苯胺光度法进行测量[17]。
沉积物生物酶活性:实验结束后收集各个组别的沉积物,冷冻干燥后过筛(孔径为0.09 mm)备用。分别采用茚三酮水浴加热分光光度法、二硝基水杨酸水浴加热分光光度法和对硝基苯酚分光光度法测定蛋白酶、转化酶和碱性磷酸酶的活性[18]。
沉积物反硝化速率:向12 mL样品管中加入匀化并用氦气曝气后的泥浆和15NO3-,在不同时间序列向管中加入饱和ZnCl2终止管内微生物的活性。静置片刻后在膜接口质谱仪(Membrane Inlet Mass Spectrometer,MIMS)上测定培养液中可溶性气体29N2、30N2的含量[19]。
紫外-可见吸收光谱和三维荧光光谱分析:分别采用紫外-可见分光光度计(UV2700,岛津)和荧光分光光度计(Fluorolog-3,Horiba)对水样进行扫描。紫外光谱波长扫描范围为200~800 nm,三维荧光光谱以超纯水为背景,激发波长扫描范围为235~450 nm,步长5 nm,发射波长扫描范围为250~750 nm,步长1 nm。
DIC含量:将用于测定DIC分析的水样放至25 mL充满氮气的西林瓶中,加入0.2 mL 1 mol/L的盐酸使其酸化,再分别使用气相色谱仪(GC7890, Agilent)和同位素质谱仪(MAT253plus, Thermo Finnigan)测定顶空气体中CO2的浓度和丰度。
1.6 数据处理与分析 1.6.1 相关计算上覆水和间隙水中离子的实际浓度根据测定浓度和采样体积进行校正[20]。培养期间系统CH4浓度变化较小,故平均矿化速率计算采用CO2平均变化量进行表征[21]。沉积物反硝化速率计算使用同位素配对法[22]。激发效应的计算参考Gontikaki等的方法[23]:通过培养系统内水相和气相中CO2的浓度和丰度,计算培养过程同位素变化,再通过端元混合模型计算SOM矿化产生的CO2量,将加藻组和对照组SOM矿化产生的CO2量进行对比,得到激发效应。以上计算公式见附录。
1.6.2 三维荧光光谱解析三维荧光组分模型分析采用平行因子分析法(parallel factor analysis,PARAFAC),此算法可以将复杂的荧光基团分离为独立的不同组分。首先将三维荧光光谱数据扣除超纯水背景值以消除拉曼散射,并结合紫外-可见光谱数据进行内滤效应修正。将出现的瑞利散射置零,消除瑞利散射影响,用Matlab 2012运行DOMFluor工具箱,处理经过预处理的三维荧光光谱数据,进行平行因子分析,并得到组分模型[24-25]。
荧光光谱特定波长的荧光强度和紫外可见光谱中特定波长的吸光强度用于表征CDOM的来源、性质等。荧光光谱中,选取腐殖化指数(HIX)与新鲜度指数(β∶α)。其中HIX为激发波长在254 nm处,发射波长435~480 nm范围内荧光强度之和与300~345 nm范围内荧光强度之和的比值,用于表征DOM的腐殖化程度或成熟度[26]。β∶α为激发波长为310 nm时,发射波长为380 nm的荧光强度与420~435 nm区间中最大的荧光强度的比值,用于表征新生有机质对CDOM的贡献[27]。紫外可见光谱中,选取SR和aCDOM(280) 分别表征CDOM的相对分子量和浓度[14, 28]。SR是275~295 nm和350~400 nm两个波段的吸光度值拟合得出的光谱斜率的比值,和DOM的相对分子量呈反比,在微生物作用下逐渐降低。aCDOM(280)是紫外吸收光谱中280 nm处的吸收系数,计算公式见附录。
1.6.3 统计分析所有数据均采用Excel 2016软件计算与处理,采用SPSS 25软件进行单因素方差分析和Pearson相关性分析,绘图采用Origin 2021软件。
2 结果与分析 2.1 上覆水和间隙水CDOM变化特征 2.1.1 上覆水和间隙水荧光组分组成特征根据平行因子分析法分析,上覆水CDOM主要荧光组分有4个,分别为C1上、C2上、C3上和C4上,其中C1上和C2上只存在1个激发波长峰,C3上和C4上存在两个激发波长峰(图 3)。间隙水中CDOM主要荧光组分有3个,分别为C1间、C2间和C3间,其中C1间存在两个激发波长峰,C2间和C3间只存在一个激发波长峰。运用OpenFluor在线数据库,将识别出的组分模型与已发表的平行因子分析模型进行比对,激发和发射相似度评分均超过0.95[29]。确定了上覆水中C1上和C3上为类腐殖质组分,C2上和C4上为类蛋白质组分;间隙水中C1间和C2间为类腐殖质组分,C3间为类蛋白质组分(表 2)。
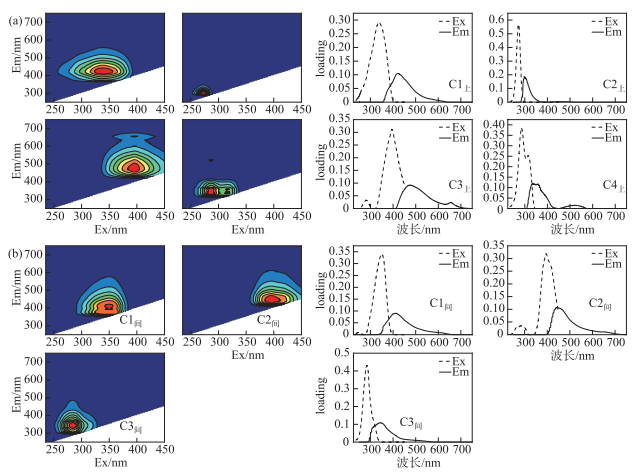
|
图 3 三维荧光组分解析结果:上覆水(a)和间隙水(b) Fig.3 Fluorescence excitation-emission matrix of overlying water (a) and porewater (b) |
| 表 2 间隙水和上覆水三维荧光激发-发射波长峰值及分类[29-30] Tab. 2 Excitation and emission maxima of the four PARAFAC components and possible assignments[29-30] |
各个荧光组分含量以荧光峰最高处荧光强度(Fmax)表示,荧光强度越大,物质组分的相对含量越高[31]。上覆水中,对照组除了C2上组分荧光强度较为恒定,其余组分荧光强度培养期间均呈上升趋势;3个加藻处理组各组分荧光强度均在前期上升,15天左右达到峰值,而后逐渐下降(图 4a)。3个加藻组上覆水中各组分荧光强度在培养期间整体高于对照组。其中,×5倍组的C1上荧光强度显著高于其他组别(P < 0.05),3个加藻组的C3上和C4上荧光强度均显著高于对照组(P < 0.05)。各个组别的类腐殖质组分(C1上和C3上)所占比例的总和均在前期高于类蛋白质组分(C2上和C4上)所占比例的总和,占总荧光强度的60%左右;中期类腐殖质组分所占比例逐渐低于类蛋白质组分所占比例,在30%~50%之间变化,后期则逐渐回升到60%左右。
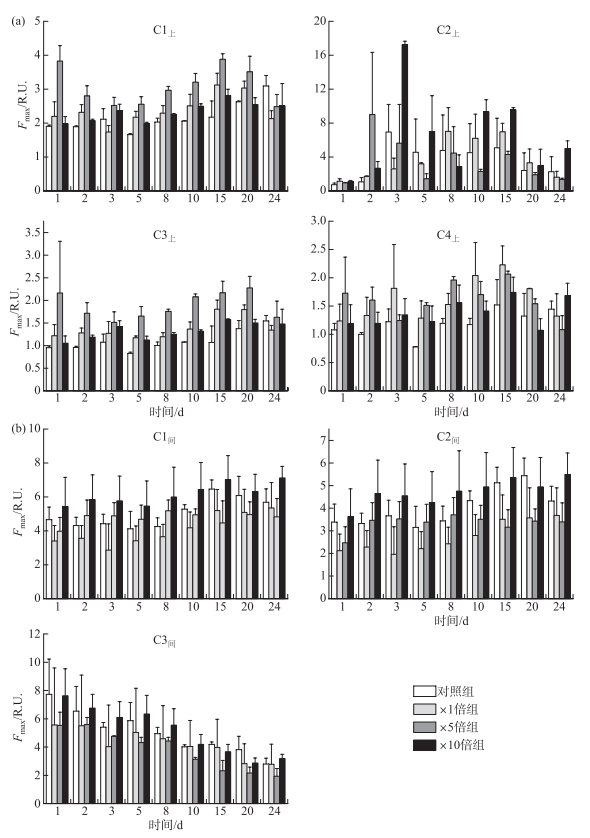
|
图 4 培养过程中上覆水(a)和间隙水(b)荧光组分Fmax变化趋势 Fig.4 Temporal responses of Fmax of overlying water (a) and porewater (b) during cultivation |
间隙水在培养期间各处理组的荧光组分变化趋势类似,类腐殖质组分C1间和C2间荧光强度均随时间缓慢上升且二者含量显著正相关(P < 0.01),二者所占比例的总和由前期的30%左右升高到后期达到80%左右,而类蛋白质组分C3间荧光强度则逐渐下降(图 4b)。×10倍组间隙水中C1间和C2间荧光强度在培养期间均显著高于对照组(P < 0.05),整体提高了3.31%~40.02%;×1倍组和×5倍组的C1间和C2间荧光强度则显著整体低于对照组(P < 0.05),整体降低了0.33%~44.35%;4个组别的C3间荧光强度在培养期间则无显著差异(P>0.05)。
2.1.3 上覆水和间隙水紫外可见光谱指数变化特征以aCDOM(280)来表示CDOM浓度,加藻组上覆水CDOM浓度前期均高于对照组,平均分别高出57.50%(×1倍组)、45.74%(×5倍组)和19.21%(×10倍组)。后期对照组CDOM浓度迅速上升,最高值达到(72.54±2.07)m-1;×1倍组和×5倍组CDOM浓度则逐渐下降,并于15天后低于对照组;×10倍组CDOM浓度缓慢上升,在20天后快速升高,最高值为(36.62±25.56)m-1(图 5a)。这表明藻屑的添加在前期向上覆水中释放了大量CDOM组分,并在后期逐渐被分解。上覆水中各组别SR整体呈先上升后下降的趋势,×1倍组SR在培养期间中整体低于或接近对照组,表明×1倍组上覆水中DOM相对分子量相比对照组略有上升,可能是由于藻屑促进了类腐殖质物质释放[7]。×5倍组和×10倍组SR在10天前高于对照组,均在第8天达到各自的峰值,而后逐渐接近甚至低于对照组,两个组别的峰值分别为6.54±0.50(×5倍组)和6.06±1.4(×10倍组)(图 5b)。可能是由于藻屑添加后释放的大量小分子DOM后期逐渐分解[8],加藻组DOM的相对分子量接近对照组。
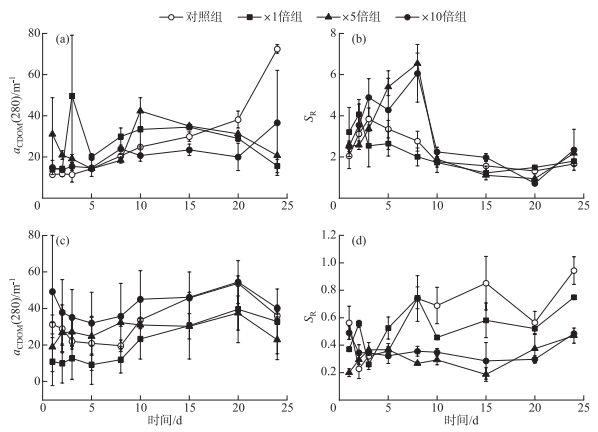
|
图 5 培养过程中上覆水(a)和间隙水(c)的aCDOM(280)以及上覆水(b)和间隙水(d)的SR变化趋势 Fig.5 Temporal responses of aCDOM (280) of overlying water (a) and porewater (c), SR of overlying water (b) and porewater (d) during cultivation |
比较间隙水中各个组别的CDOM浓度,×5倍组和×10倍组CDOM浓度变化较为稳定,平均值分别为(28.08±1.67)m-1(×5倍组)和(41.90±15.73)m-1(×10倍组);对照组和×1倍组CDOM浓度呈稳定上升趋势,在第15天后对照CDOM浓度组接近×10倍组;而×1倍组CDOM浓度接近×5倍组,平均值分别为(32.59±4.29)m-1(对照组)和(20.25±13.18)m-1(×1倍组)(图 5c)。对照组和×1倍组间隙水中SR变化趋势比较类似,整体呈先上升后下降的趋势,培养期间最大值分别为0.85±0.20(对照组)和0.75±0.01(×1倍组)。×5倍组和×10倍组SR则整体先下降后上升,最大值分别为0.47±0.05(×5倍组)和0.49±0.05(×10倍组)(图 5d)。3个加藻组间隙水中SR均逐渐低于对照组,代表沉积物中微生物活动随藻屑添加而加强,并开始利用小分子DOM,使大分子DOM比重增加[8]。而后期3个加藻组SR均逐渐上升,表明加藻组沉积物中微生物活性逐渐降低。
2.1.4 间隙水和上覆水三维荧光指数变化特征上覆水中,各个组别腐殖化指数(HIX)均在前3天下降,且3个加藻组下降速率高于对照组。而后处于波动状态,并且加藻处理组HIX普遍低于对照组(图 6a),表明藻屑的添加整体降低了上覆水的腐殖化程度。培养期间各个组别上覆水HIX的整体变化范围为0.41~1.79。对照组和×1倍组的新鲜度指数(β∶α)在前期有一定程度的下降,而×5倍组和×10倍组则有一定程度的上升。4个组别β∶α在后期均有不同程度下降,×10倍组上覆水中β∶α整体略高于其他组别(图 6b),但差异不显著(P>0.05)。
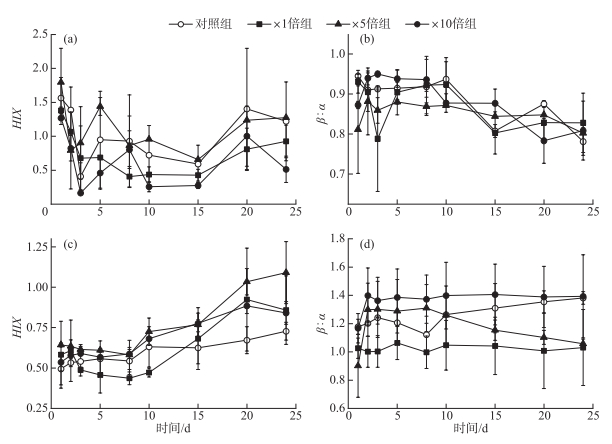
|
图 6 培养过程中间隙水和上覆水三维荧光指数变化特征:上覆水HIX(a)、上覆水β∶α(b)、间隙水HIX(c)和间隙水β∶α(d) Fig.6 Temporal responses of three-dimensional fluorescence index: HIX of overlying water (a), β∶α of overlying water (b), HIX of porewater (c) and β∶α of porewater (d) during cultivation |
3个加藻组间隙水中HIX在前期略有降低,后期大幅度上升,并在第20天左右达到各自的峰值,分别为0.92±0.32(×1倍组)、1.09±0.19(×5倍组)和0.89±0.05(×10倍组),培养期间各个组别间隙水HIX的整体变化范围为0.49~1.09。而对照组间隙水HIX变化不大,并且在15天后显著低于加藻处理组(P < 0.05)(图 6c)。×1倍组和×10倍组间隙水中β∶α变化幅度不大,与对照组相比,始终保持着×10倍组>对照组>×1倍组的趋势。而×5倍组间隙水中β∶α前期稳定高于对照组,15天后持续下降,甚至显著低于对照组(P < 0.05)(图 6d)。
2.2 系统CO2浓度和同位素变化趋势各个组别CO2浓度均在前5天呈逐渐上升的趋势,而后变化趋于平缓。培养期间对照组CO2浓度显著低于3个加藻组(P < 0.05),其变化范围为1.24~2.39 mg/L。3个加藻组中,×1倍组和×5倍组CO2浓度显著高于×10倍组(P < 0.05);且在前10天,×5倍组系统中CO2浓度最高,而后×1倍组CO2浓度缓慢上升并高于其他处理组(图 7a)。
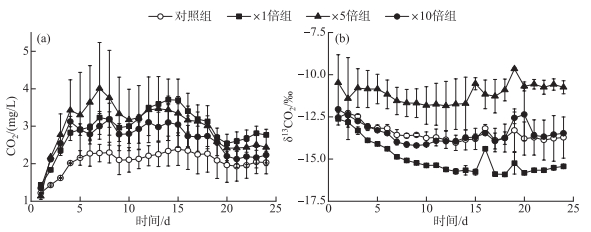
|
图 7 培养过程中系统CO2浓度(a)和同位素(b)变化 Fig.7 Temporal responses of concentrations (a) and δ values (b) of CO2 during cultivation |
系统中δ13CO2的变化较为平稳。×1倍组δ13CO2在整个培养期间显著小于对照组(P < 0.05),变化范围为-15.91 ‰~-12.62 ‰。×5倍组δ13CO2在整个培养期间显著高于对照组(P < 0.05),变化范围为-11.85 ‰~-9.65 ‰。×10倍组的δ13CO2在整个培养期间和对照组的差异不显著(P>0.05),×10倍组和对照组的变化范围分别为-14.20 ‰~-12.05 ‰和-14.04 ‰~-12.28 ‰(图 7b)。
2.3 系统矿化特征变化趋势培养期间,×1倍组、×5倍组总矿化速率略高于对照组,但差异不显著(P>0.05),分别为(1.26±0.09) μmol/(L·d)(×1倍组)、(1.24±0.14) μmol/(L·d)(×5倍组)和(1.14±0.78) μmol/(L·d)(对照组);而×10倍组的总矿化速率与其他组别相比显著降低(P < 0.05),为(0.82±0.07) μmol/(L·d)(图 8a)。各个组别反硝化速率在结束时有一定差别,其中,×1倍组和×5倍组反硝化速率相对于对照组(0.77±0.05) μmol/(L·h)显著下降(P < 0.05),分别为(0.28±0.02)和(0.38±0.05) μmol/(L·h);而×10倍组反硝化速率和对照相比虽略有下降,但差异不显著(P>0.05),为(0.68±0.05) μmol/(L·h)(图 8b)。

|
图 8 培养过程中总矿化速率(a)、培养结束时沉积物反硝化速率(b)、间隙水Fe2+变化趋势(c)和间隙水S2-变化趋势(d)(显著性标记a,b,c按各个组别平均值从大到小排列,同一字母代表差异不显著(P>0.05), 下同) Fig.8 Total mineralization rate during culture (a), denitrification rates at the end of incubation (b), variation trend of Fe2+ in porewater (c) and variation trend of S2- in porewater (d) (Where a, b, and c are the significance marks (P < 0.05), the same below) |
培养期间,×10倍组沉积物间隙水中Fe2+浓度显著高于其他组别(P < 0.05),平均值为(3.55±0.53) mg/L;而×1倍组和×5倍组间隙水中Fe2+浓度在实验过程中略低于对照组,差异不显著(P>0.05)(图 8c)。实验前期,3个加藻组间隙水中S2-浓度有明显积累,并且出现峰值时间不同,其中×5倍组显著高于对照组(P < 0.05);后期各个组别间隙水中S2-浓度趋于一致。不同处理组间隙水中S2-浓度在培养期间平均值分别为(1.83±0.02) mg/L(对照组)、(1.82±0.012) mg/L(×1倍组)、(1.93±0.11) mg/L(×5倍组)和(1.85±0.05) mg/L(×10倍组)(图 8d)。
2.4 沉积物酶活性在培养结束后,蛋白酶和碱性磷酸酶的活性均随着藻屑添加量的增加而增高,×10倍组蛋白酶活性显著高于对照组和×1倍组(P < 0.05),略高于×5倍组,其碱性磷酸酶活性显著高于其他3个组别(P < 0.05)。两种酶在4个组别的变化范围分别为15.94~31.26和6.73~15.68 mg/(kg·h)。转化酶活性变化趋势略有不同,×5倍组显著高于对照组和×1倍组(P < 0.05),略高于×10倍组(P>0.05)。4个组别转化酶活性变化范围为516.32~560.66 mg/(kg·h)(图 9)。
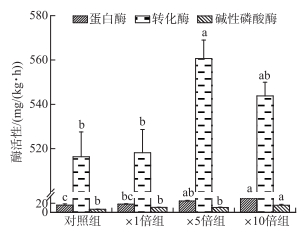
|
图 9 实验结束时各实验组沉积物蛋白酶、转化酶和碱性磷酸酶的活性 Fig.9 The activity of protease, invertase and alkaline phosphatase in the sediment at the end of the experiment in each treatment |
在培养期间,3个加藻组相对于对照组都产生了激发效应。在前期,×1倍组和×5倍组表现为正激发效应,且×5倍组的激发效应高于×1倍组。×5倍组的激发效应第7天达到最高值(26.60±9.14) μg/(mL ws),而×1倍组则在10天左右达到最高值(12.18±0.65) μg/(mL ws),而在后期两个加藻组均逐渐转为负激发效应。×10倍组在整个过程中表现为负激发效应,在第20天达到最低值(-23.10±2.20) μg/(mL ws)(图 10)。
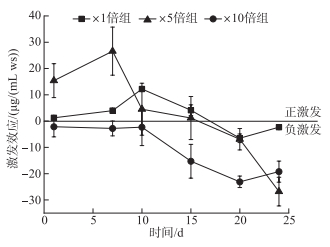
|
图 10 培养过程各实验组激发效应变化 Fig.10 Temporal response of priming effect of each treatments during cultivation |
浮游植物是湖泊CDOM的重要贡献者,能同时产生不稳定和难降解的CDOM[32]。蓝藻水华衰亡沉降到沉积物表面,促使上覆水和间隙水中CDOM浓度和组成发生变化,其中一部分CDOM可以促进沉积物中异氧细菌繁殖,进而影响后续的生物地球化学过程[33]。低浓度加藻组(×1倍组和×5倍组)对CDOM浓度的改变主要体现在对上覆水的影响,且CDOM浓度随着矿化过程消耗有机质而降低;高浓度加藻组(×10倍组)的CDOM在初期储存在沉积物间隙水中,并在实验后期逐渐扩散到上覆水。荧光组分的变化也存在相同趋势,上覆水加藻组的各组分荧光组分强度高于对照组,而间隙水仅有×10倍组荧光强度高于对照组。在间隙水和上覆水识别出的荧光组分中,类色氨酸和类酪氨酸组分属于生物降解的类蛋白物质,分别与CDOM中的芳环氨基酸结构和微生物降解产生的芳香性蛋白类结构有关。在上覆水中识别出了两种类蛋白质组分,但间隙水中只识别出一种类蛋白质组分,可能是由于上覆水和间隙水样品有一定的差别,但识别出的两种类蛋白质组分在本质上并无太大差别。而富里酸属于类腐殖质物质,主要来源于土壤和水环境中经过长时间分解的动植物残体,主要为992.1~2976.3 u之间的小分子组分,与腐殖质结构中羟基及羧基有关。培养期间,上覆水中SR显著高于间隙水(P < 0.05),间隙水中DOM分子量相对较大,说明间隙水中微生物活性更强,大量分解小分子DOM,而且加藻处理强化了这一效应。Valle等对加拿大10个典型北方湖泊共72处沉积物柱的上覆水和间隙水中DOM进行比较后发现,间隙水中微生物活性高于上覆水[34],与本研究结果一致。
蓝藻水华衰亡后对CDOM的影响在不同阶段存在差异[1]。实验初期,由于藻屑中存在生物活性较高、易降解部分,促进沉积物中微生物繁殖,加强沉积物的矿化作用,从而促进沉积物中原本难降解物质的分解[35]。因此加藻组中SOM矿化作用的终端产物CO2释放速率在前期相比对照组加快。但这一效应与加藻量呈反比,×10倍组藻屑含量最高,顶空中CO2浓度却较低,表明高浓度藻屑添加可能抑制了SOM矿化。加藻组上覆水和间隙水HIX也因此降低,CDOM的腐殖化程度降低,稳定性降低,更容易被微生物利用。实验后期,CDOM的小分子组分转变为大分子组分,剩下难降解的部分且分解趋于完全,系统新鲜度指数β∶α降低,相对稳定的类腐殖质组分荧光强度升高,CDOM的腐殖化程度也明显升高,CDOM中易被生物降解的部分减少[36]。各个加藻组顶空CO2浓度变化速率在后期和对照组接近(图 7),藻屑在后期不再促进SOM矿化。稳定、难分解的物质增加,可能使SOM对碳循环的贡献变小,减慢湖泊整体碳循环速率[35]。
综上,藻屑的添加对上覆水和间隙水中CDOM的组成和性质将产生较大的影响,甚至可能会影响SOM矿化和湖泊碳循环过程。而SOM矿化具有重要生物地球化学意义,一直是相关领域的研究热点[37],下文将通过研究藻屑添加对SOM的激发效应定量分析藻屑添加对SOM矿化的影响。
3.2 不同浓度藻源性有机质添加对沉积物有机质矿化过程的激发效应培养期间系统整体矿化速率的变化结果表明,3个加藻组系统的平均矿化速率均相比对照组有了不同程度的变化,说明藻屑的添加对于SOM矿化有一定的影响,即产生了激发效应。多项研究表明,激发效应是一个由微生物所驱动的过程,其发生过程一般伴随着微生物生物量或群落的改变[3, 38]。培养结束时,沉积物蛋白酶活性和转化酶活性与藻屑添加量呈正比(蛋白酶活性=117.60×加藻量+16.40,R2=0.99;转化酶活性= 252.64×加藻量+521.59,R2=0.49),并且加藻组转化酶和蛋白酶活性显著高于对照组(P < 0.05)。转化酶可以酶促蔗糖水解生成还原糖,其活性反映了沉积物碳的转化和微生物呼吸强度,蛋白酶活性则与蛋白质含量相关[18]。藻屑的添加一定程度上使沉积物中微生物活性升高,从而对沉积物矿化过程产生了激发效应。
×1倍组的δ13CO2略低于对照组(P>0.05),可能是少量藻屑的加入促进了SOM的矿化分解,由于δ13CSOM偏负(-28 ‰),从而导致顶空中δ13CO2降低。而×5倍组的δ13CO2在整个过程中显著高于对照组(P < 0.05),主要原因有两点:1)标记藻屑自身分解;2)在资源有限的情况下(×5倍组),微生物首先利用易分解的碳来维持自己的呼吸作用[39]。实验结果表明,×1倍组和×5倍组在初始阶段表现为正激发效应,顶空CO2浓度也在初期快速增加,增加的CO2一部分来自藻屑的快速分解,另一部分来自添加藻屑促进SOM降解;后期表现为负激发效应,且CO2释放速率减小,可能是因为沉积物中稳定的类腐殖质组分逐渐增加,从而使SOM降解速率变慢[23, 36]。而在藻屑添加含量较高时(×10倍组),SOM矿化由于微生物优先利用更新鲜的有机质而受到抑制[23, 38, 40],因此藻屑对SOM矿化在整个过程中表现为负激发效应。虽然×10倍组中CO2浓度在前期也有快速升高,但是这部分可能更多来源于藻屑分解。同时,在资源充足的情况下,微生物优先吸收利用新鲜有机质,而不是将其分解产生CO2[41],因此导致×10倍组中系统中δ13CO2在培养期间相比于对照组没有太大变化。所以×10倍组间隙水相比低藻组更容易储存CDOM,一方面是由于自身携带了比低藻组多的难降解CDOM,一方面则是因为抑制了SOM矿化。
实验结束时各个组别CO2释放速率差异较小(图 7a),表明藻屑添加对SOM矿化速率的影响具有一定的期限,并不是一个长期的作用过程。由于实验过程只模拟了单次添加藻屑的情况,而自然界中藻持续输入到沉积物表面,在将来应当对藻屑的不同添加模式进行研究。同时激发效应影响因素众多,包括添加SOM的量和结构性质、营养水平、沉积物类型、微生物群落结构,添加的外源物的数量等[23, 42-43],因此下一步研究中需要控制变量来研究其他因素的影响。
3.3 藻源性有机质的堆积对抚仙湖水质潜在危害预测藻屑添加实验表明,藻屑对SOM矿化过程以及CDOM组成产生了显著影响,改变沉积环境的生物地球化学过程。这可能导致污染物释放,进一步恶化水质[44]。
藻屑沉积使抚仙湖“黑色浮沫”产生的几率增加。加藻处理沉积物间隙水中S2-浓度在前期急剧升高,当藻屑添加浓度过高时(×10倍组),间隙水中Fe2+开始大量累积。研究表明,抚仙湖有机质富集区域,由于高负荷有机质快速积累,诱导硫酸盐还原和铁异化还原同步进行,促进铁化学还原形成致黑物质硫化亚铁,形成抚仙湖“黑色浮沫”现象[45]。
藻屑沉积增加抚仙湖水体富营养化风险。实验结束时,加藻组沉积物反硝化速率均受到了一定程度的抑制。反硝化速率主要受到溶解氧、间隙水中NO3-以及相关微生物活性的影响[13]。藻屑输入增加,溶解氧快速损耗,形成厌氧环境,同时藻屑提供了有机碳,这些条件均有利于反硝化过程的进行[46]。藻屑添加初期间隙水NO3-被快速消耗,后期则因NO3-缺少而使反硝化作用受到抑制。由于仅分析了实验结束后系统的反硝化速率,反硝化过程的变化通过各加藻组与对照组反硝化速率的差值可窥见一斑,该差值与加藻量呈反比(差值= -3.38×加藻量+0.56,R2=0.95),说明低浓度藻屑添加初期反硝化速率更快,NO3-更快被消耗,与低浓度加藻组在前期为正激发效应的结果一致。而大量藻屑的添加,降低了反硝化作用微生物的活性[46],这与高浓度加藻组呈现负激发效应的结果一致。反硝化速率受到抑制,将导致NO3-累积,增加水体富营养化的风险。而培养结束时,沉积物中碱性磷酸酶的活性随着藻屑添加浓度的增加而增加,而碱性磷酸酶的合成有赖于环境中生物可用性磷的浓度[18],因此碱性磷酸酶活性的增加说明藻屑的添加促进了沉积物中活性磷含量的增加。同时,×10倍组活性磷的扩散通量((0.07±0.01) mg/(m2·d))也相较于对照组((0.03±0.01) mg/(m2·d))显著升高(P < 0.05)。以往研究表明,蓝藻碎屑堆积造成沉积物NH4+和PO43-扩散通量增加[8, 47],与本研究结果一致。这说明当藻屑添加浓度较高时,沉积物中活性磷含量增加,增大了内源活性磷向水体中释放的可能性,增加了水体富营养化的风险。
4 结论1) 藻屑的添加对上覆水和间隙水CDOM的组成和性质产生显著影响。实验前期上覆水CDOM浓度显著提升,类蛋白质组分提高,CDOM腐殖化程度降低;后期3个加藻组中CDOM腐殖化程度均相比对照组有一定程度的上升,藻屑长期堆积将在沉积物中累积难降解的CDOM,可能导致碳循环速率降低。
2) 藻屑的添加对抚仙湖SOM的矿化产生激发效应。×1倍组和×5倍组在前期表现为正激发效应,在后期表现为负激发效应;藻屑添加浓度较高的×10倍组在培养期间体现为负激发效应。少量藻屑沉降初期激发沉积物有机质分解,而大量藻屑长期堆积将减缓沉积物中SOM的矿化速率,导致有机质的累积。
3) 藻屑沉积对抚仙湖的水质恶化有潜在的风险。高浓度藻屑堆积使间隙水中易于富集Fe2+和S2-,增加黑色物质产生的风险。同时藻屑的添加通过抑制反硝化作用以及增大沉积物中碱性磷酸酶的活性即活性磷含量,为浮游动植物生长提供丰富的氮、磷营养盐,造成抚仙湖潜在的富营养化风险。
5 附录附录见电子版(DOI: 10.18307/2023.0106)。
附录Appendix(1)激发效应计算
首先,培养系统在培养期间产生总的气相和液相∑CO2的δ13CO2值即δ13Ctotal计算方法为:
| ${\rm{\delta}}^{13} \mathrm{C}_{\text {total }}=\frac{\left({\rm{\delta}}^{13} \mathrm{C}_{\mathrm{gas}} \times\left[\mathrm{CO}_2\right]_{\mathrm{gas}}\right)+\left({\rm{\delta}}^{13} \mathrm{C}_{\text {water }} \times\left[\mathrm{CO}_2\right]_{\text {water }}\right)}{\left[\mathrm{CO}_2\right]_{\mathrm{gas}}+\left[\mathrm{CO}_2\right]_{\text {water }}}$ | (1) |
式中,δ13Cgas和[CO2]gas分别为培养系统CO2的浓度(μg C/(mL ws))和13C同位素丰度值,δ13Cwater和[CO2]water分别为培养体系中DIC的浓度(μg C/(mL ws))和13C同位素丰度值,水中DIC丰度需要经过1 ‰校正,即δ13Cwater=13CDIC+1 ‰。
随后,依据培养起始和结束时的δ13Ctotal值,计算得出产生的∑CO2的13C丰度值即δ13Cprod,具体计算方式为:
| ${\rm{\delta}}^{13} \mathrm{C}_{\text {prod }}=\frac{\left({\rm{\delta}}^{13} \mathrm{C}_{\text {end }} \times\left[\mathrm{CO}_2\right]_{\text {end }}\right)-\left({\rm{\delta}}^{13} \mathrm{C}_{\text {start }} \times\left[\mathrm{CO}_2\right]_{\text {start }}\right)}{\left(\left[\mathrm{CO}_2\right]_{\text {end }}-\left[\mathrm{CO}_2\right]_{\text {start }}\right)}$ | (2) |
式中,[CO2]start、[CO2]end分别指实验开始和结束后∑CO2的浓度(μg C/(mL ws));δ13Cstart和δ13Cend分别为培养起始和结束时的δ13Ctotal值。
利用二元混合模型(公式3和公式4)计算出来源于沉积物碳酸盐的∑CO2即[CO2]carb:
| $F_{\text {diss }}=\frac{\left({\rm{\delta}}^{13} \mathrm{C}_{\text {prod }}-{\rm{\delta}}^{13} \mathrm{C}_{\text {OM }}\right)}{\left({\rm{\delta}}^{13} \mathrm{C}_{\text {carb }}-{\rm{\delta}}^{13} \mathrm{C}_{\text {OM }}\right)}=\frac{\left[\mathrm{CO}_2\right]_{\text {carb }}}{\left[\mathrm{CO}_2\right]_{\text {OM }}}=\frac{\left[\mathrm{CO}_2\right]_{\text {carb }}}{\left[\mathrm{CO}_2\right]_{\text {prod }}-\left[\mathrm{CO}_2\right]_{\text {carb }}}$ | (3) |
| $\left[\mathrm{CO}_2\right]_{\text {carb }}=F_{\text {diss }} \times\left[\mathrm{CO}_2\right]_{\text {prod }} /\left(1+\mathrm{F}_{\text {diss }}\right)$ | (4) |
式中,δ13Ccarb和δ13COM值分别是碳酸盐和SOM的13C丰度值。
对照组中来源于SOM的[CO2]OM-control的∑CO2可表示为:
| $\left[\mathrm{CO}_2\right]_{\text {OM-control }}=\left[\mathrm{CO}_2\right]_{\text {prod}}-\left[\mathrm{CO}_2\right]_{\text {carb}}$ | (5) |
藻源性的∑CO2表示为[CO2]algae,计算公式为:
| $\left[\mathrm{CO}_2\right]_{\text {algae }}=\left[\mathrm{CO}_2\right]_{\text {end }} \times\left(F_{\text {sample }}-F_{\text {background }}\right) / F_{\text {algae }}$ | (6) |
式中,Fbackground为对照组中的13C丰度,Fsample和Falgae分别为所测样品和藻屑的13C丰度经公式7换算后的F值:
| $\begin{aligned} F & =\frac{{ }^{13} \mathrm{C}}{{ }^{13} \mathrm{C}+{ }^{12} \mathrm{C}}=\frac{R}{R+1} \\ R & =\left(\frac{{\rm{\delta}}^{13} \mathrm{C}}{1000}+1\right) R \end{aligned}$ | (7) |
沉积物藻屑添加组中来源于SOM的[CO2]OM-tracer的∑CO2浓度计算公式为:
| $\left[\mathrm{CO}_2\right]_{\text {OM-control }}=\left[\mathrm{CO}_2\right]_{\text {OM-tracer }}-\left[\mathrm{CO}_2\right]_{\text {carb }}-\left[\mathrm{CO}_2\right]_{\text {algae }}$ | (8) |
激发效应(Priming effect,PE)是指藻屑添加组来源于SOM矿化释放的[CO2]与对照组中SOM矿化的∑CO2的差值(式9)。若为正,表明自生有机碎屑输入加速原有有机质矿化,若为负,表明自生有机碎屑输入抑制原有有机质矿化。
| $\mathrm{PE}=\left[\mathrm{CO}_2\right]_{\text {OM-tracer }}-\left[\mathrm{CO}_2\right]_{\text {OM-control }}$ | (9) |
(2)反硝化速率计算
| $v\left({ }^{15} \mathrm{NO}_3^{-}\right)={ }^{29} \mathrm{N}_2+2 \times{ }^{30} \mathrm{N}_2$ | (10) |
| $v\left({ }^{14} \mathrm{NO}_3^{-}\right)=v\left({ }^{15} \mathrm{NO}_3^{-}\right)\left[{ }^{29} \mathrm{N}_2 /\left(2 \times{ }^{30} \mathrm{N}_2\right)\right]$ | (11) |
| $v\left(\mathrm{NO}_3^{-}\right){ }_{\text {total }}=v\left({ }^{15} \mathrm{NO}_3^{-}\right)+v\left({ }^{14} \mathrm{NO}_3^{-}\right)$ | (12) |
式中,v指反硝化速率,29N2和30N2指由氮同位素仪测得的速率(μmol/(L·h))。
(3)紫外可见光光谱280 nm处吸光系数计算
| $a_{\text {CDOM }}(280)=2.3030 \mathrm{OD}(280) / r$ | (13) |
式中,aCDOM(280)为280 nm处CDOM吸收系数(m-1),OD(280)为280 nm处的吸光度,r为比色皿路径长度(m)。
(4)离子浓度的体积校正公式
| $C_n^*=\frac{C_n\left[V_0-(n-1) V_{\mathrm{s}}\right]+\sum\limits_{j=1}^{n-1} C_j V_{\mathrm{s}}}{V_0}$ | (14) |
式中,Cn*是第n次(n>0)采样时某物质的校正浓度(mg/L),Cn、Cj分别是第n次、第j次采样时某物质的测定浓度(mg/L),V0是初始上覆水体积(L),Vs是采样体积(L)。
(5)总矿化速率计算
总矿化速率通过培养过程中CO2的平均产生速率来表示,计算过程为:
| $F=\frac{\Delta c}{\Delta t} \times \frac{V}{m} \times \frac{M}{22.4} \times \frac{273}{273+T}$ | (15) |
式中,F为CO2-C矿化速率(μg/(d·g)),Δc/Δt为培养瓶内单位时间内浓度的变化量(μg/(d·g)),V为培养瓶体积(L),M为沉积物干重(g),M/22.4为标准气体质量密度(g/L),T为培养温度(℃)。
致谢: 此次研究在采样过程中得到中国科学院抚仙湖高原深水湖泊研究站罗文磊等的大力支持和帮助;在实验、数据处理和分析过程中得到陈丙法、李彪、汪欣等的大力帮助,在此表示诚挚的谢意。
| [1] |
Wang X, Li ZC, Li X et al. Effect of the decline of cyanobacterial bloom on the organic carbon composition of lake sediment carbon pool. J Lake Sci, 2020, 32(2): 346-356. [汪旋, 李致春, 李翔等. 蓝藻水华衰亡对沉积物碳库有机碳组分的影响. 湖泊科学, 2020, 32(2): 346-356. DOI:10.18307/2020.0212] |
| [2] |
Song YL, Chen JG, Yang HQ et al. Distribution and source of the organic matter in the sediment of Fuxian Lake, Yunnan Province. Bulletin of Mineralogy, Petrology and Geochemistry, 2016, 35(4): 618-624, 607. [宋以龙, 陈敬安, 杨海全等. 云南抚仙湖沉积物有机质来源与时空变化特征. 矿物岩石地球化学通报, 2016, 35(4): 618-624, 607. DOI:10.3969/j.issn.1007-2802.2016.04.002] |
| [3] |
Guenet B, Danger M, Abbadie L et al. Priming effect: Bridging the gap between terrestrial and aquatic ecology. Ecology, 2010, 91(10): 2850-2861. DOI:10.1890/09-1968.1 |
| [4] |
Fortino K, Hoak J, Waters MN. Evidence for positive priming of leaf litter decomposition by contact with eutrophic pond sediments. Hydrobiologia, 2020, 847(1): 137-149. DOI:10.1007/s10750-019-04077-0 |
| [5] |
Wologo E, Shakil S, Zolkos S et al. Stream dissolved organic matter in permafrost regions shows surprising compositional similarities but negative priming and nutrient effects. Global Biogeochemical Cycles, 2021, 35(1): e2020GB006719. DOI:10.1029/2020GB006719 |
| [6] |
Blanchet M, Pringault O, Panagiotopoulos C et al. When riverine dissolved organic matter (DOM) meets labile DOM in coastal waters: Changes in bacterial community activity and composition. Aquatic Sciences, 2017, 79(1): 27-43. DOI:10.1007/s00027-016-0477-0 |
| [7] |
Li X, Li ZC, Wang X et al. Characteristics of dissolved organic matter in overlying water during algal bloom decay. Environmental Science, 2021, 42(7): 3281-3290. [李翔, 李致春, 汪旋等. 蓝藻衰亡过程中上覆水溶解性有机物变化特征. 环境科学, 2021, 42(7): 3281-3290. DOI:10.13227/j.hjkx.202011241] |
| [8] |
Wang YR, Chen XC, Chen BF et al. The release of pollutants in sediment-water interface after algal-debris accumulated in sediments. Acta Scientiae Circumstantiae, 2018, 38(1): 142-153. [王亚蕊, 陈向超, 陈丙法等. 藻屑堆积对沉积物-水界面污染物的释放效应. 环境科学学报, 2018, 38(1): 142-153. DOI:10.13671/j.hjkxxb.2017.0279] |
| [9] |
Liu GF, Fan CX, Zhang L et al. Environment effects of algae-caused black spots Ⅲ: Impacts on Fe- S- P cycle in water-sediment interface. China Environmental Science, 2014, 34(12): 3199-3206. [刘国锋, 范成新, 张雷等. 藻源性黑水团环境效应Ⅲ: 对水-沉积物界面处Fe-S-P循环的影响. 中国环境科学, 2014, 34(12): 3199-3206.] |
| [10] |
Dai L, Li YX, Qi YK. Analysis and research of ecological vulnerability of Fuxian Lake and its improvement measures. Environmental Science Survey, 2012, 31(4): 48-52. [戴丽, 李荫玺, 祁云宽. 抚仙湖生态脆弱性特征分析与改善对策研究. 环境科学导刊, 2012, 31(4): 48-52.] |
| [11] |
He HB, Liu ZH, Chen CY et al. The sensitivity of the carbon sink by coupled carbonate weathering to climate and land-use changes: Sediment records of the biological carbon pump effect in Fuxian Lake, Yunnan, China, during the past century. Science of the Total Environment, 2020, 720: 137539. DOI:10.1016/j.scitotenv.2020.137539 |
| [12] |
Chen XC, Feng MH, Ke F et al. Source and biogeochemical distribution of organic matter in surface sediment in the deep oligotrophic lake Fuxian, China. Aquatic Geochemistry, 2018, 24(1): 55-77. DOI:10.1007/s10498-018-9330-5 |
| [13] |
Wang YR, Feng MH, Wang JJ et al. Algal blooms modulate organic matter remineralization in freshwater sediments: A new insight on priming effect. Science of the Total Environment, 2021, 784: 147087. DOI:10.1016/j.scitotenv.2021.147087 |
| [14] |
Zhang YL, Zhang EL, Yin Y et al. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude. Limnology and Oceanography, 2010, 55(6): 2645-2659. DOI:10.4319/lo.2010.55.6.2645 |
| [15] |
Huo D, Gan NQ, Geng RZ et al. Cyanobacterial blooms in China: Diversity, distribution, and cyanotoxins. Harmful Algae, 2021, 109: 102106. DOI:10.1016/j.hal.2021.102106 |
| [16] |
Ji ZY, Liu SJ, Shi YF et al. Annual variation of phytoplankton community structure in Fuxian Lake and bioassessment of its water quality. Transactions of Oceanology and Limnology, 2019(3): 78-86. [吉正元, 刘绍俊, 施艳峰等. 抚仙湖浮游植物群落结构周年变化及水质生物评价. 海洋湖沼通报, 2019(3): 78-86.] |
| [17] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 132-142, 365-370.
|
| [18] |
王圣瑞. 湖泊沉积物-水界面过程: 基本理论与常用测定方法. 北京: 科学出版社, 2014: 136-160.
|
| [19] |
Kana TM, Darkangelo C, Hunt MD et al. Membrane inlet mass spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples. Analytical Chemistry, 1994, 66(23): 4166-4170. DOI:10.1021/ac00095a009 |
| [20] |
Wu LL, Jacobson AD, Hausner M. Characterization of elemental release during microbe-granite interactions at T= 28℃. Geochimica et Cosmochimica Acta, 2008, 72(4): 1076-1095. DOI:10.1016/j.gca.2007.11.025 |
| [21] |
Chen GX, Gao DZ, Wang ZP et al. Effects of reclamation aquaculture on sediment organic carbon fractions and mineralization in the Min River, Estuary. Acta Scientiae Circumstantiae, 2017, 37(11): 4374-4382. [陈桂香, 高灯州, 王志萍等. 闽江口围垦养殖对沉积物有机碳组分及其矿化的影响. 环境科学学报, 2017, 37(11): 4374-4382. DOI:10.13671/j.hjkxxb.2017.0176] |
| [22] |
Nielsen LP. Denitrification in sediment determined from nitrogen isotope pairing. FEMS Microbiology Letters, 1992, 86(4): 357-362. DOI:10.1016/0378-1097(92)90800-4 |
| [23] |
Gontikaki E, Thornton B, Huvenne VAI et al. Negative priming effect on organic matter mineralisation in NE Atlantic slope sediments. PLoS One, 2013, 8(6): e67722. DOI:10.1371/journal.pone.0067722 |
| [24] |
Stedmon CA, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: A tutorial. Limnology and Oceanography: Methods, 2008, 6(11): 572-579. DOI:10.4319/lom.2008.6.572 |
| [25] |
Stedmon CA, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy. Marine Chemistry, 2003, 82(3/4): 239-254. DOI:10.1016/S0304-4203(03)00072-0 |
| [26] |
Zsolnay A, Baigar E, Jimenez M et al. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying. Chemosphere, 1999, 38(1): 45-50. DOI:10.1016/S0045-6535(98)00166-0 |
| [27] |
Hansen AM, Kraus TEC, Pellerin BA et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation. Limnology and Oceanography, 2016, 61(3): 1015-1032. DOI:10.1002/lno.10270 |
| [28] |
Helms JR, Stubbins A, Ritchie JD et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter. Limnology and Oceanography, 2008, 53(3): 955-969. DOI:10.4319/lo.2008.53.3.0955 |
| [29] |
Murphy KR, Stedmon CA, Wenig P et al. OpenFluor- an online spectral library of auto-fluorescence by organic compounds in the environment. Analytical Methods, 2014, 6(3): 658-661. DOI:10.1039/C3AY41935E |
| [30] |
Coble PG. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 1996, 51(4): 325-346. DOI:10.1016/0304-4203(95)00062-3 |
| [31] |
Shi JH, Zhao Y, Wei D et al. Insight into transformation of dissolved organic matter in the Heilongjiang River. Environmental Science and Pollution Research, 2019, 26(4): 3340-3349. DOI:10.1007/s11356-018-3761-9 |
| [32] |
Zhang YL, Liu XH, Wang MZ et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes. Organic Geochemistry, 2013, 55: 26-37. DOI:10.1016/j.orggeochem.2012.11.007 |
| [33] |
Ye LL, Shi X, Wu XD et al. Dynamics of dissolved organic carbon after a cyanobacterial bloom in hypereutrophic Lake Taihu (China). Limnologica, 2011, 41(4): 382-388. DOI:10.1016/j.limno.2011.06.001 |
| [34] |
Valle J, Harir M, Gonsior M et al. Molecular differences between water column and sediment pore water SPE-DOM in ten Swedish boreal lakes. Water Research, 2020, 170: 115320. DOI:10.1016/j.watres.2019.115320 |
| [35] |
Wang WW, Wang SH, Jiang X et al. Occurrence characteristics and sources analysis of sediment organic matter of Lake Hulun by multiple methods. Research of Environmental Sciences, 2021, 34(2): 305-318. [王雯雯, 王书航, 姜霞等. 多方法研究呼伦湖表层沉积物有机质的赋存特征及来源. 环境科学研究, 2021, 34(2): 305-318.] |
| [36] |
Lee Y, Lee BM, Hur J et al. Biodegradability of algal-derived organic matter in a large artificial lake by using stable isotope tracers. Environmental Science and Pollution Research, 2016, 23(9): 8358-8366. DOI:10.1007/s11356-016-6046-1 |
| [37] |
Yan XC, Wang MY, Xu XG et al. Migration of carbon, nitrogen and phosphorus during organic matter mineralization in eutrophic lake sediments. J Lake Sci, 2018, 30(2): 306-313. [闫兴成, 王明玥, 许晓光等. 富营养化湖泊沉积物有机质矿化过程中碳、氮、磷的迁移特征. 湖泊科学, 2018, 30(2): 306-313. DOI:10.18307/2018.0203] |
| [38] |
Cheng Q, Zhuang WE, Yang LY. Priming effect of dissolved organic matter in aquatic ecosystems: A review. Environmental Chemistry, 2018, 37(1): 10-18. [程琼, 庄婉娥, 杨丽阳. 水生系统中溶解态有机质的激发效应研究进展. 环境化学, 2018, 37(1): 10-18.] |
| [39] |
Mayor DJ, Barry T, Zuur AF et al. Resource quantity affects benthic microbial community structure and growth efficiency in a temperate intertidal mudflat. PLoS One, 2012, 7(6): 1:6. DOI:10.1371/journal.pone.0038582 |
| [40] |
Du LS, Zhu ZK, Qi YT et al. Effects of different stoichiometric ratios on mineralisation of root exudates and its priming effect in paddy soil. Science of the Total Environment, 2020, 743: 140808. DOI:10.1016/j.scitotenv.2020.140808 |
| [41] |
van Nugteren P, Moodley L, Brummer GJ et al. Seafloor ecosystem functioning: The importance of organic matter priming. Marine Biology, 2009, 156(11): 2277-2287. DOI:10.1007/s00227-009-1255-5 |
| [42] |
Kuzyakov Y. Priming effects: Interactions between living and dead organic matter. Soil Biology and Biochemistry, 2010, 42(9): 1363-1371. DOI:10.1016/j.soilbio.2010.04.003 |
| [43] |
Sanches LF, Guenet B, Marino NDAC et al. Exploring the drivers controlling the priming effect and its magnitude in aquatic systems. Journal of Geophysical Research: Biogeosciences, 2021, 126(8): 1-14. DOI:10.1029/2020JG006201 |
| [44] |
García-Robledo E, Corzo A. Effects of macroalgal blooms on carbon and nitrogen biogeochemical cycling in photoautotrophic sediments: An experimental mesocosm. Marine Pollution Bulletin, 2011, 62(7): 1550-1556. DOI:10.1016/j.marpolbul.2011.03.044 |
| [45] |
Li B, Feng MH, Chen XC et al. Abundant sediment organic matter potentially facilitates chemical iron reduction and surface water blackness in a Chinese deep lake. Environmental Pollution, 2021, 272: 116002. DOI:10.1016/j.envpol.2020.116002 |
| [46] |
Zhu L, Shi WQ, Dam BV et al. Algal accumulation decreases sediment nitrogen removal by uncoupling nitrification-denitrification in shallow eutrophic lakes. Environmental Science & Technology, 2020, 54(10): 6194-6201. DOI:10.1021/acs.est.9b05549 |
| [47] |
Du X, Xun F, Wang YR et al. Effects of algal-debris accumulation on the mineralization characteristic of lake sediment. J Lake Sci, 2020, 32(6): 1671-1682. [杜先, 荀凡, 王亚蕊等. 蓝藻碎屑堆积对湖泊沉积物矿化特征的影响. 湖泊科学, 2020, 32(6): 1671-1682. DOI:10.18307/2020.0609] |
 2023, Vol. 35
2023, Vol. 35 

