(2: 云南大学生态与环境学院高原湖泊生态与治理研究院, 昆明 650500)
(2: Institute for Ecological Research and Pollution Control of Plateau Lakes, School of Ecology and Environment Science, Yunnan University, Kunming 650500, P. R. China)
蓝藻(也称为蓝细菌)是地球上最早出现的光合自养生物,利用水作为电子供体,利用太阳光能将CO2还原成有机碳化合物,并释放出自由氧,它们是唯一一类可以进行生物固氮的藻类[1]。蓝藻对人类的有益和有害作用都很显著,固氮蓝藻在维持全球土壤和水体肥力方面,起着十分重要的作用,但是,当湖泊、河流或水库中蓝藻大量繁殖而形成水华时,就会降低湖泊生态系统的多样性与服务功能,导致生态灾害,如蓝藻通过产生生物毒素(如微囊藻毒素)和异味物质(硫醇、硫醚、硫化氢等)危及饮水安全和人类健康,在水面堆积腐烂还会严重影响水体的景观功能[2-3]。因此,有无蓝藻水华通常被视为一个水生态系统是否良好或健康的分水岭。但这也不是绝对的,有时Ⅴ类或劣Ⅴ类水中不一定有蓝藻水华,而Ⅱ类或Ⅲ类水反而会有水华。
1 蓝藻水华的成因与影响因素许多复杂系统有临界阈值——即所谓的转换点——在此处,系统突然从一种状态转变到另一种状态。为何在一些水生态系统,藻类群落从多优状态转变到单优状态(少数蓝藻一统天下而形成表面水华)?这并不是一个容易给出确切回答的问题,因为蓝藻的生长繁殖及水华的形成受到物理因素(温度、光照、水动力学等)、化学因素(N、P、C、微量元素等)和生物因素(包括与其它藻类或水生维管束植物的竞争、牧食、微生物作用)等错综复杂的影响(图 1)。蓝藻形成水华是其内在的生理学特性与适宜的环境条件叠加的生态学结果,虽具有一定的可预测性,但由于诸多影响因素错综复杂地交织在一起,加之生命周期短、繁殖速度快,使蓝藻水华的准确预测十分困难。
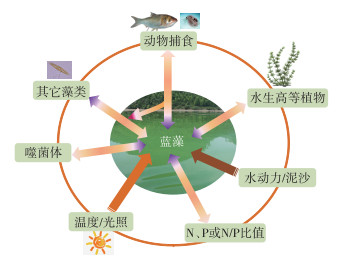
|
图 1 影响蓝藻形成水华的主要因素(双向箭头表示存在相互作用) Fig.1 Factors related to the formation of cyanobacterial blooms (The double-headed arrows indicate mutual effects) |
但我们也有一些趋势性的认识。经验表明,氮、磷过量输入对蓝藻水华的发生起到了根本性的作用,蓝藻在富营养化条件下具有明显的竞争优势,称之为“上行效应”,蓝藻水华和磷之间甚至还存在正反馈作用,互为因果,在一定程度上会加重水华的危害。蓝藻水华对沉积物磷的泵吸作用[4-5]如图 2所示。
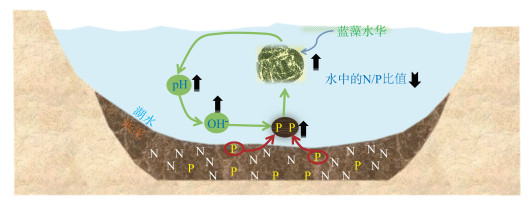
|
图 2 富营养水体(Fe-P、Al-P含量较高)中水华蓝藻对沉积物P的泵吸机制模式图(黑色箭头向上表示升高,黑色箭头向下表示下降) Fig.2 A diagram showing the pumping up of sediment phosphorus by bloom-forming cyanobacteria in eutrophic waters (with abundant Fe-P and Al-P) (The upward black arrows indicate increase, and the downward black arrows indicate decrease) |
气候对蓝藻水华的发生也能产生显著影响,如高温常常有利于蓝藻的增殖,因为蓝藻是从地球早期的高温环境中发育出来的古老生物类群。大部分蓝藻的最适温度在25~35oC之间,高于绿藻和硅藻,这使大部分蓝藻水华在夏季更具有竞争优势。水体的交换速率和泥沙含量也能影响蓝藻的丰度,如流速快、泥沙含量高的河流环境一般不容易出现蓝藻水华。
一般而言,生物因子的作用机制比较复杂,主要是抑制性质的(捕食或竞争)。有一些动物能以蓝藻为食,从而减轻蓝藻水华的发生,称之为“下行效应”或“营养级联效应”。与其它藻类的竞争(对光、营养)亦能对蓝藻水华的发生产生影响,这还可能受到营养级联效应的影响[6]。水草和蓝藻之间亦存在竞争或化感作用,还存在以蓝藻为食的噬菌体(病毒)。
2 蓝藻水华的防控不难理解,一些影响蓝藻生存与繁衍的因子可被用于蓝藻的防控,形成所谓物理的、化学的或生物的手段。引水常被认为可以稀释或冲走蓝藻,但由于这有可能会导致蓝藻向下游水体转移,在水体中的氮、磷浓度普遍较高的情况下,引水水源、下游受水区域影响等,使本方法常难以奏效。
虽然降低营养盐是根治蓝藻水华的有效途径,但这对大中型湖泊来说,往往是一个耗资巨大且缓慢的过程,对有一定规模的城市湖泊来说亦十分困难。水体的温度和光照难以人为改变。水生植物可用于抑制蓝藻的发生,但大中型湖泊中沉水植物一旦退化,恢复起来往往十分困难,且代价巨大。有时即使恢复成功,也不意味就能稳定维持。一些围隔中(切断了外源负荷、改变了水动力条件等)的恢复结果并不能简单的推演到开敞的湖泊中,因为自然湖泊(特别是城市湖泊)必须接纳巨大的季节性冲击负荷。而在较大的水体中利用噬菌体来杀灭蓝藻受其技术成熟度和成本的影响,尚难大规模开展。
还有各种各样的藻水分离装置,有些固定在岸上(如分离站),或在水中移动(如收藻船),但都需要昂贵的硬件投资和较高的运行成本,多用于处理较小范围内蓝藻的局部堆积,只能是一种应急手段,治标不治本。对数百甚至数千平方公里大小的湖泊来说,蓝藻一旦暴发,很难进行应急处理,一般就是在水华容易堆积的地方进行人工或机械打捞,但难以对水华的状态产生根本性影响。
在短期内无法对氮、磷进行有效削减而又无其它有效措施的情况下,对蓝藻的生态控制(主要是利用下行效应原理)被寄予厚望。1970s,西方学者提出了通过控制食浮游生物鱼类(颗粒捕食鱼类particulate-feeding fish)促进大型浮游动物——枝角类以达到控制藻类水华的目的,称之为“经典生物操纵”理论[7],食浮游生物鱼类的控制可以通过移去或投放凶猛鱼类的方式来实现,但面临的最大问题就是枝角类无法有效控制形成水华的蓝藻(一是其滤食的颗粒大小有限,二是其寿命短、季节更替太快),因此,在蓝藻水华的控制上难以派上用场。枝角类等的滤食甚至还会有利于难以被其摄食的丝状蓝藻或微囊藻群体的发展[8-9],因此可能反而增加生物操纵后有毒水华形成的风险[10]。广义的生物操纵还包括对生物群落其它关键组分的调控。生物操纵的主要目的就是降低蓝藻水华的风险,但几乎没什么研究报道仅通过凶猛性鱼类的投放成功降低了蓝藻的案例[10]。
1990s,刘建康院士和谢平研究员提出了利用东亚特有的滤食性鱼类(filter-feeding fish)——鲢、鳙控制蓝藻水华的“非经典生物操纵”理论,这是在对武汉东湖半个世纪蓝藻水华消长过程及驱动机制、多年的受控实验研究、摄食生态学等综合研究的基础上提出的[11-19],而且这种滤食性鱼类能抵抗微囊藻毒素,能以有毒蓝藻为食实现快速生长[20-21]。当然,鲢、鳙的食性有所差别——鲢的鳃耙较密,而鳙的鳃耙较稀,在同样的条件下,鲢摄食的藻类比鳙多,但鳙摄食的浮游动物比鲢多。鲢、鳙是杂食性浮游生物食性鱼类,被认为采用机会主义的摄食模式,缺乏稳定的生态位。鲢、鳙的食性与其自身的密度也有关,如果鲢、鳙密度较低,浮游动物在其食物中的比重就会增加,因此会降低对蓝藻的控制效果[22]。在东亚之外,鲜有利用滤食性鱼类成功控制蓝藻的案例[10]。其实全世界范围内能用来控制蓝藻的滤食性鱼类寥寥无几,生活在热带的罗非鱼虽然有一定的滤食特性,但它难以度过温带或亚热带地区的冬季。
经典与非经典生物操纵原理的比较如图 3所示,经典生物操纵遏制颗粒捕食性质的食浮游生物鱼类,促进大型浮游动物(摄食范围一般小于10~20 μm)的繁荣,但只能控制小型藻类而无法摄食形成群体的蓝藻;非经典生物操纵依赖滤食性的食浮游生物鱼类(摄食范围一般大于10~20 μm),可有效控制形成群体的蓝藻。两类浮游生物食性鱼类对小型浮游动物的影响均较弱(绿色箭头),但对大型浮游动物的影响均较强。
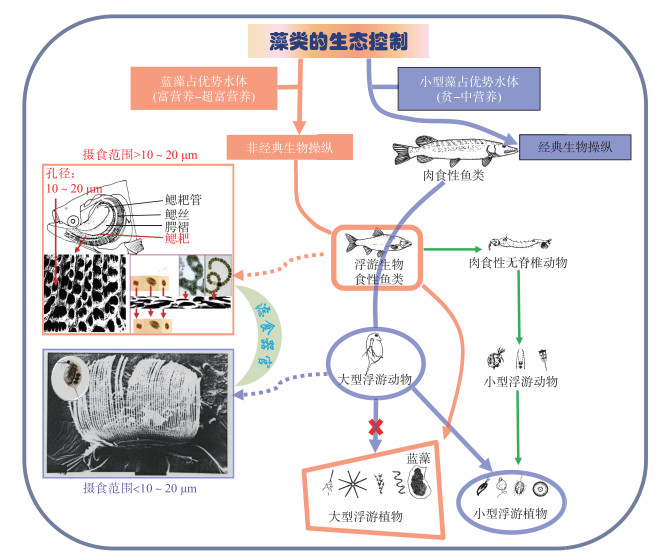
|
图 3 生物操纵原理示意图(紫色实线箭头表示经典生物操纵路径,红色实线箭头表示非经典生物操纵路径) Fig.3 A schematic diagram of biomanipulations (The purple solid arrows indicate traditional biomanipulation, and the red solid ones indicate non-traditional biomanipulation) |
非经典生物操纵理论是基于回顾性研究(图 4,5)以及中宇宙实验[11-14, 18]提出的,尚需通过全湖实验进行验证。首先,中宇宙或围隔实验通常缺乏外源负荷冲击,但天然湖泊均需接纳一定的外源负荷,特别是城市湖泊在雨季往往需要承受雨污混流的强烈冲击。其次,天然湖泊的湖盆、风场和水动力过程多样复杂,既能对营养盐的动态也能对水华的输移与堆积产生显著影响,这些最终可能会影响对蓝藻的营养级联效应。再次,天然的湖泊生态系统具有更为复杂的食物网结构以及所支撑的多样性、稳定性、种间互作和多功能性。因此,非经典生物操纵理论的有效性需要在有一定规模的自然水体中进行验证。

|
图 4 滤食性鱼类对东湖蓝藻水华影响的回顾性分析 Fig.4 A retrospective analysis on the effects of filter-feeding fishes on cyanobacterial blooms in Lake Donghu |
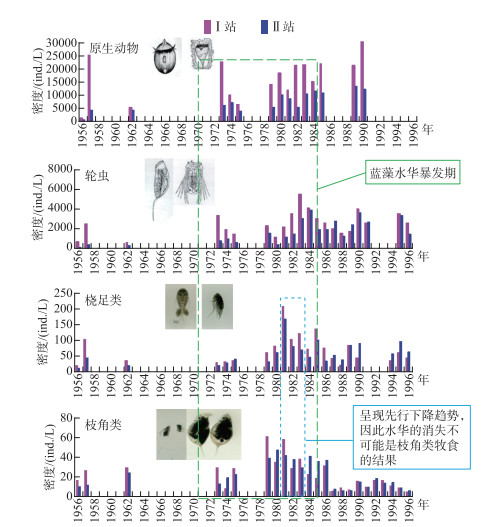
|
图 5 浮游动物对东湖蓝藻水华影响的回顾性分析(Ⅰ站为湖湾区,Ⅱ站为湖心区) Fig.5 A retrospective analysis on the effects of zooplankton on cyanobacterial blooms in Lake Donghu(Station Ⅰ is located in the bay, and Station Ⅱ is located in the center of the lake) |
生物操纵的本质是对食物网进行调控。在水生态系统中,蓝藻等浮游植物是初级生产者,以藻类为食的浮游动物为初级消费者,以浮游动物为食的鱼类为次级消费者,以鱼为食的鱼类为顶级消费者……种类繁多的生产者、消费者和分解者通过营养关系构成食物链,不同的食物链相互交织成为一个复杂的食物网。而蓝藻正是镶嵌在这种极为复杂的生态系统食物网络中,受到一系列生物和非生物因素错综复杂的制约,种群调控机制极为复杂。
经典生物操纵依赖的对象为初级消费者——浮游动物,而非经典生物操纵依赖的对象是同时具有初级消费与次级消费特征的鱼类,因为这些鱼类用致密的鳃耙过滤食物,同时摄取了大型藻类和浮游动物。食物链不同营养级间物种的相生相克是生态系统保持平衡的重要力量,如可避免低营养级物种失去天敌制约后泛滥成灾,而生物操纵正是要利用这种制约关系。当然,通过食物网的调控来实现对蓝藻水华的生态控制绝非易事,涉及复杂的种间互作,亦是世界性难题,通常需要对这种调控过程进行监控,特别是对水华早期发生进行预测预警,这也是对生物操纵关键参数及时优化调整的关键之一。
3 2021年东湖蓝藻水华及响应武汉东湖是一个较大的城中湖,水域面积约32 km2,湖水来自流域降雨,最终汇入长江。东湖曾经是一个整体,随后逐渐被道路分隔成9个子湖,但后来这些子湖又通过桥涵建立起了联系。东湖最大的子湖——郭郑湖面积约为12.8 km2,虽然处于富营养状态,但已经有三十余年未发生蓝藻水华。坐落于东湖之滨的东湖宾馆,毛泽东主席生前下榻了44次;2018年,国家主席习近平在东湖宾馆同印度总理莫迪举行非正式会晤,并在东湖边一同散步。维持东湖水色秀丽的重要性不言而喻。
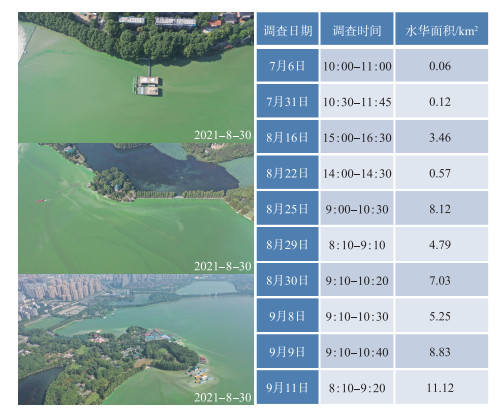
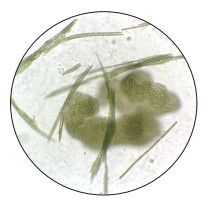
然而,2021年,郭郑湖(以下简称东湖)在时隔30多年后突然暴发了严重的蓝藻水华:6月底开始在局部湖湾/湖岸出现,7月快速扩散,8-9月全面暴发,严重时几乎覆盖了整个湖面,最大水华面积一度接近87 % (图 6)。以生物量来看,微囊藻为绝对优势种,虽然也有一些丝状蓝藻(图 7)。东湖蓝藻水华的暴发突如其来,2020年还毫无踪影,2021年一出现就以排山倒海之势覆盖了全湖,且持续了数月之久。这也从另一个侧面说明,目前东湖暴发全湖性蓝藻水华的物质基础依然存在。2021年东湖蓝藻水华暴发后,相关部门采取了各种应急措施(抽藻、无人机/人工喷洒杀藻剂),最后随着气温的降低,大面积蓝藻才自然消退(图 8,附图 Ⅰ~Ⅱ)。
|
图 6 通过无人机航拍估算的东湖蓝藻水华面积(由王蓝天等提供) Fig.6 Estimation of coverage area of cyanobacterial blooms in Lake Donghu using UAV aerial photography(Provided by Mr. Lantian Wang et al) |
|
图 7 东湖蓝藻水华的优势种——微囊藻和长孢藻(2021年8月6日) Fig.7 Dominant species of cyanobacteria, Microcystis and Dolichospermum, in Lake Donghu (Aug. 6, 2021) |

|
图 8 晚秋依然残留的东湖蓝藻水华(2021年11月24日) Fig.8 Cyanobacterial blooms of Lake Donghu in late autumn (Nov. 24, 2021) |
中国科学院水生生物研究所,尤其是对东湖进行了半个多世纪生态监测的东湖生态站,目睹了2021年东湖蓝藻暴发的全过程。在相关管理部门的支持下,积极行动,组建了以东湖生态站为主的藻华防控研究团队,对2021年东湖蓝藻暴发成因进行了解析。通过对东湖半个世纪的监测数据(水体富营养化情况、浮游动植物的群落结构和生物量、渔产量等)进行系统的梳理与分析,初步判断东湖的氮、磷水平依然适合蓝藻的发生,多种因素导致的营养级联效应失衡可能是2021年蓝藻突然暴发的主要诱因,同时,其他因素,如雨季雨污混流污水的过量排放可能导致的外源负荷增大、水文状态的变化可能促进了夏季内源氮磷负荷的释放、子湖之间生源要素或蓝藻的扩散等其它多因素的叠加,亦可能促进了中心湖区蓝藻的繁衍。
基于上述分析判断,2022年水华防控工作的重点应是如何使生态系统重回平衡状态,为此,我们多次到东湖渔场开展调研,与相关人员进行了深入交流,了解了近年渔业管理及范围变化方面的情况,包括鱼类投放量、品种、规格、投放地点、捕捞时间与产量等信息。进一步对东湖几十年的渔业数据进行趋势性分析,并在2021年底至2022年初对东湖鱼群进行多次评估、探测,重点对东湖近10年生态系统结构和营养级联效应的变化进行科学分析。最后,结合东湖目前的主要水质状况,基于非经典生物操纵理论,制定了2022年东湖蓝藻的定量化生态调控方案,并在相关方面的共同配合下,于年初实施并完成了以控制蓝藻为目的的鱼类生物群落的配置。
4 2022年东湖蓝藻水华防控2022年确实是极不平凡的一年。首先是武汉遭遇了自1961年有完整气象观测记录以来最炎热的夏天。6月正是蓝藻水华启动的月份,却经历了60年来最热的6月,比常年偏高1.8℃。根据东湖生态站的气象数据,6月18日-6月30日期间,东湖湖面平均气温为2022年(30.04℃)> 2021年(27.83℃)> 2020年(25.57℃)。7-8月武汉更是持续极端高温天气。众所周知,高温有利于蓝藻的增殖。
第2个挑战是磷水平高居不下。底泥中囤积了大量的磷,而极端高温干旱起到了助推的作用——高温促进磷释放,干旱引起湖泊水位下降,从而使环境容量降低、再悬浮增加。根据东湖生态站的监测数据,8月中旬,东湖湖心的总磷浓度高达0.195 mg/L,离劣Ⅴ类仅一步之遥,相较而言,总氮水平略低,浓度为0.853 mg/L,为Ⅲ类水。因此,东湖依然具备蓝藻水华大规模暴发的物质基础。
第3个挑战是鱼类种群调控出现风险。2022年初东湖鱼类出现不明死亡,1-3月打捞的死鱼超过125 t。由于在调控方案中预先为一些关键参数留足了冗余,确保了生态系统即使遭遇强烈的外力冲击也不至于落入蓝藻水华易发区间。
另一方面,也考虑到了方案可能的不确定性,因蓝藻水华的发生涉及诸多因素,如多样性与稳定性的联动、营养级内/间复杂的互作关系,还可能会叠加气候变暖和外源污染负荷变动的联合效应等。因此,方案中也包含了实施过程可能的适应性调整,这需要依赖对生物调控全过程的高频监测以及精准的早期预警。
为了做好水华的早期预警,东湖生态站投入了大量的人力物力,在蓝藻易发的高温季节(经常是40℃或以上的高温)开展了高频次的人工监测,即每周2次对东湖生态站附近水域、西部湖湾区(Ⅰ站)和湖心区(Ⅱ站)进行藻类群落结构分析,同时每月3次对所有子湖的水质和水生态进行综合监测;结合东湖生态站的长期监测数据对蓝藻水华的风险进行分析与连续性的精准短期预测预报。
东湖生态站积累的半个多世纪的生态系统监测数据(鱼类、藻类、浮游动物、氮磷等)为2022年东湖蓝藻水华的早期预警提供了很大帮助,这与中国生态系统研究网络(CERN)坚持以长期定位观测、研究和示范作为野外科学观测研究台站(简称野外台站)核心任务的高瞻远瞩的建设方针和长期稳定支持密不可分。事实证明,我们在5-9月期间多次为相关管理部门(东湖管理委员会、武汉市水务局、湖北省生态环境厅等)提供的东湖处于蓝藻水华较低风险区间的早期预警信息均是准确的。
一般来说,蓝藻水华一旦大规模暴发就容易成为常态,在这样的淡水湖泊,每到夏季,蓝藻水华的到来似乎已是确定性事件,只是时间早晚或严重程度的问题。尤其因为2021年东湖的蓝藻水华较为严重,覆盖面大、持续时间长,可能留下了巨量的种源,也都让人不免为翌年藻华的再次发生而担忧。但2022年,借助于非经典生物操纵理论的指导与坚定实施,经过近一年各方协同努力,蓝藻水华在东湖主湖区——郭郑湖得到了成功遏制(图 9)。

|
图 9 东湖蓝藻水华发生情况对比(左:2021年,右:2022年) Fig.9 A comparison of cyanobacterial blooms in Lake Donghu (left is 2021 and right is 2022) |
需要说明的是,在5-6月,有一些丝状蓝藻在微风的气象条件下在下风口的岸边或湖中障碍物(如围隔)的下风死角处偶尔出现小范围(一般死角处 < 数平方米或岸边狭长条)的聚集而形成极其轻微的水华现象,通常出现在清晨,白天稍大一点的风一吹就消散了。在经历了一个多月的持续高温天气之后,8月16日清晨,在极微风的气象条件下,郭郑湖(海洋世界帘口、听涛濒湖画廊、行吟阁附近湖面)岸边或围隔阻挡处,出现少量蓝藻漂浮。一年中的几次偶发现象,其发生范围很小,时间短暂,基本可以忽略不计。
5 小结与展望2022年在武汉东湖实施的以控制蓝藻为目的的非经典生物操纵成效显著。生态调控方案确定并在冬季实施后,就未再进行大的调整,对蓝藻水华的控制效果非常明显——东湖主湖区郭郑湖的最大水华面积从2021年的接近87 % 骤降到了2022年远低于万分之一。通过对以欧美学者提出的经典生物操纵为基础的蓝藻生物控制实践进行分析发现,无论从规模还是从效果来看,从未有过如此成功的案例。东湖生态站的研究人员在过去30多年持之以恒地对东湖生态系统进行监测和研究,在蓝藻的生态控制研究领域,不畏国际权威,另辟蹊径,在危难之际,勇于担当,把论文写在了祖国的大地上。这一成功实践不仅使非经典生物操纵在全湖实验中得到验证,而且表明,非经典生物操纵理论指导下的生态调控是一项环境友好、经济实用的生态技术,能有效地用于富营养-中富营养湖库中蓝藻水华的生态防控,将会得到更加广泛的推广与应用。
生态系统在一定的区间内可以在某种平衡状态(稳态)内自动调节,但超过一定阈值将导致飞跃或崩溃(常常指称灾变)。非经典生物操纵理论本质上来说是一种通过下行效应(即利用蓝藻的天敌)让富营养湖泊从水华稳态转变到非水华稳态的调控理论,是在对长期生态学过程的回溯性分析、受控原位实验以及全湖生态调控实践的基础上建立起来的,其技术方案的确定依赖于对营养级联效应及藻类的响应分异与群落演替等的综合分析。东湖目前的氮、磷浓度依然处于富营养水平,特别是磷污染严重。由于水体初级生产力受到营养盐的强烈驱动,如果东湖失去足够的下行控制力,很容易再次暴发大规模甚至全湖性的蓝藻水华,因此需继续进行以蓝藻控制为目标的食物网调控(非经典生物操纵),通过遏制水华蓝藻的优势度来提升藻类群落的多样性与稳定性,维持生态系统的多功能性。
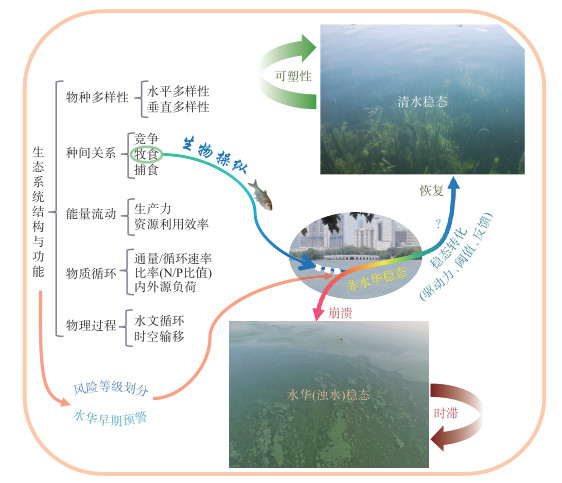
在武汉东湖,通过非经典生物操纵成功实现了从蓝藻(浊水)稳态到非蓝藻稳态的转换。但是,如何在大中型浅水湖泊中从通过下行效应维持的非水华稳态转换到沉水植物清水稳态是未来需要解决的一个关键问题(图 10),也是系统治理的重要目标之一,为此,未来还需要在对生态系统结构和功能深入研究的基础上,进一步解决好非经典生物操纵与氮磷冲击负荷、生态水文过程和水生维管束植物生长等的联动关系,以及在此基础上如何驾驭好清水稳态转化的驱动力、阈值和反馈等关键科学问题。
|
图 10 从浊水稳态经非水华稳态向清水稳态的转化 Fig.10 Regime shift from a turbid/bloom state, through a non-bloom intermediate state, to a clear water state |
最后需要指出的是,虽然清水稳态是大中型湖泊治理的终极目标,但它也不是一劳永逸的(因为自然界中没有哪一个生态系统可以在一种稳态永恒地进行自我调节或自我维持),其构建、恢复或维持都是一个极其复杂的系统工程,仍需要解决与之相关的理论、技术、成本与管理等一系列问题。
6 附录附图 Ⅰ、 Ⅱ见电子版(DOI: 10.18307/2023.0199)。

|
附图Ⅰ 东湖蓝藻水华发生情况对比(左:2021年,右:2022年) AttachedFigure1 A comparison of cyanobacterial blooms in Lake Donghu (left is 2021 and right is 2022) |

|
附图Ⅱ 东湖蓝藻水华发生情况对比(左:2021年,右:2022年) AttachedFigure2 A comparison of cyanobacterial blooms in Lake Donghu (left is 2021 and right is 2022) |
| [1] |
谢平. 论蓝藻水华的发生机制-从生物进化、生物地球化学和生态学视点. 北京: 科学出版社, 2007.
|
| [2] |
谢平. 太湖蓝藻的历史发展与水华灾害. 北京: 科学出版社, 2008.
|
| [3] |
谢平. 水生动物体内的微囊藻毒素及其对人类健康的潜在威胁. 北京: 科学出版社, 2006.
|
| [4] |
Xie LQ, Xie P, Tang HJ. Enhancement of dissolved phosphorus release from sediment to lake water by Microcystis blooms—an enclosure experiment in a hyper-eutrophic, subtropical Chinese lake. Environmental Pollution: Barking, Essex: 1987, 2003, 122(3): 391-399. DOI:10.1016/s0269-7491(02)00305-6 |
| [5] |
Xie LQ, Xie P, Li SX et al. The low TN: TP ratio, a cause or a result of Microcystis blooms?. Water Research, 2003, 37: 2073-2080. DOI:10.1016/S0043-1354(02)00532-8 |
| [6] |
Su HJ, Wang R, Feng YH et al. Long-term empirical evidence, early warning signals and multiple drivers of regime shifts in a lake ecosystem. Journal of Ecology, 2021, 109(9): 3182-3194. DOI:10.1111/1365-2745.13544 |
| [7] |
Shapiro J, Lamarra V, Lynch M. Biomanipulation: an ecosystem approach to lake restoration. In: Brezonik PL, Fox JL eds. Proceedings of a Symposium on Water Quality Management through Biological Control. Gainesville: University of Florida, 1975: 85-89.
|
| [8] |
Hanson MA, Butler MG. Responses of plankton, turbidity, and macrophytes to biomanipulation in a shallow prairie lake. Canadian Journal of Fisheries and Aquatic Sciences, 1994, 51(5): 1180-1188. DOI:10.1139/f94-117 |
| [9] |
Dawidowicz P, Prejs A, Engelmayer A et al. Hypolimnetic anoxia hampers top-down food-web manipulation in a eutrophic lake. Freshwater Biology, 2002, 47(12): 2401-2409. DOI:10.1046/j.1365-2427.2002.01007.x |
| [10] |
Triest L, Stiers I, van Onsem S. Biomanipulation as a nature-based solution to reduce cyanobacterial blooms. Aquatic Ecology, 2016, 50(3): 461-483. DOI:10.1007/s10452-015-9548-x |
| [11] |
Xie P, Liu J. Studies on the influence of planktivorous fishes (silver carp and bighead carp) on the phytoplankton community in a shallow, eutrophic Chinese lake (Donghu Lake) using enclosure method. FEBL Annual Report of State Key Laboratory for Freshwater Ecology and Biotechnology of China for 1990. Beijing: International Academic Publishers, 1991: 15-24.
|
| [12] |
Xie P, Liu J. Studies on the influence of planktivorous fishes (silver carp and bighead carp) on the "water bloom" in a shallow, eutrophic Chinese lake (Lake Donghu) using enclosure method. FEBL Annual Report for 1991. Beijing: International Academic Publishers, 1992: 21-24.
|
| [13] |
Xie P, Wang S, Wang J et al. An enclosure experiment on the influence of three "domestic" carps, silver carp, bighead carp and grass carp, on the "water bloom" in a shallow, eutrophic Chinese lake (Lake Donghu). FEBL Annual Report for l992. Beijing: International Academic Publishers, 1993: 13-20.
|
| [14] |
Xie P. Experimental studies on the role of planktivorous fishes in the elimination of Microcystis bloom from Donghu Lake using enclosure method. Chinese Journal of Oceanology and Limnology, 1996, 14(3): 193-204. DOI:10.1007/BF02850380 |
| [15] |
Liu JK, Xie P. Unraveling the enigma of the disappearance of water bloom from the east lake (Lake Donghu) of Wuhan. Resources and Enuironment in the Yangtza Basin, 1999, 8(3): 312-319. [刘建康, 谢平. 揭开武汉东湖蓝藻水华消失之谜. 长江流域资源与环境, 1999, 8(3): 312-319.] |
| [16] |
Xie P. Gut contents of silver carp, Hypophthalmichthys molitrix, and the disruption of a centric diatom, Cyclotella, on passage through the esophagus and intestine. Aquaculture, 1999, 180(3/4): 295-305. DOI:10.1016/S0044-8486(99)00205-7 |
| [17] |
Xie P. Gut contents of bighead carp (Aristichthys nobilis) and the processing and digestion of algal cells in the alimentary canal. Aquaculture, 2001, 195(1/2): 149-161. DOI:10.1016/S0044-8486(00)00549-4 |
| [18] |
Xie P, Liu JK. Practical success of biomanipulation using filter-feeding fish to control cyanobacteria blooms: A synthesis of decades of research and application in a subtropical hypereutrophic lake. The Scientific World Journal, 2001, 1: 276487. DOI:10.1100/tsw.2001.67 |
| [19] |
谢平. 鲢、鳙与蓝藻水华控制. 北京: 科学出版社, 2003.
|
| [20] |
Chen J, Xie P, Zhang DW et al. In situ studies on the bioaccumulation of microcystins in the phytoplanktivorous silver carp (Hypophthalmichthys molitrix) stocked in Lake Taihu with dense toxic Microcystis blooms. Aquaculture, 2006, 261(3): 1026-1038. DOI:10.1016/j.aquaculture.2006.08.028 |
| [21] |
Chen J, Xie P, Zhang DW et al. In situ studies on the distribution patterns and dynamics of microcystins in a biomanipulation fish—bighead carp (Aristichthys nobilis). Environmental Pollution, 2007, 147(1): 150-157. DOI:10.1016/j.envpol.2006.08.015 |
| [22] |
Ke Z, Xie P, Guo L. In situ study on effect of food competition on diet shifts and growth of silver and bighead carps in large biomanipulation fish pens in Meiliang Bay, Lake Taihu. Journal of Applied Ichthyology, 2008, 24(3): 263-268. DOI:10.1111/j.1439-0426.2008.01060.x |
 2023, Vol. 35
2023, Vol. 35 

