(2: 中国矿业大学资源与地球科学学院,徐州 221116)
(2: School of Resources and Geosciences, China University of Mining and Technology, Xuzhou 221116, P.R.China)
湖泊连接地球上的各个圈层,是陆地水圈的重要组成部分. 湖泊生态系统是地球上重要的生态系统之一,拥有着丰富的微生物资源[1]. 湖泊中的异养微生物主要负责有机物降解和系统呼吸,在生源要素生物地球化学循环方面发挥着重要的作用[2]. 作为微生物的重要类群之一,细菌是湖泊微食物网的重要组成部分[3],对湖泊生态系统中环境变化反应敏感[4]. 大量研究表明,营养物质、水温、溶解氧、氮磷含量等环境因素都会对湖泊中的细菌群落产生影响[5-6]. 通过研究湖泊中细菌多样性及群落结构的时空分布格局,可以揭示其对环境变化的适应机制,从而预测湖泊生态系统对环境变化的响应规律,对湖泊管理及区域环境可持续发展具有重要意义.
沉积物是湖泊生态系统的重要组分,为微生物生存提供环境和营养物质,具有高度的生物活性[7]. 沉积物和水体之间存在频繁的物质交换,沉积物中的氮磷等营养元素可通过静态或动态释放,进入到水体中,成为诱发水体富营养化的重要因素之一[8]. 这一过程主要发生在表层沉积物中,但是湖泊沉积是一个缓慢发生的历史过程,不同历史时期湖泊信息可在不同深度沉积物中有所反映,因此了解不同深度沉积物中微生物群落结构和多样性,对于全面了解湖泊历史演化过程具有重要意义.
在全球变暖的大背景下,干旱和半干旱地区湖泊由于蒸发量大于补给量,导致湖泊水位下降,湖面积萎缩,湖泊咸化现象加剧[9]. 湖泊盐度的差异,会导致湖泊微生物群落结构的不同[10]. 常见的细菌群落包括放线菌门、变形菌门、拟杆菌门、蓝藻门等[11],随着盐度的增加,细菌群落组成的优势菌群发生改变,放线菌的相对比例减少,细菌多样性随着盐度的升高而下降[12]. 水体中盐分的升高影响着细菌菌体内外的渗透压及群落代谢水平,因而盐度成为影响细菌群落分布的重要因素[13].
岱海(40°32′~40°37′N,112°36′~112°46′E)是内蒙古第三大内陆湖,位于乌兰察布凉城县的陷落盆地中,是个封闭的湖泊,历史上也是内蒙古自治区重要的渔业养殖基地[14]. 岱海主要入湖河流有弓坝河、五号河、步量河、天成河等22条[15],其中弓坝河全长约70 km,流域面积最大[16-17]. 目前,岱海长约11 km,宽度约7.3 km[18]. 2016年统计岱海水位为980.15 m[16],平均水深7 m,容积约为988.9×106 m3[19-20]. 岱海水位变化及其水量的增加受控于流域降水、入湖水量,而排水则完全靠湖面的蒸发[21]. 随着气候变化和人类活动的影响,岱海的生态环境发生了显著变化. 近30年来,岱海面积持续萎缩,1989年岱海湖面面积约为115 km2,到2018年时湖面面积仅为53 km2[22]. 湖泊面积萎缩导致湖水咸化的问题越来越突出[23]. 岱海在1964年时矿化度(TDS)为2.25 g/L左右,属于微咸水湖范围,到2004年已接近咸水湖标准的下限5 g/L[24];根据本文在2018年的监测结果,TDS已达到13.9 g/L,属于咸水湖. 岱海流域对细菌群落的研究主要集中在两个方面:一方面是对湖滨湿地不同盐化程度土壤微生物的群落结构的研究[25],另一方面是对湖区沉积物微生物量动态变化的研究[26-27],目前对岱海水体和沉积物细菌群落结构的研究还十分匮乏.
干旱半干旱地区的环境脆弱,区域内的湖泊对于涵养水源、调节气候、维护生态平衡起到了重要作用. 近几十年来,由于气候变化以及人类活动的影响,我国干旱和半干旱地区的部分湖泊出现了不同程度的水位下降、湖面萎缩及湖水咸化等问题,严重影响了流域的生态安全. 因此本文利用高通量测序的方法,以岱海为例,通过对岱海水体和沉积物中的细菌多样性、群落结构及其驱动因子研究,为阐明全球气候变暖背景下,干旱半干旱地区湖泊细菌对环境变化的响应模式提供理论参考.
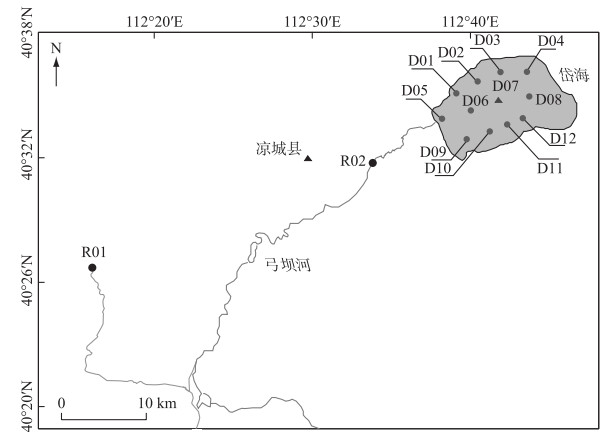
1 材料与方法 1.1 样品的采集综合考虑湖泊形态及河流输入等因素,在岱海主要入湖河流弓坝河的支流和干流各设置了1个采样点(R01、R02),湖体设置了12个采样点(D01~D12)(图 1),于2018年9月8日在每个采样点采集了表层水样(表层50 cm)各5 L,带回实验室冷藏保存,分析营养盐指标及过滤细菌总DNA等. 在湖心(D07)用柱状采泥器采集沉积物柱3根. 现场将沉积物柱每隔1 cm分层取样,装入灭过菌的保鲜袋中,冷冻保存以备后续测试.
|
图 1 岱海和入湖河流采样点位置 Fig.1 Distribution of sampling sites in Lake Daihai and its inflow river |
现场用多参数水质检测仪(YSI v6600,美国)检测水体的水温(WT)、电导率(Cond)、矿化度(TDS)、pH和溶解氧(DO),用测深仪(Uwitec,奥地利)检测水深(WD). 水质指标总氮(TN)和溶解性总氮(TDN)浓度测定采用碱性过硫酸钾消解—紫外分光光度法(GB 11894—1989),硝态氮(NO3--N)浓度采用紫外分光光度法(GB 7480—1987),氨氮(NH3-N)浓度采用纳氏试剂分光光度法(GB 7479—1987),总磷(TP)和溶解性总磷(TDP)浓度采用过硫酸钾消解-钼酸铵分光光度法(GB 11893—1989),叶绿素(Chl.a)浓度采用热乙醇萃取分光光度法[28],化学需氧量(COD)采用高锰酸钾法(GB/T 15456—2008)测定,悬浮物(SS)含量为水样经Whatman GF/F膜过滤后将滤膜在105℃烘干4 h至恒重后的质量[29]. 沉积物总氮(TNsed)含量采用凯氏法(HJ 717—2014)测定;总有机碳(TOC)含量采用总有机碳分析仪(HJ/T 104—2003)测定;磁化率(Xlf)的测定采用英国Bartington MS2型磁化率仪对样品进行测定,同一样品测量3次取平均值[30];沉积物14C测年在中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室进行.
1.3 DNA的提取和高通量测序取300 mL水样,经0.2 μm孔径的聚碳酸脂膜(Millipore Boston, MA, USA)过滤,滤膜用清洗后灭过菌的剪刀剪碎,然后用FastDNA Spin Kit for soil试剂盒(美国MPbio公司)提取总DNA. 分层后的沉积物各取约1 g,根据FastDNA Spin Kit for soil试剂盒的说明提取总DNA. 利用NanoDrop ND-1000分光光度计(美国NanoDrap Technologies公司)测定DNA浓度,然后用引物338F (5′-ACT CCT ACG GGA GGC AGC AG-3′) 和806R (5′-GGA CTA CHV GGG TWT CTA AT-3′) 扩增细菌16S rRNA基因的V3-V4区[31]. PCR扩增体系包含:20 ng DNA模板,0.4 μmol/L的引物,NEB Phusion高保真PCR mix. PCR扩增程序:98℃预变性3 min;98℃变性45 s,55℃退火45 s,72℃延伸45 s,共30次循环;最后72℃延伸7 min. 使用Ampure XP磁珠法对扩增产物进行了纯化,并溶于Elution Buffer,完成基因文库的构建. 最后,采用双端测序策略(2×300 bp),在华大基因股份有限公司的Illumina MiSeq PE300平台上完成测序[32]. 沉积物的第19层(对应于18~19 cm处样品)、第21~27层及第28层以下样品由于DNA含量少,无法得到有效扩增和测序,故获得细菌数据的沉积物样品共计20个. 本研究所得到的原始序列已提交至国家基因组科学数据中心(https://ngdc.cncb.ac.cn/gsa/),登录号为CRA002523和CRA005584.
1.4 数据分析序列的生物信息学分析通过CLC Genomics Workbench 20.0 (Qiagen)软件,使用“OTU Clustering Step by Step”的标准工作流程完成[32]. 原始双端序列经过导入、拼接和数据质控后,去除过长(>550 bp)或过短(< 200 bp)的序列、去除引物及其它低质量核苷酸序列,再以97 % 的序列相似性进行可操作分类单元(OTU)聚类. 为了减少随机测序误差,我们从OTU表中去除了低丰度(< 10 reads)的OTUs. 最后,通过与SILVA小亚基rRNA(SSU)数据库v132比对,在80 % 置信水平上比对序列,进行物种注释[33]. 此外,与叶绿体及嵌合体相关的序列被排除在后续分析之中.
细菌多样性分析利用R软件(version 4.0.3)的vegan程序包进行,绘图通过ggplot2程序包进行. 将所有的样本序列数量进行抽平至最小测序深度(10631条序列),使用抽平的数据计算细菌的α多样性指数(Chao1指数和Shannon-Wiener指数),采用非参数Kruskal Wallis检验比较岱海湖水与沉积物中细菌α多样性差异的显著性. 细菌群落结构的聚类分析采用Bray-Curtis距离,在PRIMER v7软件中完成[34]. 采用相似性分析(analysis of similarities, ANOSIM)及非参数多元方差分析(PERMANOVA)比较湖水和沉积物中细菌群落结构差异的显著性. ANOSIM分析结果中的R值范围在0~1之间,R越大,说明差异的程度越大[35]. 采用排序的方法研究了环境因子对细菌群落组成变化的影响. 首先进行除趋势对应分析(detrended correspondence analysis, DCA),如果DCA结果显示样品矩阵第1轴的梯度长度>4,表明细菌物种与环境间为非线性相关,则选择环境约束的典型对应分析(canonical correspondence analysis, CCA)来探索环境因子与细菌群落组成变化的关系;如果DCA结果显示样品矩阵第1轴的梯度长度 < 3.5,表明细菌物种与环境间为线性相关,则选择冗余分析(redundancy analysis, RDA)来探索环境因子与附着细菌群落组成时空变化的关系. OTUs数据经过hellinger转换. 通过vegan程序包的前向选择法(forward selection)筛选对群落组成影响最显著的环境因子,并通过方差膨胀因子(variance inflation factor,VIF)检测,保留VIF小于10的环境因子,以避免环境因子的共线性问题. 采用999次非限制性Monte Carlo permutation检测确定理化因子对群落组成是否具有显著影响[36].
2 结果与分析 2.1 岱海水体及沉积物理化特征采样时,岱海及入湖河流采样点的主要理化参数见表 1. 岱海水深范围为1.9~6.9 m,湖心D07点水深最深,达到6.9 m;pH均值为9.09(范围为9.03~9.11);水温均值为21.0℃(范围为19.5~22.0℃);平均TDS为13.9 g/L. 参照《地表水环境质量标准》(GB 3838—2002),监测结果表明,岱海TN平均浓度为4.39 mg/L,为劣Ⅴ类;TP平均浓度为0.107 mg/L,为V类. 岱海入湖河流的水温、TDS、TN、Chl.a及COD均低于岱海.
| 表 1 2018年9月岱海及其入湖河流水质参数 Tab. 1 Water quality parameters in Lake Daihai and its inflow rivers in September 2018 |
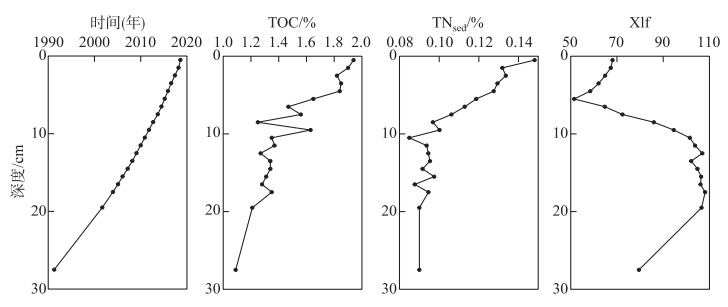
岱海湖心沉积物的理化性质如图 2所示. 对比不同深度沉积物的定年结果,28 cm深处的沉积物对应于1990年左右,而20和11 cm深处的样品分别对应于2000年及2010年左右. TOC和TNsed含量呈现随着深度增加而逐渐减少的趋势,Xlf随着深度的增加,先降低,后增高. 2001年以前,TOC和TNsed含量较低并维持在一个较为稳定的水平,2001—2010年TOC和TNsed含量出现较大波动,但没有明显增加;2010年以后TOC和TNsed含量整体呈现一个较大的增加趋势.
|
图 2 沉积物指标随深度变化 Fig.2 Changes of sediment parameters with depth |
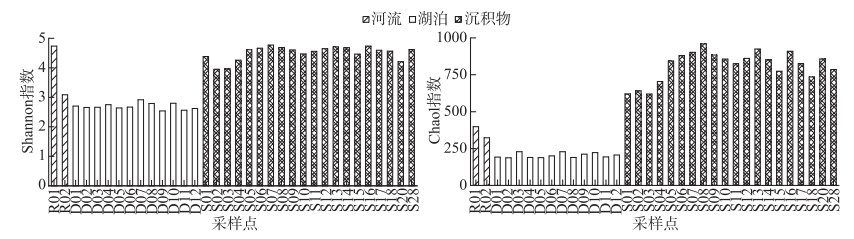
细菌α多样性分析结果如图 3所示. 沉积物的Chao1指数均值为827,明显大于河流的361和湖泊水体的189;Shannon指数也呈现为沉积物>河流>湖泊水体的趋势,3种生境Shannon指数的均值分别为4.50、3.92和2.69. 在岱海水体的不同采样点间Chao1指数和Shannon指数变化不大. 表层沉积物中(0~1 cm)细菌的多样性高于次表层(2~3 cm),随着深度的增加细菌多样性呈现先增加后减小的趋势. 河流2个采样点的多样性相差较大,上游支流的多样性高于干流. 差异显著性分析结果表明,沉积物中细菌多样性(Chao1指数和Shannon指数)显著高于岱海水体(P < 0.001). 根据距离主要入湖河流的远近,将岱海12个采样点分为易受河流影响区(D01、D05、D06、D09、D10)和不易受河流影响区(D02、D03、D04、D07、D08、D11、D12)两类;根据采样深度,将沉积物分为两组:10 cm以上(S01~S10),10 cm以下(S11~S20,S28). 差异显著性分析结果显示,岱海不同区域水体和沉积物两组样品之间的α多样性差异性均不显著(P>0.05).
|
图 3 岱海入湖河流、湖水及沉积物中细菌α多样性指数 Fig.3 Bacterial alpha diversity indexes of the inflow river, lake water and sediment of Lake Daihai |
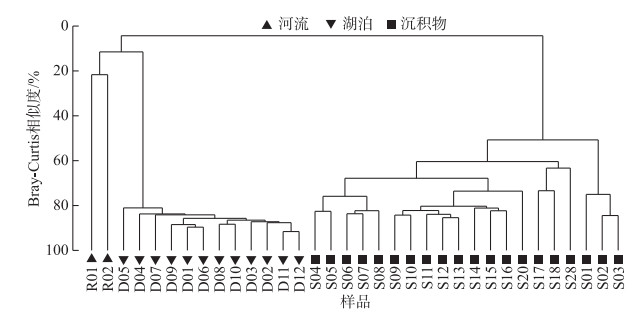
聚类分析表明,在细菌群落相似性为20 % 的水平时,样品被分为了3支,分别对应河流、湖水和沉积物3类生境(图 4). 河流样品细菌群落结构差异较大,两个样品细菌群落相似性只有21 %. 岱海水体中不同样品细菌群落相似度最高,最低相似性75.2 %. 沉积物中细菌群落结构与深度有一定关系,表层3个样品(0~3 cm)细菌群落结构与其它深度样品差异最明显,单独聚成一个小的分支;4~8 cm样品及9~16 cm样品分别聚成另外2个小的分支.
|
图 4 细菌群落聚类分析 Fig.4 Cluster analysis of the bacterial communities |
本研究34个样品测序共获得了964533条高质量细菌序列和1639个OTUs,分属于40门,106纲. 细菌群落在门水平上的物种组成如图 5所示,其中河流细菌群落共隶属22门,湖泊细菌群落隶属18门,沉积物细菌群落隶属39门.
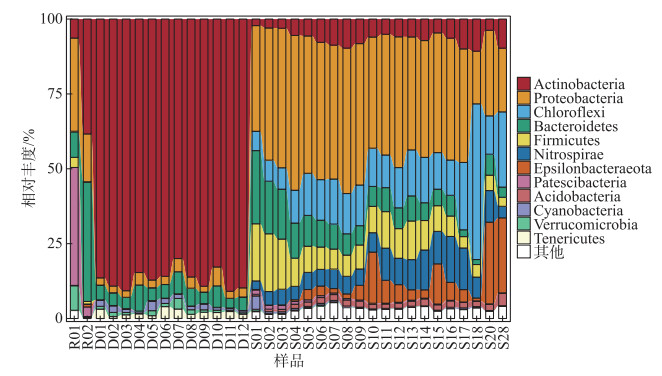
|
图 5 岱海入湖河流、湖水及沉积物中门水平细菌组成 Fig.5 Bacterial community composition of the inflow river, lake water and sediment of Lake Daihai at phylum level |
河流上游支流中(R01)的细菌群落中髌骨菌门(Patescibacteria,39.4 %)和变形菌门(Proteobacteria,31.1 %)所占比例较大. 河流干流中(R02)的细菌群落中拟杆菌门(Bacteroidetes,39.9 %)和放线菌门(Actinobacteria,38.3 %)所占比例较大. 岱海湖水中细菌群落中最优势菌门是放线菌门(Actinobacteria),相对丰度在80.0 % ~90.9 % 之间,其次拟杆菌门(Bacteroidetes,3.8 % ~8.7 %)和变形菌门(Proteobacteria,2.0 % ~6.3 %). 沉积物的细菌群落中最优势菌门为变形菌门(Proteobacteria,39.7 %),其次是绿弯菌门(Chloroflexi,15.6 %)、厚壁菌门(Firmicutes,9.25 %)、拟杆菌门(Bacteroidetes,8.6 %)和硝化螺旋菌门(Nitrospirae,7.8 %).
细菌群落在纲水平的物种组成如图 6所示,其中河流细菌群落共隶属44个纲,湖泊细菌群落隶属38个纲,沉积物细菌群落隶属86个纲. 2条河流细菌群落中的优势纲差别较大,R01中的最优菌纲为γ-变形菌纲(Gammaproteobacteria,20.5 %),其次为Gracilibacteria(20.0 %);R02中的优势菌纲为拟杆菌纲(Bacteroidia,39.7 %)和放线菌纲(Actinobacteria,38.3 %),其次是γ-变形菌纲(Gammaproteobacteria,13.6 %). 岱海湖水中的最优势菌纲是放线菌纲(Actinobacteria,82.1 %),其次是拟杆菌纲(Bacteroidia,5.1 %)和微酸菌纲(Acidimicrobiia,4.7 %). 沉积物中的最优势细菌纲为γ-变形菌纲(Gammaproteobacteria,28.8 %),其次为厌氧绳菌纲(Anaerolineae,13.1 %)、梭菌纲(Clostridia,9.1 %)和δ-变形菌纲(Deltaproteobacteria,9.0 %). ANOSIM和PERMANOVA检验,2个结果均表明:岱海沉积物与水体中细菌群落结构差异显著(P < 0.001);岱海水体易受河流影响区和不易受河流影响区细菌群落结构差异不显著(P=0.084);沉积物10 cm以上的细菌群落和10 cm以下的细菌群落差异显著(P < 0.001).
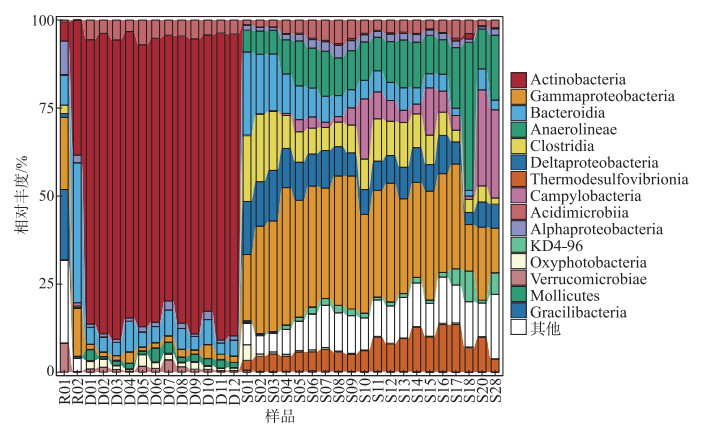
|
图 6 岱海入湖河流、湖水及沉积物中纲水平细菌组成 Fig.6 Bacterial community composition of the inflow river, lake water and sediment of Lake Daihai at class level |
在OTU水平上分析了细菌群落结构与环境因子的关系. 河湖水体样品DCA第1轴的长度为4.19,故选择CCA分析了河湖水体细菌群落差异的主导环境因子;而岱海水体和沉积物样品各自单独的DCA分析结果显示第1轴的长度分别为0.78和2.25,因此选择RDA分析方法. CCA及RDA的排序结果如图 7所示. 河湖样品CCA的分析结果表明第1轴的解释率50.2 %,第2轴的解释率为36.3 %,Monte Carlo permutation检验的结果显示Cond(P < 0.01)和SS(P < 0.001)是河湖细菌群落差异的主导因子(图 7a). 由于岱海水体细菌群落结构差异较小,故在CCA分析时聚集在一起. 当单独分析岱海水体细菌群落的影响因子时,RDA结果表明第1轴和第2轴的解释率分别为14.2 % 和4.8 %,Monte Carlo permutation检验的结果显示TDN和COD是显著影响岱海水体细菌群落结构的主导环境因子(P < 0.05)(图 7b). 沉积物样品RDA排序结果显示,三者共解释了这种变化的47.9 %,并且Monte Carlo permutation检验的结果显示Depth(P < 0.001)、TOC(P < 0.001)和Xlf(P < 0.01)均显著影响沉积物细菌群落结构的变化(图 7c).
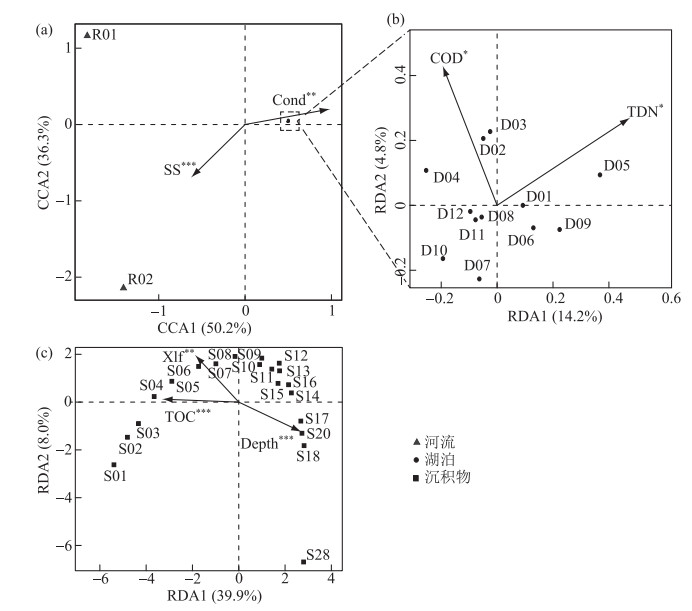
|
图 7 岱海水体及沉积物细菌群落与环境因子的CCA及RDA分析(环境因子后面的星号表示Monte Carlo permutation检验的显著性水平. *:P < 0.05;**:P < 0.01; ***:P < 0.001) Fig.7 CCA and RDA between bacterial communities and environmental factors in water and sediment of Lake Daihai |
本研究发现岱海入湖河流细菌群落的物种丰富度更高,并在物种组成上与湖水中细菌群落存在明显差异. 胡愈炘等[37]在对长江流域河流和湖库的浮游细菌群落进行分析时,也发现河流区域具有更高的物种丰富度,并且与湖库区域的物种组成差异显著. 本研究中,弓坝河R01采样点位于上游支流,水体中氮磷营养盐浓度相对较低,水质较好,水体流动比较缓慢,且采样时可见水底有较多的沉水植物,这可能是其细菌多性样高的主要原因. 而弓坝河R02采样点位于下游干流,采样时水深较浅,只有0.2 m(表 1),且水体较混浊,SS浓度达到了25.66 mg/L,水动力扰动容易引起岸边土壤流失和河床沉积物的再悬浮. 周边农田土壤细菌和沉积物细菌易被带到水体中,从而形成较大的丰富度[38]. 而岱海水体由于咸化加剧,大量不耐盐的细菌可能由于不能适应环境变化导致逐步消亡,从而导致较低的多样性. 这与以往咸水湖细菌多样性较低的报道一致[39].
弓坝河R01采样点,水中检测出大量的髌骨菌门细菌,可能与河流周边盐碱土壤流失有关. 孙建平等[40]在研究盐地碱蓬根际土壤细菌群落时,也检测出髌骨菌门的存在. 而岱海水体中细菌群落中的最优势菌为放线菌,其次为拟杆菌和变形菌. 寇文伯等[41]在研究鄱阳湖细菌群落时,也发现以上3种细菌门是浮游细菌中的优势菌群. 放线菌门相对丰度占岱海湖水细菌群落的80 % 以上,在放线菌门中发现大量的微球菌亚目(Micrococcales)和红球菌属(Rhodoluna). Hamedi等[42]研究发现,微球菌亚目中含有多种嗜盐菌,并且红球菌属也属于嗜盐菌. 这说明岱海水体的逐步咸化过程中,选择性地保留或进化出了适宜咸水环境的特殊细菌类群. 这些类群细菌的生长繁盛,是对岱海近几十年来水体咸化的一种响应.
3.1.2 湖泊与沉积物细菌群落组成之间的差异本研究发现岱海沉积物细菌的多样性显著高于岱海水体(图 3). 寇文伯等[41]在研究鄱阳湖水体浮游细菌和沉积物细菌时也得到了类似结论. Beier等[43]采用温度梯度凝胶电泳和16S rRNA基因序列分析技术研究细菌群落时,发现沉积物与水体中细菌群落结构差异显著,并且沉积物中的细菌丰度比水体中高约4个数量级. 沉积物细菌群落多样性高的原因可能与其环境异质性更高有关,并且沉积物中氮磷营养盐及有机质含量更高,不同沉积层溶解氧的水平变化大,有利于不同生理类型细菌占据相应的生态位.
本研究发现变形菌门(Proteobacteria)是岱海沉积物中的优势细菌门类. 在中国的五大湖区中[44],位于云贵高原湖区的程海[45]、东部平原湖区的鄱阳湖[46]、东北平原与山地湖区的五大连池[47]、蒙新高原湖区的艾比湖[48]以及青藏高原湖区的青海湖[49],变形菌门均是其沉积物细菌群落中的优势细菌. 张晓军等[50]采用高通量测序技术研究乌梁素海小口湖区沉积物细菌群落时也发现变形菌门占主要部分. 王鹏等[51]在对西太平洋深海沉积物的细菌群落进行研究时也发现了变形菌门占优势. 戴欣等[52]在研究南海南沙海区沉积物时也发现了细菌群落中高丰度的变形菌门. 现有的研究均说明变形菌门,尤其是γ-变形菌纲,是海洋和湖泊沉积物细菌群落的重要组成部分.
3.2 环境因子对细菌群落的影响 3.2.1 环境因子对水体细菌群落结构的影响本研究发现电导率是影响岱海河湖水体细菌群落结构差异的重要因子,可单独解释细菌群落结构差异的46.4 % (Adj. R2=0.464). 水体中溶解的大部分盐分为强电解质,在水中能电离成离子的形式,离子对电导有贡献作用,因此电导率和盐度之间存在正相关的关系[53],本研究中,Pearson相关性分析结果显示电导率与TDS之间存在极显著的正相关关系(r=0.99, P < 0.001),表明盐度对细菌群落结构有重要影响. 而岱海湖水细菌群落中大量嗜盐细菌(如微球菌亚目和红球菌属细菌)的发现,也印证了在全球尺度上盐度是细菌群落结构的主导因子的结论[54].
水体中盐度的增加,常伴随着营养盐浓度的增加. 氮元素是岱海富营养化的主要限制因子[55]. 当水体中氮元素浓度超过0.55 mg/L,磷元素浓度超过0.055 mg/L时,水体即发生富营养化[56],而岱海水体TN浓度在4.4 mg/L左右,TP浓度在0.11 mg/L左右,高于上述范围,说明岱海处于富营养化状态. 氮磷营养物质是细菌生长繁殖的物质基础. RDA分析结果显示TDN是岱海水体中细菌群落差异的主导因子之一. 蓝藻(Cyanobacteria,又名蓝细菌)易受到氮磷元素的影响[57],本研究中虽然岱海水体由于盐度较高,抑制了蓝藻的生长,但它也是水体细菌群落中重要组成部分,所占比例最高可达3.3 %.
3.2.2 环境因子对岱海沉积物细菌群落结构的影响本研究显示岱海沉积物细菌群落随着深度的增加而呈现一定的变化规律,表层沉积物和深层沉积物的优势细菌门类差异较大. RDA结果表明深度是主要影响因子之一. 深度主要影响沉积物中氧含量以及扰动所能到达的范围[58]. 随着深度的增加,氧含量减少,而氧含量影响细菌群落代谢速率[58]. 随着深度的增加,岱海沉积物中绿弯菌门的相对丰度明显增高. 研究表明,绿弯菌门细菌多为兼性厌氧生物,广泛分布在缺氧沉积物中,可参与到碳循环、氮循环和硫循环中[59]. 在目水平到属水平上,岱海表层沉积物中的优势菌包括硫杆菌属(Thiobacillus)和盐碱厌氧菌目(Natranaerobiales). 硫杆菌属在厌氧条件下以硫化物作为电子供体,以NO3-作为电子受体,通过自养反硝化作用,可以有效地进行脱氮脱硫作用[60]. 岱海水体盐碱化程度较高,因而适合具有嗜盐特性的盐碱厌氧菌目的生长. 深度27~28 cm为底层沉积物(S28,对应的沉积年代为1990年左右),底层沉积物中螺杆菌科(Helicobacteraceae)为优势菌科. 1990年左右,岱海鱼类养殖业在政府的鼓励下积极发展[61],鱼类等水生动物每天通过代谢作用排出大量粪便,粪便上可滋生大量的螺杆菌,并可通过沉积作用保留在沉积柱中[62]. 因此,通过研究不同深度沉积物细菌群落组成,可以间接反映不同年代人类活动对于岱海的影响.
根据RDA分析的结果,Xlf与沉积物细菌群落也存在显著的相关性. 当趋磁细菌死亡时,其体内的磁小体会保存在土壤环境中,从而使环境中的磁化率增高[63]. 大多数的趋磁细菌都是微厌氧菌,适合生长于无氧和有氧的过渡区[64]. 本研究的沉积物深度在10~20 cm范围时,磁化率较大,推测此区域含有较多趋磁细菌. 通过物种组成分析可知,当沉积物深度超过9 cm后,样品中检测出较多的弯曲菌(Campylobacteria). 刘光明等在研究弯曲菌捕获的技术上,使用了磁捕获—荧光PCR检测技术,发现磁捕获能够有效吸引弯曲菌[65],从而证明这是一种趋磁细菌. 张博等[63]在研究黄土高原和周边土壤时发现,磁化率与有机碳存在正相关的关系,且有机碳丰富的环境更适合细菌群落的生长. 本研究中,TOC也是沉积物细菌群落结构差异的主导因子之一. 人类活动是影响TOC的重要因素[66]. 岱海沉积物的TOC含量自1990年以来(对应27~28 cm处的样品S28)有明显的上升趋势,至采样时的2018年时,TOC的百分含量增加了约1倍,说明人类活动导致沉积物中有机质的升高显著影响沉积物中细菌群落组成.
综上所述,岱海水体及不同深度沉积物细菌多样性及群落特征,是近几十年来这一地区气候变化和人类活动共同作用的结果. 一方面,气候变化主导的岱海湖水咸化导致湖水细菌多样性减小,群落结构向适应咸水环境方向演替,最终导致河湖细菌群落差异增大;另一方面,人类活动导致的沉积物中营养盐及有机质的增加,也通过不同深度沉积物中细菌群落结构的变化得以体现.
4 结论1) 细菌多样性方面,岱海沉积物>入湖河流>湖泊水体;细菌群落组成方面:岱海入湖河流细菌群落以髌骨细菌门和变形细菌门为优势类群,湖水中以放线菌门为绝对优势类群(相对丰度超过80 %),沉积物中主要优势细菌类群为变形菌门和绿弯菌门.
2) 电导率和悬浮物浓度是岱海河湖细菌群落结构差异的主导因子,而深度、磁化率和有机碳含量是岱海不同深度沉积物细菌群落差异的主导因子.
致谢: 感谢中国科学院南京地理与湖泊研究所田伟、瞿猛、李冬、孙伟伟、倪振宇等在野外采样及室内理化参数测定中的帮助.
| [1] |
Pernthaler J. Competition and niche separation of pelagic bacteria in freshwater habitats. Environmental Microbiology, 2017, 19(6): 2133-2150. DOI:10.1111/1462-2920.13742 |
| [2] |
Cole JJ, Pace ML, Carpenter SR et al. Persistence of net heterotrophy in lakes during nutrient addition and food web manipulations. Limnology and Oceanography, 2000, 45(8): 1718-1730. DOI:10.4319/lo.2000.45.8.1718 |
| [3] |
Ren LJ, He D, Xing P et al. Bacterial diversity and ecological function in lake water bodies. Biodiversity Science, 2014, 21(4): 421-432. DOI:10.3724/sp.j.1003.2013.12052 |
| [4] |
Newton RJ, Jones SE, Eiler A et al. A guide to the natural history of freshwater lake bacteria. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14-49. DOI:10.1128/MMBR.00028-10 |
| [5] |
Song HN, Du BH, Zhang MY et al. Effect of environmental factors on bacterial community in Lake Dongping sediment. Acta Microbiologica Sinica, 2010, 50(8): 1065-1071. [宋洪宁, 杜秉海, 张明岩等. 环境因素对东平湖沉积物细菌群落结构的影响. 微生物学报, 2010, 50(8): 1065-1071.] |
| [6] |
Roguet A, Laigle GS, Therial C et al. Neutral community model explains the bacterial community assembly in freshwater lakes. FEMS Microbiology Ecology, 2015, 91(11). DOI:10.1093/femsec/fiv125 |
| [7] |
Zhao XQ, Yang LY, Yin DQ et al. Vertical distribution of physicochemical characteristics and the microbial diversity in different spatial sediments samples in Lake Taihu. Environmental Science, 2008, 29(12): 3537-3545. DOI:10.3321/j.issn:0250-3301.2008.12.041 |
| [8] |
Ospina-Alvarez N, Caetano M, Vale C et al. Exchange of nutrients across the sediment-water interface in intertidal ria systems (SW Europe). Journal of Sea Research, 2014, 85: 349-358. DOI:10.1016/j.seares.2013.07.002 |
| [9] |
Chen J. Research on lake water environment and its evolution in arid areas[Dissertation]. Xi'an: Chang'an University, 2017. [陈洁. 旱区湖泊水环境及其演化研究[学位论文]. 西安: 长安大学, 2017. ]
|
| [10] |
Izhitskiy AS, Zavialov PO, Sapozhnikov PV et al. Present state of the Aral Sea: Diverging physical and biological characteristics of the residual basins. Scientific Reports, 2016, 6: 23906. DOI:10.1038/srep23906 |
| [11] |
Zhao WY, Yang J, Dong HL et al. Microbial diversity in the hypersaline Dabuxun Lake in Qaidam Basin, China. Earth and Environment, 2013, 41(4): 398-405. [赵婉雨, 杨渐, 董海良等. 柴达木盆地达布逊盐湖微生物多样性研究. 地球与环境, 2013, 41(4): 398-405.] |
| [12] |
Simachew A, Lanzén A, Gessesse A et al. Prokaryotic community diversity along an increasing salt gradient in a soda ash concentration pond. Microbial Ecology, 2016, 71(2): 326-338. DOI:10.1007/s00248-015-0675-7 |
| [13] |
Oren A. Microbial life at high salt concentrations: Phylogenetic and metabolic diversity. Saline Systems, 2008, 4: 2. DOI:10.1186/1746-1448-4-2 |
| [14] |
Du ZH, Liu HT, Peng BC et al. Survey of sea water quality in Daihai, Inner Mongolia. Water Resources and Fisheries, 1999, 20(2): 44-45. [杜昭宏, 刘海涛, 彭本初等. 内蒙古岱海水质调查. 水利渔业, 1999, 20(2): 44-45.] |
| [15] |
Yun MR, Yan SR, Gong JX. Analysis of Daihai Reservoir runoff. Inner Mongolia Water Resources, 2019(5): 21-22. [云美荣, 闫双荣, 巩建新. 岱海入库径流量分析. 内蒙古水利, 2019(5): 21-22.] |
| [16] |
Liu XL. Dynamic changes in the area and water level of Daihai Lake and its driving force analysis[Dissertation]. Hohhot: Inner Mongolia University, 2019. [刘旭隆. 岱海湖泊面积与水位动态变化及其驱动力分析[学位论文]. 呼和浩特: 内蒙古大学, 2019. ]
|
| [17] |
Zhang Z. Research on the relationship between groundwater and surface water in Daihai Basin[Dissertation]. Shijiazhuang: Hebei University of Geosciences, 2020. [张胄. 岱海流域地下水与地表水关系研究[学位论文]. 石家庄: 河北地质大学, 2020. ]
|
| [18] |
Ma JL, Liu DW, Wang J et al. Dynamic ecological water demand based on long-term ecological water consumption in Lake Daihai, 1975-2020. J Lake Sci, 2022, 34(1): 207-219. [马佳丽, 刘东伟, 王杰等. 基于长时间序列(1975-2020年)生态耗水的岱海动态生态需水分析. 湖泊科学, 2022, 34(1): 207-219. DOI:10.18307/2022.0117] |
| [19] |
Ma F, Feng JC. Effects of human activities on Daihai Lake Inner Mongolia. Journal of Minzu University of China: Natural Sciences Edition, 2017, 26(1): 77-83. [马芳, 冯金朝. 人类活动对内蒙古岱海湖影响. 中央民族大学学报: 自然科学版, 2017, 26(1): 77-83.] |
| [20] |
Wang L, Ma GF, Zhai JF et al. Evaluation and analysis of eutrophication in Daihai. Inner Mongolia Water Resources, 2013(3): 40-41. [王丽, 马桂芬, 翟俊峰等. 岱海富营养化评价与分析. 内蒙古水利, 2013(3): 40-41.] |
| [21] |
Zhao B, Cai QH, Liu RQ et al. Studies on the changes of several ecological factors during the process of water salinization in Daihai Lake, China. Acta Hydrobiologica Sinica, 2000, 24(5): 502-508. [赵斌, 蔡庆华, 刘瑞秋等. 岱海水质咸化过程中若干生态因子的变化. 水生生物学报, 2000, 24(5): 502-508.] |
| [22] |
Pang XM, Liu HM, Liu XL et al. Analysis of lake area and water level dynamic and its driving forces of Daihai Lake in recent 30 years. Journal of Inner Mongolia University: Natural Science Edition, 2021, 52(3): 311-321. [庞雪敏, 刘华民, 刘旭隆等. 近30年岱海湖泊面积动态变化及其驱动力分析. 内蒙古大学学报: 自然科学版, 2021, 52(3): 311-321. DOI:10.13484/j.nmgdxxbzk.20210313] |
| [23] |
Yang HY. Analysis of Daihai Lake water ecological environment problems and treatment measures. Inner Mongolia Water Resources, 2020(9): 33-34. [杨红艳. 岱海湖水生态环境问题与治理措施简析. 内蒙古水利, 2020(9): 33-34.] |
| [24] |
Zhou YK, Jiang JH, Huang Q et al. Analysis on water salinization process of Daihai Lake in Inner Mongolia. Journal of Arid Land Resources and Environment, 2008, 22(12): 51-55. [周云凯, 姜加虎, 黄群等. 内蒙古岱海水质咸化过程分析. 干旱区资源与环境, 2008, 22(12): 51-55.] |
| [25] |
Pang XM. Study on the changes of soil microorganisms in the process of vegetation succession in the wetland of the lakeside of Daihai Lake[Dissertation]. Hohhot: Inner Mongolia University, 2021. [庞雪敏. 岱海湖泊湖滨带湿地植被演替过程中土壤微生物的变化研究[学位论文]. 呼和浩特: 内蒙古大学, 2021. ]
|
| [26] |
Mao HF, He J, Hou DK et al. Simulated experiments on the degradation of organic matter dynamic response for microbial biomass in sediments from Lake Wuliangsuhai and Daihai, China. Journal of Agro-Environment Science, 2013, 32(1): 118-126. [毛海芳, 何江, 侯德坤等. 乌梁素海和岱海沉积物有机质降解与微生物量动态响应模拟试验研究. 农业环境科学学报, 2013, 32(1): 118-126.] |
| [27] |
Mao HF, He J, Lv CW et al. Correlation between microbial biomass and organic carbon forms in the sediments. Journal of Agro-Environment Science, 2010, 29(12): 2406-12. [毛海芳, 何江, 吕昌伟等. 沉积物中微生物量与有机碳形态的相关性研究. 农业环境科学学报, 2010, 29(12): 2406-2412.] |
| [28] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法" 及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [29] |
Jin XC, Tu QY eds. Specification for lake eutrophication investigation: 2nd edition. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范: 第2版. 北京: 中国环境科学出版社, 1990.]
|
| [30] |
Du DD, Mughal MS, Blaise D et al. Paleoclimatic changes reflected by diffuse reflectance spectroscopy since Last Glacial Maximum from Selin Co Lake sediments, central Qinghai-Tibetan Plateau. Arid Land Geography, 2019, 42(3): 551-558. [杜丁丁, Mughal MS, Blaise D等. 青藏高原中部色林错湖泊沉积物色度反映末次冰盛期以来区域古气候演化. 干旱区地理, 2019, 42(3): 551-558.] |
| [31] |
Fadrosh DW, Ma B, Gajer P et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform. Microbiome, 2014, 2(1): 6. DOI:10.1186/2049-2618-2-6 |
| [32] |
Xie GJ, Tang XM, Gong Y et al. How do planktonic particle collection methods affect bacterial diversity estimates and community composition in oligo-, meso- and eutrophic lakes?. Frontiers in Microbiology, 2020, 11: 593589. DOI:10.3389/fmicb.2020.593589 |
| [33] |
Quast C, Pruesse E, Yilmaz P et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools. Nucleic Acids Research, 2012, 41(D1): D590-D596. DOI:10.1093/nar/gks1219 |
| [34] |
Clarke KR, Gorley RN. PRIMER v7: User Manual/Tutorial. PRIMER-E: Plymouth, 2015.
|
| [35] |
Clarke KR. Non-parametric multivariate analyses of changes in community structure. Australian Journal of Ecology, 1993, 18(1): 117-143. DOI:10.1111/j.1442-9993.1993.tb00438.x |
| [36] |
Rath KM, Fierer N, Murphy DV et al. Linking bacterial community composition to soil salinity along environmental gradients. The ISME Journal, 2019, 13(3): 836-846. DOI:10.1038/s41396-018-0313-8 |
| [37] |
Hu YX, Zhang J, Huang J et al. Characteristics of bacterioplankton community between river and lake/reservoir in the Yangtze River Basin. Environmental Science, 2022, 43(3): 1414-1423. [胡愈炘, 张静, 黄杰等. 长江流域河流和湖库的浮游细菌群落差异. 环境科学, 2022, 43(3): 1414-1423. DOI:10.13227/j.hjkx.202106173] |
| [38] |
Guo L, Xing P, Jiang WW et al. Effects of sediment resuspension on bacterioplankton community composition. Environmental Science, 2010, 31(8): 1909-1917. [郭亮, 邢鹏, 蒋伟伟等. 沉积物再悬浮对浮游细菌群落结构的影响. 环境科学, 2010, 31(8): 1909-1917. DOI:10.13227/j.hjkx.2010.08.037] |
| [39] |
Li EY, Ma XL, Lv J et al. Microbial community structure and its influencing factors of different salt lakes on the northern slope of Tianshan Mountains, Xinjiang. Acta Ecologica Sinica, 2021, 41(18): 7212-7225. [李二阳, 马雪莉, 吕杰等. 新疆天山北坡不同盐湖微生物菌群结构及其影响因子. 生态学报, 2021, 41(18): 7212-7225. DOI:10.5846/stxb202010122601] |
| [40] |
Sun JP, Liu YH, Zuo YM et al. The bacterial community structure and function of Suaeda salsa rhizosphere soil. Chinese Journal of Eco-Agriculture, 2020, 28(10): 1618-1629. [孙建平, 刘雅辉, 左永梅等. 盐地碱蓬根际土壤细菌群落结构及其功能. 中国生态农业学报, 2020, 28(10): 1618-1629.] |
| [41] |
Kou WB, Huang ZY, Zhang J et al. Bacterial community structure and composition in Lake Poyang: A case study in the Songmenshan Region, China. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. [寇文伯, 黄正云, 张杰等. 鄱阳湖湖泊细菌群落组成及结构--以松门山为例. 生态学报, 2015, 35(23): 7608-7614. DOI:10.5846/stxb201405030873] |
| [42] |
Hamedi J, Mohammadipanah F, Ventosa A. Systematic and biotechnological aspects of halophilic and halotolerant actinomycetes. Extremophiles: Life Under Extreme Conditions, 2013, 17(1): 1-13. DOI:10.1007/s00792-012-0493-5 |
| [43] |
Beier S, Witzel KP, Marxsen J. Bacterial community composition in Central European running waters examined by temperature gradient gel electrophoresis and sequence analysis of 16S rRNA genes. Applied and Environmental Microbiology, 2008, 74(1): 188-199. DOI:10.1128/AEM.00327-07 |
| [44] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [45] |
Liu HC. Study on bacterial diversity of plankton and sediment in plateau lakes[Dissertation]. Guilin: Guilin University of Technology, 2020. [刘桦聪. 高原湖泊浮游、沉积物细菌多样性研究[学位论文]. 桂林: 桂林理工大学, 2020. ]
|
| [46] |
Wu L, Ge G, Gong SJ et al. Genetic diversity and composition of bacterial community in water of Poyang Lake. Research of Environmental Sciences, 2009, 22(10): 1145-1149. [吴兰, 葛刚, 龚世杰等. 鄱阳湖水体细菌群落组成及遗传多样性. 环境科学研究, 2009, 22(10): 1145-1149. DOI:10.13198/j.res.2009.10.35.wul.003] |
| [47] |
Yang MR, Xing WJ, Zhao D et al. Bacterial diversity in sediment of Yaoquan Lake. Journal of Heilongjiang Bayi Agricultural University, 2020, 32(1): 67-71, 101. [杨孟然, 邢维佳, 赵丹等. 五大连池药泉湖沉积物的细菌多样性. 黑龙江八一农垦大学学报, 2020, 32(1): 67-71, 101.] |
| [48] |
Ma Xl, Lv J, Ma Y et al. A study on the relationship between the prokaryote community structure evolution and environmental factors of Ebinur Lake. Journal of Salt Lake Research, 2020, 28(4): 79-90. [马雪莉, 吕杰, 马媛等. 艾比湖原核微生物菌群结构演变与环境因子关系分析. 盐湖研究, 2020, 28(4): 79-90. DOI:10.12119/j.yhyj.202004010] |
| [49] |
Li GQ. Using high-throughput sequencing technology to analyze the microbial diversity in the lake water of the Qinghai-Tibet Plateau[Dissertation]. Lanzhou: Lanzhou Jiaotong University, 2016. [李国强. 应用高通量测序技术分析青藏高原湖水中微生物多样性[学位论文]. 兰州: 兰州交通大学, 2016. ]
|
| [50] |
Zhang XJ, Zhao YL, Jin YD et al. Diversity and phylogenetic analysis of bacteria in sediments of Xiaokou sites in Lake Wuliangsuhai. Journal of Inner Mongolia Agricultural University: Natural Science Edition, 2011, 32(4): 206-212. [张晓军, 赵宇龙, 金一荻等. 乌梁素海小口湖区沉积物细菌多样性及其系统发育分析. 内蒙古农业大学学报: 自然科学版, 2011, 32(4): 206-212.] |
| [51] |
Wang P, Xiao X, Wang FP. Phylogeny of bacteria in deep-sea sediments from west Pacific warm pool. Journal of Tongji University: Natural Science, 2009, 37(3): 404-409. [王鹏, 肖湘, 王风平. 西太平洋暖池区深海沉积物细菌群落结构分析. 同济大学学报: 自然科学版, 2009, 37(3): 404-409.] |
| [52] |
Dai X, Zhou H, Chen YQ et al. Preliminary study on bacterial 16S rDNA diversity in sediments of the Nansha area of South China Sea. Progress in Natural Science, 2002, 12(5): 33-8. [戴欣, 周惠, 陈月琴等. 中国南海南沙海区沉积物中细菌16S rDNA多样性的初步研究. 自然科学进展, 2002, 12(5): 33-38.] |
| [53] |
Liu CL, Xu LJ, Xian XF. Study on the relationship between concentration of salt solution and its conductivity. Environmental Monitoring in China, 1999, 15(4): 21-24. [刘成伦, 徐龙君, 鲜学福. 水溶液中盐的浓度与其电导率的关系研究. 中国环境监测, 1999, 15(4): 21-24.] |
| [54] |
Lozupone CA, Knight R. Global patterns in bacterial diversity. PNAS, 2007, 104(27): 11436-11440. DOI:10.1073/pnas.0611525104 |
| [55] |
Hou DK, He J, Lv C et al. Effects of environmental factors on nutrients release at sediment-water interface and assessment of trophic status for a typical shallow lake, northwest China. The Scientific World Journal, 2013, 2013: 716342. DOI:10.1155/2013/716342 |
| [56] |
Gao XD. Research on theenvironmental geochemical characteristics of nutrient salts in Daihai Lake[Dissertation]. Hohhot: Inner Mongolia University, 2006. [高兴东. 岱海湖泊营养盐的环境地球化学特征研究[学位论文]. 呼和浩特: 内蒙古大学, 2006. ]
|
| [57] |
Sheng P, Yu YZ, Tian XJ et al. Bacterial diversities and compositions in seven different estuarine water columns of Poyang Lake. Research of Agricultural Modernization, 2016, 37(3): 606-612. [圣平, 于一尊, 田晓娟等. 鄱阳湖7个河口水体中细菌多样性和组成特征. 农业现代化研究, 2016, 37(3): 606-612. DOI:10.13872/j.1000-0275.2016.0050] |
| [58] |
Zhao DY, Sun YM, Fang C et al. Vertical distribution of bacterial community composition in sediments of Meiliang Bay in Taihu Lake. Journal of Hohai University: Natural Sciences, 2013, 41(4): 283-287. [赵大勇, 孙一萌, 方超等. 太湖梅梁湾不同深度沉积物中细菌群落结构组成. 河海大学学报: 自然科学版, 2013, 41(4): 283-287.] |
| [59] |
Xian WD, Zhang XL, Li WJ et al. Research status and prospect on bacterial phylum Chloroflexi. Acta Microbiologica Sinica, 2020, 60(9): 1801-1820. [鲜文东, 张潇橦, 李文均等. 绿弯菌的研究现状及展望. 微生物学报, 2020, 60(9): 1801-1820.] |
| [60] |
Wu X, Zhao JZ. Removal of nitrate and sulfide from wastewater by Thiobacillus denitrificans. Chinese Journal of Applied and Environmental Biology, 2013, 19(1): 175-178. [武鑫, 赵晋忠. 脱氮硫杆菌对废水中硫氮的脱除. 应用与环境生物学报, 2013, 19(1): 175-178.] |
| [61] |
Fang LQ. Wulanchabu League of Inner Mongolia decided to actively develop Daihai fishery production. China Fisheries, 1990(7): 20. [方良泉. 内蒙古乌兰察布盟决定积极发展岱海渔业生产. 中国水产, 1990(7): 20.] |
| [62] |
Yang JJ, Guan WS, Sun HF et al. Contaminants in water and liver cancers: A review of recent studies. Journal of Environment and Health, 2010, 27(11): 1030-1033. [杨建军, 关卫省, 孙海凤等. 水体污染物致肝癌发生因素及其作用机制研究进展. 环境与健康杂志, 2010, 27(11): 1030-1033.] |
| [63] |
Zhang B, Liu WG. Impact of soil organic matter on modern soil magnetic susceptibility in Loess Plateau and its surrounding areas. Journal of Earth Environment, 2016, 7(2): 153-162. [张博, 刘卫国. 黄土高原及周边地区土壤有机质对现代土壤磁化率的影响. 地球环境学报, 2016, 7(2): 153-162. DOI:10.7515/JEE201602005] |
| [64] |
Fan GC, Li RS, Li XG et al. Research on the distribution of magnetotactic bacteria and their magnetosomes in my country. Chinese Science Bulletin, 1996, 41(4): 349-352. [范国昌, 李荣森, 李小刚等. 我国趋磁细菌的分布及其磁小体的研究. 科学通报, 1996, 41(4): 349-352.] |
| [65] |
Liu GM, Fang YW, Chen WL et al. Magnetic capture-fluorescence PCR detection technology of Campylobacter jejuni. Inspection and Quarantine Science, 2004, 14(S1): 16-21. [刘光明, 方元炜, 陈伟玲等. 空肠弯曲菌的磁捕获-荧光PCR检测技术研究. 检验检疫科学, 2004, 14(S1): 16-21.] |
| [66] |
Yang Y, Liu QG, Hu ZJ et al. Spatial distribution of sediment carbon, nitrogen and phosphorus and pollution evaluation of sediment in Taihu Lake Basin. Acta Scientiae Circumstantiae, 2014, 34(12): 3057-3064. [杨洋, 刘其根, 胡忠军等. 太湖流域沉积物碳氮磷分布与污染评价. 环境科学学报, 2014, 34(12): 3057-3064. DOI:10.13671/j.hjkxxb.2014.0710] |
 2022, Vol. 34
2022, Vol. 34 

