(2: 内蒙古自治区水资源保护与利用重点实验室,呼和浩特 010018)
(2: Water Resources Protection and Utilization Key Laboratory, Inner Mongolia Agricultural University, Hohhot 010018, P.R.China)
溶解氧作为淡水生态系统及水环境生物地球化学过程中的关键影响因子,是维持水体生态环境动态平衡的重要指标[1]. 北半球湖泊中,有近半数的湖泊会受气候的影响发生冻结现象[2],冰封后冰盖下的水体处于一个相对稳定且封闭的环境中,冰下水体溶解氧的变化在很大程度上可以反映出湖泊生态系统的水质水平[3]. 据调查显示,水体中溶解氧浓度低于5 mg/L时,鱼类等水生生物的生理活动就会受到抑制[4]; 当溶解氧浓度低于2 mg/L时,会加速水体营养物质的厌氧分解,释放过量的氮、磷元素,导致水体的富营养化[5]. 如果这种缺氧状况发生在冰封期的水体中,那么次年当湖冰融化后,湖泊便会处于一个水质状况相对较差的初始状态. 此外,水体溶解氧被消耗后的恢复速度可以用来判断水体的自净能力,如果恢复速度快,则说明水体的自净能力强,反之说明自净能力弱; 如果水体被严重污染,甚至会丧失自净能力[6].
在天然水体中,溶解氧处在一个不断消耗与补充的动态平衡过程. 由于冰层将水体与大气隔离,切断了空气与水体之间的气体交换,而且冰层对阳光的反射与吸收加上封冻季节太阳辐射的衰弱以及日照周期缩短等因素,都会对产氧的初级生产活动产生负面影响. 相反,浮游生物的呼吸与需氧微生物对水体及底泥中有机物的好氧分解不断消耗氧气,并且随着水体深度的增加,这些反应会更加剧烈[7]. 因此,产氧强度与耗氧强度的平衡关系决定着冰下溶解氧浓度的变化,进一步影响着水生态环境的动态平衡和湖泊食物网结构中各项生物活动能否正常进行. 所以了解冰下水体溶解氧的动态变化过程是必要的,而且为了明确导致其缺氧的原因并及时判断湖泊的健康状况均需要进一步分析溶解氧变化的驱动力.
目前国内关于溶解氧动力学的研究为数甚少,而国外大部分研究也仅针对于非冰封期的水体. Xu等[8]开发过一种高频率溶解氧的确定性模型,通过量化驱动溶解氧变化的作用力,对Baton Rouge的一个无冰封期浅水湖泊进行了溶解氧的模拟预测. Long等[9]在Virginia及Bermuda两处浅海通过测量水体的生产和消耗以及跨大气-水和底栖水边界的通量,模拟了水生态环境氧气的质量平衡. 对于冬季的冰下水体,驱动溶解氧变化的外在环境因素会相对更少[7],因为气候的多变及严酷的环境等问题反而加大了冬季溶解氧研究的难度,但并不会对溶解氧的变化机理产生较大改变. 白乙拉等[10]对Valken-Kotinen湖冰盖下的溶解氧实测数据采用数学方法优化辨识和数据拟合,获得了一套描述结冰湖冰下溶解氧时空分布规律的正态分布数值模型. Malve等[11]将Tuusulanjärvi湖冬季的呼吸模拟为湖泊氧气的总消耗,采用贝叶斯方法估计湖泊呼吸的长期演化并预测湖泊未来的氧气状况. 而更多的冰封期研究都集中于计算湖泊的初级生产力方面,极少数研究能够整体上对驱动湖泊冰下水体溶解氧变化的产耗氧因素分别进行量化分析,从机理上明确溶解氧亏耗或饱和的原因及程度. 因此研究团队于内蒙古的乌梁素海,在冬季湖冰生长及稳定期的一个多月时间里,高频率地测量了包括溶解氧在内的水质指标. 通过对数据的预处理,在溶解氧曲线复杂的日变化模式下,利用曲线不同时间的变化特征结合实际的天文气象资料,实现对溶解氧变化内在机理的模拟分析,清晰地了解到冬季湖泊冰下水体动态变化趋势,并从溶解氧驱动因素的角度分析其变化的原因.
本研究的目的并不是开发一种复杂的确定性模型,而是计划通过对溶解氧来源及消耗的定量分析,摸清湖泊冰下溶解氧平衡的内在机理,为更多会经历冰封期的可封冻湖提供一种冰下溶解氧模拟分析的方法,并能够对冬季湖泊溶解氧的动态变化及其驱动因素产生新的认识.
1 材料与方法 1.1 研究区概况研究区整体位于内蒙古巴彦淖尔市的乌梁素海(40°36′~41°03′N,108°43′~108°57′E),地处河套平原的东侧,南接黄河,北临狼山,是全球荒漠半荒漠地区极为罕见的具有生物多样性和环保功能的大型草原湖泊. 乌梁素海湖泊面积为293 km2,明水区面积仅占约1/3,湖岸线周长约130 km,平均水深为1.8 m,是河套灌区的重要组成部分,也是连通河套灌区和黄河的关键纽带. 其补给水源主要是河套灌区的农田退水,占总补水量的80%左右,其次为工业废水、生活污水及周边山区洪水[12]. 乌梁素海属于温带大陆性季风气候,年日照时数2900~3200 h,年平均气温为5.6~7.4℃,极端高温达37.7℃,极端低温达-41℃,年平均降水量224.2 mm,积雪深度一般不超过10 cm,降雪天数不超过7天. 作为寒旱区湖泊的乌梁素海每年都会有为期3~4个月的冰封期,由于整体水深较浅,所以湖泊冰厚普遍超过了水深的1/3.
研究从1月21日-2月26日共计37天,期间的最高气温为10.3℃,最低气温为-19.1℃,平均气温为-2.3℃. 在研究期实测乌梁素海明水区的冰层厚度在42~56 cm之间,实测水深在0.72~2.40 m之间,冰厚由北向南逐渐递减,水深逐渐递增. 在研究期内基本无降雪发生,唯一一次降雪发生在1月24日,但积雪深度仅为0.37 mm.
1.2 数据的获取在2021年1月将一台水质在线监测浮漂布设于乌梁素海的湖中心L15点(40°58′N,108°55′E),监测点位于远离入湖口及出湖口的一侧,因而受水体横向输送的影响较小,如图 1所示. 通过浮漂上的Yosemite Y4000水质多参数传感器收集到包括水温、溶解氧、浊度及叶绿素a(Chl.a)等在内的水质数据,然后利用YDOC GSM数据采集器传输至EMMI系统中. 传感器位于初始冰底以下0.7 m处(L15点实测冰厚0.48 m,水深1.49 m),监测频率为每小时1次,收集到1月21日-2月26日共计865 h的水质数据. 传感器在进行监测之前于实验室内进行了标定校准,并通过自清洁电刷进行定时清理,保证数据的可靠性. 此外,研究采用的气象数据(日照、日出和日落等)来源于国家气象科学数据中心及挪威Time and Date AS. 通过将不同方法收集到的气象资料进行相互验证,然后利用日出与日落时间校核光照周期时长,并率定光照期的计算结果,保证研究期内的气象数据质量.
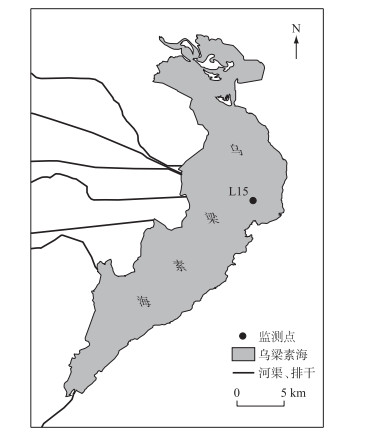
|
图 1 研究区乌梁素海及监测点位置 Fig.1 The location of Lake Wuliangsuhai and monitoring site |
虽然通过水质多参数高频传感器可以测量包括溶解氧在内的连续水质指标,但是由于湖泊冰下水体的时空动态变化以及水生动植物、微生物的干扰,获得的水质数据难免包含随机性与不确定性的噪声,即使定期清洗与校准传感器也无法避免数据噪声的产生[13]. 此外,一些偶然性的系统误差及人为误差等,也都会导致数据产生噪声污染. 因此,需要对原始数据进行降噪处理.
本研究中采用小波变换(WAT)对溶解氧数据进行降噪处理. 对于长时间序列的数据,这种数学技术可以有效减少噪声,并保持数据的时序性、连续性及可靠性[14]. 小波变换是一种多分辨率信号的分析方法,其将多尺度分析信号经过放大及平移后,可以更有效地提取信号的时频特征[15]. 其变换原理如下:
| $ W T(a, \tau)=\frac{1}{\sqrt{a}} \int\limits_{-\infty}^{\infty} f(t) \cdot \psi\left(\frac{t-\tau}{a}\right) \mathrm{d} t $ | (1) |
在公式中的小波变换包含两个变量:尺度a及平移量τ,其中尺度a控制小波函数的伸缩,平移量τ控制小波函数的平移. 进行小波降噪处理时包括3个步骤:1)将原始信号进行小波分解; 2)设置相应的去噪规则,实现小波域中噪声与有用信号的分离; 3)最后进行小波重构,以达到净化信号的目的[16]. 其流程如图 2所示.
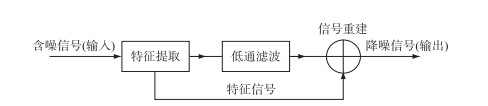
|
图 2 小波降噪流程 Fig.2 Wavelet denoising process |
在小波变换过程中需要根据变量特征选择合适的小波函数对含噪数据进行分解. 常用的小波函数包括:紧支集的正交小波Daubechies(dbN)小波与Symlet(symN)小波,对称性更好的Coiflet(coifN)小波以及双正交小波Biorthogonal(biorNr.Nd)小波. 在研究中,根据前人的探索[13, 17]并对数据的预处理后,确定了Daubechies小波、Symlet小波、Coiflet小波的消失矩阶数(N)分别为db8、sym7、coif5,双正交Biorthogonal小波的分解和重构阶数(Nr.Nd)为bior6.8. 将4种小波函数应用于溶解氧数据的降噪处理中,采用4级分解,以第1层至第4层的高频系数与第4层的低频系数进行小波重构. 此外,为了使小波系数在小波阈中光滑,利用软阈值进行处理,并通过启发式阈值(Heuristic SURE)利用启发函数在固定阈值(Sqtwolong)与Stein无偏风险阈值(Rigorous SURE)中选择最优预测变量阈值来作降噪处理[18].
2.1.2 溶解氧降噪效果评价经过降噪处理后可以通过比较降噪结果的信噪比(SNR)及含噪信号与降噪信号间的均方根误差(RMSE)、平均绝对误差(MAE)来确定最优的降噪效果[13-14, 18]. 一般降噪结果的SNR越大,RMSE与MAE越小代表的降噪效果越好. 其计算公式如下:
| $ S N R=10 \lg \left(\frac{\sum\limits_{j=1}^N x^2(j)}{\sum\limits_{j=1}^N[x(j)-\hat{x}(j)]^2}\right) $ | (2) |
| $R M S E=\sqrt{\frac{1}{N} \sum\limits_{j=1}^N[x(j)-\hat{x}(j)]^2} $ | (3) |
| $ M A E=\frac{1}{N} \sum\limits_{j=1}^N|x(j)-\hat{x}(j)| $ | (4) |
式中,x(j)为原始信号数据在j点的幅度值,
冰封期,冰盖阻隔了水体与大气间的氧气交换[19],加之溶解氧的空间变化并不显著,因此将O'Connor与Di Toro[20]提出的水体溶解氧质量平衡方程改进后用以下方程描述:
| $\mathrm{d} C_{\mathrm{O}_2}(t) / \mathrm{d} t=P(t)-R d o c $ | (5) |
式中,
此外,由于研究区湖泊冰下水体深度较浅,水体受到光驱动而发生对流混合,所以水体纵向浓度空间变异性较低[23]. 加之模拟方法仅存在时间维度上的变异性,因此研究中假定了水柱垂向混合均匀.
2.2.1 产氧模式的构建在湖泊的冰封期,冰下水体的光合作用与穿透冰层的辐射强度、水温等环境因素有关[2],目前的研究都很难通过这些因素确定光合作用的产氧速率. 因此,在研究中采用Delta方法,将光合速率视为以时间为自变量的函数,白天为半正弦函数、夜间为零,即[24]:
| $P(t)=P_{\max } \cdot \sin \left(\frac{\pi t}{f}\right), 0 \leqslant t \leqslant f $ | (6) |
| $P(t)=0, f \leqslant t \leqslant \tau $ | (7) |
同样可以利用Pmax计算出光合作用速率的平均值:
| $ P_{\mathrm{av}}=P_{\max }\left(\frac{2 f}{\pi \tau}\right) $ | (8) |
式中,Pmax为光合作用最大的产氧速率,mg/(L ·d); Pav为光合作用的日平均产氧速率,mg/(L ·d); f为光照期的时长,h; τ昼夜交替的周期时长(24 h),这种时间关系假设了0时对应着日出时间.
光合作用最大的产氧速率Pmax,可以利用极值法(EVM)计算得出. EVM适用于最大氧亏值发生时间在夜间时的水体,通过利用白天溶解氧在极值点的平衡性,有效地估算出光合作用的速率[25]. 所以在白天,f≤t≤τ,当溶解氧浓度达到最大值时即氧亏值最小(Dmin),不考虑大气复氧作用并将耗氧作用定义为Rdoc时,溶解氧平衡方程可描述为:
| $ P\left(t_{\min D}\right)=R d o c_{\mathrm{av}} $ | (9) |
光合作用速率最大值Pmax通过式(6)计算:
| $ P_{\max }=\frac{P\left(t_{\min D}\right)}{\sin \left(\pi t_{\min D} / f\right)} $ | (10) |
式中,P(tmin D)为溶解氧最小氧亏发生时(tmin D)的光合作用产氧速率,mg/(L ·d); Rdocav为水体耗氧作用的日平均耗氧速率,mg/(L ·d); tmin D为溶解氧最小氧亏发生的时间,计算为:
| $t_{\min D}=\Delta t+0.5 f $ | (11) |
式中,t为溶解氧的氧亏最小值发生时间与太阳正午时间的差值,h; 0.5f即为太阳自日出到达正午的时长,h.
产氧计算中的溶解氧动力学常用参数如图 3所示,在一个昼夜循环中,溶解氧的浓度在白天因光合作用增加,在夜晚又因有机物耗氧作用及呼吸作用等下降. 在最小氧亏点Dmin之后,溶解氧浓度由盈转亏; 在最大氧亏点Dmax之后,溶解氧浓度由亏转盈,而且在这两个极值点时,溶解氧浓度的变化率为0 mg/(L ·h),且产氧速率等于耗氧速率[26].
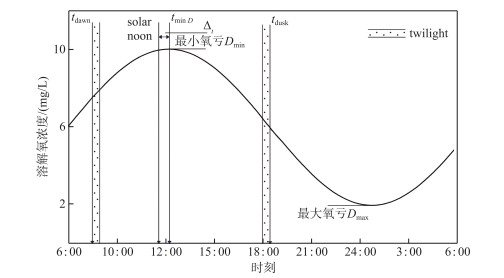
|
图 3 昼夜间的溶解氧动力学及气象学基本参数 Fig.3 Basic parameters of dissolved oxygen kinetics and meteorology in day and night |
研究者们进行一般的初级生产力分析中对夜间的呼吸作用耗氧速率计算时,会将溶解氧的衰减速率认为是湖泊呼吸作用的耗氧速率[27-28],并通过夜间的呼吸测量值来估计白天的呼吸量[29-31]. 在冰封期湖泊的夜间,当光合产氧作用在无光照下停止时,本研究同样采用这种方法计算冰下水体的整体耗氧速率,可以描述为:
| $ \overline{R d o c}_{\text {night }}=\frac{1}{\triangle t_{\text {night }}} \int\limits_{{t_{\text{s}, {\rm{ night }}}}}^{{t_{{\rm{e}}, {\rm{ night }}}}} {} \frac{{{{\rm{d}}_{{{\rm{O}}_2}}}(t)}}{{{\rm{d}}t}} \cdot {\rm{d}}t $ | (12) |
| $ R d o c_{\mathrm{av}}=\overline{R d o c}_{\text {night }} \times 24 $ | (13) |
式中,△tnight为夜间的时长,h,一般通过黄昏时间(tdusk)与黎明时间(tdawn)来确定夜间时长,即ts, night=tdusk+ △tnight和te, night=tdawn-△tnight; CO2(t)为t时刻的溶解氧浓度,mg/(L ·h); Rdocnight为夜间呼吸作用的平均耗氧速率,mg/(L ·h). 在计算过程中,将黄昏时间确定为日落后的第一个整点,将黎明时间确定为日出前的第一个整点,以确保湖泊完全处于夜晚黑暗的条件下且不受光合作用对溶解氧变化的影响.
通过日平均耗氧速率与光合作用速率间建立的联系可以使实测溶解氧数据参与模拟分析中,并利用式(5)的溶解氧质量平衡方程计算任意时刻i的呼吸作用耗氧速率为:
| $ \text { 白天: } R d o c_{i, \text { daylime }}=C_{{{{\rm{O}}_2}}}(i-1)-C_{{{{\rm{O}}_2}}}(i)+P(i) $ | (14) |
| $ \text { 夜间: } R d o c_{i, \text { night }}=C_{{{{\rm{O}}_2}}}(i-1)-C_{{{{\rm{O}}_2}}}(i) $ | (15) |
式中,CO2(i)为第i时的溶解氧浓度,mg/(L ·h); CO2(i-1)为第i-1时的溶解氧浓度,mg/(L ·h).
本研究考虑以曙暮光(twilight)的开始与结束来定义昼夜间的黎明(tdawn)与黄昏(tdusk),如图 3所示,进而确定了光照周期这一关键变量. 通常天文曙暮光即太阳中心高度维持在地平线下12°~18°之间时,在曙光之前及暮光之后均代表着天空已经达到充分的黑暗[32]. 张自国等[33]认为这种通过“光照时间”代替“日照时间”划分光周期的“光期”与“暗期”来进行光合作用的计算相较来说更为确切. 另外,在近地层气溶胶光学厚度的变化,会对散射光的颜色指数产生明显改变[34],尤其当光线变得微弱时,这种作用越加明显,因此曙暮光对喜好不同颜色光强的初级生产者的作用至关重要.
3 结果及分析 3.1 小波降噪结果通过应用4种小波变换函数(db8、sym7、coif5和bior6.8)对溶解氧数据进行降噪处理,计算对比各个方法降噪结果的SNR、RSME与MAE,确定最佳降噪效果的小波函数(表 1). sym7小波函数的SNR最大且RMSE及MAE最小,因此可以确定对溶解氧降噪最优的小波函数为sym7,其小波分解及降噪结果如图 4所示. 并将其应用于溶解氧的平衡模拟分析中.
| 表 1 不同小波函数降噪效果对比 Tab. 1 Comparison of noise reduction effects of different wavelet functions |
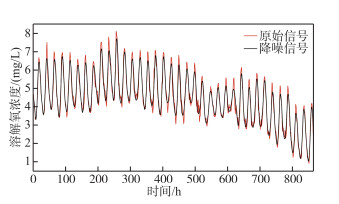
|
图 4 原始信号与降噪信号的对比 Fig.4 Contrast of original signal with denoising signal |
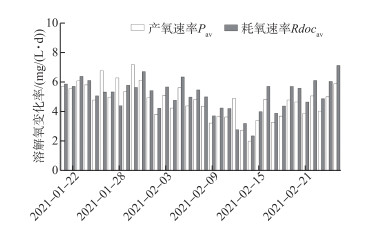
通过模拟计算驱动溶解氧变化的产氧速率与耗氧速率,如图 5所示. 在研究期间浮游植物光合产氧速率基本低于水体耗氧速率,只有在1月26日、28日、30日及2月12日出现了相反的情况. 光合作用速率的日均最大值与最小值分别为7.19和2.01 mg/(L ·d),分别出现于1月30日及2月14日; 水体耗氧作用速率的日均最大值与最小值分别为7.13和2.37 mg/(L ·d),分别出现于2月14日及2月25日. 整体上,溶解氧的变化率并未出现规律性的变化,但进一步观察发现浮游植物光合作用与水体耗氧作用速率的变化普遍具有相关性. 因此可以猜测,湖泊的冰生长及稳定期内冰下水体的光合作用与耗氧作用可能受部分相同的环境因素影响. 此外,研究期间出现了四日的日产氧速率高于耗氧速率的情况,而与整体上溶解氧负增长的变化趋势相悖,可以猜测在冰下水体中有可能出现了外源性的氧气输入,而冰面破裂后大气与水界面的气体交换很容易使水体溶解氧在短时间内上升. 导致冰面破裂的原因一方面是人为活动的因素,另外就是冰面上形成的活动冰脊(或冰裂缝)同样会使冰盖破裂,水面与空气接触,冰下高氧饱和值而低溶氧浓度的水体通过强烈的气体交换作用使溶解氧浓度迅速上升.
|
图 5 产氧作用与耗氧作用的日平均变化速率 Fig.5 Daily mean rate of change of oxygen production and oxygen consumption |
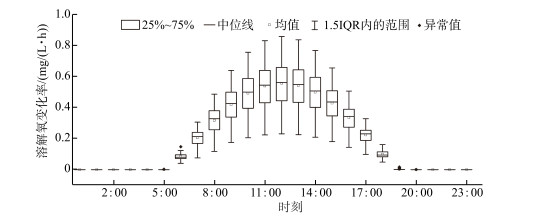
为了深入探讨单日内溶解氧驱动因素的变化率,对浮游植物光合作用速率及水体耗氧作用速率的24 h变化率进行箱形图分析,如图 6、7所示. 浮游植物的光合作用整体上呈现出“日出而作,日落而息”的变化趋势. 从每日的6:00开始,光合作用速率产生明显地上升趋势,并随着时间的推移,在12:00达到光合作用速率的峰值点,光合作用速率的均值由0.08 mg/(L ·h)增长至0.55 mg/(L ·h). 随后,产氧速率开始下降,基本于19:00左右停止进行光合作用,光合作用速率的均值也下降至2.40×10-3 mg/(L ·h),之后基本维持在0 mg/(L ·h)的变化速率直至次日的黎明. 单位时间产氧速率的分布普遍呈现出近似标准的正态分布,只在黎明及黄昏时段前后表现出了部分偏态性,并且仅包含了少量的异常值,整体的变化规律基本一致. 此外,随着单位时间的产氧速率越大,其分布的离散程度也变得越高.
|
图 6 产氧速率的24 h变化箱型图 Fig.6 Twenty-four-hour box diagram of oxygen production rate |
|
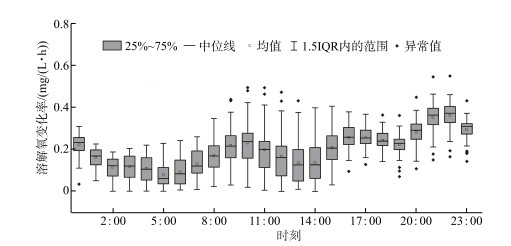
图 7 耗氧速率的24 h变化箱型图 Fig.7 Twenty-four-hour box diagram of oxygen consumption rate |
与光合作用规律性的变化趋势不同,水体耗氧作用的变化趋势则显得“杂乱无章”. 具体分析,耗氧作用速率的最大均值为0.36 mg/(L ·h),出现在22:00;最小均值为0.08 mg/(L ·h),出现在5:00. 除此之外,研究期内还分别出现了两个极大值与极小值. 与浮游植物光合作用的单位时间速率相比,水体耗氧作用的分布偏态性则更强,因此也出现了较多的异常值. 在白天9:00—12:00,于较大值一侧出现较多的异常值,分布呈右偏态,在夜间19:00—23:00,于较小值一侧出现较多的异常值,分布呈左偏态,但整体上异常值数量的占比均未超过12%,可以认为模拟结果的整体变化规律比较一致. 此外,水体耗氧作用的速率在白天的离散程度普遍较夜间的高,但夜间箱形图的异常值更多则表明其尾部更重且自由度更小.
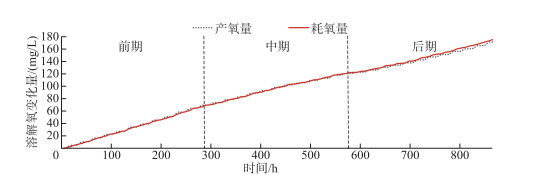
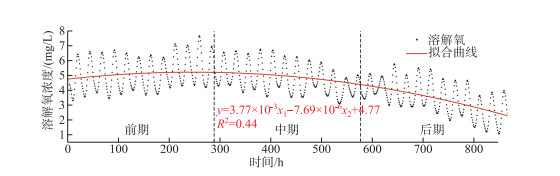
通过浮游植物光合作用与水体耗氧作用的产耗氧量累积变化曲线可以更清晰地反映出二者的变化过程(图 8). 将累积曲线按观测期的时长分为3个阶段,累积曲线的斜率即溶解氧单位时间的变化,由此可知二者的变化率在前中期基本保持一致. 但是在后期(约576 h后即2月13日后),浮游植物的产氧率明显开始低于水体的耗氧率,可以认为湖泊的溶解氧补给量逐渐无法满足其消耗量,溶解氧呈现出负增长的变化趋势. 进一步对溶解氧浓度的变化趋势采用二元多项式拟合,多项式中自变量恒为正数的x1与恒为负数的x2分别视为驱动溶解氧变化的产氧项与耗氧项,拟合结果反映了溶解氧的整体变化(图 9). 根据拟合曲线的变化趋势,前期溶解氧浓度变化平稳并有小幅度上升,中期开始回落并有所下降,而后期的持续性降低导致湖泊的部分湖区也随之进入了缺氧期. 但据调查研究显示,这种逐渐氧亏状态的形成在乌梁素海并非偶然现象. 在2016—2017年的湖泊冰封期,研究者就已经发现在无积雪覆盖期,乌梁素海冰下水体的上、中、下3层溶解氧浓度在逐渐降低,中、下层水体甚至一度处于厌氧状态[2]. 同样在2018—2019年的湖泊冰封期,研究者发现水体的溶解氧浓度在无积雪覆盖的情况下也会明显下降[35]. 这种溶解氧的补给量无法满足其消耗量而产生的亏耗现象无疑会对冰下水生生物的生存及活性产生重大的影响,甚至会改变整个冰下的水生态平衡.
|
图 8 产氧量与耗氧量的累积变化曲线 Fig.8 Oxygen production and oxygen consumption cumulative change curves |
|
图 9 溶解氧浓度变化的拟合曲线 Fig.9 Fitting curve of dissolved oxygen concentration change |
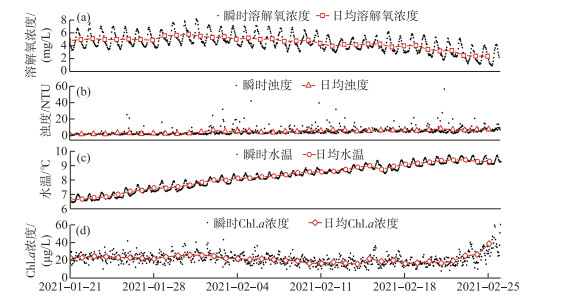
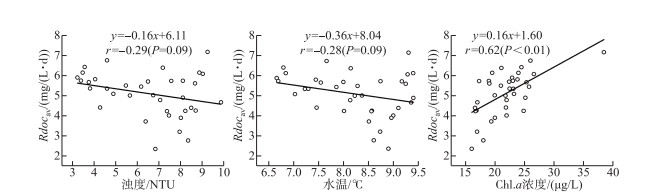
现场监测收集到的数据还包括与溶解氧数据同期的浊度、水温以及Chl.a浓度3类理化指标(图 10). 浊度与Chl.a浓度在研究期变化基本平稳,但Chl.a浓度在末期出现明显增幅,水温则一直持续上升. 将3种溶解氧的限制性环境因子与溶解氧变化的驱动力间建立相关性分析并检验显著性,分析结果如图 11、12所示. 随着光合作用速率的增加,浊度、水温均产生了显著的负相关性,Pearson相关系数r分别为-0.56(P < 0.01)与-0.57(P < 0.01). 二者与水体的耗氧作用速率同样表现出负相关关系,但是相关性较差且无显著性差异,相关系数分别为-0.29(P=0.09)、-0.28(P=0.09).
|
图 10 冰下水环境因子随时间的变化过程 Fig.10 The process of water environmental factors changing with time under ice |

|
图 11 浊度、水温及Chl.a浓度与产氧速率之间的线性关系 Fig.11 The linear relationships between turbidity, water temperature, Chl.a and oxygen production rate |
|
图 12 浊度、水温及Chl.a浓度与耗氧速率之间的线性关系 Fig.12 The linear relationships between turbidity, water temperature, Chl.a and oxygen consumption rate |
浊度能够表示水体对光的吸收和散射能力,其数值越大,表明水层对光的吸收和散射能力越强[36],浮游植物能够吸收到的光辐射就越小. 浊度主要受水体沉积物再悬浮的影响[37],即使冰封期冰盖下的水体并不受风浪扰动的影响,但在浊度轻微的变化下,对光合作用依旧会产生显著的逆向作用.
在非冰封期,淡水湖泊的溶解氧浓度主要取决于水体温度[38],水温控制着大气与水界面的氧气交换,水温的升高不利于氧气的转移并会降低溶解氧的饱和度[39],抑制作用明显. 在冰封期,冰盖阻绝了大气复氧的进行,但水温与溶解氧的负相关性一部分体现在与光合作用的响应关系上. 一种可能的解释为:在营养亏缺的条件下,光合作用和呼吸作用并不会随着温度的上升而增强[40],而且温度虽然对光合作用的初光反应过程影响不大,但对暗反应的酶促反应过程却有很大影响[41]. 暗反应又称二氧化碳固定反应,随着温度上升,代谢速率加快[42],通过消耗光合作用的原料二氧化碳在一定程度上抑制了光合作用的进行. 此外,光合作用的“副作用”光呼吸反应[8]在一定程度上同样是导致这种负相关性产生的因素. 另一方面,大环境下湖泊溶解氧下降,需氧生物受其代谢补偿影响会减少对氧气的需求,进而温度的持续上升也无法对耗氧速率产生显著性影响. Padfield等[43]研究发现初级生产者的代谢补偿会限制水温对初级生产总量的影响.
Chl.a作为一种表征浮游植物生物量的环境因子[44],无论是在浮游植物光合作用速率还是水体耗氧作用速率的增长过程中,均呈现出显著性的正相关关系,相关系数分别为0.56(P < 0.01)与0.62(P < 0.01). Chl.a作为光合反应产氧的必要条件,与光合作用的正相关性不难理解,但与水体耗氧作用的正相关可能在很大程度上依赖于浮游生物呼吸作用. 宁修仁等[45]曾经研究发现,在长江的冲淡水区呼吸作用与Chl.a之间存在明显的正相关性,Iriarte等发现[46],当Chl.a浓度超过5 μg/L后,呼吸作用与Chl.a浓度密切相关. 在乌梁素海冰生长及稳定期水体中的Chl.a浓度与呼吸作用强度同样会遵循这种规律,因此与水体整体耗氧速率之间表现出了正相关性.
4 讨论在驱动溶解氧变化的因素中,日照通过直接影响光合作用的速率而改变溶解氧的浓度,只有当光合细胞无法再受到光照的作用时,产氧才会停止. 在冬季,冰雪阻隔了大气与水体之间直接的物质交换,还影响着入射光线强度及透光深度. 但研究期间并未出现足以覆盖冰层的降雪,因此浮游植物的产氧周期依旧会随着太阳辐射周期的变化而变化. 本研究并未直接观测冰下水体接受到的太阳光强,而且利用光照强度计算水体的初级生产力是比较困难的,因此Delta法与EVM法被用来构建了冰下水体的产氧模式. 参考往年研究者对冬季乌梁素海的研究,Song等[2]的实验数据显示,在无雪期即使辐射值低至0~5 W/m2的水平时,初级生产者们也足以进行光合生产活动. 而Huang等[19]的观测结果表明,乌梁素海冬季的透光深度几乎可以覆盖整个湖泊. 这些环境因素为研究中产氧模式的构建提供了可行条件,而在Delta法与EVM法中太阳的光照周期成为研究中需要明确的关键变量. 大部分研究者通常采用日出至日落间的时长定义光合反应的时长,但这显然并不能精确地计算出产氧速率的变化. 因为即便太阳未东升至地平线以上或西沉至以下,当光线在通过高空大气时,空气分子对光的散射也足够维持地表微亮[47],进而为冰下浮游植物的光合作用提供“动力”. 此外,在耗氧模式中利用夜间溶解氧浓度变化计算耗氧作用速率时,同样需要保证水体未受到光照的干扰,所以在研究过程中需要充分考虑太阳光线能够在地表维持光合作用进行的时长. 因此本研究采用了天文曙暮光定义黎明与黄昏的时间并以此确定光照周期这一关键变量.
Delta法因其对光敏感性的缺陷[24],如阴天等,所以本研究在产氧模式建立过程中通过EVM法利用实测溶解氧对这种影响量化. 类似的有,Yean等[48]在一个Chl.a浓度高达300 μg/L的富营养化浅水湖泊——Harapan湖,利用光照瓶模拟分析湖泊中的溶解氧水平. 这种室内模拟方法通过实测溶解氧浓度将产氧速率与耗氧速率关联计算,弥补了Delta法及EVM法的缺陷. 结果显示,光合速率为37.70~51.60 mg/(L ·d),呼吸速率为3.40~5.60 mg/(L ·d),这其中高浓度的Chl.a成为产氧速率高居不下的主要原因. Xu和Mesmer[31]确定了城市区的浅水湖研究期平均初级生产力速率为1.96~7.68 g O2/(m2 ·d),平均呼吸速率为2.38~11.77 g O2/(m2 ·d). 在整个年度内,该湖泊的产氧量明显低于耗氧量,表明了大部分时间内湖泊均处于净异养环境中,这与本研究的计算值范围大体相当. 此外,Hall等[49]计算了Colorado河初级生产力的年平均值为3 g O2/(m2 ·d),并发现短时间尺度上,云层覆盖及浊度对水体初级生产力的影响较大,而长时间尺度上,气候与季节更替的作用则更加显著,这增加了对湖泊溶解氧环境因子限制性作用的思考.
乌梁素海冰下水体的溶解氧监测结果显示冬季湖冰生长及稳定期内溶解氧浓度整体上是趋于降低的,主要原因在于初级生产者的光合产氧活动在冻结期的后期并不能与水体及底泥(沉积物)等耗氧活动维持平衡. 逐日的产耗氧量变化证明了在研究期间的大部分时间内,单日的产氧量已经无法与耗氧量达到平衡,导致了整体上的溶解氧负增长趋势,不断衰减的溶解氧浓度将最终导致水体处于一种缺氧的状态. 由于乌梁素海是一个以河套灌区生态补水为主要补给源的湖泊[12],据实地调查,在湖泊冰封期的补给水量仍依靠人为控制,一般通过水源的补给便可以有效缓解湖泊的缺氧现象[50]. 逐日的溶解氧动态平衡分析可以为生态补水措施提供部分理论上的参考依据,然后通过有目的的定量补水既可以弥补湖泊溶解氧的亏耗,也可以防止溶解氧发生过饱和现象. 本研究还利用逐时的产氧速率变化趋势发现在冬季湖冰的生长及稳定期无降雪覆盖的情况下,光合作用的产氧量同样随着光照周期的变化而变化. 近似于正态分布的变化趋势可能与日间太阳辐射强度变化趋势相一致. 经调查论证,Xu等[8]通过模拟太阳辐射强度与光合作用强度的相互作用得到了二者之间相似的动态变化分析结果. 此外,尽管冬季湖面被冰盖覆盖,但冰封期的光合作用变化规律受辐射的影响程度依然大于受结冰的影响[19]. 与此不同的是,逐时的耗氧速率明显没有产生与光照周期及辐射强度相对应的变化,因为冰下水温的变化来源于太阳辐射的能量传递,而水温与耗氧速率的线性关系(r=-0.28,P=0.09)并无明显相关. Malve等[11]将冬季冰下的呼吸耗氧模拟为湖泊氧气的总消耗,并通过模拟后同样认为呼吸耗氧速率的变化与水温并无关系.
在研究过程中依然存在着不足. 水质在线监测设备收集数据的频率被设置为1 h,虽然这个监测频率足以清晰地掌握溶解氧的动态变化过程,但是在结合天文气象数据的过程中,当黎明与黄昏太阳光线的出现与消失这种短时间内光因素变化,显然更高频率(<1 h)的溶解氧动态监测数据可以获得更为详细和出色的模拟结果. 但并非收集的频率越高模拟的效果越显著,对比在其他湖泊中收集到 < 10 min的溶解氧数据在预处理后发现,数据中包含着大量的噪声,很大程度上会影响数据分析的准确性. 因此,可以认为频率在10 min~1 h的溶解氧数据在溶解氧的动态分析过程中更为适用. 此外,研究开展于湖泊冰的生长及稳定期,未对冰封期湖泊的冻融过程进行观测,而且缺少对于冰下光场辐射强度的测定,这些观测因素的缺失共同限制了研究的深度与广度.
5 结论通过原位在线监测的方式收集到乌梁素海冰下水体的溶解氧、温度等水环境指标,利用最优的小波函数变换降噪后,计算分析溶解氧的平衡性及驱动因素,得到了如下结论:
1) 乌梁素海冰下水体溶解氧的最优去噪函数为sym7小波,数据噪声去除后的SNR达到25.2979.
2) 单位日尺度下,湖泊的日平均产氧速率为2.01~7.19 mg/(L ·d),日平均耗氧速率为2.37~7.13 mg/(L ·d). 说明湖泊日间溶解氧的补给及消耗不均衡导致了研究后期溶解氧整体上的不平衡现象. 单位小时尺度下,湖泊的小时平均产氧速率为0~0.55 mg/(L ·h),小时平均耗氧速率为0.08~0.36 mg/(L ·h). 证明了产氧速率单日内的昼夜交替现象,并推测日间近似于正态分布的变化与太阳辐射强度直接相关.
3) 冰下水体的浊度与水温对湖泊产氧呈现出显著的逆向作用,而Chl.a浓度对湖泊的产氧与耗氧均呈现出显著的正向作用. 这说明冰下溶解氧浓度受其限制性水环境因子多因素的共同作用.
致谢: 感谢内蒙古农业大学水环境研究团队与芬兰赫尔辛基大学Lammi生物实验站师生的指导和帮助.
| [1] |
Zhao HC, Wang SR, Zhao M et al. Relationship between the DO and the environmental factors of the water body in Lake Erhai. Environmental Science, 2011, 32(7): 1952-1959. [赵海超, 王圣瑞, 赵明等. 洱海水体溶解氧及其与环境因子的关系. 环境科学, 2011, 32(7): 1952-1959. DOI:10.13227/j.hjkx.2011.07.026] |
| [2] |
Song S, Li CY, Shi XH et al. Under-ice metabolism in a shallow lake in a cold and arid climate. Freshwater Biology, 2019, 64(10): 1710-1720. DOI:10.1111/fwb.13363 |
| [3] |
Xu HZ, Liu SM, Xie Q et al. Seasonal variation of dissolved oxygen in Sanya Bay. Aquatic Ecosystem Health & Management, 2016, 19(3): 276-285. DOI:10.1080/14634988.2016.1215743 |
| [4] |
Huang YQ, Cai DS, Li MQ et al. Influence of changes in dissolved oxygen content on fish behavioral trajectories during water eutrophication. Applied Ecology and Environmental Research, 2019, 17(1): 653-666. DOI:10.15666/aeer/1701_653666 |
| [5] |
Xu Z, Xu YJ. Determination of trophic state changes with diel dissolved oxygen: A case study in a shallow lake. Water Environment Research, 2015, 87(11): 1970-1979. DOI:10.2175/106143015X14362865226716 |
| [6] |
Chinyama A, Ncube R, Ela W. Critical pollution levels in Umguza River, Zimbabwe. Physics and Chemistry of the Earth, Parts A/B/C, 2016, 93: 76-83. DOI:10.1016/j.pce.2016.03.008 |
| [7] |
Bengtsson L, Ali-Maher O. The dependence of the consumption of dissolved oxygen on lake morphology in ice covered lakes. Hydrology Research, 2020, 51(3): 381-391. DOI:10.2166/nh.2020.150 |
| [8] |
Xu Z, Xu Y. A deterministic model for predicting hourly dissolved oxygen change: Development and application to a shallow eutrophic lake. Water, 2016, 8(2): 41. DOI:10.3390/w8020041 |
| [9] |
Long MH, Rheuban JE, McCorkle DC et al. Closing the oxygen mass balance in shallow coastal ecosystems. Limnology and Oceanography, 2019, 64(6): 2694-2708. DOI:10.1002/lno.11248 |
| [10] |
Bai YL, Li HY, Li ZJ. Numerical model for vertical distribution of dissolved oxygen in cold and icy lake ice. Journal of Hydraulic Engineering, 2017, 48(3): 373-377. [白乙拉, 李慧莹, 李志军. 寒区结冰湖冰盖下溶解氧垂直分布数值模型. 水利学报, 2017, 48(3): 373-377.] |
| [11] |
Malve O, Laine M, Haario H. Estimation of winter respiration rates and prediction of oxygen regime in a lake using Bayesian inference. Ecological Modelling, 2005, 182(2): 183-197. DOI:10.1016/j.ecolmodel.2004.07.020 |
| [12] |
Feng WY, Jiao LX, Zhang S et al. Spectral characteristics of dissolved organic matter in the sediments of Wuliangsuhai Lake. China Environmental Science, 2013, 33(6): 1068-1074. [冯伟莹, 焦立新, 张生等. 乌梁素海沉积物溶解性有机质荧光光谱特性. 中国环境科学, 2013, 33(6): 1068-1074. DOI:10.3969/j.issn.1000-6923.2013.06.015] |
| [13] |
Evrendilek F, Karakaya N. Regression model-based predictions of diel, diurnal and nocturnal dissolved oxygen dynamics after wavelet denoising of noisy time series. Physica A: Statistical Mechanics and Its Applications, 2014, 404: 8-15. DOI:10.1016/j.physa.2014.02.062 |
| [14] |
Chen YY, Fang XM, Mei SY et al. Dissolved oxygen prediction model based on WT-CNN-LSTM. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(10): 284-291. [陈英义, 方晓敏, 梅思远等. 基于WT-CNN-LSTM的溶解氧含量预测模型. 农业机械学报, 2020, 51(10): 284-291. DOI:10.6041/j.issn.1000-1298.2020.10.032] |
| [15] |
Kisi O, Cimen M. A wavelet-support vector machine conjunction model for monthly streamflow forecasting. Journal of Hydrology, 2011, 399(1/2): 132-140. DOI:10.1016/j.jhydrol.2010.12.041 |
| [16] |
Chen YY, Xu J, Yu HH et al. Three-dimensional short-term prediction model of dissolved oxygen content based on PSO-BPANN algorithm coupled with kriging interpolation. Mathematical Problems in Engineering, 2016, 6564202. DOI:10.1155/2016/6564202 |
| [17] |
Li M, Li RL, Bai QX et al. Discrete wavelet analysis of dissolved oxygen concentration variation under ice in a Finnish freshwater lake. Mathematics in Practice and Theory, 2015, 45(7): 149-155. [李明, 李润玲, 柏钦玺等. 芬兰淡水湖冰下溶解氧浓度变化规律的离散小波分析. 数学的实践与认识, 2015, 45(7): 149-155.] |
| [18] |
Cao WD, Chen XY, Yang XR et al. Discrete wavelets transform for signal denoising in capillary electrophoresis with electrochemiluminescence detection. Electrophoresis, 2003, 24(18): 3124-3130. DOI:10.1002/elps.200305556 |
| [19] |
Huang WF, Zhang Z, Li ZJ et al. Under-ice dissolved oxygen and metabolism dynamics in a shallow lake: The critical role of ice and snow. Water Resources Research, 2021, 57(5): 1-16. DOI:10.1029/2020wr027990 |
| [20] |
O'Connor DJ, Di Toro DM. Photosynthesis and oxygen balance in streams. Journal of the Sanitary Engineering Division, 1970, 96(2): 547-571. DOI:10.1061/JSEDAI.0001093 |
| [21] |
Vinokurova GV, Sutorikhin IA, Kolomeytsev AA et al. Analysis of the state of biological communities in a continental water body using hydrooptical characteristics. Inland Water Biology, 2021, 14(2): 159-167. DOI:10.1134/s1995082921010144 |
| [22] |
Phillips KA, Fawley MW. Winter phytoplankton blooms under ice associated with elevated oxygen levels. Journal of Phycology, 2002, 38(6): 1068-1073. DOI:10.1046/j.1529-8817.2002.01044.x |
| [23] |
Baehr MM, DeGrandpre MD. In situ pCO2 and O2 measurements in a lake during turnover and stratification: Observations and modeling. Limnology and Oceanography, 2004, 49(2): 330-340. DOI:10.4319/lo.2004.49.2.0330 |
| [24] |
Chapra SC, di Toro DM. Delta method for estimating primary production, respiration, and reaeration in streams. Journal of Environmental Engineering, 1991, 117(5): 640-655. DOI:10.1061/(asce)0733-9372(1991)117:5(640) |
| [25] |
Wang H, Hondzo M, Xu C et al. Dissolved oxygen dynamics of streams draining an urbanized and an agricultural catchment. Ecological Modelling, 2003, 160(1/2): 145-161. DOI:10.1016/S0304-3800(02)00324-1 |
| [26] |
Correa-González JC, Chávez-Parga MDC, Cortés JA et al. Photosynthesis, respiration and reaeration in a stream with complex dissolved oxygen pattern and temperature dependence. Ecological Modelling, 2014, 273: 220-227. DOI:10.1016/j.ecolmodel.2013.11.018 |
| [27] |
Peeters F, Atamanchuk D, Tengberg A et al. Lake metabolism: Comparison of lake metabolic rates estimated from a diel CO2 and the common diel O2 technique. PLoS One, 2016, 11(12): e0168393. DOI:10.1371/journal.pone.0168393 |
| [28] |
Kragh T, Andersen MR, Sand-Jensen K. Profound afternoon depression of ecosystem production and nighttime decline of respiration in a macrophyte-rich, shallow lake. Oecologia, 2017, 185(1): 157-170. DOI:10.1007/s00442-017-3931-3 |
| [29] |
Portielje R, Kersting K, Lijklema L. Primary production estimation from continuous oxygen measurements in relation to external nutrient input. Water Research, 1996, 30(3): 625-643. DOI:10.1016/0043-1354(95)00202-2 |
| [30] |
Staehr PA, Bade D, van de Bogert MC et al. Lake metabolism and the diel oxygen technique: State of the science. Limnology and Oceanography: Methods, 2010, 8(11): 628-644. DOI:10.4319/lom.2010.8.0628 |
| [31] |
Xu YJ, Mesmer R. The dynamics of dissolved oxygen and metabolic rates in a shallow subtropical urban lake, Louisiana, USA. In: AHS ed. Understanding freshwater quality problems in a changing world. Gothenburg: H04, IAHS-IAPSO-IASPEI Assembly, 2013.
|
| [32] |
Arumaningtyas EP, Raharto M, Herdiwijaya D. Morning twilight measured at Bandung and Jombang. AIP Conference Proceedings, 2012, 1454(1): 29-31. DOI:10.1063/1.4730680 |
| [33] |
Zhang ZG, Yuan SC. Effects of twilight on two photoperiod reactions in Hubeiphotoperiod sensitive genic male—sterile rice (HPGMR). Chinese Journal of Rice Science, 1989, 3(3): 107-112. [张自国, 元生朝. 曙暮光在光敏感核不育水稻两个光周期反应中的作用. 中国水稻科学, 1989, 3(3): 107-112. DOI:10.16819/j.1001-7216.1989.03.003] |
| [34] |
Fan XH, Chen HB, Du BY. The influence of lower atmosphere aerosols on the radiance and color of the twilight sky. Chinese Journal of Atmospheric Sciences, 2004, 28(2): 301-310. [范学花, 陈洪滨, 杜秉玉. 近地层大气气溶胶对曙暮光辐射强度和天空颜色的影响. 大气科学, 2004, 28(2): 301-310. DOI:10.3878/j.issn.1006-9895.2004.02.13] |
| [35] |
Zhai JL, Shi XH, Liu Y et al. Change law of water temperature and dissolved oxygen concentration of Wuliangsu Sea in icebound period. Arid Zone Research, 2021, 38(3): 629-639. [翟佳伦, 史小红, 刘禹等. 乌梁素海冰封期水温与溶解氧浓度变化研究. 干旱区研究, 2021, 38(3): 629-639. DOI:10.13866/j.azr.2021.03.05] |
| [36] |
Liu GF, Fan CX, Zhang L et al. Environment effects of algae-caused black spots Ⅲ: Impacts on Fe- S- P cycle in water-sediment interface. China Environmental Science, 2014, 34(12): 3199-3206. [刘国锋, 范成新, 张雷等. 藻源性黑水团环境效应Ⅲ: 对水-沉积物界面处Fe-S-P循环的影响. 中国环境科学, 2014, 34(12): 3199-3206.] |
| [37] |
Zhou L, Feng S, Li ZY et al. Characteristics of turbidity in summer in Lake Taihu and its application to the identification of water-sediment interface. China Environmental Science, 2015, 35(10): 3108-3116. [周莉, 冯胜, 李忠玉等. 夏季太湖浊度分布特征及其在水——沉积物界面识别中的应用. 中国环境科学, 2015, 35(10): 3108-3116. DOI:10.3969/j.issn.1000-6923.2015.10.031] |
| [38] |
Yuan LN, Yang CL, Li XM et al. Effect of daily thermal stratification on dissolved oxygen, pH, total phosphorus concentration, phytoplankton and algae density of a deep plateau lake: A case study of Lake Yangzonghai, Yunnan Province. J Lake Sci, 2014, 26(1): 161-168. [袁琳娜, 杨常亮, 李晓铭等. 高原深水湖泊水温日成层对溶解氧、酸碱度、总磷浓度和藻类密度的影响: 以云南阳宗海为例. 湖泊科学, 2014, 26(1): 161-168. DOI:10.18307/2014.0120] |
| [39] |
Ouyang XR, Zhao QH, Wei YZ. A preliminary exploration of dissolved oxygen based on FVCOM in Meiliang Bay, Lake Taihu and its influence mechanism. J Lake Sci, 2013, 25(4): 478-488. [欧阳潇然, 赵巧华, 魏瀛珠. 基于FVCOM的太湖梅梁湾夏季水温、溶解氧模拟及其影响机制初探. 湖泊科学, 2013, 25(4): 478-488. DOI:10.18307/2013.0404] |
| [40] |
Fernández-González C, Pérez-Lorenzo M, Pratt N et al. Effects of temperature and nutrient supply on resource allocation, photosynthetic strategy, and metabolic rates of Synechococcus sp.. Journal of Phycology, 2020, 56(3): 818-829. DOI:10.1111/jpy.12983 |
| [41] |
Nielsen ed. Marine photosynthesis. Beijing: Science Press, 1979. [尼耳森. 海洋光合作用. 北京: 科学出版社, 1979.]
|
| [42] |
Yang DF, Chen ST, Hu J et al. Magnitude order of the effect of light, water temperature and nutrients on phytoplankton growth. Marine Environmental Science, 2007, 26(3): 201-207. [杨东方, 陈生涛, 胡均等. 光照、水温和营养盐对浮游植物生长重要影响大小的顺序. 海洋环境科学, 2007, 26(3): 201-207. DOI:10.3969/j.issn.1007-6336.2007.03.001] |
| [43] |
Padfield D, Lowe C, Buckling A et al. Metabolic compensation constrains the temperature dependence of gross primary production. Ecology Letters, 2017, 20(10): 1250-1260. DOI:10.1111/ele.12820 |
| [44] |
Guo ZY, Li CY, Shi XH et al. Spatial and temporal distribution characteristics of chlorophyll a content and its influencing factor analysis in Hulun Lake of cold and dry areas. Ecology and Environmental Sciences, 2019, 28(7): 1434-1442. [郭子扬, 李畅游, 史小红等. 寒旱区呼伦湖水体叶绿素a含量的时空分布特征及其影响因子分析. 生态环境学报, 2019, 28(7): 1434-1442.] |
| [45] |
Ning XR, Kuty C. Relationships between chlorophyll-a, bacteria, ATP, POC and microbial respiration rates in the Yangtze Estuary and the diluted water area. Acta Oceanologica Sinica, 1991, 13(6): 831-837. [宁修仁, C.库蒂. 长江口及冲淡水区叶绿素a、细菌、ATP、POC及微生物呼吸作用速率之间的关系. 海洋学报: 中文版, 1991, 13(6): 831-837. DOI:10.1007/BF02919155] |
| [46] |
Iriarte A, Daneri G, Garcia V et al. Plankton community respiration and its relationship to chlorophyll a concentration in marine coastal waters. Oceanologica Acta, 1991, 14: 379-388. |
| [47] |
Huang RH. Introduction to atmospheric science. Beijing: Meteorological Press, 2005. [黄荣辉. 大气科学概论. 北京: 气象出版社, 2005.]
|
| [48] |
Yean TS, Lye KH, Ismail AIM et al. Determining photosynthesis rate constants in Lake Harapan Penang. 2008 International Conference on BioMedical Engineering and Informatics. May 27-30, 2008, Sanya, China. IEEE, 2008: 585-590. DOI: 10.1109/BMEI.2008.217.
|
| [49] |
Hall RO Jr, Yackulic CB, Kennedy TA et al. Turbidity, light, temperature, and hydropeaking control primary productivity in the Colorado River, Grand Canyon. Limnology and Oceanography, 2015, 60(2): 512-526. DOI:10.1002/lno.10031 |
| [50] |
Ju JT, Zhu LP, Huang L et al. Ranwu Lake, a proglacial lake with the potential to reflect glacial activity in SE Tibet. Chinese Science Bulletin, 2015, 60(1): 16-30. [鞠建廷, 朱立平, 黄磊等. 基于监测的藏东南然乌湖现代过程: 湖泊对冰川融水的响应程度. 科学通报, 2015, 60(1): 16-30. DOI:10.1360/N972014-00084] |
 2022, Vol. 34
2022, Vol. 34 

