恢复和保护以沉水植物为初级生产力的草型生态系统是目前浅水富营养化湖泊控源截污后的主要治理对策[1-4]. 然而,本土草食性水生动物如鱼类的牧食对沉水植物的存在和重建威胁很大[5-7],导致其难于重建或现存的也快速消亡. 但是,目前已不仅只有草食性鱼类等对沉水植物的现存量或恢复重建产生威胁,一些外来杂食性入侵者如克氏原螯虾(Procambarus clarkii),已经在非原生栖息地成功入侵并导致沉水植物生物量急剧下降或沉水植物重建失败[8-10].
克氏原螯虾是全球入侵最广的小龙虾,也是对淡水生态系统最具破坏性的物种之一[11]. 克氏原螯虾入侵浅水湖泊后,喜栖息在岸边的水草丛中,在许多湖泊沿岸带形成优势类群[9-10],它能够摄食碎屑、植物、藻类、其他底栖动物和腐肉等[12-13],在湖泊沿岸带底栖食物网中发挥着重要作用[13-14]. 克氏原螯虾对水生植物、碎屑、附着生物的消耗,使它们在调节湖泊生产力方面发挥着重要作用[15]. 然而,长期以来,水生生态学家一直在研究克氏原螯虾摄食选择性及其对水生植物的破坏机制,Gutiérrez-Yurrita等[16]在西班牙多尼亚纳国家公园通过肠道内含物分析表明成年虾和幼虾均主要摄食植物和有机碎屑,幼虾摄取的动物食物与成年虾相比相对更高,栖息地的水生植物丰度显著下降,优势种也发生改变,植物的生物量减少的原因可能是被克氏原螯虾选择性摄食. van der Wal等[17]在荷兰特拉诺瓦湖通过肠道内含物分析却发现克氏原螯虾的主要食物是无脊椎动物等,也牧食沉水植物. Rodríguez等[18]在西班牙Chozas湖研究发现克氏原螯虾主要通过螯钳切割导致水生植物大量漂浮,其对植物的损害大多是非消费性的. 运用稳定同位素技术,Alcorlo等[19]在西班牙瓜达尔基维尔河下游的3条支流研究时发现克氏原螯虾以动物食物为主. 不同栖息地研究结果的差异性表明克氏原螯虾的食物主要来源以及对水生植物的损害可能会因食物可得性而存在区别[20-23]. 此外,不同种的沉水植物的形态、韧性、表面特征以及总酚类化感物质也会影响克氏原螯虾对其的牧食和机械破坏[24]. 但是,由于已开展的研究结果之间难于对比[25],所以对克氏原螯虾对沉水植物摄食选择尚了解不足.
克氏原螯虾是我国最重要的经济外来引种水生动物,但其作为世界上最具威胁的外来入侵物种之一的风险被忽视. 克氏原螯虾原产于美国南部和墨西哥东北部,1920s被引入中国[26]. 克氏原螯虾凭借其入侵生物学特性和水产养殖业的发展在引入我国后迅速在长江中下游地区扩散[27],又因其温度适应性广[28],目前除了青藏高原,其他各省均有分布[29]. 克氏原螯虾在欧洲、北美洲等地成功入侵后导致沉水植物生物量急剧下降或沉水植物重建失败[9, 17],导致湖泊从草型清水态向藻型浑水态转变. 而与欧、美、非等针对入侵的生态负面效应研究相比,在中国仅少量研究关注克氏原螯虾从养殖扩散到自然水体中对生态系统可能带来的危害[30]. 江舒等[31]曾在毛里湖区调查发现,克氏原螯虾在自然水域大量繁殖,而苦草、菹草和黑藻等沉水植物大量减少. 张燕萍等[32]调查发现克氏原螯虾已成为鄱阳湖底栖动物优势种. 曾珍英等[33]认为大量出现的克氏原螯虾可能是导致鄱阳湖沉水植物面积减少、优势种发生改变的原因之一. 然而,对于克氏原螯虾尤其是成年虾,人们对其是否主要摄食新鲜沉水植物还存在争议,而且一些研究者认为其主要还是以肉食性为主,仅当肉食性食物缺乏时,克氏原螯虾才转食植物或植物碎屑[14, 34],但也有研究者认为成年克氏原螯虾以摄食植物为主[21-22].
目前,克氏原螯虾入侵草型湖泊后会降低栖息地水生植物的现存量[15, 22, 34],然而对克氏原螯虾是直接取食新鲜植物还是优先吃腐烂后的植物?这些摄食选择还知之甚少. 事实上,不同的摄食行为对沉水植物的影响不同,如克氏原螯虾直接取食沉水植物,其将会直接破坏沉水植物,导致栖息地生态系统可能快速从草型清水态向藻型浑水态转变,而如果是主要取食植物碎屑其对植物的破坏可能源自机械切割或挖掘行为. 鉴于此,本研究通过设置6种沉水植物的新鲜植株和分解腐烂后的植株,拟通过受控模拟实验分析克氏原螯虾对不同沉水植物的摄食选择性行为,以及对新鲜植株和分解腐烂后的植株的摄食偏好,并结合植物总酚类含量变化分析其摄食决策原因. 在本课题组已经开展的研究中[35],通过受控模拟实验我们已经观察到克氏原螯虾能够降低苦草的生物量,但主要是导致苦草叶片折断,但具体是机械折断还是摄食残留尚不清楚. 针对克氏原螯虾的摄食生态学模拟研究,将能为合理评估克氏原螯虾在自然草型湖泊的生态效应提供基础依据.
1 材料与方法 1.1 实验材料克氏原螯虾采集孝感农户自然养殖的鱼塘,挑选均匀大小个体用于实验(克氏原螯虾重(26.0±6)g),全长(9.00±0.75) cm. 在各个实验开始前,将克氏原螯虾饥饿处理24 h.
穗花狐尾藻(Myriophyllum spicatum)、密刺苦草(Vallisneria denseserrulata)、轮叶黑藻(Hydrilla verticillata)、菹草(Potamogeton crispus L.)、马来眼子菜(Potamogeton malaianus)和金鱼藻(Ceratophyllum demersum)均采集于湖北省武汉市内沙湖. 实验中,轮叶黑藻、菹草、穗花狐尾藻、马来眼子菜和金鱼藻均选择植株顶部约20 cm的茎叶,苦草选择叶片. 在摄食实验开始前的12、8、4 d,取等量密刺苦草、轮叶黑藻、穗花狐尾藻、马来眼子菜、金鱼藻和菹草分别进行腐烂处理,然后取腐烂后的植物用吸水纸吸干水分,与称量等重的新鲜植物碎屑直接开始进行投喂试验.
1.2 实验设计选择摄食实验在圆形塑料盆(直径:50 cm)中进行,用隔板将其等分,将新鲜和分解腐烂后的植物分别放置在圆形塑料盆的边界附近,使用挂钩将植物固定在边界. 实验时,将克氏原螯虾放置在塑料盆的中心,确保其遇到每种食物的机会都相同. 实验中没有区分雄性和雌性,因为Gherardi & Barbaresi研究表明克氏原螯虾的食性无性别差异[36].
实验一:克氏原螯虾对6种沉水植物新鲜植株的摄食偏好——选择6个圆形塑料盆,盆内进行6等分,将6种新鲜沉水植物在盆内特定位置固定,加水至5 cm深,选择3个塑料盆分别加入1只克氏原螯虾为实验组,另外3个无虾盆作为对照组. 考虑克氏原螯虾喜暗习性,每个塑料盆均用纸盒盖住盆口,保持相对暗环境.
实验二:克氏原螯虾对6种不同分解程度的沉水植物的摄食偏好——选择36个圆形塑料盆,每种植物准备6个圆形塑料盆,盆内进行4等分,放置新鲜植物和不同分解腐烂程度的植物,加水至5 cm深,每种植物选择3个塑料盆分别加入1只克氏原螯虾为实验组,另外3个无虾盆作为对照组. 以上2组实验同时进行,新鲜植株和分解腐烂后的植株初始湿重为(2.0±0.2) g. 考虑克氏原螯虾喜暗习性,每个塑料盆均用纸盒盖住盆口,保持相对暗环境.
实验在室温(20±2)℃进行,持续观察5 d.
1.3 采样与分析方法1) 克氏原螯虾在不同沉水植物区逗留偏好统计:实验期间每天9:00、12:00、15:00、18:00、21:00观察并统计克氏原螯虾所在位置. 观察克氏原螯虾在哪种沉水植物区逗留,计算实验期间的逗留频率. 本研究通过记载克氏原螯虾的逗留偏好,拟作为指示克氏原螯虾的摄食偏好的指标之一.
2) 摄食量的测试:实验结束将未食用的植物和被破坏的植物收集好,称量每种食物湿重. 克氏原螯虾的消费植物量的衡量用Cronin等[24]计算公式估计:H0(Cf/C0)-Hf;H0和Hf分别为取食前和取食后实验植物植株湿重,C0和Cf分别为实验前和实验后对照组植物植株的湿重.
3) 沉水植物总酚含量测量:植物的湿重采用纸巾仔细擦干后迅速秤量,将采集的植物洗净后在80℃条件下分别烘干至恒重后磨成粉末,测量植物的总酚含量. 植物总酚含量采用Folin-Ciocalteu比色法测定,在含有酚类物质的待测试样中加入一定量的FC试剂和一定量的10 % 碳酸钠溶液,定容至25 mL,在一定温度下避光反应一定时间,以蒸馏水为空白,测定试样液体的吸光度值,依据没食子酸标准工作曲线的拟合方程,计算试样中的总酚类含量[37].
1.4 数据处理及分析所有统计分析均采用SPSS 19.0软件进行分析. 数据以平均值±标准差表示. 不同处理间的比较采用单因素方差分析,如果存在显著差异则采用Tukey's Test进行多重比较.
2 结果与分析 2.1 克氏原螯虾对6种新鲜沉水植物植株的摄食偏好单因素方差分析结果表明克氏原螯虾对6种新鲜沉水植物植区的逗留偏好和对植株的摄食偏好均具有显著差异(P<0.01). 克氏原螯虾在轮叶黑藻区逗留比例显著高于其他5种植物区(P<0.01),在菹草区逗留比例显著低于在马来眼子菜区(P<0.05),而在金鱼藻区逗留比例最低且显著低于其他5种植物(P<0.01)(图 1a),在穗花狐尾藻、密刺苦草和马来眼子菜3种植物区逗留比例无区别. 6种植物湿重减少量与逗留偏好趋势相似,在放入克氏原螯虾后轮叶黑藻湿重减少量显著高于其他5种植物(P<0.01),穗花狐尾藻、密刺苦草、菹草和马来眼子菜4种植物湿重减少量无显著区别,而金鱼藻减少量显著低于其他5种植物(P<0.01)(图 1b).
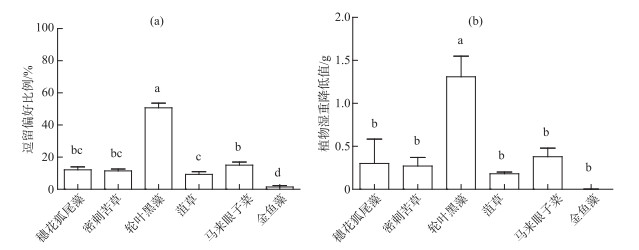
|
图 1 克氏原螯虾在6种沉水植物植区的逗留偏好(a)和对新鲜植株的摄食偏好(b) (数据棒上不同小写字母表示显著性差异,P < 0.05) Fig.1 Staying preference(a) and grazing preference(b) for six submerged macrophytes by P. clarkii (Differences between values above the bar graph that share different letters are statistically significant, P < 0.05) |
实验结束时,轮叶黑藻仅茎残留;穗花狐尾藻叶片尽管从茎上脱落,但被摄食的很少,与无虾对照组无显著区别;而金鱼藻的生物量几乎无减少,有虾组和无虾组无显著区别(图 1b).
2.2 克氏原螯虾对不同分解程度沉水植物植株的摄食偏好相对各新鲜植株,单因素方差分析结果表明克氏原螯虾在不同分解程度的植物间逗留偏好和植物湿重降低值均存在显著差异(P<0.01)(图 2),且均更偏爱逗留分解腐烂后植物区域. 其中,不同分解腐烂天数之间相较而言,穗花狐尾藻组克氏原螯虾最喜逗留在分解腐烂8 d的植物区,密刺苦草组最喜逗留在分解腐烂12 d的植物区,轮叶黑藻和菹草组最喜逗留在分解腐烂8 d的植物区,马来眼子菜组最喜逗留在8 d和12 d的植物区,而金鱼藻组最喜逗留在分解腐烂12 d的植物区(图 2a).
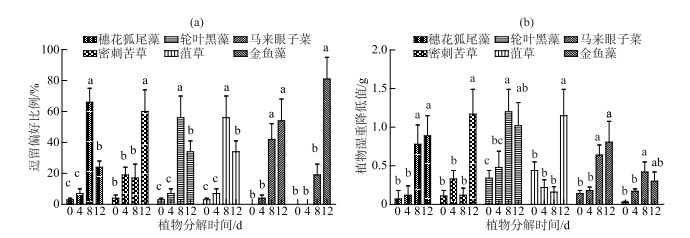
|
图 2 克氏原螯虾在不同分解程度的6种沉水植物的逗留偏好(a)和摄食偏好(b) (数据棒上不同小写字母表示显著性差异,P < 0.05) Fig.2 Staying preference(a) and grazing preference(b) for six submerged macrophytes in different decomposition periods of P. clarkii (Differences between values above the bar graph that share different letters are statistically significant, P < 0.05) |
相对新鲜植株,穗花狐尾藻、轮叶黑藻、马来眼子菜和金鱼藻分解腐烂8 d和12 d的植物减少量显著更高(P<0.05),8 d和12 d之间无显著区别. 密刺苦草和菹草分解腐烂12 d的植物减少量显著高于其他分解程度的植物(图 2b). 不同植物之间,分解腐烂12 d后的金鱼藻的减少量与其他植物相比减少最少(P<0.05)(图 2b).
2.3 不同分解时间6种沉水植物的总酚类含量变化比较新鲜的6种植物,穗花狐尾藻总酚类含量最高,均值为(46.37±6.64) mg/g,显著高于其他5种植物(P<0.01),而其他5组之间总酚类含量无显著差别(图 3). 每种植物分解腐烂后的总酚类含量均显著低于新鲜植株(P<0.05),但除黑藻外不同分解时间(4、8、12 d)各植物总酚类含量无显著区别. 穗花狐尾藻总酚类含量始终最高,而其他5种植物间分解腐烂时间相同时总酚类含量无显著区别(图 3).
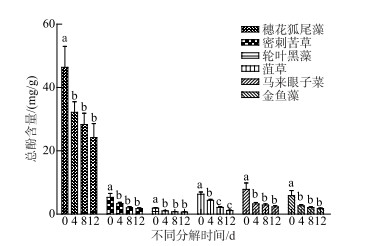
|
图 3 不同分解程度的6种沉水植物总酚类含量 (数据棒上不同小写字母的表示显著性差异,P < 0.05) Fig.3 Total phenolic content of six submerged macrophytes in different decomposition periods (Differences between values above the bar graph that share different letters are statistically significant, P < 0.05) |
本研究中克氏原螯虾对6种沉水植物存在摄食偏爱,克氏原螯虾最偏爱摄食柔软一些的轮叶黑藻,而最不喜摄食坚硬的金鱼藻;相对新鲜植株,均偏爱摄食分解腐烂后的植株. 克氏原螯虾摄食植物的决定可能取决于多种植物特征,如形态、结构、化学防御和营养价值等[24],而本研究中克氏原螯虾的摄食偏爱可能与沉水植物物理形态结构有关,偏爱摄食分解腐烂后的和细分枝或柔软一些的植株或碎屑.
克氏原螯虾对沉水植物新鲜植株的摄食具有偏好性,多个研究结果已表明轮叶黑藻是其最偏爱摄食的沉水植物之一[34, 38-39]. 在西班牙的一个湿地中,尽管在研究区域中毛刺轮藻(Chara hispida)和细金鱼藻(Ceratophyllum submersum)丰度相似,但克氏原螯虾更偏爱摄食毛刺轮藻而不是细金鱼藻[15]. Carreira等[22]也通过原位围隔研究发现克氏原螯虾偏爱摄食灯芯草(Juncus heterophyllus),而不喜以水毛茛(Ranunculus peltatus)和苔草(Carex divisa)为食,灯芯草由于被偏爱摄食其生物量减少最多,表明克氏原螯虾能够根据摄食偏爱性依次从水生植物群落中移除最偏爱种和最不喜欢的植物物种,最终影响水生植物的群落结构和功能. 虽然,牧食性动物摄食偏好通常取决于植物化感防御、营养价值和消化率等[40-41],但是克氏原螯虾摄食偏好却可能主要取决于营养价值和化学防御以外的因素,如植物物理结构的韧性[24]. 本研究中,尽管克氏原螯虾偏好摄食分解腐烂后的植物且分解腐烂后植物总酚类含量降低,但穗花狐尾藻总酚类含量显著高于其他5种沉水植物,但其被摄食量与密刺苦草、菹草、马来眼子菜类似,表明穗花狐尾藻体内高的总酚类含量也不能阻止克氏原螯虾对其摄食. 已有研究表明克氏原螯虾在摄食时往往优先选择一些韧性低的植物,但当植物韧性被破坏后,可能会改变选择,如金鱼藻(Ceratophyllum demersum)和狭叶香蒲(Typha angustifolia),克氏原螯虾会优先摄食金鱼藻,但当两种植物被冷冻干燥或磨碎后,克氏原螯虾转而优先摄食狭叶香蒲[42]. 可见,植物特定的形态可以使植物更容易被处理和食用,从而也会在摄食决定中起到主要作用. 克氏原螯虾的摄食选择也受食物可得性影响[43],当偏爱摄食的食物难以获得时,也会转而摄食次偏爱的食物. 金鱼藻、茨藻等具有坚硬、木质化的表面以及刺状的叶对一些大型牧食者来说势必是不适口的组织[44],而狐尾藻和眼子菜又比轮叶黑藻具备较强的机械方面的优势[45],因此本研究中克氏原螯虾最喜摄食轮叶黑藻而最不喜摄食金鱼藻可能与植物的物理结构相关. Bolser等[42]研究表明,在通过冻干、细磨等方法去除植物坚韧组织后,克氏原螯虾对香蒲的摄食显著增加.
相对于新鲜沉水植物植株,本研究结果表明克氏原螯虾更偏爱摄食分解腐烂后的植物碎屑. 尽管一些研究描述克氏原螯虾以新鲜植物为食[46-47],但分解腐烂后的碎屑在肠道内更为常见,Gherardi等[43]通过肠道内含物分析表明,无论性别、季节和地点,克氏原螯虾都消耗相对大量的有机碎屑,特别是大型植物分解腐烂后的碎屑. 这些研究指出,虽然在螯虾的内脏中发现了新鲜的大型植物,但是这些新鲜植物不太可能是提供营养和能量需求的主要组成部分[43]. 此外,与新鲜的大型植物相比,克氏原螯虾进食分解腐烂15 d后的植株时同化效率更高[48],年幼克氏原螯虾在单独进食腐烂的植物时也能够存活[49]. 事实上,由于“微生物调节”或“化学防御物质浸出或分解”[50],碎屑相对于新鲜植物植株来说,富含微生物蛋白质,对克氏原螯虾可能是一种高营养的食物,从而更容易被利用[24, 51]. James等[52]也认为活着的大型水生植物可能不会直接促进碳流向更高的营养层,但来自腐烂的大型植物的有机物质可以为碎屑性大型无脊椎动物提供重要的碳源.
克氏原螯虾对栖息地大型水生植物的生物量有显著负面影响,而摄食选择性会影响其在不同的大型植物中直接消费和非消费的破坏方向,如自然湖泊中,克氏原螯虾优先摄食轮叶黑藻,最终会引起这些大型植物物种相对丰度发生显著变化. 本研究发现克氏原螯虾更偏爱以分解腐烂的碎屑为食,在一定程度上可以了解克氏原螯虾食性选择策略. 作为多营养策略的杂食性消费者,克氏原螯虾通常会根据食物的可获得性,在食腐动物和食草动物摄食方式上转换[36, 53]. 更多的研究需要去探讨克氏原螯虾摄食偏好及策略,有助于科学的防治克氏原螯虾对浅水湖泊沉水植物的影响.
4 结论1) 克氏原螯虾对沉水植物具有明显的摄食偏好,6种植物其最偏爱摄食轮叶黑藻,对穗花狐尾藻、密刺苦草和马来眼子菜摄食无区别,而对金鱼藻的摄食量显著最低. 相对各新鲜植株,克氏原螯虾均更偏爱摄食分解腐烂8 d或12 d后的沉水植物碎屑.
2) 结合植物化学指标和摄食偏好结果,表明克氏原螯虾对沉水植物的摄食具有选择性,相对新鲜植物更喜摄食腐烂后的碎屑,但总酚类化学防御物质不是影响其选择的关键因子.
| [1] |
Liu ZW, Zhang XF, Chen FZ et al. The responses of the benthic-pelagic coupling to eutrophication and regime shifts in shallow lakes: Implication for lake restoration. J Lake Sci, 2020, 32(1): 1-10. [刘正文, 张修峰, 陈非洲等. 浅水湖泊底栖-敞水生境耦合对富营养化的响应与稳态转换机理: 对湖泊修复的启示. 湖泊科学, 2020, 32(1): 1-10. DOI:10.18307/2020.0101] |
| [2] |
Qin BQ. Approaches to mechanisms and control of eutrophication of shallow lakes in the middle and lower reaches of the Yangtze River. J Lake Sci, 2002, 14(3): 193-202. [秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301] |
| [3] |
Gao HL, Qian X, Wu HF et al. Combined effects of submerged macrophytes and aquatic animals on the restoration of a eutrophic water body—A case study of Gonghu Bay, Lake Taihu. Ecological Engineering, 2017, 102: 15-23. DOI:10.1016/j.ecoleng.2017.01.013 |
| [4] |
Hilt S, Gross EM, Hupfer M et al. Restoration of submerged vegetation in shallow eutrophic lakes—A guideline and state of the art in Germany. Limnologica, 2006, 36(3): 155-171. DOI:10.1016/j.limno.2006.06.001 |
| [5] |
Wang XP, Wang YB, Yang GJ et al. The effects of different fish species on growth of submerged macrophytes. J Lake Sci, 2016, 28(6): 1354-1360. [王晓平, 王玉兵, 杨桂军等. 不同鱼类对沉水植物生长的影响. 湖泊科学, 2016, 28(6): 1354-1360. DOI:10.18307/2016.0621] |
| [6] |
van Onsem S, Triest L. Turbidity, waterfowl herbivory, and propagule banks shape submerged aquatic vegetation in ponds. Frontiers in Plant Science, 2018, 9: 1514. DOI:10.3389/fpls.2018.01514 |
| [7] |
Zhen W, Zhang XM, Guan BH et al. Stocking of herbivorous fish in eutrophic shallow clear-water lakes to reduce standing height of submerged macrophytes while maintaining their biomass. Ecological Engineering, 2018, 113: 61-64. DOI:10.1016/j.ecoleng.2017.10.011 |
| [8] |
Nyström P, Strand J. Grazing by a native and an exotic crayfish on aquatic macrophytes. Freshwater Biology, 1996, 36(3): 673-682. DOI:10.1046/j.1365-2427.1996.d01-508.x |
| [9] |
Gherardi F, Acquistapace P. Invasive crayfish in Europe: The impact of Procambarus clarkii on the littoral community of a Mediterranean Lake. Freshwater Biology, 2007, 52(7): 1249-1259. DOI:10.1111/j.1365-2427.2007.01760.x |
| [10] |
Gherardi F, Aquiloni L, Diéguez-Uribeondo Javier et al. Managing invasive crayfish: is there a hope?. Aquatic Sciences, 2011, 73(2): 185-200. DOI:10.1007/s00027-011-0181-z |
| [11] |
Oficialdegui FJ, Sánchez MI, Clavero M. One century away from home: How the red swamp crayfish took over the world. Reviews in Fish Biology and Fisheries, 2020, 30(1): 121-135. DOI:10.1007/s11160-020-09594-z |
| [12] |
Crandall KA, Buhay JE. Global diversity of crayfish (Astacidae, Cambaridae, and Parastacidae—Decapoda) in freshwater. Hydrobiologia, 2008, 595(1): 295-301. DOI:10.1007/s10750-007-9120-3 |
| [13] |
Momot WT. Redefining the role of crayfish in aquatic ecosystems. Reviews in Fisheries Science, 1995, 3(1): 33-63. DOI:10.1080/10641269509388566 |
| [14] |
Hansen GJA, Hein CL, Roth BM et al. Food web consequences of long-term invasive crayfish control. Canadian Journal of Fisheries and Aquatic Sciences, 2013, 70(7): 1109-1122. DOI:10.1139/cjfas-2012-0460 |
| [15] |
Cirujano S, Camargo JA, Gómez-Cordovés C. Feeding preference of the red swamp crayfish Procambarus clarkii (Girard) on living macrophytes in a Spanish wetland. Journal of Freshwater Ecology, 2004, 19(2): 219-226. DOI:10.1080/02705060.2004.9664535 |
| [16] |
Gutiérrez-Yurrita PJ, Sancho G, Bravo MÁ et al. Diet of the red swamp crayfish Procambarus clarkii in natural ecosystems of the doñana National Park temporary fresh-water marsh (Spain). Journal of Crustacean Biology, 1998, 18(1): 120-127. DOI:10.1163/193724098X00124 |
| [17] |
van der Wal JEM, Dorenbosch M, Immers AK et al. Invasive crayfish threaten the development of submerged macrophytes in lake restoration. PLoS One, 2013, 8(10): e78579. DOI:10.1371/journal.pone.0078579 |
| [18] |
Rodríguez CF, Bécares E, Fernández-Aláez M. Shift from clear to turbid phase in Lake Chozas (NW Spain) due to the introduction of American red swamp crayfish (Procambarus clarkii). Hydrobiologia, 2003, 506/507/508/509(1/2/3): 421-426. DOI:10.1023/b:hydr.0000008626.07042.87 |
| [19] |
Alcorlo P, Baltanás A. The trophic ecology of the red swamp crayfish (Procambarus clarkii) in Mediterranean aquatic ecosystems: a stable isotope study. Limnetica, 2013, 32(1): 121-138. DOI:10.23818/limn.32.12 |
| [20] |
Alcorlo P, Otero M, Geiger W. Feeding preferences and food selection of the red swamp crayfish, Procambarus clarkii, in habitats differing in food item diversity. Crustaceana, 2004, 77(4): 435-453. DOI:10.1163/1568540041643283 |
| [21] |
Xu ZH, Zhou X, Shui Y. Food preference and feeding rhythm in red swamp crayfish Procambarus clarkii. Journal of Dalian Ocean University, 2012, 27(2): 166-170. [徐增洪, 周鑫, 水燕. 克氏原螯虾的食物选择性及其摄食节律. 大连海洋大学学报, 2012, 27(2): 166-170.] |
| [22] |
Carreira BM, Dias MP, Rebelo R. How consumption and fragmentation of macrophytes by the invasive crayfish Procambarus clarkii shape the macrophyte communities of temporary ponds. Hydrobiologia, 2014, 721(1): 89-98. DOI:10.1007/s10750-013-1651-1 |
| [23] |
Usio N, Townsend CR. Roles of crayfish: Consequences of predation and bioturbation for stream invertebrates. Ecology, 2004, 85(3): 807-822. DOI:10.1890/02-0618 |
| [24] |
Cronin G, Lodge DM, Hay ME et al. Crayfish feeding preferences for freshwater macrophytes: The influence of plant structure and chemistry. Journal of Crustacean Biology, 2002, 22(4): 708-718. DOI:10.1163/20021975-99990285 |
| [25] |
Wright JP, Jones CG. The concept of organisms as ecosystem engineers ten years on: progress, limitations, and challenges. BioScience, 2006, 56(3): 203-209. DOI:10.1641/0006-3568(2006)056[0203:TCOOAE]2.0.CO;2 |
| [26] |
Dai AY. Introduce a kind of aquatic resource—Crayfish. Chinese Journal of Zoology, 1983, 18(3): 51-53. [戴爱云. 介绍一种水产资源——蝲蛄. 动物学杂志, 1983, 18(3): 51-53. DOI:10.13859/j.cjz.1983.03.019] |
| [27] |
Wang WM. The exploitation and utilization of red swamp crayfish in China. Acta Hydrobiologica Sinica, 1999, 23(4): 375-381. [王卫民. 软壳克氏原螯虾在我国开发利用的前景. 水生生物学报, 1999, 23(4): 375-381. DOI:10.3321/j.issn:1000-3207.1999.04.013] |
| [28] |
Veselý L, Buři č M, Kouba A. Hardy exotics species in temperate zone: can "warm water" crayfish invaders establish regardless of low temperatures?. Scientific Reports, 2015, 5(1): 16340. DOI:10.1038/srep16340 |
| [29] |
Yi S, Li Y, Shi L et al. Characterization of population genetic structure of red swamp crayfish, Procambarus clarkii, in China. Scientific Reports, 2018, 8(1): 5586. DOI:10.1038/s41598-018-23986-z |
| [30] |
Twardochleb LA, Olden JD, Larson ER. A global meta-analysis of the ecological impacts of nonnative crayfish. Freshwater Science, 2013, 32(4): 1367-1382. DOI:10.1899/12-203.1 |
| [31] |
Jiang S, Pang L, Huang C. Hazards and control of exotic spiece, Procambarus clarkii. Bulletin of Biology, 2007, 42(5): 15-16. [江舒, 庞璐, 黄成. 外来种克氏原螯虾的危害及其防治. 生物学通报, 2007, 42(5): 15-16.] |
| [32] |
Zhang YP, Chen WJ, Fang CL et al. Population structure analysis of Procambarus clarkii in Poyang Lake region. Jiangxi Fishery Science and Technology, 2014(2): 6-9. [张燕萍, 陈文静, 方春林等. 鄱阳湖区克氏原螯虾捕捞种群结构分析. 江西水产科技, 2014(2): 6-9.] |
| [33] |
Zeng ZY, Wu HP, Jiang Y et al. Dynamics and impacts of invasion by exotic species to Poyang Lake national nature reserve. Energy Research and Management, 2013(4): 15-18, 35. [曾珍英, 吴和平, 江艳等. 外来物种对鄱阳湖国家级自然保护区的入侵及其影响. 能源研究与管理, 2013(4): 15-18, 35.] |
| [34] |
Jin S. Reproductive and feeding ecology of red swamp crayfish Procambarus clarkii(Girard, 1852) in China. Biodiversity and Ecology, Université Paul Sabatier-Toulouse Ⅲ, 2019. NNT: 2019TOU30114.
|
| [35] |
Gao J, Yang C, Zhang Z et al. Effects of co-occurrence of invading Procambarus clarkii and Pomacea canaliculata on Vallisneria denseserrulata-dominated clear-water ecosystems: a mesocosm approach. Knowledge and Management of Aquatic Ecosystem, 2021, 422: 29. DOI:10.1051/kmae/2021029 |
| [36] |
Gherardi F, Barbaresi S. Feeding preferences of the invasive crayfish, Procambarus clarkii. Bulletin Français de la Pêche et de la Pisciculture, 2007, 385(387): 7-20. DOI:10.1051/kmae:2007014 |
| [37] |
Box JD. Investigation of the Folin-Ciocalteau phenol reagent for the determination of polyphenolic substances in natural waters. Water Research, 1983, 17(5): 511-525. DOI:10.1016/0043-1354(83)90111-2 |
| [38] |
Lv JC, Zhang HB, Dai LL et al. Effect of Procambarus clarkii feeding on submerged macrophytes growth and community structure. Jiangsu Agricultural Sciences, 2019, 47(21): 298-301. [吕敬才, 张海波, 代亮亮等. 克氏原螯虾摄食对沉水植物生长和群落结构的影响. 江苏农业科学, 2019, 47(21): 298-301.] |
| [39] |
Yuan Y, Zhang YZ, Lv CC et al. Herbivory of the invasive crayfish Procambarus clarkii on three submerged macrophytes. Ecological Science, 2019, 38(5): 23-29. [袁野, 张尹哲, 吕超超等. 外来种克氏原螯虾(Procambarus clarkii)对3种沉水植物的牧食研究. 生态科学, 2019, 38(5): 23-29.] |
| [40] |
Elger A, Lemoine D. Determinants of macrophyte palatability to the pond snail Lymnaea stagnalis. Freshwater Biology, 2005, 50(1): 86-95. DOI:10.1111/j.1365-2427.2004.01308.x |
| [41] |
Yam RS, Fan YT, Wang TT. Importance of macrophyte quality in determining life-history traits of the apple snails Pomacea canaliculata: Implications for bottom-up management of an invasive herbivorous pest in constructed wetlands. International Journal of Environmental Research and Public Health, 2016, 13(3): 248-264. DOI:10.3390/ijerph13030248 |
| [42] |
Bolser RC, Hay ME, Lindquist N et al. Chemical defenses of freshwater macrophytes against crayfish herbivory. Journal of Chemical Ecology, 1998, 24(10): 1639-1658. DOI:10.1023/A:1020816511924 |
| [43] |
Gherardi F, Barbaresi S. Feeding opportunism of the red swamp crayfish, Procambarus clarkii, an invasive species. Freshwater Crayfish, 2008, 16: 77-85. |
| [44] |
Li YK. Study on the relationship between submerged plants and herbivorous snails[Dissertation]. Wuhan: Wuhan University, 2004. [李永科. 沉水植物与牧食性螺类的关系研究[学位论文]. 武汉: 武汉大学, 2004. ]
|
| [45] |
Zhu GR. Studies on the effects of eutrophication and floods on the biomechanical characteristics of aquatic macrophytes[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2012. [祝国荣. 富营养化和洪水对水生植物的生物力学特征的影响研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2012. ]
|
| [46] |
Jr Avault JW, Romaire RP, Miltner MR. Feeds and forages for red swamp crawfish, Procambarus clarkii: 15 years research at Louisiana State University. Freshwater Crayfish, 1981, 5: 362-369. |
| [47] |
Feminella JW, Resh VH. Submersed macrophytes and grazing crayfish: An experimental study of herbivory in a Californian freshwater marsh. Holarctic Ecology, 1989, 12(1): 1-8. DOI:10.1111/j.1600-0587.1989.tb00815.x |
| [48] |
Ilhéu M, Bernardo JM. Trophic ecology of red swamp crayfish Procambarus clarkii(Girard)—Preference and digestibility of plant foods. Freshwater Crayfish, 1995, 10: 132-139. |
| [49] |
MCclain WR, Neil WH, Garlin Ⅲ DM. Nutrient profiles of green and decomposed rice-forages and their utilization by juvenile crayfish (Procambarus clarkii). Aquaculture, 1992, 101(3/4): 251-265. DOI:10.1016/0044-8486(92)90029-K |
| [50] |
Newman RM. Herbivory and detritivory on freshwater macrophytes by invertebrates: A review. Journal of the North American Benthological Society, 1991, 10(2): 89-114. DOI:10.2307/1467571 |
| [51] |
Holdich. Biology of freshwater crayfish. Oxford: Scientific Press, 2002.
|
| [52] |
James MR, Hawes I, Weatherhead M et al. Carbon flow in the littoral food web of an oligotrophic lake. Hydrobiologia, 2000, 441: 93-106. DOI:10.1023/A:1017504820168 |
| [53] |
Thorp JH, Covich AP. Ecology and classification of north American freshwater invertebrates. San Diego: Academic Press, 1991.
|
 2022, Vol. 34
2022, Vol. 34 

