(2: 中国地质大学(武汉)流域关键带演化湖北省重点实验室, 武汉 430074)
(2: Hubei Key Laboratory of Critical Zone Evolution, China University of Geosciences, Wuhan 430074, P.R.China)
泥炭地是由泥炭积累而成的一种独特的沼泽湿地生态系统,覆盖了全球近3 % 的陆地面积[1]. 作为地球上最为重要的碳汇之一,泥炭地储存着全球约1/3的土壤碳,在气候调节、水源涵养、生物多样性保护等方面发挥着重要的生态功能[2-3]. 泥炭是在过湿的厌氧条件下,有机质未充分分解累积而成的第四纪松散堆积物[4]. 由于具有沉积速率快且连续、沉积环境稳定、可提取的信息量大等优点,泥炭已作为重要的天然地质档案,与其他载体如冰芯、树轮、湖泊沉积物等广泛用于全球变化研究,为揭示气候变化规律及预测未来环境演变趋势提供关键信息[5-6].
得益于有利的保存条件,生物残体能在泥炭中有效地保存下来,并成为反演泥炭地生态环境演变的有效指标. 截止目前,研究较为成熟的生物指标包括孢粉、植物大化石、有壳变形虫等. 然而,不同的生物由于生命周期长短、所处生态位、个体大小等特征的不同,对环境变化的敏感性存在明显差异[7]. 因此,综合多种生物指标记录才能更全面地反映泥炭地生态环境演变规律[8]. 近年来研究发现,泥炭中还保存有其他单细胞和多细胞生物亚化石,包括摇蚊、金藻孢囊、硅藻等. 泥炭地表层样品调查发现,水位是影响这些生物种群组合变化的显著变量[9-10]. 可以推测,泥炭岩芯中这些生物亚化石记录可能为泥炭地古水文重建提供新线索.
摇蚊是包括泥炭地在内的几乎所有淡水生态系统中最为常见的底栖动物之一. 其幼虫在蜕变的过程中脱落的头囊几丁质化程度高,具有抗分解能力,可在沉积物中较好地保存下来,且易于提取和鉴定[11]. 摇蚊生命周期短、生态幅相对狭窄、环境变化敏感度高、种群丰度高,这些优点都使得摇蚊亚化石被作为有效生物代用指标用于区域气候及环境变化研究. 诸多研究表明,摇蚊对温度变化响应非常迅速,被视为气温重建研究中最强有力的指示生物,在北美、欧洲、青藏高原等高纬、高海拔地区自末次盛冰期尤其全新世以来的气候变化研究中发挥了重要作用,为全球及区域古气候研究提供了大量基础数据和经典案例[12-16]. 在低纬度或平原地区,摇蚊与营养、溶解氧、盐度或水深等一系列参数间转换函数的建立推动了不同地区湖泊环境状态及演化历史的探讨研究,为人口密集区湖泊环境保护及生态恢复提供了重要的参考环境[17-20]. 然而,摇蚊古生态学研究目前主要围绕湖泊生态系统展开,其在泥炭地古环境重建中的应用报道很少,已有的零星报道也主要针对温带泥炭地. 2011年,Płóciennik等[21]分析了波兰中部Żabieniec泥炭地及其古湖中的摇蚊种群演化过程,Słowiński等[22]又基于摇蚊等多指标交叉分析探讨了近3300年来干旱所导致的波兰Rąbień泥炭地生态环境变化历史,而Diaconu等[23]则分别基于雨养泥炭沼泽摇蚊和有壳变形虫记录恢复了罗马尼亚北部地区近7500年来的水文气候条件. 然而,目前尚未见亚热带山地泥炭地摇蚊古生态学的研究报道.
除高纬高寒地区外,亚热带山地中也有数量众多的斑块状泥炭地发育,由于地处偏远、人为直接干扰很少,这些泥炭地多指标记录提供了区域气候变化的关键信息. 例如,神农架大九湖泥炭地是华中地区代表性亚高山泥炭藓湿地,自1990s以来,国内外学者相继基于泥炭地孢粉[24]、植物大化石[25]、脂类化合物[26]、有机同位素[27]、植物硅酸体[28]等指标记录重建了长江中游地区自末次冰期以来的古气候变化历史. 摇蚊亚化石能否为这些亚热带泥炭地古环境演化提供新线索目前尚不清楚. 为此,本研究选择鄂西神农架大九湖泥炭地作为研究区并采集了泥炭沉积岩芯,通过建立年代、亚化石摇蚊及地球化学指标序列,结合模拟的区域气候资料,探讨过去近400年来大九湖泥炭地地表干湿变化及摇蚊种群响应过程. 该研究是一次对泥炭地摇蚊古生态信息解译的有意义的探索,将为未来该指标在泥炭地古环境研究中的应用提供数据及案例支撑,从而为泥炭地环境演化提供新的研究手段,以便于多角度、全方位审视泥炭地环境演化及区域气候变化历史.
1 材料与方法 1.1 研究区概况大九湖泥炭地(31°24′~31°33′N,109°56′~110°11′E,图 1a)位于神农架林区最西端,隶属于大九湖乡,其东部及北部与神农架林区相连,南部及西部与湖北十堰竹山及重庆巫山相接壤. 大九湖泥炭地周围群山环绕,是一个封闭的高山岩溶盆地. 盆地底部海拔为1700~1760 m,面积约16 km2. 神农架大九湖泥炭地在气候上隶属于东亚季风带,为典型的中纬度亚高山潮湿气候. 区域内年平均气温为7.2℃,其中最热月(7月)平均气温仅为17.1℃,1月平均气温约-2.4℃. 年平均降水量为1560 mm,最大降水量可达3000 mm,相对湿度高达80 % 以上. 由于大九湖地处我国第二级和第三级阶梯交界处,同时位于温带与亚热带及湿润与半湿润过渡区,特殊的地理位置使其对环境变化响应敏感,故而被视为气候及区域环境演化研究的理想区域[29-30]. 研究区植被主要包括泥炭藓、苔草、油桦、地榆等(图 1c).
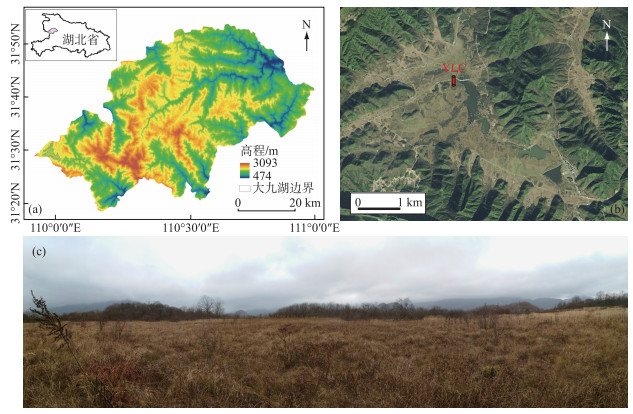
|
图 1 神农架林区地形图及大九湖位置(a)、大九湖泥炭岩芯(YLC)位置(b)和样点周围景观(c) Fig.1 Maps showing the topography of Shennongjia forestry region and the location of Dajiuhu Peatland (a), the location of the peat core (YLC) in Dajiuhu Peatland (b) and the picture showing the landscape around the sampling site (c) |
于2016年9月在大九湖泥炭地使用泥炭采样器采集长度为51 cm的岩芯一根(YLC,图 1b). 现场以1 cm间隔分样,用自封袋密封后带回实验室于4℃冰箱中冷藏保存,以待年代、摇蚊亚化石及地球化学指标的分析测试.
1.2.2 实验室处理及数据搜集采用美国EG&G Ortec公司生产的高纯锗井型探测器(HPGe GWL-120-15)与Ortec919四型谱控制器和IBM微机构成的16K多道分析器所组成的γ谱分析系统进行210Pb、226Ra和137Cs比活度测定,以用于泥炭岩芯年代序列的建立,测试精度为2 cm. 210Pb和226Ra标准样品由英国利物浦大学提供,137Cs标准样品由中国原子能科学研究院提供,测试误差小于10 %. 测试分析工作于中国科学院南京地理与湖泊研究所完成.
钻孔摇蚊亚化石分析按2 cm间隔进行,但前期实验中发现10~27.5 cm深度处沉积物中摇蚊头壳浓度极低,因此该段仅分析4个样品(11、21、25和27 cm). 沉积物样品依据标准方法处理[31]. 具体步骤如下:取3~10 g泥炭湿样加入质量浓度为10 % 的KOH后置于75℃的水浴锅中加热15 min,依次过212和90 μm分样筛并冲洗干净,将剩余样品置于25倍体视显微镜下,用镊子手动挑选摇蚊头壳,并用Hydromatrix®将头壳封片. 在100~400倍生物显微镜下对摇蚊头壳进行鉴定,一般可鉴定到属,部分保存较好的可鉴定到种. 摇蚊头壳属种鉴定依据文献[31-34]进行. 将完整的或多于半个颏的头壳记为一个,半个颏的记为半个,不足半个的不统计. 每个样品提取的摇蚊头壳数至少达到50个.
沉积物中元素(Al、Ti、C、N)含量测定均以2 cm间隔进行. 其中,Al和Ti含量测定采用美国Leeman Labs公司产的PRODIGY SPEC型电感耦合等离子体原子发射光谱仪(IPC-AES)(测试误差小于5 %),TC和TN含量测定则利用EuroEA 3000元素分析仪(Eurovector, Italy)参考标准样(精度为±0.1 %)完成. 所有元素含量测定均于中国科学院南京地理与湖泊研究所完成.
由于缺少大九湖地区长期、连续的气温和降水实测资料,因此本研究选用模拟的中国东部地区年均气温和7月降水量数据[35]来表征大九湖泥炭地区域内气候变化过程. 为表征该数据有效性,本研究同时搜集了宜昌气象站1952年以来的年均气温和7月降水数据. 两组不同来源数据间存在显著的相关关系(Pearson相关,P < 0.05,附图Ⅰ),表明模拟的中国东部地区温度和降水数据可以用来反映研究区气候变化历史. 相关分析前对数据进行5点滑动平均,且非参数检验表明数据均来源于正态分布总体.
1.3 数据处理本研究中,香农-威纳指数(Shannon-Wiener index)[36]用于历史时期摇蚊种群多样性的评估. 摇蚊种群中各属种丰度以百分含量表示,并通过软件Tilia-Graph 1.7.16以图谱形式展示,同时基于CONISS聚类分析[37]对摇蚊属种划分组合带. 对摇蚊数据进行标准化处理,即选择在2个及以上样品中出现且至少在1个样品中百分含量≥2 % 的属种参与统计分析,对亚化石摇蚊属种数据进行平方根转换并对稀有属种做降权处理以减小其对结果的影响. 主成分分析(principal component analysis, PCA)用以揭示摇蚊种群组合变化的主要特征,并提取其在主成分轴的最大变率. 香农-威纳指数的计算利用Past 2.03完成,主成分分析则利用CANOCO 5.0软件完成[38].
2 结果 2.1 钻孔年代序列由图 2可知,210Pb比活度总体上沿深度呈指数递减的趋势,137Cs比活度的峰值出现在近表层处(1.5 cm),表明钻孔中137Cs存在垂向迁移,不适宜作为年代确定的标准,因此本研究主要基于恒定补给速率(constant rate of supply, CRS)模式利用210Pb比活度进行断代并建立深度-年代标尺. 结果表明,岩芯0.5 cm处对应2016年,21.5 cm处约为1863年,此为钻孔测年底限. 基于岩芯上部平均沉积速率,利用外推法对岩芯21.5 cm以下深度对应的沉积物年代进行推算,结果表明岩芯底部50.5 cm处约为1654年,整个钻孔涵盖过去约362年的沉积历史. 岩芯沉积速率波动范围为0.012~0.185 g/(cm2 ·a),平均沉积速率为0.038 g/(cm2 ·a).
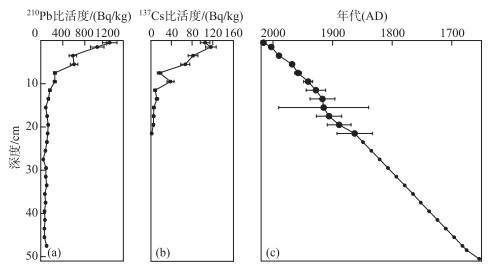
|
图 2 YLC钻孔210Pb、137Cs比活度及年代-深度对应关系 Fig.2 The activities of 210Pb, 137Cs and the age-depth relationship of the YLC core |
整个钻孔共处理沉积物样品20个,其中16个样品符合分析测试要求. 10~27.5 cm(1821-1938年)深度处沉积物中的摇蚊头壳丰度极低(头壳浓度为0.6~2.9头/g),无法满足每个样品提取的摇蚊头壳数至少为50头的要求,故该阶段摇蚊种群(Tribelos、Psilometriocnemus、Tanytarsus mendax-type出现频次较高)数据将不参与后续分析.
16个样品共挑拣出摇蚊亚化石壳体2726.5头,平均每个样品170头,分属3亚科18属26种(图 3). 其中摇蚊亚科(Chironominae)共计6属11种,直突摇蚊亚科(Orthocladinae)8属11种,而长足摇蚊亚科(Tanypodinae)仅4属4种. 所有样品摇蚊种群中,Psilometriocnemus属相对丰度最高,平均含量为32.4 %,为整个岩芯的主要优势种. 其次是Limnophyes(平均相对丰度11.9 %)、Polypedilum bergi-type(11.3 %)、Pseudosmittia(7.1 %)、T. mendax-type(7.0 %)、Neozavrelia(6.5 %)、Tribelos(5.5 %). 为便于讨论,本研究将所有摇蚊属种按其生境条件划分为湖相种和半陆生-陆生种[31, 39-40],其中湖相种包括Ablabesmyia、Neozavrelia、P. bergi-type、Polypedilum nubeculosum-type、Polypedilum nubifer-type、Paramerina、Parametriocnemus、Paratendipes nudisquama-type、Rheocricotopus effusus-type、Rheocricotopus fucipes-type、Tanytarsus chinyensis-type1、T. mendax-type、Tribelos;半陆生-陆生种包括Psilometriocnemus和Pseudosmittia. 根据CONISS聚类分析,可将整个钻孔划分为3个组合带.
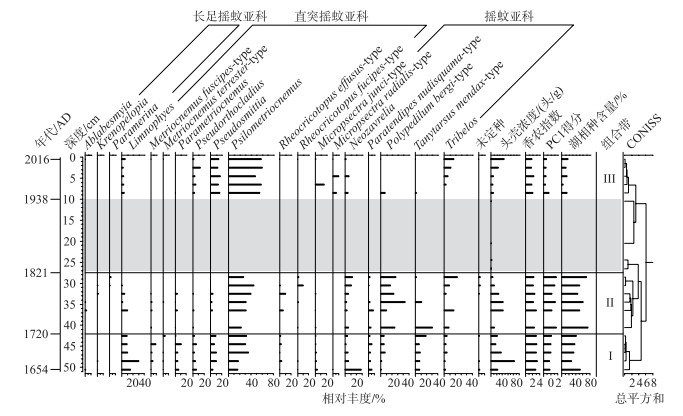
|
图 3 大九湖泥炭地YLC钻孔主要摇蚊组合图谱 Fig.3 Major taxa of chironomid assemblages in YLC peat core in Dajiuhu Peatland |
组合带Ⅰ(>42 cm;1720年以前):这一时期摇蚊种群中Psilometriocnemus平均含量为22.4 %,但仍处于整个岩芯谷值期. Limnophyes在本阶段百分含量为整个岩芯中最高,约为21.2 %. 其他相对丰度较高的属种包括Neozavrelia、T. mendax-type和Pseudosmittia,其平均百分含量分别为9.5 %、9.1 % 和8.6 %. Parametriocnemus、P. nudisquama-type和Pseudorthocladius属丰度较低,但出现频率非常高,几乎每个样品中都有发现. 该时期摇蚊头壳浓度波动较大,其变化范围为17~83头/g,平均为37头/g. 香农-威纳指数波动范围为2.97~3.30(平均为3.13),为整个岩芯高值期. 该阶段湖相种相对含量为27.0 % ~52.9 %,平均为38.5 %.
组合带Ⅱ(27.5~42 cm;1720-1821年):该阶段摇蚊种群优势种Psilometriocnemus的平均含量增加至33.3 %. P. bergi-type和Tribelos的相对丰度较前一阶段也表现出明显的上升,前者从前一阶段的3.1 % 增加至26.7 %,而后者从2.3 % 增至7.5 %. 相反,Limnophyes、Pseudosmittia和Pseudorthocladius明显减少,其平均百分含量分别降至3.8 %、1.8 % 和0.5 %. 摇蚊头壳浓度相对组合带Ⅰ有所降低,其波动范围为6~44头/g(平均值为24头/g). 多样性指数较前一时期亦略有下降,其变化范围为2.24~3.03(平均值为2.50). 该阶段湖相种相对丰度为整个岩芯最高值,占所有摇蚊的46.1 % ~74.7 %,平均为55.8 %.
组合带Ⅲ(0~10 cm;1938-2016年):10 cm以上岩芯样品中,Psilometriocnemus较之前两个时期都更为丰富,其平均含量(57.2 %)超过所有摇蚊的一半. Pseudosmittia和Pseudorthocladius在这一时期亦显著增加,其平均相对丰度分别为14.5 % 和5.8 %. 另外,Tribelos成为该时期继Psilometriocnemus和Pseudosmittia之后最为丰富的属种,其平均相对含量为9.9 %. 值得注意的是,P. bergi-type相对丰度及出现频率较前两阶段明显下降,如百分含量由组合带Ⅱ的26.7 % 降至1.1 %. 经历10~27.5 cm处的极低浓度后,摇蚊头壳丰度在该时期表现出明显的回升,但平均头壳浓度(19头/g)仍低于前两阶段,香农-威纳指数也表现为整个岩芯最低值(波动范围为1.69~2.38,均值为1.97). 湖泊相摇蚊属种含量在该时期最低,其平均丰度仅为12.4 %.
主成分分析结果表明,PCA前两轴共解释了57.7 % 的摇蚊变量,其中第1轴解释份额为33.37 %,第2轴为24.33 %. PCA属种-样点双轴图(图 4)显示,基于摇蚊种群的各组合带样点具有明显的聚集性,即组合带Ⅰ分布于双轴图下部,组合带Ⅱ和Ⅲ则分别位于第1轴右、左两侧. 岩芯优势摇蚊属种Psilometriocnemus与Limnophyes表现出明显的负相关关系,分居第2轴的正负方向,而P. bergi-type则沿PC1轴分布,两者表现出密切的正相关关系. PC1得分上,组合带Ⅰ得分值低于组合带Ⅱ,之后在组合带Ⅲ出现明显降低(图 3).
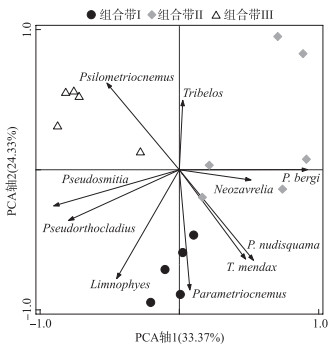
|
图 4 摇蚊属种-样点PCA双轴图 Fig.4 Principal component analysis (PCA) biplot of major chironomid taxa and samples |
钻孔元素变化序列(图 5)表明不同历史时期沉积物中各元素含量都发生了明显变化. 岩芯中TC和TN含量整体变化趋势较为一致,但42~50.5 cm深度处(1650s-1720s;组合带Ⅰ)的TN含量为整个岩芯最低,TC含量在该时期的变化范围为327.5~358.9 g/kg,C/N比值此时为整个岩芯高值期. 该阶段Al和Ti含量波动范围分别为35.98~43.91 g/kg和2.28~2.69 g/kg,其平均含量也较高,分别为38.06 g/kg和2.38 g/kg,Ti/Al比值呈上升趋势,其值在0.059~0.066范围内波动. 组合带Ⅱ中,TC含量经历谷值后迅速回升,并于30.5 cm(1800s)前后达到岩芯最高值,而TN含量在34.5 cm处(1770s)出现极低值,后迅速达到岩芯峰值. C/N比值则表现出与TN相反的变化过程. Al和Ti元素含量在该阶段经历了整个岩芯最低值期. 10~27.5 cm(1820s-1940s)深度处,TC和TN含量及C/N比值表现为持续下降,而Al、Ti含量及Ti/Al比值则表现为持续升高. 4种元素在组合带Ⅲ(0~10 cm;1940s-2016年)的变化较为剧烈,但变化趋势上依然表现为TC、TN含量与Al、Ti含量相反的变化过程,即前两者先下降后升高,而后两者先升高后降低.
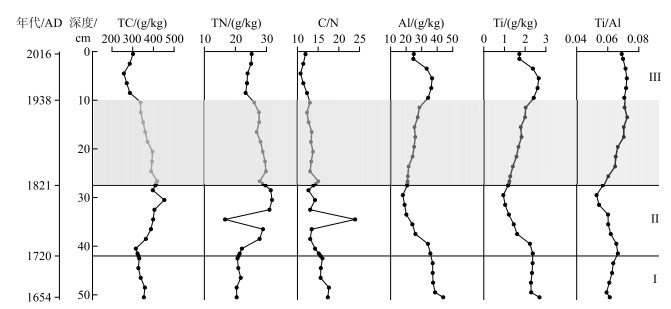
|
图 5 YLC钻孔元素变化序列 (图中分带为基于摇蚊种群的组合带) Fig.5 Elemental profiles in YLC peat core (The zones are based on chironomid assemblages) |
泥炭沼泽湿地地处水-陆过渡区域,兼具水体和陆地两者的特征,藓丘-洼地相间分布是其最显著的微地貌特征. 复杂的地表形态为以泥炭沼泽作为生境的动植物提供了多样化的栖居场所,从而使其在维持全球生物多样性方面发挥了极为重要的作用[41-42]. 有研究表明,双翅目昆虫是泥炭地动物中多样性最高的生物类群[43],其中又以摇蚊科、蜉蝣类、幽蚊属昆虫丰度最高[44-45]. 然而,尽管对生境条件改变具有良好的指示作用,摇蚊在泥炭地环境监测及生态评估中的应用却远不如其在河流及湖泊中广泛[46]. Cao等[47]曾专门对鄂西地区泥炭地摇蚊种群组成情况进行调查,发现泥炭地摇蚊多样性高于区域内浅水湖泊摇蚊种群,且在组成上兼具湖沼相、半陆生及陆生摇蚊. 然而,由于缺乏细致、深入的调查和研究,目前对国内外泥炭地摇蚊属种(尤其特有种)生态属性的了解甚少. 鉴于此,本研究中摇蚊生态属性的判识多基于古北区及长江中下游地区浅水湖泊及Cao等[47]针对泥炭地摇蚊种群调查的成果.
由古北区摇蚊生态属性的相关研究可知,该岩芯中摇蚊种群兼有陆生-半陆生种和湖相种. 优势属种Psilometriocnemus在潮湿的土壤、渗水、泉水、溪流中都有出现[33],其生境范围似乎较为广泛,但目前关于该属幼虫生态属性的相关报道极少. Cao等基于鄂西地区3处泥炭地表层摇蚊种群组成的调查结果显示,Psilometriocnemus在大九湖泥炭地表层泥炭中大量出现,且与地表水体氧化还原电位表现出良好的正相关关系[47]. 高氧化还原电位指示较强的氧化环境,泥炭分解速率较快,不利于泥炭积累,据此可以推测该属种大量出现可能反映了泥炭地地表有效湿度降低,区域内气候条件偏暖干. Pseudosmittia在古北区湖泊底泥样品中较为常见,常与水生植被相关,但在沼泽地区、池塘或溪流边界地带等也均有发现[48],故而该属许多幼虫被视为陆生-半陆生种[49]. 在亚化石头壳鉴定中,仅依靠其头壳特征很难将该属个体鉴定到种,因此,本研究区内该属摇蚊的生态属性无法完全确定. 然而,鉴于大九湖泥炭地藓丘-沟壑相间的极为复杂的地貌形态,初步推断Pseudosmittia属中陆生-半陆生种出现的几率更高. Limnophyes生境广泛,在河流、溪流、湖泊等水生环境和其他半栖生境以及陆地生境中都有生长,部分种与水生植被密切相关,其他种则为陆生或半陆生种[11, 33]. 典型的岩壁湿生摇蚊Neozavrelia为冷水狭温性属种,尤喜高山地区富含钙质的溪流、湖泊、泥炭等水体环境[50],大九湖地区碳酸盐性基岩有利于该属种幼虫的发育. Polypedilum为典型的湖泊相属种,且部分种幼虫的生长与沉水植被密切相关,在古湖沼学中常被用来指示过去环境中水生植被的发育[51]. 同时,Parametriocnemus和P. nudisquama-type也多为湖泊相属种,Parametriocnemus多见于泉水、激流生境[33],而P. nudisquama-type喜中营养湖泊沿岸柔软底质,也可见于流水中[52]. Pseudorthocladius则通常生长于湖泊浅水区,也多见于有苔藓生长的河流边缘或岩壁湿生植物上、酸性水体以及由泉水供给的溪流中[49, 53]. Tanytarsus是我国长江中下游地区乃至全球浅水湖泊中最为常见的一类摇蚊[47, 54-55]. 该属多数幼虫生态幅宽广,尤喜温暖、高生产力的浅水区域,且具一定的耐酸性[48]. Tribelos在欧洲及长江中下游地区湖泊中并不常见[34, 54],部分研究表明该属幼虫喜静水生态系统浅水环境[31],通常附着于水生植被生长.
3.2 环境代用指标的指示意义泥炭地为典型的酸性环境,泥炭中无机碳含量极低,故而泥炭沉积物中的总碳基本由有机碳构成[56]. 泥炭是植物残体积累与微生物分解共同作用的结果,其形成受各种自然因素的综合作用,其中水热条件是其决定性因素. 水分和热量直接影响泥炭沼泽植物生长发育、微生物活性、泥炭分解强度以及地表水文条件[57]. 对于东亚季风区中纬度亚高山泥炭而言,当气候处于干冷期时,由降水量和蒸发量所决定的地表有效湿度减小,泥炭处于氧化状态,有机质分解强烈;反之,暖湿的气候条件不仅有利于植物大量发育,同时地表有效湿度较大,泥炭主要处于还原状态,在获得更多植物残体的同时分解速度降低,从而有利于泥炭的积累[5]. 白光润等[58]对亚热带-热带地区6省(市)泥炭形成与水热条件关系进行研究,结果表明亚热带地区泥炭累积对水面空气湿度的反应极为敏感,该地区泥炭对湿度的表征优于温度. 因此,表征泥炭积累的TC和TN可用于指示亚热带地区泥炭地表有效湿度及区域内气候条件的干湿变化,即两指标高值期反映了地表有效湿度大、气候条件偏暖湿,而较低的TC和TN值则指示地表有效湿度小、气候条件偏冷干.
水体沉积物中有机物质的来源主要包括两个途径:一是水体自身生长的浮游植物、水生植物等;二是随流水汇入的流域内陆生植物[59]. 研究表明,低等水生植物和高等陆地植物的C/N比值存在较大差异,其中水生浮游植物的C/N比值较低,通常在4~10之间,而陆生维管植物的C/N比值一般大于10,多为20~200[60-61]. 故而C/N比值可用于判识沉积环境中有机物质来源于水生植物或陆生植物的相对比例,进而揭示区域气候条件变化[62]. 与湖泊不同的是,泥炭藓湿地中植物群落往往是非维管束植物(泥炭藓、地衣等)和维管束植物(灌木、禾本科和草本科植物等)共存. 水热条件适宜时,苔藓植物大量发育从而与维管束植物形成营养竞争,一定程度上抑制维管束植物的生长. 而非维管束植物的C/N比值甚至高于维管束植物[63]. 因此,当气候条件较为湿润时,泥炭地植物群落大量发育,加之陆源有机物质输入较多,泥炭中C/N比值较高;当气候条件较为干旱时,由流水汇入泥炭地中的陆源有机物质较少,C/N比值较低.
Al和Ti属于不易迁移元素,在化学风化过程中一般会保留在原地,常被用于指示沉积环境中陆源碎屑物质的输入[64-65]. 陆源物质主要通过风力、地表径流等方式进入泥炭地,在很大程度上受气候条件影响. 尤其是Ti元素,更易在钛铁矿、钛磁铁矿等粗矿物中富集,其含量变化主要受物理风化作用及区域降水量变化的影响[56, 66-67]. 因此,元素Al、Ti及两者比值可以用来指示流域气候条件的变化[68]. 大九湖泥炭地周围森林覆盖度高,风力对颗粒物的传输作用并不明显,而湿润气候条件下风化作用及径流搬运可能是导致粗颗粒物进入湿地的重要原因[69]. 然而,泥炭地植物生物量大且类型多样. 当气候条件湿润时,泥炭植被发育良好,泥炭有机质含量增加,即内源沉积物比例增加,而外源碎屑物质输入量虽然有所增加,但在泥炭组成中所占比例却有所下降,因此指示陆源碎屑输入的Ti和Al含量下降;而冷干气候下,内源沉积物将大大减少,流域植被覆盖度降低,径流输入陆源碎屑物质的比例相应升高,沉积物中Ti和Al含量有所增加,Ti/Al比值偏高.
综上所述,泥炭沉积物中TC、TN与Al、Ti含量变化揭示了相反的气候变化过程,即气候条件湿润时,泥炭中TC、TN含量及其C/N比值升高,而Ti、Al含量及两者比值下降;反之,当气候较为干旱时,泥炭中TC、TN含量降低,C/N比值下降,而Ti、Al含量增加,Ti/Al比值较高.
3.3 大九湖泥炭地干湿变化历史及摇蚊种群的响应模拟的区域气候数据及环境代用指标变化序列(图 6)表明,自1650s以来,大九湖泥炭沼泽经历了复杂的地表干湿变化过程,水生生物种群对其生境变化做出了良好的响应.
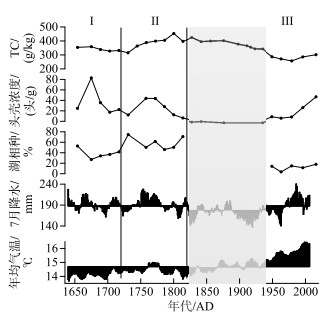
|
图 6 模拟的区域气候数据及环境代用指标变化序列 Fig.6 Simulated regional climate data and changes in environmental proxies |
气候数据表明,1650s-1720s期间中国东部地区年均气温为整个历史时期最低,7月降水量分布较为均匀,相对整个历史时期均值略微偏高,整体略湿润. 泥炭中偏低的Ti/Al比值也指示了该时期略湿的环境条件. 对于东亚季风区亚热带山间盆地泥炭沼泽而言,相对湿润的气候条件利于泥炭的积累,且外源物质输入比例略高,故而泥炭岩芯中该阶段有机碳及C/N比值均处于相对较高的水平. 冷湿的气候条件下,地表有效湿度(降水量-蒸发量)较大,摇蚊丰度较高,湖相种如T. mendax-type、Parametriocnemus和P. nudisquama-type等频繁出现. 干湿交替的环境也使得地表不断处于干旱-淹水交替状态,故而陆生-半陆生及湖相种交替出现或共存,造就了该时期的高摇蚊种群多样性. 1720s-1820s期间,全年气温基本仍处于均值以下,但平均降水量较前一阶段进一步增加,湿润的气候条件导致泥炭Ti/Al比值自1720s后持续降低至1810s前后达到最低值,之后伴随降水量下降有所回升. 泥炭在该阶段持续积累,总碳和总氮含量均表现出明显的上升趋势,并于1800s前后达到岩芯最高值. 较高的地表湿度有利于摇蚊这一水生生物种群的生长,在摇蚊丰度上即表现为头壳浓度高值期与夏季降水最丰富期(1740s-1780s)保持一致. 摇蚊组成上,优势种优势地位较前一阶段更为突出,尽管可能指示氧化环境的Psilometriocnemus平均相对丰度略有增加,但典型湖相种P. bergi-type和喜静水、浅水环境属种Tribelos丰度的增加更为显著,冷水狭温性属种Neozavrelia也相对丰富,而陆生-半陆生摇蚊Pseudosmittia含量为岩芯最低值. 摇蚊多样性较干湿交替更为频繁的组合带I时略有下降,但依然保持较丰富的属种组成.
1820s-1970s年间(尤其在1890s-1930s年间)中国东部地区7月降水量明显低于其他历史时期,且自1860s后区域内增温趋势非常明显. Ti/Al比值在该阶段逐渐升高也指示了该时期偏干气候条件的持续. 干热的气候条件一方面使泥炭加速分解,泥炭中碳、氮含量及C/N比值迅速降低. 另一方面,高蒸发量、低降水量导致地表有效湿度显著降低,不利于水生生物的生长,这可能是1820s-1940s年间摇蚊种群表现出极低生物量的主要诱因. 同一岩芯沉积物硅藻组合序列表明,10~27.5 cm(1820s-1940s)处好氧陆地旱生硅藻Hanzschia amphioxys和Luticola mutica大量生长[10],说明暖干的气候条件导致该时期泥炭加速分解,生物群落组成和结构发生剧烈变化. 1970s初期开始,研究区内夏季降水量开始逐渐回升甚至于1980s中后期达到整个历史时期峰值,尽管气温继续升高,但地表干旱状况有所缓解,泥炭分解速率下降,沉积岩芯中碳含量于1980s后开始持续增加. 摇蚊种群生物量在经历前一时期的极低值后,也于1940s后开始逐渐回升. 然而,该时期全年均温亦处于高值区,高降水量、高蒸发量导致地表有效湿度虽较1820s-1940s阶段明显增加,但可能仍低于1820s前的湿度水平,故沉积物中指示地表有效湿度降低的Psilometriocnemus含量较1820s前有较大提升,陆生-半陆生属种Pseudosmittia含量达到整个岩芯最高,植被附生种Tribelos含量也于1940s后期开始逐渐增加. 由于指示低地表湿度摇蚊属种(Psilometriocnemus和Pseudosmittia)的绝对优势地位,该时期湖相属种丰度及摇蚊多样性都处于低值期,泥炭沼泽地表环境及生物群落组成较1820s前均已发生明显改变. PCA属种-样点双轴图中,多数湖沼相属种集中于第1轴右侧,其他陆生-半陆生摇蚊则分布于左侧,且不同时期样点在图中分区而居,也印证了摇蚊种群对泥炭地表湿度的高度敏感性. 综上所述,1650s以来,大九湖泥炭沼泽地表有效湿度经历了略湿润-湿润-干旱-略湿润的复杂变化过程,而摇蚊种群则敏感响应于区域气候驱动的泥炭地表有效湿度的改变.
4 结论区域气候及大九湖泥炭岩芯记录表明,1650s以来中国东部地区气候变化导致泥炭地表湿度先后经历了略湿润-湿润-干旱-略湿润的复杂变化过程,泥炭摇蚊种群对此做出了良好的响应. 1650s-1720s年间,冷湿的气候条件使得泥炭地表有效湿度较高,摇蚊丰度较高,且该时期干湿交替的气候条件有利于陆生-半陆生及湖相种交替出现或共存,摇蚊多样性为历史时期最高期;1720s-1820s年间,区域降水量较前一阶段进一步增加,沉积物碳快速积累,较高的地表湿度有利于水生生物种群的生长,湖相种(P. bergi-type和Tribelos)丰度增加明显,冷水狭温性属种Neozavrelia也相对丰富,摇蚊多样性较前一阶段有所下降但仍保持较丰富的属种组成;干热的气候条件导致泥炭地表湿度大为降低,碳分解加速的同时,也可能很大程度上诱发了1820s-1940s年间摇蚊极低的生物量;自1940s后,摇蚊丰富度及多样性均处于历史低值期,指示低地表湿度的摇蚊属种(Psilometriocnemus和Pseudosmittia)优势地位显著,这说明尽管降水量自1970s后明显增加,但增温引起的高蒸发量导致泥炭地表湿度远低于1820s前,泥炭沼泽地表环境及生物群落组成较之前均已发生明显变化. 本研究是泥炭地摇蚊种群对区域环境及气候变化响应研究的探索性尝试,为未来将亚化石摇蚊头壳作为代用生物指标用于泥炭地环境演化及区域气候恢复奠定了基础,这将有利于古气候数据解译的多角度融合分析及区域气候重建资料的整合,进而为全球气候变化研究提供更多、更全面的基础数据. 然而,目前国内外泥炭地摇蚊生态属性可用资料仍异常匮乏,对泥炭环境中特定摇蚊生态属性的了解尚不甚明确,未来仍需要广泛的泥炭地摇蚊种群数据调查及大量的现代生态学分析工作,从而推动泥炭地摇蚊古生态研究发展.
5 附录附表Ⅰ见电子版(DOI: 10.18307/2022.0326).

|
附图Ⅰ 1952年以来宜昌站和模拟的中国东部地区年均气温(a)和7月降水量(b) FigureS1 Annual mean temperature (a) and July rainfall (b) observed in Yichang Meteorological Station and simulated for eastern China since 1952 |
致谢: 感谢夏威岚、刘一兰、朱育新老师在样品分析测试过程中给予的帮助.
| [1] |
Huang XY, Liu XW, Liu JL et al. Iron-bound organic carbon and their determinants in peatlands of China. Geoderma, 2021, 391: 114974. DOI:10.1016/j.geoderma.2021.114974 |
| [2] |
Yu ZC, Loisel J, Brosseau DP et al. Global peatland dynamics since the Last Glacial Maximum. Geophysical Research Letters, 2010, 37(13): L13402. DOI:10.1029/2010GL043584 |
| [3] |
Xi Y, Peng SS, Ciais P et al. Future impacts of climate change on inland Ramsar wetlands. Nature Climate Change, 2021, 11(1): 45-51. DOI:10.1038/s41558-020-00942-2 |
| [4] |
Cai X ed. Peat geoscience. Beijing: Geological Publishing House, 1990. [柴岫. 泥炭地学. 北京: 地质出版社, 1990.]
|
| [5] |
Ma CM, Zhu C, Zheng CG et al. Study on geochemical record of high resolution climate change in peat in Dajiuhu of Shennongjia since Late Ice Age. Chinese Science Bulletin, 2008, 53(z1): 26-37. [马春梅, 朱诚, 郑朝贵等. 晚冰期以来神农架大九湖泥炭高分辨率气候变化的地球化学记录研究. 科学通报, 2008, 53(z1): 26-37. DOI:10.3321/j.issn:0023-074X.2008.z1.003] |
| [6] |
Chambers FM, Charman DJ. Holocene environmental change: Contributions from the peatland archive. The Holocene, 2004, 14(1): 1-6. DOI:10.1191/0959683604hl684ed |
| [7] |
Hájková P, Bojková J, Fránková M et al. Disentangling the effects of water chemistry and substratum structure on moss-dwelling unicellular and multicellular micro-organisms in spring-fens. Journal of Limnology, 2011, 70(1s): 54. DOI:10.4081/jlimnol.2011.s1.54 |
| [8] |
Mitchell EAD, Payne RJ, van der Knaap WO et al. The performance of single- and multi-proxy transfer functions (testate amoebae, bryophytes, vascular plants) for reconstructing mire surface wetness and pH. Quaternary Research, 2013, 79(1): 6-13. DOI:10.1016/j.yqres.2012.08.004 |
| [9] |
Bai X, Pią tek J, Wołowski K et al. Chrysophyte stomatocysts and their associations with environmental variables in three peatlands in the subtropical monsoon climate zone of China. Ecological Indicators, 2021, 121: 107125. DOI:10.1016/j.ecolind.2020.107125 |
| [10] |
Chen X, McGowan S, Qin B et al. Effects of climate change on a subtropical montane peatland over the last two centuries: Evidence from diatom records. The Holocene, 2021, 31(7): 1112-1123. DOI:10.1177/09596836211003220 |
| [11] |
Cao YM. Subfossil chironomid assemblages and the related environmental factors in subalpine mires, western Hubei Province. Chinese Journal of Ecology, 2016, 35(5): 1268-1276. [曹艳敏. 鄂西亚高山泥炭地摇蚊种群组成及其影响因子. 生态学杂志, 2016, 35(5): 1268-1276. DOI:10.13292/j.1000-4890.201605.030] |
| [12] |
Walker IR, Cwynar LC. Midges and palaeotemperature reconstruction—the North American experience. Quaternary Science Reviews, 2006, 25(15/16): 1911-1925. DOI:10.1016/j.quascirev.2006.01.014 |
| [13] |
Langdon PG, Caseldine CJ, Croudace IW et al. A chironomid-based reconstruction of summer temperatures in NW Iceland since AD 1650. Quaternary Research, 2011, 75(3): 451-460. DOI:10.1016/j.yqres.2010.11.007 |
| [14] |
van Asch N, Lutz AF, Duijkers MCH et al. Rapid climate change during the Weichselian Lateglacial in Ireland: Chironomid-inferred summer temperatures from Fiddaun, Co. Galway. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 315/316: 1-11. DOI:10.1016/j.palaeo.2011.11.003 |
| [15] |
Zhang EL, Chang J, Cao YM et al. Holocene high-resolution quantitative summer temperature reconstruction based on subfossil chironomids from the southeast margin of the Qinghai-Tibetan Plateau. Quaternary Science Reviews, 2017, 165: 1-12. DOI:10.1016/j.quascirev.2017.04.008 |
| [16] |
Zheng T, Cao YM, Peng J et al. Effects of climate warming and nitrogen deposition on subtropical montane ponds (central China) over the last two centuries: Evidence from subfossil chironomids. Environmental Pollution, 2020, 262: 114256. DOI:10.1016/j.envpol.2020.114256 |
| [17] |
Nazarova L, Bleibtreu A, Hoff U et al. Changes in temperature and water depth of a small mountain lake during the past 3000 years in Central Kamchatka reflected by a chironomid record. Quaternary International, 2017, 447: 46-58. DOI:10.1016/j.quaint.2016.10.008 |
| [18] |
Belyakov VP, Anufriieva EV, Bazhora AI et al. Effect of salinity on chironomid larvae (Diptera, Chironomidae) in Hypersaline Lakes of Crimea. Biology Bulletin, 2018, 45(10): 1211-1218. DOI:10.1134/s1062359018100059 |
| [19] |
Engels S, Cwynar LC, Rees ABH et al. Chironomid-based water depth reconstructions: An independent evaluation of site-specific and local inference models. Journal of Paleolimnology, 2012, 48(4): 693-709. DOI:10.1007/s10933-012-9638-x |
| [20] |
Cao YM, Langdon P, Chen X et al. Regime shifts in shallow lake ecosystems along an urban-rural gradient in central China. Science of the Total Environment, 2020, 733: 139309. DOI:10.1016/j.scitotenv.2020.139309 |
| [21] |
Płóciennik M, Self A, Birks HJB et al. Chironomidae (Insecta: Diptera) succession in Żabieniec bog and its palaeo-lake (central Poland) through the Late Weichselian and Holocene. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 307(1/2/3/4): 150-167. DOI:10.1016/j.palaeo.2011.05.010 |
| [22] |
Słowiński M, Marcisz K, Płóciennik M et al. Drought as a stress driver of ecological changes in peatland—A palaeoecological study of peatland development between 3500 BCE and 200 BCE in central Poland. Palaeogeography, Palaeoclimatology, Palaeoecology, 2016, 461: 272-291. DOI:10.1016/j.palaeo.2016.08.038 |
| [23] |
Diaconu AC, Tóth M, Lamentowicz M et al. How warm? How wet? Hydroclimate reconstruction of the past 7500 years in northern Carpathians, Romania. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 482: 1-12. DOI:10.1016/j.palaeo.2017.05.007 |
| [24] |
Sun J, Ma CM, Cao XY et al. Quantitative precipitation reconstruction in the east-central monsoonal China since the late glacial period. Quaternary International, 2019, 521: 175-184. DOI:10.1016/j.quaint.2019.05.033 |
| [25] |
Zhao Y, Hölzer A, Yu ZC. Late Holocene natural and human-induced environmental change reconstructed from peat records in eastern central China. Radiocarbon, 2007, 49(2): 789-798. DOI:10.1017/s0033822200042661 |
| [26] |
Huang XY, Meyers PA, Jia CL et al. Paleotemperature variability in central China during the last 13 ka recorded by a novel microbial lipid proxy in the Dajiuhu peat deposit. The Holocene, 2013, 23(8): 1123-1129. DOI:10.1177/0959683613483617 |
| [27] |
Hong B. High resolution stable isotope record of the holocene climatic variation from peat cellulose, Dajiu Lake, Shennongjia, Hubei Province, China[Dissertation]. Guiyang: Institute of Geochemistry, Chinese Academy of Sciences, 2009. [洪冰. 中国中部全新世气候变化的泥炭同位素记录——以湖北神农架大九湖为例[学位论文]. 贵阳: 中国科学院地球化学研究所, 2009. ]
|
| [28] |
Liu HY, Gu YS, Huang XY et al. A 13, 000-year peatland palaeohydrological response to the ENSO-related Asian monsoon precipitation changes in the middle Yangtze Valley. Quaternary Science Reviews, 2019, 212: 80-91. DOI:10.1016/j.quascirev.2019.03.034 |
| [29] |
Zhang WC, Yan H, Dodson J et al. The 9.2 ka event in Asian summer monsoon area: The strongest millennial scale collapse of the monsoon during the Holocene. Climate Dynamics, 2018, 50(7/8): 2767-2782. DOI:10.1007/s00382-017-3770-2 |
| [30] |
Huang XY, Meyers PA. Assessing paleohydrologic controls on the hydrogen isotope compositions of leaf wax nalkanes in Chinese peat deposits. Palaeogeography, Palaeoclimatology, Palaeoecology, 2019, 516: 354-363. DOI:10.1016/j.palaeo.2018.12.017 |
| [31] |
Brooks SJ, Langdon PG, Heiri O eds. The identification and use of Palaearctic Chironomidae larvae in palaeoecology. London: Quaternary Research Association, 2007.
|
| [32] |
Rieradevall M, Brooks SJ. An identification guide to subfossil Tanypodinae larvae (Insecta: Diptera based on cephalic setation. Journal of Paleolimnology, 2001, 25(1): 81-99. DOI:10.1023/A:1008185517959 |
| [33] |
Epler JH. Identification manual for the larval Chironomidae (Diptera) of North and South Carolina. America: North Carolina Department of Environment and Natural Resources Division of Water Quality, 2001.
|
| [34] |
Tang HQ. Biosystematics of larvae of Chironomidae from China (Diptera: Chironomidae)[Dissertation]. Tianjin: Nankai University, 2006. [唐红渠. 中国摇蚊科幼虫生物系统学研究(双翅目: 摇蚊科)[学位论文]. 天津: 南开大学, 2006. ]
|
| [35] |
Liu J, Storch H, Chen X et al. Simulated and reconstructed winter temperature in the Eastern China during the last millennium. Chinese Science Bulletin, 2005, 50(24): 2872-2877. DOI:10.1360/982004-856 |
| [36] |
Shannon CE, Weaver W eds. The mathematical theory of communication. Urbana: The University of Illinois Press, 1963.
|
| [37] |
Grimm EC. CONISS: a FORTRAN 77 program for stratigraphically constrained cluster analysis by the method of incremental sum of squares. Computers & Geosciences, 1987, 13(1): 13-35. DOI:10.1016/0098-3004(87)90022-7 |
| [38] |
Smilauer P, Lepš J eds. Multivariate analysis ofecological data using CANOCO 5. Cambridge: Cambridge University Press, 2014. DOI:10.1017/cbo9781139627061
|
| [39] |
Eggermont H, Verschuren D. CHIRONOMID RECORDS | Africa. Encyclopedia of Quaternary Science. Amsterdam: Elsevier, 2013: 361-372. DOI: 10.1016/b978-0-444-53643-3.00272-7.
|
| [40] |
Verschuren D, Dumont HJ, Armengol-Diaz J. Armengol-Diaz J. Utilisation de cladocères et chironomides fossiles pour réconstruire I'évolution hydrologique de leur habitat marécageux dans la tourbière de Kashiru (Burundi) depuis 40.000 ans BP. Paleoecology of Africa and the Surrounding Islands, 1996, 24: 109-120. |
| [41] |
Carroll MJ, Heinemeyer A, Pearce-Higgins JW et al. Hydrologically driven ecosystem processes determine the distribution and persistence of ecosystem-specialist predators under climate change. Nature Communications, 2015, 6: 7851. DOI:10.1038/ncomms8851 |
| [42] |
Posa MRC, Wijedasa LS, Corlett RT. Biodiversity and conservation of tropical peat swamp forests. BioScience, 2011, 61(1): 49-57. DOI:10.1525/bio.2011.61.1.10 |
| [43] |
Spitzer K, Danks HV. Insect biodiversity of boreal peat bogs. Annual Review of Entomology, 2006, 51(1): 137-161. DOI:10.1146/annurev.ento.51.110104.151036 |
| [44] |
Downie IS, Coulson JC, Foster GN et al. Distribution of aquatic macroinvertebrates within peatland pool complexes in the Flow Country, Scotland. Hydrobiologia, 1998, 377(1/2/3): 95-105. DOI:10.1023/A:1003267022820 |
| [45] |
Standen V, Rees D, Twiss S. A palmate newt population in acid bog pools in the Sutherland Flows of North Scotland. The Glasgow Naturalist, 1998, 23(3): 35-39. |
| [46] |
Weller MO, Bossart JL. Insect community diversity tracks degradation and recovery of a wastewater assimilation marsh in southeast Louisiana. Wetlands, 2017, 37(4): 661-673. DOI:10.1007/s13157-017-0897-1 |
| [47] |
Cao YM, Langdon PG, Yan Y et al. Chironomid communities from subalpine peatlands in subtropical China as indicators of environmental change. Journal of Paleolimnology, 2019, 62(2): 165-179. DOI:10.1007/s10933-019-00081-5 |
| [48] |
Brodin YW. The postglacial history of Lake Flarken, southern Sweden, interpreted from subfossil insect remains. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 1986, 71(3): 371-432. DOI:10.1002/iroh.19860710313 |
| [49] |
Strenzke K. Morphologie und Ökologie der terrestrischen Chironnomiden. Archiv für Hydrobiologie (Supplement-band), 1950, 18: 207-414. |
| [50] |
Ekrem T. A redescription ofNeozavrelia cuneipennis (Edwards) comb. nov., with a checklist of Neozavrelia species of the world (diptera: Chironomidae). Zootaxa, 2006, 1153(1): 1. DOI:10.11646/zootaxa.1153.1.1 |
| [51] |
Brodersen KP, Odgaard BV, Vestergaard O et al. Chironomid stratigraphy in the shallow and eutrophic Lake Søbygaard, Denmark: Chironomid-macrophyte co-occurrence. Freshwater Biology, 2001, 46(2): 253-267. DOI:10.1046/j.1365-2427.2001.00652.x |
| [52] |
Pinder LCV, Reiss F. The larvae of Chironominae (Diptera: Chironomidae) of the holarctic region-keys and diagnoses. In: Wiederholm T ed. Chironomidae of the Holarctic region. Stockholm: Publishing House of the Swedish Research Councils, 1983: 293-435.
|
| [53] |
Saether OA, Sublette JE eds. A review of the genera Doithrix n. gen., Georthocladius Strenzke, Parachaetocladius Wülker and Pseudorthocladius Goetghebuer (Diptera: Chironomidae, Orthocladiinae). Sweden: Scandinavian Society of Entomology, 1983: 1-100.
|
| [54] |
Zhang EL, Cao YM, Langdon P et al. Alternate trajectories in historic trophic change from two lakes in the same catchment, Huayang Basin, middle reach of Yangtze River, China. Journal of Paleolimnology, 2012, 48(2): 367-381. DOI:10.1007/s10933-012-9608-3 |
| [55] |
Odume ON, Palmer CG, Arimoro FO et al. Chironomid assemblage structure and morphological response to pollution in an effluent-impacted river, Eastern Cape, South Africa. Ecological Indicators, 2016, 67: 391-402. DOI:10.1016/j.ecolind.2016.03.001 |
| [56] |
Li NN. Response of vegetation dynamics to climate change since the younger Dryas in the Longgang region, northeastern China[Dissertation]. Changchun: Northeast Normal University, 2020. [李楠楠. 中国东北龙岗地区新仙女木事件以来植被动态对气候变化的响应[学位论文]. 长春: 东北师范大学, 2020. ]
|
| [57] |
Cheng SG, Xiao H, Huang T et al. Paleoclimatic significances of peat humification in Hani of northeast China and regional comparison. Journal of Earth Sciences and Environment, 2014, 36(2): 92-102. [程胜高, 肖河, 黄庭等. 东北哈尼泥炭腐殖化度古气候意义及区域对比. 地球科学与环境学报, 2014, 36(2): 92-102. DOI:10.3969/j.issn.1672-6561.2014.02.013] |
| [58] |
Bai GR, Wang SZ, Gao J et al. Liquid-heat conditions and microbic decomposition on the forming of turf deposits. Journal of Shanghai Teachers University, 2004, 33(3): 91-97. [白光润, 王淑珍, 高峻等. 中国亚热带、热带泥炭形成的水热条件与微生物分解相关性. 上海师范大学学报: 自然科学版, 2004, 33(3): 91-97. DOI:10.3969/j.issn.1000-5137.2004.03.018] |
| [59] |
Zhang H. The study of climate recorded since nearly 1500 aBP from a peat core located in northern mountain area of Fujian province[Dissertation]. Fuzhou: Fujian Normal University, 2013. [张辉. 近1500a来福建北部山地泥炭记录的气候环境演变研究[学位论文]. 福州: 福建师范大学, 2013. ]
|
| [60] |
Meyers PA, Lallier-Vergés E. Lacustrine sedimentary organic matter records of late quaternary paleoclimates. Journal of Paleolimnology, 1999, 21(3): 345-372. DOI:10.1023/A:1008073732192 |
| [61] |
Krishnamurthy RV, Bhattacharya SK, Kusumgar S. Palaeoclimatic changes deduced from13C/12C and C/N ratios of Karewa lake sediments, India. Nature, 1986, 323(6084): 150-152. DOI:10.1038/323150a0 |
| [62] |
Zhu Y, Chen Y, Zhao ZJ et al. Record of environmental change by α-Cellulose δ13C of sphagnum peat at Shennongjia, 4000-1000 a BP. Chinese Science Bulletin, 2009, 54(20): 3108-3116. [朱芸, 陈晔, 赵志军等. 神农架大九湖泥炭藓泥炭α-纤维素δ13C记录的1000~4000a BP间环境变化. 科学通报, 2009, 54(20): 3108-3116.] |
| [63] |
Wu PP, Shi FX, Wang XW et al. Leaf C∶N stoichiometry of vascular and non-vascular plants in an ombrotrophic peatland in the Daxing'an Mountains. Chinese Journal of Applied and Environmental Biology, 2020, 26(5): 1176-1183. [吴盼盼, 石福习, 王宪伟等. 大兴安岭贫营养泥炭地维管束和非维管束植物叶片碳氮磷化学计量学特征. 应用与环境生物学报, 2020, 26(5): 1176-1183.] |
| [64] |
Zhang WC. Peatland sediments and Asian summer monsoon evolution in Dajiuhu Basin since the Last Glacial Maximum[Dissertation]. Xi'an: Institute of Earth Environment, Chinese Academy of Sciences, 2017. [张文超. 末次冰盛期以来大九湖盆地泥炭沉积与亚洲夏季风演化[学位论文]. 西安: 中国科学院地球环境研究所, 2017. ]
|
| [65] |
Nesbitt HW, Young GM. Early Proterozoic climates and plate motions inferred from major element chemistry of lutites. Nature, 1982, 299(5885): 715-717. DOI:10.1038/299715a0 |
| [66] |
Deng YK, Li L, Ma CM et al. The geochemical records and paleoclimate significance in peat from the Yuhua mountain in Jiangxi Province since the last two millennia. Journal of Stratigraphy, 2019, 43(4): 352-363. [邓云凯, 李亮, 马春梅等. 江西玉华山泥炭2000 a BP以来的元素地球化学记录及其气候意义. 地层学杂志, 2019, 43(4): 352-363.] |
| [67] |
Martinez-Ruiz F, Kastner M, Gallego-Torres D et al. Paleoclimate and paleoceanography over the past 20, 000 yr in the Mediterranean Sea Basins as indicated by sediment elemental proxies. Quaternary Science Reviews, 2015, 107: 25-46. DOI:10.1016/j.quascirev.2014.09.018 |
| [68] |
Lu AQ. Holocene climate change recorded from northern Beibu Gulf[Dissertation]. Shanghai: East China Normal University, 2011. [陆岸青. 北部湾北部记录的全世气候变化[学位论文]. 上海: 华东师范大学, 2011. ]
|
| [69] |
Wu XD, Shen J, Wang Y. Holocene paleoenvironmental evolution of the Huguangyan Maar Lake. Marine Geology & Quaternary Geology, 2011, 31(4): 155-162. [吴旭东, 沈吉, 汪勇. 湖光岩玛珥湖沉积物反映的全新世以来古环境演化. 海洋地质与第四纪地质, 2011, 31(4): 155-162. DOI:10.3724/SP.J.1140.2011.04155] |
 2022, Vol. 34
2022, Vol. 34 

