(2: 江西鄱阳湖湿地保护与恢复国家长期科研基地, 江西鄱阳湖湿地生态系统国家定位观测研究站, 南昌 330031)
(3: 南昌大学鄱阳湖环境与资源利用教育部重点实验室, 南昌 330031)
(4: 江西生态文明研究院, 南昌大学资源环境与化工学院, 南昌 330031)
(5: 复旦大学生命科学学院生物多样性与生态工程教育部重点实验室, 上海 200438)
(2: Jiangxi Poyang Lake Wetland Conservation and Restoration National Permanent Scientific Research Base, National Ecosystem Research Station of Jiangxi Poyang Lake Wetland, Nanchang 330031, P.R.China)
(3: Key Laboratory of Poyang Lake Environment and Resource Utilization, Ministry of Education, Nanchang University, Nanchang 330031, P.R.China)
(4: Jiangxi Institute of Ecological Civilization, School of Resources Environmental and Chemical Engineering, Nanchang University, Nanchang 330031, P.R.China)
(5: Ministry of Education Key Laboratory for Biodiversity Science and Ecological Engineering, School of Life Sciences, Fudan University, Shanghai 200438, P.R.China)
土壤胞外酶是一类主要来源于土壤微生物的生物催化剂[1]. 它们能够将大分子有机质降解为小分子有机物和无机物,同时释放其中的能量以及氮、磷等元素供给植物或微生物利用,从而促进生态系统养分循环和能量流动[2]. 因此,土壤胞外酶在土壤生物地球化学循环中扮演着重要的角色,其活性可以作为土壤中碳、氮、磷等元素转化速率和供给能力的良好指标[3]. 然而,研究表明参与碳、氮、磷循环过程的土壤胞外酶对环境变化的响应程度并不相同[4]. 土壤微生物会根据外界环境的变化,改变碳、氮、磷循环相关胞外酶的分泌量,优化其资源获取策略[5]. Sinsabaugh等[6]和Rosinger等[7]指出利用参与土壤碳氮磷循环过程的胞外酶活性的比值,即土壤碳、氮、磷循环相关酶活性的化学计量比,可以反映土壤微生物代谢的营养元素限制状况,并评估土壤微生物的功能动态. 考虑到它们在土壤有机碳与养分循环中的重要意义,土壤胞外酶活性及其化学计量比目前已经成为生态学研究的热点之一.
洪泛平原是指被河水或湖水以及直接降雨或地下水周期性淹没的地区[8],在景观尺度上发挥着净化水质以及固碳释氧等重要功能[9]. 作为联系微生物和外界环境的关键因子,土壤胞外酶对洪泛平原生态系统功能的稳定和维持具有不可或缺的作用,可直接影响洪泛平原河流(湖泊)系统的生物地球化学周转过程. 高程作为一个综合性指标,往往是影响洪泛平原土壤胞外酶活性的关键参数[10]. 例如,Wilson等[11]通过对澳大利亚奥文斯河洪泛平原土壤研究发现,随着高程增加,土壤α-葡萄糖苷酶、β-葡萄糖苷酶和木聚糖酶活性逐渐减小;Zhang等[12]的研究结果则表明新疆伊犁河谷蔗糖酶和淀粉酶活性与高程呈显著的正相关关系. 在高程梯度上,洪泛平原的水文节律、植物群落、微生物结构和土壤基质等都将发生显著变化,从而共同作用于土壤胞外酶活性[13-14]. 然而,有关洪泛平原土壤碳氮磷循环相关酶的化学计量特征随高程的变化规律却较少受到关注,其中的影响机制也不清楚. 探究洪泛平原土壤碳、氮、磷胞外酶化学计量特征对高程梯度响应的差异有助于我们进一步了解湖泊生态系统土壤有机碳和土壤养分生物地球化学过程的特点,为科学保护和管理洪泛平原湿地提供科学依据.
鄱阳湖位于江西省北部,是中国第一大淡水湖. 在亚热带季风气候的影响下,鄱阳湖在丰枯水季节表现出巨大的水位差异,形成大片的洪泛平原湿地即洲滩湿地[15]. 统计表明,鄱阳湖的洲滩湿地面积超过了全湖正常水位总面积的80%[16]. 明确鄱阳湖洲滩湿地的土壤胞外酶活性和化学计量比的变异规律是充分认识鄱阳湖湿地土壤碳、氮、磷生物地球化学过程的基础. 因此,本研究依托长期监测样地,综合高程、植物、土壤理化性质和酶活性等数据,阐明了鄱阳湖典型洲滩湿地土壤碳氮磷循环相关酶活性和化学计量比随高程的变化特征和影响机制. 本研究拟解决的科学问题为:(1)鄱阳湖洲滩湿地土壤碳、氮、磷循环相关酶活性和化学计量比在不同高程是否存在差异?(2)在高程梯度上鄱阳湖洲滩湿地土壤碳、氮、磷循环相关酶活性和碳氮、碳磷、氮磷酶化学计量比的影响机制分别是什么?
1 材料和方法 1.1 研究区概况研究区位于鄱阳湖南矶湿地国家级自然保护区(28°52′~29°7′N,116°10′~116°24′E),该地区属于亚热带季风气候,年平均气温为17.9℃,年平均降水量为1643 mm. 作为鄱阳湖湿地的重要组成部分,该保护区的洲滩湿地具有明显的季节性水位波动特征,在丰水季(5—9月),洲滩湿地被完全淹没并与主湖相连;而在枯水季(10—次年4月),这些洲滩又重新露出. 在退水期,鄱阳湖洲滩湿地主要的植物种为灰化苔草(Carex cinerascens)、南荻(Triarrhena lutarioriparia)、虉草(Phalaris arundinacea)和芦苇(Phragmites australis)等. 苔草群落是鄱阳湖洲滩湿地面积最大、分布最广的植物群落,对鄱阳湖湿地生态系统的能量流动和物质循环过程具有重要影响[17].
1.2 样地设置及样品采集本研究依托位于鄱阳湖南矶湿地国家级自然保护区的一处长期监测样地. 该样地建立于2017年,沿高程梯度选取6条平行于湖岸的样线(S1~S6)(图 1). 每条样线长250 m,相邻样线之间间隔约为200 m. 从S1样线到S6样线高程逐渐升高. 在每条样线上建立了6个1 m×1 m的样方,相邻样方的间隔约为50 m. 采用GPS仪记录每个样方的地理坐标,然后根据样方坐标查询江西省测绘局的鄱阳湖湿地2 m分辨率地形图来获取其高程(吴淞高程). 该样地地势平坦,是鄱阳湖苔草洲滩湿地的典型分布区域. 样地内最高和最低样线的距离长达1 km,各样方高程范围为13.80~15.01 m,全面覆盖了鄱阳湖苔草洲滩湿地的主要分布高程,可以有效反映该湿地随高程的变化趋势[16, 18].
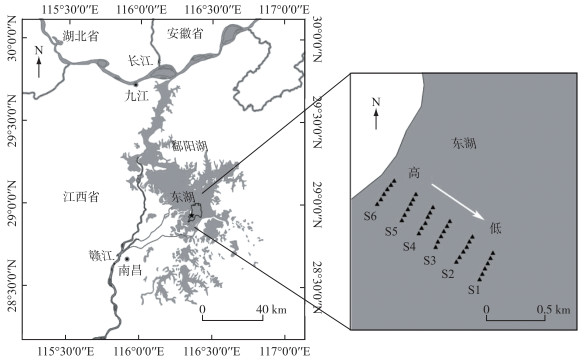
|
图 1 鄱阳湖苔草洲滩湿地样线分布 Fig.1 The location of sampling sites at the Carex lakeshore beach of Lake Poyang |
在2019年11月秋季生长期进行实地调查,首先记录下各个样方中的植物物种数和每个物种的个体数及总个体数. 然后使用采割法收集样方内所有的地上植物. 使用直径为10 cm的根钻收集3个深度为0~20 cm的根芯,并在流水中清洗根芯以获得地下根系样品. 最后,用直径为7 cm的土钻,在每个样方中沿对角线采集3个深度为0~10 cm的土壤样品,均匀地混合成一个复合的新鲜土壤样本.
1.3 植被特征和土壤理化性质测定将地上和地下植物样品放入70℃烘箱中烘48 h以获得植物干重. 本研究考虑的植被特征包括植物物种丰富度、Shannon-Wiener指数、地上生物量和地下生物量4个指标. 植物物种丰富度以单位面积物种数来评估. Shannon-Wiener指数用单位面积每个植物物种的个体数和总个体数计算. 地上生物量和地下生物量分别以单位面积地上和地下的植物干重来表示[18].
土壤样品过2 mm筛去除植物凋落物、细根和碎石后,分为两部分,分别在4℃和室温下保存. 土壤理化性质的测定指标包括土壤含水量、黏粒含量、pH、可溶性有机碳、氨态氮、硝态氮、总有机碳、总氮和总磷. 土壤含水量和黏粒含量分别采用烘干恒量法和比重计速测法测定. pH用电位法(土水比为1∶2.5)测定. 可溶性有机碳采用超纯水(土水比为1∶5)浸提,用总有机碳分析仪(Elementar,Hanau,德国)测定. 氨态氮和硝态氮用1 mol/L的KCl溶液浸提(土水比为1∶5),采用连续流动分析仪(Skalar san++,Skalar,荷兰)测定. 总有机碳含量采用重铬酸钾氧化法测定. 总氮含量采用凯氏定氮法测定. 总磷含量采用紫外分光光度计,通过钼蓝比色法测定. 土壤碳氮比、碳磷比和氮磷比分别代表总有机碳与总氮的比值,总有机碳与总磷的比值以及总氮与总磷的比值.
1.4 土壤胞外酶活性测定参考以往文献,采用微孔板荧光法测定参与土壤碳、氮、磷循环过程的7种关键水解酶活性,包括与碳循环相关的α-葡萄糖苷酶(AG)、β-葡萄糖苷酶(BG)、木聚糖酶(XYL)和纤维二糖水解酶(CBH),它们分别参与了纤维素分解的不同步骤,代表了土壤中不同碳源的分解能力;与氮循环相关的N-乙酰氨基葡萄糖苷酶(NAG)和亮氨酸氨基肽酶(LAP),它们参与了土壤主要含氮有机物几丁质和蛋白质的分解;以及与磷循环相关的磷酸酶(PHOS),它参与了磷酸酯的降解[19-20]. 具体操作步骤如下:称取相当于干重2.75 g左右的新鲜土壤样品,向其加入91 mL的50 mmol/L乙酸钠缓冲溶液(pH=6.0,接近土样原位pH值),将土壤样品和缓冲溶液倒入100 mL的玻璃结晶皿中,放于磁力搅拌器上高速搅拌1 min,制成土壤悬液. 然后将800 μL的土壤悬液和200 μL对应底物(200 μmol/L)(AG:4-MUB-α-D-glucoside;BG:4-MUB-β-D-glucoside;XYL:4-MUB-β-D-xyloside;CBH:4-MUB-β-D-cellobioside;NAG:4-MUB-N-acetyl-β-D-glucosaminide;LAP:L-leucine-7-amido-4-methylcoumarin;PHOS:4-MUB phosphate)转移至深孔板中. 在20℃的黑暗避光条件下,培养4.5 h. 培养结束后,加入5 μL、0.5 mol/L的NaOH终止反应. 用多功能酶标仪(Synergy H4, BioTek, winooski, 美国)于激发波长365 nm,发射波长450 nm处进行荧光测定,每个样品两次重复. 水解酶活性用单位时间内单位干重土分解的底物浓度(nmol/(h·g))表示. 依据前人研究,使用BG∶NAG、BG∶PHOS和NAG∶PHOS分别来表示土壤胞外酶化学计量C∶N、C∶P和N∶P[21].
采用土壤胞外酶化学计量比的向量分析(向量长度和向量角度)评估土壤微生物的养分限制状况[22]. 向量长度(Length)和向量角度(Angle)的计算方法为:
| $ \text { Length }=\sqrt{(\ln (\mathrm{BG}) / \ln (\mathrm{NAG}))^{2}+(\ln (\mathrm{BG}) / \ln (\mathrm{PHOS}))^{2}} $ | (1) |
| $ \text { Angle }=\text { DEGREES }\{\mathrm{ATAN} 2[(\ln (\mathrm{BG}) / \ln (\mathrm{PHOS})), (\ln (\mathrm{BG}) / \ln (\mathrm{NAG}))]\} $ | (2) |
向量长度反映微生物碳限制状况,长度越长,碳限制越大;向量角度反映微生物养分限制状况,角度大于45°表明微生物受磷的限制比氮更强,反之则表明微生物受氮的限制比磷更强.
1.5 数据处理采用单因素方差分析检验不同高程土壤胞外酶活性、酶化学计量比、植被特征和土壤理化性质的差异. 采用一般回归分析评估高程与土壤胞外酶活性、酶化学计量比、植物特征和土壤理化性质之间的关系. 采用相关分析探究植物特征、土壤理化性质和土壤胞外酶活性、胞外酶化学计量比之间的关系. 运用结构方程模型明确高程、植被和土壤理化性质对土壤胞外酶活性和化学计量比的直接和间接作用机制. 对土壤碳循环相关酶和氮循环相关酶进行PCA(主成分分析),并采用PC1(第1主轴)代表相应变量. 根据理论知识和假设建立一个先验模型,该模型认为高程能直接或通过植被特征和土壤理化性质间接影响土壤胞外酶活性和化学计量特征,植被特征也可以通过土壤理化性质间接影响土壤胞外酶活性和化学计量特征[23]. 在结构方程模型分析中逐步删除部分不显著的途径以获得最佳模型[24]. 采用χ2(卡方值)、P、RMSEA(近似误差均方根)、CFI(拟合优度指数)和AIC(赤池信息量准则)来评估模型的适合度[25]. 采用IBM SPSS 26、AMOS 21.0和R 4.0.3软件进行数据分析. 所有结果利用Origin 9.0软件作图.
2 结果 2.1 土壤胞外酶活性高程对碳循环相关酶中的AG(P=0.003)、CBH(P < 0.001)和XYL(P=0.015)活性有显著影响,对BG(P=0.693)活性影响不显著(图 2). 随着高程增加,AG活性逐渐减小,CBH活性先减小后增大,XYL活性逐渐减小,而BG活性没有显著变化. AG、CBH、XYL和BG四者的变化范围分别为21.04~55.24、24.95~269.83、7.85~16.62和79.47~124.46 nmol/(h·g),平均值分别为32.44、120.70、12.67和94.69 nmol/(h·g). 高程增加导致氮循环相关酶NAG和LAP活性均逐渐减少(图 2). NAG和LAP的变化范围分别为22.47~98.07和467.69~974.01 nmol/(h·g),平均值分别为45.69和680.50 nmol/(h·g). 磷循环相关酶PHOS活性不受高程的显著影响,它在6个高程的变化范围为738.22~1410.95 nmol/(h·g),平均值为987.20 nmol/(h·g)(图 2).
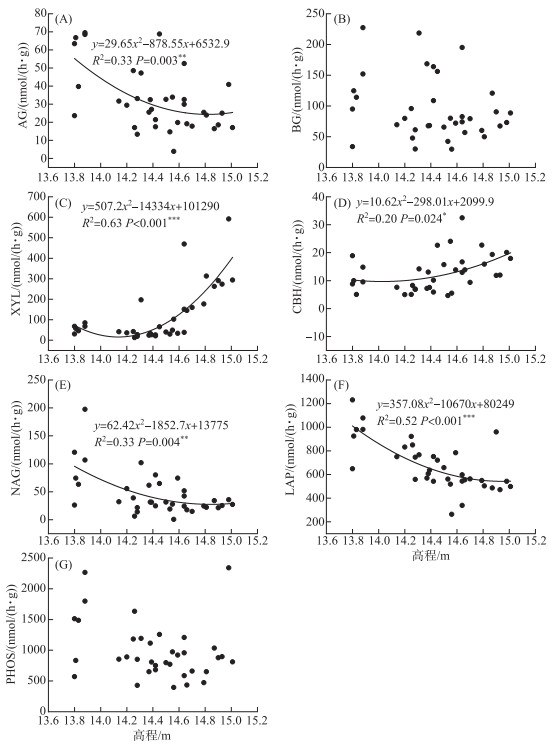
|
图 2 高程与碳、氮、磷循环相关胞外酶活性之间的关系 Fig.2 Relationships between the elevation and the soil extracellular enzyme activities |
高程对BG∶NAG(P < 0.001)和NAG∶PHOS(P=0.009)有显著影响,但对BG∶PHOS(P=0.350)影响不显著(图 3). 随高程增加BG∶NAG逐渐增加,NAG∶PHOS逐渐减小,BG∶PHOS没有明显变化. BG∶NAG、NAG∶PHOS和BG∶PHOS三者的变化范围分别为1.36~3.54、0.03~0.07和0.08~0.14,平均值分别为2.51、0.05和0.10. 根据土壤胞外酶化学计量比的向量分析,高程增加导致向量长度和角度均增大,但其变化量在统计学上不显著(长度:P=0.082;角度:P=0.190). 各高程下向量的角度均大于45°,表明微生物受磷的限制比氮更强.
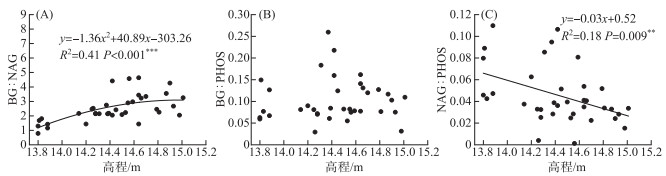
|
图 3 高程与土壤胞外酶化学计量比之间的关系 Fig.3 Relationships between the elevation and soil extracellular enzyme stoichiometry |
所调查的36个样方中共发现7个植物种. 其中灰化苔草为优势种,其他重要的植物物种包括水田碎米荠(Cardamine lyrata)、蓼子草(Polygonum criopolitanum)和具刚毛荸荠(Heleocharis valleculosa)等. 回归分析发现,植物物种丰富度(P < 0.001)和Shannon-Wiener指数(P < 0.001)均受到了高程的显著影响,并且随高程升高而显著降低(图 4). 各个样方植物物种丰富度和Shannon-Wiener指数的变化范围分别为1~5、0~0.75,平均值分别为3和0.28. 此外,高程对地下生物量(P=0.011)也具有显著影响. 并且随着高程的增加,地下生物量呈现先增加后减少的规律,其变化范围为1021.78~2017.11 g/m2,平均值为1551.09 g/m2. 地上生物量(P=0.067)不受高程的显著影响,它在6个高程的变化范围为252.43~429.52 g/m2,平均值为353.25 g/m2.
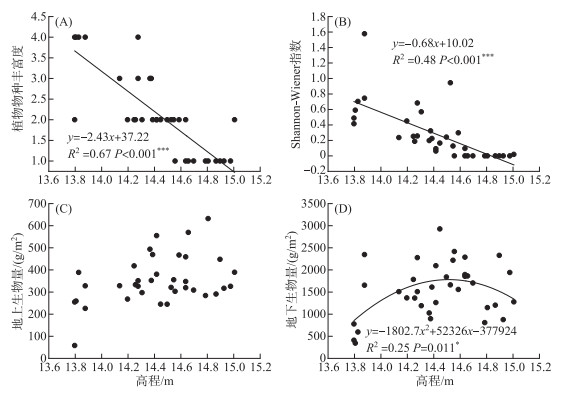
|
图 4 高程与植被特征之间的关系 Fig.4 Relationships between elevation and vegetation characteristics |
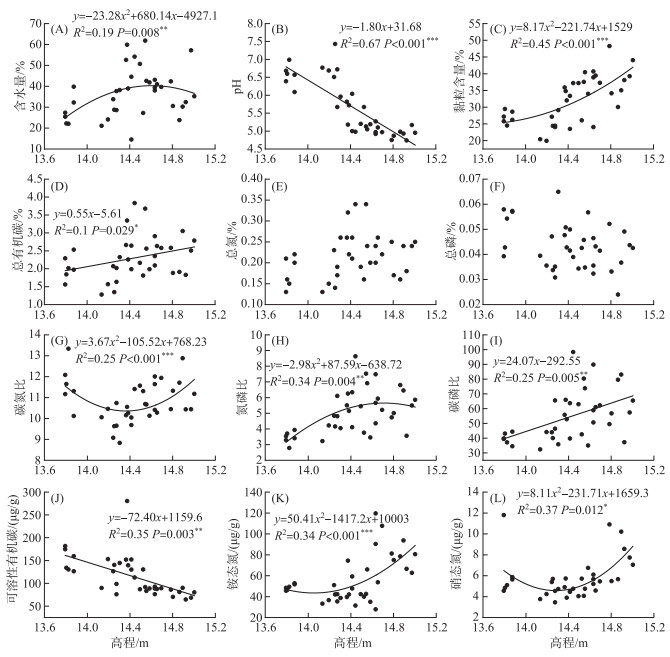
土壤理化性质中pH(P < 0.001)、总有机碳(P=0.029)、可溶性有机碳(P=0.003)和碳磷比(P=0.005)与高程呈显著线性相关. 随高程增加pH和可溶性有机碳逐渐减少,而总有机碳和碳磷比逐渐增加. 土壤含水量(P=0.008)、黏粒含量(P < 0.001)、碳氮比(P < 0.001)、氮磷比(P=0.004)、铵态氮(P < 0.001)和硝态氮(P=0.012)与高程呈显著二项式相关. 其中土壤含水量和氮磷比随高程增加呈现先增加后减小的规律,碳氮比和硝态氮随高程增加呈现先减小后增加的规律,而黏粒含量和铵态氮则随高程增加而增加. 总氮和总磷不受高程的显著影响(图 5).
|
图 5 高程与土壤理化性质之间的关系 Fig.5 Relationships between the elevation and soil physicochemical variables |
相关性分析(图 6)表明,碳循环相关酶中AG和BG活性与总磷(AG:P=0.003;BG:P=0.001)呈显著正相关;CBH和XYL活性与黏粒含量(CBH:P=0.001;XYL:P < 0.001)、铵态氮(CBH:P < 0.001;XYL:P=0.008)、硝态氮(CBH:P=0.034;XYL:P=0.047)呈显著正相关,与pH呈显著负相关(CBH:P=0.002;XYL:P=0.001). 氮循环相关酶(NAG、LAP)活性与总磷(NAG:P < 0.001;LAP:P=0.008)和可溶性有机碳(NAG:P=0.040;LAP:P=0.012)呈显著正相关,与氮磷比呈显著负相关(NAG:P=0.006;LAP:P=0.037). 磷循环相关酶(PHOS)活性与pH(P=0.049)和总磷(P=0.016)呈显著正相关. 除了CBH和XYL与植物物种丰富度(CBH:P < 0.001;XYL:P=0.013)和Shannon-Wiener指数(CBH:P=0.016;XYL:P=0.038)呈显著负相关,BG与植物物种丰富度(P=0.111)和Shannon-Wiener指数(P=0.150)不存在显著相关性外,碳、氮、磷循环相关酶(AG、NAG、LAP、PHOS)活性均与植物物种丰富度(AG:P < 0.001;NAG:P < 0.006;LAP:P < 0.001;PHOS:P=0.034)和Shannon-Wiener指数(AG:P=0.002;NAG:P=0.001;LAP:P < 0.001;PHOS:P=0.005)呈显著正相关. 土壤胞外酶化学计量比中,NAG∶PHOS仅与植物物种丰富度(P=0.008)和总磷(P < 0.001)呈显著正相关,与地下生物量(P=0.026)呈显著负相关关系. BG∶NAG和BG∶PHOS与植物特征和土壤理化性质的相关关系均不显著.

|
图 6 土壤胞外酶活性和化学计量比与植被、土壤因子的相关性分析 (圆圈的颜色与相关系数呈正比. *表示P < 0.05;**表示P < 0.01;***表示P < 0.001. Np、Hp、AGB、BGB分别表示物种丰富度、Shannon-Wiener指数、地上生物量和地下生物量;SW、pH、CL分别表示土壤含水量、pH值、黏粒含量;TOC、TN、TP分别表示总有机碳、总氮、总磷;C/N、C/P、N/P分别表示碳氮比、碳磷比、氮磷比;DOC、NH4+-N、NO3--N分别表示可溶性有机碳、铵态氮、硝态氮;AG、BG、CBH、XYL、NAG、LAP和PHOS分别表示α-葡萄糖苷酶、β-葡萄糖苷酶、木聚糖酶、纤维二糖水解酶、N-乙酰氨基葡萄糖苷酶、亮氨酸氨基肽酶和磷酸酶;BG∶NAG、BG∶PHOS和NAG∶PHOS分别表示碳氮、碳磷和氮磷获取酶的化学计量比) Fig.6 Correlation analyses of soil enzyme activity and extracellular stoichiometry with vegetation and soil factors |
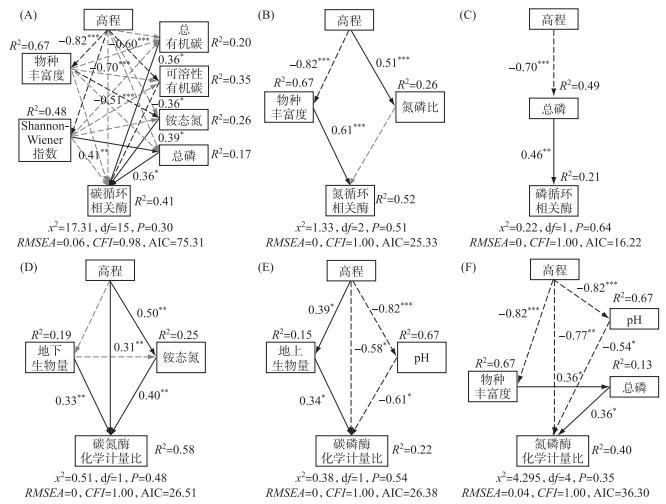
结构方程模型分别解释了土壤碳、氮、磷循环相关酶活性41%、52%和21%的方差,以及土壤碳氮、碳磷和氮磷酶化学计量比58%、22%和4%的方差. 图 7表明,土壤胞外酶活性和化学计量特征受高程、植被特征和土壤理化性质影响的机制均不相同. 土壤碳循环相关酶活性同时受到土壤理化性质(总有机碳、可溶性有机碳、铵态氮和总磷)的直接影响和高程、植被特征(植物物种丰富度和Shannon-Wiener指数)的间接影响,其中影响最大的为高程(标准回归系数(β)=0.48)(图 7A). 土壤氮循环相关酶活性显著受到植被特征(植物物种丰富度)的直接影响和高程的间接影响(图 7B),影响最大的为植物物种丰富度(β=0.61). 土壤磷循环相关酶活性显著受到土壤理化性质(总磷)的直接影响,其β为0.46(图 7C). 在土壤胞外酶化学计量特征中,碳氮酶化学计量比同时受到高程、植被特征(地上生物量)、土壤理化性质(铵态氮)的直接影响和高程的间接影响(图 7D),其中影响最大的为高程(β=0.51). 土壤碳磷酶化学计量比和氮磷酶化学计量比同时受到高程、植被特征(地上生物量或物种丰富度)、土壤理化性质(pH)的直接影响和高程的间接影响,影响最大的为均为pH(碳磷酶化学计量比:β=-0.61;氮磷酶化学计量比:β=-0.54)(图 7E, F).
|
图 7 高程、植被特征和土壤理化性质对土壤胞外酶活性和化学计量比的影响 (黑色和灰色箭头分别代表显著相关和不显著相关. 实线和虚线箭头分别代表正相关和负相关. 箭头旁边的数字为路径系数. 显著性水平:*,P < 0.05;**,P < 0.01;***,P < 0.001) Fig.7 The effects of elevation, vegetation characteristics and soil physicochemical properties on soil extracellular enzyme activities and stoichiometry |
洪泛平原洲滩湿地沿高程梯度的变化,能够引起植被类型、凋落物质量、土壤理化性质和微生物群落等变化,进而导致土壤胞外酶活性在不同高程呈现显著差异[26]. 本研究发现,高程增加后,碳循环相关酶中AG活性逐渐增大,CBH活性先减小后增大,XYL活性逐渐减小,而BG活性在统计学上没有显著变化(图 2). 这些结果说明不同的碳循环相关酶对环境因子的响应并不同. 高程可以通过影响多个土壤碳和营养成分(总有机碳、可溶性有机碳、铵态氮和总磷)来间接促进土壤碳循环相关酶活性(图 7A). 这一结果与He等[27]的结论相同. 土壤碳和营养成分可以为微生物的生长提供物质和能量,最终增加土壤碳循环相关酶活性. 土壤氮循环相关酶(NAG和LAP)活性随高程增加而减小(图 2). 相关分析表明,土壤氮循环相关酶活性与植物多样性及土壤总磷等参数显著相关(图 6). 结构方程模型的分析则显示高程主要通过植被特征(植物物种丰富度)来间接影响土壤氮循环相关酶活性(图 7B). 这些结果表明土壤氮循环相关酶活性随高程的变化特征可能是受到植被特征和土壤磷元素的影响. 随着高程的增加,植物群落的丰富度逐渐降低,生物量逐渐增加,植物对土壤磷的需求也会显著增加. 因此在高高程地区,土壤微生物可能是因为缺乏磷元素而减少了土壤氮循环相关酶的合成[28]. 高程对PHOS活性的影响不显著,表明研究区域内不同高程微生物对磷素的需求没有明显区别(图 2). 从图 7C可知,高程可以通过土壤理化性质(总磷)来间接影响PHOS,说明土壤磷循环相关酶活性受到土壤养分状况的显著影响. 这是因为土壤养分可以为微生物的生长和代谢以及胞外酶的产生提供物质基础. 这一结果可能与鄱阳湖洲滩湿地土壤的磷限制有关. 以往研究表明,亚热带湿地土壤存在广泛的P限制[29]. 本研究中各高程下化学计量特征的向量角度均大于45°,同样表明研究区土壤微生物生长和代谢受到磷的限制.
本研究中,BG∶NAG随高程增加而增加,NAG∶PHOS随高程增加而减小,BG∶PHOS随高程增加没有明显变化(图 3). 这是因为高程变化后仅氮循环相关酶(NAG)活性发生显著变化,碳循环相关酶(BG)和磷循环相关酶(PHOS)活性没有发生变化(图 2). 该结果与草地生态系统中的研究发现不同. Zuo等[30]通过对草地生态系统不同高程的土壤胞外酶化学计量特征进行研究发现,BG∶NAG和NAG∶PHOS均随高程变化呈单峰曲线格局. 这可能与湿地生态系统的环境特殊性有关. 湿地生态系统土壤环境长时间被水淹没,土壤微生物群落受到水文节律的影响更大. 本研究表明,土壤碳氮酶化学计量比受高程的综合影响最显著(图 7D). 这可能与以下两方面的原因有关. 首先,不同种微生物(如外生菌根和丛枝菌根)在生产水解酶时具有不同的生态策略[31]. 鄱阳湖洲滩湿地不同高程由于淹水时长、植物群落组成、物种竞争和历史遗留效应的差异可能会造成微生物群落结构的差别,从而导致土壤微生物对能量和养分相对需求的差异[32]. 其次,不同高程养分有效性也会影响土壤胞外酶化学计量比. 与碳氮酶化学计量比不同,土壤碳磷和氮磷酶化学计量比主要受pH的直接控制(图 7E, F). Kivlin等[33]也发现pH的变化可以改变土壤中的全磷含量,造成土壤中碳磷比和氮磷比的差别,进而导致土壤碳磷酶化学计量比和氮磷酶化学计量比发生变化. 在土壤接近于中性的环境条件下,磷元素主要被黏土矿物吸附,从而防止磷元素由于淋溶作用而被分解. 然而,过酸的环境会导致土壤板结,造成土壤磷素的吸附能力降低,加速了土壤磷素的流失[34].
本研究中部分结构方程模型的方差解释能力并不高. 例如,模型对土壤碳磷酶化学计量比的方差解释量只有20%. 这可能是因为土壤胞外酶受到了植被和土壤理化因素以外的因子的影响. 事实上,土壤微生物群落也会显著影响土壤胞外酶活性和化学计量比[35]. 未来的研究可以考虑水文、植被、土壤和微生物对洪泛平原湿地土壤碳、氮、磷循环相关酶活性和化学计量比的综合影响.
4 结论鄱阳湖洲滩湿地土壤碳、氮、磷循环相关酶活性以及酶化学计量比随高程的变化特征明显不同. 随着高程增加,碳循环相关酶中AG活性逐渐增大,CBH活性先减小后增大,XYL活性逐渐减小,而BG活性则没有显著变化;氮循环相关酶(NAG和LAP)活性均逐渐减小;磷循环相关酶(PHOS)活性变化不显著. 高程增加后,碳氮酶化学计量比显著增加,氮磷酶化学计量比显著减少,而碳磷酶化学计量比没有显著变化. 高程主要通过土壤营养元素影响碳、磷循环相关酶活性,通过植被特征影响氮循环相关酶活性. 高程可以直接或通过土壤养分间接影响土壤碳、氮、磷循环相关酶化学计量比,也可以通过植被特征和土壤pH影响碳磷、氮磷酶化学计量比. 本研究可为洪泛平原土壤碳、氮、磷生物地球化学过程的高程格局提供科学依据.
| [1] |
Jing X, Yang XX, Ren F et al. Neutral effect of nitrogen addition and negative effect of phosphorus addition on topsoil extracellular enzymatic activities in an alpine grassland ecosystem. Applied Soil Ecology, 2016, 107: 205-213. DOI:10.1016/j.apsoil.2016.06.004 |
| [2] |
Liu QY, Xu XL, Wang HM et al. Dominant extracellular enzymes in priming of SOM decomposition depend on temperature. Geoderma, 2019, 343: 187-195. DOI:10.1016/j.geoderma.2019.02.006 |
| [3] |
Luo L, Meng H, Gu JD. Microbial extracellular enzymes in biogeochemical cycling of ecosystems. Journal of Environmental Management, 2017, 197: 539-549. DOI:10.1016/j.jenvman.2017.04.023 |
| [4] |
Wei L, Razavi BS, Wang WQ et al. Labile carbon matters more than temperature for enzyme activity in paddy soil. Soil Biology and Biochemistry, 2019, 135: 134-143. DOI:10.1016/j.soilbio.2019.04.016 |
| [5] |
Stock SC, Köster M, Dippold MA et al. Environmental drivers and stoichiometric constraints on enzyme activities in soils from rhizosphere to continental scale. Geoderma, 2019, 337: 973-982. DOI:10.1016/j.geoderma.2018.10.030 |
| [6] |
Sinsabaugh RL, Hill BH, Follstad Shah JJ. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632 |
| [7] |
Rosinger C, Rousk J, Sandén H. Can enzymatic stoichiometry be used to determine growth-limiting nutrients for microorganisms?—A critical assessment in two subtropical soils. Soil Biology and Biochemistry, 2019, 128: 115-126. DOI:10.1016/j.soilbio.2018.10.011 |
| [8] |
Junk WJ, Bayley PB, Sparks RE. The flood pulse concept in river-floodplain systems. Canadian Journal of Fisheries and Aquatic Sciences, 1989, 106: 110-127. |
| [9] |
Fossey M, Rousseau AN, Savary S. Assessment of the impact of spatio-temporal attributes of wetlands on stream flows using a hydrological modelling framework: A theoretical case study of a watershed under temperate climatic conditions. Hydrological Processes, 2016, 30(11): 1768-1781. DOI:10.1002/hyp.10750 |
| [10] |
Geng YQ, Wang DM, Yang WB. Effects of different inundation periods on soil enzyme activity in riparian zones in Lijiang. CATENA, 2017, 149: 19-27. DOI:10.1016/j.catena.2016.08.004 |
| [11] |
Wilson JS, Baldwin DS, Rees GN et al. The effects of short-term inundation on carbon dynamics, microbial community structure and microbial activity in floodplain soil. River Research and Applications, 2011, 27(2): 213-225. DOI:10.1002/rra.1352 |
| [12] |
Zhang Y, Cui D, Yang H et al. Differences of soil enzyme activities and its influencing factors under different flooding conditions in Ili Valley, Xinjiang. PeerJ, 2020, 8(7): 207-210. |
| [13] |
Wang LX, Yan BX, Prasher SO et al. The response of microbial composition and enzyme activities to hydrological gradients in a riparian wetland. Journal of Soils and Sediments, 2019, 19(12): 4031-4041. DOI:10.1007/s11368-019-02373-9 |
| [14] |
Zou F, Li JQ, Han LL et al. Response of soil microbial functional traits to annually hydrological changes in Lake Poyang wetlands. J Lake Sci, 2019, 31(2): 551-559. [邹锋, 李金前, 韩丽丽等. 鄱阳湖湿地土壤微生物活性对年际水文变化的响应. 湖泊科学, 2019, 31(2): 551-559. DOI:10.18307/2019.0223] |
| [15] |
Shen RC, Lan ZC, Rinklebe J et al. Flooding variations affect soil bacterial communities at the spatial and inter-annual scales. Science of the Total Environment, 2021, 759: 143471. DOI:10.1016/j.scitotenv.2020.143471 |
| [16] |
Hu ZP, Ge G, Liu CL et al. Structure of Poyang Lake wetland plants ecosystem and influence of lake water level for the structure. Resources and Environment in the Yangtze Basin, 2010, 19(6): 597-605. [胡振鹏, 葛刚, 刘成林等. 鄱阳湖湿地植物生态系统结构及湖水位对其影响研究. 长江流域资源与环境, 2010, 19(6): 597-605. DOI:10.3724/SP.J.1088.2010.00432] |
| [17] |
Hu DD, Ouyang KH, Dai ZH et al. Investigation on community characteristics and α-diversity of Carex cinerascens meadow steppe in Poyang Lake wetland. Pratacultural Science, 2013, 30(6): 844-848. [胡豆豆, 欧阳克蕙, 戴征煌等. 鄱阳湖湿地灰化苔草草甸群落特征及多样性. 草业科学, 2013, 30(6): 844-848.] |
| [18] |
Shen RC, Lan ZC, Huang XY et al. Soil and plant characteristics during two hydrologically contrasting years at the lakeshore wetland of Poyang Lake, China. Journal of Soils and Sediments, 2020, 20(9): 3368-3379. DOI:10.1007/s11368-020-02638-8 |
| [19] |
Zhou LH, Liu SS, Shen HH et al. Soil extracellular enzyme activity and stoichiometry in China's forests. Functional Ecology, 2020, 34(7): 1461-1471. DOI:10.1111/1365-2435.13555 |
| [20] |
Ou LJ, Liu XH, Li JJ et al. Significant activities of extracellular enzymes from a brown tide in the coastal waters of Qinhuangdao, China. Harmful Algae, 2018, 74: 1-9. DOI:10.1016/j.hal.2018.03.005 |
| [21] |
Qin L, Freeman C, Jia XY et al. Microbial enzyme activity and stoichiometry signal the effects of agricultural intervention on nutrient cycling in peatlands. Ecological Indicators, 2021, 122: 107242. DOI:10.1016/j.ecolind.2020.107242 |
| [22] |
Cui YX, Fang LC, Guo XB et al. Natural grassland as the optimal pattern of vegetation restoration in arid and semi-arid regions: Evidence from nutrient limitation of soil microbes. Science of the Total Environment, 2019, 648: 388-397. DOI:10.1016/j.scitotenv.2018.08.173 |
| [23] |
Zhu Y, Wang YF, Chen LD. Effects of non-native tree plantations on soil microarthropods and their feeding activity on the Chinese Loess Plateau. Forest Ecology and Management, 2020, 477: 118501. DOI:10.1016/j.foreco.2020.118501 |
| [24] |
Wen Z, Zheng H, Smith JR et al. Plant functional diversity mediates indirect effects of land-use intensity on soil water conservation in the dry season of tropical areas. Forest Ecology and Management, 2021, 480: 118646. DOI:10.1016/j.foreco.2020.118646 |
| [25] |
Yang Y, Liang C, Wang YQ et al. Soil extracellular enzyme stoichiometry reflects the shift from P- to N-limitation of microorganisms with grassland restoration. Soil Biology and Biochemistry, 2020, 149: 107928. DOI:10.1016/j.soilbio.2020.107928 |
| [26] |
Zeng J, Li X, Hou ZY et al. Soil enzyme activities in three typical plant communities in Lake Dongting wetland with typical hygrophilous vegetations. J Lake Sci, 2017, 29(4): 907-913. [曾静, 李旭, 侯志勇等. 洞庭湖湿地3种典型植物群落土壤酶活性特征. 湖泊科学, 2017, 29(4): 907-913. DOI:10.18307/2017.0414] |
| [27] |
He LY, Lu SX, Wang CG et al. Changes in soil organic carbon fractions and enzyme activities in response to tillage practices in the Loess Plateau of China. Soil and Tillage Research, 2021, 209: 104940. DOI:10.1016/j.still.2021.104940 |
| [28] |
Qiu XC, Peng DL, Tian HX et al. Soil ecoenzymatic stoichiometry and microbial resource limitation driven by thinning practices and season types in Larix principis-rupprechtii plantations in North China. Forest Ecology and Management, 2021, 482: 118880. DOI:10.1016/j.foreco.2020.118880 |
| [29] |
Xu ZW, Yu GR, Zhang XY et al. Soil enzyme activity and stoichiometry in forest ecosystems along the North-South Transect in eastern China (NSTEC). Soil Biology and Biochemistry, 2017, 104: 152-163. DOI:10.1016/j.soilbio.2016.10.020 |
| [30] |
Zuo YP, Li JP, Zeng H et al. Vertical pattern and its driving factors in soil extracellular enzyme activity and stoichiometry along mountain grassland belts. Biogeochemistry, 2018, 141(1): 23-39. DOI:10.1007/s10533-018-0499-x |
| [31] |
Qaswar M, Huang J, Ahmed W et al. Linkages between ecoenzymatic stoichiometry and microbial community structure under long-term fertilization in paddy soil: A case study in China. Applied Soil Ecology, 2021, 161: 103860. DOI:10.1016/j.apsoil.2020.103860 |
| [32] |
Barber NA, Farrell AK, Blackburn RC et al. Grassland restoration characteristics influence phylogenetic and taxonomic structure of plant communities and suggest assembly mechanisms. Journal of Ecology, 2019, 107(5): 2105-2120. DOI:10.1111/1365-2745.13250 |
| [33] |
Kivlin SN, Treseder KK. Soil extracellular enzyme activities correspond with abiotic factors more than fungal community composition. Biogeochemistry, 2014, 117(1): 23-37. DOI:10.1007/s10533-013-9852-2 |
| [34] |
Wan WJ, Hao XL, Xing YH et al. Spatial differences in soil microbial diversity caused by pH-driven organic phosphorus mineralization. Land Degradation & Development, 2021, 32(2): 766-776. DOI:10.1002/ldr.3734 |
| [35] |
Hu Y, Wang L, Tang YS et al. Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration. Soil Biology and Biochemistry, 2014, 70: 221-228. DOI:10.1016/j.soilbio.2013.12.025 |
 2022, Vol. 34
2022, Vol. 34 

