(2: 河海大学环境学院,南京 210098)
(3: 南京信息工程大学环境科学与工程学院,南京 211800)
(2: College of Environment, Hohai University, Nanjing 210098, P.R.China)
(3: School of Environmental Science and Engineering, Nanjing University of Information Engineering, Nanjing 211800, P.R.China)
水体中氟化物污染已经成为全球性环境问题,中国作为世界上氟化物污染较为严重的国家之一,形势不容乐观[1-2]. 刘璇等[3]研究吉林西部湖泊F-浓度结果显示:F-浓度最低为3.10 mg/L,最高达到32.56 mg/L,远超我国地表水Ⅲ类标准(1 mg/L). 宁夏地区也报道了F-浓度高的现象. 宁夏清水河上游地下水F-浓度范围为0.83~2.51 mg /L,平均值为1.47 mg /L[4]. Tian等[5]在研究宁夏沙湖时发现,2019年沙湖地表水F-浓度为0.95~1.40 mg/L,周边35 % 的采样点中地下水F-浓度超过1 mg/L.
沉积物作为湖泊生态环境的重要组成部分,在湖泊环境中扮演重要的角色,沉积物的变化会对湖泊生态造成影响[6-7]. 国内外研究表明,湖泊沉积物F-释放既有内部原因也有外部原因. 内部因素主要指沉积物组成,如沉积物的性质:有机质、含水率、颗粒大小、矿化度等;外部因素包括水中离子、温度、pH值、微生物、水体扰动、藻类等[8-9]. 吴旸等[10]研究宁南西吉含水层沉积物的F-释放特征发现,粉质黏土、泥岩和黏土F-释放的浓度相对其他岩性要高. 除沉积物本身性质对其F-释放产生影响外,在对吉林西部湖泊沉积物中F-向水体释放过程中的影响因素分析中发现,沉积物F-的释放量与pH值呈正相关. 除pH外,水体中的高F-现象还与Na+、Ca2+、HCO3-等离子相关[10]. 如高F-浓度主要出现在Ca2+缺乏的地下水中[11],Ca2+浓度不足会导致CaF2饱和度降低,进而增加岩石中F-的浸出性并提高F-的浓度[12]. Na+通过与Ca2+的协同作用影响沉积物中氟释放,如低Ca2+/Na+比提高了沉积物所释放F-的活度,有利于地下水中F-的聚集[10]. 孔隙水中的F-浓度也是沉积物中F-释放的重要影响因素,张博等[13]研究了岱海沉积物中水溶态、可交换态的氟化物与孔隙水中F-浓度的关系,结果发现两者呈显著正相关,且具有较强的迁移能力. 目前鲜有上覆水F-浓度变化对沉积物中F-迁移影响方面的研究,上覆水F-浓度影响沉积物F-释放过程的机制尚不明确. 微生物群落是影响沉积物F-释放的重要因素, Gao等[14]的研究表明,微生物营造的局部酸性环境促进了沉积物中含氟碳酸盐矿物或铝锰氢氧化物的溶解以及F-的释放. 同时,F-对微生物群落具有毒性,主要通过以下4种机制介导:抑制蛋白质、破坏细胞器、改变pH值和导致电解质失衡[15]. 目前,F-浓度已被广泛证明影响土壤和地下水中的微生物群落结构及酶活性[16-18],然而,鲜有研究关注上覆水F-浓度对湖泊沉积物中主要菌属的影响,上覆水F-浓度影响湖泊沉积物F-释放的微生物机制尚不明确.
针对现有研究的不足,为明确湖泊上覆水F-浓度变化对沉积物F-释放的地球化学与微生物影响机制,本文模拟沙湖沉积物-水系统,以上覆水F-浓度为主要控制因子,分析上覆水与孔隙水中F-浓度、pH和主要离子的变化规律,研究上覆水F-浓度变化条件下沉积物优势菌属相对丰度的变化,分析沉积物优势菌属与F-及其他主要离子浓度的相互作用,从地球化学与微生物两个方面探究不同上覆水F-浓度背景下沙湖沉积物-水系统内F-释放和迁移的机理,为沙湖及其他高氟湖泊防治提供理论支持.
1 材料与方法 1.1 研究区域概况沙湖(38°45′N,106°18′E)位于宁夏回族自治区石嘴山市,地处贺兰山麓,沙湖的表面积为13.96 km2,平均深度为2.2 m[19]. 沙湖地区属于干旱和半干旱的大陆性气候,蒸发强烈. 降雨主要集中在夏季的7-9月,平均年降水量为172.5 mm,而年平均蒸发量却达到1755.1 mm[20],年平均温度为9.5℃,昼夜温差一般可达12~15℃. 2011-2018年沙湖氟离子浓度先增加后降低,并在2015年达到峰值1.59 mg/L[21].
沙湖的岩性主要为黏土砂、细砂和砂质黏土,由石英(40 % ~70 %)、斜长石(15 % ~25 %)、钠长石(5 %)、伊利石(2.5 % ~6 %)、亚氯酸盐(3 % ~5.5 %)、方解石和白云石(2.2 % ~15.5 %)以及少量的石膏(0.2 %)和角闪石(0.3 %)[22]组成.
1.2 样品采集与处理采样时间为2020年11月,采集沙湖沉积物样品和水样. 采样点位(38°49′N,106°21′E)远离河道、闸口、旅游区以及可能的污染源头且沉积物中微生物种类丰富,共采集水样25 kg,泥样10 kg. 采样选择风小、水面稳定时进行.
采集水样前,先将采样瓶用待测水样润洗2~3次,然后将采样瓶深入湖面30 cm深的位置采样. 采集泥样前,将重力采泥器清洗干净,采集时将采泥器深入湖底,采集沉积物的平均深度为30 cm. 采集完毕后,水样送往监测站监测水质指标,为后续实验配制提供参照. 经检测各项水质指标:pH(8.83)、化学需氧量(26.00 mg/L)、总磷(0.02 mg/L)、总氮(0.90 mg/L)、硝酸盐(0.33 mg/L)、氨氮(0.17 mg/L)、氟化物(0.69 mg/L)、Na+(155.00 mg/L)、K+(8.05 mg/L)、Ca2+(41.90 mg/L)、Mg2+(61.80 mg/L)、HCO3-(96.10 mg/L)、Cl-(256.60 mg/L)、SO42-(272.40 mg/L)(括号里的数值为指标浓度). 沉积物样品则在冷冻环境中送至实验室,全程避光,防止沉积物理化性质因外界因素(光照、温度等)发生改变,保存至-20℃的环境中直至实验. 期间检测沉积物样品的理化指标:有机质(3.1 %)、含水率(69.4 %)、总氮(2751.5 mg/kg)、总磷(549.9 mg/kg)、总氟(1417.0 mg/kg)、水溶氟(8.3 mg/kg)(括号里的数值为指标浓度).
1.3 实验设计实验装置为10根形状相同的聚氯乙烯(PVC)圆柱,圆筒直径为9 cm,高度为60 cm. 实验开始前,在圆柱底部铺设20 cm高的原始湖泊沉积物. 根据监测的水质指标,在实验室配制模拟原水,以模拟上覆水(为避免原水中微生物、藻类等因素的干扰,更精确地计算沉积物中氟离子的释放量,使用配制模拟原水.),上覆水高30 cm. 配置水质指标所需试剂及剂量(括号中数值为试剂投加量,按10 L配置水量计算)为:NaOH(3.5 mg)、C6H12O6(243.7 mg)、KH2PO4(0.9 mg)、NaNO3(4.5 mg)、NH4Cl(5.1 mg)、NaF(15.3 mg)、NaCl(2991.3 mg)、KCl(153.3 mg)、CaCl2(871.4 mg)、MgSO4(3090.0 mg)、NaHCO3(1323.3 mg)、MgCl2(156.6 mg)、CaSO4(357.0 mg).
为研究不同浓度的上覆水F-对沉积物-水体系中氟化物迁移的影响,以原上覆水中F-为1倍浓度(0.69 mg/L),设计了不同浓度梯度,分别为以原水浓度为1倍浓度(0.69 mg/L),设置0.5倍组(0.35 mg/L)、1倍组(0.69 mg/L)、2倍组(1.38 mg/L)和4倍组(2.76 mg/L)4个F-浓度梯度组. 另外,为研究微生物对氟化物迁移的影响,在1倍浓度组中增设1倍灭菌组(0.69 mg/L),共设置5个实验组,上述各组均设1个平行组.
在实验室环境预培养3天后,在实验第1、2、3、5、7、10、15、20、25、30天分别收集80 mL上覆水和50 mL孔隙水,共计200个水样并测量各指标. 其中孔隙水利用Rhizosphere土壤溶液取样器[23](Rhizon SMS,荷兰)采集,每次取完水样后,将准备好的上覆水模拟水沿柱壁缓慢补充各圆筒至原来高度.
1.4 分析方法 1.4.1 水样和沉积物分析各组上覆水的pH、温度和F-在实验第1、2、3、5、7、10、15、20、25、30天取完水样后立即测量,测量完毕后将水样在-20℃环境保存至下次测量使用. 实验结束后,将水样自然解冻后通过0.22 μm水相膜,利用ICS离子色谱仪(HCA-100,美国)测量5组上覆水中Na+、K+、Ca2+、Mg2+、Cl-、SO42-浓度,采用氟离子计(PXSJ-216F,上海)测量水中F-浓度. HCO3-浓度则采用双指示剂法测定. 新鲜初始沉积物取自沉积物-水界面下5 cm处,并标记为0. 采用烘干法测定沉积物含水率[24]、有机质[25],利用全自动凯氏定氮仪(KJELTEC 8400,丹麦)测定总氮浓度,采用碱熔-钼锑抗分光光法测定总磷浓度[26],分别用水溶法、碱熔法测定水溶氟和总氟浓度[27].
1.4.2 湖泊沉积物中微生物群落分析1) 微生物样品收集:实验结束后采集实验组10组沉积物样品(每组包含1个平行样),10组实验组的沉积物均收集自沉积物-水界面下5~10 cm处. 实验结束后立即将10组实验组和1组初始沉积物样品(共11组)保存在-80℃环境中.
2) DNA提取与Illumina高通量测序:称取沉积物样品0.25 g,使用OMEGA Soil DNA Kit (D5625-01) (Omega Bio-Tek,美国)提取总基因组DNA样本,具体步骤按照制造商的说明. 在进一步分析之前保存在-20℃环境中. 分别使用NanoDropND-1000分光光度计(ThermoFisherScientific,美国)和1.2 % 琼脂糖凝胶电泳检测提取DNA的数量和质量.
使用正向引物338F(5′-ACTCCTACGGGAGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16SrRNA基因V3-V4区进行PCR扩增. PCR扩增子用Vazyme VAHTSTM DNA Clean Beads(Vazyme,南京,中国)纯化,并使用Quant-iT PicoGreen dsDNA Assay Kit(Invitrogen,美国)进行定量. 进行单独的定量步骤后,将等量的扩增子合并,并使用上海派森诺生物科技股份有限公司(中国上海)的IllluminaMiSeq平台和MiSeqReagent Kit v3的双端2×250 bp测序[28-30].
3) 微生物群落结构分析:通过层次聚类和冗余分析(redundancy analysis,RDA)挖掘样品间的物种组成差异和环境因子的相关性[31-32].
1.5 数据处理与分析根据实验结果和质量守恒定定律计算沉积物中F-的累次释放量和单次释放量,计算公式见式(1)~(2):
| $ {M_i}{\rm{ = }}\left( {{C_{1i}} \cdot {V_1} + {C_{2i}} \cdot {V_2}} \right) - \left( {{C_{10}} \cdot {V_1} + {C_{20}} \cdot {V_2}} \right) $ | (1) |
式中,Mi为第i次实验测试结果沉积物F-的累次释放量,mg;C10为初始上覆水中F-浓度,mg/L;C20为初始孔隙水中F-浓度,mg/L;C1i为第i次实验此时结果上覆水中F-浓度,mg/L;C2i为第i次实验此时结果孔隙水中F-浓度,mg/L;V1为容器中上覆水体积,L;V2为容器中孔隙水体积,L;i为实验测试次数,当i=10时,计算结果则为释放总量,否则为累次释放量.
| $ {m_i} = {M_i} - {M_{i - 1}} $ | (2) |
式中,mi为第i次实验测试结果沉积物F-的单次释放量,mg;Mi为第i次累次释放量,mg;Mi-1为第i-1次累次释放量,mg;i为实验测试次数.
水质数据变化通过Origin 2018软件绘制,上覆水中各阴阳离子与F-间的相关性(Pearson相关性分析)以及上覆水F-与pH间的相关性(一元线性回归分析)利用Excel 2010、SPSS 22.0软件计算. 采用R语言进行方差分析,采用UPGMA算法对微生物群落进行Beta多样性层次聚类分析,基于97 % 相似水平的OUT对主要菌属的相对丰度和环境因子的相关性开展RDA分析,利用PHREEQC 2.16计算饱和指数[5].
2 结果与分析 2.1 上覆水和孔隙水F-浓度变化根据图 1所示,初始时0.5倍、1倍、1倍灭菌、2倍、4倍浓度组上覆水F-浓度分别为0.35、0.69、0.69、1.38和2.76 mg/L,随实验进行,各组上覆水和孔隙水F-浓度发生了不同程度变化,除了4倍浓度组F-浓度有所下降(实验结束时为2.51 mg/L),其余4组的上覆水F-浓度均有小幅度的上升. 另外1倍灭菌组中上覆水及孔隙水F-浓度均要稍低于同倍非灭菌组,说明微生物活动会影响F-的迁移.
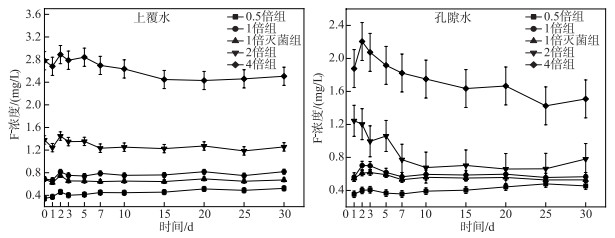
|
图 1 不同实验组上覆水和孔隙水F-浓度变化 Fig.1 F- concentration changes of overlying water and pore water in different groups |
如图 2所示,沉积物释放F-的总量由高到低依次为0.5倍、1倍、1倍灭菌、2倍和4倍组. 其中2倍组和4倍组沉积物由释放F-转为吸附F-. 相比于1倍灭菌组,1倍组中沉积物F-释放量更高. 根据实验数据,沉积物总氟含量为41.49 mg. 各实验组释放F-含量占总量的比例分别为0.85 % (0.5倍组)、0.69 % (1倍组)、0.19 % (1倍灭菌组)、-0.35 % (2倍组)以及-1.45 % (4倍组)(负号代表吸附).
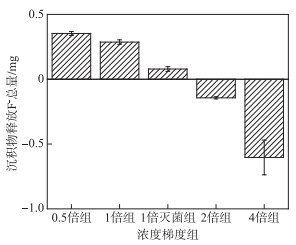
|
图 2 各实验组沉积物释放F-总量 Fig.2 Total amount of F- released by sediments in each group |
从初始沉积物及各实验组共11个样品的层次聚类图(图 3)可以看出,左侧各组的相似关系总体可以分为灭菌组和非灭菌组两大类,证明灭菌会对沉积物中微生物群落产生很大影响. 由图 3可知,除Thiobacillus外,实验前后沉积物主要菌属组成有较大差异. 初始沉积物中Paenisporosarcina相对丰度较高,但实验后各浓度组该菌属相对丰度接近0,表明上覆水F-浓度一定程度上抑制了Paenisporosarcina的代谢和生长;Clostridium_sensu_stricto_13和Fusibacter在各浓度组占比与初始沉积物相比都有不同程度的增加. 灭菌组和其他非灭菌组沉积物中菌落在属水平组成上表现出极大差异. 灭菌组菌属以Sedimentibacter和Exiguobacterium为绝对主导,而非灭菌组中Thiobacillus占绝对支配,但随F-浓度增加,其相对丰度逐渐降低. 非灭菌组中不同浓度组沉积物菌落整体组成差异不大,仅1_1中Clostridium_sensu_stricto_1,2_1、4_1和4_2中Fusibacter相对丰度较高,其中Fusibacter表现出良好耐高浓度氟的属性.
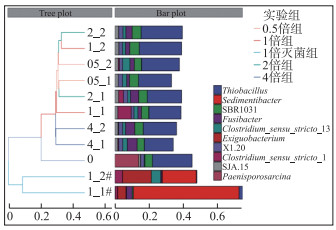
|
图 3 基于属水平各实验组相对丰度的层次聚类分析(0为处理前的样品编号,05_1、05_2、1_1、1_2、1_1#、1_2#、2_1、2_2、4_1和4_2为处理后的样品编号,“_”前面数字表示上覆水F-浓度倍数,后面数字表示平行样编号,#表示灭菌组,下同) Fig.3 The hierarchical cluster analysis based on the relative abundance of different groups at the genus level |
实验数据显示,上覆水pH平均值为7.25,并且在各浓度条件下均无显著差异;0.5倍组孔隙水pH值(平均值为7.1)显著低于其他组,其余4组无显著差异,且平均值为7.4.
2.4.2 水体中重要离子对湖泊沉积物中氟化物释放的影响各实验组上覆水中离子浓度平均值见表 1,其中各组中Na+、K+和Cl-浓度相差不大,0.5倍组的Ca2+浓度最高,SO42-、Mg2+浓度最低,HCO3-浓度在1倍组中最高. 水体中重要离子与上覆水F-浓度的Pearson相关性分析结果见表 2,Na+、Ca2+、HCO3-、Cl-和SO42-都显著影响上覆水F-浓度,其中0.5和4倍组受多个离子浓度的显著影响,其余组相关性不显著. Ca2+、HCO3-和SO42-在0.5倍和4倍组中表现出相反的相关性:4倍浓度组上覆水F-浓度与Ca2+和HCO3-浓度呈显著负相关(P < 0.05),与SO42-浓度呈极显著正相关(P < 0.01),0.5倍组与上述离子浓度的正负相关性呈现相反的结果.
| 表 1 各实验组上覆水中离子浓度平均值 Tab. 1 Average ion concentrations of the overlying water in each group |
| 表 2 各实验组上覆水中F-与离子浓度的Pearson相关性分析 Tab. 2 Pearson's correlation of ion parameters with F- of overlying water in each group |
基于4个不同上覆水F-浓度组,本研究选择了8个非灭菌组中主要菌属Thiobacillus、SBR1031、Fusibacter、Clostridium_sensu_stricto_13、SJA-15、Acinetobacter的相对丰度与环境因子(pH、HCO3-、Ca2+和Na+)进行RDA分析,结果如图 4所示.
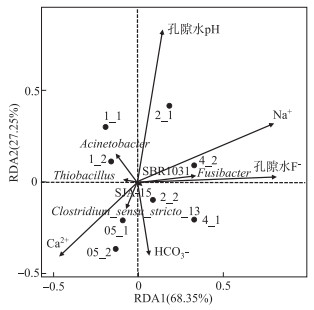
|
图 4 孔隙水中主要菌属相对丰度与环境因子的RDA分析 Fig.4 RDA analysis of main bacteria and environmental factors of pore water |
孔隙水被认为是将沉积物与上覆水联系起来的天然介质[33-34],图 1显示随着上覆水F-浓度的增加,孔隙水中的F-浓度也随之增加,其浓度变化具有一致性. 因此研究孔隙水F-浓度对沉积物中微生物和环境因子的影响比上覆水更加直观. 不同的孔隙水F-浓度梯度组在图 4中呈现明显的分级:2倍和4倍组处于横向主轴的右侧,1倍和0.5倍组处于横向主轴的左侧,说明低氟组和高氟组中主成分表现出一定差异性. Fusibacter相对丰度与F-浓度呈显著正相关,Fusibacter在沉积物中的相对丰度随浓度增大而增强,说明F-会促进Fusibacter的生命活动. Acinetobacter、Thiobacillus和Clostridium_sensu_stricto_13相对丰度与F-浓度表现出弱负相关,吴为荣等[35]研究了F-对氧化硫硫杆菌(Thiobacillus thiooxidans)的影响,结果发现当菌液中F-浓度小于8 mg/L时,对氧化硫硫杆菌产酸能力影响很小;当F-浓度大于16 mg/L时,对氧化硫硫杆菌产酸能力影响较大. 说明F-浓度会抑制其生命代谢功能导致其相对丰度下降. 但本文设置上覆水F-最高浓度为2.76 mg/L,其浓度低于8 mg/L,这解释了Thiobacillus在所有非灭菌组中为主要菌属,但随着F-浓度增加,其相对丰度逐渐下降的现象. 研究表明离子液体对Clostridium sp.具有毒性,且含有F-的液体对Clostridium sp.的毒性更大[36]. 另外,微生物生命代谢活动的强弱会对环境因子产生影响,之前的研究证明Acinetobacter在反应过程中为微生物诱导的钙沉淀提供成核位点,从而使F-和Ca2+以CaF2和Ca5(PO4)3F的形式去除[37]. 因此,水中F-对微生物群落存在抑制作用,在F-作用下微生物代谢活动改变水体的理化特征,影响F-的释放. 由图 4可知, Acinetobacter、Thiobacillus的相对丰度与pH呈负相关. 范立民等[38]在培养脱氮硫杆菌(Thiobacillus denitrificans)的过程中发现脱氮硫杆菌可以降低培养基的pH值,pH值降低会导致矿物的溶解速率增加(如碳酸盐、黑云母和硅酸盐)[14]. 说明孔隙水中F-浓度会抑制微生物的相对丰度,微生物则会降低水中pH值,从而导致矿物溶解加速,最终促进沉积物中F-的释放. 研究表明微生物可以促进岩石风化[39],而Fusibacter相对丰度与Na+呈正相关,推测Fusibacter会促进含钠矿石(如钠长石)溶解,高钠含量可能促进孔隙水中氟的富集. Fusibacter属的成员被认为是轻度嗜盐的发酵厌氧菌,而嗜盐菌具有诱导白云石形成的能力[40]. 所以Fusibacter有利于水体中Ca2+、HCO3-沉淀,因此其相对丰度与Ca2+、HCO3-呈负相关. Thiobacillus、Clostridium_sensu_stricto_13相对丰度表现出与Fusibacter相反的性质,与Ca2+呈正相关这是由于Thiobacillus利用还原硫引起方解石和白云石的风化[39],梭菌的存在则利于Mg2+进入方解石晶格[41],从而释放Ca2+. Thiobacillus、Clostridium_sensu_stricto_13的相对丰度与Na+呈负相关,推测高钠环境不利于Thiobacillus和Clostridium_sensu_stricto_13生存.
3.2 不同上覆水F-浓度下pH对湖泊沉积物F-释放的影响根据前面所得的不同实验组上覆水pH结果发现,上覆水pH在实验过程的绝大部分时间高于7,为进一步探究在不同上覆水F-浓度下pH与沉积物中氟化物释放的关系,本文以各实验组沉积物单次释放F-量为因变量,对应pH为自变量,进行一元线性回归分析,线性回归结果如表 3所示. 一元线性回归的分析结果显示,除0.5倍组的沉积物释放F-的量与pH不存在显著相关,其余各组均显示了显著的相关性(Sig < 0.05),其中4倍组显示为极显著相关(Sig < 0.01). 说明除0.5倍组,各组上覆水的pH显著影响了沉积物中氟化物的释放. 这与邓颂霖[8]、周玳等[42]、刘璇[3]等的研究结论一致,即在碱性条件下,沉积物向上覆水释放F-量随pH的升高而增加. 这是由于在碱性条件下,存在大量的HCO3-、CO32-、OH-,减少了F-与Ca2+、Mg2+等离子的络合,从而使大量的F-释放到水体中. 同时OH-易与沉积物中的矿物质、腐殖质以及胶体上吸附的F-发生交换,使F-释放到水中[8, 43].
| 表 3 不同实验组沉积物向上覆水单次释放F-的量与pH的线性回归分析结果 Tab. 3 Linear regression results of single release of F- from sediment to overlying water and pH of different groups |
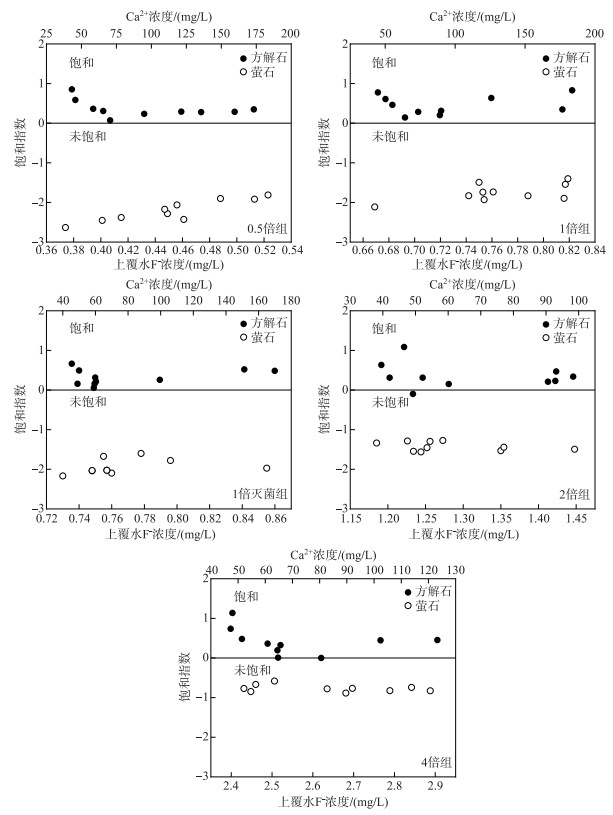
研究表明上覆水F-浓度与水中离子关系密切,尤其是水体中的Ca2+和HCO3-,水体中Ca2+浓度越大导致F-浓度越小;HCO3-浓度越高,沉积物中F-释放越多,使得水中F-浓度越高[8]. 经Pearson相关性分析可知,Ca2+和HCO3-在0.5倍和4倍组中展现了不同的相关性. 为了进一步探究0.5倍和4倍组下Ca2+和HCO3-与上覆水F-浓度的相关性,作CaF2和CaCO3的饱和指数图,从矿物溶解-沉淀角度解释沉积物中含钙矿石以及含氟矿石的沉淀和溶解作用与F-迁移的规律. 结果如图 5所示.
|
图 5 各实验组沉积物中CaCO3和CaF2的饱和指数 Fig.5 Saturation indixes of calciteand fluorite in sediments of each group |
各实验组沉积物表现出98 % 的CaCO3饱和指数>0和所有萤石CaF2饱和指数 < 0,表明本实验沉积物-水体系更容易发生含钙矿石的沉淀和含氟矿石的溶解. 各浓度组之间相比,4倍浓度组CaF2饱和指数最高(-0.89~-0.58),0.5倍浓度组CaF2饱和指数最低(-2.63~-1.81),因为上覆水较高的F-浓度会抑制CaF2等含氟矿物的溶解.
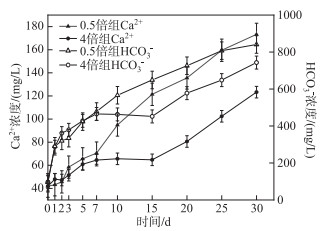
图 6显示了0.5倍和4倍浓度组上覆水Ca2+和HCO3-浓度的变化趋势:上覆水中Ca2+和HCO3-浓度呈上升趋势,Ca2+的增加是由于含氟矿石(如CaF2等)的溶解. HCO3-Na是高氟含量的典型地下水类型,高浓度的HCO3-导致更多的氟离子释放到地下水中[44]. 所以本实验中HCO3-浓度的上升促进了F-的增加,这解释了0.5倍浓度组Ca2+、HCO3-浓度与上覆水F-浓度呈极显著正相关(P < 0.01). 与之相反的是,4倍组出现了F-浓度和Ca2+、HCO3-浓度的负相关性,这是因为4倍组中上覆水和孔隙水存在的较大F-浓度差主导了体系F-的迁移:当上覆水中污染物浓度超过沉积物、孔隙水中的浓度时,溶解的污染物质会迁移至沉积物系统中,反之污染物会被释放到上覆水中去[45-47]. 这验证了图 2的结果,即随着上覆水F-浓度升高,沉积物中F-由释放转为吸附. 图 7显示了本实验中高倍浓度组(2倍和4倍)水体中的存在较高的F-浓度差(孔隙水较上覆水分别低33.42 % 和32.21 %),上覆水与孔隙水之间较大的F-浓度差导致F-进入到沉积物系统中,形成CaF2等沉淀[8],从而使高倍浓度组(2倍和4倍)中Ca2+和HCO3-浓度下降,这是4倍组Ca2+和HCO3-浓度与上覆水F-浓度呈负相关的原因.
|
图 6 0.5倍和4倍实验组上覆水Ca2+和HCO3-浓度变化 Fig.6 The changes of Ca2+ and HCO3- concentrations of two groups (0.5 and 4 times) |

|
图 7 不同实验组间上覆水与孔隙水F-浓度差 Fig.7 The F- concentration gradient between overlying water and pore water of each group |
研究表明细粒沉积物特别是黏土矿物表面上吸附的Na+容易被Ca2+所替代[48],所以水中的Na+浓度增加,Ca2+浓度相对降低,同时促使CaF2进一步溶解,使F-浓度增加. 而当水中F-浓度较高时,大量F-与Ca2+形成CaF2沉淀,导致水体中Ca2+浓度降低. 同样Ca2+浓度高时也会抑制水体中F-聚集[8]. 因此Ca2+表现出与4倍组呈负相关,与0.5倍组呈正相关,而Na+则与4倍组呈正相关(表 2),也与图 4展现的结果一致. He等[49]研究发现地下水中的高氟浓度与SO42-和Cl-有关,因此表 2中SO42-和Cl-浓度均与4倍组呈正相关,可能是高浓度F-条件下氟的变化与沉积物中矿物溶解或阴离子交换密切相关.
4 结论1) 不同F-浓度背景下,沉积物F-的释放量由大到小依次为0.5倍组、1倍组、1倍灭菌组、2倍组和4倍组,沉积物F-的释放量随上覆水F-浓度的增加而呈下降的趋势,其中2倍和4倍组的沉积物由释放F-转变为吸附F-. 对比灭菌组和非灭菌组,灭菌组F-的释放量更小.
2) 初始组中Paenisporosarcina相对丰度较高,但实验后各浓度组该菌属相对丰度接近0,灭菌组菌属以Sedimentibacter和Exiguobacterium为主要菌属,而非灭菌组中Thiobacillus占绝对支配. 非灭菌组中,随着F-浓度增加,Thiobacillus的相对丰度逐渐降低,而Fusibacter的相对丰度逐渐升高.
3) 除了0.5倍组,其余各组沉积物F-释放量均与上覆水pH呈显著正相关,其中4倍浓度组呈极显著相关. pH越大,沉积物中F-释放增量越大.
4) 0.5倍浓度组和4倍浓度组F-的迁移受Ca2+、HCO3-和SO42-浓度影响较大. 0.5倍浓度组中,F-的迁移受含氟矿石强烈的溶解作用影响显著,而4倍组中,F-的迁移则是以上覆水与孔隙水的F-浓度差为主导.
5) 通过模拟沙湖沉积物-水系统,探究不同上覆水F-浓度背景下沙湖沉积物中F-释放和迁移机理,为沙湖及其他含氟地表水防治提供理论支持.
| [1] |
Qu JH, Fan MH. The current state of water quality and technology development for water pollution control in China. Critical Reviews in Environmental Science and Technology, 2010, 40(6): 519-560. DOI:10.1080/10643380802451953 |
| [2] |
Tavener SJ, Clark JH. Chapter 5 fluorine: Friend or foe? A green chemist's perspective. Advances in Fluorine Science, 2006, 2: 177-202. DOI:10.1016/S1872-0358(06)02005-7 |
| [3] |
Liu X, Liang XJ, Xiao X et al. Experimental study on the impact of pH on the migration and transformation of various forms of fluorine in the lake mud of the western Jilin. Environmental Pollution & Control, 2011, 33(6): 19-22. [刘璇, 梁秀娟, 肖霄等. pH对吉林西部湖泊底泥中不同形态氟迁移转化影响的实验研究. 环境污染与防治, 2011, 33(6): 19-22. DOI:10.3969/j.issn.1001-3865.2011.06.005] |
| [4] |
Wang YS, Cheng XX. Spatial variation and Genesis of groundwater fluoride in confined aquifer from the upper Qingshui River basin. Journal of Arid Land Resources and Environment, 2015, 29(12): 170-176. [王雨山, 程旭学. 清水河平原上游承压地下水氟空间变异和形成机理. 干旱区资源与环境, 2015, 29(12): 170-176.] |
| [5] |
Tian LF, Zhu X, Wang LM et al. Distribution, occurrence mechanisms, and management of high fluoride levels in the water, sediment, and soil of Shahu Lake, China. Applied Geochemistry, 2021, 126: 104869. DOI:10.1016/j.apgeochem.2021.104869 |
| [6] |
Zhou LB, Chen FZ. Effect of sediment resuspension on predation of planktivorous fish on zooplankton. J Lake Sci, 2015, 27(5): 911-916. [周礼斌, 陈非洲. 沉积物再悬浮对食浮游动物鱼类捕食浮游动物的影响. 湖泊科学, 2015, 27(5): 911-916. DOI:10.18307/2015.0518] |
| [7] |
Jiang WW, Liu ZW, Guo L et al. Experimental study on the effect of sediment resuspension on zooplankton community. J Lake Sci, 2010, 22(4): 557-562. [蒋伟伟, 刘正文, 郭亮等. 沉积物再悬浮对浮游动物群落结构影响的模拟实验. 湖泊科学, 2010, 22(4): 557-562. DOI:10.18307/2010.0412] |
| [8] |
Deng SL. Experimental studies of lake sediments fluoride release laws and mechanism in western Jilin Province[Dissertation]. Changchun: Jilin University, 2009. [邓颂霖. 吉林省西部湖泊底泥氟释放规律和机理的实验研究[学位论文]. 长春: 吉林大学, 2009. ]
|
| [9] |
Yang JY, Wang M, Lu J et al. Fluorine in the environment in an endemic fluorosis area in Southwest, China. Environmental Research, 2020, 184: 109300. DOI:10.1016/j.envres.2020.109300 |
| [10] |
Wu Y, Guo HM, Han SB et al. Characteristics of fluoride release from aquifer sediments in Xiji of southern Ningxia. Hydrogeology & Engineering Geology, 2013, 40(5): 117-123. [吴旸, 郭华明, 韩双宝等. 宁南西吉含水层沉积物的氟释放特征. 水文地质工程地质, 2013, 40(5): 117-123.] |
| [11] |
Hurtado R, Gardea-Torresdey J. Environmental evaluation of fluoride in drinking water at "los Altos de Jalisco, " in the central Mexico region. Journal of Toxicology and Environmental Health, Part A, 2004, 67(20/21/22): 1741-1753. DOI:10.1080/15287390490493448 |
| [12] |
Chen Q, Lu QS, Song ZJ et al. The levels of fluorine in the sediments of the aquifer and their significance for fluorosis in coastal region of Laizhou Bay, China. Environmental Earth Sciences, 2014, 71(10): 4513-4522. DOI:10.1007/s12665-013-2843-8 |
| [13] |
Zhang B, Guo YY, Chen JY et al. Occurrence characteristics and release potential of fluoride in sediment of Daihai Lake. China Environmental Science, 2020, 40(4): 1748-1756. [张博, 郭云艳, 陈俊伊等. 岱海沉积物氟化物赋存特征及其释放风险. 中国环境科学, 2020, 40(4): 1748-1756. DOI:10.3969/j.issn.1000-6923.2020.04.043] |
| [14] |
Gao XB, Luo WT, Luo XS et al. Indigenous microbes induced fluoride release from aquifer sediments. Environmental Pollution, 2019, 252: 580-590. DOI:10.1016/j.envpol.2019.05.118 |
| [15] |
Johnston NR, Strobel SA. Principles of fluoride toxicity and the cellular response: A review. Archives of Toxicology, 2020, 94(4): 1051-1069. DOI:10.1007/s00204-020-02687-5 |
| [16] |
Zhang X, Gao XB, Li CC et al. Fluoride contributes to the shaping of microbial community in high fluoride groundwater in Qiji County, Yuncheng City, China. Scientific Reports, 2019, 9: 14488. DOI:10.1038/s41598-019-50914-6 |
| [17] |
Reddy MP, Kaur M. Sodium fluoride induced growth and metabolic changes in Salicornia brachiata Roxb. Water, Air, and Soil Pollution, 2008, 188(1/2/3/4): 171-179. DOI:10.1007/s11270-007-9533-7 |
| [18] |
Wang M, Li X, He WY et al. Distribution, health risk assessment, and anthropogenic sources of fluoride in farmland soils in phosphate industrial area, southwest China. Environmental Pollution, 2019, 249: 423-433. DOI:10.1016/j.envpol.2019.03.044 |
| [19] |
Chen J, Qian H. Characterizing replenishment water, lake water and groundwater interactions by numerical modelling in arid regions: A case study of Shahu Lake. Hydrological Sciences Journal, 2017, 62(1): 104-113. DOI:10.1080/02626667.2015.1133910 |
| [20] |
Wu JH, Xue CY, Tian R et al. Lake water quality assessment: A case study of Shahu Lake in the semiarid loess area of northwest China. Environmental Earth Sciences, 2017, 76(5): 1-15. DOI:10.1007/s12665-017-6516-x |
| [21] |
Tian LF, Zhu X, Wang LM et al. Long-term trends in water quality and influence of water recharge and climate on the water quality of brackish-water lakes: A case study of Shahu Lake. Journal of Environmental Management, 2020, 276: 111290. DOI:10.1016/j.jenvman.2020.111290 |
| [22] |
Jing XY, Yang HB, Cao YQ et al. Identification of indicators of groundwater quality formation process using a zoning model. Journal of Hydrology, 2014, 514: 30-40. DOI:10.1016/j.jhydrol.2014.03.059 |
| [23] |
Uddin M, Chen JW, Qiao XL et al. Insight into dynamics and bioavailability of antibiotics in paddy soils by in situ soil moisture sampler. Science of the Total Environment, 2020, 703: 135562. DOI:10.1016/j.scitotenv.2019.135562 |
| [24] |
Yang H, Yi CL, Xing YP et al. Porosity and water content of sediments in Lake Donghu, Wuhan. J Lake Sci, 2004, 16(1): 68-72. [杨洪, 易朝路, 邢阳平等. 武汉东湖沉积物孔隙度与含水量. 湖泊科学, 2004, 16(1): 68-72. DOI:10.18307/2004.0110] |
| [25] |
Ma JY, Wang WC, Luo QL et al. Distribution and source analysis of nutrients in sediments of Huangda Lake. Journal of Environmental Engineering Technology, 2021, 11(4): 678-685. [马金玉, 王文才, 罗千里等. 黄大湖沉积物营养盐分布及来源解析. 环境工程技术学报, 2021, 11(4): 678-685.] |
| [26] |
Zhang YP, Liu JJ, Zhang F. Risk assessment of nitrogen, phosphorus, organic carbon, and heavy metals in Shanghai aquaculture ponds. Journal of Fishery Sciences of China, 2020, 27(12): 1448-1463. [张玉平, 刘金金, 张芬. 上海地区池塘沉积物中氮、磷、有机碳及重金属风险评价. 中国水产科学, 2020, 27(12): 1448-1463.] |
| [27] |
Chen YS, Liu SJ. Research advance of detection method of fluorion in soil. Journal of Anhui Agricultural Sciences, 2013, 41(25): 10288-10289. [陈益山, 刘善江. 土壤中氟离子检测方法的研究进展. 安徽农业科学, 2013, 41(25): 10288-10289. DOI:10.3969/j.issn.0517-6611.2013.25.027] |
| [28] |
Wang LM, Pang QQ, Peng FQ et al. Response characteristics of nitrifying bacteria and Archaea community involved in nitrogen removal and bioelectricity generation in integrated tidal flow constructed wetland-microbial fuel cell. Frontiers in Microbiology, 2020, 11: 1385. DOI:10.3389/fmicb.2020.01385 |
| [29] |
Du WL, Sun JH, Mai YZ et al. Spatial and temporal distribution characteristics of bacterioplankton community structure in the downstream of Pearl River. J Lake Sci, 2020, 32(2): 380-394. [杜宛璘, 孙金辉, 麦永湛等. 珠江下游浮游细菌群落结构的时空分布特征. 湖泊科学, 2020, 32(2): 380-394. DOI:10.18307/2020.0208] |
| [30] |
Yin XW, Tian W, Ding Y et al. Composition and predictive functional analysis of bacterial communities in surface sediments of the Danjiangkou Reservoir. J Lake Sci, 2018, 30(4): 1052-1063. [阴星望, 田伟, 丁一等. 丹江口库区表层沉积物细菌多样性及功能预测分析. 湖泊科学, 2018, 30(4): 1052-1063. DOI:10.18307/2018.0418] |
| [31] |
Sun YJ, Wang TY, Peng XW et al. Effects of perfluoroalkyl substances on the microbial community structure in surface sediments of typical river, China. Environmental Science, 2015, 36(7): 2496-2503. [孙雅君, 王铁宇, 彭霞薇等. 全氟化合物对表层沉积物中细菌群落结构的影响. 环境科学, 2015, 36(7): 2496-2503. DOI:10.13227/j.hjkx.2015.07.023] |
| [32] |
Yang SQ, Zu TX, Wang HB et al. Relationship between the structure of phytoplankton community and environmental factors in the Zhangye section of Heihe River. J Lake Sci, 2019, 31(1): 159-170. [杨宋琪, 祖廷勋, 王怀斌等. 黑河张掖段浮游植物群落结构及其与环境因子的关系. 湖泊科学, 2019, 31(1): 159-170. DOI:10.18307/2019.0115] |
| [33] |
Chen ML, Kim SH, Jung HJ et al. Dynamics of dissolved organic matter in riverine sediments affected by weir impoundments: Production, benthic flux, and environmental implications. Water Research, 2017, 121: 150-161. DOI:10.1016/j.watres.2017.05.022 |
| [34] |
Mostofa KMG, Li W, Wu FC et al. Environmental characteristics and changes of sediment pore water dissolved organic matter in four Chinese lakes. Environmental Science and Pollution Research, 2018, 25(3): 2783-2804. DOI:10.1007/s11356-017-0545-6 |
| [35] |
Wu WR, Zheng ZH, Liu JH et al. Study on Thiobacillus thiooxidans domestication of fluorine enduring. Nonferrous Metals: Extractive Metallurgy, 2007(3): 38-40. [吴为荣, 郑志宏, 刘金辉等. 氧化硫硫杆菌的耐氟驯化试验研究. 有色金属: 冶炼部分, 2007(3): 38-40.] |
| [36] |
Wang H, Malhotra SV, Francis AJ. Toxicity of various anions associated with methoxyethyl methyl imidazolium-based ionic liquids on Clostridium sp. Chemosphere, 2011, 82(11): 1597-1603. DOI:10.1016/j.chemosphere.2010.11.049 |
| [37] |
Shanker AS, Srinivasulu D, Pindi PK. A study on bioremediation of fluoride-contaminated water via a novel bacterium Acinetobacter sp. (GU566361) isolated from potable water. Results in Chemistry, 2020, 2: 100070. DOI:10.1016/j.rechem.2020.100070 |
| [38] |
Fan LM, Qiu LP, Chen JZ et al. Isolation and culture of Thiobacillus denitrificans from different area of the intensive pond system and their capacities of removing nitrate. Journal of Agro-Environment Science, 2013, 32(1): 153-159. [范立民, 裘丽萍, 陈家长等. 养殖池塘系统脱氮硫杆菌(Thiobacillus denitrificans)的分离、生长特性及脱氮特征研究. 农业环境科学学报, 2013, 32(1): 153-159.] |
| [39] |
Gómez-Alarcón G, Cilleros B, Flores M et al. Microbial communities and alteration processes in monuments at Alcala de Henares, Spain. Science of the Total Environment, 1995, 167(1/2/3): 231-239. DOI:10.1016/0048-9697(95)04584-N |
| [40] |
Duan Y, Yao YC, Qiu X et al. Dolomite formation facilitated by three halophilic Archaea. Earth Science, 2017, 42(3): 389-396. [段勇, 药彦辰, 邱轩等. 三株嗜盐古菌诱导形成白云石. 地球科学, 2017, 42(3): 389-396.] |
| [41] |
Wang JP. The dynamic change of the species and morphologies of the carbonate minerals in SN-1 strain culture[Dissertation]. Nanjing: Nanjing Agricultural University, 2012. [王金平. 梭菌SN-1菌株作用下形成的碳酸盐矿物种类和形态的动态变化[学位论文]. 南京: 南京农业大学, 2012. ]
|
| [42] |
Zhou D, Yang Y. Fluoride adsorption and release test in water environment. Environmental Pollution & Control, 1995, 17(6): 13-14. [周玳, 杨云. 水环境中氟化物的吸附和释放试验. 环境污染与防治, 1995, 17(6): 13-14.] |
| [43] |
Rashid A, Guan DX, Farooqi A et al. Fluoride prevalence in groundwater around a fluorite mining area in the flood plain of the River Swat, Pakistan. Science of the Total Environment, 2018, 635: 203-215. DOI:10.1016/j.scitotenv.2018.04.064 |
| [44] |
Khair AM, Li CC, Hu QH et al. Fluoride and arsenic hydrogeochemistry of groundwater at Yuncheng basin, Northern China. Geochemistry International, 2014, 52(10): 868-881. DOI:10.1134/S0016702914100024 |
| [45] |
Zhou SL, Chen ZY, Zhang TN et al. Temporal and spatial evolution characteristics of DOM spectra in sediment interstitial water in typical zones of Baiyangdian Lake. Environmental Science, 2021, 42(8): 3730-3742. [周石磊, 陈召莹, 张甜娜等. 白洋淀典型淀区沉积物间隙水溶解性有机物的光谱时空演变特征. 环境科学, 2021, 42(8): 3730-3742. DOI:10.13227/j.hjkx.202011063] |
| [46] |
Xu HD, Xi BD, Zhai LH. Interception effect of ditch sediment on NH4+-N in agricultural drainage ditch. Journal of Agro-Environment Science, 2007, 26(5): 1924-1928. [徐红灯, 席北斗, 翟丽华. 沟渠沉积物对农田排水中氨氮的截留效应研究. 农业环境科学学报, 2007, 26(5): 1924-1928. DOI:10.3321/j.issn:1672-2043.2007.05.064] |
| [47] |
Zhang SY, Liu RQ, Li DF. The concentrations and distributions of nitrogen and phosphorus in sediment and interstitial water of baoan lake. Acta Hydrobiologica Sinica, 2000, 24(5): 434-438. [张水元, 刘瑞秋, 黎道丰. 保安湖沉积物和间隙水中氮和磷的含量及其分布. 水生生物学报, 2000, 24(5): 434-438. DOI:10.3321/j.issn:1000-3207.2000.05.006] |
| [48] |
Feng HB, Dong SG, Shi XL et al. The spatial distribution and its formed mechanism of fluoride in the unconfined and confined groundwater of Tuoketuo County, Inner Mongolia. Geoscience, 2016, 30(3): 672-679. [冯海波, 董少刚, 史晓珑等. 内蒙古托克托县潜水与承压水中氟化物的空间分布特征及形成机理. 现代地质, 2016, 30(3): 672-679. DOI:10.3969/j.issn.1000-8527.2016.03.018] |
| [49] |
He J, An YH, Zhang FC. Geochemical characteristics and fluoride distribution in the groundwater of the Zhangye Basin in Northwestern China. Journal of Geochemical Exploration, 2013, 135: 22-30. DOI:10.1016/j.gexplo.2012.12.012 |
 2022, Vol. 34
2022, Vol. 34 

