我国西南地区碳酸盐岩出露面积约为54万km2,发育有3000多条岩溶地下河和众多岩溶泉[1]. 这些岩溶泉大部分都已开发利用,有些甚至是当地重要的饮用水源. 在气候变化和人类活动的影响下,近年来一些岩溶泉出现水量减少、水质恶化、水生生态系统由草型向藻型转变的问题[2],饮用水安全受到威胁,水生生态系统健康遭到破坏. 针对到底是水质恶化导致水生生态系统改变,还是水生生态系统变化致使水环境退化的问题,很多学者从不同角度进行了讨论[3-4],结果不一,但普遍认为生物因素和非生物的环境因子的作用是相互的[5-6]. 虽然岩溶泉的水生生态系统已经发生转变,但常规的水化学监测结果可能并未发生明显变化,此种情况下如何客观掌握和评价水环境是个尚待解决的问题. 生物对环境变化响应敏感,因此探索水生生物群落结构的变化对指示水环境的变化有重要意义.
浮游生物作为水域生态系统中的重要组成部分,对能量流动和物质循环以及维持水域生态系统的稳定具有重要作用[7]. 浮游生物对水环境的变化异常敏感,环境条件的改变会影响其种类、数量以及群落结构的变化,从而对环境变化起到指示作用[8]. 利用浮游生物结合理化指标评价水质在湖泊、河流、水库等水体中得到了广泛应用[9-11]. 但是由于岩溶地下水复杂的流动条件和环境特征,对岩溶地下水补给的岩溶泉水生生态系统的研究较少. 已有研究表明,岩溶泉口浮游生物种类和数量显著少于其他自然水体[12],且个体之间差异显著,但浮游生物群落结构的变化与水环境变化的关系尚不清楚.
本文以广西武鸣盆地内的4个岩溶泉为对象,于2016年7月与2020年7月进行了浮游生物群落结构和水环境因子调查. 通过对比两个时期水的物理-化学性质和浮游生物群落结构的差异,结合冗余分析(RDA)方法找出在统计学上显著的影响浮游生物分布与演替的环境因子,并进一步探讨驱动泉口浮游生物群落结构变化的关键环境因子,解析岩溶泉口浮游生物群落结构对水环境变化的响应,为岩溶泉生态系统健康和水质的管理保护提供科学依据.
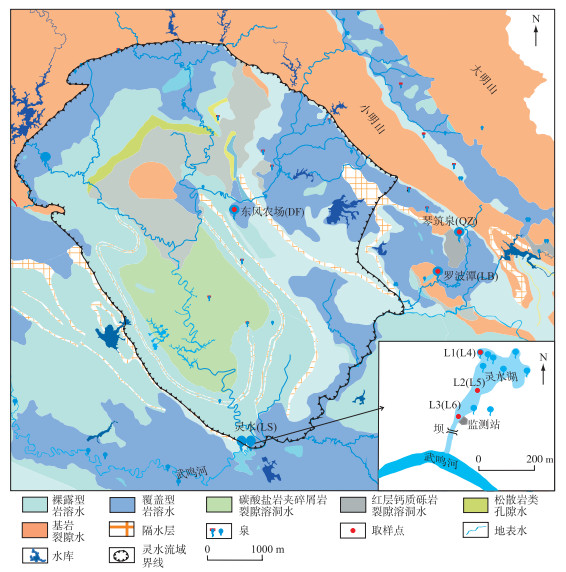
1 材料与方法 1.1 研究区概况广西南宁武鸣盆地地处亚热带季风气候区,面积为4536 km2 [13],年平均降雨量1300 mm,年平均气温21.7℃[14]. 土地利用类型以农用地为主,其中耕地和林地所占比重较大,建设用地扩张剧烈[15],近几年沃柑、香蕉、桉树种植发展和扩张迅猛. 由于对地下水资源的开采量逐年上升,盆地内多个岩溶泉都发生流量减少、水质恶化的过程.
盆地内出露的岩溶泉数量超过120个,其中灵水是武鸣盆地内流量最大的泉水,汇水面积为697 km2,大气降水为其主要补给来源[16]. 灵水是9眼泉组成的泉群,水深2~4 m,水温常年保持在23℃左右,水体清澈透明,是南宁市武鸣区居民的供水水源. 泉水集中出露后形成一面积约为29300 m2的湖泊(表 1),向下游排泄至当地的河流(图 1). 水化学监测结果显示,灵水的水质一直符合地下水I类标准,但2010年开始湖底原本茂盛的沉水植物突然大面积死亡,到2013年基本完全消失. 此后,灵水发生一系列的水环境变化,从沉水植物死亡(2010—2013年)到草型转变藻型的不稳定期(2014—2017年),至现阶段的藻型湖泊稳定期(2018—2021年)[17-19].
| 表 1 4个岩溶泉的基本信息 Tab. 1 Basic information of the four karst springs |
罗波潭是武鸣盆地出露的第二大泉水. 地下水出露后形成一个面积约2350 m2的潭水,最大水深100 m左右,水温稳定在23℃左右,为罗波镇居民的饮用水源. 罗波潭在下游排泄至河流,周围为城镇居住地. 罗波潭地下河出口一直以来无沉水植物生长,水体常年清澈.
东风农场溶潭和琴筑泉也是盆地内重要的泉水. 东风农场为深度较大的水潭,水面面积400 m2,水深可达70 m. 东风农场溶潭水体无水平流动,一直以来无沉水植物生长,表层水温主要受气温影响. 东风农场水潭是当地3000多名居民的重要饮用水源,并大量用于灌溉.
琴筑泉位于农田中,水面面积约320 m2,水深约1.5 m,水温23℃左右,水流速度慢,罗非鱼为泉内主要生物之一. 琴筑泉泉口原本沉水植物生长茂盛,但在人为拔除后泉水透明度降低,水环境有恶化趋势. 琴筑泉出露地表后在地面上流动约1 km后流入地表河流.
1.2 研究方法 1.2.1 采样点布置和采样时间选择2016年7月和2020年7月两个时期作对比研究,这两个时期分别对应灵水湖的草型转变为藻型的不稳定期和藻型相对稳定期. 对灵水、琴筑泉、罗波潭和东风农场进行水化学和浮游生物的取样. 根据泉水流向、流速和水面面积等情况(表 1),灵水从上游至下游共设置3个采样点,琴筑泉、罗波潭和东风农场采样点各一个(图 1). 2016年取样编号依次为L1~L3、DF-16、QZ-16、LB-16,2020年取样点编号依次为L4~L6、DF-20、QZ-20、LB-20.
1.2.2 样品采集与处理2016年浮游生物定性与定量检测、水的理化指标现场与室内测定根据文献[12]. 2020年浮游生物定性与定量分析、水理化指标现场与室内测定按照如下方法.
浮游植物定性样品的采集使用25号浮游生物网,在水面下0.5 m左右呈“∞”状缓慢采集数分钟,将网头中浓缩的样品装入100 mL塑料取样瓶内,现场立即加入10 % 鲁哥碘液进行染色固定,用于后续定性镜检分类. 定量样品采集使用1 L干净塑料瓶,固定方法同定性样品,沉淀浓缩后在显微镜下鉴定并计数.
使用25号浮游生物网进行浮游动物定性样品的采集,并用10 % 的福尔马林溶液固定;定量样品使用5 L有机玻璃采水器采集20 L水样并使用13号浮游生物网过滤,固定方法同定性样品,沉淀浓缩后进行样品鉴定并计数.
采集浮游生物样的同时在各个取样点使用美国Manta多参数水质分析仪现场测量水温(WT)、溶解氧(DO)、电导率(SEC)和pH. 采集1 L水样根据国家标准方法[20]测定总氮(TN)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH3-N)、总磷(TP)和高锰酸盐指数(CODMn)浓度等化学指标. 叶绿素a(Chl.a)浓度使用美国Turner Designs公司生产的Cyclops-7F水下荧光仪测定.
1.3 数据分析和评价方法 1.3.1 综合营养状态指数营养状态采用以Chl.a为核心的综合营养状态指数法[21]进行评价. 本研究中以水体Chl.a、TN、TP浓度和CODMn为单项指标,通过加权综合计算得到综合营养状态指数,并对营养状态进行判定.
1.3.2 优势种判定与生物多样性指数采用Mcnaughton优势度指数[22]计算物种优势度,将Y > 0.02的物种定为优势种. 生物多样性采用Shannon-Wiener指数(H′)[23]和Margalef物种丰富度指数(D)[24]进行计算,公式分别为:
| $ Y=\left(n_{i} / N\right) f_{i} $ | (1) |
| $ H^{\prime}=-\sum \frac{n_{i}}{N} \ln \frac{n_{i}}{N} $ | (2) |
| $ D=\frac{S-1}{\ln N} $ | (3) |
式中,fi表示第i种在各采样点的出现频率,ni表示第i种的个体数,N表示样品的总个体数,S为物种数目. 根据H′指数和D指数对水质污染状况进行评价,标准参考文献[7].
1.3.3 数据处理与分析使用CANOCO5软件对浮游生物与环境因子进行多元统计分析,通过排序寻找浮游生物群落的变化与环境因子的关系. 以浮游生物优势种作为响应变量进行排序分析,由于各指标间数据差异较大,在进行排序分析前,将响应变量和除pH外的解释变量数据进行lg(x+1)转化,使数据趋于正态分布[25]. 浮游植物的去趋势分析(DCA) 显示,各排序轴梯度长度最大值为2.8,选择基于线性模型的冗余分析(RDA)可以更好地解释岩溶泉环境因子对于浮游植物生态分布的影响. 而浮游动物的DCA分析显示,4个排序轴中梯度长度最大值为9.9,但CCA分析的结果不理想,故对浮游动物选择RDA分析.
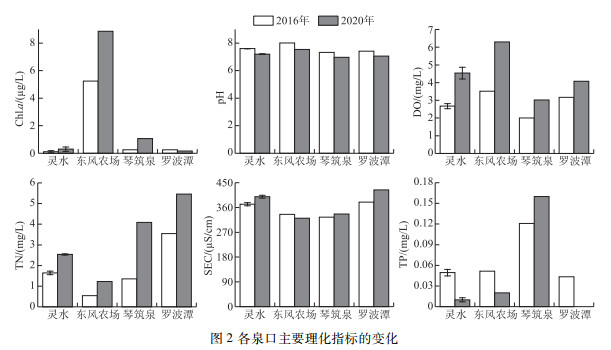
2 结果分析 2.1 水体理化指标与综合营养状态变化各泉口水体主要理化指标的变化见图 2. 2016年,4个泉口各采样点Chl.a浓度在0.003~5.249 μg/L之间,平均为1.020 μg/L. pH的变化范围为7.32~8.01,平均为7.59. DO浓度在2.00~3.51 mg/L之间,平均为2.78 mg/L. TN浓度在0.54~3.55 mg/L之间,平均为1.73 mg/L. SEC在325.0~381.0 μS/cm之间,平均为359.2 μS/cm. TP浓度在0.039~0.121 mg/L之间,平均为0.061 mg/L.
|
图 2 各泉口主要理化指标的变化 Fig.2 Changes of major physicochemical parameters in each spring |
2020年,4个泉口各采样点Chl.a浓度在0.06~8.86 μg/L之间,平均为1.83 μg/L,东风农场、琴筑泉上升幅度较大,其上升幅度达3.61 μg/L. pH范围在6.97~7.54之间,平均为7.20,pH有所下降. DO浓度在3.02~6.30 mg/L之间,平均为4.50 mg/L,与pH的变化趋势相反,DO浓度表现为升高. SEC在321.4~423.7 μS/cm之间,仅东风农场有所降低,其他泉口均为升高. 2020年各泉口TN浓度在1.23~5.46 mg/L之间,平均为3.17 mg/L,经过4年的时间,各泉口TN浓度大幅度上升,其中琴筑泉上升幅度最大,达2.73 mg/L,其次为罗波潭. 值得注意的是,在相同时期,东风农场TN浓度低于其他泉口. TP浓度除琴筑泉升高外其他泉口均表现为降低.
各泉综合营养状态指数结果如表 2所示. 可见2016年各泉基本处于贫-中营养状态,2020年均向富营养化方向变化. 其中处在农田中的琴筑泉营养状态由中营养变成富营养状态,罗波潭由贫营养变成中营养状态. 各泉营养状态排序为:琴筑泉>东风农场>罗波潭>灵水.
| 表 2 各泉综合营养状态指数评价结果 Tab. 2 Evaluation results of trophic level index of each spring |
2016年,4个泉共鉴定出浮游植物3门16种,其中绿藻门8种,硅藻门6种,蓝藻门2种(图 3). 东风农场种类最多,为3门14种;灵水为1门4种;琴筑泉和罗波潭均为1门1种. 东风农场浮游植物总丰度最大,为15.40×104 cells/L;其次是灵水,为1.58×104 cells/L;琴筑泉为900 cells/L;罗波潭为711 cells/L. 4个泉浮游植物总丰度为1.71×105 cells/L. 由图 4a可以看出,东风农场浮游植物群落结构为蓝藻-绿藻-硅藻型,灵水、琴筑泉和罗波潭均为硅藻型. 2020年,4个泉共鉴定出浮游植物6门70种,其中硅藻门和绿藻门种类较多,分别为28种和27种;蓝藻门10种;甲藻门、和裸藻门均为2种;隐藻门1种. 东风农场鉴定出的种类最多,为40种;琴筑泉31种;罗波潭24种;灵水21种. 东风农场浮游植物总丰度最大,为787.96×104 cells/L;琴筑泉为6.15×104 cells/L,灵水为3.72×104 cells/L;罗波潭为1.35×104 cells/L. 4个泉浮游植物总丰度为79.92×105 cells/L. 由图 4b可以看出,2020年东风农场浮游植物群落结构为蓝藻-绿藻-硅藻型,琴筑泉为蓝藻-硅藻-绿藻型,灵水为硅藻-蓝藻型,罗波潭为硅藻型. 总体来看,4个泉浮游植物检出种类和丰度均上升,各泉蓝藻或绿藻门比例上升,灵水与琴筑泉浮游植物群落结构发生了较明显的改变,而东风农场和罗波潭没有太大变化.

|
图 3 浮游生物种类组成 Fig.3 Composition of plankton species |

|
图 4 2016年(a)与2020年(b)各泉口浮游植物相对丰度 Fig.4 Phytoplankton relative abundance of each spring in 2016 (a) and 2020 (b) |
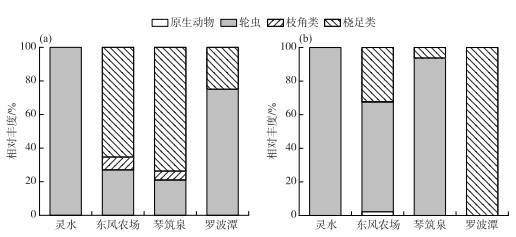
2016年,共鉴定出浮游动物3类13种,其中轮虫种类最多,共检出7种,枝角类和桡足类均为4种(图 3). 东风农场共鉴定浮游动物3门7种,灵水1门2种,琴筑泉3门4种,罗波潭2门2种. 东风农场浮游动物总丰度最大,为243.75 ind./L,琴筑泉浮游动物总丰度为13.3 ind./L,罗波潭为3.93 ind./L,灵水为3.30 ind./L. 4个泉浮游动物总丰度为264.28 ind./L. 由图 5a可见东风农场与琴筑泉浮游动物均以桡足类和轮虫为主,灵水与罗波潭则以轮虫为主. 2020年共鉴定出浮游动物4类37种,其中轮虫类最多,为20种,原生动物9种,桡足类6种,枝角类2种. 东风农场鉴定出的种类最多,为23种,琴筑泉19种,罗波潭14种,灵水7种. 东风农场浮游动物总丰度最大,为132.85 ind./L,琴筑泉1.6 ind./L,灵水1.5 ind./L,罗波潭1.3 ind./L. 4个泉浮游动物总丰度为137.25 ind./L. 由图 5b可以看出,2020年东风农场、琴筑泉、灵水浮游动物以轮虫为主,罗波潭全部为桡足类. 总体来看,4个泉浮游动物检出种类增加,但丰度却下降,浮游动物群落结构变化相对较为复杂.
|
图 5 2016年(a)与2020年(b)各泉口浮游动物相对丰度 Fig.5 Zooplankton relative abundance of each spring in 2016 (a) and 2020 (b) |
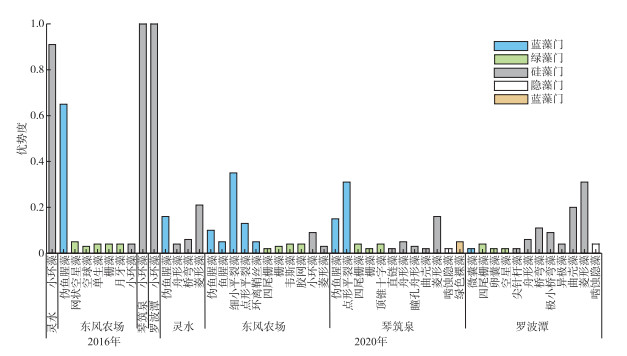
从优势种来看,2016年灵水、琴筑泉、罗波潭浮游植物优势种单一,均为小环藻(Cyclotella sp.),东风农场优势种较多,伪鱼腥藻(Pseudoanabaena sp.)占绝对优势(图 6). 2020年东风农场、琴筑泉、罗波潭优势种较多,灵水优势种少,各优势种优势度较低,仅有部分种类优势度较高,各泉蓝藻门检出种类虽不多,但在多数泉中优势度较大. 东风农场绝对优势种为细小平裂藻(Merismopedia minima),琴筑泉为点形平裂藻(Merismopedia punctata),罗波潭与灵水的主要优势种为菱形藻(Nitzschia sp.). 总体来看,4年后各泉浮游植物优势种增加,但优势度较均匀.
|
图 6 浮游植物优势种与优势度 Fig.6 Dominant species and dominance of phytoplankton |
浮游动物优势种显示(图 7),2016年,4个泉优势种均以小型类浮游动物为主. 灵水浮游动物优势种为螺型龟甲轮虫(Keratella cochleris)和曲腿龟甲轮虫(Keratella valga),东风农场与琴筑泉绝对优势种为无节幼体(Nauplius),罗波潭绝对优势种为螺型龟甲轮虫. 2020年,灵水、东风农场与琴筑泉优势种仍以小型类浮游动物为主,但灵水与琴筑泉优势种减少,出现某一优势种占据绝对地位的现象,如琴筑泉中针簇多肢轮虫(Polyarthra trigla)为绝对优势种,优势度达到0.94. 东风农场地下河天窗绝对优势种同样为针簇多肢轮虫,罗波潭浮游动物绝对优势种为哲水蚤桡足幼体(Canaloida Copepodid).

|
图 7 浮游动物优势种与优势度 Fig.7 Dominant species and dominance of zooplankton |
4个泉口浮游生物多样性的变化见表 3. 根据浮游植物H′指数对水质污染状况进行评价的结果表明,2016年各泉污染等级为中-重污染,根据D指数评价的污染等级为中-重污染. H′指数与D指数对水质的评价结果相似. 2020年,H′指数评价的污染等级为中污染,D指数评价的污染等级为中-重污染.
| 表 3 不同时期浮游生物多样性 Tab. 3 Diversity of plankton in different periods |
浮游动物H′指数对水质污染状况进行评价的结果显示,2016年各泉污染等级为中-重污染,D指数评价的污染等级为中-重污染. H′指数与D指数对水质的评价结果相似. 2020年,各泉口的污染等级为中-重污染. D指数评价的污染等级为无污-重污染.
2.4 浮游生物群落结构与环境因子的关系将浮游生物优势种和环境因子进行RDA排序分析,探索影响4个岩溶泉浮游生物分布与演替的主要环境因子. 进行排序分析的浮游生物优势种代码见表 4.
| 表 4 RDA排序图中的浮游生物物种及编号 Tab. 4 Species and their codes of plankton for RDA |
浮游植物的RDA排序结果显示,第1排序轴和第2排序轴的特征值分别为0.519和0.194,共解释了浮游植物群落变异程度的71.3 %,物种环境相关系数分别为0.997、0.999,物种环境间相关系数较高,表明4个岩溶泉浮游植物物种组成与环境因子之间关系紧密. RDA分析结果表明,WT、pH、NO2--N浓度、TP浓度、NO3--N浓度对浮游植物群落分布的解释率较高且达到显著性水平(P<0.05),因此这5个因子是影响浮游植物种类和丰度的重要环境因子.
浮游植物样点、环境因子和物种的RDA三序图(图 8a)表明,大多数浮游植物种类分布在第1轴和第2轴附近以及第2象限中,且与WT呈正相关. 分布于第1轴附近的浮游植物主要为蓝藻门和绿藻门的一些种类,主要受NH3-N和DO浓度影响,位于第2轴附近的大部分为绿藻,主要受NO2--N浓度和pH的影响. 而位于第1象限受WT影响最大的主要是一些硅藻和少部分蓝藻和绿藻. 样点与环境因子的关系显示,样点L1~L6、LB-16、LB-20、QZ-16相对集中(图 8a中虚线部分),与TN浓度、NO3--N浓度、SEC呈正相关,而与WT呈负相关. DF-16、DF-20在RDA第1、第2排序轴上得到了较好的分化,DF-16主要与NO2--N浓度和pH呈正相关,DF-20受DO和NH3-N浓度影响较大. QZ-20位于第1象限中,受WT影响最大,而与TN浓度、NO3--N浓度、SEC呈负相关.

|
图 8 浮游植物(a)和浮游动物(b)与环境因子及样点的RDA三序图 Fig.8 RDA triplot of phytoplankton (a) and zooplankton (b) species and environmental factors and samples |
浮游动物的RDA分析显示,第1排序轴和第2排序轴的特征值分别为0.547和0.371,共解释了浮游动物群落变异程度的91.8 %,物种环境相关系数均达到1,表明RDA排序能够很好地反映4个泉浮游动物与环境因子间的关系. 浮游动物的RDA分析结果表明,WT、NO2--N浓度、NH3-N浓度和Chl.a浓度对浮游动物群落分布的解释率较高且达到显著性水平(P<0.05),因此,这4个环境因子是影响浮游动物群落分布的重要环境因子.
浮游动物的分布与浮游植物的分布相似,主要集中在3个区域(图 8b). 分布于第1象限的物种包括轮虫、枝角类和桡足类的部分物种,主要受NO2--N、pH影响. 分布于第2象限的主要为轮虫,与DO和NH3-N浓度呈正相关. 而位于第1轴下方的同样包括轮虫、枝角类和桡足类,但其主要受TN浓度、NO3--N浓度、SEC的影响. 浮游动物样点与环境因子的关系显示,集中于第1象限下方的样点L1~L6、LB-16、LB-20、QZ-16和QZ-20与TN浓度、NO3--N浓度、SEC呈正相关,与WT、Chl.a浓度呈负相关. DF-16、DF-20在RDA第1、2排序轴上同样得到了较好的分化,与浮游植物一致,DF-16同样主要与NO2--N浓度和pH呈正相关,DF-20受DO和NH3-N浓度影响较大.
3 讨论 3.1 泉口水环境变化特征及原因地下水出露的泉口水环境受含水层以及所在周围环境的共同影响,包括含水层的性质、水动力条件、地表径流输入以及周围人类活动的影响等[26]. 4个泉均发育于碳酸盐岩地区,且水化学类型都属于Ca-HCO3型,但相同时期不同泉口的理化性质还是有一定的差异,且由于含水层性质、地下水水动力条件以及所处环境等的不同,导致经过4年的时间4个泉理化性质的变化趋势也有一定差异.
根据《地下水水质标准》(GB/T 14848—2017),理化指标和毒理学指标监测结果显示,4个泉的水质仍属于Ⅰ类或Ⅱ类,即根据理化指标与毒理学指标认为水质仍符合较高的水质标准. 然而水体的营养水平已经上升,部分泉口水生环境条件已经明显退化,如琴筑泉与罗波潭营养水平上升最为明显. 氮、磷是导致水体富营养化的重要元素. 4个泉的TN浓度在4年前后全部表现为上升,这与盆地内种植作物的结构变化有很大的关系,原本以木薯、甘蔗以及水稻等作物为主的种植面积逐渐减少,近年来柑橘、香蕉等果树的种植面积不断扩大[27],与传统作物相比,柑橘的种植一年四季都需要施肥打药,这无疑加剧了水体氮浓度的升高. RDA三序图中样点与环境因子的关系表明,灵水、琴筑泉与罗波潭受TN浓度、NO3--N浓度、SEC影响较大,而东风农场地下河天窗两个时期主要受不同形态氮的影响,其TN浓度也比其他泉口低,这主要是由人类活动的影响程度不同导致. 4个泉的TP浓度变化趋势也不完全一致,琴筑泉TP浓度在4个泉中最高,而其他3个泉相近,相同时期琴筑泉TP浓度是其他3个泉的数倍,说明琴筑泉受人类活动影响更大. 武鸣盆地内泉口众多,相当部分泉口与居民居住地接近,人类的生产、生活等活动产生的污染物随时可能影响到泉口的水质.
除污染负荷增加外,泉口水质恶化的主要原因还包括对地下水开采量的增加造成的泉流量下降. 这在以深埋地下水出露的灵水最为典型. 前人对灵水的长期监测表明,灵水作为南方岩溶区出露的典型构造型岩溶大泉,其枯季流量1980s以来下降了12.5 % ~50 % [16]. 由于城镇化的发展,城镇人口增加,主要取水口已由流量较低的1号出水口转移至流量高的2号出水口,而从2020年10月开始2号取水口也难达供水需求,以至于在用水高峰阶段湖水竟被倒吸至泉口下部. 此外,泉域上游农业灌溉需水量增加或桉树种植等也可能是导致泉流量下降的重要因素,泉流量的降低意味着水动力减弱,进而导致泉口对污染物的稀释能力降低,泉口周围由地表径流带来的污染物在泉口聚积,使水质有继续恶化的可能.
3.2 浮游生物群落对主要水环境因子变化的响应由于其较短的生长繁殖周期,浮游生物对所处水环境的变化能作出迅速的响应,如水体中的温度、光照、营养盐、等环境条件发生改变时,浮游生物的种类和数量会迅速发生变化,群落结构也表现出快速演替[28]. 大量研究表明,水温是影响浮游生物生长、群落组成和数量变化等最重要的环境因子之一[29-31]. 不同种类浮游生物有不同的最适生长繁殖温度范围,因此水温的变化不仅会影响浮游生物的生长,还可能会导致优势种的演替[32]. 在本研究中,蓝藻门在WT高而营养盐较低的东风农场地下河天窗中一直为主要门类,而WT偏低的其他3个泉中硅藻门为主要门类之一,这与蓝藻门是喜暖种类而硅藻门为冷水性物种有关[7]. 浮游生物与环境因子的RDA分析结果显示,WT是影响浮游生物群落结构的重要影响因子,大多数浮游生物与WT呈正相关. 但灵水、琴筑泉与罗波潭为地下水排泄形成的恒温泉,WT对其浮游生物群落结构变化基本没有影响,东风农场地下河天窗WT虽受气温影响较大,但两个时期相比无明显变化,其浮游植物群落结构未发生改变. 因此,WT是影响浮游生物群落结构的重要环境因子,但两个时期浮游生物群落结构变化主要不是WT所致.
pH与浮游植物之间是互相影响的关系. 水体pH主要从两方面对藻类产生影响,一方面改变环境的酸碱度,酸性太强或碱性太强都会对藻细胞产生伤害,只有在适宜的酸碱度范围内,藻细胞才能正常生长繁殖,另一方面通过碳酸盐平衡系统及不同形态无机碳的分配关系来影响藻类的生长[33]. 较高的pH有利于蓝藻的生长而使其处于竞争优势[34-35],其他不适应高pH的藻类生长则受到限制. 与2016年相比,2020年各泉pH有所下降,但蓝藻丰度仍有较大提升,因此,pH可能不是影响游植物群落结构变化的因素. 浮游动物与环境因子的RDA分析显示,pH对浮游动物的变化解释率较低且未达到显著性水平. 因此,pH对浮游动物的群落结构变化影响不大.
浮游植物的种类、数量及群落结构与水体营养水平密切相关,其生长离不开氮、磷等营养物质的供给[36]. 在4个泉中琴筑泉TP浓度最高,但其浮游植物丰度却并非最高,且2020年其余泉水TP浓度降低,浮游植物数量同样大量增加,说明TP浓度不是决定浮游植物群落结构变化的主要环境因子,其主要是对浮游植物的个体大小产生影响. 同样作为初级生产者,浮游植物与沉水植物在水体中是竞争关系,沉水植物对于维持水生生态系统结构和功能的稳定有着重要作用[37]. 各泉浮游植物种类和数量随氮浓度上升而升高,但却只有原本为草型生态系统的灵水与琴筑泉浮游植物群落结构发生转变,表明氮浓度升高以及缺少沉水植物对营养物质的争夺可能是灵水与琴筑泉浮游植物群落结构转变的主要原因. RDA排序结果也显示,多数浮游植物与不同形态氮的相关性较强,氮输入的上升对浮游植物的分布具有显著的影响,不同泉口优势物种对各形态氮的响应有所差异,因此,各泉口氮浓度的升高对浮游植物有重要影响. 水体中Chl.a的水平可以反映浮游植物生物量的高低[29],浮游植物是浮游动物的主要食物来源,故Chl.a浓度在一定程度上能够反映浮游动物的饵料水平. 林青等[31]对滴水湖浮游动物的研究表明,浮游动物密度和生物量与Chl.a浓度呈极显著的正相关关系和回归关系,陈光荣等[38]对广东省惠州西湖浮游动物的调查显示,浮游动物总丰度与Chl.a浓度的正相关性极强. 本研究RDA分析结果也显示,Chl.a浓度与大部分物种呈正相关,是影响浮游动物群落结构的重要环境因子之一. 大量研究表明,N、P等营养元素能调节浮游植物的生长,其主要通过影响浮游植物而间接对浮游动物的分布产生影响[9, 31, 39]. 徐梅等[40]对焦岗湖浮游甲壳动物的研究表明,当浮游植物的丰度较高时,可能会影响水体的透明度、DO浓度等因子,进而导致浮游甲壳动物密度下降. 这与本研究结果一致,2020年部分泉口一些大型的浮游甲壳动物密度下降,这可能与氮输入上升导致浮游植物丰度与群落分布改变有关.
总体而言,4个岩溶泉口浮游生物群落对两个时期主要水环境因子的变化已经显示出了一定的响应,具体表现为浮游植物种类和丰度上升,指示富营养水体的蓝藻门或绿藻门种类增加. 受浮游植物影响浮游动物丰度降低,部分泉口轮虫类丰度增大. 部分泉口浮游生物群落结构发生改变,优势种转变为更适应于富营养化环境的耐污种,或耐污种种类和数量上升,但浮游生物的多样性并未与水体营养水平完全吻合. 浮游生物多样性常用来评判水体营养状况,水体受到污染越严重,浮游生物的多样性指数值就越低[41]. 但本研究中部分泉口浮游生物多样性指数与水体的营养状况并不符合这一结论,猜测多样性指数与水体的营养水平的关系不确定性较大,因此不能单凭多样性来反映水环境状况. 限于目前调查资料在时间上的不连续性,盆地内岩溶泉口浮游生物群落的长期演变趋势还需要未来的持续监测来证实.
4 结论与建议1) 2016—2020年,广西武鸣盆地内4个岩溶泉浮游生物检出种类和数量有所上升. 浮游植物快速繁殖,总丰度由1.71×105 cells/L上升至79.92×105 cells/L,2016年除东风农场地下河天窗外,其他各泉浮游植物都以硅藻门为主,而2020年各泉蓝藻门或绿藻门比例上升,灵水与琴筑泉尤为明显. 浮游动物总丰度由264.28 ind./L降至137.25 ind./L,大型甲壳类浮游动物密度减少,部分泉口轮虫类密度升高. 部分泉口优势种转变为更适应于富营养环境的耐污种,或是耐物种种类和数量上升. 但生物多样性对水体营养水平的指示作用有不确定性.
2) WT、pH、NO2--N、TP、NO3--N是影响浮游植物群落结构的重要环境因子,氮浓度的升高以及缺少沉水植物对营养物质的争夺是灵水与琴筑泉浮游植物群落结构转变的主要原因. 影响浮游动物群落结构的主要环境因子为WT、NO2--N、NH3-N和Chl.a,氮输入增加导致浮游植物的数量与群落分布改变,从而间接改变了浮游动物的群落分布.
3) 尽管所调查岩溶泉的水化学或毒理学指标对水质的评价结果表明其水质仍符合较高的水质标准,但实际上水体营养水平已经在逐渐升高,部分泉口水生生态系统的结构也已经发生改变. 因此,建议岩溶泉的水质评价依据理化指标的同时还应关注生物指标,多个指标的相互验证才能更全面地反映水体健康状况. 同时,为使泉口以及区域地下水资源的可持续开发利用,建议对重要泉口划分泉域保护区,控制泉口污染物的输入,合理开发和管理地下水资源. 为保持生态系统结构与功能的完整,对已转变的水生生态系统可考虑尽快进行生态修复.
| [1] |
Guo F, Jiang GH, Yuan DX et al. Evolution of major environmental geological problems in karst areas of Southwestern China. Environmental Earth Sciences, 2013, 69(7): 2427-2435. DOI:10.1007/s12665-012-2070-8 |
| [2] |
Guo F. The Characteristics of environment function and formation mechanism of cave hyporheic zone in karst water system [Dissertation]. Xi'an: Changan University, 2017. [郭芳. 岩溶洞穴交互带的环境功能特征及形成机制[学位论文]. 西安: 长安大学, 2017. ]
|
| [3] |
Tong CH. Study on factors causing eutrophication of water system and phytoremediation [Dissertation]. Hangzhou: Zhejiang University, 2004. [童昌华. 水体富营养化发生原因分析及植物修复机理的研究[学位论文]. 杭州: 浙江大学, 2004. ]
|
| [4] |
Liu LZ, Qin BQ, Zhu GW et al. Effect of decomposition products of cyanobacteria on Myriophyllum spicatum and water quality in Lake Taihu, China. Acta Ecologica Sinica, 2012, 32(10): 3154-3159. [刘丽贞, 秦伯强, 朱广伟等. 太湖蓝藻死亡腐烂产物对狐尾藻和水质的影响. 生态学报, 2012, 32(10): 3154-3159. DOI:10.5846/stxb201104060439] |
| [5] |
Zhang LJ, Ye C, Li CH et al. The effect of submerged macrophytes decomposition on water quality. Research of Environmental Sciences, 2013, 26(2): 145-151. [张来甲, 叶春, 李春华等. 沉水植物腐解对水体水质的影响. 环境科学研究, 2013, 26(2): 145-151. DOI:10.13198/j.res.2013.02.34.zhanglj.001] |
| [6] |
Xie YF. Study on interaction of submerged macrophytes and nutrients in the water and sediment[Dissertation]. Guangzhou: Jinan University, 2008. [谢贻发. 沉水植物与富营养湖泊水体、沉积物营养盐的相互作用研究[学位论文]. 广州: 暨南大学, 2008. ]
|
| [7] |
Chen H, Liu Q, Pan JX et al. Spatial and temporal variation of the plankton community and its relationship with environmental factors in the city section of the Ba River. Acta Ecologica Sinica, 2019, 39(1): 173-184. [陈红, 刘清, 潘建雄等. 灞河城市段浮游生物群落结构时空变化及其与环境因子的关系. 生态学报, 2019, 39(1): 173-184.] |
| [8] |
Webber M, Edwards-Myers E, Campbell C et al. Phytoplankton and zooplankton as indicators of water quality in Discovery Bay, Jamaica. Hydrobiologia, 2005, 545(1): 177-193. DOI:10.1007/s10750-005-2676-x |
| [9] |
Chen JQ, Zhao K, Cao Y et al. Zooplankton community structure and its relationship with environmental factors in Poyang Lake. Acta Ecologica Sinica, 2020, 40(18): 6644-6658. [陈佳琪, 赵坤, 曹玥等. 鄱阳湖浮游动物群落结构及其与环境因子的关系. 生态学报, 2020, 40(18): 6644-6658. DOI:10.5846/stxb201910282257] |
| [10] |
Gou T, Xu ZC, Li J et al. Phytoplankton community structure and water quality assessment of Hejiang River, a branch of Xijiang River, Pearl River drainage basin. J Lake Sci, 2015, 27(3): 412-420. [苟婷, 许振成, 李杰等. 珠江流域西江支流贺江浮游藻类群落特征及水质分析. 湖泊科学, 2015, 27(3): 412-420. DOI:10.18307/2015.0307] |
| [11] |
Hu F, Xu ZC, Yao LA et al. Community structure of phytoplankton and its relationship with aquatic environment factors in Jiantan Reservoir. Acta Scientiae Circumstantiae, 2014, 34(4): 950-958. [胡芳, 许振成, 姚玲爱等. 剑潭水库浮游植物群落特征与水环境因子关系研究. 环境科学学报, 2014, 34(4): 950-958. DOI:10.13671/j.hjkxxb.2014.0156] |
| [12] |
Zhao HL, Guo F, Liu SH. Structure of the phytoplankton community at the Lingshui karst spring and its implications for water environment. Carsologica Sinica, 2017, 36(4): 484-491. [赵红亮, 郭芳, 刘绍华. 灵水岩溶泉浮游植物群落结构及其对水环境的指示作用. 中国岩溶, 2017, 36(4): 484-491. DOI:10.11932/karst20170409] |
| [13] |
Huang XF. Study on formation conditions and protection suggestions for the Lingshui spring in Wuming, Guangxi. Southern Land and Resources, 2015(10): 28-31. [黄秀凤. 广西武鸣灵水泉形成条件研究及保护建议. 南方国土资源, 2015(10): 28-31. DOI:10.3969/j.issn.1672-321X.2015.10.010] |
| [14] |
Huang ZW. Hydrogeological conditions of the large karst spring in Lingshui, Guangxi. Geological Survey of China, 2017, 4(5): 74-81. [黄之巍. 广西灵水岩溶大泉水文地质条件. 中国地质调查, 2017, 4(5): 74-81. DOI:10.19388/j.zgdzdc.2017.05.11] |
| [15] |
Zhang L. Research on spatial distribution of urban and rural reserved construction land at Wuming County based on the "Antiplaning" theory [Dissertation]. Nanning: Guangxi Teachers Education University, 2011. [张亮. 基于反规划理论的武鸣县城乡后备建设用地空间布局研究[学位论文]. 南宁: 广西师范学院, 2011. ]
|
| [16] |
Jiang GH, Guo F. Source identification of Lingshui Spring using GIS-based hydrochemistry and environmental isotopic methods. Water Resources Protection, 2012, 28(1): 59-63. [姜光辉, 郭芳. 利用GIS水化学和同位素方法判断灵水来源. 水资源保护, 2012, 28(1): 59-63. DOI:10.3969/j.issn.1004-6933.2012.01.014] |
| [17] |
Guo F, Jiang GH, Zhao HL et al. Physicochemical parameters and phytoplankton as indicators of the aquatic environment in karstic springs of South China. Science of the Total Environment, 2019, 659: 74-83. DOI:10.1016/j.scitotenv.2018.12.329 |
| [18] |
Guo F, Jiang GH, Liu SH. Change of water environment in Lingshui karst spring and new issues faced in water resources management and protection. Guangxi Sciences, 2018, 25(5): 553-559. [郭芳, 姜光辉, 刘绍华. 武鸣灵水岩溶泉的水环境变化及管理保护面临的新问题. 广西科学, 2018, 25(5): 553-559.] |
| [19] |
Guo F, Jiang GH, Wang WK et al. Concept of karst cave hyporheic zone and its significance in water resource management. Carsologica Sinica, 2019, 38(1): 1-9. [郭芳, 姜光辉, 王文科等. 岩溶洞穴交互带概念的提出及其在水资源管理中的意义. 中国岩溶, 2019, 38(1): 1-9. DOI:10.11932/karst20190101] |
| [20] |
Editorial board of "Monitoring and analysis methods of water and wastewater" Ministry of Environmental Protection of the People's Republic of China. Monitoring and analysis methods of water and wastewater: Fourth edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [21] |
Wang MC, Liu XQ, Zhang JH. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49. DOI:10.3969/j.issn.1002-6002.2002.05.018] |
| [22] |
McNaughton SJ. Relationships among functional properties of Californian grassland. Nature, 1967, 216(5111): 168-169. DOI:10.1038/216168b0 |
| [23] |
Shannon CE, Weaver W. The mathematical theory of communication. Urbana: University of Illinois Press, 1949.
|
| [24] |
Margalef DR. Inpersproctivesi marine biology (A Buzzati-Traversoed). California: University of California Press, 1958: 323-347.
|
| [25] |
Ter Braak CJ, Smilauer P. CANOCO Reference Manual and User's Guide to Canoco for Windows: Software for Canonical Community Ordination (Version 4). Ithaca, Greece: Microcomputer Power, 1998.
|
| [26] |
Guan QH, Li FL, Wang AQ et al. Hydrochemistry characteristics and evolution of karst spring groundwater system in Jinan. Carsologica Sinica, 2019, 38(5): 653-662. [管清花, 李福林, 王爱芹等. 济南市岩溶泉域地下水化学特征与水环境演化. 中国岩溶, 2019, 38(5): 653-662.] |
| [27] |
Wei QM, Cao ZQ. Investigation and strategies on production and marketing of Orah industry in Guangxi. Modern Business Trade Industry, 2019, 40(27): 30-32. [韦秋梅, 曹志强. 广西脱贫致富产业——沃柑产销调查及策略. 现代商贸工业, 2019, 40(27): 30-32.] |
| [28] |
Fu MZ, Sun P, Sun X et al. Phytoplankton community structure and its ecological responses to environmental changes in Jinzhou Bay, China. Acta Ecologica Sinica, 2014, 34(13): 3650-3660. [傅明珠, 孙萍, 孙霞等. 锦州湾浮游植物群落结构特征及其对环境变化的响应. 生态学报, 2014, 34(13): 3650-3660. DOI:10.5846/stxb201305151068] |
| [29] |
Ruan XH, Shi XD, Zhao ZH et al. Correlation between chlorophyll-a concentration and environmental factors in shallow lakes in plain river network areas of Suzhou. J Lake Sci, 2008, 20(5): 556-562. [阮晓红, 石晓丹, 赵振华等. 苏州平原河网区浅水湖泊叶绿素a与环境因子的相关关系. 湖泊科学, 2008, 20(5): 556-562. DOI:10.18307/2008.0502] |
| [30] |
Li RR, Zhang GX, Zhang L. Multivariate analysis of the relations between phytoplankton assemblages and environmental factors in Chagan Lake Wetland. Acta Ecologica Sinica, 2014, 34(10): 2663-2673. [李然然, 章光新, 张蕾. 查干湖湿地浮游植物与环境因子关系的多元分析. 生态学报, 2014, 34(10): 2663-2673.] |
| [31] |
Lin Q, You WH, Xu FJ et al. Zooplankton community structure and its relationship with environmental factors in Dishui Lake. Acta Ecologica Sinica, 2014, 34(23): 6918-6929. [林青, 由文辉, 徐凤洁等. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 2014, 34(23): 6918-6929. DOI:10.5846/stxb201303060360] |
| [32] |
Ji ZY, Liu SJ. Phytoplankton community structure, related influencing factors and the evaluation of water quality in theFuxian Lake. Environmental Monitoring in China, 2019, 35(4): 67-77. [吉正元, 刘绍俊. 抚仙湖浮游植物群落结构、影响因子及水质评价. 中国环境监测, 2019, 35(4): 67-77.] |
| [33] |
Xu H, Liu ZP, Yuan L et al. Effect of pH on growth of several freshwater algae. Environmental Science & Technology, 2009, 32(1): 27-30. [许海, 刘兆普, 袁兰等. pH对几种淡水藻类生长的影响. 环境科学与技术, 2009, 32(1): 27-30. DOI:10.3969/j.issn.1003-6504.2009.01.007] |
| [34] |
Ma JR, Deng JM, Qin BQ et al. Progress and prospects on cyanobacteria bloom-forming mechanism in lakes. Acta Ecologica Sinica, 2013, 33(10): 3020-3030. [马健荣, 邓建明, 秦伯强等. 湖泊蓝藻水华发生机理研究进展. 生态学报, 2013, 33(10): 3020-3030. DOI:10.5846/stxb201202140200] |
| [35] |
Shapiro J. Blue-green dominance in lakes: The role and management significance of pH and CO2. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 1984, 69(6): 765-780. DOI:10.1002/iroh.19840690602 |
| [36] |
Yu QJ, Xu FJ, Jiang Y et al. Characteristics of phytoplankton community in Suzhou River in summer and autumn and their affecting factors. Journal of Ecology and Rural Environment, 2014, 30(4): 450-457. [俞秋佳, 徐凤洁, 蒋跃等. 夏秋季苏州河浮游植物群落特征及其影响因子. 生态与农村环境学报, 2014, 30(4): 450-457. DOI:10.3969/j.issn.1673-4831.2014.04.007] |
| [37] |
Jian MF, Jian MF, Li LY et al. Distribution pattern of submerged plants in typical wetlands of Poyang Lake and its influencing factors of water environment. Resources and Environment in the Yangtze Basin, 2015, 24(5): 765-772. [简敏菲, 简美锋, 李玲玉等. 鄱阳湖典型湿地沉水植物的分布格局及其水环境影响因子. 长江流域资源与环境, 2015, 24(5): 765-772.] |
| [38] |
Chen GR, Zhong P, Zhang XF et al. Zooplankton and its relationship with water quality in Huizhou West Lake. J Lake Sci, 2008, 20(3): 351-356. [陈光荣, 钟萍, 张修峰等. 惠州西湖浮游动物及其与水质的关系. 湖泊科学, 2008, 20(3): 351-356. DOI:10.18307/2008.0314] |
| [39] |
Gao ZH, Zhang J, Pi J et al. Zooplankton community structure and its relationships with environmental factors in Datong Lake of Hunan Province. Chinese Journal of Ecology, 2016, 35(3): 733-740. [高子涵, 张健, 皮杰等. 湖南省大通湖浮游动物群落结构及其与环境因子关系. 生态学杂志, 2016, 35(3): 733-740. DOI:10.13292/j.1000-4890.201603.025] |
| [40] |
Xu M, Wu FY, Liu JJ et al. Seasonal variation of community structure of crustacean zooplanktons in Lake Jiaoganghu. Chinese Journal of Ecology, 2016, 35(5): 1254-1262. [徐梅, 吴芳仪, 刘靓靓等. 焦岗湖浮游甲壳动物群落结构的季节动态. 生态学杂志, 2016, 35(5): 1254-1262. DOI:10.13292/j.1000-4890.201605.010] |
| [41] |
Yang SQ, Gao XL, Wang LJ et al. Phytoplankton community structure and driving factors in typical reservoirs of arid region of northwest China. J Lake Sci, 2021, 33(2): 377-387. [杨宋琪, 高兴亮, 王丽娟等. 西北干旱区典型水库浮游植物群落结构特征及驱动因子. 湖泊科学, 2021, 33(2): 377-387. DOI:10.18307/2021.0207] |
 2022, Vol. 34
2022, Vol. 34