(2: 中国科学院南京地理与湖泊研究所, 南京 210008)
(3: 江西生物科技职业学院, 南昌 330200)
(4: 中国科学院大学中丹学院, 北京 100049)
(5: 江苏大学国际基因组学研究中心, 镇江 212013)
(2: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: Jiangxi Biotech Vocational College, Nanchang 330200, P. R. China)
(4: Sino-Danish College, University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(5: International Genome Center, Jiangsu University, Zhenjiang 212013, P. R. China)
秀丽白虾(Exopalaemon modestus)隶属于长臂虾科(Palaemonidae)、白虾属(Exopalaemon),广泛分布于我国大型湖库,如太湖、洞庭湖、三峡水库等[1-3]. 秀丽白虾在这些湖泊中的产量和产值均较高,是主要经济渔获对象之一. 例如,秀丽白虾是“太湖三白”之一,全湖白虾产量曾达到2310.90 t[2]. 在鄱阳湖,秀丽白虾和日本沼虾占虾年总产量的70 % 以上[4].
秀丽白虾为一年生,寿命为12~14个月. 太湖秀丽白虾大多于每年春季(4月)抱卵,形成苗汛[2],并且在5—7月的水体中具有较高的现存量[1]. 研究发现秀丽白虾为杂食性虾类,处于平游期的秀丽白虾主要以浮游植物和轮虫为饵,随着体型的增长,开始摄食枝角类和桡足类,也可摄食水生植物、碎屑、鱼卵和底栖动物等[2, 5],总体而言偏好于动物性饵料. 对于亚热带地区湖库,春季浮游动物群落通常以大型枝角类—溞属(Daphnia spp.,后文简称Daphnia)为优势种类[6-7]. 例如Chen等调查发现2004年4月中旬太湖梅梁湾Daphnia的密度达到了50 ind./L[7], 杨丽丽等研究表明千岛湖透明溞(D. hyalina)通常在3月达到生物量高峰,在整个春季都保持着较高的密度[8]. 大量研究表明Daphnia对浮游植物的牧食是抑制浮游植物生长,维持湖泊春、夏季清水态的重要机制[9-10]. 在此期间,秀丽白虾等无脊椎动物捕食者的生长、繁殖和摄食活动可能会抑制浮游动物(特别是Daphnia)生长,通过营养级联效应,进而影响浮游植物生长和水体营养盐循环[11]. 例如研究发现糠虾(mysid)通过捕食浮游动物,间接促进了温带湖泊的富营养化,而且对于加拿大安大略湖(Lake Ontario),在5月和8月, 糠虾对浮游动物的摄食压力甚至要高于鱼类[12-13].
以往的研究从渔业的角度揭示了太湖、鄱阳湖、三峡水库等大型湖库秀丽白虾的种群动态、繁殖生物学特征与食性[2-5],但是从食物网角度探讨秀丽白虾对生态系统影响的研究较少. 本研究设计了一个微宇宙模拟实验,探讨我国亚热带湖库秀丽白虾对浮游动物、浮游植物群落以及水体营养水平的影响.
1 材料与方法 1.1 实验设置该实验于中国科学院太湖湖泊生态系统研究站(位于无锡市太湖梅梁湾; 31°24′13″N, 120°13′56″E)的湖岸平台上进行,实验于2020年4月7日开始,6月30日结束,共计84 d,秀丽白虾在此期间可以繁殖一代,并生长至成体阶段. 实验设置为单因素,共2个处理组,分别为无虾的对照组(C)和白虾组(S). 每个处理组设置6个重复,共12个实验单元. 实验桶为定购的500 L大型聚乙烯实验桶(桶高97 cm,上直径为90 cm,下直径为78 cm). 实验开始前1个月,利用地笼在太湖梅梁湾捕获足量秀丽白虾,随后放入盛有湖水的大型聚乙烯桶中暂养.
实验开始前半个月,抽取太湖梅梁湾湖水,经过孔径64 μm的浮游生物网过滤后注入各实验桶中,每个实验桶中注入480 L湖水. 随后每桶添加100只蚤状溞(D. pulex,后文简称Daphnia),模拟大型枝角类占优势的春季浮游动物群落. 蚤状溞的平均体长为1.6 mm,添加的密度约为0.2 ind./L,这个密度在春季太湖梅梁湾较为常见[7, 14]. 此外,每个桶放入8株仿真水草(株高90 cm, 形似水盾草Cabomba caroliniana)模拟沉水植物. 每个实验桶内的8株水草固定在1个共同的陶瓷底座(长20 cm,宽6 cm)上,底座放置在桶中间位置,每桶内沉水植物的覆盖度约为35 %.
经过半个月的培养,各个实验桶形成了以Daphnia为优势(生物量占比超过90 %)的浮游动物群落和以硅藻占优势(生物量占比超过80 %)的浮游植物群落,各实验桶浮游生物生物量和群落无明显差异,此时实验正式开始(2020年4月7日). 挑选事先准备好的规格一致的虾添加到6个实验桶中,每桶添加30尾,其中包括18尾雌体((0.5±0.15) g/尾)和12尾雄体((0.16±0.08) g/尾),雌雄比为1.5,参照三峡水库秀丽白虾的年均性比[3]. 雌虾比雄虾具有更大的个体,符合自然水体中秀丽白虾的雌雄异形现象[3]. 秀丽白虾的初始密度约为22 g/m2, 与2015年太湖渔获物的年捕获量(21.7 g/m2)相当[15]. 实验期间每个实验桶添加营养盐(P: 5 μg/(L ·d); N: 130 μg/(L ·d))模拟湖泊外源负荷.
1.2 采样与指标测定实验期间,每2周(14 d)采集1次水样,采样时间为上午8:00—9:00之间. 采样时,先利用长竿将桶内的水混匀,避免仿真水草带来的空间异质性. 然后,利用柱状玻璃管(直径6 cm,长64 cm)采集12 L混合水样,取2 L水样带回实验室分析. 于实验室内测定总氮(TN)、总磷(TP)、总溶解氮(DTN)、总溶解磷(DTP)和叶绿素a (Chl.a)浓度,测定方法依据《湖泊富营养化调查规范》[16].
浮游动物每4周采集一次,将剩余的10 L混合水样经过64 μm浮游生物网过滤后,将浮游动物收集到50 mL小白瓶中,添加2 mL鲁哥试剂保存,显微镜下进行计数、鉴定,浮游动物生物量根据各种类的体长-体重关系进行换算[17-18]. 实验结束时,另取1 L混合水样加入10 mL鲁哥试剂保存. 显微镜下对浮游植物进行鉴定计数,其生物量根据各种类生物量经验值进行换算.
1.3 统计分析所有作图以及统计分析均在R软件中进行[19]. TN、TP、DTN、DTP和Chl.a浓度以及TN ∶TP、浮游动物总生物量、Daphnia生物量等时间序列数据采用广义线性混合模型(GLMM)进行分析. GLMM在“glmmTMB”包中进行[20],模型构建时将白虾作为固定因子,时间作为随机因子,误差项服从高斯分布. 实验结束时2个处理组浮游植物和浮游动物各类群的优势度(生物量百分比)数据不满足正态分布,我们采用非参数Kruskal-Wallis检验(K-W检验)进行比较,显著性水平为P < 0.05.
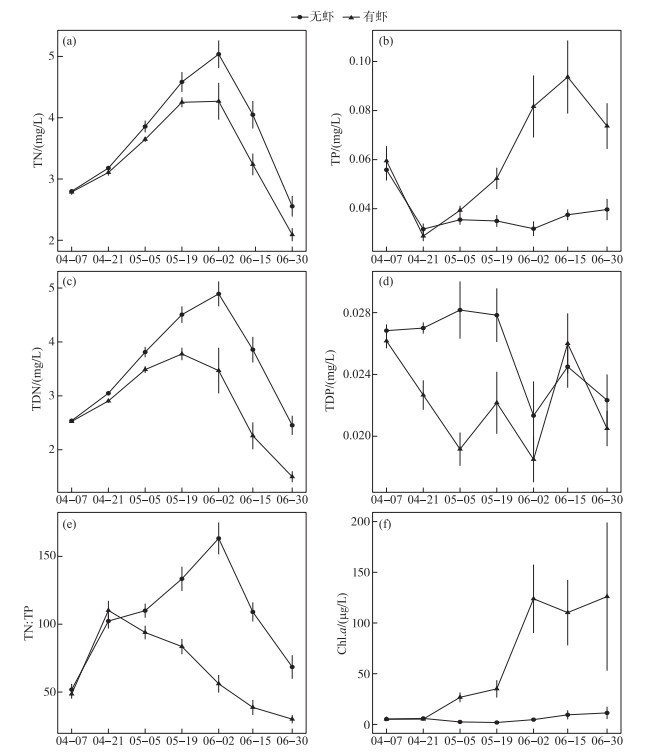
2 结果与分析 2.1 水体营养盐和叶绿素a浓度实验期间2个处理组的TN浓度均呈现单峰变化趋势,在6月2日(第56天)达到最高(图 1a). 模型结果表明白虾组水体TN浓度显著低于对照组(表 1). 2个处理组TP浓度在前14 d稳步下降,随后对照组平均TP浓度稳定在平均0.04 mg/L左右,而白虾组TP浓度急剧上升,实验结束时达到0.07 mg/L,白虾组水体TP浓度显著高于对照组(表 1). 水体DTN浓度的时间变化趋势与TN类似(图 1c),秀丽白虾同样显著降低了水体DTN浓度(表 1). 与TP相反,白虾显著降低了水体的DTP浓度(图 1d; 表 1). 此外,白虾组水体TN ∶TP比值显著低于对照组(表 1;图 1e).
|
图 1 实验期间2个处理组水体TN(a)、TP(b)、DTN(c)、DTP(d)、TN ∶TP(e)和Chl.a浓度(f)时间变化 (平均值±标准误, n=6) Fig.1 Temporal changes of TN(a), TP(b), DTN(c), DTP(d), TN ∶TP(e) and Chl.a(f) concentrations in the two treatments during the experiment (Mean ± SE, n=6) |
| 表 1 秀丽白虾对水体营养盐和浮游生物生物量影响的统计结果(基于广义线性混合模型GLMM) Tab. 1 Effects of E. modestus on nutrient concentrations and plankton biomass based on GLMM |
对照组Chl.a浓度一直维持在10 μg/L左右,而白虾组水体Chl.a浓度随时间逐渐升高,6月2日后平均Chl.a浓度稳定在100 μg/L以上(图 1f). 统计分析表明白虾组Chl.a浓度显著高于对照组(表 1).
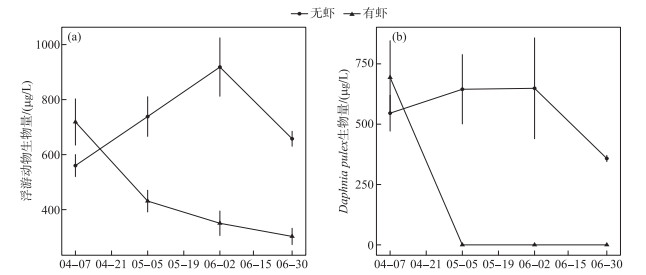
2.2 浮游动物生物量白虾组水体浮游动物总生物量随时间逐渐下降,对照组浮游动物生物量在春季(6月2日前)逐渐升高,随后小幅下降(图 2a). 白虾组浮游动物生物量一直呈下降趋势(图 2a),显著低于对照组(表 1). 白虾组Daphnia生物量在实验开始后急剧下降,在后3次采样中均未检出(图 2b). 相反,对照组Daphnia生物量在实验期间一直维持在较高水平(图 2b). 统计分析表明白虾组Daphnia生物量显著低于对照组(表 1).
|
图 2 实验期间2个处理组浮游动物(a)、Daphnia pulex(b)生物量时间变化 (平均值±标准误, n=6) Fig.2 Temporal changes of zooplankton(a) and Daphnia pulex(b) biomass in the two treatments during the experiment (Mean ± SE, n=6) |
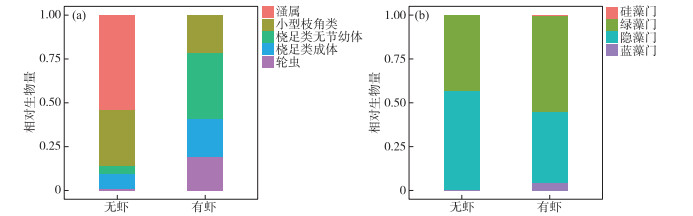
实验结束时,秀丽白虾显著降低了Daphnia在浮游动物群落中的优势度(图 3a,表 2). 对照组Daphnia的生物量占比达到了60 % 以上,而白虾组未检出. 相反,秀丽白虾显著提高了轮虫(优势种Polyarthra trigla、Trichocerca spp.、Lecane spp.和Lepadella sp.)在浮游动物群落中的优势度(图 3b). 秀丽白虾对小型枝角类(包括Alona sp.、Bosmina longirostris和Chydorus sphaericus)和桡足类(包括Mesocyclops sp.和Eucycolps serrulatus)优势度的影响不显著(表 2).
实验结束时,2个处理组浮游植物均以隐藻门(包括Cryptomonas sp.)和绿藻门(优势种:Scenedesmus quadricauda、Arthrodesmus sp.、Oedogoniaceae sp.、Pediastrum boryanum、Crucigenia quadrata、Tetraedron minimum)为主. 秀丽白虾对浮游植物各门类的优势度的影响均不显著(图 3b,表 2).
|
图 3 实验结束时2个处理组浮游动物(a)和浮游植物(b)群落结构比较 Fig.3 Comparisons of zooplankton (a) and phytoplankton (b) community structures between both treatments at the end of the experiment |
| 表 2 秀丽白虾对浮游动物和浮游植物各类群优势度的影响(基于Kruskal-Wallis检验) Tab. 2 Effects of E. modestus on dominance of each zooplankton and phytoplankton group based on Kruskal-Wallis tests |
本研究发现秀丽白虾对水体N、P浓度具有不同的影响,秀丽白虾的存在显著降低了水体TN浓度,但是提高了水体TP浓度,最终降低了水体TN ∶TP比(图 1). 这一点符合生态化学计量学的“消费者驱动的营养盐循环”理论,即消费者排泄的N: P比与消费者自身的N ∶P比呈负相关,因为高N: P比的消费者必须尽可能的摄取N,同时排出P来满足其生长需求[21]. 本研究中未检测秀丽白虾的N: P比,但根据以往的研究,杂食性虾类(如沼虾Macrobrachium spp.)的N ∶P摩尔比约为20[22],在摄食富P的食物(如Daphnia, N ∶P≈14)[23]后会倾向于保留更多的N而排出P,这可能是本研究中白虾组具有高TP浓度和低TN ∶TP比的主要原因(图 1). 同时,由于秀丽白虾自身摄取了较多的N,导致了水体TN浓度的降低(图 1). 此外,除了排泄之外,白虾组水体较高的TP浓度也可能来自于该处理组较高的P循环速率,即浮游动物通过秀丽白虾捕食后,再迅速排泄出来,其身体的P能够很快转化成可利用的P而进入水体中. 而对照组中浮游动物需死亡、分解后其身体P才能够再次进入水体P循环,导致了对照组大量的P沉降在水体底部,而水中的P相对较少. 类似的,Elser等在加拿大227湖的研究发现,该湖泊Daphnia丰度在实施生物操纵后明显升高,与此同时,水层P的沉降速率也显著增加[24]. 本研究中,秀丽白虾的排泄虽然显著提高了水体TP浓度,但是却降低了水体DTP浓度,这可能与白虾组较高的浮游植物生物量有关(图 1f),即白虾排泄的P很快被浮游植物利用,转换成了颗粒态营养盐. 有调查表明,水体Chl.a浓度较高的水体中溶解性P在P库中的比例往往较低[25-26].
秀丽白虾除了影响水体营养盐循环,还显著影响了水体的食物网结构,表现为牧食者Daphnia和浮游动物总生物量降低(图 2a~b),同时生产者—浮游植物生物量增加(图 1f). 本研究结果与其他杂食性虾类(如糠虾Neomysis integer)的研究结果一致[12-13]. 本研究中,Daphnia和浮游动物总生物量的减少主要归因于秀丽白虾对浮游动物的捕食,这一点得到了以往太湖秀丽白虾的胃含物分析以及人工饲养实验的证实[2]. 此外,有研究表明某些杂食性虾类(如澳洲淡水虾Paratya australiensis、多齿新米虾Neocaridina denticulata)也能够摄食藻类[27-28],从而通过与浮游动物竞争食物而降低浮游动物生物量. 然而,本研究中白虾组浮游植物生物量要远远高于对照组(图 1f),说明白虾组浮游动物不可能受到食物的限制,所以资源竞争不可能是白虾组Daphnia以及浮游动物生物量减少的原因.
本研究中秀丽白虾显著提升了浮游植物的生物量,与Ye等的研究结果一致[27]. 其机理主要有以下两个方面:(1)秀丽白虾驱动的营养盐循环为浮游植物提供了更多的P,同时缓解了浮游植物的P限制(图 1). 本研究中2个处理组水体TN ∶TP比均超过15 ∶1,表现为P限制[29],秀丽白虾降低了水体TN ∶TP比,因此一定程度上缓解了P缺乏对浮游植物生长的影响;(2)秀丽白虾对浮游动物(尤其是Daphnia)的捕食减弱了浮游动物对浮游植物的牧食压力,通过营养级联效应促进了浮游植物生长[30]. 其他研究同样也发现,多齿新米虾(Neocaridina denticulata)和一种对虾(Penaeus setiferus)分别通过排泄营养盐和捕食过程显著促进了浮游植物的生长[27, 31]. 本研究证明在春、夏季,秀丽白虾能从上行(释放营养盐)和下行(减少浮游动物)两个方面有利于浮游植物生长. 以往的研究发现虾类会影响浮游植物的群落结构,增加蓝藻的优势[32],本研究也发现白虾组蓝藻的优势度高于对照组,但是统计上并不显著(图 3b; P=0.074, 表 2),这可能与本实验主要在温度相对较低的春季至初夏开展有关.
在热带和亚热带地区湖泊或水库,虾类在春夏季往往具有较高的丰度[1-2]. 春季同样是大型枝角类Daphnia的繁殖窗口,对于湖库清水态的维持具有重要意义[9-10]. 本研究发现秀丽白虾的摄食降低了Daphnia的生物量及其优势度(图 2~3),导致浮游动物群落趋于小型化,同时促进了浮游植物生长,这可能会不利于湖库清水态的维持[9-10]. 当然,秀丽白虾的生态效应与其密度有关,在自然湖库中,秀丽白虾的种群规模可能会受到其他捕食者(如鱼类)的限制,导致其种群密度要低于本实验(22 g/m2)[1],因此,评判秀丽白虾的生态效应还需要野外证据的支持. 尽管如此,本研究表明秀丽白虾和鱼类一样,也可能是影响春夏季浮游动、植物生物量和群落变化的影响因素之一. 因此在大型湖库的浮游生物研究中,虾类等无脊椎动物捕食者的影响也应予以关注.
4 结论对于大型枝角类Daphnia占优势的春夏季亚热带湖库,秀丽白虾的捕食:1)显著降低水体TN浓度,增加了水体TP浓度,降低了水体TN ∶TP比;2)减少了Daphnia和浮游动物总生物量,可能导致浮游动物群落趋于小型化;(3)提高了水体Chl.a浓度,但对浮游植物群落结构影响不明显.
| [1] |
Wen ZR, Zhang DW, Xie P et al. Seasonal dynamics in stock of the freshwater shrimps, Exopalaemon modestus and Macrobrachium nipponense in Meiliang and Gonghu bays, Lake Taihu. Resources and Environment in the Yangtze Basin, 2011, 20(9): 1035-1039. [温周瑞, 张大文, 谢平等. 太湖日本沼虾、秀丽白虾现存量的周年动态研究——以梅梁湾、贡湖湾为例. 长江流域资源与环境, 2011, 20(9): 1035-1039.] |
| [2] |
Shi WG, Yan XM, Bing XW. Biology and feeding habit of Palaemon modestus (heller) in Taihu Lake. J Lake Sci, 1995, 7(1): 69-76. [施炜钢, 严小梅, 邴旭文. 太湖秀丽白虾生物学与食性的研究. 湖泊科学, 1995, 7(1): 69-76. DOI:10.18307/1995.0110] |
| [3] |
Chen SB, Liao CS, Zhao XJ et al. The growth and the reproductive biology of Expalaemon modestus (Heller, 1862) (Crustacea, Decapoda, Palaemonidae) in the Three Gorges Reservoir of China. Acta Hydrobiologica Sinica, 2015, 39(5): 989-996. [陈思宝, 廖传松, 赵修江等. 三峡水库秀丽白虾生长与繁殖生物学特征研究. 水生生物学报, 2015, 39(5): 989-996.] |
| [4] |
Li CC, Li Y, Xie QM et al. A study on the maximum sustained yield of the macrura's shrimp in the Poyang Lake and its development, utilization. Jiangxi Science, 1990, 8(4): 28-33. [李长春, 李云, 谢钦铭等. 鄱阳湖虾类资源最大持续产量及其开发利用的研究. 江西科学, 1990, 8(4): 28-33.] |
| [5] |
Wen ZR, Xie P. Studies on the feeding habits and sources of dietary carbon of Macrobrachium nipponense and Exopalaemon modestus in Taihu Lake. Journal of Yangtze University, 2013, 10(29): 36-45. [温周瑞, 谢平. 太湖日本沼虾与秀丽白虾的食性与食物碳源分析. 长江大学学报: 自然科学版, 2013, 10(29): 36-45.] |
| [6] |
Havens KE, East TL, Marcus J et al. Dynamics of the exotic Daphnia lumholtzii and native macro-zooplankton in a subtropical chain-of-lakes in Florida, USA. Freshwater Biology, 2000, 45(1): 21-32. DOI:10.1046/j.1365-2427.2000.00614.x |
| [7] |
Chen F, Gulati RD, Li J et al. A comparison of the size distribution of the filamentous green alga Ulothrix in Daphnia guts and lake water from Lake Taihu, China. Journal of Plankton Research, 2011, 33(8): 1274-1283. DOI:10.1093/plankt/fbr029 |
| [8] |
Yang LL, He GX, Hu ZJ et al. Community structure of zooplankton and its relation to environmental factors in the silver-carp-and-bighead-carp-dominated Qiandao Lake. Journal of Fisheries of China, 2013, 37(6): 894-903. [杨丽丽, 何光喜, 胡忠军等. 鲢鳙占优势的千岛湖浮游动物群落结构特征及其与环境因子的相关性. 水产学报, 2013, 37(6): 894-903.] |
| [9] |
Lampert W, Fleckner W, Rai H et al. Phytoplankton control by grazing zooplankton: A study on the spring clear-water phase1. Limnology and Oceanography, 1986, 31(3): 478-490. DOI:10.4319/lo.1986.31.3.0478 |
| [10] |
Sommer U, Adrian R, de Senerpont DL et al. Beyond the plankton ecology group (PEG) model: Mechanisms driving plankton succession. Annual Review of Ecology, Evolution, and Systematics, 2012, 43(1): 429-448. DOI:10.1146/annurev-ecolsys-110411-160251 |
| [11] |
Iglesias C, Mazzeo N, Meerhoff M et al. High predation is of key importance for dominance of small-bodied zooplankton in warm shallow lakes: Evidence from lakes, fish exclosures and surface sediments. Hydrobiologia, 2011, 667(1): 133-147. DOI:10.1007/s10750-011-0645-0 |
| [12] |
Cooper SD, Goldman CR. Opossum shrimp (Mysis relicta) predation on zooplankton. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(6): 909-919. DOI:10.1139/f80-120 |
| [13] |
Gal G, Rudstam LG, Mills EL et al. Mysid and fish zooplanktivory in Lake Ontario: Quantification of direct and indirect effects. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(12): 2734-2747. DOI:10.1139/f06-156 |
| [14] |
Yang GJ, Qin BQ, Tang XM et al. Contrasting zooplankton communities of two bays of the large, shallow, eutrophic Lake Taihu, China: Their relationship to environmental factors. Journal of Great Lakes Research, 2012, 38(2): 299-308. DOI:10.1016/j.jglr.2012.03.011 |
| [15] |
Mao ZG, Gu XH, Cao Y et al. The role of top-down and bottom-up control for phytoplankton in a subtropical shallow eutrophic lake: Evidence based on long-term monitoring and modeling. Ecosystems, 2020, 23(7): 1449-1463. DOI:10.1007/s10021-020-00480-0 |
| [16] |
Jin XC, Tu QY. The standard methods for obervation and analysis in lake eutrophication. 2nd. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范: 第2版. 北京: 中国环境科学出版社, 1990.]
|
| [17] |
Dumont HJ, Velde I, Dumont S. The dry weight estimate of biomass in a selection of Cladocera, Copepoda and Rotifera from the plankton, periphyton and benthos of continental waters. Oecologia, 1975, 19(1): 75-97. DOI:10.1007/BF00377592 |
| [18] |
Huang XF. Survey observation and analysis of lake ecology. Beijing: China Standards Press, 2000. [黄祥飞. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 2000.]
|
| [19] |
R Core Team. R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/. 2019.
|
| [20] |
Bolker BM, Brooks ME, Clark CJ et al. Generalized linear mixed models: A practical guide for ecology and evolution. Trends in Ecology & Evolution, 2009, 24(3): 127-135. DOI:10.1016/j.tree.2008.10.008 |
| [21] |
Elser JJ, Urabe J. The stoichiometry of consumer-driven nutrient recycling: Theory, observations, and consequences. Ecology, 1999, 80(3): 735-751. DOI:10.2307/177013 |
| [22] |
Snyder MN, Small GE, Pringle CM. Diet-switching by omnivorous freshwater shrimp diminishes differences in nutrient recycling rates and body stoichiometry across a food quality gradient. Freshwater Biology, 2015, 60(3): 526-536. DOI:10.1111/fwb.12481 |
| [23] |
Andersen T, Hessen DO. Carbon, nitrogen, and phosphorus content of freshwater zooplankton. Limnology and Oceanography, 1991, 36(4): 807-814. DOI:10.4319/lo.1991.36.4.0807 |
| [24] |
Elser JJ, Sterner RW, Galford AE et al. Pelagic C: N: P stoichiometry in a eutrophied lake: Responses to a whole-lake food-web manipulation. Ecosystems, 2000, 3(3): 293-307. DOI:10.1007/s100210000027 |
| [25] |
Zhu GW, Zou W, Guo CX et al. Long-term variations of phosphorus concentration and capacity in Lake Taihu, 2005-2018:Implications for future phosphorus reduction target management. J Lake Sci, 2020, 32(1): 21-35. [朱广伟, 邹伟, 国超旋等. 太湖水体磷浓度与赋存量长期变化(2005-2018年)及其对未来磷控制目标管理的启示. 湖泊科学, 2020, 32(1): 21-35. DOI:10.18307/2020.0103] |
| [26] |
Mazumder A. Phosphorus-chlorophyll relationships under contrasting zooplankton community structure: Potential mechanisms. Canadian Journal of Fisheries and Aquatic Sciences, 1994, 51(2): 401-407. DOI:10.1139/f94-041 |
| [27] |
Ye JL, Tang YL, Zhang XF et al. Omnivorous shrimp Neocaridina denticulata sinensis enhances the growth of submerged macrophyte Vallisneria denseserrulata. Knowledge & Management of Aquatic Ecosystems, 2019(420): 32. DOI:10.1051/kmae/2019025 |
| [28] |
Moulton TP, Souza ML, Brito EF et al. Strong interactions of Paratya australiensis (Decapoda: Atyidae) on periphyton in an Australian subtropical stream. Marine Freshwater Research, 2012, 63(9): 834-844. DOI:10.1071/MF12063 |
| [29] |
Abell JM, Özkundakci D, Hamilton DP. Nitrogen and phosphorus limitation of phytoplankton growth in New Zealand lakes: Implications for eutrophication control. Ecosystems, 2010, 13(7): 966-977. DOI:10.1007/s10021-010-9367-9 |
| [30] |
Polis GA, Sears ALW, Huxel GR et al. When is a trophic cascade a trophic cascade?. Trends in Ecology and Evolution, 2000, 15(11): 473-475. DOI:10.1016/S0169-5347(00)01971-6 |
| [31] |
Bruno JF, O'Connor MI. Cascading effects of predator diversity and omnivory in a marine food web. Ecology Letters, 2005, 8(10): 1048-1056. DOI:10.1111/j.1461-0248.2005.00808.x |
| [32] |
Alonso-Rodríguez R, Páez-Osuna F. Nutrients, phytoplankton and harmful algal blooms in shrimp ponds: A review with special reference to the situation in the Gulf of California. Aquaculture, 2003, 219(1/2/3/4): 317-336. DOI:10.1016/S0044-8486(02)00509-4 |
 2022, Vol. 34
2022, Vol. 34 

