(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
作为淡水生态系统中有机碳的主要载体,溶解性有机碳(DOC)占湖泊、水库等内陆水体总有机碳的80 %以上,对水体的理化性质和微生物的生化反应有着重要作用[1]. DOC按照来源可以分为两类,一类是内源性DOC,主要来自水体初级生产者(浮游藻类、水生植物以及附着藻类)光合作用产物的释放以及内源性碎屑物质的分解;另一类是外源性DOC,主要来自以C3植物为主的陆地初级生产者以及土壤渗滤液中的可溶解部分[2-3]. 有的研究表明,以浮游细菌为主的微生物是有机碳代谢过程的主要参与者,在其代谢过程中不仅能够利用水体中的内源性DOC还能够利用外源性DOC[4-5]. 在淡水生态系统中,DOC的代谢主要是通过细菌的生产和呼吸作用进行的,降解消耗DOC的过程驱动着水生食物网的物质循环和能量流通[6-7]. 大量研究结果表明,浮游细菌会根据有机碳底物的化学性质和代谢的难易程度,选择性地利用内外源碳以用于生产和呼吸代谢[8-9]. 在瑞典中东部的浅水型湖泊中,Sundh[8]发现与高分子量(>10000)的DOC相比,细菌对低分子量(< 1000)的DOC利用率更高. 但是,以往研究主要针对的是中高纬地区寡营养型湖泊中细菌的代谢特征[5, 10],缺乏对中低纬地区较高营养水平的淡水系统中细菌碳代谢策略的探究.
水库具有独特的水力学特征,诸如水力停留时间长、水体流动性差以及自净功能较差等特性[11]. 致使近年来,水库的富营养化问题日益严重,藻类周期性繁殖现象时有发生[12-13]. 在长江中下游地区,水库分布众多,受藻类繁殖和外源有机碳输入的共同影响,水库DOC的来源与构成日趋复杂[5, 14]. 浮游细菌在碳代谢过程中,是否对水库中内外源DOC的利用存在偏好,能否对细菌利用内外源DOC进行生产和呼吸过程做准确的定量分析,是本研究拟解决的问题. 对这些问题的探究,将有助于揭示浮游细菌分配内外源碳以进行代谢的生物学机制,推动水库生态系统碳循环的研究.
1 材料与方法 1.1 研究区概况与样品采集 1.1.1 研究区概况南京市位于我国东部长江下游地区,属宁镇扬丘陵地区,受亚热带湿润气候影响,四季分明,雨水充沛,水域面积达11 %以上,拥有众多水库,其中中小型水库多达250座[12]. 陈美军等[12]对南京市37座水库进行了水质评价,发现富营养和中营养水库占比分别为55 %和45 %,均处于较高的营养水平. 因此,本研究于2019年秋季至2020年夏季期间对南京市11座水库(碾坨坝、泥桥、河王坝、黄山、山湖、傅湾、平山、海王庄、方便、姚家以及老鸭坝水库)进行了现场调研与采样(图 1).
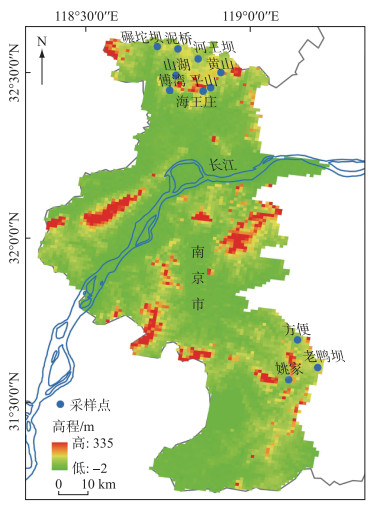
|
图 1 本研究中水库的地理位置分布 Fig.1 Geographical distribution of the reservoirs in this study |
根据水库面积的大小均匀布置2~3个采样点,利用Niskin采水器(General Oceanic, USA)在水面以下0.5 m处采集20 L水样,置于提前洗净的聚乙烯采样瓶中,于4℃冷藏箱内保存,并于2 h内运回实验室,用于水体理化性质的分析与浮游细菌的分离培养.
1.1.3 内源DOC样品采集在采样船行进过程中,利用25#浮游植物网收集水体中的藻类,拖行约15 min,将采集到的浮游藻类转移至提前洗净的500 mL聚乙烯采样瓶中,于4℃冷藏箱内保存,并于2 h内运回实验室,用于水体内源DOC的分析.
1.1.4 外源DOC样品采集在水库沿岸10 m范围内,利用铁铲与镊子采集沿岸表层土壤样品以及优势植物的枯叶残体等陆源输入的有机碳样品,置于干净的聚乙烯密封袋中,用于水体外源DOC的分析.
1.2 水库理化指标的测定利用多参数水质分析仪(YSI 6600, Xylem Inc, USA)在采样现场测定水温、pH和溶解氧(DO)等指标. 在实验室中,利用热乙醇法萃取后测定叶绿素a(Chl.a)浓度,利用总有机碳分析仪(TOC-V CPN, Shimadzu, Japan)测定水库水体中的DOC浓度. 采用流动分析仪(San plus, Skalar, Netherlands)测定水体的总氮(TN)、总磷(TP)、磷酸根(PO43-)、硝酸根(NO3-)等营养盐浓度[15]. 利用营养级指数(TLI)描述水库的营养状态,选取Chl.a和TN浓度两个指标作为评价TLI的主要因子[16-17],将水库营养级水平分别为贫营养型(TLI(Σ)≤30)、中营养型(30 < TLI(Σ)≤50)、富营养型(50 < TLI(Σ)≤60)、中度富营养型(60 < TLI(Σ)≤70)以及重度富营养型(TLI(Σ)> 70).
1.3 水体DOC以及内外碳源中碳稳定同位素的测定 1.3.1 水体DOC碳稳定同位素的测定取250 mL水样,经0.22 μm聚碳酸酯滤膜(Waterman, USA)过滤,在-70℃下冻干后,将残留的渣体置于底部放有5 mol/L浓盐酸的干燥器中酸熏48 h,在45℃下烘干,称量约2 mg样品置于锡杯中,利用同位素质谱仪(Delta Plus, Finnigan, USA)测定水体DOC的碳稳定同位素(δ13C)特征值[18].
1.3.2 内源DOC碳稳定同位素的测定利用过滤装置将采集的内源DOC样品中的浮游藻类转移至0.7 μm GF/F滤膜(Waterman, USA)上,随后将滤膜置于一次性培养皿中冻干. 与上述方法类似,将冻干后的内源碳样品酸熏并烘干后,称量约0.2 mg样品置于锡杯中,利用同位素质谱仪(Delta Plus, Finnigan, USA)测定水库内源DOC的碳稳定同位素特征值[18].
1.3.3 外源DOC碳稳定同位素的测定利用去离子水将采集的植物样品洗净,在-70℃下冻干,经过均匀研磨后,在3 mol/L的盐酸中浸泡14 h,利用纯水冲洗至中性,转移至一次性培养皿中烘干,称量约0.5 mg样品置于锡杯中;称取约50 g低温烘干的土壤放入盛有250 mL蒸馏水的三角瓶中,常温下震荡浸提30 min,高速离心10 min,上清液用0. 22 μm滤膜过滤[19],后续测定方法与水体DOC碳稳定同位素相同,利用同位素质谱仪(Delta Plus, Finnigan, USA)测定水库外源DOC的碳稳定同位素特征值.
1.4 浮游细菌的分离培养与代谢产物中碳稳定同位素的测定 1.4.1 浮游细菌的生产和呼吸过程观测取800 mL水样,经0.7 μm GF/F滤膜(Waterman, USA)过滤后,作为浮游细菌样本,置于自制的浮游细菌代谢装置中(专利号:ZL202020314401.5),用3 mol/L盐酸调节pH至2.5以下,待水体中溶解性无机碳(DIC)基本排尽,加入碱液调节pH至初始水平. 随后通入氮气,排净装置中的CO2后,向装置中通入不含CO2的空气30 min,密封装置瓶,在培养箱中培养48 h,温度设定与采样时的水库温度一致.
1.4.2 细菌DOC代谢速率的测定在细菌培养的初始和结束阶段,分别从培养装置中抽取30 mL水样,利用总有机碳分析仪(TOC-V CPN, Shimadzu, Japan)测定细菌代谢初始和结束阶段水体的DOC与DIC浓度. 浮游细菌DOC代谢速率(μg/(L·h))的计算公式为:
| $ {\rm{DOC}}代谢速率=(DOC_{初}-DOC_末)V \times 1000/t $ | (1) |
式中,DOC初和DOC末分别为实验初始和结束时溶解性有机碳浓度(mg/L),V为细菌培养体系中液体体积(L),t为培养时间(h).
1.4.3 细菌呼吸代谢速率与产物中碳稳定同位素的测定在细菌培养的初始和结束阶段,分别从培养装置的取气口抽取25 mL气体样品,利用气相色谱温室气体仪(7890B, Agilent, USA)测定代谢初始和结束阶段装置中的CO2浓度(mg/L). 呼吸碳代谢速率(μg/(L·h))的计算公式为:
| $呼吸代谢速率= [(DI{{C}_{末}}-DI{{C}_{初}})~+(d\text{C}{{\text{O}}_{{{2}_{末}}}}-d\text{C}{{\text{O}}_{{{2}_{初}}}})]~V\times 1000/t $ | (2) |
式中,dCO2初和dCO2末分别为实验初始和结束时水体溶解性CO2的浓度(mg/L),DIC初和DIC末分别为实验初始和结束时溶解性无机碳浓度(mg/L)[20].
基于细菌培养结束阶段抽取的气体样品,利用碳稳定同位素仪(G2201-i, Picarro, USA)测定浮游细菌呼吸代谢产物中的碳稳定同位素特征值.
1.4.4 细菌生产代谢速率与生物体碳稳定同位素的测定通常认为,浮游细菌的代谢主要由呼吸代谢和生产代谢构成[14]. 因此,在本研究中利用质量守恒法来测定浮游细菌的生产代谢速率计算公式为:
| $生产代谢速率={\rm{DOC}}代谢速率-呼吸代谢速率 $ | (3) |
在细菌培养结束后,取反应装置中约600 mL水样,经0.7 μm GF/F滤膜(Waterman, USA)和0.2 μm纯无机AnodiscTM 47氧化铝滤膜(Waterman, USA)依次过滤,对浮游细菌进行富集. 随后,将附有浮游细菌的滤膜置于一次性培养皿中冻干,并使用玛瑙研钵研磨,使样品通过孔径为0.075 mm的筛网. 称量约10 mg样品置于锡杯中,利用同位素质谱仪(Delta Plus, Finnigan, USA)测定细菌生产代谢产物中的碳稳定同位素特征值.
1.5 水体DOC以及浮游细菌代谢产物中的内外碳源贡献率为研究水库内外碳源对水体DOC和浮游细菌代谢产物的贡献率,本研究利用双元混合模型计算了水体DOC中内外碳源的占比,以及浮游细菌在生产和呼吸代谢过程中对两种碳源的利用率[21]. 计算公式为:
| ${{\delta }^{13}}{{\text{C}}_{组分}}={{f}_{1}}\cdot {{\delta }^{13}}{{\text{C}}_{外}}+{{f}_{2}}\cdot {{\delta }^{13}}{{\text{C}}_{内}} $ | (4) |
| ${{f}_{1}}+{{f}_{2}}=1 $ | (5) |
式中,δ13C组分代表给定组分(水体DOC、细菌呼吸以及生产代谢产物)的碳稳定同位素特征值;f1和f2分别代表内外碳源对δ13C组分特征值的相对贡献率.
1.6 数据分析方法运用Excel 2007、Origin 9.0等软件对实验数据进行处理、图形绘制. 采用SPSS 20.0软件进行数据相关性分析. 此外,采用ArcGIS 10.2软件绘制水库的地理位置图.
2 结果与分析 2.1 水体基本理化环境特征及碳源类型本研究中11座水库的位置及基础理化指标如表 1所示. 选取的研究区多为浅水型水库,各个采样点水深不超过5 m. 采样期间,11座水库的水温在8.85~27.35℃之间,季节性差异较大(表 1). 水体的pH值在7.87~8.90之间,均为弱碱性水库. 水库溶解氧浓度在(6.74±0.56)~(12.35±0.19) mg/L之间变化. 浮游细菌细菌丰度在105~106数量级之间(表 1).
| 表 1 本研究中11座水库的水体理化性质 Tab. 1 Physicochemical properties of water samples in the 11 reservoirs in this study |
在11座水库中,内外源有机碳稳定同位素的端元值在不同水库中呈现出较大的差异(表 2),藻类等内源碳同位素的特征值范围为-34.24‰~-23.59‰,外源DOC碳同位素特征值最小值为-27.93‰ (碾坨坝水库),最大值为-19.59‰ (海王庄水库). 测定结果显示水体DOC碳稳定同位素的特征值范围为-28.96‰~-24.04‰. 以上3种有机碳碳稳定同位素的特征值在大多数水库中均呈现出以下大小关系:δ13C外> δ13CDOC> δ13C内. 双元混合模型的计算结果表明,内源碳对水体DOC的贡献率在14.94 %~91.67 %之间,不同水库之间存在较大的差异;相应地,以植物凋落物和岸边土壤为主的外源碳对DOC的贡献率范围为8.33 %~85.06 %. 根据内、外源有机碳的贡献率,将11座水库划分为两种类型,即内源碳占据主导(内源碳贡献率>50 %)的水库——内源型水库,包括海王庄、傅湾、泥桥、平山、碾坨坝5座水库,以及外源碳占据主导(外源碳贡献率>50 %)的水库——外源型水库,包括山湖、老鸭坝、河王坝、黄山、姚家以及方便6座水库(表 2). 基于指数模型Exponential的拟合结果,随着水库Chl.a浓度升高,内源碳对水体DOC的贡献率显著增加,拟合方程为y=-0.59 + 0.90807-0.08045-0.03373x(R2= 0.55, P < 0.01, 图 2).
| 表 2 水库水体DOC以及内外碳源稳定同位素的特征值和贡献率* Tab. 2 Characteristic values of the stable carbon isotope for the DOC, the endogenous, and exogenous carbon sources in the reservoirs and the contribution of endogenous carbon to DOC |
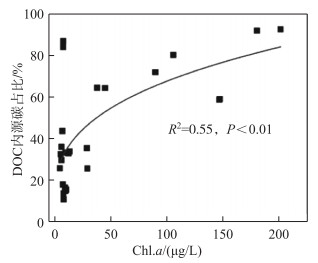
|
图 2 水库DOC内源碳占比与Chl.a浓度的关系 Fig.2 Relationship between the ratio of endogenous carbon to DOC and Chl.a in the reservoirs |
作为水库浮游细菌代谢的主要碳源,基于水库碳源类型划分(图 3a),外源型水库中DOC的平均浓度为(9.86±1.12) mg/L,内源型水库DOC平均浓度达到(15.71±3.35) mg/L,因此内源型水库水体DOC的浓度显著高于外源型水库(P < 0.01)(图 3b). PO43-是淡水生态系统中重要的营养盐离子,在内源型水库的浓度也显著高于外源型水库(P < 0.01)(图 3c). 同样,Chl.a浓度在两种类型水库间呈现显著的差异,Chl.a在外源型水库中的平均浓度为(12.11±6.14) μg/L,显著低于内源型水库的平均浓度((97.42±60.02) μg/L) (图 3d). 营养级指数计算结果表明,外源型水库的整体营养水平低于内源型水库(P < 0.01)(图 3e). 此外,外源型水库水体的DOC/TN比值(21.62±9.61)显著高于内源型水库(10.52±2.73)(P < 0.01)(图 3f). 但细菌计数结果表明,内外源型水库在浮游细菌数量上并无明显差异(P>0.05)(表 1).
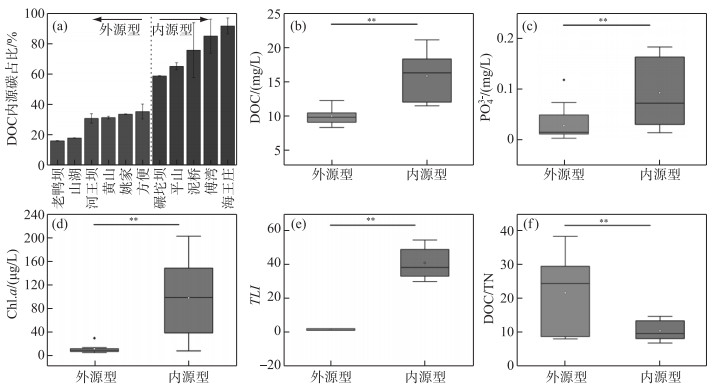
|
图 3 内外源水库中DOC、PO43-、Chl.a、TLI以及DOC/TN的差异(*表示显著性水平 < 0.05;**表示显著性水平 < 0.01) Fig.3 Difference of DOC, PO43-, Chl.a, TLI and DOC/TN between the exogenous and endogenous reservoirs |
11座水库浮游细菌培养48 h后,细菌生物体中碳稳定同位素特征值(δ13C生产)的范围为-29.83‰~-22.39‰,其中,方便水库最低而平山水库最高,与内外碳源稳定同位素端元值相比变化范围较小(表 3). 双端元混合模型计算显示,外源型水库中,内源碳对生产过程的贡献率为24.96 %~78.31 %;内源型水库中,内源碳对生产过程的贡献率为10.55 %~90.50 %. 外源型水库中,方便水库浮游细菌生产代谢碳速率最高,为(12.53±0.10) μg/(L·h),同时细菌生产代谢内源碳速率也是最高((0.58±0.16)μg/(L·h))(图 4a). 内源型水库中,海王庄水库浮游细菌生产代谢碳速率最高,为(15.63±1.06) μg/(L·h). 平山水库与海王庄水库浮游细菌生产代谢外源碳速率显著高于其他水库(P < 0.01),分别为(11.25±0.22)和(8.96±0.71) μg/(L·h)(图 4a).
| 表 3 浮游细菌代谢产物中碳稳定同位素的特征值以及内外源贡献分析* Tab. 3 The characteristic values of stable carbon isotope of bacterial metabolite and contribution rates of endogenous/exogenous carbon to bacterial metabolite |
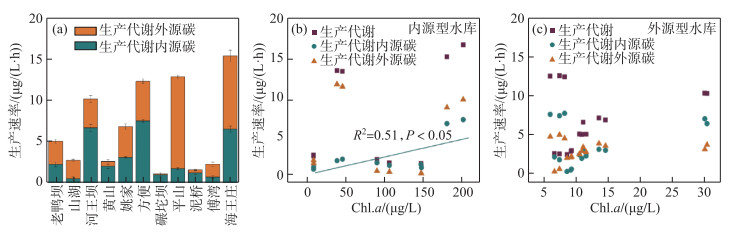
|
图 4 水库浮游细菌的生产代谢速率(a)、Chl.a浓度与内源型水库(b)以及外源型水库中细菌生产代谢速率(c)的关系 Fig.4 Bacterial production rates in the reservoirs (a) and relationships between the Chl.a concentration and bacterial production rates in the endogenous (b) and exogenous (c) reservoirs |
浮游细菌的呼吸代谢速率在内外源水库中也存在着较大差异(图 5). 在外源型水库中,黄山水库浮游细菌的呼吸代谢碳速率最高为(30.46±1.82) μg/(L·h),方便水库中浮游细菌的呼吸代谢碳速率最低为(2.86±0.03) μg/(L·h). 在内源型水库中,浮游细菌呼吸代谢碳速率的范围为3.91~32.29 μg/(L·h)(图 5a). 呼吸代谢产物CO2中碳稳定同位素特征值(δ13C呼吸)的范围为-31.48‰~-22.72‰ (表 3). 双元混合模型的计算结果表示,内外碳源对不同水库浮游细菌呼吸代谢的贡献率存在差异. 外源型水库中,内源碳对呼吸代谢的贡献率为12.72 %~83.80 %;内源型水库中,内源碳对呼吸代谢的贡献率为34.94 %~81.70 %.
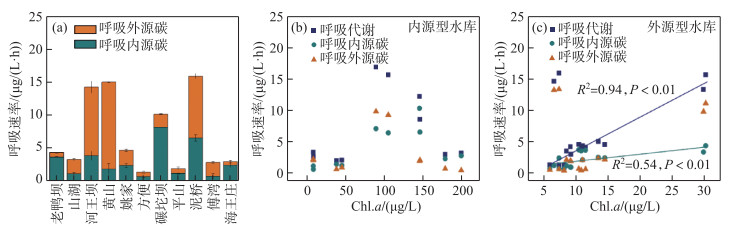
|
图 5 水库浮游细菌的呼吸代谢速率(a)、Chl.a浓度与内源型水库(b)以及外源型水库(c)中细菌呼吸代谢速率的关系 Fig.5 Bacterial respiration rates in the reservoirs (a) and relationships between the Chl.a concentration and bacterial respiration rates in the endogenous (b) and exogenous (c) reservoirs |
在浮游细菌生产和呼吸代谢基础上,分析了细菌转化DOC的总体代谢速率. 外源型水库河王坝浮游细菌代谢DOC总速率最高,为(49.48±1.56) μg/(L·h), 代谢外源碳和内源碳速率分别为(27.86±2.60)和(21.61±0.52) μg/(L·h),其次为海王庄、黄山和泥桥水库(图 6a). 山湖水库中浮游细菌代谢外源碳速率最低,为(0.78±0.26) μg/(L·h);在傅湾水库中细菌代谢内源碳速率最低,为(3.13±0.26) μg/(L·h).
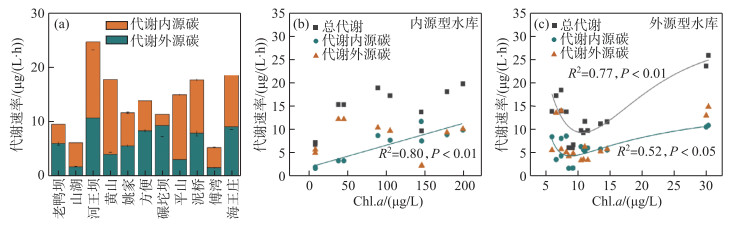
|
图 6 水库浮游细菌的代谢速率(a)、Chl.a浓度与内源型水库(b)以及外源型水库(c)中细菌代谢速率的关系 Fig.6 Bacterial metabolic rates in the reservoirs (a) and relationships between the Chl.a concentration and bacterial metabolic rates in the endogenous (b) and exogenous (c) reservoirs |
对浮游细菌生产和呼吸代谢过程的分析显示,内源型水库中,随着Chl.a浓度的增加,浮游细菌生产代谢内源碳速率显著增加(P < 0.05),但总生产代谢速率及生产代谢外源碳速率与Chl.a浓度无显著相关性(P>0.05)(图 4b);而在外源型水库中,Chl.a浓度与生产代谢速率及不同来源碳的生产代谢速率的关系弱(P>0.05)(图 4c). 随着Chl.a浓度的升高,内源型水库浮游细菌总呼吸代谢速率及呼吸内外源碳速率无明显变化特征(图 5b). 而外源型水库中细菌呼吸代谢速率与呼吸内源碳速率均随Chl.a浓度的升高而显著增加(P < 0.01)(图 5c). 上述结果显示,不同类型的水库中,初级生产力增加对系统中浮游细菌生产和呼吸过程产生的影响不同. 特别是外源型水库中,初级生产力增加显著促进了呼吸代谢过程.
在内源型水库中,水体Chl.a浓度与浮游细菌代谢内源DOC速率存在着显著正相关关系(P < 0.01)(图 6b),而在外源型水库中,Chl.a浓度不仅与代谢内源碳速率而且与浮游细菌代谢DOC速率均存在显著的正相关关系(P < 0.05)(图 6c). 总体上,随着水体Chl.a浓度增加,细菌代谢内源DOC的速率显著升高(图 6).
本研究中去除温度的偏相关分析结果显示:在内源型水库中,随NO3-和PO43-浓度的升高,浮游细菌呼吸速率显著下降(P < 0.05)(图 7a);但外源型水库浮游细菌呼吸速率随两种营养盐离子的升高而显著增加(P < 0.05)(图 7b).
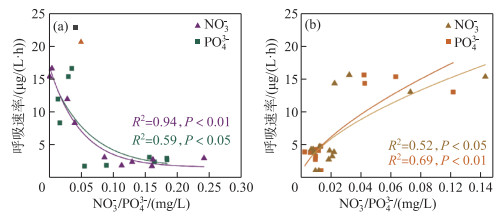
|
图 7 NO3-和PO43-与内源型水库(a)和外源型水库(b)中细菌呼吸代谢速率的关系 Fig.7 Relationships between the NO3- and PO43- concentrations and bacterial respiration rates in the endogenous (b) and exogenous (c) reservoirs |
通过逐步回归方法,将不同碳源类型浮游细菌呼吸速率与环境因子建立关系(表 4). 在内源型水库中,浮游细菌呼吸作用主要受PO43-、NO3-、pH和温度的影响. 而外源性水库浮游细菌呼吸速率可通过PO43-、NO3-、Chl.a、DOC以及溶解氧浓度进行预测. 由此可见,在预估水体温室气体释放通量时,在计算浮游细菌呼吸作用部分中,需要充分考虑水体碳源类型及营养水平,选择恰达的理化指标进行更准确的预估.
| 表 4 浮游细菌呼吸速率与水库理化因子的关系* Tab. 4 Relationship between the bacterial respiration rate and physicochemical factors in the reservoirs |
本研究中,11座水库DOC中的内源碳占比从16.17 %到91.67 %不等,碳的来源呈现出明显的异质性与复杂性,对探究水库浮游细菌两种代谢过程中对内外源碳的利用规律无疑是个挑战[22]. 在11座水库中,随着水库初级生产力(Chl.a浓度)升高,内源碳的占比显著升高,表明藻类是水库生态系统中内源型DOC的重要补给(图 2). 这与曾庆飞等[23]在太湖的研究结果类似,以浮游藻类为代表的内源碳对太湖湖心区域DOC的贡献率高达58.80 %~92.90 %. 自然水体中DOC浓度的升高往往伴随着氮、磷等营养物质的增多,有助于提高浮游细菌的碳代谢过程[24]. Karlsson等[25]发现在瑞典北部的9座贫营养型湖泊中(DOC浓度小于4 mg/L),浮游细菌的呼吸代谢碳速率为3.1~9.8 μg/(L·h),生产代谢碳速率为0.7~6.7 μg/(L·h). 本研究中水库营养类型为中营养型和富营养型(碾坨坝和海王庄水库为富营养),DOC平均浓度超过10 mg/L,而本研究中浮游细菌呼吸代谢碳速率为2.86~30.46 μg/(L·h), 生产代谢碳速率为5.72~25 μg/(L·h). 与这些北半球高纬度地区的贫营养湖泊相比,本研究水库中浮游细菌生产及呼吸代谢速率更高.
无论是在内源碳主导类型(内源型)还是外源碳主导类型(外源型)水库中,随着水体初级生产力的增加,浮游细菌总代谢过程中对内源碳的利用速率均显著上升(图 4b,c),说明水体初级生产力增加对浮游细菌代谢内源DOC具有一定程度的促进作用. 研究者普遍认为,水体初级生产者释放的藻源性碳(内源DOC)的生物可利用性更高[26],比起芳香化程度较高的外源DOC,内源DOC存在更多的氨基酸和碳水化合物. Amon等[27]利用北极水体中的藻类DOC(内源DOC)进行了10天的浮游细菌降解实验,发现浮游细菌选择性地利用DOC中容易被其降解的中性糖和氨基酸组分,留下难降解组分. Brett等[28]学者通过大量文献调查,发现流入淡水生态系统中的外源性有机碳由80 %~90 %的难以生物化学降解的木质纤维素组成,这无疑增加了细菌代谢陆源碳的难度. 在本研究选取的11座水库中,外源型有机碳的来源主要为树叶和土壤(表 2),在水体中不易分解[29]. 不过Logue等通过对加拿大数百个湖泊、河流和湿地的分析表明,外源DOC中可生物降解的DOC的比例仍然存在[30]. 这也在一定程度上解释了本实验中所观察到的外源碳在两种水库细菌代谢过程中保持一定当量的现象.
在本研究中的外源型水库中随Chl.a浓度的增加,呼吸速率及呼吸内源碳速率均显著增加,这与Guillemette等[5]对加拿大魁北克省12座寡营养型湖泊的研究结果一致,外源碳主导的水体浮游细菌优先利用内源DOC完成呼吸作用. 而本研究中的内源型水库中,未发现细菌呼吸代谢与初级生产存在显著的相关关系,我们推测内源DOC不是浮游细菌呼吸作用的限制因子. 两种类型水库浮游细菌呼吸速率对水体初级生产力升高的响应不同,反映了不同水体细菌碳代谢特征的差异. 而浮游细菌呼吸作用是整个水域生态系统异养呼吸作用的主体[31],特别是一些初级生产力水平较低的寡营养水体,浮游细菌呼吸强度远远超过水体初级生产力,使得湖库水体成为大气CO2的重要释放源[32],因此,关注不同营养水平和不同碳源环境下浮游细菌呼吸速率对了解区域CO2释放具有重要意义.
3.2 水体营养水平与浮游细菌呼吸作用的联系氮、磷一直被认为是淡水生态系统中限制细菌生长的主要营养成分,其生物可利用性在很大程度上影响着DOC的累积和细菌的代谢[33]. 呼吸作用强弱是评价浮游细菌分解代谢活性的重要指标,更是水体DOC分解促使CO2排放的重要环节. 异养浮游细菌的呼吸作用与有机底物浓度、碳源类型、温度、营养条件等因素有着密切的联系[31, 34]. Sánchez等[35]利用废水处理的光呼吸反应器进行了浮游细菌的光呼吸实验,发现细菌的呼吸代谢速率与水体藻源性有机碳的浓度存在着显著相关性,并且受光强、温度、pH、营养盐离子以及溶解氧等环境条件的共同影响.
外源型水库中NO3-和PO43-浓度的升高促进了浮游细菌呼吸作用的现象,在寡营养水体中具有一定的普遍性[36-37]. 可能的原因为:一方面,NO3-和PO43-浓度的升高使水体C∶N和C∶P的比例降低,更有利于呼吸作用对有机底物的分解[38];另一方面,营养盐的增加不仅为浮游细菌提供更为优良的代谢条件,同时也为水体初级生产者给予更充分的营养来源. 一项在河口地区的研究表明[39],外源性有机物质的输入通过所携带营养物质的增多,刺激了内源性有机质的产生,进而间接促进异养浮游细菌的呼吸速率. 而在本研究中,外源型水库中Chl.a浓度与DOC、TN、NO3-、PO43-具有显著的正相关关系(r > 0.7; P < 0.01),而且外源DOC主导的水体中,NO3-、PO43-增加导致浮游细菌呼吸速率上升. 与外源型水库相比,内源型水库不仅优势碳源类型不同,其DOC、Chl.a、及各形态氮磷浓度也更高(图 3). Stelzer等[40]在寡营养溪流水体中构建了不同碳源类型、不同营养梯度的实验,发现不同类型的有机底物下浮游细菌对营养盐的响应不同. Allesson等[41]研究了不同DOC和磷浓度下浮游细菌代谢特征,发现当DOC浓度小于10 mg/L时,磷添加会促进浮游细菌的呼吸作用. 而当DOC浓度大于15 mg/L时,有机底物对细菌代谢过程不构成限制作用,添加了磷的处理组中浮游细菌特异性呼吸rRNA基因拷贝数反而低于不添加磷的对照组. 这些发现与本研究对外源型与内源型水库调查获得的结果相吻合. 在Allesson等[41]的实验中,随着水体磷元素浓度增加,尽管细胞水平上呼吸作用降低,但细菌生产过程反而增强,也可以表现出更高的代谢活性.
4 结论本研究选取了南京市11座中小型水库,利用碳稳定同位素技术和双端元混合模型定量分析浮游细菌在生产和呼吸代谢过程中对内外碳源的利用. 通过对比内源型和外源型水库,获得的主要结论:
1) 不同类型的水库随初级生产力提高,浮游细菌生产和呼吸过程的响应不同. 对于内源型水库,Chl.a浓度升高促进了浮游细菌生产过程对内源碳的利用,而对外源型水库,Chl.a浓度升高显著促进了浮游细菌呼吸作用对内源碳的利用.
2) 不同类型的水库水体营养盐浓度对呼吸作用的影响不同. 内源型水库随着氮、磷营养盐浓度升高,呼吸作用显著减弱,而外源型水库的规律完全相反.
| [1] |
Sun H, Zhang YD, Yu JL et al. Contribution of allochthonous dissolved organic carbon to the carbon source of planktonic crustaceans in Lake Fuxian. J Lake Sci, 2017, 29(4): 887-895. [孙欢, 张永东, 于谨磊等. 外源溶解性有机碳对抚仙湖甲壳类浮游动物碳源的贡献. 湖泊科学, 2017, 29(4): 887-895. DOI:10.18307/2017.0412] |
| [2] |
Peterson JA, McDowell WH, Neff JC. Sources, production, and regulation of allochthonous dissolved organic matter inputs to surface waters. In: Findlay S, Sinsabaugh R eds. Aquatic ecosystems: interactivity of dissolved organic matter. New York: Academic Press, 2003: 26-70.
|
| [3] |
Bertilsson S, Jones JB Jr. Supply of dissolved organic matter to aquatic ecosystems: autochthonous sources. In: Findlay S, Sinsabaugh R eds. Aquatic ecosystems: interactivity of dissolved organic matter. New York: Academic Press, 2003: 3-25.
|
| [4] |
Falkowski PG, Fenchel T, Delong EF. The microbial engines that drive Earth's biogeochemical cycles. Science, 2008, 320(5879): 1034-1039. DOI:10.1126/science.1153213 |
| [5] |
Guillemette F, Leigh McCallister S, del Giorgio PA. Selective consumption and metabolic allocation of terrestrial and algal carbon determine allochthony in lake bacteria. The ISME Journal, 2016, 10(6): 1373-1382. DOI:10.1038/ismej.2015.215 |
| [6] |
de Kluijver A, Yu JL, Houtekamer M et al. Cyanobacteria as a carbon source for zooplankton in eutrophic Lake Taihu, China, measured by 13C labeling and fatty acid biomarkers. Limnology and Oceanography, 2012, 57(4): 1245-1254. DOI:10.4319/lo.2012.57.4.1245 |
| [7] |
Banerjee S, Schlaeppi K, van der Heijden MGA. Keystone taxa as drivers of microbiome structure and functioning. Nature Reviews Microbiology, 2018, 16(9): 567-576. DOI:10.1038/s41579-018-0024-1 |
| [8] |
Sundh I. Biochemical composition of dissolved organic carbon derived from phytoplankton and used by heterotrophic bacteria. Applied and Environmental Microbiology, 1992, 58(9): 2938-2947. DOI:10.1128/aem.58.9.2938-2947.1992 |
| [9] |
Russell JB. The energy spilling reactions of bacteria and other organisms. Journal of Molecular Microbiology and Biotechnology, 2007, 13(1/2/3): 1-11. DOI:10.1159/000103591 |
| [10] |
Guillemette F, McCallister SL, del Giorgio PA. Differentiating the degradation dynamics of algal and terrestrial carbon within complex natural dissolved organic carbon in temperate lakes. Journal of Geophysical Research: Biogeosciences, 2013, 118(3): 963-973. DOI:10.1002/jgrg.20077 |
| [11] |
Tang XQ, Guo WJ, Wu M et al. Functional deterioration and restoration measures for rural small reservoirs. J Yangtze River Scientific Research Institute, 2018, 35(2): 17-21. [汤显强, 郭伟杰, 吴敏等. 农村小型水库功能退化分析及恢复对策. 长江科学院院报, 2018, 35(2): 17-21. DOI:10.11988/ckyyb.20160993] |
| [12] |
Chen MJ, Chen FZ. Water quality evaluation and eutrophication analysis of small reservoirs in Nanjing. Environmental Protection Science, 2020, 46(4): 87-91. [陈美军, 陈非洲. 南京市小型水库水质评价和富营养化分析. 环境保护科学, 2020, 46(4): 87-91.] |
| [13] |
Acuña-Alonso C, Álvarez X, Lorenzo O et al. Water toxicity in reservoirs after freshwater algae harvest. Journal of Cleaner Production, 2021, 283: 124560. DOI:10.1016/j.jclepro.2020.124560 |
| [14] |
Karlsson J, Berggren M, Ask J et al. Terrestrial organic matter support of lake food webs: Evidence from lake metabolism and stable hydrogen isotopes of consumers. Limnology and Oceanography, 2012, 57(4): 1042-1048. DOI:10.4319/lo.2012.57.4.1042 |
| [15] |
Li B, Gu QJ, Miao YQ et al. Methane distribution patterns along a transect of Lake Fuxian, a deep oligotrophic lake in China. Environmental Science and Pollution Research, 2020, 27(21): 25848-25860. DOI:10.1007/s11356-019-06098-7 |
| [16] |
Zhou YW, Song K, Han RM et al. Nonlinear response of methane release to increased trophic state levels coupled with microbial processes in shallow lakes. Environmental Pollution, 2020, 265: 114919. DOI:10.1016/j.envpol.2020.114919 |
| [17] |
Zhang JY, Ni WM, Luo Y et al. Response of freshwater algae to water quality in Qinshan Lake within Taihu Watershed, China. Physics and Chemistry of the Earth, Parts A/B/C, 2011, 36(9/10/11): 360-365. DOI:10.1016/j.pce.2010.04.018 |
| [18] |
Pierson-Wickmann AC, Gruau G, Jardé E et al. Development of a combined isotopic and mass-balance approach to determine dissolved organic carbon sources in eutrophic reservoirs. Chemosphere, 2011, 83(3): 356-366. DOI:10.1016/j.chemosphere.2010.12.014 |
| [19] |
Li ZP, Zhang TL, Chen BY. Dynamics of soluble organic carbon and its relation to mineralization of soil organic carbon. Acta Pedologica Sinica, 2004, 41(4): 544-552. [李忠佩, 张桃林, 陈碧云. 可溶性有机碳的含量动态及其与土壤有机碳矿化的关系. 土壤学报, 2004, 41(4): 544-552.] |
| [20] |
Goldenfum JA. GHG measurement guidelines for freshwater reservoirs. London: The International Hydropower Association, 2010: 76.
|
| [21] |
Phillips DL, Gregg JW. Uncertainty in source partitioning using stable isotopes. Oecologia, 2001, 127(2): 171-179. DOI:10.1007/s004420000578 |
| [22] |
Liew JH, Chua KWJ, Arsenault ER et al. Quantifying terrestrial carbon in freshwater food webs using amino acid isotope analysis: Case study with an endemic cavefish. Methods in Ecology and Evolution, 2019, 10(9): 1594-1605. DOI:10.1111/2041-210x.13230 |
| [23] |
Zeng QF, Kong FX, Zhang EL et al. Effects of anthropogenic organic matter inputs on stable carbon and nitrogen isotopes in organisms from microbial food chain in Taihu Lake. Environ Sci, 2007, 28(8): 1670-1674. [曾庆飞, 孔繁翔, 张恩楼等. 利用稳定同位素技术研究外源物质输入对太湖微食物链的贡献. 环境科学, 2007, 28(8): 1670-1674. DOI:10.13227/j.hjkx.2007.08.036] |
| [24] |
Figueroa D, Rowe OF, Paczkowska J et al. Allochthonous carbon-a major driver of bacterioplankton production in the subarctic northern Baltic sea. Microbial Ecology, 2016, 71(4): 789-801. DOI:10.1007/s00248-015-0714-4 |
| [25] |
Karlsson J, Jansson M, Jonsson A. Respiration of allochthonous organic carbon in unproductive forest lakes determined by the Keeling plot method. Limnology and Oceanography, 2007, 52(2): 603-608. DOI:10.4319/lo.2007.52.2.0603 |
| [26] |
Shen Y, Fichot CG, Liang SK et al. Biological hot spots and the accumulation of marine dissolved organic matter in a highly productive ocean margin. Limnology and Oceanography, 2016, 61(4): 1287-1300. DOI:10.1002/lno.10290 |
| [27] |
Amon RMW, Fitznar HP, Benner R. Linkages among the bioreactivity, chemical composition, and diagenetic state of marine dissolved organic matter. Limnology and Oceanography, 2001, 46(2): 287-297. DOI:10.4319/lo.2001.46.2.0287 |
| [28] |
Brett MT, Bunn SE, Chandra S et al. How important are terrestrial organic carbon inputs for secondary production in freshwater ecosystems?. Freshwater Biology, 2017, 62(5): 833-853. DOI:10.1111/fwb.12909 |
| [29] |
France R, Culbert H, Peters R. Decreased carbon and nutrient input to boreal lakes from particulate organic matter following riparian clear-cutting. Environmental Management, 1996, 20(4): 579-583. DOI:10.1007/BF01474657 |
| [30] |
Logue JB, Stedmon CA, Kellerman AM et al. Experimental insights into the importance of aquatic bacterial community composition to the degradation of dissolved organic matter. The ISME Journal, 2016, 10(3): 533-545. DOI:10.1038/ismej.2015.131 |
| [31] |
Pace ML, Prairie YT. Respiration in lakes. Oxford: Oxford University Press, 2005.
|
| [32] |
Grasset C, Sobek S, Scharnweber K et al. The CO2-equivalent balance of freshwater ecosystems is non-linearly related to productivity. Global Change Biology, 2020, 26(10): 5705-5715. DOI:10.1111/gcb.15284 |
| [33] |
Farjalla VF, Faria BM, Esteves FA. The relationship between DOC and planktonic bacteria in tropical coastal lagoons. Archiv Für Hydrobiologie, 2002, 156(1): 97-119. DOI:10.1127/0003-9136/2002/0156-0097 |
| [34] |
Rodibaugh KJ, Becker JC, Timmins G et al. Physicochemical and carbon quantity-quality gradients equally influence bacterial carbon metabolism across an arid riverscape. Aquatic Ecology, 2020, 54(3): 677-696. DOI:10.1007/s10452-020-09767-9 |
| [35] |
Sánchez Zurano A, Gómez Serrano C, Acién-Fernández FG et al. Modeling of photosynthesis and respiration rate for microalgae-bacteria consortia. Biotechnology and Bioengineering, 2021, 118(2): 952-962. DOI:10.1002/bit.27625 |
| [36] |
Cimbleris ACP, Kalff J. Planktonic bacterial respiration as a function of C: N ratios across temperate lakes. Hydrobiologia, 1998, 384(1): 89-100. DOI:10.1023/a:1003496815969 |
| [37] |
Jansson M, Bergström AK, Lymer D et al. Bacterioplankton growth and nutrient use efficiencies under variable organic carbon and inorganic phosphorus ratios. Microbial Ecology, 2006, 52(2): 358-364. DOI:10.1007/s00248-006-9013-4 |
| [38] |
Weigel BL, Pfister CA. The dynamics and stoichiometry of dissolved organic carbon release by kelp. Ecology, 2021, 102(2): e03221. DOI:10.1002/ecy.3221 |
| [39] |
Soares ARA, Berggren M. Indirect link between riverine dissolved organic matter and bacterioplankton respiration in a boreal estuary. Marine Environmental Research, 2019, 148: 39-45. DOI:10.1016/j.marenvres.2019.04.009 |
| [40] |
Stelzer RS, Heffernan J, Likens GE. The influence of dissolved nutrients and particulate organic matter quality on microbial respiration and biomass in a forest stream. Freshwater Biology, 2003, 48(11): 1925-1937. DOI:10.1046/j.1365-2427.2003.01141.x |
| [41] |
Allesson L, Andersen T, Dörsch P et al. Corrigendum: phosphorus availability promotes bacterial DOC-mineralization, but not cumulative CO2-production. Frontiers in Microbiology, 2020, 11: 569879. DOI:10.3389/fmicb.2020.569879 |
 2022, Vol. 34
2022, Vol. 34 

