湿地生态系统是陆地上重要的有机碳库,其不仅储存大量的有机碳,而且被认为是大气中二氧化碳的重要碳汇基地,对减缓全球气候变化具有重要作用[1]. 土壤也是湿地生态系统中极其重要的生态因子,其有机碳含量显著影响湿地生态系统的环境调节功能. 目前,人类活动对土壤有机碳的含量造成了消极的影响[2],如土地利用和土地覆盖(LUCC)的改变会导致湿地植物群落发生次生演变以及水文条件的变化,这将会显著影响湿地土壤碳汇功能,从而影响整个地球生态系统碳循环[3]. 随着全球气候变暖的加剧以及人类的不合理利用,湿地退化严重,导致土壤中有机碳分解速率加快,温室效应突显,对全球气候变化造成重要的影响[4]. 因此,开展土壤有机碳特征对湿地土地利用改变的响应过程研究,不仅有助于科学评价湿地退化程度,而且有助于精确估算湿地生态系统碳收支状况,为准确预测气候变化以及对遭到破坏的湿地土壤生态功能进行恢复与重建有重要意义[5].
土壤有机碳库包括易分解和矿化的活性有机碳组分,其对土壤管理措施响应最为敏感,也最容易从碳库中丢失[6]. 土壤有机碳降解过程需要特定功能的胞外酶来协助完成,而胞外酶通常会受到土壤物理和化学性质改变的影响[6],从而影响到土壤中有机碳的分解和循环过程. Alster等[7]和Du等[8]研究认为蔗糖酶和多酚氧化酶活性与湿地土壤的碳循环有重要关系. 另外,目前研究表明,相对于总有机碳而言,土壤中一些活性有机碳组分对人类活性干扰响应更为敏感[9-10]. 目前关于土地利用和土地覆盖变化对森林和草地土壤有机碳组分的影响已有报道,其机理主要是土地利用和覆盖的变化影响了微生物代谢作用,从而改变了土壤有机碳结构的稳定性[11-12]. 但是,湖滨带湿地土地利用方式改变造成的活性有机碳组分改变及其对土壤酶活性的影响以及作用机理仍不清晰.
湖滨带是湖泊水陆生态系统间的物流、能流、信息流和生物流热点场所,发挥着过滤器和屏障作用的缓冲带功能,拥有维持陆地和湖泊生态系统平衡稳定的重要作用[13-14]. 但是,湖滨带湿地作为地球上最为脆弱的湿地系统之一,受人类活动影响最为强烈[15]. 巢湖位于安徽省中部,为我国五大淡水湖之一,为典型淡水浅水湖泊,过去拥有大面积的湖滨带原生芦苇湿地. 由于受到强烈的人为活动干扰,特别是城镇化的快速发展,加上常年高水位运行,目前巢湖湖滨带原生芦苇面积严重萎缩,土地利用与覆盖发生明显变化,造成湖滨带生态系统功能退化,大大削弱了湖滨缓冲带对陆源污染的拦截和降解作用,从而对巢湖水体水质造成不良影响[16]. 本研究以巢湖湖滨带为研究对象,通过对不同土地利用和覆盖下湖滨带土壤有机碳组分和酶活性进行测定,以阐明湖滨带原生湿地改变后对土壤有机碳组分特征与生化代谢过程的影响,研究结果将为揭示湖滨带土壤对土地利用与覆被改变响应的微观机制以及筛选出敏感的表征指标提供理论依据和方法.
1 研究区域和研究方法 1.1 研究区域概况巢湖为我国五大淡水湖之一,湖面积约780 km2,流域面积13486 km2. 巢湖东西长54.5 km,南北宽21 km,湖岸线长约170 km. 巢湖水深2~5 m,多年平均水深2.69 m,库容为17.17亿km3. 巢湖流域属北热带湿润季风气候区,四季分明、气候温和,年均气温15.8℃,极端最高气温41.1℃,极端最低气温-20.6℃,无霜期约225 d. 流域年均降雨量1120.3 mm,年际变化悬殊. 巢湖北部地貌类型主要为平坦平原、波状平原、浅丘状平原和丘陵地貌,受区域地理地质环境、成土条件和成土过程的影响,主要分布着河流冲积物母质和晚更新世黄土母质,形成了以黄褐土、水稻土为主要类型的土壤. 区域内分布有大量的湖滨带原生湿地,其代表性植被类型包括芦苇和水柳,这些原生态湖滨带湿地不仅是重要的碳库,同时对拦截、净化陆源污染、改善巢湖水环境发挥极其重要作用. 但是,近几年随着环湖大道的修建和城镇化的快速发展,很多湖滨带原生植被已经被破坏,取而代之的是人工景观植被,包括绿地公园和岸上草原,从而大大削弱湖滨带的生态和环境功能.
1.2 样地设置与样品采集本次采样区域位于巢湖北岸的湖滨大道沿线湖岸,该区域受人类干扰和城镇化影响最大,本研究区域所在位置及采样点分布见图 1所示.

|
图 1 研究区域及采样点分布 Fig.1 Study area and distribution of sampling sites |
根据湖滨带植被类型和受人类活动影响程度共设9个采样点,S1为原生芦苇(Phragmites australis (Cav.) Trin. ex Steud)湿地,植被覆盖度高达70 % ~80 %,面积约为2.0 hm2;S2和S3采样点分别位于原生芦苇湿地破坏后经过10~20年种植历史的次生水柳林(Homonoia riparia Lour.),林下为杂草,植被覆盖度45 % ~60 %,面积分别约为2.5和3.1 hm2;S4位于15年水柳林和芦苇带混交区,植被覆盖度40 % ~55 % 左右,面积约为1.5 hm2;S5为受人类活动干扰和风浪侵蚀严重的荒滩,原来也是芦苇湿地,目前植被平均覆盖度仅为16 % 左右,面积约为1.2 hm2;S6和S7分别为8年和5年恢复历史的纯人工水杉(Metasequoia glyptostroboides Hu et Cheng)林,植被覆盖度为45 % ~60 %,面积分别约为1.5和1.7 hm2;S8和S9分别为2010年左右由退化芦苇湿地构建的城市公园绿地和人工草滩(岸上草原),由于受游客踩踏严重,植被长势一般,平均覆盖度为40 % 左右,但面积较大,分别约为3.5和4.2 hm2. 不同采样点基本信息如表 1所示.
| 表 1 不同采样点基本信息 Tab. 1 Basic information of different sampling points |
采样时间是2017年3月28日. 在每种湖滨带湿地类型中选择3块4 m×4 m的样地,设定为研究采样点,并观测记录地表植被分布、地理位置等相关信息,由于采样期间巢湖正处于枯水季节,水位较低,9个采样点所在样地均高出湖水水面,无明显水层. 采用多点混合法采集0~30 cm深度的表层土壤样品. 每个样点采集2 kg的土样,取好的土样装入塑料袋中密封好,立即放入装有冰块的冷藏箱中保存,并及时带回实验室进行分析. 称取一半重量的新鲜土样立即分析测定过氧化氢酶、脲酶、多酚氧化酶、蔗糖酶等酶的活性;另一半土壤样品经剔除可见的动、植物残体和石块后进行自然风干、磨细分别过0.85和0.25 mm孔筛,以测定土壤pH和阳离子交换量(CEC);研磨过0.15 mm孔筛分别测定土壤总有机碳(TOC)及溶解性有机碳(DOC)、易氧化有机碳(EOC)等活性有机碳组分含量. 每个样品3次重复.
1.3 分析方法 1.3.1 土壤基本理化指标分析土壤pH采用pH计测定(上海雷磁PHSJ-3F型),浸提水土比为2.5 ∶1;土壤容重采用环刀法测定;CEC测定采用BaCl2-H2SO4强迫交换法:以Ba2+离子交换沉积物中的各种阳离子,再以硫酸将交换到沉积物中的Ba2+沉淀出来,H+被交换到土壤中,通过滴定剩余硫酸溶液的H+物质的量计算CEC值. 土壤中总氮(TN)含量采用凯氏定氮法测定. 以上指标具体测定方法可参考文献[17].
土壤TOC含量采用总有机碳分析仪法,使用有固体进样器(SSM-5000A)的总有机碳分析仪(TOC-V CPN)(日本岛津公司)进行测定. 土壤DOC含量测定:取6.0 g过0.15 mm孔筛的风干土样加入50 mL离心管中,并加入25 mL蒸馏水,放入摇床中,调至摇床速度至180 r/min,振荡1 h,之后放入离心机中,调至转速为3500 r/min,离心20 min,将离心好的悬浊液倒入真空抽滤装置中进行抽滤,使用0.45 μm膜过滤,得到的上清液即为土壤样品的DOC浸提液,倒入TOC仪器专用试剂瓶中,使用总有机碳分析仪(TOC-V CPN)进行测定[18];土壤EOC,即能被333 mmol/L的高锰酸钾溶液氧化的有机碳组分含量测定:根据用于氧化土样中的“易氧化碳”之后的高锰酸钾(剩液)的浓度与对照浓度之差来定量土样中易氧化碳消耗高锰酸钾的摩尔质量,进而计算每个土壤中的易氧化有机碳的含量,土壤有机碳氧化量用mg/kg表示(1 mmol KMnO4氧化0.75 mmol C)[19].
1.3.2 土壤酶活性测定土壤脲酶活性采用靛酚蓝比色法[20];该方法以尿素为基质,酶促产物氨与苯酚-次氯酸钠作用生成蓝色的靛酚,该生成物量与氨浓度呈正比,脲酶的活性以24 h后1 g土壤中产生的NH3-N质量表示(mg/(g ·24 h));蔗糖酶采用二硝基水杨酸比色法[18],其活性以24 h内1 g干土生成葡萄糖毫克数表示(mg/(g ·24 h));多酚氧化酶采用邻苯二酚比色法[21],多酚氧化酶的活性以2 h后1 g干土样中紫色没食子素的毫克数表示(mg/(g ·2 h));过氧化氢酶活性采用紫外分光光度法[22]:通过加入定量过量的过氧化氢,与土壤反应一段时间后,加入量与剩余之差即为被酶催化反应消耗的过氧化氢,以此表示酶活性,单位为mg/(g ·h).
1.4 数据处理与统计分析采用Excel 2010和SPSS 19.0统计软件对实验数据进行处理,所有实验数据通过ANOVA变异分析程序进行统计分析. 采用邓肯新复检验法(Duncan’newmultiple range test)对巢湖湖滨带不同采样点土壤有机碳组分和酶活性进行差异显著性分析,在P<0.05的概率水平视为显著. 采用Pearson相关性分析评价湖滨带湿地土壤有机碳组分与酶活性之间的相关性.
2 结果与分析 2.1 不同采样点土壤基本理化指标差异由表 2可以明显看出,除土壤pH外,不同采样点土壤容重和阳离子交换量(CEC)均存在明显差异(P<0.05). 土壤容重以原生芦苇湖滨带湿地土壤最低,植被破坏后裸露并出现沙化的S5点最高,基本上呈现出受人为影响程度越高,其湖滨带土壤容重也越高的趋势. CEC是表征土壤具有缓冲性能的重要指标,特别是对于湖滨带湿地来说,该指标可以有效表征湖滨带缓冲带对陆源污染物的吸附作用. 从表 2可以明显看出,随着湖滨带土地利用和覆被的变化以及人工干扰强度的增加,土壤CEC大小均呈现不同程度下降的趋势,从而会导致湖滨带湿地缓冲功能减弱.
| 表 2 不同采样点土壤主要理化性质* Tab. 2 Major soil physiochemical properties from different sampling sites |
巢湖北岸湖滨带不同土地利用和覆被下各采样点土壤样品TOC含量变化范围为7.88~11.2 g/kg,平均含量为9.12 g/kg(图 2). 不同采样点的土壤TOC含量存在明显的差异(P<0.05),其中原生芦苇湿地(S1)土壤TOC含量最高,高达11.2 g/kg,由芦苇湿地改种的次生水柳林(S2和S3)土壤平均TOC含量次之(10.3 g/kg),而芦苇群落消失后形成的荒滩土壤TOC含量最低,仅为2.88 g/kg. S6~S9分别为原生芦苇湿地破坏后人工种植8 a的水杉林、5 a的水杉林、绿地公园和人工草滩,其土壤TOC含量明显低于次生的水柳林和原生的芦苇湿地土壤,但显著高于S5采样点(P<0.05). 通过比较还发现,人工水杉林种植年限越长,TOC含量增加越明显. 由此可见,对于受人为破坏的湖滨带湿地,适当进行植被修复,可以对土壤有机碳起到一定的恢复作用,但是很难恢复到原生湿地土壤有机碳水平.

|
图 2 不同采样点土壤总有机碳含量比较 (不同小写字母表示差异显著(P<0.05),下同) Fig.2 Comparison of soil total organic carbon (TOC) content from different sampling sites |
湖滨带表层土壤活性有机碳组分,即DOC和EOC含量变化范围分别为150~370 mg/kg和1.7~5.2 g/kg(图 3). 从图 3可以看出,与TOC相似,不同采样点土壤中活性有机碳组分(DOC和EOC)含量差异也非常明显,但与TOC含量变化趋势不完全一致. 另外,不同采样点表层土壤DOC和EOC的差异明显高于TOC. DOC含量最高值出现在植被恢复较好的次生水柳林湿地,最低出现在土壤裸露程度较高的S5点,说明DOC可以很好反映出湖滨带湿地植被覆盖程度和受人类干扰程度,可作为表征湖滨带湿地退化程度的敏感性指标. 从图 4中还可以看出,同样是活性有机碳组分,EOC含量在不同采样点的变化趋势与DOC和TOC略有不同,其最高值出现在天然芦苇和水柳混合带湿地林,但最低值却出现在8年种植历史的人工水杉林湿地. 位于植被裸露的荒滩土壤EOC含量却明显高于人工水杉林湿地EOC含量. 而位于滨湖城市公园绿地和人工草地的S8和S9样点土壤EOC含量却略高于原生芦苇湿地,与实际湖滨带植被覆盖度和受人为活动干扰程度吻合度不及DOC.
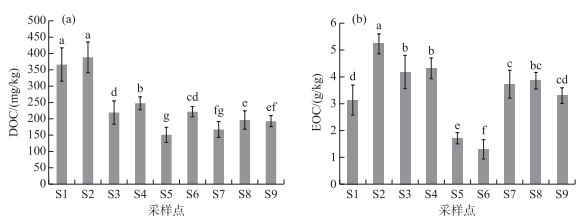
|
图 3 不同采样点土壤溶解性有机碳(a)与易氧化有机碳(b)含量比较 Fig.3 Comparisons of soil dissolved organic carbon (a) and easily-oxidation organic carbon (b) contents from different sampling sites |
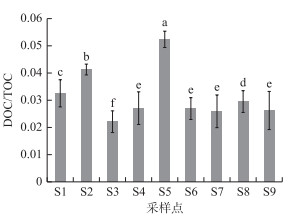
|
图 4 不同采样点土壤中溶解性有机碳与总有机碳比值分布 Fig.4 Ratio of soil dissolved organic carbon to total organic carbon (DOC/TOC) from different sampling sites |
溶解性有机碳占总有机碳的比值(DOC/TOC)也可以反映土壤有机碳的总体活性和转换效率. 从图 4可看到,位于水柳林和芦苇带混合区S3的DOC/TOC比值最低, 说明湿地土壤有机碳易分解组分所占比例较小, 有机碳较为稳定, 利于土壤有机碳的累积. 而在所有采样点中,位于植被稀少、且沙化严重的S5采样点表层土壤DOC/TOC比值却为最高.
2.4 不同采样点土壤酶活性比较巢湖湖滨带不同采样点土壤中与碳、氮代谢过程相关的几种关键酶活性也存在显著差异(图 5). 过氧化氢酶和蔗糖酶活性以种植20年历史的次生水柳树林采样点S3为最高,种植10年历史的次生水柳树林采样点S2和原生芦苇湿地次之,而植被稀疏并侵蚀沙化较为严重的S5采样点过氧化氢酶和蔗糖酶活性均为最低. 尿酶活性则以S2和S3采样点为最高,说明芦苇湿地变为次生水柳林有利于土壤中脲酶活性的提升. 不同采样点多酚氧化酶活性变化则与其它3种酶呈现出几乎相反的规律,其活性最高土壤位于S5采样点,原生植被湖滨带和人工恢复湖滨带土壤多酚氧化酶活性反而皆较低,相关机理还有待于进一步研究. 相对于植被稀疏的S5采样点,S6~S8采样点由于实施了人工林(草)种植和恢复过程,其湖滨带土壤酶活性具有明显的提升作用(图 6),特别是脲酶和蔗糖酶活性增加效果更为明显. 与S5相比较,S6~S8采样点土壤脲酶和蔗糖酶活性平均值分别增加了78.6 % 和89.4 %. 由此表明,对遭人为破坏后的原生芦苇湿地湖滨带进行植被生态修复,可以逐步恢复湖滨带土壤生化和生态功能.
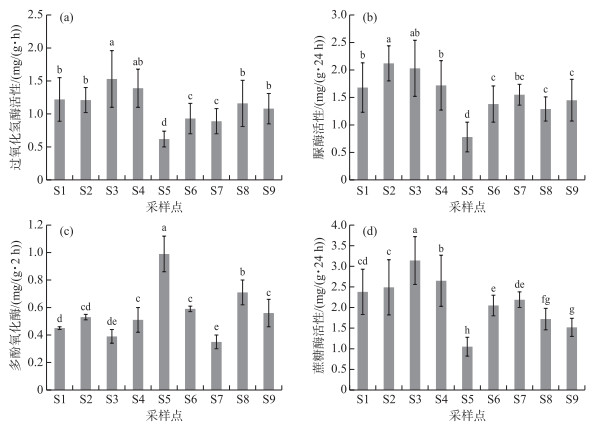
|
图 5 不同采样点土壤过氧化氢酶(a)、脲酶(b)、多酚氧化酶(c)和蔗糖酶(d)活性比较 Fig.5 Comparisons of soil enzymatic activities of catalase (a), urease (b), polyphenol oxidase (c), and invertase (d) from different sampling sites |
表 3为巢湖湖滨带不同采样点几种关键性酶活性与土壤有机碳组分及主要理化指标之间的相关性分析结果. 从表 3中可以看出,过氧化氢酶、脲酶和多酚氧化酶活性与土壤CEC和pH相关性皆不显著(P>0.01),蔗糖酶活性与CEC呈显著正相关(P<0.05),但是与pH关系不显著(P>0.05). 除多酚氧化酶外,其他几种酶的活性与土壤总氮(TN)含量到显著水平,其中脲酶活性与TN含量相关系数为0.893,达到极显著水平(P<0.01). 所测定的几种土壤酶活性与土壤有机碳组分之间呈现不同程度的相关性,其中过氧化氢酶、脲酶和蔗糖酶活性与TOC含量的相关性均达到显著水平(P<0.05),而与活性有机碳组分EOC和DOC含量的相关性达到极显著水平(P<0.01). 蔗糖酶活性与DOC含量的变化趋势符合程度极高,当蔗糖酶活性达到最大值3.14 mg/(g ·24 h)时,土壤的DOC含量随之达到接近1 % 的高水平,相关系数达到0.907. 与其他几种酶相反,多酚氧化酶与土壤有机碳组分呈负相关性,但只与TOC含量的相关性达到显著水平(P<0.05),与EOC和DOC含量之间负相关性不显著(P>0.01). 脲酶与TN含量的相关系数为0.893,脲酶与TN含量存在不可分割的联系.
| 表 3 湖滨带土壤关键酶活性与土壤理化性质及土壤有机碳含量相关系数 Tab. 3 Correlation coefficents between soil enzymatic activities and soil physiochemical properties, soil carbon fractions |
研究表明,湿地土壤TOC含量主要取决于植被积累和分解速率,当植被的积累量大于分解量时土壤TOC开始进行累积[23]. 因此,土壤TOC含量及储存主要受植被类型与覆盖度影响,夏品华等[24]对贵州高原草海湿地的研究结果表明,不同湿地植物类型及其退化程度下土壤TOC含量差异明显. 本研究结果也表明,巢湖湖滨带不同土地利用方式与覆盖度下土壤TOC含量差异显著. 湖滨带原生芦苇湿地由于地上部分生物量较大,有机质返还率较高,加上地势较低,长期或周期性淹水,有机质分解速率较低,导致土壤中有机质不断积累,TOC含量在所有采样点为最高. 而巢湖湖滨带原生芦苇湿地退化后变为植被稀疏的荒滩后,土壤TOC含量迅速下降,如S5采样点TOC含量为2.88 g/kg,约为原生芦苇湿地土壤的1/4. 原生芦苇湿地退化后改种水柳或通过其他人工植被恢复后土壤TOC含量出现不同程度的增加. 通过比较还发现,人工种植年限越长,TOC含量增加越明显. 由此可见,对于受人为破坏的湖滨带湿地,适当进行植被修复,可以提升土壤碳汇能力,但是很难恢复到原生湿地土壤有机碳水平. 而受人类活动干扰较大的湖滨城市绿地和人工草滩对土壤有机碳的截存能力会产生不利影响.
土地利用与覆被变化所导致的湿地土壤碳截存能力及稳定性下降将会引发不良的环境效应[25]. 湿地土地利用方式变化后,水文条件发生改变,加上土壤扰动比较频繁,土壤呼吸作用增加,从而加速了TOC的分解消耗[26],并成为温室气体排放的重要策源地. 湖滨带原生芦苇湿地被人为开发破坏之后,脱离了原有的植被环境,土壤中有机碳的稳定性大大降低,其损耗的速率也将加快[27],使得湖滨带湿地由“碳汇”变成“碳源”,对减缓全球气候变化产生不利影响. 另外,湿地土壤有机碳是衡量湿地缓冲性能的重要指标,土地利用和覆盖的改变所导致的湖滨带有机碳含量的下降和微团聚体的缺失将大大降低了湖滨带湿地的缓冲性能,特别是削弱了湖滨带对面源污染的拦截、净化能力,从而会影响湖体水质[28-29]. 有研究表明,湖滨缓冲带保留越完整,土壤TOC含量越高,土壤微团聚体也越丰富,从而大大提高土壤对陆源污染物的吸附能力,这对提升湖滨带生态环境功能具有重要意义[30-31].
3.2 湖滨带原生芦苇湿地改变后对土壤活性有机碳组分的影响目前有研究表明,与TOC含量相比较,土壤中分子量较小、易被微生物分解的活性有机碳组分,如易氧化有机碳(EOC)、溶解性有机碳(DOC)和轻组分有机碳(LFOC)等对土地利用及覆盖变化响应更为敏感[32-33]. 本研究结果也表明,巢湖湖滨带不同采样点土壤中EOC、DOC含量差异明显高于TOC在不同采样点之间的差异,特别是土壤DOC含量受湖滨带土地利用与覆盖变化的影响最为显著. 巢湖湖滨带原生芦苇湿地虽然TOC含量最高,但是土壤活性有机碳组分EOC和DOC最高值却出现次生水柳林样地,主要原因可能是次生水柳林土壤本身总有机质较高,同时由于次生水柳林地势较高,每年大部分时间露在外面,积水极少,土壤平均温度较高,土壤中好氧微生物代谢作用较强[34],使得原来被截存在芦苇湿地土壤中大分子腐殖质被分解成小分子的活性有机碳组分. 但是,植被稀疏的荒滩由于地上部分归还率较低,同时缺乏植被保护,土壤平均温度也会明显上升,从而导致微生物对有机碳分解作用加强,分解后形成的活性有机碳组分也会迅速再次分解成CO2和水[35],从而导致其土壤中总有机碳和活性有机碳组分皆很低. DOC/TOC是衡量土壤中有机碳稳定性重要指标[36]. 目前的研究表明,受人类活动干扰程度越高,湖滨带土壤中的DOC/TOC值也越高,特别是位于芦苇湿地破坏后的荒滩S5采样点,DOC/TOC值最高,这也进一步验证了巢湖湖滨带植被破坏后会明显降低土壤有机碳库的稳定性,并造成活性有机碳分解加速和土壤碳库的亏损[37-38].
3.3 湖滨带土壤酶活性及其与土壤有机碳组分相互作用机制湿地土壤酶活性是评价湿地生态功能的一项重要指标[39]. 研究表明,湿地土壤中酶的活性对土地利用和覆盖变化的响应也非常敏感[40-41]. 本研究结果也表明,巢湖湖滨带不同土地利用与覆盖方式下土壤几种关键酶活性差异非常显著. 除多酚氧化酶外,原生芦苇湿地和次生水柳林及其混交区域土壤酶活性普遍较高,而荒滩及受人为活动干扰的城市绿地及人工草地土壤酶活性均出现不同程度的下降. 原生芦苇湿地被破坏后通过水柳种植与生态恢复可以显著提高土壤中酶的活性,从而可以提升土壤生态功能. 受人类活动干扰较小的原生芦苇湿地和次生水柳林及其混交区域植物生长较好,根系分泌物较多,土壤碳源,特别是易被微生物利用活性碳源较为丰富,微生物数量及活性也较高,因此酶活性普遍较高. 而荒滩及受人为活动干扰的城市绿地及人工草地植被覆盖度较差,凋落物归还率较低,土壤碳源数量及质量较差,微生物数量及代谢活性也较低. 土壤中酶主要来自微生物代谢分泌作用,其活性也必将会受到土壤有机碳数量及质量的影响[39-40]. 而活性有机碳,特别是DOC是微生物代谢的主要碳源,其含量大小必将影响土壤酶的活性. 目前的研究表明,巢湖湖滨带土壤中几种酶的活性与土壤有机碳,特别是活性有机碳组分相关性显著. 同时,土壤中有机碳转化和分解过程也受到相关功能性酶活性的影响. 过氧化氢酶活性的上升会导致土壤微生物细胞膜的破坏程度下降,对于有机物料的利用效率就能维持在较高水平,这样就增强了土壤的碳汇能力,从而使TOC、DOC、EOC的含量都保持在较高水平. 有研究认为,多酚化合物会在多酚氧化酶的活性受抑制时进行累积,而酚类物质可以抑制多种水解酶的作用,如β-葡萄糖苷酶、磷酸酶和硫酸酯酶等,多酚氧化酶通过将土壤中的芳香族化合物氧化成醌,进而由醌与土壤中的蛋白质、氨基酸、糖类等进行反应[42],消耗土壤中的有机质,使得其含量降低. 多酚氧化酶的活性提高会造成土壤有机质,特别是活性有机碳组分急剧氧化分解,降低了土壤碳储存能力,也会削弱湖滨带的生态缓冲能力.
蔗糖酶对于蔗糖分解的催化作用具有专一性[43]. 蔗糖分解后形成的果糖和葡萄糖是土壤植物与微生物的重要营养物质. 因此,蔗糖在土壤总有机碳含量之中占据重要地位,可以通过蔗糖酶活性来表征土壤有机碳组分的变化. 目前的研究也表明,巢湖湖滨带不同采样点土壤蔗糖酶活性与EOC和DOC两种活性有机碳组分含量的相关性达到极显著水平. 巢湖湖滨带不同采样点蔗糖酶活性变化规律与植被覆盖度吻合程度也较好,特别是与人为活动干扰强度关系较为紧密,可作为今后表征湖滨带受土地利用与覆被变化影响下土壤有机碳动态变化和生态退化程度较为敏感的指标.
4 结论1) 巢湖湖滨带不同土地利用和覆被下土壤有机碳组分差异显著,其中以原生芦苇湿地TOC含量最高. 湖滨带10~20年种植历史的次生水柳林湿地土壤DOC和EOC含量为最高,其次为原生芦苇湿地;植被破坏严重的湖滨带荒滩土壤TOC和活性有机碳(DOC和EOC)含量均为最低. 原生芦苇湿地变为人工植被后,土壤中有机碳的稳定性降低,土壤固碳能力被削弱.
2) 巢湖湖滨带不同采样点土壤中4种关键性酶活性在存在显著差异,过氧化氢酶、脲酶和蔗糖酶均以受人类活动干扰较小的原生芦苇湿地和次生水柳林及其混交区域土壤酶活性普遍较高,而以植被退化严重的荒滩土壤酶活性为最低. 几种酶活性与土壤活性有机碳组分之间呈现显著的相关性,特别是蔗糖酶活性与DOC和EOC含量的相关性均达到极显著水平.
3) 湖滨带原生芦苇被破坏后通过适当的植被恢复,可以显著增加土壤活性有机碳库,并增强湖滨带生化代谢过程和生态缓冲功能. 土壤DOC和蔗糖酶2个指标对植被类型、覆盖度以及人类活动响应较为敏感,可以作为表征湖滨带湿地土地利用与覆被改变所带来的土壤微观变化和生态功能退化的敏感性指标.
| [1] |
Yu JB, Dong HF, Li YZ et al. Spatiotemporal distribution characteristics of soil organic carbon in newborn coastal wetlands of the Yellow River Delta estuary. CLEAN-Soil, Air, Water, 2014, 42(3): 311-318. DOI:10.1002/clen.201100511 |
| [2] |
Xiong X, Grunwald S, Myers DB et al. Interaction effects of climate and land use/land cover change on soil organic carbon sequestration. Science of the Total Environment, 2014, 493: 974-982. DOI:10.1016/j.scitotenv.2014.06.088 |
| [3] |
Mao DH, Wang ZM, Li L et al. Soil organic carbon in the Sanjiang Plain of China: Storage, distribution and controlling factors. Biogeosciences, 2015, 12(6): 1635-1645. DOI:10.5194/bg-12-1635-2015 |
| [4] |
Morrissey EM, Berrier DJ, Neubauer SC et al. Using microbial communities and extracellular enzymes to link soil organic matter characteristics to greenhouse gas production in a tidal freshwater wetland. Biogeochemistry, 2014, 117(2/3): 473-490. DOI:10.1007/s10533-013-9894-5 |
| [5] |
Ausseil AGE, Jamali H, Clarkson BR et al. Soil carbon stocks in wetlands of New Zealand and impact of land conversion since European settlement. Wetlands Ecology and Management, 2015, 23(5): 947-961. DOI:10.1007/s11273-015-9432-4 |
| [6] |
Kim H. A review of factors that regulate extracellular enzyme activity in wetland soils. The Korean Journal of Microbiology, 2015, 51(2): 97-107. DOI:10.7845/kjm.2015.4087 |
| [7] |
Alster CJ, German DP, Lu Y et al. Microbial enzymatic responses to drought and to nitrogen addition in a southern California grassland. Soil Biology and Biochemistry, 2013, 64: 68-79. DOI:10.1016/j.soilbio.2013.03.034 |
| [8] |
Du YH, Guo P, Liu JQ et al. Different types of nitrogen deposition show variable effects on the soil carbon cycle process of temperate forests. Global Change Biology, 2014, 20(10): 3222-3228. DOI:10.1111/gcb.12555 |
| [9] |
Yang CM, Yang LZ, Ouyang Z. Organic carbon and its fractions in paddy soil as affected by different nutrient and water regimes. Geoderma, 2005, 124(1/2): 133-142. DOI:10.1016/j.geoderma.2004.04.008 |
| [10] |
Zhang SJ, Xiang WH, Sun WJ et al. Effects of land use on soil readily oxidized carbon and carbon management index in hilly region of central Hunan Province. Ecology and Environmental Sciences, 2016, 25(6): 911-919. [张仕吉, 项文化, 孙伟军等. 中亚热带土地利用方式对土壤易氧化有机碳及碳库管理指数的影响. 生态环境学报, 2016, 25(6): 911-919.] |
| [11] |
Haghverdi K, Kooch Y. Soil carbon and nitrogen fractions in response to land use/cover changes. Acta Oecologica, 2020, 109: 103659. DOI:10.1016/j.actao.2020.103659 |
| [12] |
Ren CJ, Wang T, Xu YD et al. Differential soil microbial community responses to the linkage of soil organic carbon fractions with respiration across land-use changes. Forest Ecology and Management, 2018, 409: 170-178. DOI:10.1016/j.foreco.2017.11.011 |
| [13] |
Ye C, Li CH, Wu L et al. Ecological degradation of lake littoral zone and interaction effects with human activities. Research of Environmental Sciences, 2015, 28(3): 401-407. [叶春, 李春华, 吴蕾等. 湖滨带生态退化及其与人类活动的相互作用. 环境科学研究, 2015, 28(3): 401-407.] |
| [14] |
Hu XZ, Xu QJ, Jiang LJ et al. A preliminary study on demarcation limits of lake buffer zones: A case study of Lake Taihu. J Lake Sci, 2011, 23(5): 719-724. [胡小贞, 许秋瑾, 蒋丽佳等. 湖泊缓冲带范围划定的初步研究——以太湖为例. 湖泊科学, 2011, 23(5): 719-724. DOI:10.18307/2011.0508] |
| [15] |
Fergus CE, Lapierre JF, Oliver SK et al. The freshwater landscape: Lake, wetland, and stream abundance and connectivity at macroscales. Ecosphere, 2017, 8(8): e01911. DOI:10.1002/ecs2.1911 |
| [16] |
Kuang W, Rui M, Zhang YH et al. Effect of nitrogen and phosphorus on rainstorm runoff reduction cut from ecological restoration engineering of Chaohu lakeside zone. Resources and Environment in the Yangtze Basin, 2015, 24(11): 1906-1912. [匡武, 芮明, 张彦辉等. 巢湖湖滨带生态恢复工程对暴雨径流氮磷削减效果研究. 长江流域资源与环境, 2015, 24(11): 1906-1912. DOI:10.11870/cjlyzyyhj201511014] |
| [17] |
Lu RK. Analytical methods of soil agrochemistry. Beijing: China Agricultural Science and Technology Press, 1999. [鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 1999.]
|
| [18] |
Huo LL, Zou YC, Guojia W et al. Effect of reclamation on the vertical distribution of SOC and retention of DOC. Environmental Science, 2013, 34(1): 283-287. [霍莉莉, 邹元春, 郭佳伟等. 垦殖对湿地土壤有机碳垂直分布及可溶性有机碳截留的影响. 环境科学, 2013, 34(1): 283-287. DOI:10.13227/j.hjkx.2013.01.015] |
| [19] |
Blair GJ, Lefory RD. Soil C fractions based on their degree of oxidation and the development of a C management index for agricultural system. Australian Journal of Agricultural Research, 1995, 46: 1459-1466. DOI:10.1071/AR9951459 |
| [20] |
Guan SY. Soil enzyme and its research methods. Beijing: Agricultural Press, 1986: 108-111. [关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986: 108-111.]
|
| [21] |
Hao JC, Wu YY, Lian B et al. Properties of polyphenol oxidase in soil and its significance. Chinese Journal of Soil Science, 2006, 37(3): 470-474. [郝建朝, 吴沿友, 连宾等. 土壤多酚氧化酶性质研究及意义. 土壤通报, 2006, 37(3): 470-474. DOI:10.3321/j.issn:0564-3945.2006.03.013] |
| [22] |
Yang LF, Zeng Q, Li HB et al. Measurement of catalase activity in soil by ultraviolet spectrophotometry. Chinese Journal of Soil Science, 2011, 42(1): 207-210. [杨兰芳, 曾巧, 李海波等. 紫外分光光度法测定土壤过氧化氢酶活性. 土壤通报, 2011, 42(1): 207-210.] |
| [23] |
Sanders LM, Taffs K, Stokes D et al. Historic carbon burial spike in an Amazon floodplain lake linked to riparian deforestation near Santarém, Brazil. Biogeosciences, 2018, 15(2): 447-455. DOI:10.5194/bg-15-447-2018 |
| [24] |
Xia PH, Yu LF, Kou YZ et al. Distribution characteristics of soil organic carbon and its relationship with enzyme activity in the Caohai wetland of the Guizhou Plateau. Acta Scientiae Circumstantiae, 2017, 37(4): 1479-1485. [夏品华, 喻理飞, 寇永珍等. 贵州高原草海湿地土壤有机碳分布特征及其与酶活性的关系. 环境科学学报, 2017, 37(4): 1479-1485. DOI:10.13671/j.hjkxxb.2016.0129] |
| [25] |
Wu QB, Wang XK, Guo R. Soil organic carbon stability and influencing factors. Chinese Journal of Soil Science, 2005, 36(5): 743-747. [吴庆标, 王效科, 郭然. 土壤有机碳稳定性及其影响因素. 土壤通报, 2005, 36(5): 743-747. DOI:10.3321/j.issn:0564-3945.2005.05.026] |
| [26] |
Waters MN, Kenney WF, Brenner M et al. Organic carbon sequestration in sediments of subtropical Florida lakes. PLoS One, 2019, 14(12): e0226273. DOI:10.1371/journal.pone.0226273 |
| [27] |
Chen FX, Lu SY, Hu XZ et al. Multi-dimensional habitat vegetation restoration mode for lake riparian zone, Taihu, China. Ecological Engineering, 2019, 134: 56-64. DOI:10.1016/j.ecoleng.2019.05.002 |
| [28] |
Xu QY, Wang P, Wang T et al. Investigation of the impacts of land use structure and landscape pattern on water quality in the Ganjiang River, Lake Poyang Basin. J Lake Sci, 2020, 32(4): 1008-1019. [徐启渝, 王鹏, 王涛等. 土地利用结构与景观格局对鄱阳湖流域赣江水质的影响. 湖泊科学, 2020, 32(4): 1008-1019. DOI:10.18307/2020.0410] |
| [29] |
Xiong C, Hoyer MV. Influence of land use and rainfall variability on nutrient concentrations in Florida Lakes. Lake and Reservoir Management, 2019, 35(1): 25-37. DOI:10.1080/10402381.2018.1511659 |
| [30] |
Wu JQ, Huang SF, Wu J et al. Pollutant removal efficiency of sward buffers to runoff and the correlation with biomass. J Lake Sci, 2008, 20(6): 761-765. [吴建强, 黄沈发, 吴健等. 缓冲带径流污染物净化效果研究及其与草皮生物量的相关性. 湖泊科学, 2008, 20(6): 761-765. DOI:10.18307/2008.06.010] |
| [31] |
Li CH, Wang YK, Ye C et al. A proposed delineation method for lake buffer zones in watersheds dominated by non-point source pollution. Science of the Total Environment, 2019, 660: 32-39. DOI:10.1016/j.scitotenv.2018.12.468 |
| [32] |
Lin XD, Qi ZP, Tang SM et al. Oxidizable organic carbon and light fraction organic carbon of artificial plantation land and artificial grassland in Hainan Province. Chinese Journal of Tropical Crops, 2012, 33(1): 171-177. [林晓东, 漆智平, 唐树梅等. 海南人工林地、人工草地土壤易氧化有机碳和轻组碳含量初探. 热带作物学报, 2012, 33(1): 171-177.] |
| [33] |
Tirol-Padre A, Ladha JK. Assessing the reliability of permanganate-oxidizable carbon as an index of soil labile carbon. Soil Science Society of America Journal, 2004, 68(3): 969-978. DOI:10.2136/sssaj2004.9690 |
| [34] |
Wu JQ, Ma WW, Li G et al. Contents of active organic carbon in soils of different flooding areas in marshy meadow in Gahai wetlands. Wetland Science, 2017, 15(1): 137-143. [吴江琪, 马维伟, 李广等. 尕海湿地沼泽化草甸中不同积水区土壤活性有机碳含量. 湿地科学, 2017, 15(1): 137-143.] |
| [35] |
Padhy SR, Bhattacharyya P, Dash PK et al. Seasonal fluctuation in three mode of greenhouse gases emission in relation to soil labile carbon pools in degraded mangrove, Sundarban, India. Science of the Total Environment, 2020, 705: 135909. DOI:10.1016/j.scitotenv.2019.135909 |
| [36] |
Hu YF, Peng JJ, Jiang SL et al. Study on soil active organic carbonin different land use patterns ofthe Middle Sichuan Region. Journal of Soil and Water Conservation, 2014, 28(2): 221-225, 231. [胡玉福, 彭佳佳, 蒋双龙等. 川中丘陵区不同土地利用方式土壤活性有机碳含量特征研究. 水土保持学报, 2014, 28(2): 221-225, 231.] |
| [37] |
Yang YG, Yang Y, Geng YQ et al. Effects of different land types on soil enzyme activity in the Qinghai lake region. Wetlands, 2018, 38(4): 711-721. DOI:10.1007/s13157-018-1014-9 |
| [38] |
Qian HY, Zhou HX, Luo YJ et al. Responses of soil labile organic carbon and carbon pool management index to alpine wetland degradation. Chinese Journal of Ecology, 2020, 39(7): 2273-2282. [钱虹宇, 周宏鑫, 罗原骏等. 土壤活性有机碳及碳库管理指数对高寒湿地退化的响应. 生态学杂志, 2020, 39(7): 2273-2282. DOI:10.13292/j.1000-4890.202007.018] |
| [39] |
Huang LL, Hu WJ, Tao J et al. Soil bacterial community structure and extracellular enzyme activities under different land use types in a long-term reclaimed wetland. Journal of Soils and Sediments, 2019, 19(5): 2543-2557. DOI:10.1007/s11368-019-02262-1 |
| [40] |
Xiao Y, Huang ZG, Lu XG. Changes of soil labile organic carbon fractions and their relation to soil microbial characteristics in four typical wetlands of Sanjiang Plain, Northeast China. Ecological Engineering, 2015, 82: 381-389. DOI:10.1016/j.ecoleng.2015.05.015 |
| [41] |
Shao XX, Yang WY, Wu M. Seasonal dynamics of soil labile organic carbon and enzyme activities in relation to vegetation types in Hangzhou bay tidal flat wetland. PLoS One, 2015, 10(11): e0142677. DOI:10.1371/journal.pone.0142677 |
| [42] |
Veres Z, Kotroczó Z, Fekete I et al. Soil extracellular enzyme activities are sensitive indicators of detrital inputs and carbon availability. Applied Soil Ecology, 2015, 92: 18-23. DOI:10.1016/j.apsoil.2015.03.006 |
| [43] |
Qi RM, Li J, Lin ZA et al. Temperature effects on soil organic carbon, soil labile organic carbon fractions, and soil enzyme activities under long-term fertilization regimes. Applied Soil Ecology, 2016, 102: 36-45. DOI:10.1016/j.apsoil.2016.02.004 |
 2021, Vol. 33
2021, Vol. 33 

