(2: 中南民族大学生命科学学院, 武汉 430074)
(2: College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, P. R. China)
物种多样性是生态系统生产力、稳定性、可入侵性和养分动态变化的主要决定因子[1]. 传统的物种多样性测定一般以物种数目和丰度为基础(如物种丰富度、Shannon-Wiener指数),近20年来以功能性状和系统发育为特征的多样性分析逐渐成为生态学研究中的常用手段. 功能多样性(functional diversity)是对一个群落中物种功能性状变化范围和分布的度量. 在此概念出现之前,群落生态学研究者通常忽略不同物种在生理、生态和形态特征等方面存在的极大差异,用物种丰富度代表生物多样性,这在生物多样性与生态系统功能关系的研究中尤为常见. 近年来的许多研究发现,生态系统功能不仅依赖于物种数目,而且依赖物种所具有的功能性状,功能多样性才是与生态过程密切相关的生物多样性因素[2-3],在预测生态系统功能时甚至能超越物种丰富度[4-5].
功能性状是物种对外界环境长期响应与适应后所呈现出来的特征,不同的功能性状体现了物种不同的生态适应性. 经过多年发展,不同生物类群的功能性状被广泛应用于各种研究. 最常见的植物功能性状包括叶片形态特征(如叶片厚度、比叶面积、叶片C/N、气孔密度、光合速率等)、根属性(根大小、根长度、比根长等)及种子大小和质量[6-7];鱼类功能性状有头长、眼睛大小、上/下颌长度、鳃耙数目和长度等[8]. 相对于上述生物所具有的可量化指标,小型生物所报道的定量指标偏少,如藻类常用的功能性状中,体积大小、最大长度为分类变量,吞噬性、运动性和对硅的需求为名义变量[9];浮游甲壳动物常用的功能性状仅体长为定量指标,其余(如摄食类型、栖息生境、食性)均为分类指标[10]. 现代分子生物学证实了物种的功能性状具有相当的进化保守性,亲缘关系越近的物种,其功能性状也越相似[11-12].
与物种多样性指数类似,功能多样性也可以从不同的方面来描述,常见的有功能丰富度(functional richness, FRic)、功能均匀度(functional evenness, FEve)、功能离散度(functional divergence, FDiv)和功能分散度(functional dispersion, FDis)等. FRic表示群落中物种占据的功能空间的大小,FEve表示功能性状在功能空间分布的均匀程度,FDiv表示群落丰度在功能空间的分布对功能性状离散程度的影响[13];FDis表示功能空间中的各个物种到质心(centroid)的加权平均距离[14]. 这些指数被广泛运用于各种生态学问题的研究,如群落构建机制、生物多样性与生态系统功能关系、环境因子对生物群落结构的影响等. 基于生态位理论的群落构建学说认为,环境滤过(environmental filtering)将导致群落中物种的功能性状趋同(clustering),亦即功能多样性降低. 例如,湖泊中浮游甲壳动物的功能丰富度和底栖动物的功能分散度均随水体营养水平的上升而下降[15-16]. 在干旱地区,土壤水分和含盐量促进了植被叶片面积和氮含量的趋同, 群落功能离散度与水分呈显著负相关[17]. Bassler等[18]研究发现,苔藓群落的功能分散度随海拔的升高而降低.
目前有关功能多样性在生态学中的应用习见于陆地生态系统. 浮游动物作为水生态系统中重要的初级消费者,其功能多样性受学者关注的程度要远低于鱼类、底栖动物和藻类,直到2007年才有第一篇关于浮游甲壳动物功能性状的系统描述[19],这可能一方面与其个体小、功能性状难以定量量化,另一方面与其物种数目少,存在明显的季节变化和空间分布特征(如沿岸带和敞水区)有关. 虽然国际上的相关研究陆续在发表,但国内对其的研究仅限于少量的几篇文献[11, 20]. 本文通过对14个水体浮游甲壳动物群落结构的研究,分析了环境因子对其功能多样性指数(包括FRic、FEve、FDiv和FDis)和功能群分布的影响,目的在于抛砖引玉,让更多的研究者运用功能性状来探讨浮游动物群落多样性的维持、变化机制.
1 研究方法 1.1 研究地点本研究选取湖北省范围内14个水体进行样品采集,其中湖泊4个,水库10个. 野外采样分别在2014年和2015年的4月20日—5月9日进行. 具体的环境因子采样和分析过程已在王松波等研究中[21]进行了详细的描述,本文对其进行了归纳总结并不再赘述(表 1).
| 表 1 采样水体的环境因子* Tab. 1 Environmental factors in the sampled water bodies |
浮游甲壳动物样品通过64 μm浮游生物网的垂直拖曳来采集,上提速度约为0.5 m/s,采样深度为沉积物界面之上0.5 m至水面. 采集的样品用甲醛保存,最终浓度为5 %. 物种组成和密度通过显微镜进行鉴定和计数,并记录每一物种的最大体长. 枝角类和桡足类的鉴定参考工具书[22-23]. 每个水体采集3个样品,取其密度平均值用于分析.
1.3 浮游甲壳动物的功能性状浮游甲壳动物的功能性状反映了其在水环境中的生态适应性. 参考Vogt等[10]的研究,本文选取5个功能性状用于分析,包括:体长(body length)、摄食类型(feeding type)、捕食者防御(predator defense)、栖息地(habitat type)和食性(trophic group). 在这5个指标中,仅体长为连续型变量,其余4个均为分类变量. 由于浮游甲壳动物的个体较小,有关其生理、摄食率、种群增长率等的数据难于从文献中获取,而体长的大小又与这些过程直接相关,故可用体长来间接反映这些重要的生理生态过程. 摄食类型反映了物种获取食物的方式,分为6种:Bosmina型(以水平游泳和不太发达的过滤胸肢为主要特征)、Chydorus型(以刮食物体表面的藻类颗粒为主要特征)、Daphnia型(在固定的地方通过第三和第四对胸肢过滤摄食)、Sida型(与Daphnia型类似,不同的是利用前5对胸肢过滤)、捕食型(raptorial,主动捕获猎物)、悬停型(stationary suspension,在一个相对固定的地方悬停摄食). 捕食者防御反映物种面对捕食者时的行为响应,包括4种类型,无响应、快速游泳、减慢游泳、中止游泳并跳跃逃离. 栖息地反映物种生活的生境,分为2种,沿岸带型(包括底栖型)和敞水区型. 食性分为3种,植食性、杂食性和肉食性. 5个指标除了体长是直接测定的外,其余指标均通过查找工具书[22-23]获得,本研究中各物种的具体功能性状见表 2.
| 表 2 浮游甲壳动物的功能性状 Tab. 2 Functional traits of crustacean zooplankton |
功能丰富度(FRic)指数以凸包体积(convex hull volume)来衡量,表示在多维功能空间中能将所有物种囊括在内的最小多面体体积,在二维空间中则表现为多边形面积. 该凸包体的计算基于“Quickhull”算法,是一个复杂的过程,必须依赖计算机完成[24].
功能均匀度(FEve)指数[24]:
| $ F E v e=\frac{\sum\limits_{l=1}^{s-1} \min \left(P E W_{l}, \frac{1}{S-1}\right)-\frac{1}{S-1}}{1-\frac{1}{S-1}} $ | (1) |
| $ P E W_{l}=\frac{E W_{l}}{\sum\limits_{l=1}^{S-1} E W_{l}} $ | (2) |
| $ E W_{l}=\frac{\operatorname{dist}(i, j)}{w_{i}+w_{j}} $ | (3) |
式中,wi、wj表示物种i、j的相对丰度,dist(i, j)表示在最小生成树(minimum spanning tree, MST)中两相邻物种i和j之间的欧氏距离,EWl表示经相对丰度加权处理后的均匀度;l表示在MST中连接两相邻物种的树枝数量;PEWl表示局部加权均匀度;S表示物种丰富度.
功能离散度(FDiv)指数[24]:
| $ F D i v=\frac{\Delta d+\overline{d G}}{\Delta|d|+\overline{d G}} $ | (4) |
| $ \Delta|d|=\sum\limits_{i=1}^{S} w_{i}\left|d G_{i}-\overline{d G}\right| $ | (5) |
| $ \Delta d=\sum\limits_{i=1}^{S} w_{i}\left(d G_{i}-\overline{d G}\right) $ | (6) |
| $ \overline{d G}=\frac{1}{S} \sum\limits_{i=1}^{s} d G_{i} $ | (7) |
| $ d G_{i}=\sqrt{\sum\limits_{k=1}^{T}\left(x_{i k}-g_{k}\right)^{2}} $ | (8) |
| $ g_{k}=\frac{1}{V} \sum\limits_{i=1}^{V} x_{i k} $ | (9) |
功能分散度(FDis)指数[14]:
| $ F D i s=\sum\limits_{i=1}^{S} w_{i} \cdot z_{i} $ | (10) |
| $ c=\left[c_{k}\right]=\sum\limits_{i=1}^{S} w_{i} \cdot x_{i k} $ | (11) |
式中,xik表示物种i的第k个性状值;V表示形成凸包体的顶点个数;gk表示性状k的重心;T表示性状数量;S表示物种丰富度;dGi表示物种i到凸包体重心(the center of gravity)的距离;dG表示物种距离重心的平均距离;wi表示物种i的相对丰度;Δd表示经丰度加权处理后的物种i相对于平均距离的离散度;Δ|d|表示经丰度加权处理后的物种i相对于平均距离的绝对离散度;ck表示群落全部物种第k个性状值的质心;zi表示物种i到质心的距离.
1.5 统计分析物种对之间的相异矩阵采用Gower距离构建. 聚类分析采用非加权组平均法(UPGMA),通过“hclust”函数实现. 功能多样性指数通过FD软件包中的“dbFD”函数实现,上述分析均依赖R 3.6.1. 相关分析和线性回归分析通过SPSS 17.0软件完成.
2 结果与分析 2.1 浮游甲壳动物功能群基于Gower距离和非加权组平均法的聚类分析见图 1. 结果显示:亲缘关系近的物种(在分类学上相近)由于具有相似的功能性状,均很好地聚为一类,如颈沟基合溞和简弧象鼻溞,角突网纹溞和方形网纹溞. 另外,在分类学上隶属于某一科或目的物种也能很好地聚集在一起,如溞科的角突网纹溞、方形网纹溞、盔形溞、老年低额溞,哲水蚤目中的汤匙华哲水蚤、特异荡镖水蚤、右突新镖水蚤、球状许水蚤和长江新镖水蚤. 此外,生活在沿岸带,与水草关系紧密的晶莹仙达溞、钩足平直溞、尖额溞和盘肠溞聚在一起;肉食性种类,如透明薄皮溞、中剑水蚤和台湾温剑水蚤聚为一类. 为方便研究,根据优势种组成,我们将上述22个种属分为6个功能群,分别称之为Mesocyclops群组、Sinocalanus群组、Diaphanosoma群组、Chydorus群组、Bosmina群组和Daphnia群组(图 1). 在这些采样水体中,浮游甲壳动物的功能群数量变化范围为2~6,均值为4. 除火连畈水库Mesocyclops群组和Diaphanosoma群组占优势外,Daphnia群组和Sinocalanus群组在其余水体中合计占到了总密度的45 % ~96 % (图 2).
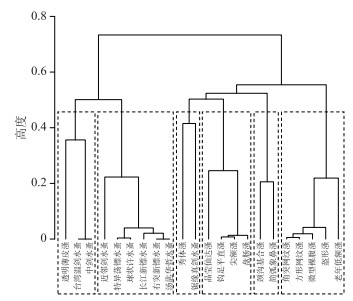
|
图 1 基于浮游甲壳动物功能性状的聚类分析 Fig.1 Cluster analysis based on functional traits of crustacean zooplankton |
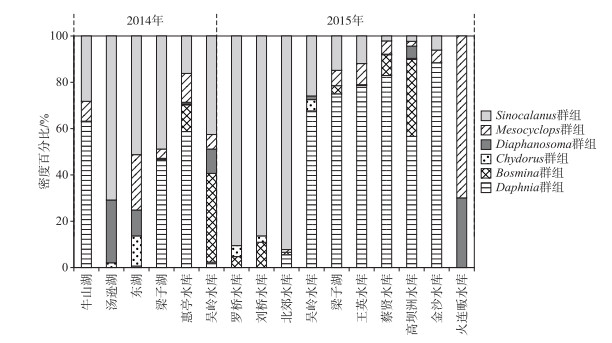
|
图 2 各采样水体功能群密度百分比组成 Fig.2 Percentage compositions of functional groups in the sampled water bodies |
在16个采样水体中,FRic变化范围为0.085~0.673,均值0.374,最大值出现在2015年的吴岭水库,最小值出现在金沙水库. FEve均值为0.489,最大值和最小值分别出现在惠亭水库(0.722)和罗桥水库(0.192). FDiv变化范围为0.670~0.982,均值0.868,最大值出现在2015年的吴岭水库,最小值出现在牛山湖. FDis均值为0.227,最大值出现在2014年的吴岭水库(0.350),最小值出现在北郊水库(0.107). 火连畈水库由于物种数小于经主坐标分析后选取的特征轴数,无法进行FRic、FEve和FDiv的计算(表 3).
| 表 3 浮游甲壳动物的功能多样性指数 Tab. 3 Functional diversity indices of crustacean zooplankton |
相关分析显示,FRic、FEve和FDiv与环境因子之间不存在显著的相关关系(P>0.05). FDis与TDN、TDP、NH3-N和C/P比均存在显著的相关关系(P < 0.05)(表 4). 线性回归分析发现,随着水体TDP浓度的增加,浮游甲壳动物的物种数表现出下降趋势(R2=0.21, P=0.073),功能群数量(R2=0.36, P=0.014)、功能群Shannon-Wiener指数(R2=0.60, P < 0.001)和FDis(R2=0.66, P < 0.001)均显著下降(图 3). 另外,FRic和FDis均随着功能群数量的增加而显著变大(P < 0.05)(图 4).
| 表 4 功能多样性指数与环境因子之间的Spearman相关分析 Tab. 4 Spearman correlation between functional diversity indices and environmental factors |
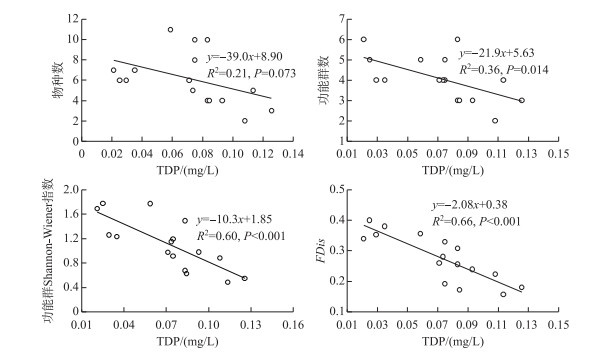
|
图 3 物种数、功能群数、功能群Shannon-Wiener指数和功能分散度(FDis)与TDP浓度之间的回归分析 Fig.3 Regression analyses of species number, number and Shannon-Wiener index of functional groups as well as FDis to TDP concentration |

|
图 4 浮游甲壳动物功能丰富度(FRic)和功能分散度(FDis)与功能群数量之间的回归分析 Fig.4 Regression analyses of FRic and FDis to the number of functional groups of crustacean zooplankton |
功能多样性指数从不同方面刻画了群落功能性状的分布模式. FRic表示一个群落中的物种所占据的功能空间的大小,该值一般随物种丰富度的增多而变大,其余3个指数与物种丰富度无关[14, 24-25]. 在本研究中,FRic与物种丰富度呈显著正相关(R=0.77, P=0.001),但随着水体TDP浓度的增大,物种丰富度呈不显著的下降趋势,FRic与TDP浓度之间也呈不显著的负相关关系(R=-0.31, P=0.259). 已有的研究发现,浮游甲壳动物的功能丰富度与TP浓度之间呈单峰分布或线性负相关的模式[15, 26]. 这种分布模式实际上与物种丰富度随水体营养状态或初级生产力的分布具有一致性,如Jeppesen等[27]发现浮游动物的物种数随水体营养水平的上升而下降;Dodson等[28]发现浮游动物的物种数与初级生产力之间的关系为单峰模型. 虽然FRic的大小受物种丰富度的直接影响,但多的物种数量并不总是代表高的FRic,因为可能有冗余物种存在. 例如Bässler等[18]研究发现随着海拔的增加,苔藓群落的功能分散度下降,但物种丰富度反而上升,主要表现为喜好高湿环境和行无性繁殖模式种类数的增加. 在一个水体中如果同时出现汤匙华哲水蚤、右突新镖水蚤和长江新镖水蚤,与只有其中的一个物种相比,FRic可能并不会受到多大影响. 在本研究中,功能群数量随着TDP浓度的增加而下降,而且FRic与功能群数量之间呈显著正相关. 在水体富营养化的过程中,浮游甲壳动物功能群数量的下降说明环境选择促进了它们功能性状的趋同,同时也表明它们对资源充分利用能力的下降,这可能也是富营养水体中浮游动植物间能量传递效率下降的原因之一.
融合物种丰富度与丰度的FEve和FDiv也不受所选环境因子的影响. 一般来说,如果优势种分布在功能空间的边缘,FDiv就大,表明生态位分化明显,物种间资源竞争较弱;反之,如果优势种靠近功能空间重心,FDiv就小,物种间资源竞争激烈[13, 24]. 在本研究中,FDiv普遍偏大,说明群落物种间的竞争较弱. 例如在最小FDiv出现的牛山湖,盔形溞和汤匙华哲水蚤分别占总密度的62.5 % 和27.9 %,两者虽然都生活在敞水区,以滤食藻类为主,但可能通过对食物颗粒大小的选择实现生态位的分化,前者以小颗粒为主,后者则以大颗粒为主[29]. FEve基本分布在0.5左右,其大小不仅受物种间距离的影响,还受物种丰度在功能空间分布的影响. 在上述FRic的讨论中,我们发现水体富营养化导致浮游甲壳动物功能群数量减少,亦即物种在功能空间聚集,物种间性状趋同,对资源的利用能力下降,理论上FDiv和FEve也会变小,但它们两者的计算还受物种丰度在功能空间分布的影响,所以本研究对其大小随营养水平的变化规律很难给出合理的解释. 考虑到这些水体中依然存在渔业养殖活动,强烈的下行效应可能导致了这些结果的产生. Li等[30]认为在长江流域受人类活动影响强烈的水体中浮游动物的群落结构主要受鱼类捕食的影响,与营养状态的关系不大. 张晓妆等[31]也认为每年春、秋季渔汛期对经济鱼种进行高强度捕捞,从而引起其生物量大幅下降,可能是造成海州湾鱼类群落优势种和功能均匀度、功能离散度变化的重要原因. 之前的研究发现[21],浮游甲壳动物密度和生物量均与Chl.a浓度不存在显著相关性,且有78 % 水体的TDP浓度高于0.07 mg/L. 在长江中下游的浅水湖泊中,当总磷浓度大于0.097 mg/L时,浮游甲壳动物生物量会因鱼类捕食而变得不确定,由于我们所选择的水库和湖泊大都存在渔业活动,鱼类捕食对其群落结构和功能多样性指数的影响不容忽视[30, 32].
FDiv在计算重心时,仅用到了构成多面体的顶点(顶点数≤物种数)对应的物种坐标,且仅在计算物种到重心的距离时用到了物种丰度权重[24]. FDis在计算质心坐标时用的是全部物种坐标,而且在计算质心坐标和物种到质心距离时均用到了物种丰度权重[14],也就是说FDis比FDiv更能反映物种在功能空间的聚集程度. 在本研究中,FDis不仅与营养盐(TDN、TDP、NH3-N)浓度呈显著负相关,而且还与功能群数量呈显著正相关,表明富营养化促进了浮游甲壳动物群落功能性状在生态位空间的聚集. Valdivia等[33]在潮间带的研究也发现,栖居于严酷环境下(高潮间带)的生物群落的FRic和FDis最低,表现为性状趋同,而在温和条件下(低潮间带)FRic和FDis最大,表现为性状发散. 随着水体营养水平的上升,大型底栖动物群落的功能性状β多样性显著下降[16]. 植物与生长和繁殖有关的功能性状的FDis随温度和降雨的增加而变大[34]. 这些结果表明,群落的FDis受群落构建过程(例如环境滤过)的直接影响,水体富营养化带来的物理、化学、生物等环境的改变最终会影响到浮游动物的群落结构. 另外,FDis与悬浮物C/P比呈显著正相关. 在我们研究的水体中,悬浮物C/P比均满足浮游甲壳动物发展对食物质量的要求[21],相反过低的悬浮物C/P比可能会对浮游甲壳动物的生长造成负面影响[35],从而对其群落组成产生选择压力,所以悬浮物C/P比的适当增大可能更有利于多样化物种的共存.
功能群是群落中具有相似功能物种的集合. 在经验性的水生动物功能群划分中,个体大小、摄食类型和食性常被用于分组,如Krztoń等[36]根据这些特征将包括纤毛虫、轮虫和浮游甲壳动物在内的浮游动物群体分为6个功能类群;Heino[37]通过摄食和行为特点的组合将底栖动物划分为24个功能群. 本文依据5个功能性状对浮游甲壳动物的聚类分析发现,在分类学上相近的物种(也可粗略地认为在系统发育上亲缘关系较近[38]),其功能性状的差异也较小,更容易形成一个类群,表明功能性状可能具有进化上的保守性[11]. 以外形特征作为主要分类依据的枝角类、哲水蚤和剑水蚤本身也隐含着功能性状的应用,如运动方式和食性. 随着水体TDP浓度的上升,浮游甲壳动物功能群的数量和Shannon-Wiener多样性指数均显著下降,表明沿着营养盐梯度群落中的物种向更适应当前环境的功能群或优势种集中. Heino[37]也发现水体中TP浓度的增加降低了底栖动物功能群的多样性和均匀性. 群落构建理论认为环境选择一般会导致群落功能性状的趋同. 在本研究中,低营养水体以2个优势功能群为主,包括Daphnia、Sinocalanus、Bosmina群组的组合,其密度能占到总密度的75 % 以上;在中、高营养水平的水体,如罗桥水库、北郊水库和王英水库,一个功能群就能占到总密度的70 % 以上,这些优势功能群基本以Daphnia或Sinocalanus群组为主[21]. 当Daphnia和Sinocalanus群组共存时,一般以Daphnia群组占优势. 前者对磷具有较高的需求,后者对氮具有较高的需求[39],表明食物质量在群落构建中可能占有重要作用.
| [1] |
Tilman D, Isbell F, Cowles JM. Biodiversity and ecosystem functioning. Annual Review of Ecology, Evolution, and Systematics, 2014, 45(1): 471-493. DOI:10.1146/annurev-ecolsys-120213-091917 |
| [2] |
Thompson PL, Davies TJ, Gonzalez A. Ecosystem functions across trophic levels are linked to functional and phylogenetic diversity. PLoS One, 2015, 10(2): e0117595. DOI:10.1371/journal.pone.0117595 |
| [3] |
Gross N, le Bagousse-Pinguet Y, Liancourt P et al. Functional trait diversity maximizes ecosystem multifunctionality. Nature Ecology & Evolution, 1(5): 1-9. DOI:10.1038/s41559-017-0132 |
| [4] |
Abonyi A, Horv áth Z, Ptacnik R. Functional richness outperforms taxonomic richness in predicting ecosystem functioning in natural phytoplankton communities. Freshwater Biology, 2018, 63(2): 178-186. DOI:10.1111/fwb.13051 |
| [5] |
Gagic V, Bartomeus I, Jonsson T et al. Functional identity and diversity of animals predict ecosystem functioning better than species-based indices. Proceedings of the Royal Society B: Biological Sciences, 2015, 282(1801): 20142620. DOI:10.1098/rspb.2014.2620 |
| [6] |
Liu XJ, Ma KP. Plant functional traits-concepts, applications and future directions. Science in China: Series C, 2015, 45(4): 325-339. [刘晓娟, 马克平. 植物功能性状研究进展. 中国科学: 生命科学, 2015, 45(4): 325-339. DOI:10.1360/N052014-00244] |
| [7] |
He NP, Liu CC, Zhang JH et al. Perspectives and challenges in plant traits: From organs to communities. Acta Ecologica Sinica, 2018, 38(19): 6787-6796. [何念鹏, 刘聪聪, 张佳慧等. 植物性状研究的机遇与挑战: 从器官到群落. 生态学报, 2018, 38(19): 6787-6796. DOI:10.5846/stxb201710241900] |
| [8] |
Ingram T, Shurin JB. Trait-based assembly and phylogenetic structure in northeast Pacific rockfish assemblages. Ecology, 2009, 90(9): 2444-2453. DOI:10.1890/08-1841.1 |
| [9] |
Weithoff G, Rocha MR, Gaedke U. Comparing seasonal dynamics of functional and taxonomic diversity reveals the driving forces underlying phytoplankton community structure. Freshwater Biology, 2015, 60(4): 758-767. DOI:10.1111/fwb.12527 |
| [10] |
Vogt RJ, Peres-Neto PR, Beisner BE. Using functional traits to investigate the determinants of crustacean zooplankton community structure. Oikos, 2013, 122(12): 1700-1709. DOI:10.1111/j.1600-0706.2013.00039.x |
| [11] |
Zhao K. Species diversity of zooplankton in Huaihe River Basin: spatial pattern and formation mechanism[Dissertation]. Shanghai: East China Normal University, 2018. [赵坤. 淮河流域浮游动物分布格局及群落形成机制[学位论文]. 上海: 华东师范大学, 2018. ]
|
| [12] |
Kraft NJB, Ackerly DD. Functional trait and phylogenetic tests of community assembly across spatial scales in an Amazonian forest. Ecological Monographs, 2010, 80(3): 401-422. DOI:10.1890/09-1672.1 |
| [13] |
Mason NWH, Mouillot D, Lee WG et al. Functional richness, functional evenness and functional divergence: The primary components of functional diversity. Oikos, 2005, 111(1): 112-118. DOI:10.1111/j.0030-1299.2005.13886.x |
| [14] |
Lalibert é E, Legendre P. A distance-based framework for measuring functional diversity from multiple traits. Ecology, 2010, 91(1): 299-305. DOI:10.1890/08-2244.1 |
| [15] |
Barnett A, Beisner BE. Zooplankton biodiversity and lake trophic state: Explanations invoking resource abundance and distribution. Ecology, 2007, 88(7): 1675-1686. DOI:10.1890/06-1056.1 |
| [16] |
Zhang Y, Cheng L, Li KY et al. Nutrient enrichment homogenizes taxonomic and functional diversity of benthic macroinvertebrate assemblages in shallow lakes. Limnology and Oceanography, 2019, 64(3): 1047-1058. DOI:10.1002/lno.11096 |
| [17] |
Gong YM, Ling HB, Lv G et al. Disentangling the influence of aridity and salinity on community functional and phylogenetic diversity in local dryland vegetation. Science of the Total Environment, 2019, 653: 409-422. DOI:10.1016/j.scitotenv.2018.10.358 |
| [18] |
B ässler C, Cadotte MW, Beudert B et al. Contrasting patterns of lichen functional diversity and species richness across an elevation gradient. Ecography, 2016, 39(7): 689-698. DOI:10.1111/ecog.01789 |
| [19] |
Barnett AJ, Finlay K, Beisner BE. Functional diversity of crustacean zooplankton communities: Towards a trait-based classification. Freshwater Biology, 2007, 52(8): 796-813. DOI:10.1111/j.1365-2427.2007.01733.x |
| [20] |
Gomes LF, Pereira HR, Gomes ACAM et al. Zooplankton functional-approach studies in continental aquatic environments: A systematic review. Aquatic Ecology, 2019, 53(2): 191-203. DOI:10.1007/s10452-019-09682-8 |
| [21] |
Wang SB, Geng H, Wu LY et al. Effects of food and physicochemical factors on crustacean zooplankton community structure. J Lake Sci, 2018, 30(3): 723-731. [王松波, 耿红, 吴来燕等. 食物和理化因子对浮游甲壳动物群落结构的影响. 湖泊科学, 2018, 30(3): 723-731. DOI:10.18307/2018.0314] |
| [22] |
Jiang XZ, Du NS. Fauna sinica, crustacea: Freshwater cladocera. Beijing: Science Press, 1979. [蒋燮治, 堵南山. 中国动物志: 淡水枝角类. 北京: 科学出版社, 1979.]
|
| [23] |
Shen JR. Fauna sinica, crustacea: Freshwater copepoda. Beijing: Science Press, 1979. [沈嘉瑞. 中国动物志: 淡水桡足类. 北京: 科学出版社, 1979.]
|
| [24] |
Vill éger S, Mason NWH, Mouillot D. New multidimensional functional diversity indices for a multifaceted framework in functional ecology. Ecology, 2008, 89(8): 2290-2301. DOI:10.1890/07-1206.1 |
| [25] |
Mouchet MA, Vill éger S, Mason NWH et al. Functional diversity measures: An overview of their redundancy and their ability to discriminate community assembly rules. Functional Ecology, 2010, 24(4): 867-876. DOI:10.1111/j.1365-2435.2010.01695.x |
| [26] |
Nevalainen L, Luoto TP. Relationship between cladoceran (Crustacea) functional diversity and lake trophic gradients. Functional Ecology, 2017, 31(2): 488-498. DOI:10.1111/1365-2435.12737 |
| [27] |
Jeppesen E, Peder JJ, S øndergaard M et al. Trophic structure, species richness and biodiversity in Danish lakes: Changes along a phosphorus gradient. Freshwater Biology, 2000, 45(2): 201-218. DOI:10.1046/j.1365-2427.2000.00675.x |
| [28] |
Dodson SI, Arnott SE, Cottingham KL. The relationship in lake communities between primary productivity and species richness. Ecology, 2000, 81(10): 2662-2679. DOI:10.1890/0012-9658(2000)081[2662:TRILCB]2.0.CO;2 |
| [29] |
Sommer U, Sommer F, Santer B et al. Complementary impact of copepods and cladocerans on phytoplankton. Ecology Letters, 2001, 4(6): 545-550. DOI:10.1046/j.1461-0248.2001.00263.x |
| [30] |
Li Y, Chen FZ. Are zooplankton useful indicators of water quality in subtropical lakes with high human impacts?. Ecological Indicators, 2020, 113: 106167. DOI:10.1016/j.ecolind.2020.106167 |
| [31] |
Zhang XZ, Wang J, Xu BD et al. Spatio-temporal variations of functional diversity of fish communities in Haizhou Bay. Chinese Journal of Applied Ecology, 2019, 30(9): 3233-3244. [张晓妆, 王晶, 徐宾铎等. 海州湾鱼类群落功能多样性的时空变化. 应用生态学报, 2019, 30(9): 3233-3244. DOI:10.13287/j.1001-9332.201909.035] |
| [32] |
Wang SB, Xie P, Wu SK et al. Crustacean zooplankton size structure in aquaculture lakes: Is larger size structure always associated with higher grazing pressure?. Hydrobiologia, 2007, 575(1): 203-209. DOI:10.1007/s10750-006-0394-7 |
| [33] |
Valdivia N, Segovia-Rivera V, Fica E et al. Context-dependent functional dispersion across similar ranges of trait space covered by intertidal rocky shore communities. Ecology and Evolution, 2017, 7(6): 1882-1891. DOI:10.1002/ece3.2762 |
| [34] |
Schellenberger CD, Gerschlauer F, Pabst H et al. Community-weighted means and functional dispersion of plant functional traits along environmental gradients on Mount Kilimanjaro. Journal of Vegetation Science, 2017, 28(4): 684-695. DOI:10.1111/jvs.12542 |
| [35] |
Elser JJ, Kyle M, Learned J et al. Life on the stoichiometric knife-edge: Effects of high and low food C: P ratio on growth, feeding, and respiration in three Daphnia species. Inland Waters, 2016, 6(2): 136-146. DOI:10.5268/IW-6.2.908 |
| [36] |
Krzto ń W, Kosiba J. Variations in zooplankton functional groups density in freshwater ecosystems exposed to cyanobacterial blooms. Science of the Total Environment, 2020, 730: 139044. DOI:10.1016/j.scitotenv.2020.139044 |
| [37] |
Heino J. Patterns of functional biodiversity and function-environment relationships in lake littoral macroinvertebrates. Limnology and Oceanography, 2008, 53(4): 1446-1455. DOI:10.4319/lo.2008.53.4.1446 |
| [38] |
Heino J, Tolonen KT. Untangling the assembly of littoral macroinvertebrate communities through measures of functional and phylogenetic alpha diversity. Freshwater Biology, 2017, 62(7): 1168-1179. DOI:10.1111/fwb.12934 |
| [39] |
Moody EK, Wilkinson GM. Functional shifts in lake zooplankton communities with hyper eutrophication. Freshwater Biology, 2019, 64(3): 608-616. DOI:10.1111/fwb.13246 |
 2021, Vol. 33
2021, Vol. 33 

