(2: 中国科学院大学, 北京 100049)
(3: 淮阴师范学院, 江苏区域现代农业与环境保护协同创新中心, 淮安 223300)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Jiangsu Collaborative Innovation Center of Regional Modern Agriculture&Environmental Protection, Huaiyin Normal University, Huai'an 223300, P. R. China)
我国五大淡水湖中太湖、巢湖、洪泽湖和滇池均处于轻度乃至中度富营养化状态[1].蓝藻通常为富营养化水体的优势藻种[2-3].蓝藻的大量繁殖使水体呈现绿色或蓝色,这是湖泊水体富营养化的重要特征,水体蓝藻暴发不仅会造成鱼虾死亡,导致水体污染,还会直接威胁到当地经济发展,我国已经成为世界上蓝藻水华暴发最严重、分布最广的国家之一[4].我国富营养化湖泊中,形成水华的蓝藻主要包括微囊藻(Microcystis)、鱼腥藻(Dolichospermum)、束丝藻(Aphanizomenon)和颤藻(Oscillatoria)等,其中以铜绿微囊藻(M. aeruginosa)在数量和发生频率上占绝对优势[5].根据文献显示,就年平均水平的群落组成和空间分布而言,蓝藻占巢湖藻种的绝对主导地位(超过总数的99.4 %)[6],且巢湖的蓝藻以微囊藻和鱼腥藻为主,部分区域以束丝藻为主[7].不同蓝藻类群的危害、环境适应性、时空分布特征以及应急治理方法不同,因此在实施富营养化湖泊生态环境治理与恢复、蓝藻生态灾害预测预警的过程中,掌握不同蓝藻的时空分布特征就显得尤为重要.
藻类种群识别涉及生物学、光谱分析等多个学科领域,主要分为传统识别方法和遥感识别方法.传统藻类识别方法大都是利用藻类的细胞形态特征[8-9]、藻种DNA[10]、色素特征光谱(高效液相色谱法[11-12])、荧光光谱特征[13-14]和吸收光谱特征[15]进行区分[16].
而藻类的遥感识别方法主要依据固有光学特性或者表观光学特性.藻类的吸收特性和散射特性是目前基于固有光学特性开展藻类遥感监测的基础. Mahoney[17]在固有光学特性的基础上建立了腰鞭毛藻的生物光学定量反演模型;Martinez-Guijarro等[18]根据浮游藻类吸收系数光谱曲线识别浮游藻类组成成分;黄昌春等[19]利用四阶微分、标准化系数等方法对太湖水体藻类组成进行计算分析. Boddy等[20]利用浮游藻类的荧光特性和散射特性的差异识别藻类;马万泉[21]、戴红亮[22]、吕恒等[23-24]和王瑜[25]基于室内控制试验及模拟试验,及色素吸收特征、藻细胞特征和反射光谱特征等探索性地建立了藻种门类间比例遥感估算方法.国内外亦有基于藻类反射光谱特征开展藻类遥感识别的相关研究.崔延伟等[26]利用687~728 nm波段的特征反射峰、Lee等[27]利用活体藻类的荧光特性、Hunter等[28]利用不同藻种的反射率光谱,先后对藻类进行了识别.
由此可见,目前研究主要集中在海洋中不同藻种的遥感反演,尽管内陆湖泊亦有少量针对不同门类间藻类遥感反演的研究报道,但是针对主要水华蓝藻类群(微囊藻、鱼腥藻、束丝藻)的遥感反演基础理论方面的研究尚未见到公开发表文献.张壹萱等[29]基于室内控制实验,对微囊藻、鱼腥藻、束丝藻3种典型水华蓝藻的固有光学特性和影响因子进行研究,结果表明,3种主要水华蓝藻吸收系数的波谱特征趋势相近,440、620和675 nm波长附近有明显的吸收峰.鱼腥藻在440 nm处有较高的吸收能力,微囊藻在620和675 nm波长处有较高的吸收能力.微囊藻与束丝藻散射光谱曲线均呈现随波长增加而下降的趋势,鱼腥藻的散射波谱相对缓和且平滑,3种水华蓝藻均在440和675 nm处有微弱的散射谷.这3种蓝藻的吸收系数和散射系数都随着色素浓度(叶绿素a(Chl.a)或藻蓝素)增加而增大.
本研究在该研究结果[29]的基础上,通过甄别不同水华蓝藻的吸收和散射的特征波段,构建微囊藻、鱼腥藻和束丝藻3种水华蓝藻类群的定量识别模型,并以巢湖为应用区域,实现主要水华蓝藻类群的定量监测,为我国富营养化湖泊蓝藻水华的预测、预警提供重要的技术支撑.
1 实验部分 1.1 实验参数测量 1.1.1 室内实验本研究在光照培养箱中对铜绿微囊藻、水华鱼腥藻和水华束丝藻3种蓝藻进行纯藻种和混合藻种培养,培养基均为BG-11.经过无菌实验室内的保种,将纯藻接种至50 mL的三角锥形瓶中,生长7~10 d后进行逐级扩大培养.培养环境为温度25℃,光照强度2000 lx,光周期为12 h光照/12 h黑暗,主要流程为:将50 mL的三角锥形瓶和配置的营养液进行高温高压灭菌后,在无菌室进行接种和保种,每日摇晃3~4次,生长7~10 d后,重复上述操作扩大培养至100 mL,直至总藻量达到5 L,在藻类生长的稳定期时获取数据.
单藻的室内光学控制实验过程如下:向有机玻璃桶中加入150 L纯水和2 L纯藻液,后以500 mL为梯度分5次加入藻的母液,最终使桶内有4.5 L藻的母液.由于束丝藻生长缓慢,束丝藻实验中以500 mL为梯度分3次加入藻的母液.本研究的实验是连续性实验,所以单藻混合实验的具体过程请参见第一阶段论文[29].
双藻混合实验过程如图 1 a所示,向桶中加入150 L纯水和2 L纯藻液i,后以500 mL为梯度加入纯藻液j,测量各参数,重复操作4次,使j藻量最终达到2 L(i和j分别为微囊藻、鱼腥藻、束丝藻中任意两种),一共构建12组混合实验.三藻混合实验与单藻和双藻实验类似,加入150 L纯水后,以500 mL为梯度依次加入束丝藻、微囊藻、鱼腥藻500 mL,一共构建10组混合藻比例(图 1b).

|
图 1 藻类混合实验流程图:(a)双藻;(b)三藻 Fig.1 Experimental flow chart: (a) two cyanobacteria groups; (b) three cyanobacteria groups |
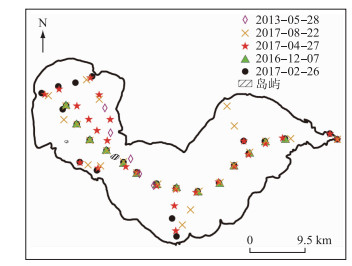
巢湖是中国第5大淡水湖,是位于安徽省中部的富营养化浅水湖泊,面积770 km2(31°25′~31°43′N,117°17′~117°51′E,图 2),平均水深3.0 m[30].巢湖富营养化程度严重,近几十年来,蓝藻水华一直是巢湖最严重的环境污染问题之一,不仅会引起水质恶化,破坏生态系统结构,还会引起水体生态系统功能改退化,造成生态环境风险或直接的环境污染.因此,开展巢湖蓝藻类群的识别研究对于评价蓝藻生态环境风险、有针对性地采取措施控制巢湖水华蓝藻以及建立水质的预警系统尤为重要.
|
图 2 巢湖野外采样点位分布 Fig.2 Distribution of sampling sites in Lake Chaohu |
2013年5月进行1次巢湖野外垂向采样,2016年12月-2017年8月对巢湖进行了4次表层巡测采样(图 2).垂向采样每个点位采集9层水样,包括表层、深度0.1、0.2、0.4、0.7、1.0、1.5、2.0和3.0 m.垂向分层水样采集使用自制的垂向水样采集器,主要由直径10 cm的抽水泵、连接管、标尺,进水口的位置和深度参考标尺组成.表层水样直接用采水瓶采集.现场采集的水样放在冷藏保温箱里遮光保存,当天进行过滤处理,实验室内实测数据包括Chl.a浓度及其对应组分的吸收系数.
1.1.3 参数测量颗粒物吸收系数采用定量滤膜技术测定.用分光光度计(UV-2600)测量过滤水样后直径为47 mm的GF/F膜得到总颗粒物吸收系数(ap);再用NaClO3对滤膜上的总悬浮颗粒物进行漂白,从而测得非色素颗粒物吸收系数(ad);浮游植物色素吸收系数(aph)为ap与ad的差值[31].
Chl.a浓度采用丙酮萃取法及分光光度计法测定.用1.2 μm的GF/C滤膜过滤水样,使用液氮反复冻融3次破碎藻细胞,加入90 %丙酮溶液后经过离心机(TG16-WS)离心提取Chl.a,而后用分光光度计分别在750、663、645和630 nm波长处测定叶绿素吸光度值,从而获得Chl.a的浓度[32-34].
吸收和衰减系数测量:光学控制实验中使用的仪器为Wetlabs公司的高光谱吸收/衰减仪(AC-S).该仪器在400~730 nm光谱范围内有80个波段输出,光谱分辨率为4 nm,测量精准度为±0.01 m-1.该仪器可以同步测量吸收和衰减系数,能够通过保证同步性来控制实验误差.
1.2 水华蓝藻类群定量识别模型构建浮游藻类的吸收、散射以及后向散射特性均属于固有光学特性,具有严格的累加性[35],因此,混合蓝藻的固有光学特性是每个组成蓝藻固有光学特性的线性叠加,因此,本研究中3种水华蓝藻的总吸收系数和总散射系数可以转化为每种蓝藻的吸收系数和散射系数的多元线性回归.由于本研究中水华蓝藻主要为3种,每种蓝藻的Chl.a浓度为未知变量C微囊藻、C鱼腥藻和C束丝藻,在已知蓝藻的总Chl.a浓度(Ct)、总吸收系数(at)和总散射系数(bt)的情况下,通过确定2个特征波段即可构建三元一次方程组从而求解出C微囊藻、C鱼腥藻和C束丝藻.
基于固有光学特性分析[29],可用于定量识别3种水华蓝藻固有光学特性的特征波段汇总如表 1所示.本研究依据这些特征波段,分别构建基于吸收特征波段、散射特征波段以及吸收散射特征波段的定量识别模型.
| 表 1 主要水华蓝藻固有光学特性的特征波段 Tab. 1 Feature bands of inherent optical properties of main bloom-forming cyanobacterial groups |
受藻密度和包裹效应的影响,单位Chl.a浓度藻类的吸收、散射系数并不固定,因此需要通过实验与公式拟合来建立与Chl.a浓度的关系,从而去除包裹效应的影响.室内光学实验的结果显示:单位Chl.a浓度藻类的吸收以及散射光谱与相关研究具有较好的一致性[29],在此基础上本研究分别拟合了3种水华蓝藻在特征波段上的吸收、散射系数随Chl.a浓度变化的曲线,即:
| $ a_{i, {\lambda _{\rm{a}}}}^* = {f_{{\rm{a}}, i}}\left( {{C_i}} \right) $ | (1) |
| $ b_{i, {\lambda _{\rm{b}}}}^* = {f_{{\rm{b}}, i}}\left( {{C_i}} \right) $ | (2) |
式中,a*、b*分别为单位Chl.a浓度藻类的吸收、散射系数,m2/mg;fa、fb分别为拟合函数;C为Chl.a浓度,mg/m3;i为微囊藻、鱼腥藻或束丝藻;λa、λb分别为吸收、散射的特征波段,nm. 3种蓝藻在特征波段上,单位Chl.a浓度固有光学特性拟合曲线详见表 2.
| 表 2 单位叶绿素a浓度的固有光学特性与叶绿素a浓度间的拟合曲线汇总 Tab. 2 Fitting curves of specific inherent optical properties and chlorophyll-a concentrations |
每种蓝藻的吸收、散射将通过该浓度对应的单位吸收、散射系数进行计算,即:
| $ {{a_{i, {\lambda _{\rm{a}}}}} = {C_i} \cdot a_{i, {\lambda _{\rm{a}}}}^*} $ | (3) |
| $ {{b_{i, {\lambda _{\rm{b}}}}} = {C_i} \cdot b_{i, {\lambda _{\rm{b}}}}^*} $ | (4) |
式中,a、b分别为吸收、散射系数,m-1.
1.2.2 基于固有光学特性的水华蓝藻类群定量识别模型1) 模型构建:固有光学特性和Chl.a浓度均具有加和性,因此,本研究中蓝藻的at即为am、ad和aa吸收系数之和,Ct亦为3种蓝藻的浓度(Cm、Cd、Ca)之和,即:
| $ \begin{aligned} a_{\mathrm{t}}(\lambda)= a_{\mathrm{m}}(\lambda)+a_{\mathrm{d}}(\lambda)+a_{\mathrm{a}}(\lambda) \\ C_{\mathrm{t}}=C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}} \\ \lambda =440, 620, 675 \mathrm{nm} \end{aligned} $ | (5) |
结合公式(1)和(3),将蓝藻在2个特征波段总吸收的加和性作为限制条件,总Chl.a浓度的加和性作为目标函数,可采用线性最优规划方法求解3种蓝藻的Chl.a浓度值.
本研究建立的基于吸收特性的水华蓝藻类群定量识别模型如下:
a-CIM440, 620:
| $ \begin{array}{c} \min Z=\left|C_{\mathrm{t}}-\left(C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}}\right)\right| \\ \text { s.t. } a_{\mathrm{t}}(440)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 440}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 440}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 440}^{*} \\ a_{\mathrm{t}}(620)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 620}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 620}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 620}^{*} \\ C_{\mathrm{m}}, C_{\mathrm{d}}, C_{\mathrm{a}} \geqslant 0 \end{array} $ | (6) |
a-CIM440, 675:
| $ \begin{array}{c} \min Z=\left|C_{\mathrm{t}}-\left(C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}}\right)\right| \\ \text { s.t. } a_{\mathrm{t}}(440)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 440}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 440}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 440}^{*} \\ a_{\mathrm{t}}(675)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 675}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 675}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 675}^{*} \\ C_{\mathrm{m}}, C_{\mathrm{d}}, C_{\mathrm{a}} \geqslant 0 \end{array} $ | (7) |
a-CIM620, 675:
| $ \begin{array}{c} \min Z=\mid C_{\mathrm{t}}-\left(C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}}\right) \\ \text { s.t. } a_{\mathrm{t}}(620)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 620}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 620}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 620}^{*} \\ a_{\mathrm{t}}(675)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 675}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 675}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 675}^{*} \\ C_{\mathrm{m}}, C_{\mathrm{d}}, C_{\mathrm{a}} \geqslant 0 \end{array} $ | (8) |
a-CIM440, 620, 675:
| $ \begin{array}{c} \min Z=\left|C_{\mathrm{t}}-\left(C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}}\right)\right| \\ \text { s.t. } a_{\mathrm{t}}(440)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 440}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 440}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 440}^{*} \\ a_{\mathrm{t}}(620)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 620}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 620}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 620}^{*} \\ a_{\mathrm{t}}(675)=C_{\mathrm{m}} \cdot a_{\mathrm{m}, 675}^{*}+C_{\mathrm{d}} \cdot a_{\mathrm{d}, 675}^{*}+C_{\mathrm{a}} \cdot a_{\mathrm{a}, 675}^{*} \\ C_{\mathrm{m}}, C_{\mathrm{d}}, C_{\mathrm{a}} \geqslant 0 \end{array} $ | (9) |
与吸收特性类似,蓝藻的bt为其所包含3种水华蓝藻散射系数(bm、bd、ba)之和,Ct亦为3种蓝藻的浓度(Cm、Cd、Ca)之和,即:
| $ \begin{aligned} b_{t}(\lambda)=b_{\mathrm{m}}(\lambda)+b_{\mathrm{d}}(\lambda)+b_{\mathrm{a}}(\lambda) \\ C_{\mathrm{t}} =C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}} \\ \lambda =440, 675 \mathrm{nm} \end{aligned} $ | (10) |
本研究中,结合公式(2)和(4),同样依据类似的方法采用线性最优规划方法求解3种蓝藻的Chl.a浓度值.
基于散射特性的水华蓝藻类群定量识别模型如下:
b-CIM440, 675:
| $ \begin{array}{c} \min Z=\left|C_{\mathrm{t}}-\left(C_{\mathrm{m}}+C_{\mathrm{d}}+C_{\mathrm{a}}\right)\right| \\ \text { s.t. } b_{\mathrm{t}}(440)=C_{\mathrm{m}} \cdot b_{\mathrm{m}, 440}^{*}+C_{\mathrm{d}} \cdot b_{\mathrm{d}, 440}^{*}+C_{\mathrm{a}} \cdot b_{\mathrm{a}, 440}^{*} \\ b_{t}(675)=C_{\mathrm{m}} \cdot b_{\mathrm{m}, 675}^{*}+C_{\mathrm{d}} \cdot b_{\mathrm{d}, 675}^{*}+C_{\mathrm{a}} \cdot b_{\mathrm{a}, 675}^{*} \\ C_{\mathrm{m}}, C_{\mathrm{d}}, C_{\mathrm{a}} \geqslant 0 \end{array} $ | (11) |
2) 精度评价方法:上述水华蓝藻类群定量识别模型采用非线性最优化方法求得最终结果,具体实施基于MATLAB语言中fmincon()函数,主要分为目标函数和限制条件两部分,目标函数是Chl.a总浓度的加和性,限制条件具体指Chl.a浓度与3种蓝藻固有光学特性间的拟合公式,在此基础上同时定义3种蓝藻的Chl.a浓度介于0和总浓度之间,通过编程实现非线性多元函数求最优解的计算.
为了评价模型的精度,本研究将双藻和三藻混合实验数据作为验证数据,同时选取均方根误差(RMSE)、相对均方根误差(RMSErel)、平均标准差(MNB)以及标准均方根误差(NRMS)[36]作为模型精度评价指标:
| $ {\alpha _i}{\rm{ }} = {Y_i} - {X_i} $ | (12) |
| $ {\beta _i}{\rm{ }} = \frac{{{Y_i} - {X_i}}}{{{X_i}}} $ | (13) |
| $ RMSE = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {\alpha _i^2} } $ | (14) |
| $ RMS{E_{{\rm{rel }}}}{\rm{ }} = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {\beta _i^2} } $ | (15) |
| $ MNB{\rm{ }} = \frac{1}{N}\sum\limits_{i = 1}^N {{\beta _i}} $ | (16) |
| $ NRMS = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {{{\left( {{\beta _i} - MNB} \right)}^2}} } $ | (17) |
式中,X为实测值,Y为模型计算值.
2 结果与讨论 2.1 藻类实验结果基于上述评价指标,本研究对所构建的5种蓝藻类群水华定量识别模型分别进行了精度评价,具体结果如表 3所示.
| 表 3 模型评价结果 Tab. 3 Model assessment results |
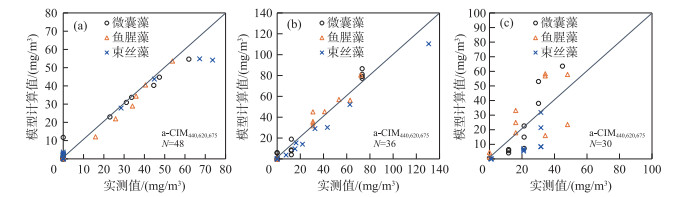
对于建模的纯藻实验数据,a-CIM440, 620、a-CIM440, 620, 675、b-CIM440, 675均给出了较好的定量识别结果. 3种主要水华蓝藻在440、620和675 nm处的吸收和散射特征差异显著,因此在互不干扰的情况下,上述3种模型对3种水华蓝藻的定量识别能力较高.图 3a展示了基于a-CIM440, 620, 675的不同蓝藻类群定量识别结果和监测值的对比.由该图可知,a-CIM440, 620, 675模型对微囊藻和鱼腥藻的识别精度较高,图中点位基本分布在1 :1线附近,而束丝藻则在高浓度区域出现了一定程度的低估.
|
图 3 基于纯藻(a)、双藻(b)和三藻(c)实验数据的a-CIM440, 620, 675模型3种蓝藻的叶绿素a浓度计算值与监测值对比 Fig.3 Chlorophyll-a concentration comparison of model predictions and measurements based on single cyanobacteria specie (a), bi-cyanobacteria-specie (b) and tri-cyanobacteria-specie (c) experiments |
双藻混合实验数据中所有模型的定量识别能力都有所下降,总体上,基于吸收的模型的定量识别能力明显优于基于散射的模型,其中基于440、620和675 nm 3个波段吸收的a-CIM440, 620, 675显示了较为稳定的定量识别能力,而基于两个波段吸收的模型定量识别能力较弱,说明混合藻类实验中,不同蓝藻之间有所干扰,因此从混合蓝藻中定量识别不同蓝藻需要更多波段信息才更准确.图 3b是基于双藻混合实验数据a-CIM440, 620, 675模型计算值与监测值的对比,由该图可知,a-CIM440, 620, 675模型对微囊藻和鱼腥藻的定量识别结果与监测值较好地分布在1 :1线附近,而对束丝藻的定量识别结果略低于监测值.
2.1.3 三藻实验结果3种蓝藻混合实验验证5种定量识别模型发现,由于3种水华蓝藻在吸收和散射上的累积叠加,吸收、散射数据的复杂性进一步降低了模型的定量识别能力,总体上,基于吸收的三波段模型a-CIM440, 620, 675具有相对较好的定量识别能力.图 3c是该模型定量识别值和监测值的对比,从图中看出3种蓝藻的结果均较为分散地分布在1 :1线附近.由于在三藻混合实验中,3种蓝藻的Chl.a浓度以间隔 < 20 mg/m3的浓度依次递增,没有明显的主导蓝藻,因此每种主要水华蓝藻的吸收、散射特征不突出,从而降低了模型的定量识别能力.
2.2 巢湖主要水华蓝藻类群的时空分布特征蓝藻占巢湖藻种的绝对主导地位,主要由微囊藻、鱼腥藻、束丝藻这3种藻类构成[6-7],因此本研究结合实测Chl.a总浓度和各特征波段的吸收系数将本研究提出的水华蓝藻定量识别模型应用于巢湖,可以获取巢湖3种水华蓝藻的时空分布特征,同时也能初步验证该模型在巢湖的适用性.
本研究的水华蓝藻类群定量识别模型建立在室内光学控制实验基础之上,蓝藻的吸收系数是在实验室通过AC-S仪器实测获得.巢湖野外样品的浮游植物总吸收系数采用QFT-分光光度计方法测得.两种方法之间存在着系统误差.周雯[37]的研究发现,QFT-分光光度计方法测得的吸收系数与色素浓度线性关系较差,实验测量引入的误差也较大,且其测得的吸收系数平均值高于AC-S测量吸收系数.在野外条件下,受水体中无机悬浮物和黄色物质的影响,AC-S只能获取水体的总吸收系数,无法直接获取浮游植物总吸收.
为了初步判断该模型在巢湖的适用性,将本研究水华蓝藻类群定量识别模型应用于巢湖,需要做以下假定:(1)假定AC-S与QFT-分光光度计方法所测的浮游植物总吸收之间的系统误差可忽略;(2)假定巢湖野外采样获取的Chl.a浓度和浮游植物总吸收均来自3种水华蓝藻的贡献.
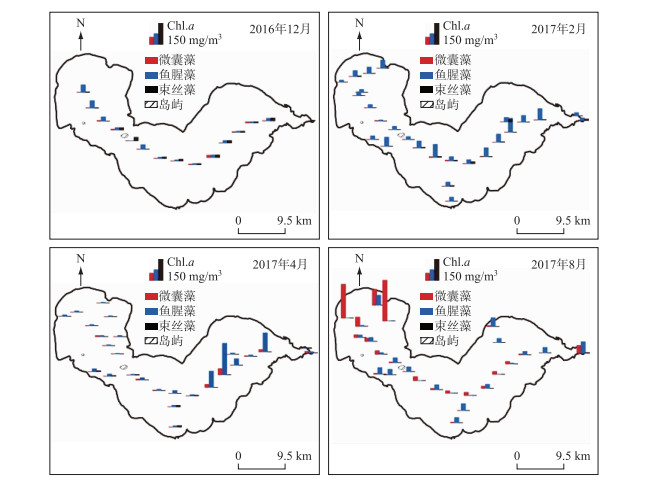
基于3个特征吸收波段的a-CIM440, 620, 675模型,巢湖3种主要水华蓝藻类群的时空分布如图 4所示.可以看出,2016年12月,各监测点3种水华蓝藻浓度(Chl.a浓度)均较低,西部监测点鱼腥藻浓度明显高于东部湖区,微囊藻和束丝藻浓度总体较低,束丝藻在中部湖区的浓度略高于东部和西部湖区. 2017年2月,巢湖各监测点几乎均以鱼腥藻为主,全湖鱼腥藻浓度相当;微囊藻和束丝藻浓度在所有监测点均很低;束丝藻浓度在东部湖区要略高于其他湖区. 2017年4月,巢湖中西部各监测点的鱼腥藻浓度较2月份有下降,但东部湖区的鱼腥藻浓度较高,且出现了鱼腥藻水华;微囊藻浓度除在水华区域监测点稍高外,非水华区域依然较低;束丝藻浓度在所有监测点都很低. 2017年8月,各监测点依然以鱼腥藻和微囊藻为主,其中西部湖区出现了以微囊藻为绝对优势的蓝藻水华现象,其余监测点鱼腥藻和微囊藻浓度相近;束丝藻浓度总体上是4次巡测的最低值.
|
图 4 巢湖主要水华蓝藻类群的时空分布 Fig.4 Temporal and spatial distribution of main bloom-forming cyanobacteria in Lake Chaohu |
总体上,巢湖的水华蓝藻以鱼腥藻、微囊藻为主,温度较低的季节鱼腥藻占绝对优势,主要与内源环境因素有关,冬季巢湖溶解氧浓度较高且磷浓度较低,而且温度较低,适宜鱼腥藻生存.微囊藻主要发生于夏季的西部湖区,于湖面形成水华,是流域西北部的外源污染负荷所致.微囊藻自身的无机碳浓缩机制和伪空胞调节,以及巢湖夏季20~34℃的适宜温度,较高的氮、磷浓度,较高的pH值,适宜的光照强度和时间等环境条件,是微囊藻水华多发生在夏季的主要原因.由于高温对鱼腥藻(13~30℃)、束丝藻(13~25℃)生长代谢有明显的抑制作用,因此夏季鱼腥藻和束丝藻浓度总体偏低,上述结论与马健荣等[38]、刘菲菲等[39]、Jiang等[6]、Zhang等[7]对巢湖蓝藻种群结构的调查结果完全一致,证实了该模型在巢湖的适用性.
2.3 巢湖主要水华蓝藻类群的垂向分布特征水华蓝藻因其独特的生理结构(伪空胞)以及外环境水动力条件,通过上浮或下沉来改变其垂向位置,选择最佳的生存空间[40-41.因此,蓝藻垂向位置迁移造成了水体表层藻类信息难以全面、准确地表征水华蓝藻的垂向分布特征.本研究在已知总Chl.a浓度和浮游植物总吸收的剖面分布的情况下,基于3个特征吸收波段的a-CIM440, 620, 675模型获取了3种水华蓝藻的垂向分布,这为科学诠释不同水华蓝藻类群的垂向分布规律提供了重要的技术支撑.
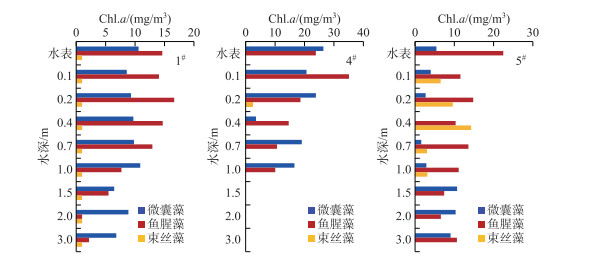
非藻华条件下断面1#、4#和5#中5种水华蓝藻的垂向分布情况见图 5.由图 5可知,3个断面均以微囊藻和鱼腥藻为主,且均呈垂向均匀分布状态,1#和4#断面束丝藻浓度整体偏低,5#断面水面以下1 m范围内主要为10 mg/m3左右的束丝藻. 2#和3#断面出现蓝藻水华时主导的蓝藻完全不同:2#断面主要发生的是微囊藻藻华;3#断面则是鱼腥藻藻华(图 6).微囊藻自身含有气囊,在气温和光照适宜的条件下,通过扩大气囊上浮至水体表层;鱼腥藻自身并无气囊,但是当其浓度较高、形成抱团状态时,较大的比表面积使其更加容易上浮至水体表面形成水华.浓度较高(>30 mg/m3)的水华蓝藻主要出现在水体表面以下20 cm范围内.
|
图 5 非藻华条件下3种主要水华蓝藻的垂向分布 Fig.5 Vertical distribution of main bloom-forming cyanobacteria at non-bloom condition |
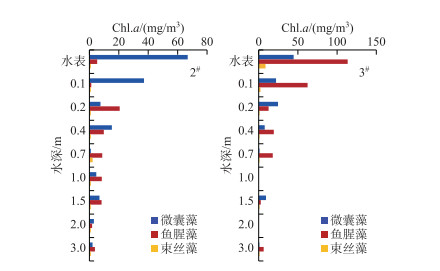
|
图 6 藻华条件下3种主要水华蓝藻的垂向分布 Fig.6 Vertical distribution of main bloom-forming cyanobacteria at bloom condition |
本研究基于室内光学控制实验构建了3种水华蓝藻的定量识别模型,其精度还需结合大量野外实测数据进行验证与优化;在以水华蓝藻为主的湖泊进行野外实测时通常以数量作为衡量藻类群落结构的方式,与本研究测量以及计算的Chl.a浓度指标具有不一致性,难以直接进行验证.本研究是水华蓝藻主要类群遥感定量监测的重要尝试,结果呈现的巢湖蓝藻类群的时空变化与传统方法得到的变化趋势一致,可以为相关部门准确掌握富营养化湖泊水华蓝藻的时空分布状况、科学开展湖泊水污染治理与生态修复提供重要的决策依据.
实现富营养化湖泊水华蓝藻类群的卫星遥感监测是本项研究的最终目标.近年来新增的海洋水色传感器主要有可见光成像辐射仪(VIIRS)、第二代海洋水色监视仪(OCM-2)、地球静止海洋水色成像仪(GOCI)、海洋和陆地颜色仪(OLCI)等.其中,Sentinel-3A OLCI的波段设置与3种水华蓝藻固有光学特性的特征波段恰好匹配,为下一步研究提供了重要的遥感数据基础.但是要实现基于卫星影像开展水华蓝藻的定量识别目标,还需解决富营养化湖泊水体浮游植物吸收特性及其色素浓度的卫星遥感反演算法研究.受人类影响最强烈的富营养化湖泊,属于典型的Ⅱ类水体,其光学成因复杂,传统大洋Ⅰ类水体的大气校正算法、色素浓度反演算法和颗粒物固有光学特性反演算法的适用性不强.因此,基于卫星影像实现富营养化湖泊主要水华蓝藻空间分布的遥感定量反演,还需水色遥感相关理论研究的不断发展和进步,任重而道远.
| [1] |
Ministry of Environmental Protection, PRC. Bulletin of the state of the environment of China. Beijing: China Environmental Science Press, 2017. [中华人民共和国环境保护部. 中国环境状况公报. 北京: 中国环境科学出版社, 2017.]
|
| [2] |
Reynolds CS, Walsby AE. Water-blooms. Biological Reviews, 1975, 50(4): 437-481. DOI:10.1111/j.1469-185x.1975.tb01060.x |
| [3] |
Reynolds CS ed. Cyanobacterial water-blooms. Advances in botanical research. Amsterdam: Elsevier, 1987: 67-143. DOI: 10.1016/s0065-2296(08)60341-9.
|
| [4] |
Wu QL, Xie P, Yang LY et al. Studies on the mechanism of ecological disaster of harmful algal blooms in shallow lakes. Advantages Earth Science, 2008, 23(11): 1115-1123. [吴庆龙, 谢平, 杨柳燕等. 湖泊蓝藻水华生态灾害形成机理及防治的基础研究. 地球科学进展, 2008, 23(11): 1115-1123.] |
| [5] |
Liu Y. Studies on the diversity, spatial-temporal distribution, and physiological characters of Anabaena flos-aquae in Lake Taihu[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2013. [刘洋.太湖水华鱼腥藻的多样性、时空分布及生理特性研究[学位论文].北京: 中国科学院大学, 2013. ]
|
| [6] |
Jiang YJ, He W, Liu WX et al. The seasonal and spatial variations of phytoplankton community and their correlation with environmental factors in a large eutrophic Chinese lake (Lake Chaohu). Ecological Indicators, 2014, 40: 58-67. DOI:10.1016/j.ecolind.2014.01.006 |
| [7] |
Zhang M, Zhang YC, Yang Z et al. Spatial and seasonal shifts in bloom-forming cyanobacteria in Lake Chaohu: Patterns and driving factors. Phycological Research, 2016, 64(1): 44-55. DOI:10.1111/pre.12112 |
| [8] |
Pech-Pacheco JL, Alvarez-Borrego J. Optical-digital system applied to the identification of five phytoplankton species. Marine Biology, 1998, 132(3): 357-365. DOI:10.1007/s002270050402 |
| [9] |
Qiao XY. Automatic recognition method of microscopic image of harmful algae. Journal of Shandong University: Engineering Science, 2016, 46(3): 1-6. [乔小燕. 赤潮藻显微图像自动识别方法. 山东大学学报:工学版, 2016, 46(3): 1-6.] |
| [10] |
Chen Y, Liu GQ, Li WB et al. Comparison of three extraction methods for DNA from Chlorella spp. Plant Physiology Communications, 2001, 37(3): 242-244. [陈颖, 刘根齐, 李文彬等. 3种小球藻DNA提取方法的比较. 植物生理学通讯, 2001, 37(3): 242-244.] |
| [11] |
MacKey MD, MacKey DJ, Higgins HW et al. CHEMTAX User's Manual: A program for estimating class abundances from chemical markers—Application to HPLC measurements of phytoplankton pigments. Marine Ecology Progress, 1996, 144(1): 265-283. DOI:10.3354/meps144265 |
| [12] |
Lewitus AJ, White DL, Tymowski RG et al. Adapting the CHEMTAX method for assessing phytoplankton taxonomic composition in Southeastern US estuaries. Estuaries, 2005, 28(1): 160-172. DOI:10.1007/bf02732761 |
| [13] |
Hu XP, Su RG, Zhang CS et al. Fluorescence discrimination technology for the red tide algae by spectra similarity index. Chinese Journal of Lasers, 2008, 35(1): 115-119. [胡序朋, 苏荣国, 张传松等. 基于光谱相似性指数的赤潮藻荧光识别技术. 中国激光, 2008, 35(1): 115-119.] |
| [14] |
Zhang SS, Su RG, Duan YL. Research on the 3D discrete fluorescence spectrum technique for differentiation of phytoplankton population. Spectroscopy and Spectral Analysis, 2011, 31(3): 732-736. [张珊珊, 苏荣国, 段亚丽等. 浮游植物群落组成的离散三维荧光光谱识别测定技术. 光谱学与光谱分析, 2011, 31(3): 732-736.] |
| [15] |
Moberg L, Karlberg B, Sørensen K et al. Assessment of phytoplankton class abundance using absorption spectra and chemometrics. Talanta, 2002, 56(1): 153-160. DOI:10.1016/S0039-9140(01)00555-0 |
| [16] |
Lu L. Study on fluorescence spectra for identifying phytoplankton community[Dissertation]. Qingdao: Scean University of China, 2007. [卢璐.浮游植物群落组成荧光识别测定方法研究[学位论文].青岛: 中国海洋大学, 2007. ]
|
| [17] |
Mahoney KL. Backscattering of light by Karenia brevis and implication for optical detection and monitoring[Dissertation]. Hattiesburg: University of Southern Mississippi, 2003.
|
| [18] |
Martínez-Guijarro R, Romero I, Pachés M et al. Determination of phytoplankton composition using absorption spectra. Talanta, 2009, 78(3): 814-819. DOI:10.1016/j.talanta.2008.12.073 |
| [19] |
Huang CC, Li YM, Sun DY. Identification of algea using photosensitive pigment absorption signals in Tiahu Lake. Acta Hydrobiologica Sinica, 2010, 34(3): 582-590. [黄昌春, 李云梅, 孙德勇等. 基于感光色素吸收信号的太湖藻类识别. 水生生物学报, 2010, 34(3): 582-590.] |
| [20] |
Boddy L, Morris CW, Wilkins MF et al. Identification of 72 phytoplankton species by radial basis function neural network analysis of flow cytometric data. Marine Ecology Progress Series, 2000, 195(1): 47-59. DOI:10.3354/meps195047 |
| [21] |
Ma WQ. Study on biological optical properties remote sensing identification of Microcysis [Dissertation]. Nanjing: Nanjing Normal University, 2012. [马万泉.微囊藻生物光学特性与遥感识别研究[学位论文].南京: 南京师范大学, 2012. ]
|
| [22] |
Dai HL. The scattering characteristics and theoretical analog of the primary algae species in freshwater lakes [Dissertation]. Nanjing: Nanjing Normal University, 2013. [戴红亮.淡水湖泊主要藻种的散射特性和理论模拟研究[学位论文].南京: 南京师范大学, 2013. ]
|
| [23] |
Lv H, Dai HL, Li YM et al. simulating the light absorption and scattering properties of Microsystis aeruginosa using a two-layered spherical geometry. Acta Optica Sinica, 2013, 12: 319-329. [吕恒, 戴红亮, 李云梅等. 铜绿微囊藻吸收和散射特性两层球形模型模拟. 光学学报, 2013, 12: 319-329.] |
| [24] |
Lv H, Wang Y, Li XJ et al. Scattering and backscattering properties of main fresh water alga species. Bulletin of Botany, 2014, 49(5): 578-586. [吕恒, 王瑜, 李晓俊等. 内陆湖泊主要藻种散射特性. 植物学报, 2014, 49(5): 578-586.] |
| [25] |
Wang Y. Study on estimation of Micocystis aeruginosa proportion in Taihu Lake based on optical absorption spectra[Dissertation]. Nanjing: Nanjing Normal University, 2014. [王瑜.基于吸收光谱的太湖铜绿微囊藻比例估算研究[学位论文].南京: 南京师范大学, 2014. ]
|
| [26] |
Cui TW, Zhang J, Ma Y et al. Study of red tide spectral characteristics and its mechanism. Spectroscopy and Spectral Analysis, 2006, 26(5): 884-886. [崔廷伟, 张杰, 马毅等. 赤潮光谱特征及其形成机制. 光谱学与光谱分析, 2006, 26(5): 884-886.] |
| [27] |
Lee Z, Carder KL, Du KP. Effects of molecular and particle scatterings on the model parameter for remote-sensing reflectance. Applied Optics, 2004, 43(25): 4957-4964. DOI:10.1364/ao.43.004957 |
| [28] |
Hunter PD, Tyler AN, Présing M et al. Spectral discrimination of phytoplankton colour groups: The effect of suspended particulate matter and sensor spectral resolution. Remote Sensing of Environment, 2008, 112(4): 1527-1544. DOI:10.1016/j.rse.2007.08.003 |
| [29] |
Zhang YX, Zhang YC, Zhou W et al. Inherent optical properties of typical cyanobacteria in eutrophic lakes. J Lake Sci, 2018, 30(6): 1681-1692. [张壹萱, 张玉超, 周雯等. 富营养化湖泊典型水华蓝藻的固有光学特性. 湖泊科学, 2018, 30(6): 1681-1692. DOI:10.18307/2018.0620] |
| [30] |
Chen X, Yang XD, Dong XH et al. Environmental changes in Chaohu Lake (southeast, China) since the mid 20th century: The interactive impacts of nutrients, hydrology and climate. Limnologica, 2013, 43(1): 10-17. DOI:10.1016/j.limno.2012.03.002 |
| [31] |
Mueller JL, Lange RE. Bio-optical provinces of the Northeast Pacific Ocean: A provisional analysis. Limnology and Oceanography, 1989, 34(8): 1572-1586. DOI:10.4319/lo.1989.34.8.1572 |
| [32] |
Duan HT, Ma RH, Hu CM. Evaluation of remote sensing algorithms for cyanobacterial pigment retrievals during spring bloom formation in several lakes of East China. Remote Sensing of Environment, 2012, 126: 126-135. DOI:10.1016/j.rse.2012.08.011 |
| [33] |
Moses WJ, Gitelson AA, Berdnikov SV et al. Estimation of chlorophyll-a concentration in case Ⅱ waters using MODIS and MERIS data—successes and challenges. Environmental Research Letters, 2009, 4(4): 045005. DOI:10.1088/1748-9326/4/4/045005 |
| [34] |
Simis SGH, Ruiz-Verdú A, Domínguez-Gómez JA et al. Influence of phytoplankton pigment composition on remote sensing of cyanobacterial biomass. Remote Sensing of Environment, 2007, 106(4): 414-427. DOI:10.1016/j.rse.2006.09.008 |
| [35] |
Mobley CD. Estimation of the remote-sensing reflectance from above-surface measurements. Applied Optics, 1999, 38(36): 7442-7455. DOI:10.1364/ao.38.007442 |
| [36] |
Mentaschi L, Besio G, Cassola F et al. Problems in RMSE-based wave model validations. Ocean Modelling, 2013, 72: 53-58. DOI:10.1016/j.ocemod.2013.08.003 |
| [37] |
Zhou W. Theoretical simulation of phytoplankton light scattering characteristics[Dissertation]. Guangzhou: South China Sea Institute of Oceanology, Chinese Academy of Sciences, 2008. [周雯.浮游植物光散射特性理论模拟[学位论文].广州: 中国科学院南海海洋研究所, 2008. ]
|
| [38] |
Ma JR, Deng J, Qin BQ et al. Progress and prospects on cyanobacteria bloom-forming mechanism in lakes. Acta Ecologica Sinica, 2013, 33(10): 3020-3030. [马健荣, 邓建明, 秦伯强等. 湖泊蓝藻水华发生机理研究进展. 生态学报, 2013, 33(10): 3020-3030.] |
| [39] |
Liu FF, Feng MH, Shang LX et al. Effects of temperature on the growth and generation of extracellular organic matter of Microcystis aeruginosa and Anabaena sp. J Lake Sci, 2014, 26(5): 780-788. [刘菲菲, 冯慕华, 尚丽霞等. 温度对铜绿微囊藻(Microcystis aeruginosa)和鱼腥藻(Anabaena sp.)生长及胞外有机物产生的影响. 湖泊科学, 2014, 26(5): 780-788. DOI:10.18307/2014.0517] |
| [40] |
Walsby AE. Gas vesicles. Microbiological Reviews, 1994, 58(1): 94-144. DOI:10.1128/mmbr.58.1.94-144.1994 |
| [41] |
Kong FX, Song LR. Study on the formation process and environmental characteristics of cyanobacteria bloom. Beijing: Science Press, 2011. [孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究. 北京: 科学出版社, 2011.]
|
 2021, Vol. 33
2021, Vol. 33 

