(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学, 北京 100049)
(4: 中国科学院生态环境研究中心, 北京 100049)
(5: 河海大学, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(4: Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100049, P. R. China)
(5: Hohai University, Nanjing 210008, P. R. China)
蓝藻水华是富营养化湖泊最常见的环境问题.大量蓝藻滋生积聚,部分在水体中被异养微生物分解,其余形成有机碎屑,沉降至沉积物表面[1],被底栖微生物分解矿化[2].蓝藻碎屑这种新鲜、活性有机质的输入和堆积改变了沉积物-水界面(SWI)生物理化性质,从而改变了沉积物环境的地球化学循环过程.
蓝藻堆积对沉积物有机质矿化产生的影响,目前研究侧重于蓝藻的聚积和衰亡对沉积物-水环境和藻类生长繁殖的影响,以及对微生物与有机质矿化的作用[3-4].蓝藻本身是由易降解的藻源性有机质(AOM)构成[5],其聚积的过程中,部分在水体中被分解利用,释放出溶解性有机质(DOM)和氮磷营养盐至上覆水中[6],使得上覆水中碳氮磷浓度上升;另一部分蓝藻碎屑沉降到沉积物表面,不仅会对微生物活性和群落组成造成影响[7-8],而且增加了沉积物中有机质负荷,并通过矿化作用改变沉积环境的生物理化条件,影响沉积物中氮、磷营养盐释放,使得沉积物形成强大的氮、磷释放潜力,成为污染物的“源”[9-10].一方面,AOM可以作为异养微生物的重要能量加快其新陈代谢速度,提高异养微生物活性,加速微生物群落的增长[11].有研究发现,溶解性有机碳(DOC)的浓度与微生物密度和多样性有着密不可分的关系,微生物密度与其呈正比,多样性与其呈反比[10-12].另一方面,AOM对沉积物有机碳的矿化具有明显的促进作用[13],而O2作为矿化过程中的电子供体首先会被利用,水体中溶解氧(DO)浓度和氧化还原电位(Eh)因此持续降低[14],形成缺氧甚至厌氧的强氧化还原环境.其中,氧化还原条件变化进一步影响着沉积物、孔隙水和上覆水中的FeS-P浓度,控制着沉积物中P向上覆水中扩散的通量[15-16].
在沉积物有机质矿化过程中,有机质是电子受体,O2作为电子供体首先被利用,然后是NO3-、SO42-、Fe3+等被还原[17],也就是说矿化途径包括有氧呼吸、反硝化、SO42-还原、铁锰氧化物还原等.沉积物中较难分解的有机质受环境理化性质改变和外源活性有机质输入的影响可能再矿化,发生“共同代谢”现象[18],从而影响沉积物元素的地球化学循环过程.目前的研究鲜见蓝藻碎屑输入对沉积物矿化过程的影响,以及矿化引起的产物释放、扩散通量的变化[19-20].因此,本文主要研究藻屑输入对沉积物矿化特征以及碳氮磷等产物的释放速率变化特征的影响,并与微生物的生物酶活性相联系.
于桥水库是天津市生活饮用水和农业用水的重要水源地,近年来入库河流带来大量氮磷污染物使其水体逐渐富营养化,夏、秋季蓝藻水华现象频繁发生,湖心区上覆水的叶绿素a(Chl.a)平均浓度为50~60 μg/L,大坝区受风力、风向等因素影响,局部岸带累计的Chl.a浓度最高达1200 μg/L[21],对饮用水源水质产生强大的污染效应.本实验选择于桥水库湖心区作为沉积物采样点,将优势藻种铜绿微囊藻(Microcystis aeruginosa)的藻屑作为添加物,模拟研究堆积在湖泊沉积物表面的蓝藻碎屑对有机质矿化特征的影响.实验参考于桥水库夏、秋季蓝藻水华发生期间Chl.a的平均浓度和最高浓度,设计2个对照组(分别为加藻对照组、加泥对照组)和2个不同藻屑添加密度的处理组.监测各个实验组的pH值变化和碳、氮、磷等释放情况,以揭示不同藻屑堆积密度下沉积物矿化产物的变化特征,为蓝藻水华影响下的饮用水环境修复和科学管理提供理论依据.
1 材料与方法 1.1 样品采集与处理于2018年10月在于桥水库湖心区(40°02′7.30″N,117°32′36.61″E)采集水样和沉积物样品.柱状采泥器(ϕ86 mm×500 mm)采集沉积物样品.现场采集同一位置的底层水样10 L,经过0.45 μm的醋酸纤维膜过滤,作为实验用水和备用水冷藏保存于4℃的冰箱中.取少量泥样冷冻干燥,研磨过120目筛,分析Chl.a、总有机碳(TOC)、总氮(TN)和总磷(TP)含量,具体含量如表 1所示.剩余泥样模拟秋季蓝藻衰亡时的温度,于恒温(16±1℃)下,避光静置2 h稳定后用于实验.
| 表 1 表层沉积物、藻屑的理化性质 Tab. 1 Physical and chemical properties of surface sediments and algal-detritus |
从中国科学院水生生物研究所藻种库购买铜绿微囊藻(Microcystis aeruginosa)作为藻种,用BG11培养基培养,培养基pH=7.1,培养条件设置为12 h光照/12 h黑暗,光照强度为20 μE/(m2 ·s),温度为25±1℃.每天摇晃1次使其避免附壁生长,培养至对数生长期后,以藻种:培养基=1 :5的体积比在无菌操作台中进行移藻,扩大培养.在稳定期通过离心收获微囊藻,收获之前用超纯水冲洗3次,以去除多余的盐和溶解的营养物质.将由此产生的微囊藻浓缩物放入-50℃的冻干机中冷冻干燥,研磨后过120目筛制成干藻屑,取少量进行理化指标分析,其余存放于4℃保存[22].
1.2 实验设计培养实验采用2 L厌氧培养瓶(底面积125 cm2),设置4个处理组,每个处理组设置一组平行.根据测得的于桥水库蓝藻水华发生期间湖心区上覆水的Chl.a平均浓度(50~60 μg/L)和水华严重时的最高浓度(1200 μg/L)[7],设计2个对照组(分别为加藻对照组和加泥对照组)和2个不同藻屑密度添加组,分别为×1倍组(代表常规水华发生时蓝藻密度密度,0.075 g干藻,约6 g/m2,以干重计)和×20倍组(代表水华严重暴发时蓝密度,1.5 g干藻,约120 g/m2,以干重计)[10],如表 2所示.
| 表 2 各实验组设置 Tab. 2 Setting of each treatment |
将沉积物与少量上覆水均匀混合于培养瓶中,待沉积物稳定2~3天后,把冻干的铜绿微囊藻藻屑按上述添加量与表层1 cm的沉积物均匀混合,重新沿管壁缓缓注入水样.为模拟湖底沉积物矿化时的缺氧环境,向培养装置中通高纯氮气20 min,迅速密封培养瓶.将每组处理的培养瓶与同位素检测仪(G2201i,PICARRO)和在线pH计连接,设置测量频率均为每小时1次,以实时监测培养瓶的顶空气体(CO2和CH4)和上覆水的pH值(实验装置示意图如图 1所示).培养温度为16±1℃,避光培养.
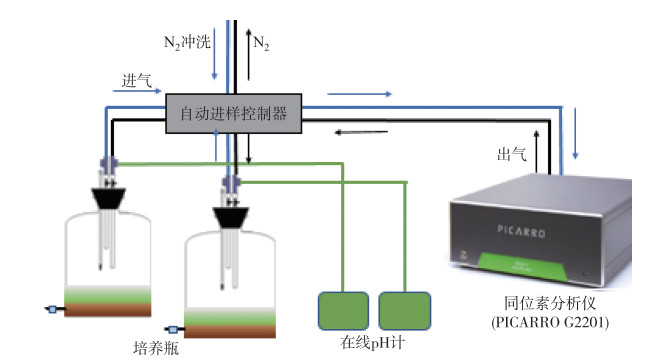
|
图 1 实验装置示意图 Fig.1 The diagrammatic sketch of experimental devices |
培养过程中,采用注射器吸取上覆水样品,采用间隙水采集器(Rhizon CSS-F, Netherland)采集间隙水,上覆水和间隙水的采样位置分别位于SWI上方和下方1 cm处.分别于第0、0.5、1、2、3、5、7、10、14、17天取2 mL间隙水和4 mL上覆水,经0.45 μm醋酸纤维膜滤头过滤后,取2 mL上覆水测定溶解性无机碳(DIC)的浓度,剩余水样用于测定氨态氮(NH4+)、磷酸盐(PO43-)、亚铁(Fe2+)和硫离子(S2-)的浓度.
实验结束后,收集培养瓶中沉积物样品,测定碳氮磷含量和生物酶(蛋白酶、转化酶、碱性磷酸酶)活性.
1.3 分析方法 1.3.1 水样中碳氮磷硫铁测定将用于测定DIC分析的水样放至25 mL充满氮气的西林瓶中,通过加入0.2 mL的1 mol/L盐酸使其酸化,定量转化为CO2,再使用气相色谱仪(GC 7890,Agilent)测定CO2浓度[24].
参照《水和废水监测分析方法(第四版)》对间隙水和上覆水中的NH4+、PO42-、Fe2+、S2-浓度定期进行测定. NH4+采用纳氏试剂光度法,PO43-采用钼锑抗分光光度法,Fe2+采用邻菲咯啉分光光度法,S2-采用对氨基二甲基苯胺光度法[27].
1.3.2 顶空气体中CO2和CH4浓度的测定采用多通道温室气体进样装置连接培养瓶和温室气体碳同位素分析仪(G2201i,PICARRO),用隔膜泵抽取培养瓶中顶空气体,注入分析仪的腔室中,检测CO2和CH4浓度,气体再回到培养瓶顶空.取样时间为5 min,间隔时间为1 h.取样间隔采用N2作为空白气.自动连续温室气体监测系统在实验期间表现稳定.
1.3.3 沉积物TOC、TN、TP、Chl.a、生物酶活性的测定实验结束后,收集各个处理的沉积物样品,冷冻干燥后过180目筛,备用.在坩埚中使用2 mol/L HCl(50℃)将沉积物酸化,再通过元素分析仪(EA3000)分析沉积物的TOC和TN含量.用过硫酸盐消化分析沉积物TP含量[25].对冷冻干燥的沉积物使用丙酮提取,采用荧光光度计(RF5301PC,岛津,日本)在激发波长为428 nm,发射波长为671 nm处测定荧光强度,分析Chl.a含量[26].沉积物中蛋白酶、转化酶和碱性磷酸酶的酶活性分析分别采用茚三酮水浴加热分光光度法、二硝基水杨酸水浴加热分光光度法和对硝基苯酚分光光度法[27].
1.4 计算方法释放通量Fi按下式计算:
| $ {F_i} = \frac{{V\left( {C_n^* - {C_0}} \right)}}{{S \cdot t}} $ | (1) |
式中,Fi为释放通量(mg/(m2 ·d)),i指上覆水中的NH4+和PO43-;V为柱中上覆水体积(L);Cn*是第n次采样时某物质的校正浓度(mg/L);C0为某物质的初始测定浓度(mg/L);S为柱样中水-沉积物接触面积(m2);t为释放时间(d)[29].
扩散通量Fm运用Fick第一定律:
| $ {F_{mi}} = {\left. {{\phi _0} \cdot {D_s}\frac{{\partial c}}{{\partial x}}} \right|_{x = 0}} $ | (2) |
式中,Fmi是扩散通量(mg/(m2 ·d));ϕ为表层沉积物孔隙度(%);Ds为经孔隙度校正的有效分子扩散系数
上覆水和间隙水中NH4+、PO42-、Fe2+、S2-浓度校正按下式计算:
| $ C_n^* = \frac{{{C_n}\left[ {{V_0} - (n - 1){V_s}} \right] + \sum\limits_{j = 1}^{n - 1} {{C_j}} {V_s}}}{{{V_0}}} $ | (3) |
式中,Cn*是第n次(n>0)采样时某物质的校正浓度(mg/L),Cn、Cj分别是第n次、第j次采样时某物质的测定浓度(mg/L),V0是初始上覆水体积(L),Vs是采样体积(L)[28].
2 结果分析与讨论 2.1 藻屑添加对上覆水pH值的影响实验开始时,4个实验组的上覆水pH值在7.72~8.41之间.第0~3天内,pH值总体都呈快速下降趋势,并很快达到实验期间各自上覆水pH的最低值.其中,加藻对照组(水+藻×1)、加泥对照组(水+泥)和×1倍组(水+泥+藻×1)分别在第3天左右达到最低值7.25、7.17和7.06,×20倍组(水+泥+藻×20)则是在第1天时达到最低值6.47.第3~4天内,所有实验组的上覆水pH值迅速上升,此后直到实验结束,除了×20倍组的上覆水pH值有明显的上升趋势,其他实验组pH值基本稳定在7.1~7.5之间.总之整个实验期间,除了×20倍组外,其他实验组的上覆水pH始终呈弱碱性,且处理组的pH值始终小于对照组.
氧气充足情况下,异养微生物新陈代谢过程利用水体中氧气与无机碳,降低系统pH;低氧情况下,异养微生物死亡裂解产生NH4+,导致pH升高;因此pH可以反应异养微生物活性状态[30].上覆水是污染物释放的汇聚区,在浓度梯度作用下沉积物中的污染物可扩散至上覆水,可以体现SWI污染物释放过程[9].藻屑的添加会提高系统上覆水的碱度,相比之下沉积物则具有一定的缓冲作用,因此在实验开始时,加藻对照组和×20倍组的pH值比加泥对照组和×1倍组的pH值更高(图 2).同时,藻屑有机质添加到沉积物表面使得沉积物的需氧量和异养微生物的活性提高,在有机质充足的情况下,微生物快速将其降解并产生大量CO2[31](图 3a、b),降低上覆水的pH值.自第3天起,藻屑死亡分解,释放的氨基酸氨化产生NH4+,导致各实验组pH值迅速上升,逐渐恢复至弱碱性(图 2).因此可知,有机藻屑的输入提高微生物活性,降低上覆水pH值,这种影响随着藻屑量的累积而增大.
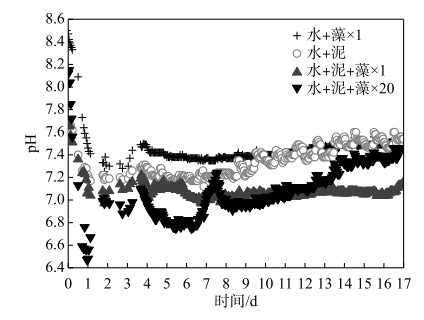
|
图 2 各实验组上覆水pH值变化 Fig.2 The variation of pH in overlying water in each treatment |
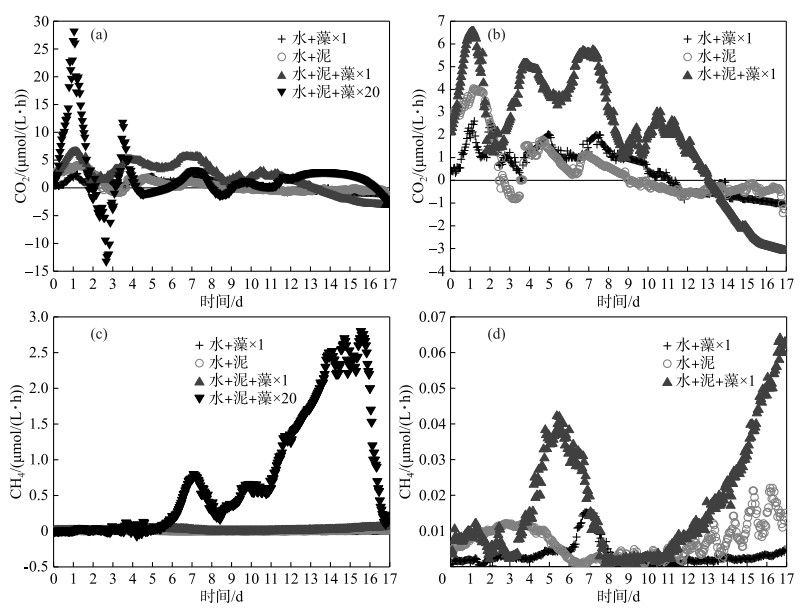
|
图 3 各实验组CO2(a)和CH4(c)释放速率随时间的变化特征(其中(b)、(d)分别为(a)、(c)的部分详图) Fig.3 The variation of CO2(a) and CH4(c) release rates with time in each treatment (where (b) and (d) are the detailed diagrams of (a) and (c), respectively) |
CO2是沉积物有机质降解的重要产物,产CH4过程是有机质矿化的终端过程,因此对CO2和CH4释放速率的监测可以表征沉积物有机质矿化程度和矿化速率的变化.实验期间,所有实验组的CO2和CH4释放速率虽然显著不同,但其变化趋势却均处于波动状态,其中CO2释放速率在实验前期(约第0~9天内)波动较大,CH4释放速率的变化则完全相反. CO2释放速率在实验前期绝大部分为正值,实验后期逐渐降低至负值;CH4释放速率则始终为正值(图 3c、d). CO2和CH4的释放速率由小到大依次为加藻对照组、加泥对照组、×1倍组和×20倍组,该顺序的CO2释放速率峰值分别为2.61、4.04、6.54和28.18 μmol/(L ·h),CH4释放速率峰值分别为0.02、0.02、0.06和2.83 μmol/(L ·h).
实验刚开始时,异养微生物活性较高,沉积物中易降解有机质被迅速矿化,因此CO2释放速率较高,其中×20倍组的CO2释放速率最大,这是因为藻屑也是由碳、氮、磷组成的易降解有机质,活性有机质的快速累积导致矿化速率增大.随着氧化剂的消耗,各实验组的CO2释放速率开始变缓,×20倍组的CO2释放速率甚至呈负值(图 3a),这导致了其上覆水pH值的升高(图 2).与此同时,各实验组CH4释放速率开始迅速上升,其中×20倍组的CH4释放速率明显大于其他组.这可能是沉积物中活性有机质的快速积累,使得×20倍组迅速处于厌氧状态[6],而CH4的生成正是厌氧矿化的重要途径[32],而且溶解氧环境的变化和大量蓝藻堆积腐败容易促进黑臭物质产生,增加发生湖泛现象的风险,严重恶化水体环境[33].相比之下,×1倍组中活性有机质的量较少,微生物呼吸作用大于同化作用,所以其CO2释放速率有所降低但依然为正值,CH4释放速率有所升高但依然较小.异养微生物的裂解死亡使得呼吸作用减小,溶解氧浓度回升,因此剩余异养微生物降解有机质的速率提高.
影响沉积物有机质矿化的环境因素主要有温度、溶解氧、pH及生物扰动[34]等,本实验排除了温度和生物扰动的干扰,藻屑有机质的添加主要通过增加沉积物的需氧量和异养微生物的活性,引起各实验组矿化产物和矿化速率的差异. ×1倍组藻屑添加量少,活性有机质的含量较少,主要进行好氧矿化,以CO2释放为主;×20倍组藻屑添加量大,活性有机质充足,O2会被微生物快速消耗至缺氧甚至厌氧状态,所以实验中后期主要进行厌氧矿化,其CH4释放速率远远大于其他组.
2.3 藻屑添加对氮磷扩散、释放通量的影响为求扩散通量,首先测的加泥对照组、×1倍组和×20倍组的表层沉积物扰动层的孔隙度为0.50、0.48和0.58,然后计算得到实验温度下的有效分子扩散系数DS[35], 最后得出相应的氮磷扩散通量Fm(其中正值表示为从沉积物间隙水向上覆水扩散的通量).
实验期间,加泥对照组、×1倍组和×20倍组的NH4+扩散和释放趋势基本相同,均在第0~10天内逐渐减小,达到各自的最小值后(扩散通量最小值分别为-1.81、-2.12和-2.76 mg/(m2 ·d),释放通量最小值分别为0.06、0.09和0.54 mg/(m2 ·d)),开始有上升趋势,直至实验结束(图 4a、5a).其中,除加泥对照组和×20倍组在实验后期(第10~17天)的NH4+扩散通量为正值外,其余均为负值.

|
图 4 各实验组NH4+(a)、PO43-(b)的扩散通量 Fig.4 Diffusion fluxes of NH4+(a) and PO43-(b) in each treatment |
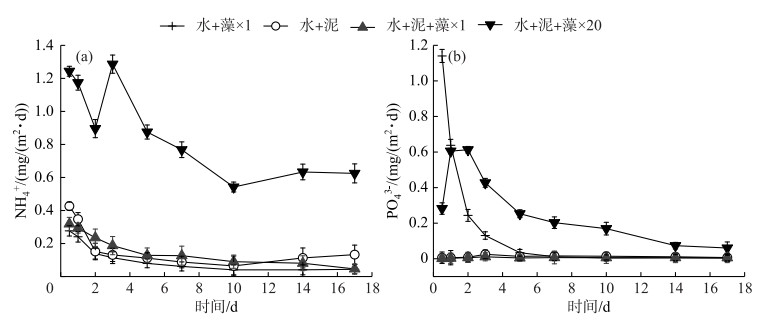
|
图 5 各实验组NH4+(a)、PO43-(b)的释放通量 Fig.5 Release fluxes of NH4+(a) and PO43-(b) in each treatment |
加泥对照组和×1倍组的PO43-扩散通量在-0.12~-0.05 mg/(m2 ·d)之间,释放通量则变化较小,在0.001~0.025 mg/(m2 ·d)之间.相比之下,×20倍组的PO43-扩散通量始终为正值,且扩散和释放趋势相同,先逐渐上升,达到峰值0.71和0.61 mg/(m2 ·d)后下降,至实验结束时均为0.06 mg/(m2 ·d)(图 4b、5b).
沉积物中氮磷的扩散-释放过程受多种因素的影响,如有机质的输入种类和数量、环境因素、电子受体的可用性及生物扰动作用[36].有研究表明,沉积物中有机氮经矿化作用释放出NH4+和NO3-,矿化作用的程度和速率与沉积物中有机氮的含量密切相关[37].沉积物磷素形态释放则以PO43-为主[38],且湖泊生态系统中的沉积物对PO43-具有调控功能,即厌氧条件下沉积物对PO43-表现为释放,好氧条件下则表现为吸附[39]. ×1倍组的藻屑添加量与实际环境中相似,对照组中沉积物的生物理化性状在实际环境中已被改变[8],所以2组的NH4+和PO43-扩散均以沉积物吸附为主,释放通量较小;相比之下,×20倍组中高密度的藻屑添加,使得沉积物中活性有机质的含量和需氧量迅速增大,导致其氮磷扩散-释放量更大,与对照组和×1倍组有明显差异(图 4、5).有研究表明,磷矿化是由微生物对碳,而不是对磷的需求引起的[40],因此加藻处理组的释放通量变化也可能是由藻屑添加对微生物碳需求的改变产生的.实际上,PO43-释放对沉积物氧化还原环境具有高度敏感性,沉积物表层的微生物群落结构、活性变化、颗粒物的吸附都可能对PO43-释放造成影响[41],其中S2-与Fe2+的非生物沉降反应[42],被认为是河口环境中影响磷释放的关键步骤[15].因此,少量藻屑添加对沉积物中NH4+和PO43-的扩散释放无显著影响,但大量藻屑添加对其有促进作用.
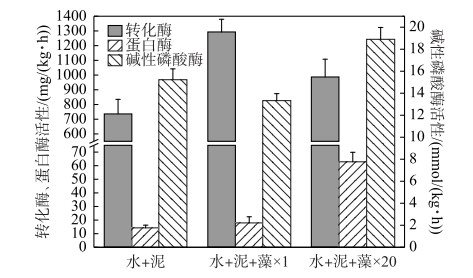
2.4 藻屑添加对沉积物生物酶活性的影响培养实验结束后测定不同的培养组沉积物中的生物酶活性.其中,转化酶又称蔗糖酶,可以酶促蔗糖水解生成还原糖(果糖和葡萄糖),是生物体内糖代谢的关键酶,其活性可反映沉积物碳的转化和呼吸强度;蛋白酶是一类作用于肽键催化蛋白质分解的水解酶,是沉积物氮循环的重要催化酶,其活性与沉积物有机碳氮磷的含量密切相关;碱性磷酸酶几乎能催化所有的磷酸单脂,使其水解产生无机酸和相应醇、酚或糖,因此其活性常被用作系统中有机磷缺乏的指示参数[18].
如图 6所示,与加泥对照组相比,×1倍组的转化酶活性较高,×20倍组的蛋白酶活性和碱性磷酸酶活性较高.这说明实验结束时×1倍组的沉积物有机质中碳的转化和微生物的呼吸强度较大;×20倍组的沉积物表面添加了大量活性有机质,增强了微生物活性,SWI的碳氮磷循环较快,且有机磷矿化强度较高.该结果与前面的结论大致相符合,即少量藻屑添加(×1倍组)主要影响沉积物有机碳的矿化,加快呼吸作用生成更多CO2(图 3a);大量藻屑添加(×20倍组)增加了沉积物表面的活性有机质含量,其矿化速率增大(图 3),且氮、磷扩散和释放通量较高(图 4、图 5).
|
图 6 实验结束时各实验组沉积物转化酶、蛋白酶和碱性磷酸酶的活性 Fig.6 Activity of invertase, protease and alkaline phosphatase in sediment at the end of the experiment in each treatment |
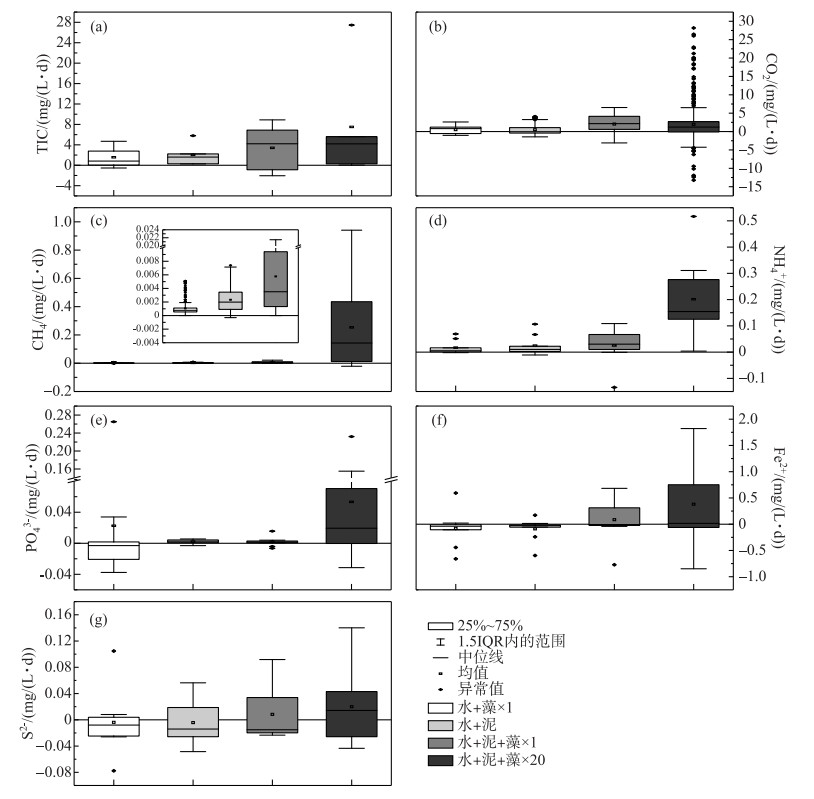
沉积物矿化途径主要包括有氧呼吸、反硝化、铁还原、SO42-还原、产甲烷矿化等,其主要特征产物为Fe2+、S2-和CH4,共同产物为CO2、NH4+和PO43-.本实验通过对各实验组总无机碳(上覆水中DIC与顶空中CO2浓度之和,TIC)、CO2、CH4和上覆水中NH4+、PO43-、Fe2+、S2-的浓度制成箱线图,可得出其释放速率的均值,并比较各组释放速率之间的差异性.由图 7可知,与2个对照组相比,×1倍组和×20倍组的TIC、CO2、Fe2+和S2-平均释放速率显著较高,且除CO2平均释放速率外,×20倍组的平均释放速率均显著大于×1倍组.这表明藻屑添加使得沉积物的总矿化、铁还原和SO42-还原速率增大,且藻屑密度越大,其平均释放速率越大.而×1倍组的CH4、NH4+、PO43-和S2-平均释放速率与加泥对照组差异性较小,却远小于×20倍组,这表明少量藻屑添加对SO42-还原、产甲烷矿化和有机质氮磷的矿化无显著影响,大量藻屑添加则对其有明显的促进作用.另外,加藻对照组的PO43-平均释放速率显著大于×1倍组和加泥对照组,这表明沉积物对PO43-有明显的吸附作用.因此,藻屑添加密度与有机质总矿化速率、铁还原速率和SO42-还原速率均呈正相关,而大量藻屑添加则可以增大沉积物有机质的各个矿化途径的释放速率,使得沉积物成为各种污染物释放的重要污染源,这势必为蓝藻的生长繁殖作出贡献,并对污染物的地球化学循环带来影响.
|
图 7 各实验组碳(a、b、c)、氨氮(d)、磷酸盐(e)、亚铁(f)和硫离子(g)的平均释放速率 Fig.7 The average release rates of carbon (a, b, c), ammonia nitrogen (d), orthophosphate (e), ferrous (f) and sulfur (g) in each treatment |
1) 通过设置不同密度藻屑处理组和对照组模拟蓝藻堆积对沉积物矿化过程的影响研究,结果表明,藻屑添加到沉积物表面,降低了上覆水pH值,改变了沉积物生物酶的活性.实验初期各处理组的上覆水pH值波动越大,后期较为平稳,上覆水pH值反映了沉积物微生物活性的变化过程.与对照组相比,×1倍组的转化酶活性较高,其沉积物有机质中碳的转化和微生物的呼吸强度较大;而×20倍组蛋白酶和碱性磷酸酶活性较高,其SWI的碳、氮、磷循环较快,有机磷矿化强度较高.
2) 藻屑添加对沉积物有机碳的矿化途径和释放速率产生显著影响.一方面,×1倍组和×20倍组的TIC平均释放速率分别为3.37和4.54 mg/(L ·d),均大于两个对照组,且藻屑添加密度与有机碳的平均矿化速率呈正相关.另一方面,×1倍组的CO2平均释放速率最大,达2.15 mg/(L ·d),表明少量藻屑添加主要增强有机碳的好氧矿化;×20倍组的CH4平均释放速率远远大于其他组,达0.255 mg/(L ·d),表明大量藻屑添加主要增强有机碳的产甲烷矿化.
3) 少量藻屑添加(×1倍组)对沉积物中NH4+和PO43-的扩散和释放影响均较小;而大量藻屑添加(×20倍组)则影响较大,其NH4+和PO43-的平均释放速率均明显大于其他实验组,达0.223和0.075 mg/(L ·d).与对照组相比,藻屑添加对Fe2+、S2-的释放同样具有显著地促进作用.因此,大量蓝藻堆积明显促进沉积物的碳氮磷矿化,释放大量CO2、CH4和氮磷营养盐至上覆水中,对湖泊水环境造成污染,为蓝藻的生长繁殖作贡献.
致谢: 本研究得到陈丙法师兄、刘高飞和汪欣师妹的帮助,在此表示诚挚的谢意!
| [1] |
Li K, Guan BH, Liu ZW et al. Experiments on decomposition rate and release forms of nitrogen and phosphorus from the decomposing cyanobacterial debris. J Lake Sci, 2011, 23(6): 919-925. [李柯, 关保华, 刘正文. 蓝藻碎屑分解速率及氮磷释放形态的实验分析. 湖泊科学, 2011, 23(6): 919-925. DOI:10.18307/2011.0614] |
| [2] |
Gudasz C, Bastviken D, Steger K et al. Temperature-controlled organic carbon mineralization in lake sediments. Nature, 2010, 466(7305): 478. DOI:10.1038/nature09186 |
| [3] |
Zhu MY, Zhu GW, Zhao LL et al. Influence of algal bloom degradation on nutrient release at the sediment-water interface in Lake Taihu, China. Environmental Science and Pollution Research, 2013, 20(3): 1803-1811. DOI:10.1007/s11356-012-1084-9 |
| [4] |
Shang LX, Ke F, Li WC et al. Laboratory research on the contaminants release during the anaerobic decomposition of high-density cyanobacteria. J Lake Sci, 2013, 25(1): 47-54. [尚丽霞, 柯凡, 李文朝等. 高密度蓝藻厌氧分解过程与污染物释放实验研究. 湖泊科学, 2013, 25(1): 47-54. DOI:10.18307/2013.0107] |
| [5] |
Danger M, Cornut J, Chauvet E et al. Benthic algae stimulate leaf litter decomposition in detritus-based headwater streams:A case of aquatic priming effect?. Ecology, 2013, 94(7): 1604-1613. DOI:10.1890/12-0606.1 |
| [6] |
Chen BF, Feng MH, Shang LX et al. Effects on cyanobacterial growth and water quality after harvesting accumulated cyanobacteria in autumn:an in-situ experiment in Lake Chaohu. J Lake Sci, 2016, 28(2): 253-262. [陈丙法, 冯慕华, 尚丽霞等. 秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验. 湖泊科学, 2016, 28(2): 253-262. DOI:10.18307/2016.0203] |
| [7] |
Blanchet M, Pringault O, Panagiotopoulos C et al. When riverine dissolved organic matter (DOM) meets labile DOM in coastal waters:changes in bacterial community activity and composition. Aquatic Sciences, 2017, 79(1): 27-43. DOI:10.1007/s00027-016-0477-0 |
| [8] |
Zhu P, Hua ZL, Zhang RY et al. Characteristics of spatial distribution differences of spectrum of dissolved organic matter and nitrogen phosphorus pollution in Taihu Lake. Environmental Science Research, 2010, 23(2): 129-136. [祝鹏, 华祖林, 张润宇等. 太湖溶解有机质光谱和氮磷污染的区域分布差异特征. 环境科学研究, 2010, 23(2): 129-136.] |
| [9] |
Wang YR, Chen XC, Chen BF et al. The release effect of pollutants in sediment-water interface after algal-debris accumulated on sediments. Acta Scientiae Circumstantiae,, 2017(2): 1-18. [王亚蕊, 陈向超, 陈丙法等. 藻屑堆积对沉积物-水界面污染物的释放效应. 环境科学学报, 2017(2): 1-18. DOI:10.13671/j.hjkxxb.2017.0279] |
| [10] |
Wang YR, Chen XC, Fu XJ et al. The releasing characteristics of carbon, nitrogen and phosphorus from sediment under the influence of different densities of algal detritus. J Lake Sci, 2018, 30(4): 925-936. [王亚蕊, 陈向超, 付绪金等. 不同密度藻屑堆积下沉积物碳氮磷释放特征. 湖泊科学, 2018, 30(4): 925-936. DOI:10.18307/2018.0406] |
| [11] |
Attermeyer K, Tittel J, Allgaier M et al. Effects of light and autochthonous carbon additions on microbial turnover of allochthonous organic carbon and community composition. Microbial Ecology, 2015, 69(2): 361-371. DOI:10.1007/s00248-014-0549-4 |
| [12] |
Catalán N, Kellerman AM, Peter H et al. Absence of a priming effect on dissolved organic carbon degradation in lake water. Limnology and Oceanography, 2015, 60(1): 159-168. DOI:10.1002/lno.10016 |
| [13] |
Bianchi TS, Thornton DCO, Yvon-Lewis SA et al. Positive priming of terrestrially derived dissolved organic matter in a freshwater microcosm system. Geophysical Research Letters, 2015, 42(13): 5460-5467. DOI:10.1002/2015GL064765 |
| [14] |
Wu TT, Liu GF, Han SQ et al. Impacts of algal blooms accumulation on physiology ecology of water hyacinth. Environmental Science, 2015, 36(1): 114-120. [吴婷婷, 刘国锋, 韩士群等. 蓝藻水华聚集对水葫芦生理生态的影响. 环境科学, 2015, 36(1): 114-120. DOI:10.13227/j.hjkx.2015.01.015] |
| [15] |
Rozan TF, Taillefert M, Trouwborst RE et al. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay:Implications for sediment nutrient release and benthic macroalgal blooms. Limnology and Oceanography, 2002, 47(5): 1346-1354. DOI:10.1016/s1385-1101(00)00056-3 |
| [16] |
Tian LF, Hu JW, Qin FX et al. Distribation of heavy metal elements in the water body from Lake Hongfen. China Environmental Science, 2011(3): 131-139. [田林锋, 胡继伟, 秦樊鑫等. 重金属元素在贵州红枫湖水体中的分布特征. 中国环境科学, 2011(3): 131-139.] |
| [17] |
Canavan RW, Slomp CP, Jourabchi P et al. Organic matter mineralization in sediment of a coastal freshwater lake and response to salinization. Geochimica et Cosmochimica Acta, 2006, 70(11): 2836-2855. DOI:10.1111/j.1574-6941.1994.tb00088.x |
| [18] |
Wakeham SG, Canuel EA eds. Degradation and preservation of organic matter in marine sediments. Springer Berlin Heidelberg, 2006, 295-321. DOI:10.1007/698-2-009 |
| [19] |
Hyun JH, Mok JS, Cho HY et al. Rapid organic matter mineralization coupled to iron cycling in intertidal mud flats of the Han River estuary, Yellow Sea. Biogeochemistry, 2009, 92(3): 231-245. DOI:10.1007/s10533-009-9287-y |
| [20] |
Randlett ME, Sollberger S, Del Sontro T et al. Mineralization pathways of organic matter deposited in a river-lake transition of the Rhone River Delta, Lake Geneva. Environmental Science:Processes & Impacts, 2015, 17(2): 370-380. DOI:10.1039/c4em00470a |
| [21] |
Zhang Y. Study on eutrophication of Yuqiao Reservoir[Dissertation]. Tianjin: Tianjin University, 2011.[ [张亚.于桥水库富营养化研究[学位论文].天津: 天津大学, 2011.] ]
|
| [22] |
Moodley L, Boschker HTS, Middelburg JJ et al. Ecological significance of benthic foraminifera:13C labelling experiments. Marine Ecology Progress Series, 2000, 202: 289-295. DOI:10.3354/Meps202289 |
| [23] |
Naisse C, Girardin C, Davasse B et al. Effect of biochar addition on C mineralisation and soil organic matter priming in two subsoil horizons. Journal of Soils and Sediments, 2015, 15(4): 825-832. DOI:10.1007/s11368-014-1002-5 |
| [24] |
Editorial Board of Water and Wastewater Monitoring and Analysis Methods, Ministry of Environmental Protection of the People's Republic of China eds. Water and Wastewater Monitoring and Analysis Methods. 4th edition. Beijing: China Environmental Science Press, 2002: 243-250,254-257,670-671. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 243-250,254-257,670-671.]
|
| [25] |
Qian JL. Simultaneous determination of total nitrogen and total phosphorus in water by persulfate oxidation. Foreign Environmental Science and Technology, 1985(2): 42-49. [钱君龙. 用过硫酸盐氧化的方法同时测定水中的总氮和总磷. 国外环境科学技术, 1985(2): 42-49.] |
| [26] |
Schubert CJ, Klockgether G, Niggemann J et al. The Chlorin-Index:A new parameter for organic matter freshness in sediments. Geochimica et Cosmochimica Acta, 2002, 66(15A Suppl. 1): A689-A689. DOI:10.1029/2004GC000837 |
| [27] |
Xiang SL. Research progress on nutrients forms and interface process from lake sediments. Guizhou Agricultural Sciences, 2011(9): 204-208. [向速林. 湖泊沉积物营养盐的赋存形态及其界面过程研究进展. 贵州农业科学, 2011(9): 204-208.] |
| [28] |
Wu L, Jacobson AD, Chen HC et al. Characterization of elemental release during microbe-basalt interactions at T=28℃. Geochimica et Cosmochimica Acta, 2007, 71(9): 2224-2239. DOI:10.1016/j.gca.2007.02.017 |
| [29] |
Zhang L, Fan CX, Wang JJ et al. Space-time dependent variances of ammonia and phosphorus flux on sediment-water interface in Lake Taihu. Environmental Science, 2006, 27(8): 1537-1543. [张路, 范成新, 王建军等. 太湖水土界面氮磷交换通量的时空差异. 环境科学, 2006, 27(8): 1537-1543.] |
| [30] |
Feng M, Ngwenya BT, Wang L et al. Bacterial dissolution of fluorapatite as a possible source of elevated dissolved phosphate in the environment. Geochimica et Cosmochimica Acta, 2011, 75(19): 5785-5796. DOI:10.1016/j.gca.2011.07.019 |
| [31] |
Wang J, Jiang X, Zheng B et al. Effects of electron acceptors on soluble reactive phosphorus in the overlying water during algal decomposition. Environmental Science and Pollution Research, 2015, 22(24): 19507-19517. DOI:10.1007/s11356-015-5057-7 |
| [32] |
Zhang YH, Wu ZJ. Sedimentary organic carbon mineralization and its contribution to the marine carbon cycle in the marginal sea. Advances in Earth Science, 2019, 34(2): 202-209. [张咏华, 吴自军. 陆架边缘海沉积物有机碳矿化及其对海洋碳循环的影响. 地球科学进展, 2019, 34(2): 202-209.] |
| [33] |
Bianchi TS, Thornton DCO, Yvon-Lewis SA et al. Positive priming of terrestrially derived dissolved organic matter in a freshwater microcosm system. Geophysical Research Letters, 2015, 42(13): 5460-5467. DOI:10.1002/2015GL064765 |
| [34] |
Guenet B, Danger M, Harrault L et al. Fast mineralization of land-born C in inland waters:first experimental evidences of aquatic priming effect. Hydrobiologia, 2014, 721(1): 35-44. DOI:10.1007/s10750-013-1635-1 |
| [35] |
Guan R, Lu CW, He J et al. Diffusion fluxes of phosphorus across water-sediment interface in Lake Wuliangsuhai and Daihai. Journal of Agricultural and Environmental Sciences,, 2013, 32(8): 1609-1617. [关瑞, 吕昌伟, 何江等. 乌梁素海和岱海水-沉积物界面磷的扩散通量研究. 农业环境科学学报, 2013, 32(8): 1609-1617. DOI:10.11654/jaes.2013.08.018] |
| [36] |
Valdemarsen T, Quintana CO, Kristensen E et al. Recovery of organic-enriched sediments through microbial degradation:implications for eutrophic estuaries. Marine Ecology Progress Series, 2014, 503: 41-58. DOI:10.3354/meps10747 |
| [37] |
Zhao Y, Shan B, Tang W et al. Nitrogen mineralization and geochemical characteristics of amino acids in surface sediments of a typical polluted area in the Haihe River Basin, China. Environmental Science and Pollution Research International, 2015, 22(22): 17975-17986. DOI:10.1007/s11356-015-4873-0 |
| [38] |
Joshi SR, Kukkadapu RK, Burdige DJ et al. Organic matter remineralization predominates phosphorus cycling in the mid-bay sediments in the Chesapeake Bay. Environmental Science & Technology, 2015, 49(10): 5887-5896. DOI:10.1021/es5059617 |
| [39] |
Li H, Song CL, Cao XY et al. The phosphorus release pathways and their mechanisms driven by organic carbon and nitrogen in sediments of eutrophic shallow lakes. Science of the Total Environment, 2016, 572: 280-288. DOI:10.1080/01490451.2015.1099762 |
| [40] |
Spohn M, Kuzyakov Y. Phosphorus mineralization can be driven by microbial need for carbon. Soil Biology and Biochemistry, 2013, 61: 69-75. DOI:10.1016/j.soilbio.2013.02.013 |
| [41] |
Sun XJ, Qin BQ, Zhu GW. Release of colloidal phosphorus, nitrogen, and organic carbon in the course of dying and decomposing of cyanobacteria. China Environmental Science, 2007, 27(3): 341-345. [孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放. 中国环境科学, 2007, 27(3): 341-345.] |
| [42] |
Kostka JE, Gribsholt B, Petrie E et al. The rates and pathways of carbon oxidation in bioturbated saltmarsh sediments. Limnology and Oceanography, 2002, 47(1): 230-240. DOI:10.2307/3069135 |
 2020, Vol. 32
2020, Vol. 32 

