“世界最大的淡水鱼类灭绝:长江濒危动植物种保护的启示”[1],白鲟灭绝这一结论着实令人吃惊,这是继白鱀豚宣布功能性灭绝之后长江又一物种灭绝!更甚的是,长江专项调查报告显示,长江有分布记录的448种鱼类中有130余种未被采集到(占长江分布鱼类总数的29.9 %)[1],除白鲟外,还包括鲥、鯮以及白鱼类、裂腹鱼类、高原鳅类、鮡类、云南鳅类、银鱼类、鳑鲏类、光唇鱼类、类、鲀类等,说明长江鱼类自然种群整体衰退到了岌岌可危的状况!这些未被采集到的鱼类中,一些种类可能是因为资源极度稀少没有被采集到,物种还没有灭绝,但是一些种类如鲥、鯮等也可能和白鲟一样已经灭绝,因此亟待开展这130余种鱼类的进一步调查和评估.长江鱼类资源或水生生物保护,不能说没有重视和投入,例如自四川宜宾至长江口近3000 km的长江干流建立有自然保护区10处、国家级水产种质资源保护区11处,全长约1700 km,约占自宜宾以下长江干流总长的56.7 %,长江春季禁渔制度已实施了18年,增殖放流、各类环境影响补偿措施等投入以亿元计,但白鱀豚和白鲟灭绝,长江鲟自然种群野外绝迹①,中华鲟自2013年开始出现自然繁殖中断,2015年中断,2017-2019年连续中断!长江物种一个一个濒危、灭绝,系统的长江水生生物保护已是迫在眉睫!
① 2019年世界自然保护联盟(IUCN)——鲟鱼专家组评估报告,待发布.
Huang和Wang研究认为,如果不采取针对性措施,中华鲟在未来10~20年或将灭绝(野外灭绝)[2],并强调,回避或轻视长江水坝的影响,就难以准确认识中华鲟种群衰退的定量影响机制,也不可能采取针对性措施,应该对中华鲟保护工作进行全面反思、改革和创新[3],进一步研究认为,长江水坝的累积影响是导致中华鲟生存危机的主因,捕捞、污染、航运等其他因素对种群数量有一定不利影响[4].谢平认为,“干流大坝的建设对繁殖行为的影响是最大的原因”, “中华鲟体型巨大,生命周期长,生态可塑性小,完成生活史需要跨越近海和长江的巨大空间,对产卵的条件要求苛刻,因此,如它无法自然产卵,灭绝就是迟早的事情.在过去的近40年,虽然人工放流了数百万尾中华鲟,但成效不容乐观,对野生种群的补充微乎其微.因此,对鲟鱼濒危机制(特别是自然繁殖条件的丧失)和人工放流效果的重新评估以及对救鱼对策的重新调整已刻不容缓”[5].
2018年,习近平总书记在武汉召开的深入推动长江经济带发展座谈会上的讲话指出“长江病了,而且病得还不轻”.关于如何治好“长江病”,他说“要科学运用中医整体观,追根溯源、诊断病因、找准病根、分类施策、系统治疗”.本文通过系统梳理中华鲟生活史和相应栖息地特征,回顾长江重大涉水工程等人类活动时间节点和保护措施实施情况,分析目前的保护困境,提出以中华鲟为代表的长江珍稀特有鱼类保护策略或思路调整建议.长江中华鲟自然分布贯穿长江上中下游和近海,是长江水生生物的典型代表,其保护涉及地域广、领域多,涵盖渔业、工程、政策法规和长江水域及沿岸社会经济方方面面,其成败不仅仅是一条鱼的保护成败,更是长江生物多样性和长江水生态保护成败的关键,影响巨大!
1 中华鲟生活史、行为和栖息地现生鲟形目鱼类2科6属27个种,多数形体硕大,都分布在北半球,为亚冷水性鱼类,要求较广阔的水面,分布于大江大河和近岸浅海地带,均具有洄游习性.依照不同种类的洄游特性可分3种生活史类型:溯河产卵洄游型(anadromy)、咸淡水双向迁徙型(freshwater amphidromy)和河川洄游型(potamodromy)[6].溯河产卵洄游型:生活史的主要阶段在海洋中度过,性成熟时上溯到淡水河流中产卵,繁殖后亲鱼再返回海洋,子代也行降河洄游,进入河口咸淡水后陆续进入海洋生长.鲟鱼的绝大多数种类属于这种生活史类型,包括欧洲鳇、尖吻鲟、大西洋鲟、俄罗斯鲟、闪光鲟等15种,中华鲟也属于这一类. Sulak和Randall认为,这种溯河产卵洄游可能是一种次生适应(secondary adaption),是由于鲟鱼基本属于底层摄食类型,在进化史上,它们开发河口和近岸丰富的底层无脊椎动物资源,进而形成了溯河洄游习性[7].
1.1 自然地理分布与种群结构特征中华鲟自然地理分布区为东亚大陆架及其主要注入河流(图 1),自北向南包括黄海的朝鲜半岛西部,东至日本九州岛附近,向南过台湾海峡,最南至海南的万宁海域,沿海岸线分布于水深不及200 m的大陆架,可进入沿海大型河流.有记载的河流包括黄河、长江、钱塘江和闽江及珠江的西江.这些河流中除了珠江西江和长江之外,其他河流历史上是否形成过产卵场或地理种群不得而知. 1911年6月8日曾经在福建闽江的龙潭阁网捕到一尾鲟鱼(长349.47 cm,重198.85 kg),次日在林浦放生,从鱼体照片的形态特征和个体大小判断,应该是中华鲟.清朝时的林浦,系现在的福州市仓山区城门镇,距离闽江口河道约40 km.
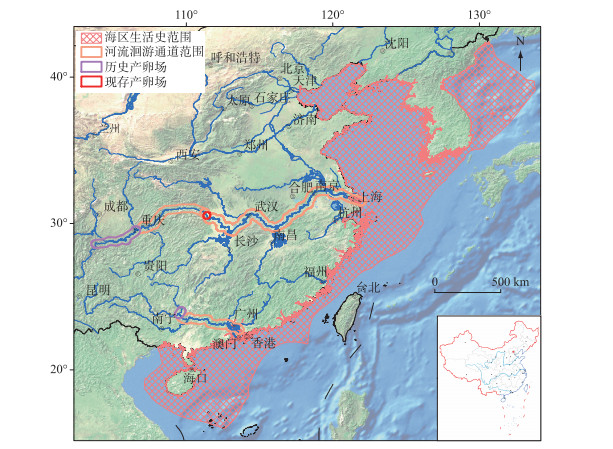
|
图 1 中华鲟生活史空间范围及产卵场的分布 Fig.1 Life history range and spawning grounds of Chinese sturgeon |
分布在珠江口的鲟鱼,上溯到西江象州附近产卵繁殖,曾经有学者将其命名为珠江鲟[8-9],因形态等方面与长江分布的中华鲟差距不大,普遍认为是中华鲟的珠江种群.中华鲟珠江种群是全球鲟鱼类越过北回归线的两个种群之一,另外一个种群是北美尖吻鲟亚种海湾鲟(A. oxyrinchus desotoi).中华鲟珠江种群资源稀少,研究资料缺乏.最近的目击记录是:1996年2月16日,在珠江西江武宣二塘江段的河道整治炸礁中,一尾体重约250 kg的中华鲟被炸死,标本现存于广西水产研究所;1998年2月24日,浔江梧州渔民误捕一尾体重约250 kg的中华鲟,后被放生(李新辉等,未发表资料).珠江种群繁殖时间为春季,生殖洄游时间被认为是1-4月,在西江的洄游路线为珠江口、西江、浔江、黔江至柳江河口干流江段,广西象州县境石龙三江口为西江中华鲟的主要产卵场,三江口汇合处岸上屹立一块巨石,上刻有“鱼母石”,认为中华鲟产卵场就在附近,产卵时间集中在3月中旬至4月上旬,当年孵出的仔稚幼鱼在桂平、藤县至梧州沿江各地时有捕获[10]. 1834年Gray定名中华鲟时,所用的模式标本(体长32 cm)可能来自珠江水系[9].
中华鲟长江种群数量多,每年的繁殖和洄游路线稳定,研究较多.据1981-1996年所采集样本(共计415尾个体)的实测数据统计表明(表 1),长江中华鲟繁殖群体平均体长为275.9 cm,平均体重为144.0 kg,雌雄性比接近1 :1.繁殖群体平均年龄为17.2龄,雄性和雌性平均年龄分别为14.2龄(范围为8~27龄)和20.7龄(范围为14~34龄).我们观测到中华鲟最大年龄为34龄,结合我们在北京海洋馆的养殖实践,中华鲟个体寿命可能为40龄左右.通过第一胸鳍棘或匙骨,部分高龄个体可见致密生殖轮,但是生殖间隔和有过几次生殖则难以判断.我们只能区别“有”生殖轮(重复繁殖的个体)和“无”生殖轮(初次繁殖的个体),结果显示初次繁殖的群体平均年龄为14.3龄(范围为8~26龄),雄性和雌性平均初次繁殖年龄分别为12.5龄(范围为8~25龄)和16.8龄(范围为14~26龄),并发现初次繁殖群体占总群体的比例为57.2 %.葛洲坝截流之前的1972-1974年,其雄性和雌性第一次性成熟亲鱼的比例分别为17 %和6 % [11],相比之下1980s-1990s期间初次繁殖比例更高,说明1970s阶段的捕捞压力小得多.此外,通过超声波跟踪的直接证据,发现中华鲟雌性和雄性两次繁殖的周期(生殖周期)分别为4年和3年[12].人工养殖中华鲟生殖周期可缩短,依营养状况和养殖条件不同而存在差异,雌性为2~5年,雄性为1~3年.养殖中华鲟性腺最终成熟的季节与野生中华鲟一致,都是10月份,这是遗传决定的,曾试图春季催产,未获成功.
| 表 1 1981-1996年长江湖北段中华鲟繁殖群体种群结构特征* Tab. 1 Structural characteristics of spawning stock of Chinese sturgeon in Hubei Province of the Yangtze River from 1981 to 1996 |
中华鲟在淡水中出生,海洋中生长.长江中华鲟种群生活史全过程见图 2,我们将中华鲟生活史分成从自然繁殖过程(过程A)开始,经历孵化(过程B)、藏匿(过程C)、边滩浅水区索饵(过程D、E)、到次年抵达长江口淡海水的转化过程,再逐渐入海,在海洋中索饵生长直至性成熟(海洋索饵生长发育(过程I),此间经历漫长时间,平均为14.3年);即将性成熟的中华鲟(可能靠地球磁力线导航)找到长江口(过程K),每年夏季开始溯江而上(过程L、M,可能靠嗅觉导航,很少迷途入支流), 秋季最早到达的个体可到达产卵场江段(过程N),11月至次年部分晚到的个体继续上溯到达产卵场江段或其下游深潭中越冬(过程O),春季及夏季在产卵场下游江段和产卵场之间依水情变化来回迁移,秋季再进入产卵场,进行自然繁殖,其经历A~R 18个过程,完成了中华鲟第1次生殖的1个生命周期.由图 2还可见,中华鲟从孵化到入海,在淡水经历约9~11个月(平均10个月),而产卵群体进入长江口到产卵结束后返回海洋则约需要经历17~19个月(平均18个月).如果按照中华鲟平均初次性成熟年龄计算(表 1),雌性和雄性分别为16.8龄和12.5龄,生殖周期按照雌性约4年、雄性约3年计算,雌性和雄性分别有(34-16.8)/4=4.3次和(27-12.5)/3=4.8次,即雌性和雄性分别有约4次和5次的繁殖机会.可多次繁殖的中华鲟,则多了S和T两个过程,周而复始,年复一年.中华鲟其他的时间都在海洋中度过,按照其平均第1次性成熟时间为14.3年(即172个月)计算,淡水两段生活史历时都取中间值,则中华鲟淡、海水生活史履历比例约为长江:海洋=29 :172≈1 :9.从图 2还可知,长江干流常年都有中华鲟产卵群体存在,特别是在中华鲟产卵季节,产卵场江段存在中华鲟的两个股群,即性腺还没有发育成熟的当年股群和性腺已经发育成熟的上一年股群.冬季至次年初夏在长江中下游边滩和沙洲浅水区都有中华鲟仔稚幼鱼存在,夏季中华鲟幼鱼出现在长江口.长江中华鲟繁殖时间为每年的10-11月份,高峰在10月下旬至11月上旬,历史上一般都有两批次产卵,也有的有3批[9].三峡水利工程建成后,产卵期被迫推迟了近一个月,产卵多在11月下旬,1年只有1次产卵.

|
图 2 长江中华鲟生活史模式图 Fig.2 Life history of Yangtze population of Chinese sturgeon |
1) 过程A:10月是中华鲟的繁殖季节,葛洲坝截流之前,金沙江下游宜宾屏山一带,性成熟的中华鲟寻找适宜的江段,在具有特殊地形构造和适宜的卵砾石河床,当江水冲刷干净江底后,在适宜的时间,或有某种自然信号,或者是必然中的偶然,中华鲟开始批量产卵,交配排卵时间非常快,在葛洲坝下产卵场我们观察大致可持续24 h[13],受精卵撒播在产卵场江底卵砾石缝隙中孵化. 2)过程B:在18~19℃水温条件下,受精卵在卵砾石缝隙中经历125 h左右孵化. 3)过程C:刚孵出的仔鱼(平均全长13.2 mm)有垂直游泳习性.随着仔鱼尾巴剧烈摆动,头朝上、尾朝下游到水面,稍后尾巴停止摆动做自由落体运动,产生周期性垂直游泳的特殊行为——这是所有鲟鱼类固有的属性.中华鲟仔鱼垂直游泳高峰约持续2天,随快速流动的江水把仔鱼带向下游.如果按照金沙江下游和长江上游中华鲟产卵场江段的平均流速为1.0~1.5 m/s计算,48 h中华鲟仔鱼可以漂流172.8~259.2 km,如果是在屏山产卵,可漂流到泸州江段;第3~8日龄有部分仔鱼继续漂游,部分下沉江底,少数沉入江底的仔鱼藏匿洞穴或卵石缝隙;第8~10日龄钻洞高峰期,趋光性减弱;从11日龄开始有些仔鱼开始出洞,趋光性恢复. 4)过程D:12日龄(平均全长32 mm)开口摄食,开口摄食后便进入后期仔鱼时期,这是仔鱼阶段的一个重要转折期,这时中华鲟仔鱼全部贴底,全部选择白色底质栖息地,全部趋光. 13~17日龄还有少量仔鱼待在洞穴中,但比例逐日减少,18日龄以后全部出洞[14-15].出洞不久的仔鱼,在摄食场要停留一段时间. 5)过程E:有相当一部分仔稚鱼较长时间地停留在长江中下游摄食[16].值得指出的是,不论是垂直游泳行为还是趋光性和藏匿行为,不同个体的发生时间均存在差异,这种差异性或多样性使中华鲟仔稚鱼在长江中下游分散栖息和摄食,是一种提高中华鲟群体成活率的适应性行为.研究发现,中华鲟子代在长江中下游滞留时间长短或降河洄游速度与螺山水文站冬季至夏季的水位呈现正相关关系,即长江中下游水文条件影响中华鲟子代到达长江口的时间,推测水位影响长江河滨带浅水区的面积或食物丰度,从而影响中华鲟在长江中下游的洄游[17].关于中华鲟在长江中天然饵料缺乏研究,根据中华鲟的口位、口裂、早期生活史消化道特征以及中华鲟苗种人工培育过程中对食性的判断,中华鲟子代在中下游的食物为沿岸带浅水区底栖动物,如水丝蚓、摇蚊幼虫或浮游动物. 6)过程F:4-7月中华鲟幼鱼(7~38 cm)陆续到达长江口水域,随潮汐作用,在长江口滩涂上觅食底栖动物,虾、蟹是其喜好饵料,在此调整机体渗透压并完成相关组织器官的适应性发育,为海洋生活做准备;7)过程G:7月下旬开始,陆续离开长江口滩涂,进入长江口浅海区域生活.
1.2.2 海洋生活史过程I:中华鲟幼鱼进入海洋后的生活史研究甚少.根据误捕记录,中华鲟幼鱼和亚成体在我国东海、黄渤海和台湾海峡及南海北部近岸水域都有分布记录,包括广东汕头,福建厦门、福州、宁德,浙江温州、台州、舟山、宁波,上海,江苏,山东青岛,辽宁大连等,以长江口渔场和舟山渔场为多[9].根据我们近年人工放流后的卫星遥测和误捕监测结果,中华鲟在海区的栖息范围南至汕头海域,北至朝鲜东部海域,南北纬度跨15.905°.从经度上看,中华鲟主要在大陆架水域活动,以离岸15 km范围内的近岸水域活动为主,最远迁移离岸距离为350 km.根据误捕记录,中华鲟可能在温度高的夏季多分布在北边海域,冬季在南部偏多,可能有季节性南北洄游习性,以适应海温和食物丰欠的变化.解剖发现,长江口中华鲟以鲬属、舌鳎属鱼类、端足类、虾蟹和蚬等底栖类鱼类和软体动物为主要食物.
1.2.3 生殖洄游性腺即将成熟的中华鲟,如何找到长江口不得而知,或许和其他洄游性鱼类[18]机制类似,依靠地磁场的导航进入长江口(过程K),然后依靠嗅觉(中华鲟的陷器)导航[19],顺流而上(过程L~M),很少误入歧途进入支流,总是能够回到出生的“家乡”产卵繁殖(过程N).这可能是由于其在早期生活史阶段,依靠嗅觉记下了长江沿途环境特征,成为印痕行为[20],这是被学术界普遍接受的观点,这种印痕行为能力只有在早期生活史才有,如果人工放流年龄过大的中华鲟,可能就没有印痕行为能力了[21].
1.2.4 长江中的关键栖息地中华鲟的栖息地研究主要集中在长江生活史阶段.如前所述,中华鲟进入长江后,并非直接到达产卵场,而是等待翌年自然繁殖,多数会选择在产卵场下游不远的深潭处栖息,完成脂肪的转化和性腺的逐步成熟过程,这些便是中华鲟的产前栖息地.我们通过水声学探测、超声波跟踪并结合历史捕捞数据,发现葛洲坝下中华鲟自然繁殖中华鲟的产前栖息地主要位于葛洲坝下隔流堤左侧的深潭(距葛洲坝2 km)、枝城梅子溪(距葛洲坝约55 km)、石首调关(距葛洲坝约280 km)等江段[22].这些江段的水深多超过40 m,深水区范围较大,且位于河道转弯处.
葛洲坝截流前,中华鲟产卵场的分布江段为金沙江下游冒水江段至重庆以上的长江江段,分布范围超过600 km,分布数量达19处.其中,比较著名的中华鲟产卵场有金沙江下游的三块石、偏岩子和金堆子产卵场,长江上游的铁炉滩和望龙碛产卵场.葛洲坝截流后,中华鲟的生殖洄游路线被切断,原有的产卵场全部无法利用,所幸在葛洲坝近坝约4 km的江段形成了唯一已知的稳定产卵场,然而其面积不足葛洲坝截流前的1 %,中华鲟在此产卵场连续31年发生了自然繁殖活动,直至2012年以来7年中5年产卵中断.四川省长江水产资源调查组[9]对长江上游中华鲟历史产卵场进行了定性的描述:上有深水急滩,中有深洼的洄水沱,下为宽阔石砾或卵石碛坝浅滩;产卵场必在河流转弯或转向的外侧,必须具有使河流转向的峡谷、巨石或矶头石梁延伸于江中.我们近年来对葛洲坝下产卵场的研究也发现了类似的特点,并对产卵场的非生物环境特征进行了定量研究[23].
中华鲟受精卵在葛洲坝下产卵场孵化后,鲟苗随江漂流,在到达长江口索饵场之前,需在葛洲坝以下的长江中下游江段洄游、索饵、藏匿、栖息6个月以上.根据庄平[14]和王恒[24]等的行为学研究结果,推测长江中下游中华鲟子代的索饵场主要位于一些河滩沙洲以及江心洲的浅水区.这些区域是中华鲟子代所需饵料生物资源丰富的区域,自然河滨带生境也提供了其必要藏匿场所.值得注意的是,开口饵料的种类,特别是饵料的适口性和投喂时机是中华鲟苗种人工培育成功的关键,在自然条件下也不例外,即在葛洲坝截流后,中华鲟仔鱼能否在长江中游找到适口的饵料并及时开口摄食,是影响中华鲟早期生活史的关键因素之一.长江中下游河滨浅水区的丰欠除受到各种人类活动侵占或破坏之外,还受洪水或水文条件的显著影响.丰水年份显然河滨浅水区面积大,食物丰富,有利于中华鲟仔稚幼鱼生长和成活.但目前这方面缺乏研究.
长江口营养盐和底栖动物丰富,是中华鲟幼鱼进入海洋前的关键索饵场,借助东海高盐水与长江中淡水剧烈交汇,幼鱼在此育肥并完成渗透压调节过程.长江口索饵场分布范围较广,上游至江苏浒浦江段,下至水深3~5 m潮间带下的咸淡水区域.其中,靠近崇明岛东侧是主要的索饵场,其范围东西长约25 km,南北宽约20 km,北起崇明岛东滩的东旺沙南部,南至横沙岛东滩,西起奚家港至长兴岛中部.中华鲟夜间随潮水聚集到潮间带索饵,白天则聚集在远离岸边的深水区避光和调节渗透压,随着对海水的逐渐适应,由浅滩低盐水域向长江口外深水高盐水域扩展.
2 长江流域环境变迁与中华鲟保护建国以来长江沿岸8省(市)的国内生产总值增长1600多倍,其中改革开放以来增长270多倍;工业总产值,建国以来增长5000多倍,其中改革开放以来增长250多倍(图 3).与经济社会发展相同步的是人类活动强度和范围的增大以及生态环境状况的恶化[25-27].

|
图 3 四十年来长江流域梯级水电开发、航运和GDP为代表的人类活动发展变化 Fig.3 Development and change of human activities represented by cascade hydropower development, shipping and GDP in the Yangtze River Basin in the past 40 years |
始于30多年前的“西电东送”,在长江上游修建了大量水电工程. 2012年2月《长江流域综合利用规划》(2012-2030年)发布后,上游干流与主要支流又规划了若干水电站,形成梯级开发.这些水电闸坝的建设导致了生境破碎化和生境条件改变,各水电工程的下闸蓄水影响了中下游的水温节律和水沙状况,而水库的反季节调蓄影响了中下游的水文节律,进而影响水生态系统的变化以及部分高等水生生物多样性,导致种群的衰退[28-29].
建国后,围湖造田、岸带开垦等导致了第一波的江湖阻隔、河滨带消落区压缩,使得水生生物栖息地空间破碎化;改革开放以来,因为城市化发展、人类活动强度增大,导致了第二波的自然河滨带、消落区丧失以及水生生物栖息地空间压缩和功能退化.据不完全统计,1940s末以来,长江大通以上中下游地区有1/3以上的湖泊面积被围垦,围垦总面积超过13000 km2,因围垦而消亡的湖泊达1000余个[30].长江中下游通江湖泊由102个减少至如今的2个(洞庭湖和鄱阳湖),而其面积还在持续萎缩[31]. 1995-2015年,长江中下游区域的人类活动高强度带面积增加,低强度带面积减少.各强度带的人类活动强度平均值均呈增长趋势,强度带等级越高,平均值增幅越大[27].
改革开放40年来,长江水系水路货运量新增37倍,其中干流水路货运量新增59倍[32].长江航道通航条件和支持保障设施大为改善,长江干线1907 km航道得到治理,长江口深水航道全面建成,南京以下12.5 m水深航道实现贯通,荆江“瓶颈”被初步打通,干支联通成网,长江干线全面建成高等级航道,并实现昼夜通航.长江港口专业化、规模化、现代化程度不断提高,亿吨大港从无到有,现在达到14个;万吨级生产性泊位从寥寥无几发展到587个;长江干线形成了3大航运中心、5个自由贸易区、22个主要港口、26个水运开放口岸.长江水系14省市拥有内河货运船舶近12万艘,船舶大型化、专业化、标准化水平日益提升,长江干线货船平均吨位从改革开放初期的150 t提升到1780 t,增长近11倍.
由于三峡蓄水导致水体含沙量明显减少,对河床的冲刷日益明显,中华鲟产卵场江段沉积细砂和粗砂区域面积显著减少,河床卵石缝隙充塞度明显下降,导致中华鲟自然产卵位点的改变和迁移,进而影响中华鲟自然产卵场的繁殖适合度,影响中华鲟自然繁殖的规模和效果[33](图 4). Huang和Wang [2]研究认为,1981年葛洲坝的建设将中华鲟生殖洄游距离缩短了1175 km,性腺发育推迟37天,进而导致有效繁殖群体数量下降到原来的24.1 %,产卵场环境容量下降到原来的6.5 %. 2003年三峡水库蓄水运行以后,冬季水温升高约4℃,春季水温降低约4℃,夏、秋季水温升高约3℃,长江上游向家坝、溪洛渡、乌东德大坝等梯级电站的修建和下闸蓄水,进一步加剧水温滞后效应,致使中华鲟繁殖季节的水温进一步偏高,性腺发育进一步延迟、自然繁殖窗口期进一步缩短,抑制了其繁殖活动,有效繁殖能力下降到原来的0~4.5 %,葛洲坝阻隔还是导致中华鲟产卵群体性腺退化的原因[34].关于葛洲坝水利工程导致中华鲟性腺退化的问题存在争论,据我们观察,在1980s即葛洲坝截留后的约10年内退化严重[11],但是后续的观察发现,性腺退化问题有明显缓解[35],其机制仍然不清楚.监测研究表明,随着长江航运船舶数量和吨位的增加,中华鲟亲体周期性浮出水面被船舶误伤致死的事件日益频繁,船舶振动与噪音对栖息中华鲟的影响不可避免,也是导致部分中华鲟性腺退化的原因.中华鲟仔稚幼鱼赖以生存的河滨浅滩和江心洲沙滩栖息地被大量的航道、码头、防洪工程、桥梁、城市景观工程和挖沙采石作业所侵占或破坏,三峡蓄水清水下泄导致长江中游河道下切,秋、冬季及早春,河滩浅水区面积减小,进一步影响中华鲟仔稚幼鱼的索饵.此外,2005-2007年,葛洲坝下游因二江电厂区来水导致的“横波”影响通过葛洲坝1号船闸船舶的航行安全,由中国长江三峡工程开发总公司建设“葛洲坝下游河势调整工程”——一是大江下游新建隔流堤,二是二江下槽浅滩移除工程.结果二江下槽浅滩移除工程导致了下产卵区消失,新建隔流堤覆盖了上产卵区,后续多年监测发现,产卵区被迫上移到大江电厂下更狭小的范围,直接影响了中华鲟的自然繁殖效果[17, 22-23].
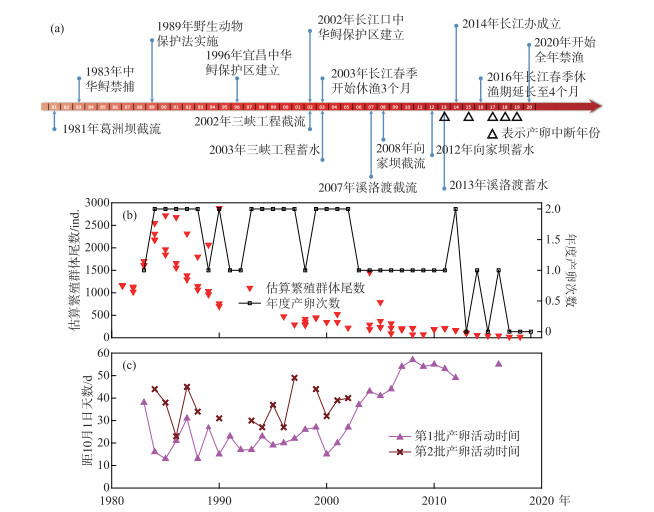
|
图 4 40年来中华鲟主要保护措施和自然种群变化 Fig.4 Conservation measures, population number & natural reproduction of Chinese sturgeon in the past 40 years |
由鱼类驱动的生态服务功能非常强大[36],我们几乎还没有意识到这些,水域生态系统特别是淡水生态系统远没有陆地生态系统被了解和重视.陆生动物如以大熊猫、东北虎为旗舰或伞护物种的保护体系,可以拿出大片土地和森林来进行严格的系统性保护.如研究显示,大熊猫保护的生态服务远比投入大[37].自葛洲坝建设论证开始,国家就给予了中华鲟高度的关注,目前中华鲟也被认为是长江生物多样性保护的旗舰物种.中华鲟曾经较广泛分布在我国沿海和长江、珠江、黄河等水域,特别是长江种群,其分布跨度大,在全球也属于迁徙距离较长的物种之一[38],从丹东到长江口海上直线距离约为1000 km,从长江口上溯至金沙江下游老君滩的距离约为3500 km.中华鲟在生态系统中的生态功能缺乏研究.中华鲟为巨型溯河产卵洄游性鱼类,在海洋生态系统和淡水生态系统之间起什么样的联系作用不得而知!中华鲟在海洋主要摄食底栖鱼类和软体动物,摄食量大,性成熟后携带海洋营养物质游到长江上游、金沙江下游,沿途不摄食,只为去出生的地方完成繁殖使命.长江上游尤其是金沙江干流的营养物质相对匮乏,中华鲟在长达600 km江段产卵,性成熟的雌鲟的性腺量一般占体重的20 %以上,到产卵结束,其约35 %的体重消耗都留在了长江.假设中华鲟每年上溯群体2000尾[9],其生物量为57.6 t,这些“高级”营养物质(主要是精子和卵子),在短期内可以极大滋养这里的圆口铜鱼、铜鱼、长鳍吻鮈和黄颡鱼等数十种长江上游特有鱼类(这些食卵鱼类也是监测中华鲟产卵发生的重要指示物种).世界其他鲟鱼分布的河流报道有大量食鲟鱼卵鱼类是很罕见的,说明中华鲟与长江上游特有鱼类之间可能已经建立了某种稳定的联系.中华鲟在产卵洄游途中不摄食,或许是因长江中上游和金沙江干流食物较匮乏,中华鲟无法获得食物,故需要在海洋中积累足够的营养,以完成其繁衍使命,延续物种!
我国秋季繁殖的生物尤其是鱼类很少,中华鲟可能是一个特例,通过长期的进化,中华鲟选择了秋季繁殖策略,其生态意义值得研究!由于中华鲟生命周期较长,洄游范围几乎跨越半个中国,在其生活史过程的30多年里,所到之处,环境痕迹留在其体内,或许通过现代的监测和检测手段还原其生命旅程以记录环境变迁很有意义.中华鲟为大范围洄游的物种,进化历史长,自然种群的衰退或灭绝暗示其生存环境状况下降到了一个危险等级,敲响了长江生态安全的警钟!保护中华鲟,不仅仅是单纯保护一个物种,而是通过中华鲟及其栖息地的保护与修复,推动长江水生态系统整体得到修复.从生态意义和社会效应上来讲,如果说中华鲟是“水中大熊猫”也不为过!大熊猫所带来的生态服务价值远远大于其投入[37].但是,如果保护“水中大熊猫”中华鲟,停留在口头,没有体现在行动上,中华鲟人工群体的可持续、野生种群的恢复都可能会落空. 《中华鲟拯救行动计划(2015-2030年)》由我国原农业部在2015年颁布,是农业部第一个正式颁布的关于水生野生动物单物种保护的行动计划.然而,行动计划颁布以来,还没有获得财政专项支持,农业部长江办努力筹集资金组织开展了一些监测、人工群体普查和保种点建设等,急需启动的“陆-海-陆”保种工程、增殖放流和栖息地调查与修复等系列行动计划的主体内容仍然没有得到落实.保护宣传方面,需要唤起社会公众的广泛响应参与,特别是公众对中华鲟栖息地范围的了解和保护意识提升到等同于大熊猫的地位任重道远.或许在不知不觉中,像白鲟一样,中华鲟野生种群也会悄声无息地离人类而去.幸好,我们还保存了一批中华鲟人工繁殖后代,不至于像白鱀豚和白鲟那么悲哀!
Wilcox[39]于1984年最早提出伞护种的概念,他认为“伞护种”就是选择一个合适的目标物种,这个目标物种的生境需求能涵盖其他物种的生境需求,从而实现对该物种的保护,同时也为其他物种提供了保护伞,这种目标物种的生境需求应综合其他种类生境需求的信息.中华鲟因地理分布范围相对较大,生活史过程和种群丰度与其栖息的区域环境质量息息相关,中华鲟是国家一级保护动物,在目前渔业法“违法成本低”的现实情况下,中华鲟的保护为其同域分布的物种提供了很好的保护作用,这在执法层面显得尤为重要,故加强对中华鲟自然种群及其栖息地的保护,无疑能够起到伞护的作用.同时,中华鲟在物种进化、江-海联系、物种的遗传资源等方面均具有重要价值,中华鲟个体硕大,形态和行为独特,容易引起公众的关注和喜爱,作为长江乃至我国水生生物保护的旗舰物种都是非常合适的!
3.2 误区2:对影响中华鲟自然种群濒临灭绝的主因和人工增殖放流认识不统一黄真理和王鲁海[3]回顾了葛洲坝水利枢纽建设救鱼论证过程:论证初期,在救鱼对象和保护或补偿措施方面存在很大分歧,中华鲟被选为唯一的救护对象,葛洲坝救鱼论证结果没有考虑白鲟为救护对象是非常遗憾的,限于篇幅另文讨论.对中华鲟保护提出的禁捕、自然繁殖保护、网捕过坝和人工繁殖放流措施被采纳,建设鱼道被否定.并认为[6],中华鲟目前濒临灭绝的局面是葛洲坝和三峡等水坝对中华鲟的影响被忽视了.本文同意此观点.但对于葛洲坝修建鱼道的争论,本文认为,在葛洲坝修建中华鲟上行和下行都有效的过鱼设施,在葛洲坝建设时期尚不具备技术条件,即使目前考虑在三峡大坝加建过鱼设施,可解决中华鲟上行过坝问题,体形硕大的中华鲟亲鱼下行问题也很难解决,仔鱼下行越过110 m水头大坝存活几率不大.当然,不反对加强过鱼设施研究,解决其他中小型鱼类的上行需求和下行的保护问题.中华鲟的人工繁殖放流,被认为是弥补中华鲟资源损失的主要手段,1983-2018年人工放流持续实施了36年,放流了人工繁殖中华鲟子代700多万尾,但是其自然种群资源一直在持续衰退,这也是导致一些决策者不支持中华鲟人工放流的原因,以至于近些年一些专家学者认为人工增殖放流挽救不了中华鲟[3, 5].查阅有关论证资料,从“三三〇工程局”中华鲟研究所成立之初的设计目标看,对其初期设计年度放流目标为3~5 g中华鲟幼鱼0.5万~1万尾(按新标准划分,此规格发育期处于约30日龄,应为后期仔鱼).该研究所2008年9月划归中国长江三峡集团公司管理,至今未见该研究所有一个明确的更高的年度放流任务指标,国家或行业部门至今也并未对该研究所明确下达中华鲟放流任务.中华鲟的保护或增殖放流开国内水电生态保护补偿的先河,某种意义上成为我国水电鱼类保护的标杆[3],其初期的增殖放流设计目标过低,以及后继执行者没有明确设定更高的具体放流目标,这些不仅影响了中华鲟的人工增殖放流任务,也影响了我国水电行业决策者们对增殖放流数量的正确理解甚至误解.还有一些人甚至提出,“珍稀鱼类增殖放流,不能放太多,放多了无法体现珍稀鱼类的珍稀性”等诸如此类的观点,也影响了我国水电工程增殖放流站的设计目标和规模.
本文汇总了1983-2018年在长江历次公开报道和有确切记载的中华鲟增殖放流情况[17],按不同生活史进行归类(表 2),36年人工繁殖放流中华鲟子代总量为712.81万尾,其中仔稚幼鱼总量为712.49万尾,亚成体和成体3231尾. 1980s-1990s初期没有突破苗种培养技术难关,放流主体是开口前后的仔鱼,数量达575.6万尾,占放流总量的80.75 %.开口摄食前后仔鱼没有越过死亡高峰,是不适宜的人工放流规格,剩余137.21万尾是已经越过了死亡高峰期的稚鱼和幼鱼,属“有效”放流数量,36年间平均放流3.81万尾/年,此数量较国外放流同类规格数量低了近1~3个数量级!例如在1961-1991年(苏联解体之前),苏联在伏尔加河等河流放流人工繁殖的3大主要鲟鱼,即俄罗斯鲟、闪光鲟和欧洲鳇子代(规格为30~50日龄的稚鱼),每年放流数量都在百万尾至千万尾数量级,不仅在商业捕捞上恢复了苏联在里海鲟鱼和亚速海流域的历史最高产量,而且在恢复自然繁殖方面都取得了成功[40-41].美国对许多鲟鱼种,如高首鲟、湖鲟、尖吻鲟、铲鲟等多数鲟鱼的人工繁殖放流自1990s至今仍然是鲟鱼物种恢复计划的重要手段之一,至今多数方式是采捕野生亲本进行人工繁殖,人工培育并野化后在产卵场附近江段放流稚鱼,进行监测和科学评估[42],根据评估结果,优化调整放流方案,一般每年对于每一个河流种群人工放流稚鱼的数量在数千尾至几十万尾不等,放流任务多下达给美国国家鱼类孵化场体系(NFH),作为国家鱼类孵化场的年度任务布置.中华鲟人工增殖放流不成规模,其放流力度最大的一次为1999年12月31日的“世纪中华鲟放流”,共增殖放流2月龄(规格超过10 cm)的中华鲟稚鱼10万尾,分别由中华鲟研究所和长江水产研究所各义务提供5万尾[43].
| 表 2 1983-2018年期间长江中华鲟人工增殖放流统计* Tab. 2 Statistics of restocking of Chinese sturgeon in the Yangtze River from 1983 to 2018 |
放流的亚成体和成体中华鲟,有可能人工养殖时间过长,规格过大,错过了印痕(imprint)生活史时期[20];在长江口实施的中华鲟放流,可能缺乏放流后经历长江洄游“履历”.没有长江洄游路径的印痕,可能在成长并性成熟后难以找到长江产卵场进行自然繁殖,不能实现增殖放流的初衷.
放流数量不足等问题,国内业内学者早已有过建议[44].
从生活史分析得知,中华鲟繁殖栖息地大幅度损失,仔稚幼鱼栖息地损失严重,需要人工提高繁殖量和早期生活史成活率,即通过人工增殖放流是国际上迄今为止最为有效的手段,纵观对濒危鲟鱼种类如大西洋鲟、湖鲟、尖吻鲟、海湾鲟、短吻鲟以及商业化规模的俄罗斯鲟、闪光鲟和欧洲鳇的做法,物种恢复行动计划的首要措施就是增殖放流.在世界鲟鱼保护学会(WSCS)的主导下,针对鲟鱼增殖放流编制了技术手册和指南,对放流规格和时间都有比较规范的做法[45-46],中华鲟的人工增殖放流应该参照国际推荐的规范.
3.3 误区3:对中华鲟人工增殖放流缺乏科学规划和管理我国水生生物增殖放流尽管起步早,但是一直是以增加渔业产量为目的的生产性增殖放流为主导,真正成为国家行为并涵盖生态修复意义的增殖放流是在2006年国务院颁布《中国水生生物资源养护行动纲要》后才开始的.增殖放流十多年以来,中央和各级政府重视,产生了很大的经济和社会效益,一些物种数量也有明显增加,但是还存在诸多管理问题,例如存在重生产,轻生态;重数量,轻质量;重形式,轻效果;重放流,轻评估等一系列问题,增殖放流资金普遍采取公开招投标形式,过于市场化,导致了有良好愿望,但效果不佳,甚至造成一些地方放流失控.
就中华鲟增殖放流而言,缺乏科学的规划和管理.葛洲坝对中华鲟影响的补偿性放流措施,国家应该有明确的规划和要求,责成因葛洲坝救鱼而成立的中华鲟研究所来承担中华鲟放流义务,规定放流数量和规格,规划第三方进行周期性放流效果评估,根据效果评估对放流进行优化调整.然而,在葛洲坝建成初期,基本为以突破人工繁殖为目的的义务放流,实施单位只有长江水产研究所(放流时间段为1983-1986年,1991年-)和中华鲟研究所(1984年-).中华鲟放流直至2003年基本都属于义务放流,期间,中华鲟研究所隶属于葛洲坝集团,一度经济状况欠佳,用于中华鲟人工繁殖和放流苗种培育投入有限,甚至以被私营企业半承包的形式实施中华鲟放流;而长江水产研究所也因中华鲟人工繁殖技术难以突破(并未突破苗种培育技术),人工增殖放流工作在1987年中断了,中华鲟人工繁殖和饵料培育组解散. 1987-1997年,受大的外部经济环境影响,中华鲟苗种培育和增殖放流工作处于低谷. 1998年,农业部渔政局批复了广东和福建几家企业开展中华鲟南方人工驯养繁殖,目标是寄希望于有朝一日中华鲟可商业利用!此后,开始了除研究所外的民营企业开展中华鲟养殖和人工增殖放流工作. 2004年国务院三峡工程建设委员会办公室(简称三峡办)启动了三峡水利枢纽工程对中华鲟影响增殖放流补偿措施,项目采取社会公开招投标办法实施,包括两家研究所及多家鲟鱼养殖企业参与了中华鲟人工增殖放流,三峡办中华鲟增殖放流资金执行了几年结束,其后是中央财政的水生生物增殖放流资金,增殖放流计划分珍稀物种和经济物种,资金安排以经济物种占比为主,由于全国性放流种类多,资金被稀释且逐年减少,直至非常有限的中华鲟人工繁育放流企业无法维持生产.此外,放流规格、时间和地点时常被行政化左右,例如在海上放流、河口放流,长江的中华鲟种群在珠江流域放流,高温季节放流,过大规格的放流,放流后无休渔保护措施,用于人工繁殖放流的亲本数量和质量无人关心,问题层出不穷,业界科技工作者呼吁加强跟踪监测评估放流效果的建议长期不被重视和采纳.还有一些增殖放流计划得不到落实,如“三峡后期规划项目”中有关中华鲟人工增殖放流的计划.
4 中华鲟保护的困境 4.1 困境1:自然繁殖受阻,生活史过程难以完成中华鲟自然种群资源量严重衰退,难以支撑种群的自然繁衍(图 2),阻隔、过渡捕捞、非法捕捞和其他综合因素导致中华鲟产卵群体数量逐年下降,中华鲟性成熟周期长(初次性成熟年龄平均为14.3年)的特性导致其产卵群体数量短期内难以大幅度增长;另一方面,现有产卵场空间范围狭小,三峡水库“滞温”效应导致达到适宜产卵水温的时间逐步推迟,由水温控制的产卵窗口期与中华鲟性腺成熟期错开[2],而且三峡水库处于同温层,这种水利工程带来的水温滞温效应在秋季难以通过生态调度得到解决[47],或者提前生态调度,或者采取创新性的产卵场人工降温措施,这些或许是理论探讨,执行层面的可行性渺茫,故秋季中华鲟繁殖季节葛洲坝下水温过高问题成为葛洲坝下中华鲟自然繁殖的最大障碍!因此,总体来看,中华鲟生活史关键环节——自然繁殖出现中断,是当前中华鲟保护的最大困境,自然种群灭绝倒计时!
4.2 困境2:洄游旅途艰难其一是仔稚幼鱼降河洄游(过程B~H)旅途艰难.中华鲟早期生活史被缩短约1000 rkm,中华鲟仔鱼需要的躲避敌害藏匿的卵砾石河床大幅度减少,长江中游河滨浅水区或沙洲浅滩索饵场被侵占或硬化,导致中华鲟早期生活史和幼鱼降河过程艰难.在长江干流和长江口中华鲟栖息环境仍然受人类开发活动影响的根本面没有改变,长江中下游至河口岸坡硬化,或被城市景观建设、航道和防洪工程、码头桥梁侵占,还有大量的挖沙及河道治理工程,长江口滩涂造地侵占严重,使得中华鲟仔稚幼鱼赖以生存的关键栖息地越来越少.其二是产卵群体溯河洄游(过程K~M)旅途艰辛!航运的大力发展、长江黄金水道的建设、深水航道的建设和运行、成倍增长的航运量、水下噪声的振动和螺旋桨的直接伤害都影响中华鲟产卵群体溯河洄游和周期性出水“换气”行为[48]. 2005-2007年的调查显示,因螺旋桨或船舶致伤的中华鲟个体就超过50 %.因航运导致的中华鲟死亡事件每年都有报道.
有幸的是,到2020年底,长江干流和长江口将是长江流域十年休渔全覆盖的区域,各种网具对中华鲟仔稚幼鱼和产卵群体的围追堵截可能不复存在,这将极大地改善中华鲟的洄游旅程,提高洄游成活率,为中华鲟人工增殖放流提供保障.
4.3 困境3:海洋生活环境不容乐观中华鲟在海洋中的生活史履历占中华鲟生活史主体(淡水:海水=1 :9),其大部分生长发育期都在海洋,而且多在人类活动干扰强的近海海域生活.尽管长江已经开始全面休渔,但是海洋只有伏季休渔,海洋捕捞压力不可小觑,例如我们曾经监测到一尾放流的中华鲟,在宁波海域就被误捕4次,最终死亡.近海的船舶、污染、赤潮等都会给中华鲟的生存带来影响,然而,我们对中华鲟海洋的生活史所知非常有限.
4.4 困境4:“陆-海-陆”接力保种面临困难 4.4.1 淡水养殖保种群体遗传谱系单一中华鲟人工群体保种成功,避免了走白鲟的覆辙,确保了中华鲟物种不会灭绝.然而,养殖群体还存在保种数量有限、群体遗传谱系较为单一、性成熟比例低下、规模化繁殖苗种有限等困难.由于长期投入体制机制问题没有得到解决,中华鲟人工群体养殖条件和健康状况堪忧,企业弃养中华鲟事件时有发生,如厦门松达实业有限公司弃养中华鲟事件[49].随着中华鲟的生长发育,需求空间越来越大,一些企业场地受限,资金投入捉襟见肘,中华鲟饲养条件受限,病害发生频率增加,养殖压力日趋增大,人工保种群体面临危机.
2016年农业部长江流域渔政监督管理办公室立项开展“全国人工养殖中华鲟普查”,历时4年,采用现场抽查和问询相结合的方式开展了18次调查.普查结果显示,中华鲟人工养殖群体主要集中在25家人工养殖基地(包括国立科研所、央企研究所、保护区养殖基地、养殖企业以及水族馆),统计子一代(F1)中华鲟共有3091尾,资源主要集中在湖北省,共计2132尾,占全国总养殖数量的68.97 %.其中,养殖规模最大的中华鲟繁育保种基地位于荆州市.虽然中华鲟全人工繁殖技术瓶颈已突破,规模日益增大,但人工繁殖难题也显现出来.人工保种因养殖空间的限制使得养殖中华鲟性成熟个体小型化、成熟比例低,最终影响了繁殖效果,限制了人工繁殖规模.以某典型中华鲟保种基地为例,对1998-2019年参与保种繁殖的共计492尾子一代中华鲟进行统计发现,仅有74尾性腺发育成熟,成熟比例仅为15.04 %.进一步对成熟亲鱼的世代分析发现,以2000年和2001年出生的中华鲟雄鱼为主,占比达82 %,参与繁殖的雌性亲本仅为1998年和1999年世代雌鱼,其中1999年世代雌鱼占比达89 %.这种单一世代亲本来源导致繁育子代的遗传背景单一,因此出现了大规模疾病死亡的现象.实际生产中,人工养殖的中华鲟雄鱼初次性成熟最小年龄为10龄,平均年龄为(15±2)龄,雌鱼初次性成熟最小年龄为12龄,平均年龄为(18±2)龄,似乎都比野生群体初次性成熟时间长(表 1).而且,人工养殖的子一代中华鲟繁殖群体雄鱼体重最大仅为79 kg,雌鱼最大仅为166 kg,均远低于野生群体,且出现体重增长缓慢或不增长等“长不大”的现象[50].根据1973-1976年对野生中华雌鲟的调查,其绝对怀卵量为30.6万~130.3万粒(平均64.5万粒),卵径为4.4~4.6 mm,雄鲟精子剧烈运动时间为248 s[9];1998-2004年中华鲟野生雌鲟的绝对怀卵量为20万~59万粒(平均35.8万粒),卵径为4.0~4.2 mm,精子剧烈运动时间下降至103 s[35].而人工养殖成熟子一代中华鲟雌鲟怀卵量仅有5万~25万粒(平均13.43万粒),远低于野生个体,卵径为3.75~4.20 mm (平均3.97 mm),小于野生个体,雄鲟精子剧烈运动时间为34~90 s (平均49.11 s),也显著低于野生个体[50].这导致人工养殖中华鲟雌、雄亲鲟催产成功率(分别为57.89 %和76.36 %)远低于野生中华鲟(94.7 %),平均受精率(42.72 %)明显低于野生中华鲟(63.7 %)[51].总之,与野生中华鲟相比,人工养殖的中华鲟繁殖力和繁殖效果呈下降趋势.
4.4.2 养殖保种群体缺乏海水驯养过程迄今,中华鲟保种养殖几乎都在淡水进行,缺乏海洋生活史(中华鲟自然生活史的I~J和T~U过程),中华鲟在海水中的生活时间占生活史的90 %,海水过程对于中华鲟是必须的.但是我们发现,我国近海适合中华鲟规模化养殖的自然条件非常有限.适合于中华鲟生长的环境在我国近海,以舟山海域为多,中华鲟也洄游至黄渤海及台湾海峡,最南至海南岛万宁,但是较为稀少,其生活的海域盐度一般在32 ‰以内,多数在28 ‰以内,而适宜水温为5~28℃.中华鲟为大陆架生活近岸鱼类,属于亚冷水特性,在高盐度和高水温的南海少见,推测可能存在季节性的南北迁移,在东海和黄渤海之间,夏季向北迁移,冬季向南迁移,以选择水温适宜和饵料丰富的海域生活.然而,海水网箱养殖或海水池塘养殖是固定的,受地域海温和气温影响.经过我们的调查和实验,普通的固定海水网箱养殖几乎没有适宜的海域,黄渤海冬季有浮冰,舟山近岸水温适宜但潮汐和台风大,导致网箱中的中华鲟受海流影响而大量死亡.舟山以南的近岸水域夏季水温都超过30℃,不适合中华鲟的生长.东海等许多近海赤潮对中华鲟养殖产生致命影响.海水养殖中华鲟还需要科技创新!
4.5 困境5:保护体制机制不畅中华鲟保护养殖时间长,难度大,资金投入巨大,缺乏专项支持,社会或私营资本投入无出路,以成果论文产出为导向的科研院所也缺乏足够人财物力进行长期性支持,亟待体制和机制创新!
4.5.1 民营保护力量缺乏出路,科研单位势单力薄从中华鲟生活史特征和养殖实践可知,雌性的批量性成熟需要20年,比其他所有鲟鱼种类都长,也似乎比任何其他鱼类都长,其个体大,要求养殖条件苛刻:对水温、池体空间、水质、饲料和操作等的要求都很高.然而,由于中华鲟生长速度快、养殖性状好,在中华鲟繁殖养殖技术取得突破后,国内外许多企业都曾申请引进和驯养,包括美国、日本和韩国,以及国内的广东、福建、北京、江苏、浙江、山东和湖北的一些企业,多数企业因养殖周期长、难度大、养殖无出路而逐渐退出.少数企业一直坚持,最终还是难以为计.举例来说,厦门一家私营企业,自1999年开始养殖中华鲟至2015年破产,驯养中华鲟投入巨大,该企业系由专家推荐开展中华鲟人工养殖,企业也强烈要求,经农业部渔业局批准,同时接管了难以维持的福建另外一家私营企业养殖的中华鲟,分别在海水和淡水开展养殖,投资数千万元,长期的投入无产出,企业难以维持,老板弃养跑路,最终该养殖企业由厦门市海洋渔业局接管[49],所剩中华鲟被放流或转赠其他家,属于悲剧!湖北荆州中华鲟养殖量最多的一家私营企业,1998年经农业部渔业局正式批准开展中华鲟人工养殖,2018年荆州城市建设,导致36尾中华鲟子一代非正常死亡[52],养殖地点被迫搬迁,政府出面解决了大型中华鲟的养殖生存条件问题,因中华鲟仍在不断快速生长,该基地仍面临扩建继续投资问题,放流资金远不足以维系中华鲟的生存,且中华鲟为国家一级保护动物禁止商业开发,故企业也无信心继续养殖!除养殖企业外,海洋馆也是中华鲟饲养单位,最早的为北京一家海洋馆,2004年经农业部渔业局批准,至今开展了中华鲟的驯养展示,在野生产后中华鲟康复、成体中华鲟饲养管理、养殖行为和健康标准等方面取得了一系列突破,然而,海洋馆受人工恒温条件和空间限制,养殖中华鲟数量非常有限,也无法在海洋馆突破人工繁育,海洋馆养殖只能作为中华鲟迁地保护的补充.
中国科学院或大学等基础研究性质的单位,因养殖投入巨大,无专项经费,未曾开展养殖研究,只开展野外调查和监测等基础工作;一些国家部委所属的应用基础研究院所,因项目需要,开展过小批量中华鲟实验性养殖.目前开展批量人工繁育和保种的只有两家科研机构,一家因葛洲坝水利工程兴建而设立的“救鱼”机构,系专门从事中华鲟人工繁殖放流的企业性质的研究所(央企),因种种原因,目前企业保留育龄中华鲟数量不多;另一家为部属科研机构,保留了一批中华鲟子一代,不知不觉成为保存育龄中华鲟数量和总生物量最多的机构,但不是国家或行业指定的中华鲟保种和人工繁育放流机构.然而,国家科研机构中长期从事中华鲟养殖保种的科技人员积极性不高,养殖条件和空间也不能满足日益增长的中华鲟的需要.中华鲟养殖保种属于基础性或生产性工作,不仅不能持续产生高影响力的研究论文和科研成果,还需要长期的养殖保种和几十年如一日的投入,在资金、场地、人员等各方面都存在很大困难.故此,中华鲟这一巨型鱼类的保种工作,私营企业是当前事实的养殖主体,而国家科研院所或央企在中华鲟的保护、保种、人工增殖放流等方面的运行遇到障碍,亟待机制创新!
4.5.2 中华鲟保护地和物种分置于不同部门管理新一轮改革将所有保护地归属林业草原主管部门主管,自然保护得到了加强,山水林田湖草生命共同体为一体化管理.然而,《中华人民共和国野生动物保护法》规定,水生野生动物主管部门为农业(渔业)主管部门,在长江干流和长江口建设有10处自然保护区归口林草部门主管,所占江段长度近1000 km,其中分布有国家一二级保护动物如中华鲟、长江鲟、长江江豚、胭脂鱼等分属林草和农业(渔业)两个主管部门管理,理论上虽然管理加强了,但在执行层面,包括科研监测、保护措施的落实、保护的主体责任等方面,谁为主谁为次仍处于磨合期. 《中华鲟拯救行动计划(2015-2030年)》亟待加快执行.中华鲟灭绝在加速,保护的进程要与物种灭绝的速度赛跑!
此外,按照《中华鲟拯救行动计划(2015-2030年)》规划,需要在长江三峡水域、长江故道等天然和半天然水域开展中华鲟保种养殖,然而,随着全国水污染防治法在各省的贯彻实施,在天然水域中养殖中华鲟均被取缔,例如湖北省,自2005年开始在三峡库区网箱养殖的中华鲟被强行取缔,导致转移的中华鲟大批死亡.长江三峡系中华鲟曾经的故乡(natal river),不让其在故乡即历史出生地河流养殖,不论对保种中华鲟环境自然性还是降低养殖成本而言,都是很不适宜的.尽管在《中华鲟拯救行动计划(2015-2030年)》、长江经济带生态保护规划和《关于加强长江水生生物保护工作的意见》(国办文[2018]95号)都明文规定了中华鲟“陆-海-陆”接力保种工程,规划了三峡水库保种的相关内容,但是由于与地方法规的不匹配和衔接困难,申请办理三峡水域使用证困难重重,至今未能突破.
4.5.3 《中华鲟拯救行动计划(2015-2030年)》缺乏专项支持《中华鲟拯救行动计划(2015-2030年)》,系农业农村部推出的第一个单物种保护行动计划,此后,农业农村部又陆续推出了《长江江豚拯救行动计划》、《长江鲟(达氏鲟)拯救行动计划》、《中华白海豚拯救行动计划》、《中国海龟拯救行动计划》等,并先后成立了各物种行动计划的保护救助联盟. 《中华鲟拯救行动计划(2015-2030年)》出台5年了,尽管农业农村部长江流域渔政监督管理办公室积极筹集资金,开展了产卵场联合调查、全国人工养殖中华鲟普查、“陆-海-陆”接力保种点等行动计划的一些优先行动,然而,行动计划主体行动仍然无法落实,如优先项目“陆-海-陆”接力的主体工程、规模化繁育基地建设、产卵场修复、中华鲟海洋普查、增殖放流、遗传多样性等行动计划主体项目等基本无法落实.目前普查发现分散在25家企业的三千余尾11龄以上的F1保种群体的生存状况普遍堪忧,中华鲟人工增殖放流仍然没有专项经费支持.如不能尽快落实,担心等到计划落地的那一天,中华鲟野生群体已经和白鲟一样难觅踪迹,人工群体也已损失惨重!
4.6 困境6:对中华鲟的损害缺乏有效的补偿机制黄真理和王鲁海[3]认为,中华鲟是葛洲坝救鱼的唯一对象,长江梯级水坝是导致中华鲟种群衰退的主因,直接影响了中华鲟的自然繁殖,是中华鲟物种受损害的责任主体.从中华鲟生活史栖息地需求来看,葛洲坝阻隔导致了中华鲟有效繁殖群体数量和产卵场容量减少,是中华鲟资源衰退的主因[2];中华鲟产卵洄游过程损失超过1000 km洄游历程,导致仔鱼藏匿的卵砾石河床大面积减小,长此以往对中华鲟种群将产生深远影响.有研究表明,鲟鱼种群大小与河流长度呈正相关[6],从长期进化的角度,对中华鲟种群属性如个体大小、游泳能力和繁殖力等可能都会产生更深远影响.目前中国长江三峡集团公司中华鲟研究所,由于历史原因,其成立初期设计的年度任务为放流3~5 g中华鲟0.5万~1万尾/年,时间过去近40年,至今政府部门也没有对其保护和人工增殖放流中华鲟作相应的定量目标要求,其增殖放流行为属于企业自愿.从该研究所向主管部门报送的统计数字来看,该研究所在中华鲟保种数量方面,并不是国内的主要持有单位,其进入育龄期的中华鲟子一代保有量也不如一些养殖企业多.中国三峡集团公司也是长江葛洲坝、三峡、向家坝、溪洛渡4个已建水电站和即将完工的乌东德和白鹤滩水电站的业主,这6个水电站在防洪和发电方面发挥着巨大的正面作用,其运行也对长江水生态和水生生物的自然繁殖和物种延续有举足轻重的作用,特别对中华鲟、长江鲟、长江江豚、圆口铜鱼、胭脂鱼和四大家鱼等,这些物种生活史高度依赖于长江干流.由于葛洲坝的建设和论证时间已经过去40年之久,后期的三峡工程、向家坝和溪洛渡对中华鲟的叠加影响没有得到充分论证,负面影响没有得到有效补偿.
5 中华鲟困境的突围当前中华鲟保护当中最突出的问题,即自然繁殖中断(图 5).系统分析来看,其“病因”,即影响中华鲟生活史过程的外环境因素为:第一冲击因素是葛洲坝阻隔,最后一冲击因素是三峡工程及金沙江梯级电站蓄水运行形成的滞温效应;“病根”,即导致中华鲟自然繁殖中断的生活史过程中控制性节点,有种群缩减类节点和生境恶化类节点;分类施策,有盯“病根”的分类施策和盯“病因”的分类施策,盯“病根”的分类施策以人工保种和增殖放流为主,盯“病因”的分类施策以生境修复和重建为主;而整体来看,就是确保《中华鲟拯救行动计划(2015-2030年)》的落实落地.

|
图 5 中华鲟保护问题的系统分析与应对解决框架示意图 Fig.5 Systemic diagnosis and therapy of problems involved in conservation of Chinese sturgeon |
造成中华鲟当前出现自然繁殖中断的“病因”,系统分析有4类:1)葛洲坝阻隔导致中华鲟产卵栖息地严重不足,在此生态容量的胁迫下,中华鲟经过一个生活史周期后,自然补充群体严重不足,进而导致后续产卵群体数量不足,因而葛洲坝阻隔是导致近期中华鲟自然繁殖中断的第一冲击因素;2)三峡工程蓄水导致葛洲坝下中华鲟产卵场自然繁殖季节产生滞温效应,而后金沙江下游水电站——向家坝、溪洛渡的相继运行促使葛洲坝下中华鲟产卵场自然繁殖季节的滞温发生叠加,进而强烈压缩中华鲟自然繁殖的时间窗口,因而三峡及上游梯级电站运行形成的滞温效应是导致近期中华鲟自然繁殖中断的最后一个冲击因素;3)葛洲坝下游河势调整工程直接导致葛洲坝下中华鲟产卵场地形改变,使产卵条件进一步恶化;4)河道冲刷、航道疏浚、防洪工程建设和沿江城市景观工程建设等人类活动大幅损害或侵占了中华鲟仔幼鱼的栖息地,长江口滩涂湿地的围垦等工程导致中华鲟幼鱼索饵场减小,再加上长江的污染、航运以及近海的过度捕捞等一系列因素,促使了中华鲟补充群体和繁殖群体的死亡率上升,是加剧中华鲟繁殖群体持续减少的重要因素;5)近40年以来,中华鲟人工增殖放流这一葛洲坝水利工程救鱼的主要措施没有得到科学有效地实施,是导致通过人类干预力保中华鲟自然群体的希望几近破灭的重要因素.
中华鲟保护按目标可分为低、中、高3个层次(图 6):1)可人工或迁地保护维持物种延续;2)自然种群可延续,尽管其种群数量和地理分布远不及历史水平;3)野生种群和栖息地及其生态服务功能得以恢复和延续.第1层次目标是目前长江许多物种首先要确保的目标,经过若干年努力实现第2层次目标,最终是第3层次目标.对一些物种而言,在长江流域资源环境压力没有显著改善的情况下,第2层次目标或许是良好的愿望或终极理想!第1层级目标最低要求是物种不至于灭绝,可以通过迁地保护或人工保种的方式,或通过传统人工繁殖和养殖来实现.就水生濒危物种而言,野生种群的数量和养殖的难易程度是关键.如白鱀豚、白鲟和鲥就因野生种群数量太稀少,对其生物学行为特性了解甚少,难以人工养殖和繁殖成功,一旦自然种群绝迹,物种就灭绝了.中华鲟已经突破了人工繁殖和全人工繁殖,保存物种不至于灭绝理论上可行.当然,人工群体长期可持续需要有自然种群遗传多样性的支持.故中华鲟保护目标的实现是确保第1层次目标,实现第2层次目标.终极目标是第3层级目标,此目标的实现,估计需要经过中华鲟2个以上生活史(>30年),在长江中下游和近海的宏观生态环境得到显著恢复后才可能实现.
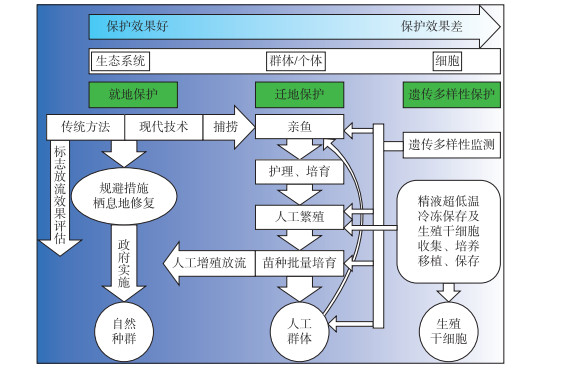
|
图 6 中华鲟物种保护技术路线示意图 Fig.6 Technological route for conservation of Chinese sturgeon |
将中华鲟物种保护作为长江大保护的主要抓手之一,系统设计,统筹实施.长江十年休渔,给中华鲟野生种群的修复带来了非常重要的契机[53],放流的成活率有望得到显著改善,产卵亲鱼在长江上溯再无千层网的围追堵截.另一方面,中华鲟幼鱼被地笼等非法渔具破坏现象显著减少,中华鲟早期生活史成活率将显著提升.需尽快完善和细化《中华鲟拯救行动计划(2015-2030年)》,按照“谁污染环境、谁破坏生态谁付费”的原则,落实责任和经费,并付诸实施!
5.1.1 显著提高中华鲟稚鱼放流数量和质量,投放性成熟亲本以尽早恢复自然繁殖中华鲟增殖放流,是弥补自然繁殖不足和显著提高早期生活史成活率的有效办法,欧美国家一直持续在做.例如美国对其濒危的短吻鲟、湖鲟、海湾鲟、铲鲟等实施了20多年的物种行动(恢复)计划,最主要的就是增殖放流措施,实施至今.美国的70个国家鱼类孵化场,很多都承担了鲟鱼的增殖放流任务.增殖放流的鲟鱼来源、放流规格、放流数量均由政府管理和规定.放流的鱼类均来源于国家或州立鱼类孵化场,保证了放流苗种来源的可靠性.放流规格和放流数量均有规定,如湖鲟,需达到约15 cm方可放流;放流苗种的遗传管理非常严格,如密苏里铲鲟,要求一尾雌鲟最多只能和两尾雄鲟配对,每一尾雄鲟产出的后代放流数量不能超过280尾,即一尾雌鲟产出的后代放流的总数量不能多于560尾,多余的只能用于科学试验或其他目的.
目前美国的鲟鱼人工繁殖和放流几乎完全依靠野生亲本,借鉴鲑鱼行为遗传机理(imprint),认为鲟鱼和鲑鱼一样,在其早期生活史阶段,利用其高度进化的感觉器官对环境的识别能力,将产卵、孵化及洄游履历(水土元素谱)记下来,等到性成熟时,个体可沿幼时生活履历,找到出生地进行产卵繁殖,周而复始,形成了对产卵场河段环境的忠实性或高度依耐性特征.例如在毛米河畔,鱼和野生动物管理局建立了车式孵化车间,利用自然河水孵化和培育湖鲟并进行放流,希望20年后放流的子代批量回来产卵繁殖,从而恢复毛米河鲟鱼自然种群.配合严格的遗传管理政策和措施的实施,有效地保证了放流后代较丰富的遗传多样性,这使得濒危鲟鱼类状况得到了很大缓解.基于目前中华鲟自然繁殖中断和野生种群资源极度濒危的现状,本文认为通过人工保种群体补充恢复中华鲟野外资源极其重要.
关于中华鲟增殖放流数量问题.已知1998-2000年放流中华鲟稚鱼(TL>10 cm)10万尾/年, 在长江口的贡献率约为野生中华鲟年补充量的1 % ~5 % [54-55],按照3 %计算,该期间出生的中华鲟经过一个生活史周期(14年)可批量到长江产卵繁殖. 2012-2014年是长江中华鲟子代栖息地及子代产卵群体洄游都受到长江流域及近海人类活动最强或较为强烈影响的时期,如果投放100万尾,在长江全面休渔的背景下,可弥补大于1998-2000年中华鲟自然繁殖规模的30 %以上,放流稚鱼300万尾/年,可达到或超过1998-2000年自然繁殖水平的90 %,故建议将这个数量(年放流稚鱼300万尾)设为中华鲟人工增殖放流的目标.
目前,人工保种的中华鲟成体资源约3000余尾(11龄以上),监测结果显示,这批鱼中平均每年性腺发育成熟、可以用于人工繁育的群体数量平均约占3 % (1 % ~5 %),随着年龄的增加,这批鱼的性成熟比例将逐渐升高.中华鲟具备繁殖力高的特性(自然繁殖群体的怀卵量平均为40万粒/尾,人工保种群体怀卵量平均为20万粒/尾),加之中华鲟全人工繁殖技术基本成熟,规模化繁育技术已经获得突破[51, 56],为快速实现中华鲟的资源增殖提供了保障.按中华鲟繁殖能力初步预测,目前,每年催产成功>30组,按每组获仔鱼5万尾计算,育苗成活率为70 %,可获得15 cm以上稚鱼100万尾/年以上,以后可逐年增加.
如何有效利用中华鲟人工保种群体实现野外种群的修复是拯救的关键.需要制定完善的中华鲟增殖放流和资源修复计划,包括针对现有保种资源的资源共享与繁育利用计划,基于保种群体的遗传管理和科学繁育搭配计划,人工增殖放流中华鲟的野化训练计划,增殖放流规格、规模和地点的科学规划和放流效果监测评估计划等.要建立增殖放流保障机制,解决中华鲟增殖放流中的经费需求和运行管理问题.
目前,中华鲟不能形成自然繁殖主要有两个因素:一是水温滞温效应导致的适宜中华鲟繁殖的水温窗口和自然繁殖的生理节律窗口错位或重叠区非常小;二是每年上溯到产卵场的中华鲟亲本数量太少,2017-2019年每年为20~30尾不等.探索在产卵场放流性成熟的人工养殖亲本以增加自然繁殖的概率.跟踪监测表明,人工放流亲本可上溯到葛洲坝下中华鲟产卵场(未发表数据),表明性成熟中华鲟繁殖具有自然繁殖的趋向性.这种现象通过短吻鲟、中吻鲟和长江鲟人工模拟自然产卵得到了验证[57].建议近3~5年内,在宜昌江段每年放流一定数量的人工培育的性成熟中华鲟亲本(例如100尾左右),增加产卵场中华鲟繁殖群体的数量,是促进中华鲟自然繁殖的有益探索.在目前中华鲟自然繁殖非常有限的水温和性腺发育重叠期内增加繁殖亲鱼的数量,尤其是雄性中华鲟,通过葛洲坝各水轮机的精细化调度营造适合中华鲟繁殖的水流条件,配合产卵场地形和底质改良、产卵引诱物(信息素)投放等综合措施,以实现中华鲟自然繁殖.
5.1.2 加强“陆-海-陆”接力计划实施力度根据中华鲟的生活史特征,人工群体应顺应其生活史过程.在《中华鲟拯救行动计划(2015-2030)》中已提出了“陆-海-陆”接力保种计划,以人工辅助的方式帮助中华鲟完成淡水-海水-淡水的洄游过程,以满足中华鲟不同生活史时期的生长和发育需求.当前中华鲟养殖均为水泥池人工水体,过小的水体对中华鲟产生了空间胁迫.在三峡水库和海区天然水域,建立大型养殖网箱或围栏,探索建设大型养殖工船,人工辅助中华鲟“洄游”,使中华鲟处于水温适宜的环境,避免台风袭扰,消除中华鲟的空间胁迫,同时可大幅度降低现阶段水泥池养殖模式的病害发生率,降低养殖成本,使中华鲟可发育至其应有的规格和体质,减缓中华鲟因小水体人工养殖造成的种质退化.
该计划三峡水库网箱平台和活鱼运输船等已经通过论证,解决三峡水库中华鲟网箱养殖许可问题,应尽快组织实施;中华鲟自然生活史的90 %在海洋度过,因此,应尽快论证东海区大型海洋养殖平台、海湾围栏工程和海洋养殖工船,并早日付诸实施.海洋保种工程是中华鲟物种保护成败的关键.
5.2 体制机制创新中华鲟保护工作是我国珍稀水生动物保护中持续时间最长、社会关注度最高、最具代表性的物种保护工作.回顾中华鲟保护的艰难历程和保护成效,必须认识到,国家层面中华鲟的保护决策制定与执行是关乎中华鲟保护成败的关键.国家虽然从不同层面制定了保护对策,但政策的落实和执行中还存在很多问题.中华鲟广域的分布和江海洄游习性决定了其经受社会经济发展过程不同类型人类干扰的复杂性、广域性、综合性和独特性,以中华鲟为代表的珍稀水生动物保护工作不是靠单纯一个国家行政部门就可以解决问题的;因为大型水利工程建设、航运、污染、捕捞等多种人类活动干扰,水域生态系统相对于陆地生态系统的区域性、社会功能性的不同,决定了需要不同层面的保护决策制定和执行;中华鲟作为大型物种,人工可持续保种和资源养护中需要的物资和经费投入巨大;以中华鲟保护为目标的研究团体相对分散,研究成果和资源共享机制也相对缺乏;这些因素都严重制约了物种保护的力度和成效.亟须创新保护机制,解决中华鲟的长效保护难题:(1)借鉴大熊猫等陆生珍稀动物保护的成功经验,建议建立国家中华鲟和水生野生动物保护研究中心,在长江流域自宜宾、重庆、宜昌、荆州、武汉、安庆、上海及浙江等建立一系列保护基地,在政府主管部门的监管下,设立保护决策、科学研究、动物管理、基地管理、科普宣传、对外合作交流等单元,形成科技创新、资源共享、数据整合、宣教示范和科学管理的统一体,从总体上解决以中华鲟为代表的珍稀水生动物的保护问题,提高保护成效.(2)以“谁污染环境、谁破坏生态谁付费”的原则,以政府监管和第三方管理的形式,建立长江中华鲟等长江水生野生动物保护专项基金或资金;(3)借鉴国际濒危物种利用措施,建立以利用(如科普宣传和展示)促保护的管理机制,提高社会参与度.
5.3 探索产卵场改良和旁通道人工建设产卵场面对当前中华鲟自然繁殖活动出现经常性中断这一现状,需要积极采取措施.针对葛洲坝下目前唯一已知的中华鲟产卵场,需积极采取生态水文学和水力学调度的方式改善产卵场的环境,如可以利用三峡工程及金沙江下游梯级调蓄能力强的特点,通过梯级联合调度改善葛洲坝下中华鲟产卵场的水文环境,尤其是水温变化过程,使其周年变化节律更接近自然过程或更好地满足中华鲟性腺发育和产卵活动的需要[2].特别是在中华鲟自然繁殖季节,通过联合调度使繁殖适宜水温(18~20℃)及时到来显得尤为重要[53].此外,通过葛洲坝水轮机组不同运行方式的调配,或产卵场局部河床地形特征的工程改良,还可在中华鲟产卵场创造出更适宜的水力学环境,从而促进其自然产卵活动[23].在距葛洲坝较远的长江中游江段,由于水温自然节律受上游梯级运行的影响逐渐减小[58],可能更有利于中华鲟的性腺发育和自然繁殖,如果寻找到一些具有中华鲟产卵场地形特征的江段,通过适当的工程措施进行改良,还可以新建或创造出新的中华鲟产卵场[59].除此之外,结合目前有关部门正在推动的荆汉新水道项目(长江勘测规划设计研究院内部报告)(图 7),还可考虑利用虎渡河人工模拟建设中华鲟自然产卵场.设想以原有太平口为进口,并在下游临长江较近位置新建入江出口,利用虎渡河此河段相对较小(河段长约20 km,河宽100~200 m)、水流水温等易于人工操控、水量充沛、距原有葛洲坝下中华鲟产卵场较近、对其洄游印痕影响较小等特点,以扩大中华鲟的自然繁殖场所.

|
图 7 拟结合荆汉生态新水道项目在虎渡河人工构建中华鲟自然产卵场(a)荆汉生态新水道位置示意图;(b)虎渡河与荆汉新水道的位置关系;(c)虎渡河生境状况 Fig.7 A natural spawning ground for Chinese sturgeons planned to be constructed in the Hudu River by combining the Jinghan ecological new waterway project (a) the location diagram of the new ecological waterway in Jinghan; (b) the location relationship between the Hudu River and the new waterway in Jinghan; (c) the habitat status of the Hudu River |
由于葛洲坝建设导致中华鲟早期生活史被缩短约1000 km,中华鲟仔稚幼鱼需要躲避敌害的卵砾石河床大幅度减少.而后,由于中华鲟仔稚幼鱼赖以生存的长江中下游河滨浅滩和江心洲沙滩栖息地,以及长江口滩涂湿地(包括崇明岛周围、九段沙周围、南支北支沿岸滩涂)被大量的航道、码头、防洪工程、桥梁、城市景观工程、挖沙采石作业所侵占或破坏,再加上三峡蓄水清水下泄导致长江中游河道下切,水位边幅减小,秋、冬季及早春河滩浅水区面积减小,影响了中华鲟仔稚幼鱼的庇护、索饵,导致中华鲟早期生活史和幼鱼降河过程困难.为了减轻中华鲟仔稚幼鱼降河洄游阶段的生存压力,提高其生存率,需要扭转长江中下游干流及长江口中华鲟仔稚幼鱼赖以生存的浅水滩地被侵占的基本面.近3年通过对长江中下游干流的岸线码头、采砂等人工设施的环保督察清理整顿,岸线复绿,或岸线的自然性得到了较大改观,对中华鲟和其他长江幼鱼的栖息和索饵产生了积极影响.近期可以重点关注和研究中华鲟仔稚幼鱼降河洄游过程中的关键庇护和索饵河段,在宜昌、石首、监利和洪湖开展试点示范,结合采用人工投放中华鲟仔稚幼原位野化训练试验,针对性地开展相关河段的消落区和浅滩水域的生态修复和再自然化,营造卵砾石河床等相关生境,满足其躲避敌害的需求,同时对相关区域的底栖生物群落结构和数量开展恢复性实验研究,保证其必需的索饵需求.
5.5 将中华鲟保护与长江流域其他鱼类的保护相融合中华鲟个体大、寿命长、洄游范围广,毫无疑问是长江流域水生态系统的伞护种和旗舰种,对中华鲟的保护可促进其他鱼类的保护,反之,对其他鱼类自然种群和栖息地的保护亦能促进中华鲟的保护,两者相互促进.从我国农业农村部启动的“长江渔业资源与环境调查”财政专项(简称长江专项)2017-2019年3年的调查结果来看,长江流域历史有分布而本次调查未发现的鱼类有130种,占长江鱼类总种数的30 %.从种类来看,主要为白鲟、鯮、鲥、白鱼类、裂腹鱼类、高原鳅类、鮡类、云南鳅类、银鱼类、鳑鲏类、光唇鱼类、类、鲀类等. 130种未采集到鱼类中含特有种83种,占长江特有种总种数的44.6 %.按照2015年生态环境部发布的红色名录来统计,130种鱼类中有11种为极危(CR),21种为濒危(EN),6种为易危(VU).当前,亟需针对这130余种鱼类逐一开展物种生存状况调查分析,评估其自然种群和栖息地状况,以及时采取有针对性的保护措施.针对狭域分布种类如邛海白鱼、近期新种如原鲮等物种,建议开展专项调查评估,尤其是模式产地和地模种群考察,填补保护空缺.针对多样性热点区域如金沙江等保护空缺区域,建议增设保护区.针对外来物种增多对濒危种和特有种的潜在不利影响,建议开展外来物种风险评估,尤其是在特有性和多样性高的长江上游区域.唯有实现中华鲟和其他珍稀特有鱼类的全面保护,才能维持长江水生态系统健康,最终实现中华鲟的长久保护.
6 展望将中华鲟物种保护作为长江大保护的主要抓手之一,系统设计,统筹实施.通过《中华鲟拯救行动计划(2015-2030年)》的全面实施,以“陆-海-陆”保种工程实现为基础,推动人工群体的保育、维持与扩大,使中华鲟育龄成体的规格和繁殖力等生物学特性显著提升接近自然种群水平;对中华鲟生活史各阶段的栖息地进行保护和修复,提高中华鲟各生活史阶段自然群体的存活率,并通过野化训练、软放流、亲本放流等科学增殖放流,补充野外补充群体和繁殖群体,使中华鲟补充群体逐年稳步增加,产卵群体呈现显著增长态势,实施15年后,自然繁殖得以恢复.与此同时,实现在中华鲟保护的伞护下,长江中下游和长江口一批物种及栖息地得到保护和恢复.
可以设想,未来随着科技的进步,(1)长江中游与上游重新获得自然连通,中华鲟等一批洄游性鱼类的洄游生活史得以延伸;(2)宜昌至武汉新航道得以实施和运行,鱼-船分道格局形成,中华鲟等水生动物获得专属领地;(3)整合长江中游(比如荆江+洞庭湖)重要保护地和生境区域建立以大江大湖流域水域为主题的国家公园,通过系统保护设计和统一规划实施,中华鲟等水生动物实现上下游、左右岸、水上与水下的系统保护.中华鲟保护真正成为长江乃至近海旗舰物种保护的典范,并使得中华鲟真正起到长江水生生物伞护种的作用,藉由中华鲟生活史各阶段的栖息地的保护和修复,实现一批长江与河口鱼类及其栖息地得到保护和修复,推动受损长江水生态系统逐步恢复健康,长江生物完整性指数回升到良好水平,长江大保护的目标得以实现.
致谢: 感谢本学科组张辉研究员、杜浩研究员、杨海乐博士、王成友副研究员、程佩琳博士、罗江助理研究员及魏晋博士等的多方面支持,包括基础数据整理、图表制作、文献查阅核实等.
潜在利益冲突声明:本文作者不存在相关利益冲突,包括但不限于从利益相关方获得可能会影响本文公正性和客观性的经费资助;本文作者危起伟研究员,1984年至今在中国水产科学研究院长江水产研究所从事渔业资源保护研究工作,世界鲟鱼保护学会理事(2011-).
| [1] |
Zhang H, Jaric I, Roberts DL et al. Extinction of one of the world's largest freshwater fishes:lessons for conserving the endangered Yangtze fauna. Science of the Total Environment, 2020, 710: 136242. DOI:10.1016/j.scitotenv.2019.136242 |
| [2] |
Huang ZL, Wang LH. Yangtze dams increasingly threaten the survival of the Chinese sturgeon. Current Biology, 2018, 28(22): 3640-3647. DOI:10.1016/j.cub.2018.09.032 |
| [3] |
Huang ZL, Wang LH. The Chinese sturgeon (Acipenser sinensis) conservation-Introspection, reform and innovation. J Lake Sci, 2020, 32(5): 1320-1332. [黄真理, 王鲁海. 长江中华鲟(Acipenser sinensis)保护——反思、改革和创新. 湖泊科学, 2020, 32(5): 1320-1332. DOI:10.18307/2020.0510] |
| [4] |
Wang LH, Huang ZL. What is actually the main cause for the survival crisis of Chinese sturgeon?, , 32(4):924-940. J Lake Sci, 2020, 32(4): 924-940. [王鲁海, 黄真理. 中华鲟(Acipenser sinensis)生存危机的主因到底是什么?. 湖泊科学, 2020, 32(4): 924-940.] |
| [5] |
Xie P. Can we save the disappearing sturgeons in the Yangtze River?. J Lake Sci, 2020, 32(4): 899-914. [谢平. 我们能拯救长江中正在消逝的鲟鱼吗?. 湖泊科学, 2020, 32(4): 899-914. DOI:10.18307/2020.0401] |
| [6] |
Bemis WE, Kynard B. Sturgeon rivers:an introduction to Acipenseriform biogeography and life history. Environmental Biology of Fishes, 1997, 48(1/2/3/4): 167-183. DOI:10.1023/A:1007312524792 |
| [7] |
Sulak KJ, Randall M. Understanding sturgeon life history:enigmas, myths, and insights from scientific studies. Journal of Applied Ichthyology, 2002, 18(4/5/6): 519-528. |
| [8] |
Pan JH, Liu CH. Morphological comparison of sturgeons in Changjiang and Zhujiang rivers. Journal of South China Normal University:Natural Science Edition, 1986(2): 35-39. [潘炯华, 刘成汉. 长江及珠江鲟鱼形态特征的初步比较. 华南师范大学学报:自然科学版, 1986(2): 35-39.] |
| [9] |
Yangtze Aquatic Resources Survey Group of Sichuan Province ed. The biology of the sturgeons and paddlefish in the Yangtze river and their artificial propagation. Chengdu: Sichuan Scientific and Technical Publishing House, 1988. [四川省长江水产资源调查组.长江鲟鱼类生物学及人工繁殖研究.成都: 四川科学技术出版社, 1988. ]
|
| [10] |
Zhou J. Chinese sturgeon in Xijiang. Fisheries Science & Technology of Guangxi, 1996, 2: 36. [周解. 西江中华鲟. 广西水产科技, 1996, 2: 36.] |
| [11] |
Wei QW, Zhang J, Zhuang P et al. Biology, fisheries, and conservation of sturgeons and paddlefish in China. Environmental Biology of Fishes, 1997, 48(1/2/3/4): 241-255. DOI:10.1023/A:1007395612241 |
| [12] |
Wang CY, Wei QW, Kynard B et al. Migrations and movements of adult Chinese sturgeon Acipenser sinensis in the Yangtze River, China. Journal of Fish Biology, 2012, 81(2): 696-713. DOI:10.1111/j.1095-8649.2012.03365.x |
| [13] |
Wei QW. Reproductive behavioral ecology of Chinese sturgeon (Acipenser sinensis Gray) with its stock assessment[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academy of Science, 2003. [危起伟.中华鲟繁殖行为生态学与资源评估[学位论文].武汉: 中国科学院水生生物研究所, 2003. ]
|
| [14] |
Zhuang P. Ontogenetic behavior of sturgeons (Acipenseridae) with comments on evolutionary and practical significance[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academy of Science, 1999. [庄平.鲟科鱼类个体发育行为生态学及其在进化与实践上的意义[学位论文].武汉: 中国科学院水生生物研究所, 1999. ]
|
| [15] |
Zhuang P, Kynard B, Zhang L et al. Ontogenetic behavior and migration of Chinese sturgeon Acipenser sinensis. Environmental Biology of Fishes, 2002, 65(1): 83-97. DOI:10.1023/A:1019621501672 |
| [16] |
Yu ZT, Xu YG, Deng ZL. Study on reproductive ecology of Chinese sturgeon in the downstream of Gezhouba Hydroelectric Project//Gui JF ed. Anthology of ichthyology (Volume 5). Beijing: Science Press, 1986: 1-13. [余志堂, 许蕴玕, 邓中粦.葛洲坝水利枢纽下游中华鲟繁殖生态的研究//桂建芳.鱼类学论文集(第五辑).北京: 科学出版社, 1986: 1-13. ]
|
| [17] |
Wei QW, Du H, Zhang H et al. Conservation biology of Chinese sturgeon (Acipenser sinensis). Beijing: Science Press, 2019. [危起伟, 杜浩, 张辉等. 中华鲟保护生物学. 北京: 科学出版社, 2019.]
|
| [18] |
Putman NF, Lohmann KJ, Putman EM et al. Evidence for geomagnetic imprinting as a homing mechanism in Pacific salmon. Current Biology, 2013, 23(4): 312-316. DOI:10.1016/j.cub.2012.12.041 |
| [19] |
Ueda H. Physiological mechanisms of imprinting and homing migration of Pacific salmon//Watabe S ed. Aqua-bioscience monographs. Tokyo: Terra Scientific Publishing Company, 2016: 1-27.
|
| [20] |
Boiko NE, Grigoryan RA, Chichachev AS. Olfactory imprinting in juveniles of Russian sturgeon, Acipenser guldenstadti. Journal of Evolutionary Biochemistry and Physiology, 1993, 29(5/6): 509-514. |
| [21] |
Wei K, Chen CS, Zhang XG et al. Review on olfactory organ and behavior in fish. Marine Fisheries, 2017, 39(6): 723. [魏凯, 陈春山, 张旭光等. 鱼类嗅觉系统功能与行为生态研究进展. 海洋渔业, 2017, 39(6): 723.] |
| [22] |
Wang CY. Migrations for reproduction of Chinese sturgeon (Acipenser sinensis) and its habitat selections in the Yangtze River[Dissertation]. Wuhan: Huazhong Agricultural University, 2012. [王成友.长江中华鲟生殖洄游和栖息地选择[学位论文].武汉: 华中农业大学, 2012. ]
|
| [23] |
Zhang H. Abiotic environment for natural reproduction of Chinese sturgeon (Acipenser sinensis)[Dissertation]. Wuhan: Huazhong Agricultural University, 2009. [张辉.中华鲟自然繁殖的非生物环境[学位论文].武汉: 华中农业大学, 2009. ]
|
| [24] |
Wang H. Research on environmental preference of F2 Chinese sturgeon (Acipenser sinensis)[Dissertation]. Wuhan: Huazhong Agricultural University, 2014. [王恒.中华鲟子二代环境偏好性研究[学位论文].武汉: 华中农业大学, 2014. ]
|
| [25] |
Zhang Z, Ni HW, Wang W et al. Land use and change of riparian zone at different scales in the Yangtze River Basin. Journal of Environmental Engineering Technology, 2017, 7(4): 500-508. [张哲, 倪贺伟, 王维等. 长江流域不同尺度岸带区域的土地利用及其变化. 环境工程技术学报, 2017, 7(4): 500-508.] |
| [26] |
Duan XJ, Wang XL, Xu XB et al. Main problems and Countermeasures of ecological protection along the Yangtze River coastline. Resources and Environment in the Yangtze Basin, 2019, 28(11): 2641-2648. [段学军, 王晓龙, 徐昔保等. 长江岸线生态保护的重大问题及对策建议. 长江流域资源与环境, 2019, 28(11): 2641-2648.] |
| [27] |
Jia YY, Tang XL, Tang FL et al. Research on human activity intensity and its impact on wetland landscape pattern in the middle and lower reaches of the Yangtze River Basin. Resources and Environment in the Yangtze Basin, 2020, 29(4): 950-963. [贾艳艳, 唐晓岚, 唐芳林等. 长江中下游流域人类活动强度及其对湿地景观格局影响研究. 长江流域资源与环境, 2020, 29(4): 950-963.] |
| [28] |
Sun HL, Wang D, Wu YY et al. Analysis for the effect of hydropower and water conservancy engineering on basin eco-environment in the upper Yangtze River. Environmental Protection, 2017, 45(15): 37-40. [孙宏亮, 王东, 吴悦颖等. 长江上游水能资源开发对生态环境的影响分析. 环境保护, 2017, 45(15): 37-40.] |
| [29] |
Cao WX. Water ecological restoration in the cascade development of hydropower in the upper reaches of the Yangtze River. Technology and Economy of Changjiang, 2019, 3(2): 25-30. [曹文宣. 长江上游水电梯级开发的水域生态保护问题. 长江技术经济, 2019, 3(2): 25-30.] |
| [30] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [31] |
Liu ZG, Ni ZK. The rules and the effects of varying river-lake relationships on the evolution of Poyang Lake. Acta Scientiae Circumstantiae, 2015, 35(5): 1265-1273. [刘志刚, 倪兆奎. 鄱阳湖发展演变及江湖关系变化影响. 环境科学学报, 2015, 35(5): 1265-1273. DOI:10.13671/j.hjkxxb.2014.1051] |
| [32] |
Changjiang River Administration of Navigational Affairs ed. 2017 Report on Changjiang River shipping development. Beijing: People's Communications Press, 2018. [交通运输部长江航务管理局. 2017长江航运发展报告. 北京: 人民交通出版社, 2018.]
|
| [33] |
Du H, Wei QW, Zhang H et al. Changes of bottom substrate characteristics in spawning ground of Chinese sturgeon downstream the Gezhouba dam from impounding of three gorge reservoir. Acta Ecologica Sinica, 2015, 35(9): 3124-3131. [杜浩, 危起伟, 张辉等. 三峡蓄水以来葛洲坝下中华鲟产卵场河床质特征变化. 生态学报, 2015, 35(9): 3124-3131.] |
| [34] |
Huang ZL, Wang LH. Did the gonads of the Chinese sturgeon below the Gezhouba Dam degenerate seriously?. J Lake Sci, 2020, 32(4): 915-923. [黄真理, 王鲁海. 葛洲坝下中华鲟性腺退化严重吗?. 湖泊科学, 2020, 32(4): 915-923. DOI:10.18307/2020.0402] |
| [35] |
Liu JY, Wei QW, Chen XH et al. Reproductive biology and artificial propagation of Acipenser sinensis below Gezhouba Dam. Chinese Journal of Applied Ecology, 2007, 18(6): 1397-1402. [刘鉴毅, 危起伟, 陈细华等. 葛洲坝下中华鲟繁殖生物学特性及其人工繁殖效果. 应用生态学报, 2007, 18(6): 1397-1402.] |
| [36] |
Holmlund CM, Hammer M. Ecosystem services generated by fish populations. Ecological Economics, 1999, 29(2): 253-268. DOI:10.1016/S0921-8009(99)00015-4 |
| [37] |
Wei FW. The value of ecosystem services from Giant panda reserves. Current Biology, 2018, 13(2): 2174-2180. |
| [38] |
Alerstam T, Bäckman J. Ecology of animal migration. Current Biology, 2018, 28(17): R968-R972. DOI:10.1016/j.cub.2018.04.043 |
| [39] |
Wilcox BA. In situ conservation of genetic resources: determinants of minimum area requirements//McNeely JA, Miller KR eds. National parks, conservation and development: the role of protected areas in sustaining society. Washington: Smithsonian Institution Press, 1984: 639-647.
|
| [40] |
Khodorevskaya RP, Dovgopol GF, Zhuravleva OL et al. Present status of commercial stocks of sturgeons in the Caspian Sea basin//Balon EK ed. Developments in Environmental Biology of Fishes. Berlin: Springer, 1997, 17: 209-219.
|
| [41] |
Chebanov MS, Karnaukhov GI, Galich EV et al. Hatchery stock enhancement and conservation of sturgeon, with an emphasis on the Azov Sea populations. Journal of Applied Ichthyology, 2002, 18(4/5/6): 463-469. |
| [42] |
Ireland SC, Beamesderfer RCP, Paragamian VL et al. Success of hatchery-reared juvenile white sturgeon (Acipenser transmontanus) following release in the Kootenai River, Idaho, USA. Journal of Applied Ichthyology, 2002, 18(4/5/6): 642-650. |
| [43] |
Zhang JQ, Liu JS. Saving Chinese sturgeon and protecting the live river-the Yangtze River:A record of'99 Restocking event of Chinese sturgeon with 100, 000 fingerlings. China Fisheries, 2000(1): 58-59. [张嘉秋, 刘晋生. 拯救中华鲟保护生命河——'99十万中华鲟苗世纪放流活动纪实. 中国水产, 2000(1): 58-59.] |
| [44] |
Chang JB, Cao WX. History and prospect of conservation on Chinese Sturgeon in the Yangtze River. Acta Hydrobiologica Sinica, 1999, 23(6): 712-720. [常剑波, 曹文宣. 中华鲟物种保护的历史与前景. 水生生物学报, 1999, 23(6): 712-720.] |
| [45] |
Chebanov MS, Galich EV. Sturgeon hatchery manual//Soto D ed. FAO fisheries and aquaculture technical paper. Rome: FAO, 2011: 558.
|
| [46] |
Chebanov MS, Rosenthal H, Gessner J et al. Sturgeon hatchery practices and management for release guidelines//Soto D ed. FAO fisheries and aquaculture technical paper. Rome: FAO, 2011: 570.
|
| [47] |
Yu WG, Xia ZQ, Yu GR et al. Water temperature variation in Three-Gorges Reservoir and its influences on procreation of Chinese sturgeons. Journal of Hohai University:Natural Sciences, 2007, 35(1): 92-95. [余文公, 夏自强, 于国荣等. 三峡水库水温变化及其对中华鲟繁殖的影响. 河海大学学报:自然科学版, 2007, 35(1): 92-95.] |
| [48] |
Watanabe Y, Wei QW, Yang DG et al. Swimming behavior in relation to buoyancy in an open swimbladder fish, the Chinese sturgeon. Journal of Zoology, 2008, 275(4): 381-390. DOI:10.1111/j.1469-7998.2008.00451.x |
| [49] |
Anonymous. Chinese sturgeon breeding base in Xiamen, Fujian Province: Looking forward to getting out of the dilemma. Fujian Daily[2013-09-12]. http://www.shuichan.cc/news_view-151885.html. [匿名记者.福建厦门中华鲟养殖基地: 期待走出困局.福建日报[2013-09-12]. ]
|
| [50] |
Luo J, Du H, Wei QW et al. Reproductive biology of an artificial population of endangered Chinese sturgeon (Acipenser sinensis). Journal of Fishery Sciences of China, 2020, 27(3): 269-276. [罗江, 杜浩, 危起伟等. 濒危中华鲟人工群体的繁殖生物学. 中国水产科学, 2020, 27(3): 269-276.] |
| [51] |
Liu JY, Wei QW, Du H et al. Studies on promoted key technologies in artificial propagation of Chinese sturgeon. Journal of Economic Animal, 2006, 10(2): 96-100. [刘鉴毅, 危起伟, 杜浩等. 中华鲟人工繁殖关键技术的改进效果研究. 经济动物学报, 2006, 10(2): 96-100.] |
| [52] |
Anonymous. 15 leaders were investigated because 36 Chinese sturgeons died during the construction of Mi Yue Bridge in Jingzhou City. Chengdu Economic Daily[2019-07-26]. http://hb.sina.com.cn/news/sh/2019-07-26/detail-ihytcitm4695895.shtml. [匿名记者.荆州芈月桥施工震死36尾中华鲟15名领导干部被查处.成都商报[2019-07-26]. ]
|
| [53] |
Mei ZG, Cheng PL, Wang K et al. A first step for the Yangtze. Science, 2020, 367(6484): 1314. DOI:10.1126/science.abb5537 |
| [54] |
Yang DG, Wei QW, Chen XH et al. Hydrological Status of the spawning ground of Acipenser sinensis underneath the Gezhouba Dam and its relationship with the spawning runs. Acta Ecologica Sinica, 2007, 27(3): 862-868. DOI:10.1016/S1872-2032(07)60023-7 |
| [55] |
Zhu B, Zhou F, Cao H et al. Analysis of genetic variation in the Chinese sturgeon, Acipenser sinensis:estimating the contribution of artificially produced larvae in a wild population. Journal of Applied Ichthyology, 2002, 18(4/5/6): 301-306. |
| [56] |
Wei QW, Li LX, Du H et al. Research on technology for controlled propagation of cultured Chinese sturgeon (Acipenser sinensis). Journal of Fishery Sciences of China, 2013, 20(1): 1-11. [危起伟, 李罗新, 杜浩等. 中华鲟全人工繁殖技术研究. 中国水产科学, 2013, 20(1): 1-11.] |
| [57] |
Van Eenennaam JP, Linares-Casenave J, Doroshov SI. Tank spawning of first generation domestic green sturgeon. Journal of Applied Ichthyology, 2012, 28(4): 505-511. DOI:10.1111/j.1439-0426.2012.02012.x |
| [58] |
Zhang H, Kang M, Wu JM et al. Increasing river temperature shifts impact the Yangtze ecosystem:Evidence from the endangered Chinese sturgeon. Animals, 2019, 9(8): 583. DOI:10.3390/ani9080583 |
| [59] |
Zhang H, Wei QW, Du H. A bedform morphology hypothesis for spawning areas of Chinese sturgeon. Environmental Biology of Fishes, 2009, 84(2): 199-208. DOI:10.1007/s10641-008-9410-2 |
 2020, Vol. 32
2020, Vol. 32 

