(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
活性氧物种(reactive oxygen species, ROS)是一类直接或间接的由分子氧转化而来、具有未配对电子的物质,其化学反应活性比分子氧更为活泼,具有强氧化性、能进行链式反应、不稳定、寿命极短以及顺磁性等特点[1-3]. ROS主要包括超氧阴离子自由基(O2-·)、过氧化氢分子(H2O2)、羟基自由基(·OH)、单线态氧(1O2)、可溶性有机质(DOM)三线激发态(3DOM*)等[2-4]. ROS在天然水体中无处不在,并且在水体的光化学、氧化还原反应中发挥着重要作用:(1)影响有机物,包括有机污染物及难降解有机质在水环境中的降解及转化,如药物[5]、有机磷阻燃剂[6]、多环芳烃[4]、腐殖质[7]等;(2)与水体中微量元素如铁、铬、铜和锰等反应,进而影响微量元素的化学行为和生物可利用性[8-10];(3)改变水体微生物的群落结构和功能[11].过量的ROS可破坏重要生物大分子,对水生生物造成毒害或致死[12-13]. ROS在水生生态系统的生物地球化学等领域中,扮演着重要的角色,并且成为近年来的研究热点.
天然水体中ROS的来源主要为水体中DOM的光化学反应[14-15],尤其是其中的有色可溶性有机物(CDOM)组分. CDOM是一类含有苯环、羧基和羰基等发色团的复杂混合有机物,能够吸收特定波长的太阳光.在水生生态系统中,藻型湖区、草型湖区存在环境具有显著性差异[16],维持稳定生态系统状态的机理也完全不同,水体中DOM的来源及组分特征也存在较大差异,其中草型水生植物衰亡期植物残体的腐烂分解是湖泊水体中DOM的重要来源,然而目前关于草源型DOM释放ROS的过程并不清楚[17].
实际上,对于湖泊系统尤其是浅水湖泊来说,由于其具有更高的透光性,更强的水土界面物质交换,从而更易受外界环境影响[18].因此,随着全球气候变暖,湖泊富营养化,沼泽化过程使得河床被抬高,以及水生植被生态修复技术的推广运用,刺激了浅水湖泊中水生植物的过量生长[19].一方面水生植物在去除污染物、净化水质、改善水体治理以及恢复水体生态功能等方面发挥重要作用,其产生的ROS在去除污染物如有机污染物、重金属等方面同时发挥作用[20];另一方面,过量水生植物存在下,产生的大量ROS有可能对生态系统造成危害.开展草型湖区水生植物产生ROS过程及机理的研究,既有利于了解水生植物产生ROS的环境行为,也有利于提高水生植物对水体污染物净化能力的认识.
本研究通过室内模拟实验,首先参考并选择了3种ROS(3CDOM*、1O2、·OH)的测定方法,接着选取了鄱阳湖具有代表性的草原植物——苔草(Carex tristachya),获得典型草源型DOM提取液,分析了其DOM降解过程中ROS的产生过程及机理.该研究对认识湖泊生态系统中DOM产生ROS的过程、迁移、转化、归宿及其作用机制具有重要的意义,在湖泊环境治理方面有重要的应用价值,同时为水生植物的生态修复功能提供重要的理论支持,以期对湿地生态系统修复提供一定的科学依据.
1 材料与方法 1.1 样品采集与处理植物样品苔草(Carex tristachya)采自于鄱阳湖南矶湿地国家级自然保护区(图 1),装入聚乙烯密封袋,带回实验室,先用自来水冲洗附着泥土,再用去离子水冲洗3遍后,用吸湿纸去除表面水分.将植株茎和叶剪约为5 mm长度,混匀后放入坩埚中于60℃烘干至恒重.称取20 g烘干样品,置于5 L广口烧杯中,添加4 L蒸馏水,避光、室温放置2天,获得DOM浸出液[21].
|
图 1 鄱阳湖采样点位 Fig.1 The sampling site in Lake Poyang |
DOM浸出液用0.45 μm玻璃纤维滤膜过滤,再用0.22 μm滤膜过滤微生物后,分别取400 mL浸出液加入到500 mL广口石英瓶中,并加入捕获剂,每组做3个重复.放置在温度为25℃的光照培养箱下,光源为紫外灯(UVA-340,40 W,LH仪器有限公司,北京,中国),并且避免其它光源干扰.对照组用锡箔纸做避光处理.无DOM的对照组为纯水中添加实验初始浓度捕获剂.在实验一周内,每天按时采集DOM降解液.水样在2 d内完成理化、光学指标的测定.
1.2 检测及计算方法 1.2.1 ROS测定方法本实验中测定3种ROS:3CDOM*,1O2和·OH,分别用2,4,6-三甲基苯酚(TMP)、呋喃甲醇(FFA)和苯酚进行捕获[22-23],捕获剂同时添加,初始浓度分别为1、1、2 mmol/L,其中·OH检测产物为苯酚.测定在高效液相色谱仪(Agilent 1200 series)上进行,紫外检测器进行检测,所有样品用甲醇和磷酸盐缓冲液(pH 2.8)洗脱,洗脱液为60 :40(甲醇:磷酸盐缓冲液)混合物,流速为1.0 mL/min,TMP保留时间11 min,FFA保留时间3.4 min,·OH检测产物苯酚保留时间4.3 min,检测波长为220 nm.测定TMP、FFA、苯酚的标准曲线,以及DOM降解过程中3CDOM*、1O2和·OH的浓度.
1.2.2 紫外光谱测定CDOM吸收光谱采用SHIMADZU UV-2550紫外可见分光光度计进行全波段扫描,扫描波长范围为200~800 nm,比色皿为1 cm的石英槽,以Mili-Q水作空白,按公式(3)~(4)进行计算[24]:
| $ {a^\prime }(\lambda ) = 2.303 \times {\rm{OD}}(\lambda )/r $ | (3) |
| $ a(\lambda ) = {a^\prime }(\lambda ) - {a^\prime }(700) \cdot \lambda /700 $ | (4) |
式中,a′(λ)和a(λ)分别为未经散射校正和经过散射校正过后波长λ处的吸收系数,m-1;r为比色皿光程,m;OD(λ)为样品在波长λ处的吸光度值.
本文采用波长280 nm的CDOM吸收系数来表征CDOM浓度[25]. CDOM的光谱特征是由DOM的组分和浓度共同决定的,通过如下公式[26]将CDOM吸收系数标准化,可表征单位DOC浓度的CDOM对光的吸收能力:
| $ {a^*}(\lambda ) = a(\lambda )/[{\rm{DOC}}] $ | (5) |
式中,a*(λ)为波长λ处的CDOM比吸收系数,L/(mg ·m).
吸收光谱斜率S值的确定:CDOM吸收光谱从紫外到可见波长随波长的增加大致呈现指数衰减规律,公式为[27]:
| $ a(\lambda ) = a\left( {{\lambda _0}} \right)\exp \left[ {S\left( {{\lambda _0} - \lambda } \right)} \right] $ | (6) |
本文采用光谱斜率比值(SR)表征CDOM分子量的变化,其计算方法为[28]:
| $ {S_{\rm{R}}} = {S_{(275 - 295)}}/{S_{(350 - 400)}} $ | (7) |
水样中铵态氮、亚硝态氮、硝态氮、总氮(TN)、可溶性无机磷(DIP)及可溶性有机磷(DOP).采用过硫酸盐氧化法测定全氮;磷钼蓝比色法测定无机磷和有机磷;过硫酸钾法测定总磷(TP)、采用纳氏比色法测定铵态氮(NH4+-N);硝态氮(NO3--N)和亚硝态氮(NO2--N)浓度采用全自动智能化学分析仪(Smartchem 200,AMS-Westco,意大利)进行测定.可溶性有机碳(DOC)浓度利用连续流动分析仪(Futura,Alliance,法国)测定,用邻苯二甲酸氢钾标准储备液稀释梯度作为标准曲线对照. 1.2.4三维荧光光谱测定水样稀释10倍后采用三维荧光分光光度计(Hitachi F-4500)测定水样的三维荧光光谱(EEMs).激发波长(Ex)和发射波长(Em)的扫描区间分别为200~450和250~600 nm,步长分别为5和1 nm,扫描速率为2400 nm/min,带宽裂缝均为5 nm,光电倍增管电压为800 V.扫描光谱进行仪器自动校正,以Milli-Q水作为空白.
1.3 统计分析采用MATLAB进行数据拟合.采用SPSS 19.0软件进行数据统计分析,P>0.05表示未达到显著检验水平;0.01 < P < 0.05为显著水平,P < 0.01为极显著水平.采用Origin 8.5软件绘图.
2 结果与讨论 2.1 ROS测定方法的构建由于自由基具有半衰期极短、浓度低等特点,故准确检测自由基的种类及含量是有关ROS研究的前提.目前用于检测自由基的方法有:电子自旋共振(ESR)技术、化学发光法、高效液相色谱法、分光光度法、电化学法等[29-30].其中,高效液相色谱法是自由基的间接测量方法,具有可持续测定、快速、高效等优点.已有研究报道化学发光探针——MCLA可用于O2-·的检测,检测限低至1.41 pmol/s[31-32]. TMP、FFA和苯可以分别做捕获剂进而用高效液相色谱法测定水体中3CDOM*、1O2和·OH浓度[33].对于TMP、FFA和苯酚的紫外检测波长分别为220、230和210 nm,洗脱液的比例也不相同,并且以往的研究都是采用单独添加一种捕获剂的办法对一种ROS测定,需要耗费大量的时间和样品量.本研究结合已有的方法,将3种捕获剂同时添加,在紫外检测波长220 nm、洗脱液为60 :40(甲醇:磷酸盐缓冲液)条件下对于提取的样品一次进样,分别在3个对应的保留时间出峰,测定实验中ROS的产生及变化,目前已成功测定水体中3CDOM*、1O2和·OH浓度(表 1),大大缩短了实验时间.
| 表 1 3CDOM*、1O2和·OH标准曲线及其检测范围 Tab. 1 Standard curves of 3CDOM*, 1O2 and·OH and their detection ranges |
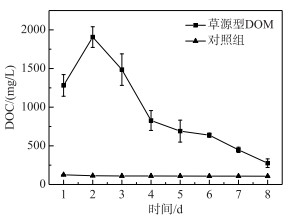
DOM光化学降解有两个途径,一是直接光降解,即溶解性有机质直接吸收光的能量发生的降解变化,另一个是间接光解,通过光照过程中生成的ROS的氧化作用;水中存在的中间介质吸收光子经过电子转移过程将能量传递给有机质,激发态的有机质进一步反应生成ROS[34],在光降解DOM产生ROS的过程中,DOC是一项直接反映DOM降解情况的指标.如图 2所示,DOC浓度从初始的1906.8 mg/L降为实验结束后的275.4 mg/L,紫外条件下草源型DOM浸出液光降解效果显著.在降解中后期(2~8 d),DOC浓度在持续下降,在2~4 d期间降幅较大,之后平稳下降.另外本实验设置了无光无微生物的对照组,实验结果显示无光无微生物处理下对DOC的降解没有影响.另外在无DOM的对照组中,DOC浓度变化同样很低,推测主要由于3种捕获剂——TMP、FFA和苯在短时间内光降解反应速率很低的原因[35-36].
|
图 2 草源型DOM及对照组降解过程中DOC浓度 Fig.2 Changes of DOC concentration during degradation of grass-source DOM and control group |
在DOM降解过程中,从ROS产生来看3种自由基浓度均随着降解时间的延长而都有明显的增加(图 3),其中·OH累积浓度在第7天和第8天有一定程度的下降.实验结束时,3CDOM*累积浓度与1O2相近,分别为0.87和0.99 mmol/L,而最少累积浓度的ROS为·OH,为0.026 mmol/L.本实验证实了草源型DOM能够在光分解过程中产生大量ROS,并且ROS随时间增加而逐渐上升.并且这种关系与捕获剂的选择性加入密不可分,捕获剂持续捕获DOM降解过程产生的ROS,在随着时间的推移而逐渐累积的过程中,既保证了ROS不会长时间处于游离状态,也阻止了ROS参与其它化学反应,使得ROS能够稳定累积.

|
图 3 DOM降解过程中3CDOM* (A)、1O2(B)、·OH (C)的浓度变化 Fig.3 Changes of 3CDOM* (A), 1O2(B) and·OH (C) concentrations during the degradation of DOM |
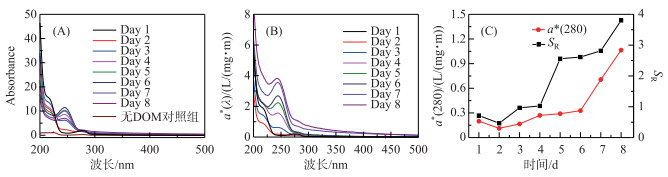
由图 4A可知,捕获剂对光谱吸收系数影响较小.在此基础上分析CDOM的光谱吸收系数. CDOM光谱吸收系数总体上呈现指数形式单调衰减,200~250 nm处紫外波段吸收系数最大,350 nm以后的波段吸收曲线较为平滑(图 4B),这与国内外学者公认的CDOM光吸收特征相符合,因此CDOM在光降解过程中吸收度的减小具有不均衡性,对光的吸收也具有选择性,吸收损失都主要发生在320 nm以下的紫外区,其中UVB(275~320 nm)波段无论对陆源DOM,还是对生物自生源的DOM,都是最有效的辐照光谱区[21].在275 nm附近存在一显著的肩,该肩值与Warnock等[37]的报道结果一致,并且肩峰随着DOM光解时间的增加而增强,从实验初期无肩峰到后期肩峰突出十分明显.然而,随着DOM降解时间的增加,CDOM相对浓度在第2天略微下降后开始上升,在第8天达到最大值.另外,图 4C给出了光谱斜率比值SR,SR表征CDOM的平均相对分子量,根据SR与相对分子量呈反比的关系可以看到随着DOM光解时间的增加,CDOM分子量逐渐降低,说明大分子逐渐被光降解为小分子.
|
图 4 DOM和捕获剂的的紫外可见吸收光谱(A)和CDOM比吸收系数随波长的变化(B)及CDOM相对浓度和光谱斜率比值SR(C) Fig.4 Uv-vis spectra of DOM samples and probes (A) and CDOM absorption coefficient with different wavelengths (B) and relative concentrations of CDOM and spectral slope ratio SR(C) |
进一步分析表明,随着DOC浓度的降低,CDOM组分中容易光降解部分先得到快速降解,a*(280)先有微弱降低(图 4B),后剩余难光降解部分,光解速度较慢,但由于DOC在持续降低,标准化后的CDOM吸收系数(a(280)/[DOC])在第2~8天能够呈现明显上升趋势,整体与ROS累计含量呈现正相关关系(表 2),尤其与3CDOM*、1O2浓度显著性水平较好(P=0.031、0.035),相关系数分别为0.753、0.742.虽然CDOM与·OH呈现正相关关系,但显著性水平一般(P=0.231).结果证明ROS的产生与DOM中的光敏感物质——CDOM密切相关,CDOM中含有大量的发色基团,是重要的天然光敏剂,在紫外辐射或太阳光照射下吸收光子能量,引发一系列反应.单线态(state DOM singlet,1DOM)分子吸收光能先转化为激发单线态(excited state DOM singlet,1DOM*),进而转化为激发三线态(excited state DOM triplets,3DOM*)(公式(8)),进一步与溶解氧分子等发生一系列反应(公式(9)~(12)),产生3CDOM*、1O2、·OH等活性中间体[36].
| 表 2 CDOM含量与3CDOM*、1O2、·OH浓度的相关系数 Tab. 2 Correlation coefficient CDOM content and the concentration of 3CDOM*, 1O2 and ·OH |
| $ {\rm{CDOM}} + {\rm{h}}v{ \to ^1}{\rm{CDOM}}{ \to ^3}{\rm{CDO}}{{\rm{M}}^*} $ | (8) |
| $ ^3{\rm{CDO}}{{\rm{M}}^*} + {{\rm{H}}_2}{\rm{O}}\left( {{\rm{O}}{{\rm{H}}^ - }} \right) \to {\rm{CDOM}} - {\rm{H}} \cdot + \cdot {\rm{OH}}\left( {{\rm{CDO}}{{\rm{M}}^ - } \cdot + \cdot {\rm{OH}}} \right) $ | (9) |
| $ ^3{\rm{CDO}}{{\rm{M}}^*} + {{\rm{O}}_2} \to {\rm{CDOM}}{ + ^1}{{\rm{O}}_2} $ | (10) |
| $ ^3{\rm{CDO}}{{\rm{M}}^*} + {\rm{R}} \to {\rm{CDO}}{{\rm{M}}^ - } \cdot + {{\rm{R}}^ - } \cdot $ | (11) |
| $ {\rm{CDO}}{{\rm{M}}^ - } \cdot + {0_2} \to {\rm{CDOM}} + {\rm{O}}_2^ - \cdot $ | (12) |
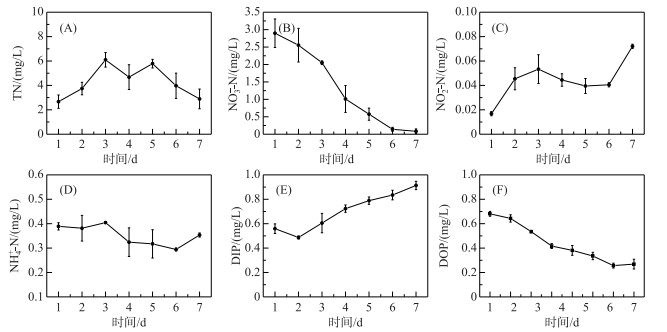
DOM光降解过程中,水中TN浓度先上升后下降,在实验第8天达到最小值,为2.09 mg/L(图 5),与ROS的显著性水平较弱(P>0.05). NO3--N浓度逐渐下降,6天后趋于稳定,在实验第7天为最小值(0.085 mg/L),与ROS达到了极显著性水平(P=0.001),并且呈现负相关关系.与NO2--N浓度在前6天上升又略微下降,之后又迅速上升,在实验结束时浓度最高,为0.07 mg/L,并与ROS呈现正相关关系.水中NH4+-N浓度波动变化,在实验结束时为0.42 mg/L,显著性水平较弱.水体中DIP在实验前2天呈下降趋势,之后逐渐增加,实验结束时浓度为0.95 mg/L,而DOP呈相反变化趋势,结果表明,在光催化下,有机磷一定程度上向无机磷发生了转化.也有研究表明[38],硝酸盐、亚硝酸盐也是水体中ROS的重要来源(公式(13)~(14)).水体中NO3--N在反硝化的作用下生成NO2--N,而NO2--N能够在光激发作用下产生ROS,因此本研究结果进一步分析表明,3CDOM*、1O2、·OH浓度与NO3--N浓度呈现负相关关系,与NO2--N浓度呈现正相关关系.
|
图 5 DOM降解过程中水体中TN(A)、NO3--N(B)、NO2--N(C)、NH4+-N(D)、DIP(E)和DOP(F)浓度 Fig.5 The concentrations of TN(A), NO3--N(B), NO2--N(C), NH4+-N(D), DIP(E) and DOP (F) in the water during the degradation of DOM |
| $ {\rm{NO}}_2^ - + {\rm{h}}v + {{\rm{H}}^ + } \to \cdot {\rm{OH}} + \cdot {\rm{NO}} $ | (13) |
| $ {\rm{HN}}{{\rm{O}}_2} + {\rm{h}}v \to \cdot {\rm{OH}} + \cdot {\rm{NO}} $ | (14) |
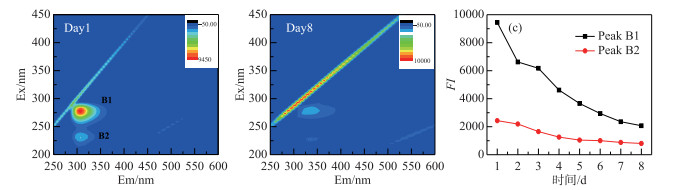
图 6为DOM光解过程中3D-EEMs图.从DOM降解液中发现了强烈的类蛋白荧光峰[39],其中B2激发波长最大值分别在225 nm处,发射波长最大值在306 nm处,为低激发光络氨酸荧光组分;B1(275 nm/306 nm)为类络氨酸荧光组分[40].随着光解时间的增加,这两个区域的荧光强度明显减弱,在处理第8天后,络氨酸荧光峰(Peak B2)几乎完全消失,仅在Ex/Em= (220~250) nm/(300~350) nm残留很弱荧光峰,而类络氨酸峰荧光指数FI衰减率也达到了80 % (图 6C),表明DOM发生了显著的光化学降解,主要为类蛋白分子的降解.
|
图 6 DOM降解第1天和第8天的EEMs谱图(A, B)及类蛋白荧光组分峰强变化(C) Fig.6 The EEMs spectra of the first and eighth day(A, B) and changes of fluorescence component peak intensity of protein-like proteins during the degradation of DOM(C) |
| 表 3 ROS与水质参数的相关系数 Tab. 3 The correlation coefficient between ROS and the water quality parameters |
同时有着较强的紫外激发波段的类蛋白分子证明CDOM吸收光谱在紫外波段迅速衰减变化的现象.本研究在紫外光照条件下,对在低激发类蛋白荧光峰的强度变化与ROS进行相关性分析发现(表 4),类蛋白荧光峰值强度与ROS累积浓度呈现明显负相关关系,其中类络氨酸荧光组分峰值强度与ROS浓度之间具有较高的显著性水平(P=0.001),r在-0.976~-0.938之间.低激发光络氨酸荧光组分与ROS累计浓度呈现出同样极高的显著性水平(P=0.001)和相关性.进一步说明了在DOM的光降解过程中蛋白质分子的降解是产生ROS很重要的一个部分.目前,Zhang等[41]通过比较污水DOM中各组分产生ROS的情况,也发现含有大量的多肽类和蛋白质的亲水性成分相比疏水性成分和中性成分可产生更多的ROS.
| 表 4 ROS与类蛋白荧光组分峰值强度的相关系数 Tab. 4 The correlation coefficient between ROS and fluorescence component peak intensity of protein-like proteins |
本研究中,CDOM吸收光谱从紫外到可见区通常情况下都可近似呈指数形式降低,但DOM降解液在275 nm处出现肩峰,破坏了这种指数衰减规律,这种现象在污染比较严重的太湖[42]、厦门筼筜湖及一些近海海域[37]也有观测到,但还没有非常明确的解释.并且肩峰随着DOM光解时间的增加而增强,从实验初期无肩峰到后期肩峰突出十分明显.综合考虑在太湖、筼筜湖等的观测结果,推测该峰的出现和增强或可用来指示水环境中现场生物(如藻类、草类、微生物)活动对CDOM的贡献,同时也反映了水体中草类DOM光学性质的变化,导致了结构或性质有所不同的CDOM的产生[43].
另外在本研究中,DOM降解液的荧光指数FI≥2.08,是典型水体植物释放液.有研究发现B1(275 nm/305 nm)为陆源物质的光化学降解产物,Peak B2也与文献中提到的C5峰十分相近,解释为光化学降解产物[44].水体中也经常存在陆源DOM的汇入,使水环境中DOM组成和结构更丰富.由于自然水体的复杂性,DOM产生ROS的过程会随着不同类型DOM和其他影响因素的改变而变化,不同形成环境DOM产生ROS的能力有所不同,比如一般陆源DOM产生1O2的能力整体上要强于水源DOM,并且不同来源的DOM其产生1O2的能力也存在差异[45].
在水生生态系统中,草型DOM的ROS光化学行为研究有助于了解水体中污染物的转化机制及其环境归趋.由DOM介导或直接产生的ROS对于本身光化学活性差或者没有光化学活性的污染物可以进行直接光解,但对于本身具有光化学活性、可以直接光解的污染物,DOM会抑制其光化学转化和降解.不同来源的DOM都会具有一些光吸收的基团,都存在不同程度的光吸收,如本研究草型DOM中的类蛋白分子在UVB波段的显著吸收,因此DOM对污染物的光屏蔽是一个相对普遍的抑制机制.同时对于本研究中的草型DOM释放不同ROS来看,每种ROS的产生速率也有较大差异,对于不同性质、不同来源的水体释放ROS能力有差异,产生的ROS种类、浓度及行为都有不同,并且不同的光解反应、光解条件或光解时段下可能是不同的ROS占主导[4].
4 结论1) 利用TMP、FFA和苯的混合捕获剂优化了3CDOM*,1O2和·OH的测定方法,对DOM光降解过程中产生3CDOM*,1O2和·OH的累积浓度进行检测.
2) 3CDOM*的释放量相较于1O2和·OH最多,·OH释放量低于3CDOM*和1O2两个数量级.
3) DOM降解过程中,CDOM与ROS累计浓度呈现正相关关系,与3CDOM*和1O2浓度显著性水平较好,进一步证明CDOM是产生ROS的重要来源和介导.
4) DOM中NO2--N和NO3--N是影响水体ROS浓度的重要影响因素,而其它营养盐物质对其影响较小.
5) 类蛋白荧光峰值强度的衰减与ROS累积浓度呈现明显负相关关系,说明在DOM的光降解过程中蛋白质分子的降解是产生ROS很重要的一个部分.
| [1] |
Zhong P, Lin ZF, Liu ZW et al. The sources, species and measurement of reactive oxygen species in aquatic environment. Ecologic Science, 2005, 24(4): 364-367. [钟萍, 林志芬, 刘正文等. 水环境中活性氧的来源、种类及测定方法. 生态科学, 2005, 24(4): 364-367.] |
| [2] |
Schneider RJ, Roe KL, Hansel CM et al. Species-level variability in extracellular production rates of reactive oxygen species by diatoms. Frontiers in Chemistry, 2016, 4: 1-13. DOI:10.3389/fchem.2016.00005 |
| [3] |
Zhang T, Hansel CM, Voelker BM et al. Extensive dark biological production of reactive oxygen species in brackish and freshwater ponds. Environmental Science & Technology, 2016, 50(6): 2983-2993. DOI:10.1021/acs.est.5b03906 |
| [4] |
Tai C, Li YB, Yin YG et al. Free radical photochemistry of dissolved organic matter in natural water. Progress in Chemistry, 2012, 24(7): 1388-1397. [邰超, 李雁宾, 阴永光等. 天然水体中可溶性有机质的自由基光化学行为. 化学进展, 2012, 24(7): 1388-1397.] |
| [5] |
Passananti M, Temussi F, Iesce MR et al. The impact of the hydroxyl radical photochemical sources on the rivastigmine drug transformation in mimic and natural waters. Water Research, 2013, 47(14): 5422-5430. DOI:10.1016/j.watres.2013.06.024 |
| [6] |
Cristale J, Dantas RF, Luca AD et al. Role of oxygen and DOM in sunlight induced photodegradation of organophosphorous flame retardants in river water. Journal of Hazardous Materials, 2017, 323(SI): 242-249. DOI:10.1016/j.jhazmat.2016.05.019 |
| [7] |
Fujii M, Otani E. Photochemical generation and decay kinetics of superoxide and hydrogen peroxide in the presence of standard humic and fulvic acids. Water Research, 2017, 123: 642-654. DOI:10.1016/j.watres.2017.07.015 |
| [8] |
Pettine M, Gennari F, Campanella L et al. The effect of organic compounds in the oxidation kinetics of Cr(Ⅲ) by H2O2. Geochimica et Cosmochimica Acta, 2008, 72(23): 5692-5707. DOI:10.1016/j.gca.2008.09.009 |
| [9] |
Heller MI, Croot PL. Superoxide decay kinetics in the southern ocean. Environmental Science & Technology, 2010, 44(1): 191-196. DOI:10.1021/es901766r |
| [10] |
Hansel CM, Zeiner CA, Santelli CM et al. Mn(II) oxidation by an ascomycete fungus is linked to superoxide production during asexual reproduction. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(31): 12621-12625. DOI:10.1073/pnas.1203885109 |
| [11] |
Pancotto VA, Sala OE, Cabello M et al. Solar UV-B decreases decomposition in herbaceous plant litter in Tierra del Fuego, Argentina:potential role of an altered decomposer community. Global Change Biology, 2003, 9(10): 1465-1474. DOI:10.1046/j.1365-2486.2003.00667.x |
| [12] |
Mai-Prochnow A, Lucas-Elio P, Egan S et al. Hydrogen peroxide linked to lysine oxidase activity facilitates biofilm differentiation and dispersal in several gram-negative bacteria. Journal of Bacteriology, 2008, 190(15): 5493-5501. DOI:10.1128/JB.00549-08 |
| [13] |
Zinser ER. The microbial contribution to reactive oxygen species dynamics in marine ecosystems. Environmental Microbiology Reports, 2018, 10(4): 412-427. DOI:10.1111/1758-2229.12626 |
| [14] |
Wang J, Xing ML, Tai C et al. Generation of hydroxyl radical from water constituents under different spectra bands of sunlight. Environmental Chemistry, 2015, 34(12): 2162-2169. [王静, 邢梦林, 邰超等. 不同光谱区间日光照射下水体成分的光致羟基自由基生成研究. 环境化学, 2015, 34(12): 2162-2169. DOI:10.7524/j.issn.0254-6108.2015.11.2015060402] |
| [15] |
Méndez-Díaz JD, Shimabuku KK, Ma J et al. Sunlight-driven photochemical halogenation of dissolved organic matter in seawater:A natural abiotic source of organobromine and organoiodine. Environmental Science & Technology, 2014, 48(13): 7418-7427. DOI:10.1021/es5016668 |
| [16] |
Zhang YL, Qing BQ, Ma RH et al. Chromophoric dissolved organic matter absorption characteristics with relation to fluorescence in typical macrophyte, algae lake zones of Lake Taihu. Environmental Science, 2005(2): 142-147. [张运林, 秦伯强, 马荣华等. 太湖典型草、藻型湖区有色可溶性有机物的吸收及荧光特性. 环境科学, 2005(2): 142-147.] |
| [17] |
Zhang T, Hansel CM, Voelker BM et al. Extensive dark biological production of reactive oxygen species in brackish and freshwater ponds. Environmental Science & Technology, 2016, 50(6): 2983-2993. DOI:10.1021/acs.est.5b03906 |
| [18] |
Scheffer M, van Nes EH. Shallow lakes theory revisited:various alternative regimes driven by climate, nutrients, depth and lake size. Hydrobiologia, 2007, 584: 455-466. DOI:10.1007/s10750-007-0616-7 |
| [19] |
Xu F, Yang ZF, Chen B et al. Impact of submerged plants on ecosystem health of the plant-dominated Baiyangdian Lake, China. Ecological Modelling, 2013, 252(SI): 167-175. DOI:10.1016/j.ecolmodel.2012.07.013 |
| [20] |
Dong XX, Yan CZ, Wang ZS et al. Removal efficiency and accumulation characteristics of Cu, Pb and Cd in combined purification systems. Chinese Journal of Environmental Engineering, 2014, 8(4): 1447-1453. [董小霞, 颜昌宙, 王灶生等. 组合式水生植物净化系统对Cu、Pb和Cd的去除与生物富集特征. 环境工程学报, 2014, 8(4): 1447-1453.] |
| [21] |
Chen WZ, Yi YY, Yu XX et al. Photochemical degradation of autochthonous dissolved organic matter from the culture media of Chlorella spp. Acta Scientiae Circumstantiae, 2012, 32(5): 1095-1103. [陈文昭, 易月圆, 余翔翔等. 小球藻来源溶解有机质的光化学降解特性. 环境科学学报, 2012, 32(5): 1095-1103.] |
| [22] |
Vione D, Falletti G, Maurino V et al. Sources and sinks of hydroxyl radicals upon irradiation of natural water samples. Environmental Science & Technology, 2006, 40(12): 3775-3781. DOI:10.1021/es052206b |
| [23] |
Boreen AL, Edhlund BL, Cotner JB et al. Indirect photodegradation of dissolved free amino acids:the contribution of singlet oxygen and the differential reactivity of DOM from various sources. Environmental Science & Technology, 2008, 42(15): 5492-5498. DOI:10.1021/es800185d |
| [24] |
Guo WD, Cheng YY. Photodegradation of chromophoric dissolved organic matter from jiulong river estuary under natural solar radiation. Environmental Science, 2008, 29(6): 1463-1468. [郭卫东, 程远月. 天然日光辐照下河口区CDOM的光化学降解. 环境科学, 2008, 29(6): 1463-1468. DOI:10.3321/j.issn:0250-3301.2008.06.002] |
| [25] |
Zhou Y, Wen H, Liu J et al. The optical characteristics and sources of chromophoric dissolved organic matter (CDOM) in seasonal snow of northwestern China. Cryosphere, 2019, 13(1): 157-175. DOI:10.5194/tc-13-157-2019 |
| [26] |
Kowalczuk P, Zablocka M, Sagan S et al. Fluorescence measured in situ as a proxy of CDOM absorption and DOC concentration in the Baltic Sea. Oceanologia, 2010, 52(3): 431-471. DOI:10.5697/oc.52-3.431 |
| [27] |
Bricaud A, Morel A, Prieur L. Absorption by dissolved organic matter of the sea (yellow substance) in the UV and visible domains. Limnology and Oceanography, 1981, 26(1): 43-53. DOI:10.4319/lo.1981.26.1.0043 |
| [28] |
Xu XK, Luo XB, Jiang SH et al. Biodegradation of dissolved organic carbon in soil extracts and leachates from a temperate forest stand and its relationship to ultraviolet absorbance. Science Bulletin, 2012, 57(8): 912-920. DOI:10.1007/s11434-011-4923-z |
| [29] |
Yang X, Kong LS, Wang LS. Determination of hydroxyl radicals in aquatic environment with a new molecular probe. Environmental Chemistry, 2003, 22(5): 490-492. [杨曦, 孔令仁, 王连生. 水环境中OH自由基的分子探针法测定. 环境化学, 2003, 22(5): 490-492. DOI:10.3321/j.issn:0254-6108.2003.05.015] |
| [30] |
Qi M. Detection methods of hydroxyl radicals. Electric Power Technology and Environmental Protection, 2014, 30(6): 27-30. [齐萌. 羟基自由基检测技术方法概述. 电力科技与环保, 2014, 30(6): 27-30. DOI:10.3969/j.issn.1674-8069.2014.06.009] |
| [31] |
Godrant A, Rose AL, Sarthou G et al. New method for the determination of extracellular production of superoxide by marine phytoplankton using the chemiluminescence probes MCLA and red-CLA. Limnol Oceanogr-Meth, 2009, 7: 682-692. DOI:10.4319/lom.2009.7.682 |
| [32] |
Hansel CM, Buchwald C, Diaz JM et al. Dynamics of extracellular superoxide production by Trichodesmium colonies from the Sargasso Sea. Limnol Oceanogr, 2016, 61: 1188-1200. DOI:10.1002/lno.10266 |
| [33] |
Laurentiis DE, Buoso S, Maurino V et al. Optical and photochemical characterization of chromophoric dissolved organic matter from lakes in Terra Nova Bay, Antarctica. Evidence of considerable photoreactivity in an extreme environment. Environmental Science & Technology, 2013, 47(24): 14089-14098. DOI:10.1021/es403364z |
| [34] |
Amado AM, Cotner JB, Suhett AL et al. Contrasting interactions mediate dissolved organic matter decomposition in tropical aquatic ecosystems. Aquatic Microbial Ecology, 2007, 49(1): 25-34. DOI:10.3354/ame01131 |
| [35] |
Fernando L, Rosario-Ortiz, Silvio C. Probe compounds to assess the photochemical activity of dissolved organic matter. Environmental Science & Technology, 2016, 50(23): 12532-12547. DOI:10.1021/acs.est.6b02776 |
| [36] |
Al Housari F, Vione D, Chiron S et al. Reactive photoinduced species in estuarine waters. Characterization of hydroxyl radical, singlet oxygen and dissolved organic matter triplet state in natural oxidation processes. Photochem Photochemical & Photobiological Sciences, 2010, 9: 78-86. DOI:10.1039/B9PP00030E |
| [37] |
Warnock RE, Gieskes WC, Laar S. Regional and seasonal differences in light absorption by yellow substance in the southern bight of the North Sea. Sea Research, 1999, 42(3): 169-178. DOI:10.1016/S1385-1101(99)00025-8 |
| [38] |
Vione D, Lauri V, Minero C et al. Photostability and photolability of dissolved organic matter upon irradiation of natural water samples under simulated sunlight. Aquatic Sciences, 2009, 71(1): 34-45. DOI:10.1007/s00027-008-8084-3 |
| [39] |
Mudarra M, Andreo B, Bake A. Characterisation of dissolved organic matter in karst spring waters using intrinsic fluorescence:Relationship with infiltration processes. Science of the Total Environment, 2011, 409: 3448-3462. DOI:10.1016/j.scitotenv.2011.05.026 |
| [40] |
Hansen AM, Kraus TEC, Pellerin BA et al. Optical properties of dissolved organic matter (DOM):effects of biological and photolytic degradation. Limnology and Oceanography, 2016, 61(3): 1015-1032. DOI:10.1002/lno.10270 |
| [41] |
Zhang D, Yan S, Song W. Photochemically Induced Formation of Reactive Oxygen Species (ROS) from effluent organic matter. Environmental Science & Technology, 2014, 48(21): 12645-12653. DOI:10.1021/es5028663 |
| [42] |
Huang CC, Li YM, Sun DY et al. Spatial-temporal distribution of cdom molecular weight and its ultraviolet absorb coefficience characteristics in Taihu Lake. China Environmental Science, 2009, 29(3): 261-268. [黄昌春, 李云梅, 孙德勇等. 太湖CDOM紫外吸收特性及其分子量时空分布特征. 环境科学, 2009, 29(3): 261-268.] |
| [43] |
Xie HX, Aubry C, Bélanger S et al. The dynamics of absorption coefficients of CDOM and particles in the St. Lawrence estuarine system:Biogeochemical and physical implications. Marine Chemistry, 2011, 128: 44-56. DOI:10.1016/j.marchem.2011.10.001 |
| [44] |
Zhou ZZ, Guo LD, Shiller AM et al. Characterization of oil components from the deepwater horizon oil spill in the Gulf of Mexico using fluorescence EEM and PARAFAC techniques. Marine Chemistry, 2013, 148: 10-21. DOI:10.1016/j.marchem.2012.10.003 |
| [45] |
Paul A, Hackbarth S, Vogt RD et al. Photogeneration of singlet oxygen by humic substances:comparison of humic substances of aquatic and terrestrial origin. Photochemical & Photobiological Sciences, 2004, 3(3): 273-280. DOI:10.1039/b312146a |
 2020, Vol. 32
2020, Vol. 32 

