(2: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
淡水生态系统中浮游植物群落的变动受到多种因素的调控[1],包括栖息地地理特征、种间竞争、捕食作用等[2].大量的非生物和生物因素,及其之间的相互作用,使得浮游植物群落结构变化过程更为复杂[3].蓝藻优势种群对环境变化的响应极为敏感[4],常见的水华蓝藻——微囊藻(Microcystis sp.)和鱼腥藻(Anabaena sp.)的季节性变动通常在春季以鱼腥藻占优势,夏季以微囊藻占优势,秋冬季又转变为鱼腥藻[5]. 2015—2016年的巢湖监测数据显示在夏季东湖区也出现大面积的鱼腥藻,这与两种藻通常的季节性演替规律不同[6].一般认为温度是不同水华蓝藻季节性演替的直接驱动因素[7-9],然而这里温度似乎并不足以完全解释巢湖的季节性演替变化,藻类自身内部功能特性(functional traits)的调节可能是水华蓝藻得以维持优势的重要内在机制.
基于功能特性的群落生态学研究方法有利于理解群落演替或特征维持的生态学机理,近年来被广泛关注[10-11],该方法最重要的一个方面就是各功能特性之间的权衡(trade-off)[12],如物种对不同资源竞争能力的权衡[13],竞争能力与生长速率间的权衡[14],形态变化与生长速率的权衡等[15].这种权衡已经被发现存在于一些特定种类中,如赤潮藻类亚历山大藻生长速率和细胞大小之间的权衡[16].越来越多的研究开始关注蓝藻的各功能特性之间的权衡[17-19],然而,我们对这一过程中不同功能性状如何平衡的理解是有限的.
温度是影响浮游植物种群生长的重要因素之一,它与浮游植物的许多基本功能特性,如酶活性、膜流动性密切相关,并影响着细胞的光合作用和生长的状态[8-9, 20]. Thomas等[21]在研究温度对微囊藻的影响时发现当水温超过20℃时藻团获得浮力迅速漂浮. Chalifour等[22]在研究微囊藻生理特性时发现光合作用随着温度的升高明显增强.温度变化敏感,单个藻丝内细胞数随温度变化而变化[23],另外,巫娟等[24]在研究光照度对水华鱼腥藻藻丝长度的影响时发现,光照越强藻丝长度越快增大到最大值.因此,微囊藻和鱼腥藻通过调节自身生理、形态特性以适应环境的变化[25].然而在不同环境条件下,两种蓝藻如何调整形态及生理特性同自身生长之间的权衡仍有待探讨.
本研究选用水华蓝藻常见优势属中的一株微囊藻和一株鱼腥藻,通过不同温度梯度下的室内模拟试验,分析不同温度下两种藻形态和光合特性变化,及其与生长之间的关系,阐述两种藻功能特性对温度的响应模式及其与生长之间的权衡,该研究将有助于深入了解微囊藻和鱼腥藻的种群动态及其环境适应机制.
1 材料与方法 1.1 藻种培养本研究所用藻种购于中国科学院水生生物研究所淡水藻种库,分别为一株铜绿微囊藻(Microcystis aeruginosa FACHB-905,下文简称“微囊藻”或微囊藻(FACHB-905))和一株鱼腥藻(Anabaena sp. FACHB-82,下文简称“鱼腥藻”或鱼腥藻(FACHB-82)).试验前,将两种藻接种至BG-11培养基,在恒温20℃、光照25 μmol photons/(m2·s)、光暗比12 :12条件下扩大培养. 7 d后,分别取一定体积的培养物3000 r/min离心15 min,弃掉上清液,用15 mg/L NaHCO3溶液洗涤后离心,重复3次,所得培养物用无菌水稀释备用.分别在250 mL玻璃三角瓶中加入150 mL培养基,接种上述洗涤并稀释过的培养物,初始接种浓度为1×105 cells/mL.根据本课题组调查以及Wan等[26]的报道,巢湖湖水温度在部分年份盛夏时可超过30℃,但是大多时间在30℃以下.故本实验培养温度分别设置为17、21、24、27和30℃,用以模拟春夏之交的温度变化过程,每组设置4组平行,光照强度为25 μmol photons/(m2·s),光暗比为12 h :12 h.
1.2 细胞及光合指标每隔3 d取3 mL培养物以检测其形态及光合指标.形态指标取微囊藻的细胞直径、鱼腥藻的细胞直径和藻丝长度,用光学显微(Imager. A2x, ZEISS, Germany)在100x(A-Plar 10x/0.25)和400x(EC plan-NEOFLUAR 40x/0.75)下结合ZEN 3(blue dition)显微镜拍照软件,再用图像分析软件(Image Pro Plus 6.0, Media Cybernetics, Inc., USA)分别提取两种藻的细胞直径和鱼腥藻的藻丝长度.利用浮游植物荧光仪Phyto-PAM(Walz, Effeltrich, Germany)测定两种藻类的叶绿素荧光参数,取样2 mL培养物暗适应15 min进行叶绿素荧光测定,荧光参数按照下面的公式计算:
| $ F_{\mathrm{v}} / F_{\mathrm{m}}=\left(F_{\mathrm{m}}-F_{\mathrm{o}}\right) / F_{\mathrm{m}} $ | (1) |
| $ F_{\mathrm{v}}^{\prime} / F_{\mathrm{m}}^{\prime}=\left(F_{\mathrm{m}}^{\prime}-F_{\mathrm{t}}\right) / F_{\mathrm{m}}^{\prime} $ | (2) |
式中,Fo是初始光,也可以称为基础荧光,是在暗适应状态下当光系统Ⅱ (PSⅡ)的所有反应中心处于完全开放状态并且所有的非光化学过程处于最小时的荧光产量,Fm是最大荧光,是在暗适应状态下,当PSⅡ的所有反应中心处于完全关闭状态并且所有的非光化学过程处于最小时的荧光产量,Fm′是在光适应状态下,当PSⅡ的所有反应中心处于完全关闭状态并且所有的非光化学过程处于最优态时的荧光产量.最大荧光变化与最大荧光量子产量的比值(Fv/Fm)反映了光系统PSⅡ反应中心激发捕获的效率[27-29]. Fv/Fm是最大光合量子产量,Fv′/Fm′是有效光合量子产量[30].根据Phyto-PAM使用要求,在MF32(即光强条件为16 μmol photons/(m2·s))时测定叶绿素a含量(Chl.a).
1.3 比增长速率培养物的比增长速率(μ)计算公式为[31]:
| $ \mu=\left[\ln \left(N_{n}\right)-\ln \left(N_{0}\right)\right] / t $ | (3) |
式中, Nn为第n天培养物的叶绿素a浓度,μg/L;N0为第0天的叶绿素a浓度,μg/L;t为培养周期,d.
1.4 数据处理数据采用Excel 2016进行整理,Origin 8.5和R语言平台进行统计分析和相关绘图,统计显著性采用‘agricolae’和‘mgcv’ R语言程序包确定,组间差异采用方差分析(TukeyHSD)确定,绘图采用‘ggplot2’程序包完成.
2 结果分析 2.1 温度对两种藻比增长速率的影响不同温度下微囊藻的比增长速率有所不同,24、27和30℃条件下的比增长速率明显高于17和21℃组,且与17和21℃组存在显著差异(P < 0.05)(图 1).当温度≤24℃时,比增长速率随着温度的升高而升高,结果如下:17℃为1.45 d-1,21℃为1.53 d-1,24℃为1.7 d-1;当温度> 24℃时相对稳定,结果如下:27℃为1.69 d-1,30℃为1.67 d-1.鱼腥藻的比增长速率随温度的变化趋势与微囊藻的类似,27和30℃最高,21和24℃相近,17℃最低.
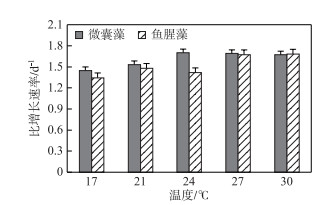
|
图 1 不同温度条件下微囊藻(FACHB-905)和鱼腥藻(FACHB-82)的比增长速率 Fig.1 The specific growth rates of Microcystis (FACHB-905) and Anabaena (FACHB-82) cultured under different temperature conditions |
试验周期内,微囊藻的细胞直径呈现先升高再降低,之后趋于稳定的趋势,17℃温度组的细胞直径与总体趋势略有不同,波动较为剧烈(图 2a).整个试验周期内21、24和27℃组的微囊藻细胞直径平均值与其他温度组的存在显著差异(P < 0.05, 图 2d),而17和30℃组的细胞直径显著小于其他温度组,具体如下:21℃ (4.42 μm) > 27℃ (4.41 μm) > 24℃ (4.36 μm) > 30℃ (4.28 μm) > 17℃ (4.04 μm).
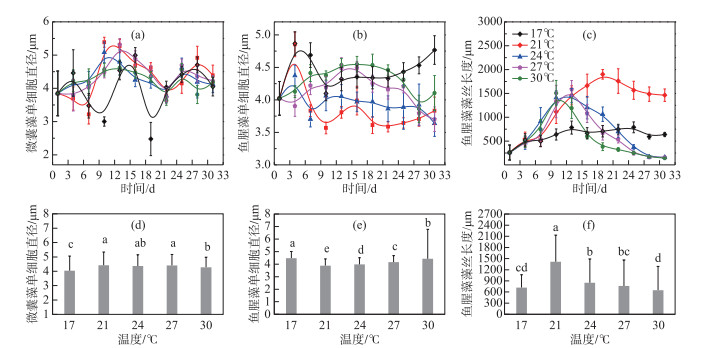
|
图 2 不同温度条件下微囊藻(FACHB-905)和鱼腥藻(FACHB-82)细胞直径及鱼腥藻藻丝长度的变化 (a~c代表两种藻细胞形态在不同温度下的时间变化趋势,不同颜色的点和线代表不同温度组;d~f代表两种藻细胞形态在不同温度组间的均值差异,小写字母表示各组间的差异显著性) Fig.2 The variation of cell diameters of Microcystis (FACHB-905) and Anabaena (FACHB-82) and length of filaments of Anabaena (FACHB-82) cultured under different temperature conditions (a-c: the morphological change trends of two algae in different temperature groups during the experiment period. Different colors represent different temperature groups; d-f: the mean difference of the morphological in the two species of algae among different temperature groups. The letters indicate the significance among the groups) |
鱼腥藻的细胞直径各温度组间变化趋势差异较大,17℃和21℃组的细胞直径随培养时间的变化趋势相近,接种后4~10 d细胞直径大幅降低至最低值,分别为4.1 μm和3.57 μm,接种后10~22 d内,21℃组的细胞直径出现先增大后减小的变化现象,而17℃组的细胞直径持续增大直至22 d,随后两种温度下的鱼腥藻细胞直径不断增大且17℃增幅更大.其他温度下细胞形态变化都是先增大后减小,且24℃的变化幅度最小,27℃的变化幅度最大(图 2b).整体来看,鱼腥藻细胞直径中间温度组较低,低温和高温组(17和30℃)较大且各温度组间存在显著差异(P < 0.05, 图 2e).
从图 2c可以看出鱼腥藻的藻丝长度均呈现先升高后下降的变化趋势,17℃组藻丝长度随时间变化较小;21℃组藻丝长度在接种16 d后大于其他温度下的藻丝长度,在19 d达到最大值1900.53 μm,30℃组藻丝长度在10 d达到最大值1506.54 μm,24和27℃组在13 d达到最大值.从图 2f可以看出,鱼腥藻藻丝长度在21℃最小,其他温度组间存在显著差异(P < 0.05).除17℃外,各温度组的鱼腥藻藻丝长度在试验周期内变化较大.综上所述,发现鱼腥藻细胞直径随温度的变化趋势与鱼腥藻细胞长度随温度的变化趋势相反,即温度在21℃时鱼腥藻细胞直径最小,但其藻丝长度最长,而在高温或低温时,细胞直径相对较大,但藻丝长度较短.
2.3 不同温度下两种藻的光合特性变化由图 3可知,微囊藻中Fv/Fm和Fv′/Fm′的变化趋势基本相似.除17℃组外,Fv /Fm和Fv′/Fm′都是随着时间的变化先升高后降低,在28 d时又升高. 17℃组的Fv/Fm和Fv′/Fm′值呈先上升后下降的变化趋势,接种前10 d,17℃组的Fv/Fm值小于其他温度下的值,在接种16 d时达到最大,而Fv′/Fm′的值在16 d后高于其他温度组.
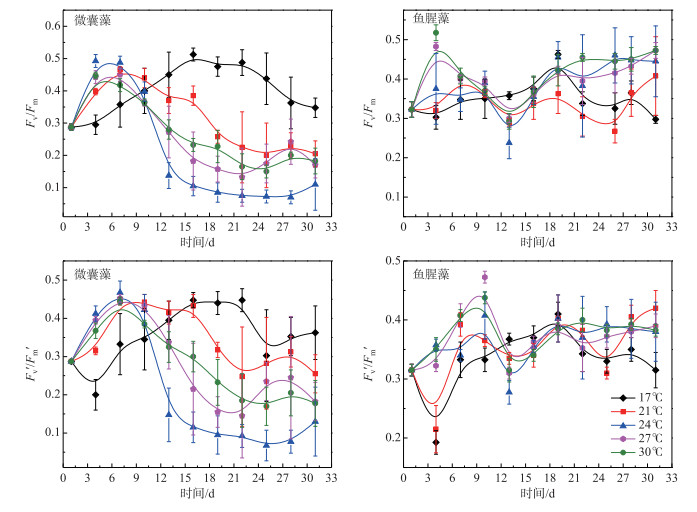
|
图 3 不同温度条件下微囊藻(FACHB-905)和鱼腥藻(FACHB-82)光合活性的变化趋势 Fig.3 The variations of Fv/Fm and Fv′/Fm′ in Microcystis (FACHB-905) and Anabaena (FACHB-82) cultured under different temperature conditions |
鱼腥藻的Fv /Fm和Fv′/Fm′除27和30℃组外变化趋势基本相似,在27和30℃组Fv/Fm值在接种后4~13 d内呈现剧烈的下降趋势,13~19 d内Fv/Fm的值明显上升,19~31 d的上升幅度减小,且在27℃组Fv/Fm值的上升幅度大于30℃组. 17、21和24℃组Fv/Fm值在培养周期内波动变化,17℃组,接种后4~19 d后Fv/Fm和Fv′/Fm′值不断上升至最大值,19~31 d值总体呈下降趋势. 24、27和30℃组Fv′/Fm′值在接种后3~9 d内明显上升,并在第9天取得最大值;9~15 d内降至最小值随后开始回升并在19 d后变化趋于平稳. 21℃组的Fv/Fm和Fv′/Fm′值在培养周期内波动变化,并且上升趋势较下降趋势更为显著.
2.4 两种藻各功能特性之间的关系将试验周期内不同温度下的微囊藻和鱼腥藻的细胞形态、比增长速率和光合活性进行线性回归,由图 4可以看出微囊藻在不同生长阶段下其细胞直径差别较为明显,且与比增长速率呈显著正相关(P=0.006, Radj2=0.044),与Fv′/Fm′呈显著正相关(P < 0.01, Radj2=0.171);比增长速率与Fv′/Fm′呈极显著正相关(P < 0.001, Radj2=0.2).鱼腥藻的细胞形态在不同生长阶段差异较大,细胞直径与藻丝长度呈显著负相关(P=0.03,Radj2=0.021),与Fv′/Fm′呈极显著负相关(P < 0.01, Radj2=0.012);比增长速率与藻丝长度之间呈显著正相关(P=0.012, Radj2=0.033),而与细胞直径无显著相关性;鱼腥藻的比增长速率也与其对应的Fv′/Fm′呈极显著正相关(P < 0.01, Radj2=0.07).
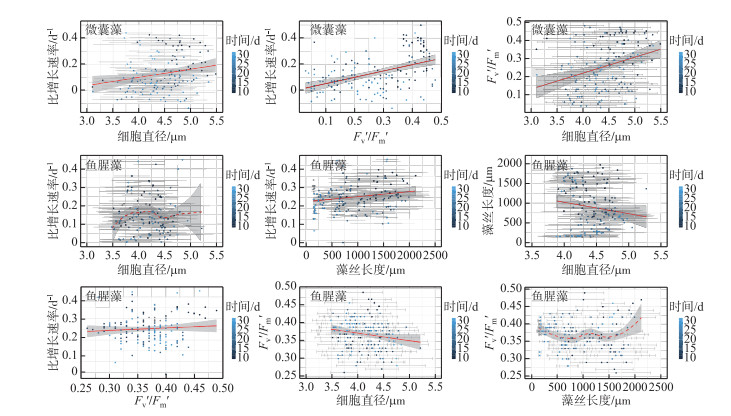
|
图 4 微囊藻(FACHB-905)和鱼腥藻(FACHB-82)形态特性与生长、光合活性间的关系(点的颜色表示培养时间;红色实线表示显著线性相关;红色虚线为loess回归线,且无线性相关;灰色区域表示95 %置信区间) Fig.4 The relationship between morphological traits and growth rate, photosynthesis parameters in Microcystis (FACHB-905) and Anabaena (FACHB-82) (Different colorful points represent different culture time. The red solid lines indicate significant linear relationship. The red dash line is the loess fitting line, and indicate non-significant linear relationship. The gray areas indicate the 95 % confidence interval) |
温度是影响浮游植物生长的重要环境因子,它的变化直接影响水环境中的生化反应、氧的溶解和水生生物的生长等一些系列过程. Butterwick等[32]发现不同淡水藻类的生长从低温到高温(2~35℃)有相当大的差异,不同藻类对温度的适应范围也有所不同.不少研究者认为,春季蓝藻水华的出现及冬季蓝藻水华的消失与蓝藻对温度的响应有关,而夏季和初秋蓝藻水华暴发与蓝藻在高温下具有相对较高的生长速率有关[33-34].在富营养化湖泊中,蓝藻都是在温度最高的季节占优势[35],而且微囊藻的最适生长温度是在25℃以上[11, 36],鱼腥藻通常被认为更适应低温环境,常锋毅等[37]的研究显示鱼腥藻的最适生长温度在25℃左右,温度升高导致其比增长速率明显下降.本研究中的微囊藻在24~30℃生物量较高而比增长速率高于低温环境,而鱼腥藻在27~30℃时生物量和比增长速率也维持较高水平,这与Wood等[38]的研究结果有所不同,这可能是由于鱼腥藻种类间差异导致的,历史的文献调研结果显示[39],鱼腥藻的最优生长温度为20~32℃不等.本研究的结果与巢湖东部湖区夏季仍出现较高鱼腥藻生物量的情况相符合[6],表明在自然环境中可能存在其他因素,包括鱼腥藻的自身调节因素和外部环境因素,驱动了高温环境或夏季鱼腥藻的快速繁殖.
3.2 不同温度下两种藻的形态变化及其与生长速率之间的关系本研究中的微囊藻细胞直径在21~27℃之间最大,而17和30℃相对较小,说明过低或过高的温度均导致微囊藻细胞直径偏小,而鱼腥藻细胞直径的趋势与微囊藻相反,即中间温度时直径较小,低温和高温时偏大,但是其藻丝长度变化趋势则表现为中间温度时最长,低温和高温均偏短,且各温度间的差异性显著.根据Ploug等[40]的研究发现,相对较小的蓝藻细胞对营养物质的传输率更高,说明微囊藻和鱼腥藻在受到温度的影响时,不断地调节其细胞的大小去维持自身的生长. Litchman等[41]研究发现蓝藻的细胞大小在适宜的环境中缓慢增加,且细胞对营养物质的吸收波动较小,当受到环境影响时波动较大.本研究发现中等偏低的温度处理组(21℃)鱼腥藻的细胞大小在进入对数生长期后变化幅度较小,此时藻丝长度缓慢稳定地增长;在高温组鱼腥藻细胞直径在试验前期较小,营养传输速率较高,快速生长,导致短链较多,直径变大.同时藻类细胞形态的变化与其生长速率间具有密切的关系,其受温度影响较为明显.微囊藻的细胞直径和鱼腥藻藻丝长度与其生长速率都存在显著相关性,这种相关性可能与细胞的生长阶段有关,间接反映了两种藻在生长过程中调节自身细胞大小.而针对各温度处理组的总体生长速率分析可以发现:鱼腥藻在高温组试验后期,藻丝长度显著降低,但是却维持了较高的生长速率,因此,鱼腥藻可能通过调节藻丝的长度来维持生长速率.另外,鱼腥藻的细胞大小与藻丝长度呈显著负相关,表明鱼腥藻的调节过程可能是在细胞和藻丝两个水平上同时进行的.微囊藻在高温和低温组的细胞直径较小,其可能是通过降低细胞大小来维持一定的生长速率,只是这种响应在高温组更有效果.有研究表明微囊藻的最佳生长温度在28℃左右[42-43],当藻类进入最佳生长温度时,细胞内的代谢过程可以以最小的代价完成,因此所产生的消耗较少,这进一步增加了细胞内含物的积累,导致细胞体积的变大,这与这一温度范围内细胞尺寸相对较大的研究结果相吻合.综上所述,本研究中的两种蓝藻在受到外界温度变化干扰时,均可能通过调节自身的细胞形态适应外界环境因素的干扰.
浮游植物细胞大小和生长速率间的关系已经被广泛讨论,通常认为相对高的温度更适宜较小个体的浮游植物种类[44],已有少量研究发现细胞大小与生长速率间具有负相关关系,即细胞越小生长速率越高,如赤潮藻类亚历山大藻,这有助于赤潮的维持[16].微囊藻和鱼腥藻由于其自身的细胞大小、群体大小以及藻丝长度与其所特有的浮力调节机制与表面水华形成也有着密切的关系[24],我们的研究发现两种藻的细胞大小或藻丝长度与其自身的生长具有明显的负相关性,即更高的温度下微囊藻细胞变小,鱼腥藻藻丝长度变短,通过这种调节,两种藻均保持了较高的比增长速率.而在低于两种藻的最优生长温度时,则呈现正相关关系.因此,浮游藻类细胞大小与生长速率间的权衡关系可能取决于其所处的温度范围和最优生长温度,这也与先前关于种间权衡的发现是一致的[15, 45].因此在高温的环境下,这两种藻均可以通过调节细胞大小或藻丝长度来实现快速增长,这可能是野外环境中两类蓝藻水华维持的内在机制之一.
3.3 不同温度对两种藻的光合特性影响及其与生长速率之间的关系温度作为影响藻类生长的主要因子,控制着光合作用的酶促反应和呼吸作用的强度[46]以及藻类CO2固定[47],进一步影响藻类光合作用能力[48-50].为了揭示温度对两种藻类光合特性的影响,采用Phyto-PAM (Pulse-Amplitude-Modulation)测量不同温度下的叶绿素荧光参数. Fv/Fm是最大光合量子产量,用于估量光系统功能反应中比例的变化,反映了藻细胞PSII光化学的变化状况即浮游植物光合作用能力,Fv′/Fm′是实际光合量子产量,反应其实际光合作用能力[29].从光化学角度来看,不同的温度下,微囊藻的光化学活性趋势基本相同,在24℃对数生长期内光化学活性相对较高,但整个试验周期其生物量和比生长速率相对较低.这种不一致可能是光合效率和呼吸作用效率共同作用的结果,即当光合效率较低时,微囊藻的呼吸作用效率也较低,所以微囊藻保持一定的增长速度.大量研究表明藻类通过光合作用来适应温度的变化,且调整速度较快[51-53].在本试验当中微囊藻和鱼腥藻的Fv′/Fm′与细胞形态以及比增长速率间都存在显著相关性,说明微囊藻和鱼腥藻可能通过光化学过程的调节,实现生理和形态特性两者与生长速率间的权衡.
本研究中,我们发现试验所用两种蓝藻的形态、光合活性与其生长速率间具有一定的权衡关系,这可能是野外环境中微囊藻与鱼腥藻生物量维持的机制之一,但是这一机制仍需要野外的观测数据予以验证.同时,由于浮游藻类功能特性种类众多,如对氮磷的利用效率、细胞生化组分、他感物质的分泌、毒素的分泌等,而同一环境的变化可以导致多种特性的同步响应,目前这些响应之间的权衡关系仍不清楚.基于功能特性及其权衡关系的方法将是解决物种分布、组成变化以及群落装配的有效方法之一,因此这将是未来重要的研究方向.
4 结论1) 微囊藻(FACHB-905)细胞直径在低温或高温条件下均有所降低,表明在不利条件下,其可能通过减小细胞直径的调节方式增大生长速率.
2) 鱼腥藻(FACHB-82)的细胞直径和藻丝长度在不同温度组中的变化趋势相反,高温下维持较高的生长速率,但细胞直径增大,藻丝长度缩短,这可能是鱼腥藻具有通过调节自身形态来维持较高生长速率的种群发展策略.
3) 两种藻均可以通过调节自身形态和光合活性来适应温度的变化以达到最佳的生长状态,微囊藻通过调节细胞大小和光合活性来维持生长优势,而鱼腥藻则通过权衡细胞直径、藻丝长度以及光合活性来维持生长优势,但两种藻的这些机理性研究结论仍有待在野外条件下进一步证实.
| [1] |
Whitton, Brian A, Malcolm P et al. The ecology of cyanobacteria: their diversity in time and space. Springer Science & Business Media, 2007.
|
| [2] |
Likens GE ed. Plankton of inland waters. Academic Press, 2010.
|
| [3] |
Lawton, John H. Are there general laws in ecology?. Oikos, 1999, 177-192. DOI:10.2307/3546712 |
| [4] |
Carey CC, Ibelings BW, Hoffmann EP et al. Eco- physiological adaptations that favour freshwater cyanobacteria in a changing climate. Water Research, 2012, 46(5): 1394-1407. DOI:10.1016/j.watres.2011.12.016 |
| [5] |
Zhang M, Zhang Y, Yang Z et al. Spatial and seasonal shifts in bloom-forming cyanobacteria in Lake Chaohu: Patterns and driving factors. Phycological Research, 2016, 64(1): 44-55. DOI:10.1111/pre.12112 |
| [6] |
Wang XL, Zhang M, Yin J. Composition and influential factors of phytoplankton function groups in Lake Chaohu. J Lake Sci, 2018, 30(2): 431-440. [王徐林, 张民, 殷进. 巢湖浮游藻类功能群的组成特性及其影响因素. 湖泊科学, 2018, 30(2): 431-440. DOI:10.18307/2018.0214] |
| [7] |
Melack JM. Phytoplankton ecology. Dordrecht: Springer Netherlands, 1986.
|
| [8] |
Raven JA, Geider RJ. Temperature and algal growth. New Phytologist, 2010, 110(4): 441-461. DOI:10.1111/j.1469-8137.1988.tb00282.x |
| [9] |
Falkowski PG, Raven JA. Aquatic Photosynthesis. Princeton: Princeton University Press, 2007.
|
| [10] |
McGill BJ, Enquist BJ, Weiher E et al. Rebuilding community ecology from functional traits. Trends in Ecology Evolution, 2006, 21(4): 178-185. DOI:10.1016/j.tree.2006.02.002 |
| [11] |
Reynolds CS. The ecology of phytoplankton. Cambridge: Cambridge University Press, 2006.
|
| [12] |
Bohannan BJ, Kerr B, Jessup CM et al. Trade-offs and coexistence in microbial microcosms. Antonie van Leeuwenhoek, 2002, 81(1/2/3/4): 107-115. DOI:10.1023/a:1020585711378 |
| [13] |
Litchman KE. Algal games: Thevertical distribution of phytoplankton in poorly mixed water columns. Limnology and Oceanography, 2001, 46(8): 1998-2007. DOI:10.2307/3069069 |
| [14] |
Litchman E. Competition and coexistence of phytoplankton under fluctuating light: Experiments with two cyanobacteria. Aquatic Microbial Ecology, 2003, 31(3): 241-248. DOI:10.1515/9781400849727 |
| [15] |
Finkel ZV, Beardall J, Flynn KJ et al. Phytoplankton in a changing world: cell size and elemental stoichiometry. Journal of Plankton Research, 2010, 32(1): 119-137. DOI:10.1093/plankt/fbp098 |
| [16] |
Brandenburg KM, Wohlrab S, John U et al. Intraspecific trait variation and trade-offs within and across populations of a toxic dinoflagellate. Ecology Letters, 2018, 21(10): 1561-1571. DOI:10.1111/ele.13138 |
| [17] |
Schlüter L, Lohbeck KT, Gutowska MA et al. Adaptation of a globally important coccolithophore to ocean warming and acidification. Nature Climate Change, 2014, 4(11): 1024-1030. DOI:10.1038/nclimate2379 |
| [18] |
Listmann L, Leroch M, Schlüter et al. Swift thermal reaction norm evolution in a key marine phytoplankton species. Evolutionary Applications, 2016, 9(9): 1156-1164. DOI:10.1111/eva.12362 |
| [19] |
Hoffmann AA, Sgrò CM. Climate change and evolutionary adaptation. Nature, 2011, 470(7335): 479-485. DOI:10.1038/nature09670 |
| [20] |
Harris GP ed. Phytoplankton ecology: structure, function and fluctuation. London: Chapman and Hall, 1986.
|
| [21] |
Thomas RH, Walsby AE. The effect of temperature on recovery of buoyancy by Microcystis. Microbiology, 1986, 132(6): 1665-1672. DOI:10.1099/00221287-132-6-1665 |
| [22] |
Chalifour A, Juneau P. Temperature-dependent sensitivity of growth and photosynthesis of Scenedesmus obliquus, Navicula pelliculosa and two strains of Microcystis aeruginosa to the herbicide atrazine. Aquatic Toxicology, 2011, 103(1/2): 10-17. DOI:10.1016/j.aquatox.2011.01.016 |
| [23] |
Seki H, Ozawa H, Ichimura S. Temperature dependence of filament length of Anabaena spiroides Klebahn var. crassa Lemm. Hydrobiologia, 1981, 83(3): 419-423. DOI:10.1007/BF02187039 |
| [24] |
Wu J, Chen XC, Kong HN et al. The effect of light intensity on the cell density and chain length of Anabaena flos-aquae. China Environmental Science, 2012, 32(5): 875-879. [巫娟, 陈雪初, 孔海南等. 光照度对水华鱼腥藻细胞比重与藻丝长度的影响研究. 中国环境科学, 2012, 32(5): 875-879. DOI:10.3969/j.issn.1000-6923.2012.05.016] |
| [25] |
Hu ZQ, Liu YD, Li DH et al. Growth and antioxidant system of the cyanobacterium Synechococcus elongatus in response to microcystin-RR. Hydrobiologia, 2005, 534(1/2/3): 23-29. DOI:10.1007/s10750-004-1319-y |
| [26] |
Wan L, Chen X, Deng Q et al. Phosphorus strategy in bloom-forming cyanobacteria (Dolichospermum and Microcystis) and its role in their succession. Harmful Algae, 2019, 84: 46-55. DOI:10.1016/j.hal.2019.02.007 |
| [27] |
Genty B, Briantais JM, Baker NR. The relationship between the quantμm yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. BBA - General Subjects, 1989, 990(1): 87-92. DOI:10.1016/s0304-4165(89)80016-9 |
| [28] |
Kolber Z, Falkowski PG. Use of active fluorescence to estimate phytoplankton photosynthesis in situ. Limnol Oceanog, 1993, 38(8): 1646-1665. DOI:10.4319/lo.1993.38.8.1646 |
| [29] |
Falkowski P, Kolber Z. Variations in chlorophyll fluorescence yields in phytoplankton in the world oceans. Australian Journal of Plant Physiology, 1995, 22(2): 341-355. DOI:10.1071/PP9950341 |
| [30] |
Juneau P, Harrison PJ. Comparison by PAM fluorometry of photosynthetic activity of nine marine phytoplankton grown under identical conditions. Photochemistry & Photobiology, 2010, 81(3): 649-653. DOI:10.1111/j.1751-1097.2005.tb00239.x |
| [31] |
Sun J, Ning XR. Specific growth rate of marine phytoplankton community. Advances in Earth Science, 2005, 20(9): 939-945. [孙军, 宁修仁. 海洋浮游植物群落的比生长率. 地球科学进展, 2005, 20(9): 939-945. DOI:10.3321/j.issn:1001-8166.2005.09.003] |
| [32] |
Zhang M, Kong FX, Wu X et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. Hydrobiologia, 2008, 603(1): 267-278. DOI:10.1007/s10750-008-9277-4 |
| [33] |
Rengefors K, Karlsson I, Hansson LA. Algal cyst dormancy: A temporal escape from herbivory. Proceedings of the Royal Society of London. Series B: Biological Science, 1998, 265(1403): 1353-1358. DOI:10.1098/rspb.1998.0441 |
| [34] |
Kong FX, Gao G. Hypothes is on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes. Acta Ecologicas Sinica, 2005, 25(3): 589-595. [孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考. 生态学报, 2005, 25(3): 589-595. DOI:10.3321/j.issn:1000-0933.2005.03.028] |
| [35] |
Paerl HW. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnology and Oceanography, 1988, 33(4): 823-847. DOI:10.4319/lo.1988.33.4part2.0823 |
| [36] |
Paerl HW, Huisman JJS. Blooms like it hot. Science, 2008, 320(5872): 57-58. DOI:10.1126/science.1155398 |
| [37] |
Chang FY, Pan XJ, Kang LJ et al. Preliminary study on the physiological characteristics of the growth of Spirulina. Acta Hydrobiologica Sinica, 2009, 33(3): 385-390. [常锋毅, 潘晓洁, 康丽娟等. 洱海螺旋鱼腥藻生长生理特性的初步研究. 水生生物学报, 2009, 33(3): 385-390. DOI:10.3724/SP.J.0000.2009.30385] |
| [38] |
Wood SA, Prentice MJ, Smith K et al. Low dissolved inorganic nitrogen and increased heterocyte frequency: precursors to Anabaena planktonica blooms in a temperate, eutrophic reservoir. Journal of Plankton Research, 2010, 32(9): 1315-1325. DOI:10.1093/plankt/fbq048 |
| [39] |
Lürling M, Eshetu F, Faassen EJ et al. Comparison of cyanobacterial and green algal growth rates at different temperatures. Freshwater Biology, 2013, 58(3): 552-559. DOI:10.1111/j.1365-2427.2012.02866.x |
| [40] |
Ploug H, Stolte W, Epping EHG et al. Diffusive boundary layers, photosynthesis, and respiration of the colony-forming plankton algae, Phaeocystis sp. Limnology and oceanography, 1999, 44(8): 1949-1958. DOI:10.2307/2670467 |
| [41] |
Litchman E, Klausmeier CA, Yoshiyama K. Contrasting size evolution in marine and freshwater diatoms. Proceedings of the National Academy of Sciences, 2009, 106(8): 2665-2670. DOI:10.1073/pnas.0810891106 |
| [42] |
Van der Westhuizen AJ, Eloff JN. Effect of temperature and light on the toxicity and growth of the blue-green alga Microcystis aeruginosa (UV-006). Planta, 1985, 163(1): 55-59. DOI:10.2307/23377530 |
| [43] |
Watanabe MF, Oishi S. Effects of environmental factors on toxicity of a cyanobacterium (Microcystis aeruginosa) under culture conditions. Applied & Environmental Microbiology, 1985, 49(5): 1342-1344. |
| [44] |
Winder M, Reuter J, Schladow S. Lake warming favours small-sized planktonic diatom species. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1656): 427-435. DOI:10.1098/rspb.2008.1200 |
| [45] |
Banse K. Rates of growth, respiration and photosynthesis of unicellular algae as related to cell size—A review. Journal of Phycology, 1976, 12(2): 135-140. DOI:10.1098/rspb.2008.1200 |
| [46] |
Wang ZH, Cui FY, An Q. Influence of water temperature and nutrient value on reservoir algal bloom situation. Ecology and Environment, 2005, 14(1): 10-15. [王志红, 崔福义, 安全. 水温与营养值对水库藻华态势的影响. 生态环境, 2005, 14(1): 10-15. DOI:10.3969/j.issn.1674-5906.2005.01.003] |
| [47] |
Rokka A, Al E. Rubisco activase: an enzyme with a temperature-dependent dual function. Plant Journal, 2010, 25(4): 463-471. DOI:10.1046/j.1365-313x.2001.00981.x |
| [48] |
Song L, Chen W, Peng L et al. Distribution and bioaccumulation of microcystins in water columns: a systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay, Lake Taihu. Polar Biology, 2007, 41(13): 2853-2864. DOI:10.1016/j.watres.2007.02.013 |
| [49] |
Markager S, Vincent WF, Tang EPY. Carbon fixation by phytoplankton in high Arctic lakes: Implications of low temperature for photosynthesis. Limnology & Oceanography, 1999, 44(3): 597-607. DOI:10.4319/lo.1999.44.3.0597 |
| [50] |
Yang DF, Gao DF, Wang PG et al. The preliminary dissection of the day-time-length and water temperature effects on phytoplankton growth. Marine Sciences, 2002, 26(12): 18-22. [杨东方, 高振会, 王培刚等. 光照时间和水温对浮游植物生长影响的初步剖析——以胶州湾为例. 海洋科学, 2002, 26(12): 18-22. DOI:10.3969/j.issn.1000-3096.2002.12.006] |
| [51] |
Falkowski PG. The role of phytoplankton photosynthesis in global biogeochemical cycles. Photosynthesis Research, 1994, 39(3): 235-258. DOI:10.1007/bf00014586 |
| [52] |
Kolzau S, Dolman AM, Voss M et al. The response of nitrogen fixing cyanobacteria to a reduction in nitrogen loadinging. International Review of Hydrobiology, 2018, 103(1/2): 5-14. DOI:10.1002/IROH.201601882 |
| [53] |
Qiu B, Li Y. Photosynthetic acclimation and photoprotective mechanism of Haematococcus pluvialis (Chlorophyceae) during the accumulation of secondary carotenoids at elevated irradiation. Journal Information, 2006, 45(2). DOI:10.2216/04-99.1 |
 2020, Vol. 32
2020, Vol. 32 

