(2: 贵州师范大学高原湿地生态与环境研究中心, 贵阳 550001)
(2: Plateau Wetland Ecology and Environment Research Center, Guizhou Normal University, Guiyang 550001, P. R. China)
自然水体中,沉水植物表面常富集水体中有机质、泥沙、菌胶团、藻类、微生物等形成附植生物膜.附植生物膜是浅水湖泊的重要组成部分之一,膜中附着藻类群落在水生生态系统中占据着重要的角色.内陆水体中的附着藻类以硅藻、绿藻和蓝藻为主[1].附着藻类生物量受水体营养盐浓度的影响[2],其总初级生产与水体富营养化程度密切相关[3].附着藻类对水体污染物具有很高的敏感性,可作为污染水体监测的指示种[4];同时藻类因于其低能耗、高吸附量、环境友好的特点,被用于去除重金属[5-6];另外,还可以监测水体的重金属含量[7].
镉(Cd)和铅(Pb)作为两种常见的环境重金属污染物,不但会造成环境污染,还能通过食物链进入人体,严重威胁人体健康.生物膜对水环境中的重金属具有强烈的富集作用,在控制水环境中重金属的迁移、毒性、生物可利用性以及最终归宿的过程中起着非常重要的作用[8].多项研究表明生物膜对多种重金属(Cd、Pb、锌(Zn)、铜(Cu)、钴(Co)等)有着较强的吸附作用[9-11];Beck等[12]研究发现光营养底栖生物膜会影响渗透性沉积物中重金属Cd、Cu、镍(Ni)和Pb的迁移;生物膜对不同重金属的吸附能力有差异,对Cd、Pb有着较强的吸附能力[8-9],其影响因子众多.在淡水环境中生物膜上的锰氧化物(特别是生物锰氧化物)对Cd、Pb等金属阳离子的吸附能力很强[11, 13-14];生物膜中微生物(细菌、真菌和藻类)对重金属也有着较强的吸附能力[15-16];而生物膜中胞外聚合物(EPS)同样对重金属有一定的吸附作用[8];与Cd相比,Pb,Zn和铬(Cr)的吸附主要是通过生物膜中的有机物[17].而有关附植生物膜特征,如藻类组成、铁锰氧化物含量等与重金属Cd、Pb累积的关系尚不清楚.
草海是一个完整、典型的高原湿地生态系统.由于地质背景和人类活动的影响,草海湿地重金属Cd、Pb和Zn污染较重,针对草海沉积物[18]、水体[19]和周边土壤[20]重金属污染已有不少研究,但是草海沉水植物附植生物膜中Cd、Pb累积情况并不清楚.鉴于此,本文选择3种不同叶形的沉水植物:光叶眼子菜、微齿眼子菜和金鱼藻,对其附植生物膜藻类组成、形貌、理化特征及Cd、Pb的累积进行研究,揭示附植生物膜特征对Cd、Pb累积的影响.研究结果增加人们对水体自净作用的理解,对于正确认识和利用沉水植物的生态调控功能,改善水环境质量具有十分重要的意义.
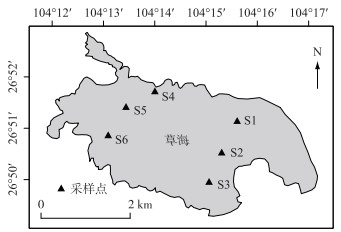
1 材料与方法 1.1 研究区概况草海位于贵州省西部威宁县县城西南面,水域面积约25 km2.是黑颈鹤等228种鸟类的重要越冬地和迁徙中转站.水生维管束植物有25科37属49种,沉水植被以眼子菜属、金鱼藻属、狐尾藻属、茨藻属植物为主,主要生活在水深比较深的区域[21-22],全湖共设6个采样点(图 1).
|
图 1 草海采样点分布 Fig.1 Location of sampling sites in Lake Caohai |
研究期间草海水体水质参数见表 1,期间草海水温(T)为14.33℃,pH为8.63,溶解氧(DO)、化学需氧量(CODMn)和叶绿素a(Chl.a)浓度平均值分别为9.65 mg/L、7.14 mg/L和4.30 μg/L,水体总氮(TN)、总磷(TP)浓度平均值分别为0.76 mg/L和0.02 mg/L,铵态氮(NH4+-N)浓度平均值为0.44 mg/L.综合营养状态指数TLI(Σ)[23]为38.88(去除了透明度(SD),因为草海充满了大量的沉水植物),水质处于中营养状态.
| 表 1 草海水质参数 Tab. 1 Water quality parameters in Lake Caohai |
采样时间为2017年11月中旬,采样点S1和S2采集植物分别为金鱼藻和微齿眼子菜,采样点S3~S6采集植物为光叶眼子菜,每个采样点植物采集3个平行,按沉水植物种类将水面以下50 cm的植株分别装入不同的塑料瓶(1000 ml)中,24 h内取出,用软毛刷仔细刷洗植株表面,刷洗液收集并定容至500 ml,取100 ml用5 %福尔马林溶液固定,运用显微镜进行镜检[24].将软毛刷冲洗过后的茎叶平铺在附有保鲜膜的玻璃板上,放在光下以直尺为对照进行拍照,计算叶片的表面积[25].冲洗后的植物在105℃下杀青30 min,90℃烘干至恒重,将烘干后的植物样磨碎后过60目筛保存备用[26];剩余400 ml刷洗液用滤纸过滤,置于通风处自然风干.将风干后的生物膜采用玛瑙研钵研磨,过100目微孔筛,至全部过筛为止,采用四分法将研磨后的生物膜干样保存于聚乙烯塑料袋中备用[27];裁取约4 cm2叶片转移到装满有1 %戊二醛溶液的30 ml聚乙烯瓶中(用0.1 mol/L稀释,pH=7.4),用于扫描电子显微镜(SEM)形貌观察[25].
1.4 数据处理及分析方法采用钼酸铵分光光度法(GB 1183-1989)测定TP浓度,采用凯氏定氮法测定TN浓度.取植物和生物膜样品各约0.25 g待用, 生物膜中重金属全量采用浓HNO3-H2O2消煮(EPA3050B),植物用HNO3-HClO4联合消煮(GB/T5009.11-15-2003),用ZEEnit700P原子吸收分光光度计(150Z7P1064)测定植物的Cd、Pb含量和附植生物膜Fe、Mn、Cd、Pb含量[28];水体的富营养化程度采用综合营养指数法进行界定.参照《地表水环境质量标准》(GB 3838-2002)中的分析方法测定NH4+-N、TN、CODMn、TP、Chl.a浓度.使用YSI多参数水质检测仪现场测定水温(T)、pH和DO浓度;附着藻类的物种多样性(H′)采用Shannon-Wiener多样性指数[23]进行分析:
| ${H^\prime } = - \Sigma {P_i} \cdot \ln {P_i} $ | (1) |
式中,Pi=n/N,n为单个物种的数量,N为所有物种的数量. Shannon-Wiener多样性指数评价等级:<0.6为差;0.6~1.5为一般;1.6~2.5为较好;2.6~3.5为丰富;>3.5为非常丰富.本文中地图采用ArcGIS软件绘制,实验数据使用Excel 2010和Origin 9.1进行作图分析处理;采用SPSS 19.0软件进行单因素方差分析(One-way ANOVA)检验不同植物间附植生物膜中铁(Fe)、锰(Mn)、氮(TN)、磷(TP)、Cd和Pb含量的差异显著性以及附植生物膜组成成分与Cd、Pb含量的相关关系.附着藻类功能群与环境因子的相关关系采用Canoco5软件分析.
2 结果与分析 2.1 附植生物膜形态及理化特征运用扫描电子显微镜(JSM-6490)观察了3种沉水植物附植生物膜结构组成(图 2),3种沉水植物附植生物膜包含大量金属氧化物、有机质、少量矿物质及丰富的胞外聚合物(EPS),但胞外聚合物(EPS)结构并不规整.金鱼藻附植生物膜中大量物质集中在其细小分支的交接处(图 2a).生物膜上观察到主要藻类有舟形藻(Navicula sp.)、异极藻(Gomphonema intricalum Kutz. )、鼓藻(Cosmarium sp.)、多甲藻(Peridiniopsis sp.)、桥弯藻(Cymbella sp.)等(图 2),同时观察到一些菌丝缠绕在藻类间;金鱼藻附植生物膜形态结构相对于微齿眼子菜和光叶眼子菜更加紧密.

|
图 2 扫描电镜下金鱼藻(a)、微齿眼子菜(b)、光叶眼子菜(c)叶片表面藻类分布特征 (①舟形藻属;②异极藻属;③鼓藻属;④多甲藻属;⑤桥弯藻属) Fig.2 Distribution characteristics of algae on leaf surface of Ceratophyllum demersum (a), Potamogeton maackianus (b) and Potamogeton lucens L. (c) under scanning electron microscopy (①Navicula sp.; ②Gomphonema intricalum Kutz.; ③Cosmarium sp.; ④Peridiniopsis sp.; ⑤Cymbella sp.) |
沉水植物附植生物膜的主要化学组分包括氮、磷及铁、锰氧化物等[9, 29].研究区3种沉水植物附植生物膜中Fe、Mn、TN及TP含量特征见图 3. 3种沉水植物附植生物膜Fe、Mn含量变化规律一致,皆表现为金鱼藻>微齿眼子菜>光叶眼子菜. Fe含量最高为7825.24 mg/kg,最低为3098.43 mg/kg;锰含量最高为4089.08 mg/kg,最低为647.96 mg/kg. TN和TP含量也是金鱼藻附植生物膜中最高,分别为13440和1110 mg/kg.光叶眼子菜附植生物膜中TN含量最低,为2380 mg/kg;微齿眼子菜附植生物膜中TP含量最低,为160 mg/kg;金鱼藻附植生物膜中的Fe、Mn及TN、TP含量均最高,这与植物的叶形结构复杂程度有关.金鱼藻簇拥在一起,加大了自身的吸附表面积,其纤细且分支繁杂的叶片结构,对水体中的悬浮物质吸附作用更强,从而使金鱼藻附植生物膜中的Fe、Mn及TN、TP含量更高.生物膜中藻类也会吸收水体中的氮、磷[30].金鱼藻附植生物膜中TN、TP含量最高,可能与其附植生物膜中藻类密度最大有关.此外,附植生物膜可通过磷吸收和促进磷的沉淀、过滤水体中颗粒态的磷,通过光合作用升高水体的pH,加速Ca-P和碳酸盐-磷酸盐复合体的沉淀[29],使附植生物膜中磷含量升高.

|
图 3 沉水植物附植生物膜中铁、锰(a)和氮、磷(b)含量 (不同小写字母表示不同附植生物膜铁、锰或氮、磷含量达到显著性差异,P < 0.05) Fig.3 Iron, manganese (a) and nitrogen and phosphorus (b) contents in epiphytic bioflioms of submerged macrophytes |
通过对3种沉水植物附植生物膜中藻类进行鉴定,得到藻类6门8纲17目29科65属81种,其中金鱼藻附着藻类共6门8纲16目27科49属58种,微齿眼子菜附着藻类共6门8纲17目25科43属54种,光叶眼子菜附着藻类共6门8纲17目26科38属50种,25种(属)藻类在3种沉水植物叶片上都有检出,在所有藻类单位面积藻类密度比例中占38.46 %.金鱼藻附植生物膜中藻类Shannon-Wiener多样性指数最高,为3.23;其次是微齿眼子菜,为3.14;光叶眼子菜最低,为2.80,说明3种沉水植物附植生物膜中有着丰富的藻类.
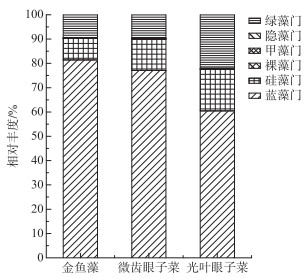
金鱼藻、微齿眼子菜、光叶眼子菜单位叶片面积上附着藻类主要包括蓝藻门、绿藻门、硅藻门、裸藻门和隐藻门.其中蓝藻门相对丰度最大,其次为绿藻门和硅藻门(图 4).单位叶片面积上3种沉水植物附着藻类密度为:金鱼藻(1.82×105 cells/cm2)>微齿眼子菜(9.93×104 cells/cm2)>光叶眼子菜(1.81×104 cells/cm2).单位叶片质量上3种沉水植物附着藻类密度为:金鱼藻(1.06×108 cells/g)>光叶眼子菜(6.89×107 cells/g)>微齿眼子菜(3.39×107 cells/g).叶形精细且分支繁多的金鱼藻比叶片宽大但复杂程度较小的光叶眼子菜和微齿眼子菜的附着藻类密度更大.
|
图 4 沉水植物附植生物膜中各门藻类相对丰度 Fig.4 Relative abundance of algae class in epiphytic bioflioms of submerged macrophytes |
参考Reynolds等[31]和Padisák等[32]提出的浮游植物功能群分类方法,对鉴定出的附着藻种进行分类,归类出20个功能类群,分别为M、S1、L0、LM、MP、G、N、B、J、D、X1、F、A、P、W1、W2、Y、X2、X3和H1(表 2).金鱼藻上归类出18个功能群,无X3和H1两个功能群;微齿眼子菜上归类出20个功能群;光叶眼子菜共归类出19个功能群,比金鱼藻上多了功能群H1. 3种沉水植物附植生物膜中单位面积密度最大的是M、S1、LM、P、J、L0和MP这7个功能群.金鱼藻附着藻类单位面积密度最大的功能群为M,所占比例为25.62 %;微齿眼子菜和光叶眼子菜附着藻类单位面积密度最大的功能群为S1,所占比例分别为39.23 %和39.14 %.
| 表 2 附着藻类功能群分组的代表性藻种及其C-R-S生长策略 Tab. 2 Epiphytic algae functional groups and their C-R-S growth strategies |
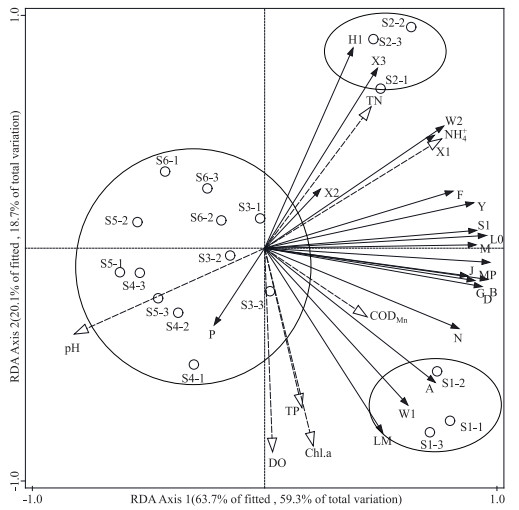
选取3种沉水植物附植生物膜中20个藻类功能群密度(单位面积)数据进行DCA分析检验,结果发现最长长度梯度小于3,故选择冗余分析(RDA)分析附着藻类功能群密度与环境因子之间的关系.从7个环境因子TN、TP、NH4+、CODMn、DO、Chl.a和pH与功能群密度的关系(图 5)可以看出,轴1的特征值达到0.593,物种-环境累计百分比为63.7 %,说明轴1能解释大多数藻类分布.功能群H1、X3、W2、F、X1与环境因子TN、NH4+呈正相关(图 5).而功能群X2、Y、S1、L0、B、D、J、G、MP、M、A、N、LM和W1与环境因子CODMn、Chl.a的分布呈正相关性,即这14个功能群的分布受到CODMn和Chl.a的强烈影响.附着藻类功能群的分布受单一因子的影响,同时也受到多种因子的共同作用,即研究附着藻类分布特征要考虑多因子之间的协同效应带来的影响. 3种不同沉水植物附植藻类分布在不同象限(图 5),说明植物叶形复杂度对功能群的分布有明显影响,其附着藻类的密度(单位面积)及种类上有明显差异.
|
图 5 附着藻类功能群冗余分析 Fig.5 Redundancy analysis of epiphytic algae functional groups related to environmental factors |
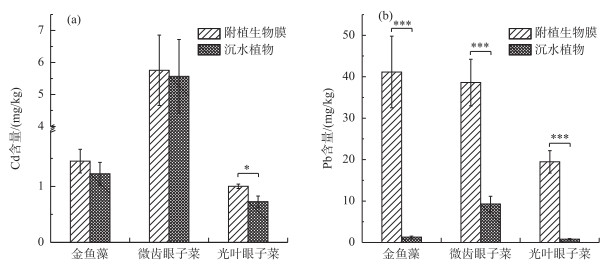
沉水植物及其生物膜中的Cd含量分别在0.44~5.56 mg/kg和0.59~5.76 mg/kg之间(图 6),植物与生物膜中含量差异不大(光叶眼子菜除外);生物膜中Pb含量(11.41~41.31 mg/kg)远高于植物体中(0.57~9.53 mg/kg),差异极显著(P < 0.005). Cd、Pb含量在光叶眼子菜生物膜中均最低,但Cd含量在微齿眼子菜生物膜中最高,Pb含量在金鱼藻生物膜中最高. 3种附植生物膜中Pb含量都高于Cd含量,表明生物膜对Pb的富集能力高于Cd.附植生物膜中Cd含量均高于贵州表生沉积物背景值(0.31 mg/kg);金鱼藻及微齿眼子菜生物膜中Pb含量高于贵州表生沉积物背景值(29.39 mg/kg)[33].
|
图 6 沉水植物与附植生物膜中重金属Cd(a)和Pb(b)含量 (*表示P < 0.05,* *表示P < 0.01,* * *表示P < 0.005) Fig.6 Contents of heavy metals Cd (a) and Pb (b) in submerged macrophytes and epiphytic biofilm |
根据Pearson相关性分析,可知附植生物膜中总的藻类生物量及各门类水平藻类生物量(单位面积)、理化组成(Fe、Mn、TN和TP含量)与重金属Cd、Pb累积的相关关系(表 3),得到Pb累积含量与附植生物膜中硅藻门藻类生物呈极显著相关(P < 0.001),与隐藻门藻类生物量、Fe和Mn含量、TN含量呈显著相关(P < 0.05).
| 表 3 沉水植物附植生物膜组成成分与重金属Cd、Pb含量的相关关系 Tab. 3 The correlation between heavy metal Cd and Pb accumulation and composition of epiphytic bioflioms of submerged macrophytes |
3种不同叶形沉水植物附着藻类功能群组成和数量不同.金鱼藻附着藻类的密度及藻类多样性指数均高于微齿眼子菜与光叶眼子菜,这与Laugaste等[34]的研究相似.附着藻类的生物量也不尽相同,不同的植物类型影响着附着藻类的生物量[35].不同附着藻类群落组成和生物量的差异与环境因子和植物本身有关.
首先,水体理化因子对附植生物膜藻类群落具有重要影响.草海沉水植物附植生物膜中的藻类分布与水体物理化学因子有显著的相关关系,说明附着藻类生长状况易受水体环境中物理化学因素的影响[7],附着藻类的组成结构受水体中光照、营养盐等因素的影响.已有研究表明,附着藻类的总初级生产与水体富营养化程度呈正相关关系[3],随着营养盐浓度的升高,附着藻类生物量会显著增加[36];而附着藻类由于固着生活不能主动或者被动改变深度,其生长及群落组成会受光的影响[7];在通常情况下,淡水水体pH偏碱性,绝大多数无机碳以HCO3-形式存在,并能被藻类吸收利用,水体HCO3-缺乏势必会对附着藻类的生长产生影响[37];水动力扰动也是影响附着藻类群落组成的一个因素,不仅影响附着藻类群落组成,还通过扰动沉积物再悬浮来影响水体营养盐浓度及水体光的传播,进而影响藻类的发展[38].反之,附着藻类也会对沉水植物光合作用产生影响,进而影响沉水植物的生长[39].
其次,植物本身也会影响藻类群落结构.水生植物的形态为附着藻类提供了重要的栖息地,而植物结构固有的空间复杂性创造了多样的结构,使得附着藻类能够最大限度地附着和获得阳光[40-41].在同一地点,不同沉水植物在相似的环境条件下,其附着植物群落组成存在显著差异[42].这可能归因于藻类附着对特定底物的亲和力,诸如宿主植物表面积和表面的微纹理不同[43].植物的形状和排列、比表面积或生物量都会导致其附着藻类的生物量不同.也就是说,大型植物上的附着藻类生物量受植物结构的复杂性和排列性的影响,因此复杂的结构不仅比简单的结构提供更大的比表面积,而且提供了最大限度获得光的附着点.金鱼藻叶形和排列方式不同于微齿眼子菜与光叶眼子菜,它在自然水体中成团簇拥在一起生长,拥有更大的附着表面区域而可以产生更多的附着藻类[35].另外,像金鱼藻这种具有复杂结构的植物,其表面较高的附着生物量也可能是由于其牧食压力的降低,因为鱼类在更复杂的生境中觅食效率较低[42],这也是金鱼藻附植生物膜中藻类密度及藻类多样性指数最高的原因之一.
3.2 附植生物膜Cd、Pb累积差异成因附植生物膜对水体重金属Cd、Pb具有较强累积作用,附植生物膜对Pb的累积远高于Cd,与以往生物膜对重金属的吸附能力为Pb>Cu>Cd的结论一致[10].一方面可能与附植生物膜特征,如藻类、胞外聚合物、铁锰氧化物等有关.生物膜中的藻类会吸附和富集水环境中的重金属[16],其方式包括:络合、离子交换、氧化还原、胞外聚合物、胞内聚合物和液泡区室化.生物膜中有机成分EPS也会吸附重金属Cd、Pb,且对Pb的结合能力比Cd强[44].生物膜中的无机物即铁、锰氧化物对重金属的吸附起着主要作用[8].生物膜中微生物对不同重金属的吸附有选择性且与金属离子的电负性、离子势、离子半径和氧化还原电势等性质有关;此外微生物能通过多种途径将重金属吸附在其细胞表面,而细胞壁则是金属离子的主要积累场所[15].另一方面,与Cd、Pb竞争吸附有关,不同离子间存在竞争吸附,比如在多相体系中,生物膜对Cd、Pb和Cu总体的吸附量有所下降,3种金属在生物膜上的吸附分配比发生了变化,Pb所占比例升高,Cd和Cu所占比例降低[11];Cd2+的存在会影响Pb2+的吸附[10].此外,水体环境也会对生物膜吸附重金属产生影响.田超等[45]的研究发现生物膜对Pb2+的吸附选择性明显比Zn2+强,在pH为6~7、温度为25~30℃的条件下,生物膜对Pb有较强的吸附能力.从本研究中附植生物膜组成成分与重金属Cd、Pb累积的相关性分析可知,Pb累积含量与生物膜中隐藻门、硅藻门藻类生物量(P < 0.01)及Fe、Mn、TN含量显著相关(表 3) (P < 0.05),与总的藻类生物量无相关关系;说明附植生物膜对于Pb的累积作用与附着藻类中的隐藻门、硅藻门的藻类生物量密切相关;而生物膜中的理化物质如Fe、Mn和TN含量都会影响对Pb的累积.而Cd含量与生物膜所测指标均无关系,表明附植生物膜对Cd的累积可能与外部环境因子有关.可见,附植生物膜中重金属的累积与重金属自身的属性、生物膜特征及环境条件密切相关.
4 结论1) 沉水植物附植生物膜的主要化学组分是铁、锰氧化物,附植生物膜作为水体氮、磷的主要库存者,含有大量氮、磷物质,叶形精细且分支繁多的金鱼藻附植生物膜中铁、锰氧化物含量及氮、磷含量高于微齿眼子菜与光叶眼子菜.
2) 金鱼藻、微齿眼子菜和光叶眼子菜附植生物膜中共鉴定出藻类6门8纲17目29科65属81种,以蓝藻门、绿藻门和硅藻门为主,不同叶形沉水植物附着藻类组成和密度不同,叶形结构较复杂的金鱼藻附着藻类密度最大,受水环境因子和植物的双重影响.
3) 附植生物膜对水体中Cd、Pb的累积具有选择性,Pb的累积显著高于Cd,这与生物膜特性有关,如理化特性(生物膜铁锰氧化物含量)、生物特性(藻类种类及群落结构)等.
| [1] |
Kalff J ed. Limnology:Inland water ecosystem. Beijing: Higher Education Press, 2011.
|
| [2] |
Quinlan EL, Phlips EJ, Donnelly KA et al. Primary producers and nutrient loading in Silver Springs, FL, USA. Aquatic Botany, 2008, 88(3): 0-255. |
| [3] |
Ma MY, Cui LJ, Zhang MY et al. Primary production of periphyton and their relationship to water quality in Baiyangdian Lake, China. Acta Ecologica Sinica, 2018. [马牧源, 崔丽娟, 张曼胤等. 白洋淀附着藻类的初级生产力及其与水质的关系. 生态学报, 2018.] |
| [4] |
Yuan XF, Shi HH, Wang XR. Temporal and spatial distributions of periphytic algae in Taihu Lake. Journal of Agro-Environment Science, 2006, 25(4): 1035-1040. [袁信芳, 施华宏, 王晓蓉. 太湖着生藻类的时空分布特征. 农业环境科学学报, 2006, 25(4): 1035-1040. DOI:10.3321/j.issn:1672-2043.2006.04.044] |
| [5] |
Pandey LK, Kumar D, Yadav A et al. Morphological abnormalities in periphytic diatoms as a tool for biomonitoring of heavy metal pollution in a river. Ecological Indicators, 2014, 36: 272-279. DOI:10.1016/j.ecolind.2013.08.002 |
| [6] |
Jacinto MLJAJ, David CPC, Perez TR et al. Comparative efficiency of algal biofilters in the removal of chromium and copper from wastewater. Ecological Engineering, 2009, 35(5): 856-860. DOI:10.1016/j.ecoleng.2008.12.023 |
| [7] |
Ji HT, Xie D, Zhou HJ et al. Advances in ecological research on epiphytic community of submerged macrophytes. J Lake Sci, 2013, 25(2): 163-170. [纪海婷, 谢冬, 周恒杰等. 沉水植物附植生物群落生态学研究进展. 湖泊科学, 2013, 25(2): 163-170. DOI:10.18307/2013.0201] |
| [8] |
Dong DM, Li Y, Hua XY et al. Relationship between chemical composition of surface coatings and waters in natural waters. Chemical Journal of Chinese Universities, 2002, 23(8): 1507-1509. [董德明, 李鱼, 花修艺等. 自然水体中生物膜的主要化学组分与水体中相关化学物质的关系. 高等学校化学学报, 2002, 23(8): 1507-1509. DOI:10.3321/j.issn:0251-0790.2002.08.040] |
| [9] |
Kang CL, Guo J, Guo P et al. Adsorption behavior of Pb2+ by organic components of natural biofilms in natural water and the influencing factors. Chemical Journal of Chinese Universities, 2005, 26(11): 2043-2045. [康春莉, 郭晶, 郭平等. 自然水体生物膜有机组分对Pb2+的吸附特性及其影响因素. 高等学校化学学报, 2005, 26(11): 2043-2045. DOI:10.3321/j.issn:0251-0790.2005.11.044] |
| [10] |
Zheng N, Hua XY, Dong DM et al. Competitive adsorption of metal cations onto natural surface coatings. Journal of Jilin University:Science Edition, 2005, 43(3): 388-393. [郑娜, 花修艺, 董德明等. 重金属在自然水体生物膜上的竞争吸附. 吉林大学学报:理学版, 2005, 43(3): 388-393.] |
| [11] |
Dong D. Adsorption of Pb and Cd onto metal oxides and organic material in natural surface coatings as determined by selective extractions:new evidence for the importance of Mn and Fe oxides. Water Research, 2000, 34(2): 427-436. |
| [12] |
Beck AJ, Beer JDD. The influence of phototrophic benthic biofilms on Cd, Cu, Ni, and Pb transport in permeable sediments. Biogeochemistry, 2011, 102(1/2/3): 167-181. |
| [13] |
Dong D, Liu L, Hua X et al. Comparison of lead, cadmium, copper and cobalt adsorption onto metal oxides and organic materials in natural surface coatings. Microchemical Journal, 2007, 85(2): 270-275. DOI:10.1016/j.microc.2006.06.015 |
| [14] |
Haack EA, Warren LA. Biofilm hydrous manganese oxyhydroxides and metal dynamics in acid rock drainage. Environmental Science & Technology, 2003, 37(18): 4138-4147. |
| [15] |
Liu P, Zeng GM, Huang JH et al. Research progress of biosorption in treatment of waste water containing heavy metals. Industrial Water and Wastewater, 2004, 35(5): 1-5. [刘萍, 曾光明, 黄瑾辉等. 生物吸附在含重金属废水处理中的研究进展. 工业用水与废水, 2004, 35(5): 1-5. DOI:10.3969/j.issn.1009-2455.2004.05.001] |
| [16] |
Zheng MM, Shao LZ, Zhou SQ et al. Mechanism and application of algae enrichment of heavy metals in water. Environmental Science and Technology, 2017, 30(6): 66-70. [郑蒙蒙, 邵鲁泽, 周思齐等. 藻类富集水体重金属的机理及应用. 环境科技, 2017, 30(6): 66-70. DOI:10.3969/j.issn.1674-4829.2017.06.015] |
| [17] |
Drahota P, Škaloud P, Nováková B et al. Comparison of Pb, Zn, Cd, As, Cr, Mo and Sb adsorption onto natural surface coatings in a stream draining natural as geochemical anomaly. Bulletin of Environmental Contamination & Toxicology, 2014, 93(3): 311-315. |
| [18] |
Zhang ZL, Tan H, He JL et al. Distribution characteristics and source identification of heavy metals in surface sediments of Caohai Lake in Guizhou. Ecology and Environmental Sciences, 2018(12): 2314-2320. [张转玲, 谭红, 何锦林等. 贵州草海表层沉积物重金属污染特征及来源分析. 生态环境学报, 2018(12): 2314-2320.] |
| [19] |
Zhu YZ, He TR, Gao Z et al. Distribution of heavy metals in sediments and its impact on zoobenthos community of Lake Caohai in Guizhou. China Environmental Science, 2016, 36(6): 1859-1866. [朱玉珍, 何天容, 高钊. 贵州草海沉积物重金属分布及其对底栖动物群落的影响. 中国环境科学, 2016, 36(6): 1859-1866. DOI:10.3969/j.issn.1000-6923.2016.06.040] |
| [20] |
Zhang JZ, Lin SX, Zhang QH et al. Characteristics of heavy metal pollution in crops and soil around Caohai Wetland in Guizhou Province. Research of Soil and Water Conservation, 2014, 21(3): 273-278. [张家春, 林绍霞, 张清海等. 贵州草海湿地周边耕地土壤与农作物重金属污染特征. 水土保持研究, 2014, 21(3): 273-278.] |
| [21] |
Tang JG, Li WJ, Zhou CY. Study on aquatic plant diversity changes in Caohai plateau wetland. Guihaia, 2014(5): 601-607. [唐金刚, 李苇洁, 周传艳. 高原湿地草海水生植物多样性变化研究. 广西植物, 2014(5): 601-607.] |
| [22] |
Xiang G, Zhou H, Wang CL. Flora studies on aquatic vascular plants in Caohai Lake. Journal of Guizhou Normal University:Natural Sciences, 2009(3): 9-14. [向刚, 周红, 王承录. 贵州草海水生维管植物区系地理研究. 贵州师范大学学报:自然科学版, 2009(3): 9-14.] |
| [23] |
Xia YF, Hu XD, Xu JX et al. Seasonal succession of phytoplankton functional group and assessment of water quality in Lake Taihu. J Lake Sci, 2019, 31(1): 134-146. [夏莹霏, 胡晓东, 徐季雄等. 太湖浮游植物功能群季节演替特征及水质评价. 湖泊科学, 2019, 31(1): 134-146. DOI:10.18307/2019.0113] |
| [24] |
Hu HJ, Wei YX eds.Chinese freshwater algae-system, classification and ecology.Beijing: Science Press, 2006. [胡鸿钧, 魏印心.中国淡水藻类--系统、分类及生态, 2006. ]
|
| [25] |
Liu KH, Zhang SH, Lu XY et al. The characteristics of epiphytic microbes of three submerged macrophytes in Lake Huashen. J Lake Sci, 2015, 27(1): 103-112. [刘凯辉, 张松贺, 吕小央等. 南京花神湖3种沉水植物表面附着微生物群落特征. 湖泊科学, 2015, 27(1): 103-112. DOI:10.18307/2015.0113] |
| [26] |
Qiao YL, Li MH, Xie PJ et al. A study on the absorption of cadmium and zinc in the water sediments with submerged plants. Journal of Zhejiang University:Science Edition, 2016, 43(5): 601-609. [乔云蕾, 李铭红, 谢佩君等. 沉水植物对受重金属镉、锌污染的水体底泥的修复效果. 浙江大学学报:理学版, 2016, 43(5): 601-609.] |
| [27] |
Li ZX, Yuan LH, Lei HY et al. Study on adsorption and migration regularity of heavy metals by biofilm in Tidal River. Journal of Anhui Agricultural Sciences, 2011(34): 21217-21220. [李召旭, 袁丽华, 雷恒毅等. 感潮河道生物膜吸附重金属性能及迁移规律研究. 安徽农业科学, 2011(34): 21217-21220. DOI:10.3969/j.issn.0517-6611.2011.34.109] |
| [28] |
Lei M, Yue QL, Chen TB et al. Heavy metal concentrations in soils and plants around Shizhuyuan mining area of Hu'nan Province. Acta Ecologica Sinica, 2004, 25(5): 1146-1151. [雷梅, 岳庆玲, 陈同斌等. 湖南柿竹园矿区土壤重金属含量及植物吸收特征. 生态学报, 2004, 25(5): 1146-1151.] |
| [29] |
Dodds WK. The role of periphyton in phosphorus retention in shallow fresh water aquatic systems. Journal of Phycology, 2010, 39(5): 840-849. |
| [30] |
Song YZ, Feng Y, Wang JQ et al. Effects of nitrogen and phosphorus availability on epiphytic algae attaching to the macrophyte Vallisneria natans. Acta Scientiae Circumstantiae, 2018, 38(12): 4721-4727. [宋玉芝, 丰叶, 王锦旗等. 水体及沉积物氮磷水平对附植藻类的影响. 环境科学学报, 2018, 38(12): 4721-4727.] |
| [31] |
Reynolds CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [32] |
Padisák J, Crossetti LO, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification:a critical review with updates. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [33] |
Liu XB, Liu XL, Li X et al. Distribution and pollution assessment of heavy metals in surface sediments from Cao hai Lake, Guizhou. Journal of Safety and Environment, 2016, 16(1): 325-332. [刘宪斌, 刘新蕾, 李厦等. 贵州草海表层沉积物重金属分布特征及污染评价. 安全与环境学报, 2016, 16(1): 325-332.] |
| [34] |
Laugaste R, Reunanen M. The composition and density of epiphyton on some macrophyte species in the partly meromictic Lake Verevi. Hydrobiologia, 2005, 547(1): 137-150. DOI:10.1007/s10750-005-4155-9 |
| [35] |
Pettit NE, Ward DP, Adame MF et al. Influence of aquatic plant architecture on epiphyte biomass on a tropical river floodplain. Aquatic Botany, 2016, 129: 35-43. DOI:10.1016/j.aquabot.2015.12.001 |
| [36] |
Quinlan EL, Phlips EJ, Donnelly KA et al. Primary producers and nutrient loading in Silver Springs, FL, USA. Aquatic Botany, 2008, 88(3): 247-255. DOI:10.1016/j.aquabot.2007.11.003 |
| [37] |
Yue GF, Wang JX, Zhu MY et al. Progress of inorganic carbon acqusition by alage (Ⅰ):Origen and methods of the studies. Marine Sciences, 2003, 27(5): 15-18. [岳国峰, 王金霞, 朱明远等. 藻类无机碳营养的研究进展(Ⅰ)--研究起源及研究方法. 海洋科学, 2003, 27(5): 15-18. DOI:10.3969/j.issn.1000-3096.2003.05.005] |
| [38] |
Xu YS.The effect of sediment resuspension on phytoplanktonic communities[Dissertation].Wuhan: Huazhong Agricultural University, 2007. [许炎生.沉积物再悬浮对浮游植物群落结构的影响[学位论文].武汉: 华中农业大学, 2007. ]
|
| [39] |
Wei HN.Relationship between algae and water nutrients and the decline of submerged plants[Dissertation].Nanjing: Nanjing Normal University, 2013. [魏宏农.附着藻类与水体营养盐及沉水植物衰亡的关系[学位论文].南京: 南京师范大学, 2013. ]
|
| [40] |
Dibble ED, Thomaz SM. A simple method to estimate spatial complexity in aquatic plants. Brazilian Archives of Biology and Technology, 2006, 49(3): 421-428. DOI:10.1590/S1516-89132006000400010 |
| [41] |
Taniguchi H, Nakano S, Tokeshi M. Influences of habitat complexity on the diversity and abundance of epiphytic invertebrates on plants. Freshwater Biology, 2010, 48(4): 718-728. |
| [42] |
Rho J, Gunner HB. Microfloral response to aquatic weed decomposition. Water Research, 1978, 12(3): 165-170. DOI:10.1016/0043-1354(78)90004-0 |
| [43] |
Warfe DM, Barmuta LA. Habitat structural complexity mediates food web dynamics in a freshwater macrophyte community. Oecologia, 2006, 150(1): 141-154. DOI:10.1007/s00442-006-0505-1 |
| [44] |
Guibaud G, Bhatia D, D'Abzac P et al. Cd (Ⅱ) and Pb (Ⅱ) sorption by extracellular polymeric substances (EPS) extracted from anaerobic granular biofilms:Evidence of a pH sorption-edge. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43(3): 444-449. DOI:10.1016/j.jtice.2011.12.007 |
| [45] |
Tian C, Si YB, Zhang YY. Sorption characteristic of Pb (Ⅱ) and Zn (Ⅱ) by biofilms in natural water. Journal of Agro-Environment Science, 2011, 30(6): 1180-1184. [田超, 司友斌, 张圆圆. 自然水体生物膜对Pb2+、Zn2+的吸附特性. 农业环境科学学报, 2011, 30(6): 1180-1184.] |
 2019, Vol. 31
2019, Vol. 31 

