(2: 宁波市城区内河管理处, 宁波 315040)
(2: Ningbo City Inland River Management Office, Ningbo 315040, P. R. China)
河流在城市生态景观、行洪排涝等方面发挥着重要作用[1].在城市发展过程中, 为充分利用土地资源、保障河流行洪能力和增强驳岸稳定性等, 河流岸线常常遭受侵占、河流被裁弯取直以及驳岸被硬质化改造,导致河岸自然岸线遭到破坏、生态功能退化[2-4].加上城市水体遭受污染甚至出现黑臭问题,部分区域出现水质型缺水,河流生态景观、自净能力大大下降,严重制约了社会经济和环境的可持续发展[5].因此,城市河流生态修复已成为河道管理者和学者的研究热点之一[6].
水生植物是水体主要初级生产者、水生态系统的重要组成部分[7].随着城市河流污染治理的深入,水质得到改善,基于水生植物的生态修复引起了人们的热烈关注[8].按照水生植物在水体中的生活方式不同,通常分为挺水植物、浮叶植物、沉水植物和漂浮植物.目前城市河流生态修复中最常见的是以挺水植物、浮叶植物以及漂浮植物为主的浮岛技术,沉水植物应用较少[9-10].与其他植物相比,沉水植物具有较独特的生态功能,如沉水植物的茎叶生长在水面以下能够直接吸附悬浮颗粒物、吸收氮磷营养物质、通过化感作用抑制藻类生长、直接向水体释放氧气以及增加水体空间生态位等[11-16].另外,沉水植物平均生活水深可达3.6 m[17].因此,在当前城市河流亟需生态治理、水体较深以及驳岸硬质化严重等多重背景下,恢复沉水植物并构建水下生态系统有较好的经济与环境效益.
然而,受多种条件限制,沉水植物在城市河流生态修复中实际应用的案例较少.张兰芳[18]发现苏州城市河道中悬浮物限制了沉水植物生长; 袁树东等[19]发现南京珍珠河的水流对沉水植物形态影响较大; 蒋克彬等[20]在宿迁河道进行沉水植物应用时,植物全部死亡,总结失败因素为河道水深、水质、底泥以及管理等.通过这些案例可以看出,城市河道复杂的环境加大了沉水植物恢复难度.多年来国内外学者开展了大量的环境因素对沉水植物影响机理的研究[21-24],这些环境因素包括光照、水质、底质、水文条件以及温度等.然而这些研究多是以室内试验或者干扰较少的自然水体为基础,对实际城区河道沉水植物的恢复指导作用有限.因此,基于城区河流复杂的环境特征对沉水植物的影响研究显得尤为必要.
宁波在城市河道治理方面一直走在我国前列,在国内率先采取PPP(Public—Private—Partnership)管理模式对市内河流进行了综合治理和养护,城区内河黑臭现象全面消除[25],河道治理发展到生态修复阶段.在河道管理过程中发现,沉水植物分布的河道往往生态环境较好,因此河道管理者在城市河流中也尝试了沉水植物恢复,但难以形成稳定的群落.即使形成了群落,却难以度过冬季.因此,本文选择宁波城区内河为研究对象,调查当前城区河流环境状况以及沉水植物分布特征,分析影响该区域沉水植物生长与分布的主要因素,并原位取样分析秋、冬季沉水植物群落特征及其耐低温生理特征,以期为城市河流沉水植物恢复提供指导依据.
1 材料与方法 1.1 研究区概况宁波中心城区包括海曙区、鄞州区及江北区,城区水系纵横交错,连通性良好.城区内河与外河(奉化江、姚江及甬江)受闸、碶隔断.除汛期向外河排水外,内河水位、流速常年比较稳定.本研究以宁波中心城区所有内河(154条)为研究对象,调研河流环境状况和沉水植物分布情况.
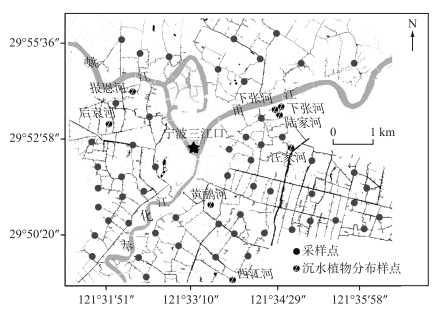
1.2 现场调研与分析于2017年10月对宁波城区154条内河进行沉水植物资源调查,以掌握沉水植物分布情况.在此基础上,选取城区无沉水植物分布的河流以及所有沉水植物分布的河流作为研究样点.普通河流的样点设置遵循系统布点规则,主要设置在多条河流交汇的河段,同时样点数量遵循抽样调查的经验法则,能够较好地反映宁波城区内河环境状况.沉水植物分布的河流样点主要设置在植物生长河段.如图 1所示,共设置了63个研究样点(这些样点可以反映宁波城区60 %以上的河流环境状况).对63个样点的水深、透明度、电导率(Cond)、总可溶性固体(TDS)、温度(T)、氧化还原电位(ORP)、酸碱度(pH)以及溶解氧(DO)等水环境指标进行现场测量以及上覆水样品采集.针对有沉水植物的河流,调研沉水植物的类型和群落盖度,并进行植物样品采集. 2018年1月,针对有沉水植物的河流进行第2次调研,并现场采集植物和上覆水样品.
|
图 1 研究区采样点分布 Fig.1 Distribution of sampling sites in the study area |
现场利用测深锤测定河道断面平均水深.利用塞氏盘测定水体透明度.利用便携式水质检测仪对水深、透明度、电导率、总可溶性固体、温度、氧化还原电位、pH以及DO等水环境指标进行监测.利用便携式摄影仪对沉水植物群落垂直照相后进行图像处理并统计像素,计算沉水植物盖度.
1.3 样品采集与保存每个样点利用分层采水器采集表层下50 cm处水样约1 L,储存于灭菌的聚乙烯塑料瓶中.乘坐皮划艇或者直接下水采集植物样品(约200 g),选取植物的新鲜叶片或茎尖绿色叶片.取来的样品经无菌蒸馏水清洗干净后放入无菌塑料袋.水样和植物样品直接放在带冰袋的保温箱内,于6 h内运回实验室.水样保存于4℃冰箱,24 h内完成水质分析.植物样品利用液氮冷冻后,保存于-65℃冰箱供后续植物生理指标分析.
1.4 水质指标分析总氮(TN)浓度采用碱性过硫酸钾消解紫外分光光度法测定,氨氮(NH3-N)浓度采用纳氏试剂分光光度法测定,总磷(TP)浓度采用钼酸铵分光光度法测定,高锰酸盐指数(CODMn)采用酸性高锰酸盐指数法测定[26].
1.5 植物生理指标分析植物叶片相对电导率(R)测定过程[19]:现场取新鲜植物叶片,用去离子水清洗干净并吸干表面水分,剪成适宜长度,利用便携电子天平快速称取3份,每份0.1 g,分别浸泡于10 ml去离子水的试管中; 常温下浸泡12 h,用电导仪测定浸提液电导率(R1),然后沸水浴加热30 min,冷却至常温后摇匀,再次测定浸提液相对电导率R2,R=R1/R2×100 %.叶片的可溶性糖、可溶性蛋白、丙二醛(MDA)、过氧化氢(H2O2)含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)活性测定过程[19, 27]:将保存于超低温冰箱中的植物叶片取出,用滤纸将叶片表面水分吸干.称取1 g植物叶片,按1:9的比例加入磷酸缓冲盐溶液,用匀浆器研磨成匀浆液.分别使用对应试剂盒测定可溶性蛋白、可溶性糖、MDA、H2O2含量以及SOD、POD活性(方法参考说明书).试剂盒购买于南京建成生物工程研究所(中国,南京).
1.6 数据处理与分析使用Excel 2013软件进行数据分析处理及图表绘制,使用SPSS 23.0软件进行独立样本T检验和显著性分析,使用Canoco 4.5软件进行数据CCA典范对应分析.
2 结果与分析 2.1 宁波城区内河环境状况以及沉水植物分布情况.调查期间,宁波城区河流的平均水温约20.2℃,63个调查样点平均水深约1.5 m. 63个采样点的水质监测结果显示:NH3-N、TP、CODMn以及DO浓度分别为0.97~4.98、0.18~0.7、2.88~13.92和0.54~6.45 mg/L,若以《地表水环境质量标准》中V类水为水质目标,主要超标因子为NH3-N,其次为TP.
根据沉水植物分布的调研,154条内河中仅有8条河流分布有沉水植物(图 1和表 1).这8条河流内均单一地分布着3种沉水植物轮叶黑藻(Hydrilla verticillata)、苦草(Vallisneria natans)或金鱼藻(Ceratophyllum demersum)中的1种.其中,黄鹂河的苦草群落盖度最大,后袁河的金鱼藻群落盖度最小.沉水植物分布的8个样点中有7个样点水质优于地表V类水(考虑NH3-N、TP及CODMn指标).
| 表 1 宁波城区内河沉水植物分布情况及植物样品编号 Tab. 1 Distribution of submerged plants in Ningbo urban rivers and the marking of some plant samples |
对55个无沉水植物分布样点以及8个有沉水植物分布样点的11个环境指标进行对比分析,如表 2.从河道特征来看,相比无沉水植物植物分布样点水深(范围1.0~2.9 m),有沉水植物分布样点水深(范围0.7~1.3 m)显著较浅(P < 0.01);从水体物理指标来看,有沉水植物植物分布样点的ORP显著高于无沉水植物植物分布样点(P < 0.01),而透明度、电导率以及总可溶性固体等指标在有、无沉水植物分布样点均无显著性差异; 从水质指标来看,相比无沉水植物分布样点,沉水植物分布样点水体的NH3-N和TP浓度显著较低(P < 0.01),而pH和DO浓度显著较高(P < 0.01),TN浓度和CODMn则无显著性差异.
| 表 2 有、无沉水植物分布河流环境状况 Tab. 2 Environmental conditions of rivers with and without submerged plants |
为研究样点与环境因子、沉水植物分布与环境因子之间的关系,对63个样点的物种及环境指标进行CCA分析(表 3).根据前向选择法和蒙特卡罗显著性检验,从11个环境指标中筛选出水深、ORP、pH、DO、TP和NH3-N 6个环境变量,这些环境变量的方差膨胀因子(VIF)均小于10,说明无明显的共线性问题.排序前两轴物种与环境因子的相关系数分别为0.859和0.311,同时物种与环境因子的累计解释量达到98.4 %,表明前两轴能够较好地反映沉水植物分布与环境因子的关系(表 3).
| 表 3 沉水植物与环境因子典型对应分析(CCA)前两轴的统计特征 Tab. 3 Statistical characteristics of the first two axes of the CCA analysis of submerged plants and environmental factors |
根据环境因子与排序轴的相关关系(表 4与图 2),与排序轴1呈显著正相关的指标有DO、ORP和pH值,呈显著负相关的指标有水深、NH3-N和TP; 与排序轴2呈显著正相关的指标有NH3-N和pH值,呈显著负相关的指标有DO和水深.沉水植物分布的样点主要集中在排序图中的第一、四象限,无沉水植物分布的样点集中在第二、三象限,说明沉水植物的分布与DO、ORP、pH指标均呈显著正相关,与水深及NH3-N、TP指标均呈显著负相关.
| 表 4 环境因子与排序轴的相关关系 Tab. 4 Correlation coefficient between environmental factors and sorting axes |

|
图 2 样点与环境因子的CCA排序图 Fig.2 CCA ordination diagrams of sampling sites-environmental factor |
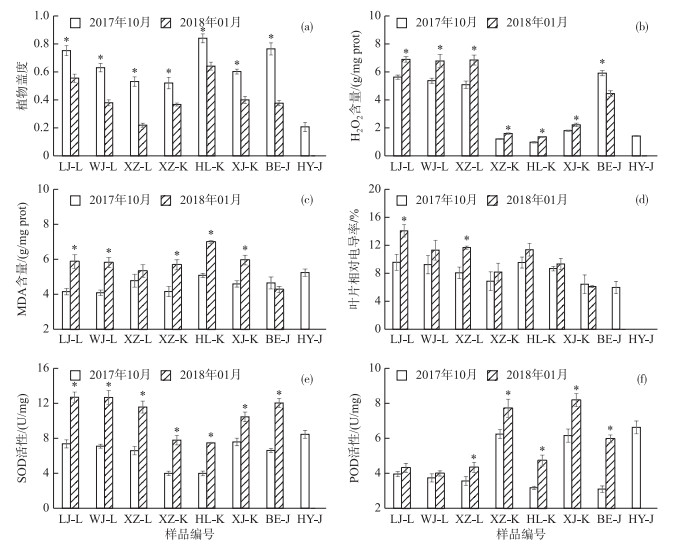
1月平均水温为6.9℃,沉水植物分布区平均透明度为0.65±0.15 m,NH3-N、TN、TP、CODMn以及DO浓度分别为1.06±0.57、6.89±1.82、0.45±0.2、6.3±1.9和5.3±1.2 mg/L.与10月温度(20.2℃)相比明显降低,水体透明度有所升高,TP浓度有所升高,其他水质指标变化不大.各样点沉水植物群落也有所变化,植物群落盖度在1月均有所减少(图 3a).另外发现,1月后袁河的金鱼藻已经消失,故未采集到植物样品.
|
图 3 植物生长及叶片生理指标变化 (*表示该植物样品在1月和10月存在显著差异,P < 0.05;LJ-L、WJ-L、XZ-L、XZ-K、HL-K、XJ-K、BE-J及HY-J分别表示表示陆家河-轮叶黑藻、汪家河-轮叶黑藻、下张河-轮叶黑藻、下张河-苦草、黄鹂河-苦草、西江河-苦草、报恩河-金鱼藻及后袁河-金鱼藻的样品) Fig.3 Changes in plant growth and plant leaf physiology indicators |
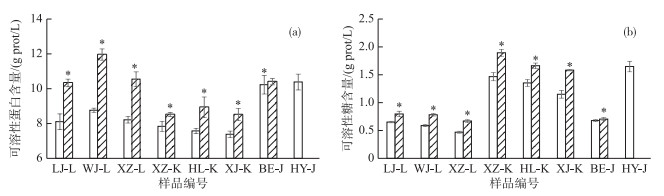
与10月样品相比,1月各植物样品中的苦草和轮叶黑藻体内H2O2含量(图 3b)显著升高(P < 0.05),MDA含量(图 3c)及叶片相对电导率(图 3d)也有所升高; 而金鱼藻体内H2O2含量显著降低(P < 0.05),MDA含量及叶片相对电导率有所下降. 1月3种沉水植物体内的SOD(图 3e)及POD(图 3f)活性均比10月份有所增强.此外1月植物体内的可溶性蛋白(图 4a)和可溶性糖含量(图 4b)均显著增加(P < 0.05).
|
图 4 植物体内可溶性蛋白和可溶性糖含量变化 (*表示该植物样品在1月和10月存在显著差异,P < 0.05;LJ-L、WJ-L、XZ-L、XZ-K、HL-K、XJ-K、BE-J及HY-J分别表示表示陆家河-轮叶黑藻、汪家河-轮叶黑藻、下张河-轮叶黑藻、下张河-苦草、黄鹂河-苦草、西江河-苦草、报恩河-金鱼藻及后袁河-金鱼藻的样品) Fig.4 Changes of soluble protein and soluble sugar contents in plants |
光照是影响沉水植物分布与生长的重要影响因素.水深和透明度直接决定了水体中沉水植物可获取的光照强度[28].水深越深或透明度越低,水下光照越弱.当光照强度低于沉水植物的光合补偿点时,植物生长则会受阻[22].另外,水深也会影响河流底部的温度、盐度以及溶解氧等环境条件,进而影响沉水植物的生长与繁殖[29].本研究中的宁波城区河流的平均水深为1.5 m,而沉水植物主要分布在水深较浅的区域(平均水深为0.9 m),表明当前环境条件下水深是影响沉水植物分布的因子之一.
透明度通过影响水体光学特性而影响水下光场[30].总可溶性固体表示水体中可溶性固体的含量,电导率是表示水体电解质含量的指标,二者与水体悬浮物存在着密切关系,一定程度上反映了水体的光学特性.已有研究表明沉水植物有吸附水体悬浮颗粒物、提高水体透明度的作用[7],但是本研究发现透明度、电导率和总可溶性固体在有、无沉水植物分布区域并无显著性差异.这可能与宁波市内河流连通性较高、生态补水浊度较高及河道管理船只通行扰动有关.
沉水植物对水体中的营养盐及有机质有着重要的调节作用[7].沉水植物是水体中天然的膜载体,其表面会附着一层由不同功能的微生物通过胞外聚合而形成的生物膜,这些植物及其表面附着生物膜是水体自净体系中的重要组成部分[31].然而,过高的营养盐浓度会对植物产生胁迫作用,从而抑制沉水植物生长.不同类型的沉水植物对营养盐的耐受范围不同,如Zhou等[24]在研究NH3-N对不同沉水植物影响时发现,轮叶黑藻、苦草、金鱼藻对NH3-N最大耐污浓度分别为6、6、4 mg/L; 张兰芳等[18, 32-33]发现磷浓度在超过0.6 mg/L时沉水植物依然能够存活,但会受到一定胁迫作用.本研究发现水体中NH3-N最高浓度为4.98 mg/L,TP最高浓度为0.70 mg/L; 沉水植物分布样点与无沉水植物分布样点的NH3-N和TP浓度差异十分显著,NH3-N和TP浓度在大多数无沉水植物分布样点均较高,在有沉水植物分布的样点普遍较低.这一方面说明当前部分河流的水质可能对沉水植物生长有一定影响,但另一方面金鱼藻、轮叶黑藻以及苦草对当前水质净化有较大贡献.另外,相比无沉水植物分布区,沉水植物分布区TN浓度差异不明显,而NH3-N浓度明显较低,说明有沉水植物区对水体NH3-N转化具有一定作用.
水体pH与沉水植物的生长代谢息息相关.溶解性无机碳(CO2、H2CO3、HCO3-及CO32-)是影响水体pH的重要因素[34].沉水植物可以通过光合作用吸收无机碳,进而影响水体的pH.不同类型沉水植物对不同形式无机碳的利用能力不同[35].例如金鱼藻在pH值介于5.8~6.2时光合作用最大[36],苦草和轮叶黑藻在pH大于9的水体仍能够生长[35, 37].本研究中宁波城区内河的样点pH值均在6.0~7.7范围内,是沉水植物适合生长的pH范围; 同时沉水植物分布样点的pH明显比无沉水植物分布区的要高,说明沉水植物可以通过光合作用消耗水中的CO2引起水体pH上升[38].
水体DO浓度是影响水生植物生长的重要环境因子.氧化还原电位是一项综合性指标,能反映水体中所有物质的宏观氧化-还原性,它与水体DO浓度密切相关.卢姣姣等[22]发现DO浓度小于5.5 mg/L时,苦草植株的生长与C代谢出现受阻,碳水化合物储存量降低.宁波城区水体的DO浓度范围为0.54~6.45 mg/L,部分水体为低氧状态,说明DO浓度可能是限制宁波城区沉水植物恢复的因素之一.与无沉水植物分布样点相比,有沉水植物分布样点的DO浓度和ORP显著较高,而氨氮和总磷浓度较低.这些结果说明,释放氧气提高水DO浓度和ORP,进而促进氨氮氧化及总磷沉降.然而,关于沉水植物对水体氨氮和总磷的去除机制还需要深入研究.
3.2 秋、冬季沉水植物的群落特征及生理变化温度是影响植物生长代谢以及生理活动的重要因素之一[39-40].水体温度往往伴随着季节变化,决定着植物的萌发、生长量和最大生长限度[41].本研究中宁波城区河流1月的水温约6.9℃,远低于10月(20.2℃),同时3种沉水植物的群落盖度(图 3a)相比10月均显著减少,可能与这3种沉水植物冬季进入衰亡期或低温生长缓慢有关[42-43].
根据秋、冬季的植物叶片生理指标变化结果,3种植物间存在着较大差异.大量研究表明,植物处于逆境条件下,细胞内固有的活性氧平衡会被打破,产生大量的活性氧(如H2O2)[19, 44].过量的活性氧产生会造成细胞原生质膜系统中不饱和脂肪酸发生过氧化作用而生成丙二醛(MDA),导致细胞的选择性降低,进一步胞内电解质外渗,引起植物叶片相对电导率升高[19],严重时会导致植物细胞死亡.本研究中,苦草和轮叶黑藻体内H2O2(图 3b)及MDA(图 3c)含量在冬季均有所升高,叶片相对电导率(图 3d)也升高,说明冬季苦草和轮叶黑藻相比秋季明显受到了胁迫作用,细胞膜系统遭受了一定损害.
为减轻逆境条件对细胞的伤害,植物体内也具备一套消除自由基和减轻脂质过氧化物的系统.超氧化物歧化酶(SOD)和过氧化物酶(POD)正是该系统中最重要的2个保护酶,分别参与分解植物体内的超氧根阴离子和H2O2[24, 27, 45].本研究发现1月各样点苦草和轮叶黑藻叶片中SOD(图 3e)和POD(图 3f)活性均比10月份的高,说明苦草和轮叶黑藻启动了抗氧化酶防御系统以应对低温环境的胁迫.
金鱼藻无根,在秋冬季节植株变脆,顶芽易脱落并沉于泥中休眠越冬,次年春天萌发为新株.本研究发现与另外2种沉水植物相比,金鱼藻冬季体内SOD和POD活性也明显上升,但是H2O2含量显著变低,MDA含量和叶片相对电导率也有所降低.笔者猜测可能是金鱼藻进入休眠期,生理活性减弱; 而较高的抗氧化酶活性仍有助于抵抗氧化胁迫、提高细胞耐胁迫能力.关于金鱼藻休眠期的生理指标变化仍需进一步研究.
可溶性蛋白含量常用来指示植物体总代谢变化,可溶性还原糖可用来指示植物体内碳素营养状况,它们均与植物细胞的渗透势有关.高浓度的可溶性蛋白和可溶性糖有助于维持植物细胞较低的渗透势,抵抗外界各种胁迫的伤害[19, 41].本研究中1月3种植物体内可溶性蛋白(图 4a)和可溶性糖(图 4b)含量显著高于10月份,说明低温环境促进了沉水植物体内这些物质的合成,提高了植物调节渗透平衡的能力.
上述研究表明,总体上低温对3种植物的生理活性产生了不利影响,但是这些植物也存在着一些耐低温机制以减轻低温对其伤害.该结果对于冬季生态修复和水生植物的选择提供了依据.但是,关于低温及其他因素综合作用对越冬沉水植物分布是否有显著影响,仍需要进一步研究.
4 结论1) 宁波城区内河中仅8条河流有沉水植物分布,以轮叶黑藻、苦草以及金鱼藻3种沉水植物为主.
2) 与无沉水植物分布河流相比,沉水植物分布的河道普遍较浅,水质更优. CCA分析结果表明宁波城区河道沉水植物分布主要与水深、NH3-N、TP、ORP、DO以及pH环境因素有关.
3) 与10月相比,1月研究区内轮叶黑藻、苦草以及金鱼藻的群落盖度均显著下降; 冬季低温对3种沉水植物的影响存在一定差异,冬季轮叶黑藻和苦草叶片的过氧化氢、丙二醛含量以及叶片相对电导率均显著提高,金鱼藻没有显著变化; 3种沉水植物均具有一定抗低温胁迫的能力,主要表现为叶片内抗氧化酶活性、可溶性蛋白和可溶性糖含量均显著提高.
上述研究结果进一步表明:当前条件下宁波市城区内河中水深、NH3-N、TP、DO以及温度是影响沉水植物修复的主要因素; 沉水植物轮叶黑藻、苦草及金鱼藻具有一定的耐低温性.因此,建议宁波城区河道进行沉水植物生态恢复实践时,优先选择本土沉水植物种类,如轮叶黑藻和苦草等,在水深较浅、水环境稳定的河流(河段)开展.
| [1] |
Chen XR. The impact and function of urban rivers in urban development. China Three Gorges, 2013, 20(3): 19-24. [陈兴茹. 城市河流在城市发展中的作用及功能. 中国三峡, 2013, 20(3): 19-24.] |
| [2] |
Wu AN, Che Y, Zhang HW et al. Urban river regulation: Past, present and prospects. China Water and Wastewater, 2008(4): 13-18. [吴阿娜, 车越, 张宏伟等. 国内外城市河道整治的历史、现状及趋势. 中国给水排水, 2008(4): 13-18. DOI:10.3321/j.issn:1000-4602.2008.04.003] |
| [3] |
Wang DD, Shi Z, Yang K et al. Environmental effects of riparian land use change of urban river: A case study of Suzhou creek in Shanghai. China Population, Resources and Environment, 2009(3): 96-101. [汪冬冬, 施展, 杨凯等. 城市河流滨岸带土地利用变化的环境效应——以上海苏州河为例. 中国人口·资源与环境, 2009(3): 96-101. DOI:10.3969/j.issn.1002-2104.2009.03.020] |
| [4] |
Cai JN, Pan WB, Cao YZ et al. Impact of river morphology on urban river self-purification capacity in Guangzhou. Water Resources Protection, 2010(5): 16-19. [蔡建楠, 潘伟斌, 曹英姿等. 广州城市河流形态对河流自净能力的影响. 水资源保护, 2010(5): 16-19. DOI:10.3969/j.issn.1004-6933.2010.05.004] |
| [5] |
Ji L, Yang LW, Li J. Study on pollution situation of Nanfeihe River and strategies of sustainable development. Journal of Anhui University: Natural Science, 2006, 30(4): 91-94. [纪岚, 杨立武, 李菁. 南淝河水污染现状与可持续发展对策研究. 安徽大学学报:自然科学版, 2006, 30(4): 91-94.] |
| [6] |
He SY, Wei YF, Yang HJ. Current situation and problems of ecologic rehabilitation study for urban river. Water Resources & Hydropower of Northeast China, 2005(12): 44-45. [何松云, 韦亚芬, 杨海军. 城市河流生态恢复的研究现状与问题. 东北水利水电, 2005(12): 44-45. DOI:10.3969/j.issn.1002-0624.2005.12.022] |
| [7] |
Wu ZB et al. Aquatic plants and ecological restoration of water bodies. Beijing: Science Press, 2011. [吴振斌等. 水生植物和水体生态修复. 北京: 科学出版社, 2011.]
|
| [8] |
Xu HW, Lu Y. Research advances of aquatic plants in water ecological restoration. Chinese Agricultural Science Bulletin, 2011, 27(3): 413-416. [徐洪文, 卢妍. 水生植物在水生态修复中的研究进展. 中国农学通报, 2011, 27(3): 413-416.] |
| [9] |
Fang C. Plant space construction technology for pollution control in Dianchi Lake[Dissertation]. Shanghai: Fudan University, 2014. [方晨.滇池污染控制的植物空间构建技术[学位论文].上海: 复旦大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015414011.htm ]
|
| [10] |
Ren ZY, Deng CG. A new green phytoremediation technology of aquatic plants. Water Saving Irrigation, 2007(4): 17-19. [任照阳, 邓春光. 新兴绿色技术——水生植物修复技术. 节水灌溉, 2007(4): 17-19. DOI:10.3969/j.issn.1007-4929.2007.04.006] |
| [11] |
Barko JW, James WF eds. Effects of submerged aquatic macrophytes on nutrient dynamics. Sedimentation, and resuspension. New York: Springer, 1998: 197-214.
|
| [12] |
Ferreira TF, Crossetti LO, Marques DMLM et al. The structuring role of submerged macrophytes in a large subtropical shallow lake: Clear effects on water chemistry and phytoplankton structure community along a vegetated-pelagic gradient. Limnologica, 2018, 69: 142-154. DOI:10.1016/j.limno.2017.12.003 |
| [13] |
Leu E, Kriegerliszkay A, Goussias C et al. Polyphenolic allelochemicals from the aquatic angiosperm Myriophyllum spicatum inhibit photosystem Ⅱ. Plant Physiology, 2002, 130(4): 2011-2018. DOI:10.1104/pp.011593 |
| [14] |
Cai PY, Liu AQ, Hou XL. Biological purification effect of nine aquatic plants on N and P from simulation wastewater. Journal of Fujian Agriculture & Forestry University, 2010, 39(3): 313-318. |
| [15] |
Li EH, Li W, Liu GH et al. The effect of different submerged macrophyte species and biomass on sediment resuspension in a shallow freshwater lake. Aquatic Botany, 2008, 88(2): 121-126. DOI:10.1016/j.aquabot.2007.09.001 |
| [16] |
Xue WN. Physiological and ecological studies on several submerged plants in water ecological restoration [Dissertation]. Shanghai: Shanghai Normal University, 2005. [薛维纳.水体生态修复中几种沉水植物的生理生态研究[学位论文].上海: 上海师范大学, 2005. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y708329 ]
|
| [17] |
Li W, Fu H, Cao T et al. Distribution and carbon, nitrogen and phosphorus stoichiometric characteristics of submersed macrophytes in Lake Fuxian. J Lake Sci, 2017, 29(2): 448-457. [李威, 符辉, 曹特等. 抚仙湖沉水植物分布及其碳、氮和磷化学计量学特征. 湖泊科学, 2017, 29(2): 448-457. DOI:10.18307/2017.0221] |
| [18] |
Zhang LF. Effects of water quality conditions on the growth of submerged plants (Elodea elegans and Potamogeton crispus) [Dissertation]. Nanjing: Hohai University, 2006. [张兰芳.水质条件对沉水植物(伊乐藻、菹草)生长的影响.南京: 河海大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10294-2006044056.htm ]
|
| [19] |
Zhang SH, Yuan SD, Han B. Physiological response of Vallisneria natans to water flow in wild river. Water Resources Protection, 2018, 34(3): 96-103. [张松贺, 袁树东, 韩冰. 自然河道中沉水植物苦草对水流的生理响应. 水资源保护, 2018, 34(3): 96-103.] |
| [20] |
Jiang KB, Peng S. Basie situation of aquatic plants and application experiment of submerged plants in Suqian area. Environmental Science and Technology, 2010, 23(Z2): 7-9. [蒋克彬, 彭松. 宿迁地区水生植物基本情况与沉水植物应用实验. 环境科技, 2010, 23(Z2): 7-9. DOI:10.3969/j.issn.1674-4829.2010.z2.003] |
| [21] |
Wang C, Zheng S, Wang P et al. Interactions between vegetation, water flow and sediment transport: A review. Journal of Hydrodynamics, 2015, 27(1): 24-37. DOI:10.1016/S1001-6058(15)60453-X |
| [22] |
Lu JJ, Zhang M, Quan SQ et al. Integrated effects of hypoxia, high ammonia and low light on the growth and physiological C-N metabolism indices of Vallisneria natans. J Lake Sci, 2018, 30(4): 1064-1074. [卢姣姣, 张萌, 全水清等. 低氧、高铵和低光对沉水植物苦草(Vallisneria natans)生长与C-N代谢生理指标的影响特征. 湖泊科学, 2018, 30(4): 1064-1074. DOI:10.18307/2018.0419] |
| [23] |
Zhao ST, Li EH, Yang J et al. Effects of light intensity on the seeds germination, seedlings growth and physiology of Ottelia acuminata. J Lake Sci, 2014, 26(1): 107-112. [赵素婷, 厉恩华, 杨娇等. 光照对海菜花(Ottelia acuminata)种子萌发、幼苗生长及生理的影响. 湖泊科学, 2014, 26(1): 107-112. DOI:10.18307/2014.0113] |
| [24] |
Zhou JB, Jin SQ, Bao WH et al. Comparison of effects of ammonia-nitrogen concentrations on growth of four kinds of submerged macrophytes. Journal of Agricultural Resources & Environment, 2018, 35(1): 74-81. [周金波, 金树权, 包薇红等. 不同浓度氨氮对4种沉水植物的生长影响比较研究. 农业资源与环境学报, 2018, 35(1): 74-81.] |
| [25] |
Yang Z. Eliminate the inferior Class V water, Ningbo does so. Ningbo Newsreport, 2017(9). [杨芝. 剿灭劣Ⅴ类水, 宁波这么做. 宁波通讯, 2017(9).] |
| [26] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and wastewater monitoring and analysis methods: 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.]
|
| [27] |
Gong L, Zhang S, Chen D et al. Response of biofilms-leaves of two submerged macrophytes to high ammonium. Chemosphere, 2018, 192: 152-160. DOI:10.1016/j.chemosphere.2017.09.147 |
| [28] |
Sun SY. Effects of water depth gradient on community structure and interspecific relationship of submerged plants [Dissertation]. Nanjing: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, 2016. [孙淑雲.水深梯度对沉水植物群落结构及种间关系的影响[学位论文].南京: 中国科学院南京地理与湖泊研究所, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3105173 ]
|
| [29] |
Yang K, Zhang ML. Application of vertical water quality automatic monitoring system in stratified water intake of reservoir: case of Lushui Reservoir in Chibi, Hubei Province. Yangtze River, 2015(4): 98-101. [杨鹍, 张茂林. 水质垂直剖面自动监测在水库分层取水中的应用——以湖北赤壁市陆水水库为例. 人民长江, 2015(4): 98-101.] |
| [30] |
Cao J, Hu H, Shi Q. Study on transparency conditions of submerged plants. Journal of Zhejiang Agricultural Sciences, 2012, 40(3): 1710-1711. [曹昀, 胡红, 时强. 沉水植物恢复的透明度条件研究. 安徽农业科学, 2012, 40(3): 1710-1711. DOI:10.3969/j.issn.0517-6611.2012.03.159] |
| [31] |
Liu KH, Zhang SH, Lv XY. The characteristics of epiphytic microbes of three submerged macrophytes in Lake Huashen. J Lake Sci, 2015, 27(1): 103-112. [刘凯辉, 张松贺, 吕小央等. 南京花神湖3种沉水植物表面附着微生物群落特征. 湖泊科学, 2015, 27(1): 103-112. DOI:10.18307/2015.0113] |
| [32] |
Kang CX, Dai XZ, Liu Y. Physiological responses of Vallisneria asiatica to the stress of high concentrations of ammonia N or P. Safety and Environmental Engineering, 2018(3): 72-77. [康彩霞, 戴星照, 刘艳. 高浓度氨氮或磷胁迫对亚洲苦草生理特性的影响. 安全与环境工程, 2018(3): 72-77.] |
| [33] |
Wen MZ. Effects of nutrients and snail grazing on the growth of submerged plants (Vallisneria natans) [Dissertation]. Nanjing: Nanjing University of Information Engineering, 2008. [文明章.营养盐及螺牧食对沉水植物(苦草)生长的影响[学位论文].南京: 南京信息工程大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1257720 ]
|
| [34] |
Wang H, Pang Y, Liu SB et al. Research progress on influencing of environmental factors on the growth of submersed macrophytes. Acta Ecologica Sinica, 2008(8): 3958-3968. [王华, 逄勇, 刘申宝等. 沉水植物生长影响因子研究进展. 生态学报, 2008(8): 3958-3968. DOI:10.3321/j.issn:1000-0933.2008.08.056] |
| [35] |
Zhang L, Chen C, Gao Q et al. Effects of pH on the growth of Hydrilla verticillata and its antioxidative enzyme activities under two nutritional conditions. Ecology and Environment, 2007, 16(3): 748-752. [张浏, 陈灿, 高倩等. 两种营养状态下pH对轮叶黑藻(Hydrilla verticillata)生长和抗氧化酶活性的影响. 生态环境, 2007, 16(3): 748-752. DOI:10.3969/j.issn.1674-5906.2007.03.007] |
| [36] |
Su RL, Li W. Advances in research on photosynthesis of submerged macrophytes. Chinese Bulletin of Botany, 2005(S1): 128-138. [苏睿丽, 李伟. 沉水植物光合作用的特点与研究进展. 植物学报, 2005(S1): 128-138.] |
| [37] |
Ren N, Yan GA, Ma JM et al. The study on the influence of environmental factors of the sumberged macrophytes in the east lake. Journal of Wuhan University: Natural Science Edition, 1996(2): 213-218. [任南, 严国安, 马剑敏等. 环境因子对东湖几种沉水植物生理的影响研究. 武汉大学学报:自然科学版, 1996(2): 213-218.] |
| [38] |
Zhao LF, Zhu W, Mo MX. Effects of submerged macrophytes on pH values and nitrogen removal. Water Resources Protection, 2008, 24(6): 64-67. [赵联芳, 朱伟, 莫妙兴. 沉水植物对水体pH值的影响及其脱氮作用. 水资源保护, 2008, 24(6): 64-67. DOI:10.3969/j.issn.1004-6933.2008.06.016] |
| [39] |
Carvalho P, Thomaz SM, Bini LM. Effects of temperature on decomposition of a potential nuisance species: the submerged aquatic macrophyte Egeria najas Planchon (Hydrocharitaceae). Brazilian Journal of Biology, 2005, 65(1): 51-60. DOI:10.1590/S1519-69842005000100008 |
| [40] |
He J, Gu XH, Liu GF. Aquatic macrophytes in East Lake Taihu and its interaction with water environment. J Lake Sci, 2008, 20(6): 790-795. [何俊, 谷孝鸿, 刘国锋. 东太湖水生植物及其与环境的相互作用. 湖泊科学, 2008, 20(6): 790-795. DOI:10.18307/2008.0618] |
| [41] |
Pan Q, Song XF, Zou GY et al. Effect of temperature on the activities of antioxidative enzymes of submerged macrophytes. Ecology and Environmental Sciences, 2009, 18(5): 1881-1886. [潘琦, 宋祥甫, 邹国燕等. 不同温度对沉水植物保护酶活性的影响. 生态环境学报, 2009, 18(5): 1881-1886. DOI:10.3969/j.issn.1674-5906.2009.05.053] |
| [42] |
Wang LZ, Wang GX. Influence of submerged macrophytes on phosphorus transference between sediment and overlying water in decomposition period. Acta Ecologica Sinica, 2013, 33(17): 5426-5437. [王立志, 王国祥. 衰亡期沉水植物对水和沉积物磷迁移的影响. 生态学报, 2013, 33(17): 5426-5437.] |
| [43] |
Si J, Xing Y, Lu SY et al. Release rule research of submerged plants with temperature impact in contabescence. Chinese Agricultural Science Bulletin, 2009, 25(1): 217-223. [司静, 邢奕, 卢少勇等. 沉水植物衰亡过程中氮磷释放规律及温度影响的研究. 中国农学通报, 2009, 25(1): 217-223.] |
| [44] |
Demidchik V. ROS-activated ion channels in plants: Biophysical characteristics, physiological functions and molecular nature. International Journal of Molecular Sciences, 2018, 19(4): 1263. DOI:10.3390/ijms19041263 |
| [45] |
Xing YN, Ruan XH. Effects of sulfide (S2-) on physiological and biochemical indicators of Potamogeton malaianus. Water Resources Protection, 2010, 26(4): 46-48. [邢雅囡, 阮晓红. 硫化物胁迫对马来眼子菜生理生化指标的影响. 水资源保护, 2010, 26(4): 46-48. DOI:10.3969/j.issn.1004-6933.2010.04.013] |
 2019, Vol. 31
2019, Vol. 31 

