(2: 江苏省地理信息资源开发与利用协同创新中心, 江苏省环境演变与生态建设重点实验室, 江苏省水土环境生态修复工程实验室, 南京 210023)
(3: 美国东北大学土木与环境学院, 马萨诸塞州 02115)
(2: Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Jiangsu Engineering Lab of Water and Soil Eco-remediation, Nanjing 210023, P. R. China)
(3: Department of Civil and Environmental Engineering, Northeastern University, Boston, Massachusetts 02115, United States)
铁循环广泛分布于湖泊、湿地、海洋等各类水生态系统中[1]. Fe(Ⅱ)和Fe(Ⅲ)的氧化还原过程是铁循环的核心,分为微生物氧化还原及化学氧化还原,微生物过程由铁还原菌(FeRB)和铁氧化菌(FeOB)主导,而化学过程的主要参与者为H2、ΣS2-等电子供体和NO3-、O2等电子受体[2-3].由于铁循环通常伴随着有机物向无机物的转化,且铁氧化物的结晶与沉淀会吸附大量无机元素,因此铁循环与其他元素循环往往有着密不可分的关系[4-5].
随着工业发展,大量硫元素进入水生态系统,引起了全球性的淡水硫酸盐浓度升高[6-8].硫酸盐浓度的升高会刺激硫还原,导致水体与沉积物中的硫化物(ΣS2-)聚集.这一过程通常是微生物过程,由硫酸盐还原菌(SRB)主导[9].由于SRB和FeRB同为厌氧菌,且可利用的基质相仿(甲酸、乙酸等小分子有机物),因此可能会发生竞争,竟而影响到硫铁循环.已有研究发现自然环境中FeRB被SRB抑制的现象,并导致微生物铁还原被ΣS2-诱导的化学铁还原所替代[10-12].这类化学铁还原过程往往伴随着大量磷释放,使富营养化加剧[13].而富营养化引起的蓝藻暴发又会为上述反应过程提供基质和厌氧环境,由此形成恶性循环[14].此外,由于不断生成的黄铁矿能在厌氧条件下永久埋藏,导致水生态系统中可利用的活性铁减少,微生物硫还原的主导地位将更加难以改变,恶性效应不断加剧[15]. Diaz等[16]报道了海洋中的“死亡海域”,影响面积已超过24000 km2.这类区域的水体长期保持缺氧与富营养化状态,有严重的生态风险.
强烈的硫还原和化学铁还原也会对淡水生态系统造成严重负面影响.太湖湖泛现象的产生与硫、铁还原密不可分[17].硫还原产生的硫离子(dS2-)能与二价铁离子(dFe2+)生成铁硫化合物,导致湖水变黑[18].而湖泛发生时产生的挥发性硫化物,如硫化氢、甲硫醇、二甲基三硫醚等,是致嗅物质的主要成分[19].由于备受关注的湖泛现象多发生于蓝藻暴发的夏季,且与铁、硫循环密不可分,因此关于铁、硫循环的研究一般集中于蓝藻对其的影响[20]. Chen等[21-22]在模拟太湖蓝藻暴发时,在沉积物中发现了强烈的硫、铁还原.而这一结果也在诸多夏季蓝藻暴发期间的野外调查得到印证[23].但关于春季无蓝藻的太湖原位调查较少,较近的同时对太湖沉积物硫、铁循环的研究是来自于2007年尹洪斌等[24]对梅梁湾沉积物的报道,对于春季太湖沉积物中的硫铁循环特征并未有普适结论.已有研究表明,即使硫酸盐浓度较低(0.1 mmol/L),硫元素也能显著影响铁循环[10],因此,研究春季沉积物中的硫铁循环特征是必要的.
本研究选取太湖西岸三种典型区域的柱状沉积物为研究对象,分别代表太湖的聚藻区、清淤区及开阔水域.通过分析沉积物及间隙水中的还原性无机硫和铁的分布及微生物群落结构,揭示太湖典型区域沉积物的硫铁地球化学特征.
1 材料与方法 1.1 样品采集与处理以太湖西岸3个不同区域为研究对象.聚藻区位于毛渎港近岸(31.412°N,120.011°E),其周边有长条状的密集芦苇带,仅有芦苇带的头尾与外部湖水相连,因此具有几乎不受风浪扰动的密闭环境,该区域即使在春季仍有蓝藻覆盖在水面.清淤区位于芦苇带外侧的近岸区域(31.418°N,120.001°E),因被清淤而少有淤泥淤积.开阔水域位于离岸3.5 km处(31.402°N,120.040°E),代表了太湖的主要环境类型.
2018年4月中旬用重力采样器(内径9.5 cm,长100 cm)于不同区域分别采集柱状沉积物,为了排除单个沉积物柱状样有特异性,每个区域均采集2根沉积物柱状样,并以A、B代称,以反映真实情况.采集样品时,保留10 cm的上覆水,随后将重力采样器上下分别用橡胶塞密封,在冰块的保护下于4 h内带回实验室分析.
柱状样按前1~9 cm为1 cm一层,9~78 cm为3 cm一层进行分层,将分层后的样品立即装入离心管中,并在通N2 20 s后加盖离心(5000转/min,10 min)得到间隙水,dS2-和dFe2+浓度立即测定,其余间隙水指标在48 h内测定,沉积物指标在5 d内完成,沉积物DNA提取在样品分层24 h内完成.
1.2 间隙水及沉积物中硫、铁分析所有间隙水样品均经0.45 μm滤膜过滤后测定. SO42-浓度参照Tabatabai[25]的浊度比色法进行测定. dS2-浓度用亚甲基蓝比色法测定[26],dFe2+浓度用Ferrozine比色法测定[27],在加入10 %的盐酸羟胺溶液将dFe3+还原成Fe2+后,经比色后可得dTFe.
沉积物中铁氧化物的测定参照Rozan等[28]的方法.将4 g抗坏血酸、10 g柠檬酸钠和10 g碳酸氢钠溶于200 ml高纯水得到抗坏血酸提取液,向0.4 g沉积物中加入10 ml提取液并水浴(50℃,200转/min)24 h得到无定形三价铁(FeASC)的待测液.将20 g连二亚硫酸钠溶解到200 ml 0.35 mol/L乙酸钠的溶液中,将配置所得的提取液10 ml加入0.25 g沉积物中,振荡(室温,200转/min)2 d得到总三价铁氧化物(Fe(Ⅲ)oxides)的待测液.将待测液过滤后用Ferrozine比色法测定dTFe浓度,经换算得到FeASC、Fe(Ⅲ)oxides含量.结晶三价铁(Fecry)含量为Fe(Ⅲ)oxides含量减去FeASC含量.所测得的FeASC主要为无定形铁,可能包含少量FeS,是最易参与铁循环的沉积态铁;Fe(Ⅲ)oxides为Fe(Ⅲ)氧化物的总量,Fecry主要为结晶态铁[28].
沉积物AVS和Pyrite-S的测定采用冷扩散分级提取法[29].以10 %碱性醋酸锌为吸收液,用6 mol/L HCl对沉积物提取6 h,所得吸收液的dS2-浓度经换算得到AVS含量.更换吸收液后,用经Zn粒还原的Cr(Ⅱ)溶液对沉积物提取48 h,所得吸收液的dS2-浓度经换算得到Pyrite-S含量.测得的AVS主要包括游离态ΣS2-、非晶质FeS、及其他二价金属硫化物,其中FeS是dS2-与dFe2+反应的初级产物;Pyrite-S的主要成分是黄铁矿(FeS2),是硫铁化合物的稳定贮存形态[30].
硫、铁还原速率测定参照Thomsen等的袋式培养实验[31].沉积物分层后,将0~15 cm沉积物均匀混合,放置于气密培养带在15℃(湖底温度)的黑暗环境中培养.分别于0.5、1、2、3、5 d测定沉积物间隙水的dS2-、dFe2+浓度.所有指标浓度均转化为单位体积间隙水中的摩尔值,并根据单位时间内dS2-、dFe2+浓度的线性增加量,参照公式(1)计算得到硫、铁还原速率.
| ${\rm{硫(铁)还原速率 = }}\frac{{{\rm{d}}{{\rm{S}}^{2 - }}\left( {{\rm{dF}}{{\rm{e}}^{2 + }}} \right){\rm{浓度变化}}\left( {{\mathrm{\mu mol/L}}} \right)}}{{{\rm{反应时长}}\left( {\rm{d}} \right) \cdot {\rm{沉积物干重}}\left( {\rm{g}} \right)}} $ | (1) |
土壤微生物量碳的测定方法是经林启美等[32]改进后的熏蒸法.具体操作为:称取20 g沉积物置于100 ml烧杯中,并连同盛有60 ml无酒精氯仿的烧杯放入真空干燥器.抽真空使氯仿沸腾2 min,随后将真空干燥器培养24 h (25℃).去除氯仿,反复抽气直至沉积物无氯仿气味,随后加入0.5 mol/L K2SO4溶液并振荡30 min (200转/min),过滤后用TOC分析仪(Analytik Jena HT1300)测定TOC含量.同时以无熏蒸作为空白对照,计算方法如下:
| ${\rm{土壤微生物量碳}}\left( {{\rm{mg/kg}}} \right) = 2.64 \times {\rm{熏蒸与不熏蒸土壤有机碳含量的差值}} $ | (2) |
沉积物按0~10、10~40 cm分层,根据Ultra CleanTM Soil DNA Isolation Kit (Mo Bio Laboratories. Inc)说明书的方法提取各层沉积物的DNA.提取后的DNA用Nano Drop进行检验,260/280在1.8~2.0之间,并用1 %琼脂糖凝胶电泳检测DNA提取质量.
用515F (5′-GTGCCAGCMGCCGCGG-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)引物对V3~V4可变区进行PCR扩增,扩增程序为:95℃预变性3 min,随后进行27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),最后72℃延伸10 min.扩增体系为20 μl,包含4 μl 5FastPfu缓冲液,2 μl 2.5 mmol/L dNTPs,0.8 μl引物,0.4 μl FastPfu聚合酶,10 ng DNA模板[22].扩增完成后送至上海美吉生物技术公司进行Illumina测序.测序序列用UPARSE软件,根据97 %的相似度对序列进行OUT分类.将OUT中的代表序列对比得到微生物在界门纲目科属种分类水平的信息.
本研究16S rRNA高通量测序数据已上传NCBI Sequence Read Archive (SRA)数据库,序列号为PRJNA492360.
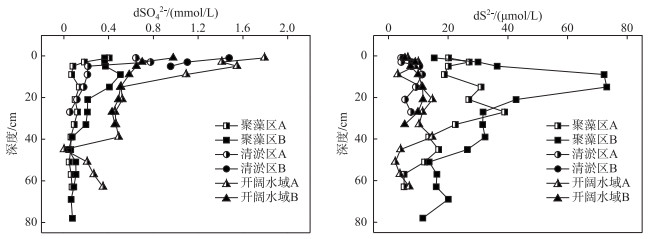
2 结果 2.1 沉积物间隙水中硫、铁的分布特征各区域沉积物间隙水中dSO42-浓度均随深度增加而下降.聚藻区沉积物dSO42-平均浓度仅为0.12±0.01(聚藻区A)、0.21±0.02 (聚藻区B) mmol/L,清淤区A点平均浓度为0.33±0.01 mmol/L,而B点因沉积物深度仅有5 cm,其dSO42-浓度较高(1.22±0.19 mmol/L).开阔水域沉积物的dSO42-浓度最高,其中0~5 cm表层沉积物达到1.56±0.13 (开阔水域A),0.80±0.02 mmol/L(开阔水域B)(图 1).
|
图 1 不同区域沉积物间隙水中dSO42-和dS2-浓度的垂直分布特征 Fig.1 Vertical distribution of dSO42- and dS2- concentrations in three types of sediments |
沉积物间隙水中的dS2-主要来源于SO42-的还原.聚藻区A、B点的0~1 cm表层沉积物中dS2-含量较低,随后在2~30、2~21 cm深度迅速波动上升,A点的最高浓度可达84.47±5.39 μmol/L.当沉积物深度大于30、21 cm时,聚藻区A、B点的dS2-浓度均随深度增加而下降.清淤区、开阔水域仅分别在15~20、30~40 cm的沉积物中有轻微上升,且最大浓度均小于20 μmol/L,其余点位的dS2-浓度均在较低浓度内(< 11.3±1.82 μmol/L)波动.不同区域的沉积物dS2-浓度分布差异明显,趋势与dSO42-浓度相反,自近岸到湖心各点位平均浓度分别为20.4±1.69 (聚藻区A)、31.3±2.30 (聚藻区B)、9.29±1.04 (清淤区A)、7.10±0.91 (清淤区B)、7.41±1.63 (开阔水域A)、8.88±1.52 (开阔水域B) μmol/L(图 1).各点位dFe2+平均浓度为dS2-的2.68~10.26倍.
除开阔水域A点的表层dFe2+浓度出现轻微降低,各点位沉积物间隙水中dFe2+浓度的垂直分布基本为随深度增加而减小.聚藻区A、B点位深度低于50 cm的沉积物中,dFe2+浓度均呈上升趋势.不同区域沉积物中的dFe2+浓度差异明显,总体趋势为聚藻区>开阔水域>清淤区.所有点位的dFe2+浓度峰值均出现在0~10 cm沉积物中,自近岸带向湖心的方向依次为0.36±0.02(聚藻区A)、0.29±0.02 (聚藻区B)、0.14±0.03 (清淤区A)、0.08±0.01 (清淤区B)、0.14±0.03 (开阔水域A)、0.16±0.01 (开阔水域B) mmol/L(图 2).

|
图 2 不同区域沉积物间隙水中dFe2+和dTFe浓度的垂直分布特征分布 Fig.2 Vertical distribution of dFe2+ and dTFe concentrations in three types of sediments |
间隙水dTFe浓度的垂直分布不同于dFe2+,随深度增加呈递增趋势.不同区域沉积物中dTFe浓度的分布与dFe2+不同,呈沿聚藻区-清淤区-开阔水域的递减趋势,平均浓度分别为0.60±0.05 (聚藻区A)、0.47±0.02 (聚藻区B)、0.18±0.03 (清淤区A)、0.25±0.05 (清淤区B)、0.13±0.01 (开阔水域A)、0.11±0.01 (开阔水域B) mmol/L(图 2).
dFe2+是表层沉积物(0~20 cm)间隙水中的主要赋存形态,约占dTFe的26.8 % ~91.3 %,反映出沉积物间隙水中的dFe2+具有较高的释放通量,由于dFe2+主要来源于被还原的Fe3+或Fe(Ⅲ)oxides,因此可以间接表明沉积物中铁还原的活跃程度.聚藻区沉积物的平均dFe2+占比高达63.1 %,而清淤区和开阔水域的dFe2+占比仅为26.1 %和38.3 %.
2.2 沉积物中硫、铁的分布特征本研究测定了不同区域沉积物中硫化物(AVS、Pyrite-S)、铁氧化物(FeASC、Fecry、Fe(Ⅲ)oxides)含量及硫铁还原速率以探究沉积物中的硫铁还原.
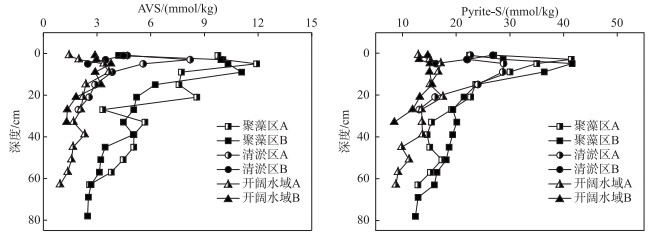
AVS和Pyrite-S是还原性无机硫的主要成分.各点位沉积物AVS和Pyrite-S含量的垂直变化趋势相似,均在表层较低,并在0~10 cm深度快速上升,在达到峰值后随深度增加而降低.不同区域沉积物还原性无机硫的含量差异显著.各点位AVS平均含量分别为6.74±0.25 (聚藻区A)、5.26±0.10 (聚藻区B)、4.42±0.10 (清淤区A)、3.68±0.08 (清淤区B)、2.10±0.10(开阔水域A)、2.61±0.09 (开阔水域B) mmol/kg.此外聚藻区沉积物Pyrite-S含量也高于其余点位,聚藻区A、B点的含量峰值分别在5、9 cm深度处,达到13.86±0.14、11.99±0.17 mmol/kg. Pyrite-S含量在40 cm以下的深度相对稳定,聚藻区和开阔水域的平均含量分别为3.61±0.16、1.54±0.16 mmol/kg (图 3).
|
图 3 不同区域沉积物中AVS和Pyrite-S含量的垂直分布特征 Fig.3 Vertical distribution of AVS and Pyrite-S contents in three types of sediments |
AVS与Pyrite-S的摩尔比常被用作代表沉积物黄铁矿化的速率,其比值小于0.3时,便认为黄铁矿化可以有效进行[33].本研究中,Pyrite-S在各点位沉积物无机硫化物中均占较大比例(76.6 % ~87.6 %).除聚藻区A表层沉积物,AVS/Pyrite-S的摩尔比均小于0.3(表 1).
清淤区、开阔水域沉积物各形态三价铁的含量垂直分布特征相似. FeASC、Fecry、Fe(Ⅲ)oxides含量均随沉积物深度的增加而逐渐下降,当深度大于40 cm时,无明显变化趋势,稳定在28.3~57.7 mmol/kg.聚藻区沉积物的三价铁含量在表层较低,表层沉积物平均FeASC含量仅分别为清淤区、开阔水域的57.8 %、56.8 %;Fe(Ⅲ)oxides含量分别为清淤区、开阔水域的68.1 %、52.7 % (图 4).

|
图 4 不同区域沉积物中FeASC、Fecry和Fe(Ⅲ)oxides含量的垂直分布特征分布 Fig.4 Vertical distribution of FeASC, Fecry and Fe(Ⅲ)oxides contents in three types of sediments |
| 表 1 不同区域沉积物中AVS与Pyrite-S的摩尔比 Tab. 1 Molar ratio of AVS and Pyrite-S in three types of sediments |
参照Thomsen等[31]的袋式培养实验测定硫、铁还原速率.结果表明,硫还原速率表现为聚藻区>清淤区=开阔水域,铁还原速率表现为聚藻区>清淤区>开阔水域(表 2).
| 表 2 不同区域沉积物硫、铁还原速率(μmol/(g·d)) Tab. 2 Sulfate-reducing and iron-reducing rates in three types of sediments |
微生物量碳常被用来指征微生物的潜在能量供给[34].所有点位的微生物量碳含量均随沉积物深度增加而降低.不同区域的微生物碳含量差异较大,呈聚藻区>开阔水域>清淤区的规律.聚藻区表层沉积物的微生物量碳含量比清淤区、开阔水域分别高69.6 %、52.0 % (表 3).
| 表 3 不同区域沉积物中微生物量碳含量(mg/kg) Tab. 3 Content of microbial biomass carbon in three types of sediments |
在各点位共计发现SRB属17个,聚藻区、清淤区、开阔水域沉积物的SRB相对丰度分别为2.65 %、0.29 %和1.43 %.聚藻区、清淤区占主导地位的SRB为Desulfobulbus,开阔水域为Desulfatiglans.各点位的FeRB均以Geobacter为主,其中聚藻区、清淤区、开阔水域沉积物的FeRB平均丰度分别为0.63 %、1.11 %和0.53 %.聚藻区、开阔水域表层沉积物的SRB占比分别高于FeRB 147.2 %、150.1 %,清淤区的SRB丰度则低于FeRB(图 5).

|
图 5 不同区域沉积物中的主要硫铁细菌(属) Fig.5 The major genera of sulfur and iron species in three types of sediments |
此外,以Sulfurisoma为主的硫氧化细菌(SOB)在聚藻区、开阔水域的相对丰度均超过3 %,分布规律为聚藻区>开阔水域>清淤区.铁氧化细菌(FeOB)的分布规律为开阔水域>聚藻区>清淤区,其中清淤区表层及深层沉积物中的FeOB均以Ferritrophicum为主(图 5).
3 讨论 3.1 不同区域沉积物中的硫还原硫还原通常是微生物过程[12],本次调查共发现SRB属17个,其中开阔水域的优势属为Desulfatiglans,聚藻区、清淤区的优势属为Desulfobulbus. SRB的出现表明春季太湖西岸典型区域沉积物中均发生硫还原过程.
开阔水域由于地处开阔水域,湖水交换频繁,难以形成一定厚度的蓝藻聚集层,表层沉积物微生物量碳含量较低(表 3),且风浪有效阻止了上覆水及表层沉积物厌氧环境的形成,虽然存在兼氧菌,但以厌氧菌为主体的SRB仍较难适应开阔水域的环境[35],相对丰度仅占1.14 %.此外,沉积物中dS2-浓度均小于20 μmol/L,AVS未见明显的积累,这都表明开阔水域硫还原过程较弱.清淤区的SRB相对丰度、dS2-浓度均为最低,说明硫还原较弱,显然清淤将表层高有机质含量的沉积物去除,抑制了硫还原的发生.
聚藻区沉积物的硫还原强于清淤区、开阔水域.厌氧/微氧条件下,硫元素的形态分布反映了硫还原的强弱[12],聚藻区表层沉积物具有最高的dS2-、AVS浓度,表明沉积物中发生着强烈的硫还原(图 1,图 3).硫还原通常是微生物过程,聚藻区沉积物中SRB的占比显著高于开阔水域、清淤区(图 5),表层沉积物的SRB相对丰度达到了2.64 %,部分属(Desulfobulbus、Desulforhabdus)的丰度甚至高于以往研究中室内培养的太湖沉积物[21],也证明了沉积物中发生着活跃的微生物硫还原.一方面,聚藻区表层沉积物含有大量蓝藻残体,微生物量碳含量较高(表 3),SRB的生长有充足的基质.另一方面,聚藻区因密集芦苇带形成了相对封闭的环境,蓝藻残体堆积诱发了持续的厌氧条件,也有利于硫还原的进行[36].
Pyrite-S通常是还原性无机硫的最终积累形态[37].本研究中,Pyrite-S主要在聚藻区的表层沉积物中积累. AVS与Pyrite-S的摩尔比常被用作代表沉积物黄铁矿化的速率,一般认为,AVS与Pyrite-S的比值小于0.3,便代表黄铁矿化能够有效进行[38].本研究中,除聚藻区表层沉积物外,所有沉积物中AVS与Pyrite-S的比值均小于0.3(表 1),说明黄铁矿化广泛存在于太湖西岸沉积物中.而聚藻区表层沉积物比值高于0.3,可能是因为较高的dS2-含量促进了AVS的生成,从而使比值升高.本次调查聚藻区、开阔水域的沉积物Pyrite-S平均含量分别为22.21±0.81、13.64±0.35 mmol/kg,约分别为尹洪斌等[24]2007年春季调查结果的2.0、1.3倍,说明太湖沉积物中的黄铁矿化持续存在.
此外,以Sulfurisoma和Sulfuricurvum属为优势属的ΣS2-氧化菌也在不同区域沉积物中被发现,其相对丰度均不低于SRB,且分布趋势与SRB一致,说明沉积物中硫元素的迁移转化并不仅是单向的硫还原,而是包含了ΣS2-氧化、S0歧化的复杂硫循环.
3.2 不同区域沉积物中的铁还原在厌氧环境中,dFe2+通常由Fe(Ⅲ)还原生成,对铁还原过程具有有效指示作用[2].从沉积物dFe2+含量与dFe2+/dFe3+的比值来看,不同区域铁还原速率由高到低分别为聚藻区、开阔水域和清淤区.聚藻区的dFe2+含量是开阔水域的4.47倍,且表层沉积物的dFe2+占dTFe的比例达62.4 % (图 2),反映出聚藻区沉积物中的铁还原较活跃,这是由于芦苇阻隔形成的相对封闭环境及蓝藻残体堆积导致的持续微/厌氧环境有利于铁还原的进行.清淤区、开阔水域则因为清淤、风浪作用等因素,难以形成稳定的厌氧环境,不利于铁还原的进行.所有调查点位中,沉积物中表层dFe2+含量均高于深层沉积物,说明表层铁还原最剧烈,还原速率最高达到0.61 μmol/(g ·d),这与新积底泥中Fe(Ⅲ)氧化物的可利用性较高有关(图 4).在各区域沉积物中均发现以Geobacter为优势属的FeRB,其分布趋势也是表层高于深层沉积物,表明铁还原过程有一部分为微生物作用.
清淤区、开阔水域沉积物中FeASC和Fe(Ⅲ)oxides均随深度增加而下降.这是因为沉积物深度与沉积时间具有正相关性,当沉积物形成后,铁还原持续消耗铁氧化物,因此随着沉积深度的增加,铁氧化物逐渐减少[3].表层沉积物的Fe(Ⅲ)oxides含量均高于深层沉积物,一方面是因为新沉降的悬浮物含有丰富的铁元素;另一方面,微生物铁还原生成的Fe2+会吸附在Fe(Ⅲ)氧化物及铁还原菌上,阻碍短期的高速率铁还原[39].聚藻区表层沉积物的Fe(Ⅲ)oxides含量均低于深层沉积物,仅为清淤区、开阔水域的52.7 % ~83.3 %,这与高速率的铁还原有关.聚藻区表层沉积物铁还原速率分别为清淤区、开阔水域的2.37、2.80倍,显然高速率的铁还原消耗了大量Fe(Ⅲ)oxides.此外,FeOB属Ferritrophicum也出现在各区域沉积物中,其中开阔水域沉积物中的相对丰度达到6.20 %,表明微生物铁氧化过程存在于沉积物中,与铁还原共同构成铁循环.
3.3 不同区域沉积物中的硫、铁关系及环境意义硫、铁循环在湖泊沉积物的地球化学循环中发挥着重要的作用[40].一般地,水生态系统中的硫还原主要是微生物过程,而铁还原则兼有微生物和化学代谢途径.微生物硫还原、微生物铁还原的反应过程分别为反应(3)、(4) (以乙酸盐为基质),而能参与化学铁还原的氧化物较多,其中ΣS2-可以诱导化学铁还原的发生,反应过程为反应(5)[12].
| ${\rm{C}}{{\rm{H}}_3}{\rm{CO}}{{\rm{O}}^ - } + {\rm{SO}}_4^{2 - } \to 2{\rm{HCO}}_3^ - + {\rm{H}}{{\rm{S}}^ - } $ | (3) |
| ${\rm{C}}{{\rm{H}}_3}{\rm{CO}}{{\rm{O}}^ - } + 8{\rm{F}}{{\rm{e}}^{3 + }} + 4{{\rm{H}}_2}{\rm{O}} \to 2{\rm{HCO}}_3^ - + 8{\rm{F}}{{\rm{e}}^{2 + }} + 9{{\rm{H}}^ + } $ | (4) |
| $2{\rm{Fe}}{({\rm{OH}})_3} + {\rm{H}}{{\rm{S}}^ - } + 5{{\rm{H}}^ + } \to {{\rm{S}}^0} + 2{\rm{F}}{{\rm{e}}^{2 + }} + 6{{\rm{H}}_2}{\rm{O}} $ | (5) |
开阔水域距离湖岸3.5 km,代表了太湖的主要环境类型.调查发现,硫铁还原均存在于沉积物中.但dFe2+平均浓度为dS2-的5.24倍,说明铁还原比硫还原活跃.清淤区的情况与开阔水域相似,根据Thomsen[31]等的测定方法,开阔水域、清淤区沉积物中的铁还原速率分别是硫还原速率的6.83、9.69倍,这与已有研究报道中太湖北部沉积物以铁还原为主的结论一致[41].但尹洪斌等[24]2007年调查的太湖沉积物间隙水中dFe2+浓度为dS2-的82倍,远高于本次调查值.这一差异反映出硫循环可能在这段时期内变得更加活跃.
聚藻区的硫还原速率远高于开阔水域、清淤区,但考虑到dFe2+平均浓度为dS2-的4.76倍,铁还原仍应比硫还原活跃.通过监测dFe2+和dS2-的浓度变化发现,聚藻区表层沉积物铁还原速率是硫还原的7.44倍[31].但已有研究表明,dS2-与dFe2+或Fe(Ⅲ)oxides反应生成硫铁化合物,会导致部分dS2-无法被测定,dS2-的优先沉淀甚至会导致其在间隙水与上覆水中消失,形成“cryptic sulfur cycling”[10, 42].考虑到本研究中硫铁化合物在沉积物中出现明显积累,通过测定dS2-变化计算的硫酸盐还原速率是低于真实情况的,这也意味着仅监测间隙水和上覆水中dS2-的变化可能会导致硫还原过程被严重低估.事实上,本次调查区域属于湖泛易发区.已有研究表明,高速硫还原是湖泛(黑水团)中致黑致嗅物质的主要诱因[43],这也佐证了硫还原在聚藻区的重要地位.
在聚藻区,强烈的硫还原对铁还原产生了影响. dFe2+作为表层沉积物(0~20 cm)间隙水中的主要赋存形态,约占dTFe的62.4 %,表明聚藻区表层沉积物中的dFe3+经历着强烈的铁还原.但是各层沉积物中以Gaobacter属为主导的FeRB相对丰度仅占0.63 %.此外,虽然聚藻区FeRB的分布与清淤区、湖心区相似,但dFe2+的释放、Fe(Ⅲ)oxides的消耗却显著高于其他区域(P<0.05),说明微生物铁还原并非主要的铁还原途径.而由于dS2-的分布与dFe2+的分布一致,且硫铁化合物的积累与Fe(Ⅲ)oxides的减少相吻合,沉积物中发生的化学铁还原主要是反应(5),即ΣS2-诱导的化学铁还原主导了沉积物中的铁还原过程.
通常在湖泊沉积物中,微生物过程是铁还原的重要组成部分[2].聚藻区沉积物中高dFe2+释放量与低FeRB丰度的差异反映出微生物铁还原被抑制.而取代而之的化学铁还原的主要反应物为ΣS2-,来源于SRB主导的微生物硫还原,因此实际是SRB参与抑制了微生物铁还原,并诱发了化学铁还原.聚藻区表层沉积物中SRB的丰度比FeRB高12.46倍,也证明了微生物硫还原(反应(3))比微生物铁还原(反应(4))活跃.这一现象与以往研究不同.微生物学的核心理论表明,微生物利用终端电子应遵循一个可预测的顺序[10].根据这一经典理论,即使在高浓度硫酸盐的环境中,铁还原菌也能比硫酸盐还原菌优先利用基质[44].考虑到太湖沉积物中丰富Fe(Ⅲ)oxides与微生物量碳等有利于FeRB生长的条件,微生物铁还原应在聚藻区的厌氧环境中更活跃[45].但本研究出现微生物硫还原比微生物铁还原活跃的现象,一方面因为聚藻区的表层沉积物多为蓝藻残体.有研究表明,随蓝藻的聚集沉降,FeRB的密度会降低,微生物铁还原的能力受到抑制,这可能与FeRB不能完全利用残体的分解产物有关[43].而SRB能够广泛利用各种基质[46],其在蓝藻腐解过程中的显著增殖已有报道[21].另一方面,硫还原产生的ΣS2-会对FeRB产生毒害作用,抑制微生物铁还原的发生[11].相似的硫铁竞争已有多位学者报道. Lohmayer等[47]发现在低硫酸盐浓度下,持续的硫还原过程能抑制微生物铁还原的进行.甚至在富含水铁矿的沉积物中,硫还原仍能主导沉积物中的厌氧呼吸[10].在荷兰的一个淡水湖泊也发现了强烈的硫还原与化学铁还原[48].这些研究中都发生着相似的过程:强烈的微生物硫还原抑制了微生物铁还原,并诱发了化学铁还原.
上述过程已被证明有巨大的负面作用.硫还原产生的ΣS2-和不稳定的AVS均存在对水生生物的潜在毒害风险[49].此外在ΣS2-诱导的化学铁还原的驱动下,铁氧化物会逐步转化为厌氧环境中永久埋藏的黄铁矿,导致沉积物参与铁循环的活性铁不断被削减.由于硫铁化合物在中性条件下几乎无法吸附磷元素,磷释放也将更加剧烈[50].而磷释放导致的富营养化会引发规模更大的藻华,使环境更利于SRB的生长,从而形成恶性循环,极端情况是海洋中的“dead zones”.这些由硫还原和化学铁还原主导的富营养化海域,因其持续的厌氧条件使水生动物难以存活而引起广泛关注[16].如今这一现象虽然仅在太湖西岸的局部区域出现,但也应引起重视.
4 结论1) 太湖西岸三种典型区域沉积物的硫铁还原均集中在0~15 cm的表层沉积物中.各区域沉积物中dFe2+平均浓度为dS2-的4.8~7.0倍,铁还原速率是硫还原速率的5.6~12.4倍,硫铁分布的巨大差异说明太湖西岸沉积物中是以铁还原为主.
2) 各典型区域沉积物中的硫还原由强到弱表现为:聚藻区>清淤区=开阔水域,铁还原表现为:聚藻区>清淤区>开阔水域.丰富的微生物量碳、较小的风浪扰动与持续微/厌氧环境显著提升了聚藻区的硫、铁还原速率.
3)聚藻区沉积物中dFe2+的释放与Fe(Ⅲ)oxides的消耗较高,而FeRB丰度却较低,反映出微生物铁还原并非主要的铁还原途径; 而AVS、Pyrite-S的聚积表明铁还原主要由ΣS2-诱导的化学铁还原主导.作为ΣS2-的主要生产者,SRB刺激了化学铁还原并导致微生物铁还原被抑制.
4)ΣS2-诱导的化学铁还原会诱发水体的持续厌氧与富营养化,是海洋中“dead zones”和淡水湖泊中湖泛的主要成因,因此虽然仅在太湖西岸局部区域发现,但也应引起重视.
| [1] |
Kappler A. Geomicrobiological cycling of iron. Reviews in Mineralogy&Geochemistry, 2005, 59(1): 85-108. |
| [2] |
Thamdrup B. Bacterial manganese and iron reduction in aquatic sediments. Advances in Microbial Ecology, 2000, 16(1): 41-84. |
| [3] |
Flynn TM, O'Loughlin EJ, Mishra B et al. Sulfur-mediated electron shuttling during bacterial iron reduction. Science, 2014, 344(6187): 1039-1042. DOI:10.1126/science.1252066 |
| [4] |
Ding SM, Wang Y, Wang D et al. In situ, high-resolution evidence for iron-coupled mobilization of phosphorus in sediments. Scientific Reports, 2016, 6: 24341. DOI:10.1038/srep24341 |
| [5] |
Huang QH, Wang ZJ, Wang CX et al. Phosphorus release in response to pH variation in the lake sedimentswith different ratios of iron-bound P to calcium-bound P. Chemical Speciation&Bioavailability, 2005, 17(2): 55-61. |
| [6] |
Paerl HW, Paul VJ. Climate change:links to global expansion of harmful cyanobacteria. Water Research, 2012, 46(5): 1349-1363. DOI:10.1016/j.watres.2011.08.002 |
| [7] |
Zak D, Rossoll T, Exner H et al. Mitigation of sulfate pollution by rewetting of fens-A conflict with restoring their phosphorus sink function?. Wetlands, 2009, 29(4): 1093-1103. DOI:10.1672/09-102D.1 |
| [8] |
Yu T, Zhang Y, Wu FC et al. Six-decade change in water chemistry of large freshwater Lake Taihu, China. Environmental Science&Technology, 2013, 47(16): 9093-9101. |
| [9] |
Luther GW, Church TM, Scudlark JR et al. Inorganic and organic sulfur cycling in salt-marsh pore waters. Science, 1986, 232(4751): 746-749. DOI:10.1126/science.232.4751.746 |
| [10] |
Hansel CM, Lentini CJ, Tang Y et al. Dominance of sulfur-fueled iron oxide reduction in low-sulfate freshwater sediments. Isme Journal, 2015, 9(11): 2400-2412. DOI:10.1038/ismej.2015.50 |
| [11] |
Koretsky CM, Moore CM, Lowe KL et al. Seasonal oscillation of microbial iron and sulfate reduction in saltmarsh sediments (Sapelo Island, GA, USA). Biogeochemistry, 2003, 64(2): 179-203. DOI:10.1023/A:1024940132078 |
| [12] |
Man JK, Boyanov MI, Antonopoulos DA et al. Effects of dissimilatory sulfate reduction on FeⅢ(hydr) oxide reduction and microbial community development. Geochimica et Cosmochimica Acta, 2014, 129(129): 177-190. |
| [13] |
Rozan TF, Taillefert M, Trouwborst RE et al. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay:Implications for sediment nutrient release and benthic macroalgal blooms. Limnology and Oceanography, 2002, 47(5): 1346-1354. DOI:10.4319/lo.2002.47.5.1346 |
| [14] |
Anderson DM, Burkholder JM, Cochlan WP et al. Harmful algal blooms and eutrophication:Examining linkages from selected coastal regions of the United States. Harmful Algae, 2009, 8(1): 39-53. |
| [15] |
Hyacinthe C, Van Cappellen P. An authigenic iron phosphate phase in estuarine sediments:composition, formation and chemical reactivity. Marine Chemistry, 2004, 91(1): 227-251. |
| [16] |
Diaz RJ, Rosenberg R. Spreading dead zones and consequences for marine ecosystems. Science, 2008, 321(5891): 926-929. DOI:10.1126/science.1156401 |
| [17] |
Chen C, Zhong JC, Yu JH et al. Optimum dredging time for inhibition and prevention of algae-induced black blooms in Lake Taihu, China. Environ Sci Pollut Res Int, 2016, 23(14): 14636-14645. DOI:10.1007/s11356-016-6627-z |
| [18] |
Duval B, Ludlam SD. The black water chemocline of meromictic lower Mystic Lake, Massachusetts, U.S.A. International Review of Hydrobiology, 2015, 86(2): 165-181. |
| [19] |
Zhang XJ, Chen C, Ding JQ et al. The 2007 water crisis in Wuxi, China:analysis of the origin. Journal of Hazardous Materials, 2010, 182(1): 130-135. |
| [20] |
Liu C, Shen QS, Zhou QL et al. Precontrol of algae-induced black blooms through sediment dredging at appropriate depth in a typical eutrophic shallow lake. Ecological Engineering, 2015, 77: 139-145. DOI:10.1016/j.ecoleng.2015.01.030 |
| [21] |
Chen M, Li XH, He YH et al. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake. Water Research, 2016, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| [22] |
Zhao YP, Zhang ZQ, Wang GX et al. High sulfide production induced by algae decomposition and its potential stimulation to phosphorus mobility in sediment. Science of the Total Environment, 2019, 650: 163-172. DOI:10.1016/j.scitotenv.2018.09.010 |
| [23] |
Shen QS, Zhou QL, Shang JG et al. Beyond hypoxia:occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake. Journal of Environmental Sciences-China, 2014, 26(2): 281-288. DOI:10.1016/S1001-0742(13)60452-0 |
| [24] |
Yin HB, Fan CX, Li B et al. Geochemical characteristics of iron and sulfur in sediments of northern Lake Taihu. Geocheimica, 2008, 37(6): 595-601. [尹洪斌, 范成新, 李宝等. 太湖北部沉积物中铁硫的地球化学特征研究. 地球化学, 2008, 37(6): 595-601. DOI:10.3321/j.issn:0379-1726.2008.06.010] |
| [25] |
Tabatabai MA. A rapid method for determination of sulfate in water samples. Environmental Letters, 1974, 7(3): 237-243. |
| [26] |
Cline JD. Spectrophotometric determination of hydrogen sulfide in natural waters. Limnology and Oceanography, 1969, 14(3): 454-458. DOI:10.4319/lo.1969.14.3.0454 |
| [27] |
Lovley DR, Phillips EJP. Novel mode of microbial energy-metabolism-organic-carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environmental Microbiology, 1988, 54(6): 1472-1480. |
| [28] |
Rozan TF, Taillefert M, Trouwborst RE et al. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay:Implications for sediment nutrient release and benthic macroalgal blooms. Limnology and Oceanography, 2002, 47(5): 1346-1354. DOI:10.4319/lo.2002.47.5.1346 |
| [29] |
Hsieh YP, Shieh YN. Analysis of reduced inorganic sulfur by diffusion methods:improved apparatus and evaluation for sulfur isotopic studies. Chemical Geology, 1997, 137(3): 255-261. |
| [30] |
Howard DE, Evans RD. Acid-volatile sulfide (AVS) in a seasonally anoxic mesotrophic lake:Seasonal and spatial changes in sediment AVS. Environmental Toxicology&Chemistry, 2010, 12(6): 1051-1057. |
| [31] |
Thomsen U, Thamdrup B, Stahl DA et al. Pathways of organic carbon oxidation in a deep lacustrine sediment, Lake Michigan. Limnology and Oceanography, 2004, 49(6): 2046-2057. DOI:10.4319/lo.2004.49.6.2046 |
| [32] |
Lin QM, Wu YG, Liu HL. Modification of fumigation extraction method for measuring soil microbial biomass carbon. Chinese Journal of Ecology, 1999(2): 63-66. [林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进. 生态学杂志, 1999(2): 63-66. DOI:10.3321/j.issn:1000-4890.1999.02.014] |
| [33] |
Gagnon C, Mucci A, Émilien P. Anomalous accumulation of acid-volatile sulphides (AVS) in a coastal marine sediment, Saguenay Fjord, Canada. Geochimica et Cosmochimica Acta, 1995, 59(13): 2663-2675. DOI:10.1016/0016-7037(95)00163-T |
| [34] |
Bradley RL, Fyles JW. A kinetic parameter describing soil available carbon and its relationship to rate increase in C mineralization. Soil Biology&Biochemistry, 1995, 27(2): 167-172. |
| [35] |
Dolla A, Fournier M, Dermoun Z. Oxygen defense in sulfate-reducing bacteria. Journal of Biotechnology, 2006, 126(1): 87-100. |
| [36] |
Wang JZ, Jiang X, Zheng BH et al. Effects of electron acceptors on soluble reactive phosphorus in the overlying water during algal decomposition. Environmental Science&Pollution Research International, 2015, 22(24): 19507-19517. |
| [37] |
Wilkin RT, Barnes HL. Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species. Geochimica et Cosmochimica Acta, 1996, 60(21): 4167-4179. DOI:10.1016/S0016-7037(97)81466-4 |
| [38] |
Gagnon C, Mucci A, Pelletier E. Anomalous accumulation of acid-volatile sulphides (AVS) in a coastal marine sediment, Saguenay Fjord, Canada. Geochimica et Cosmochimica Acta, 1995, 59(13): 2663-2675. DOI:10.1016/0016-7037(95)00163-T |
| [39] |
Roden EE, Urrutia MM. Influence of biogenic Fe (Ⅱ) on bacterial crystalline Fe (Ⅲ) oxide reduction. Geomicrobiology Journal, 2002, 19(2): 209-251. DOI:10.1080/01490450252864280 |
| [40] |
Lovley D. Dissimilatory Fe (Ⅲ)-and Mn (Ⅳ)-Reducing Prokaryotes. Prokaryotes, 2000(3): 635-658. |
| [41] |
Yin HB, Fan CX, Ding SM et al. Geochemistry of iron, sulfur and related heavy metals in metal-polluted Taihu Lake sediments. Pedosphere, 2008, 18(5): 564-573. DOI:10.1016/S1002-0160(08)60050-8 |
| [42] |
Friedrich MW, Finster KW. How sulfur beats iron. Science, 2014, 344(6187): 974-975. DOI:10.1126/science.1255442 |
| [43] |
Feng ZY, Fan CX, Huang WY et al. Microorganisms and typical organic matter responsible for lacustrine"black bloom". Science of the Total Environment, 2014, 470/471: 1-8. DOI:10.1016/j.scitotenv.2013.09.022 |
| [44] |
Nakagawa M, Ueno Y, Hattori S et al. Seasonal change in microbial sulfur cycling in monomictic Lake Fukami-ike, Japan. Limnology and Oceanography, 2012, 57(4): 974-988. DOI:10.4319/lo.2012.57.4.0974 |
| [45] |
Sun M, Xiao T, Ning Z et al. Microbial community analysis in rice paddy soils irrigated by acid mine drainage contaminated water. Applied Microbiology&Biotechnology, 2015, 99(6): 2911-2922. |
| [46] |
Rabus R, Hansen TA, Widdel F eds.Dissimilatory sulfate-and sulfur-reducing prokaryotes.New York: Springer, 2006: 659-768.
|
| [47] |
Lohmayer R, Kappler A, Lösekannbehrens T et al. Sulfur species as redox partners and electron shuttles for ferrihydrite reduction by sulfurospirillum deleyianum. Applied&Environmental Microbiology, 2014, 80(10): 3141-3149. |
| [48] |
Moosmann L, Gachter R, Muller B et al. Is phosphorus retention in autochthonous lake sediments controlled by oxygen or phosphorus. Limnology and Oceanography, 2006, 51(1): 763-771. |
| [49] |
Berry WJ, Hansen DJ, Boothman WS et al. Predicting the toxicity of metal-spiked laboratory sediments using acid-volatile sulfide and interstitial water normalizations. Environmental Toxicology&Chemistry, 2010, 5(12): 2067-2079. |
| [50] |
Bebie J, Schoonen MAA, Fuhrmann M et al. Surface charge development on transition metal sulfides:An electrokinetic study. Geochimica et Cosmochimica Acta, 1998, 62(4): 633-642. DOI:10.1016/S0016-7037(98)00058-1 |
 2019, Vol. 31
2019, Vol. 31 

