(2: 湖南省农业科学院, 湖南省农业环境生态研究所, 长沙 410125)
(2: Hunan Academy of Agricultural Sciences, Hunan Institute of Agricultural Environment and Ecology, Changsha 410125, P.R.China)
近年来,随着经济的快速发展,湖泊水体富营养化日趋严重,蓝藻水华频发[1].蓝藻水华不仅造成水质下降,而且会向水体中释放各种类型藻毒素,危害水生态系统安全[2-3].微囊藻毒素(Microcystins,MCs)是蓝藻水华污染中出现频率最高和造成危害最严重的蓝藻毒素,淡水蓝藻中的微囊藻(Microcystis)、鱼腥藻(Dolichospermum)和束丝藻(Aphanizomenon)是合成MCs的主要种属[4]. MCs是细胞内合成毒素,待细胞裂解后即释放入水体中表现毒性[5-6].它能够强烈抑制蛋白磷酸酶的活性,还是强烈的肝脏肿瘤促进剂,不仅对水生生物产生毒害作用,还可能通过饮用水和食物链的生物富集危害人类健康[7].最早因MCs污染引起人类死亡的报道,发生于1996年的巴西,由于医院使用被MCs污染的血液透析水,最终导致88人发生肝功能衰竭症状而死亡[8]. MCs是一类环状七肽化合物,其环肽结构中含有X和Y两个可变的氨基酸基团,X和Y不同的氨基酸组合可以形成不同的MCs异构体[9].现已发现100多种同分异构体,最常见的是MC-LR、MC-RR和MC-YR(L、R和Y分别代表亮氨酸、精氨酸和酪氨酸)[10-12],其中MC-LR的急性和生理毒性明显大于MC-RR和MC-YR,有较强的致毒性[13].正是由于各异构体生理毒性的不同,它们组成比例的变化将直接影响水体中毒素污染水平,进而影响饮用水安全.
野外条件下,气象、水文、营养盐等环境条件都有可能对有害蓝藻及其产毒能力产生较大影响. Harke等[14]发现湖体氮浓度和形态会直接影响铜绿微囊藻的毒素产量;Mowe等[15]发现水温能够提高蓝藻的产毒能力;Yu等[16]在巢湖蓝藻水华期间调查发现水温、总磷(TP)和可溶性无机碳是影响MCs浓度变化的关键因子. Shi等[17]通过对太湖11年来MCs空间分布的估算及分析,发现光照、水温等环境条件与MCs浓度有密切关系,甚至风速也能通过对蓝藻水华的空间堆积而影响MCs的空间分布.虽然影响蓝藻生长及产毒能力的环境因子众多,但不同条件不同藻的产毒能力不同,产生的毒素异构体种类及组成也不一定相同[18].研究表明水温高于25℃有利于MC-RR的合成,低于25℃则有利于MC-LR的合成[19].光强的增加会使藻类偏向合成毒性较强的MC-LR异构体[20].氮限制条件下增加氮浓度会更有助于MC-RR异构体的产生[21],而磷限制条件下则有利于MC-LR的合成[22].此外,蔡金傍等[23]对华北水库胞外MCs异构体年变化的研究显示,MC-LR和MC-RR两种异构体的组成比例与氮磷比呈正相关.
巢湖(30°25′~31°43′N,117°16′~117°51′E)位于安徽省中部,是我国第五大淡水湖,平均水深3 m,水域面积约770 km2,是长江中下游重要的淡水资源和生态湿地,同时兼有渔业养殖、航运和旅游功能.富营养化的加剧导致蓝藻水华发生的频率逐年增多,MCs污染也日趋严重. Yu等[16]研究表明,2012年巢湖的总MCs浓度最大值达到17.61 μg/L,而且藻毒素分布广泛,时空差异明显.不同营养湖区的水产品如鱼、虾、贝类的各个组织都有不同程度的藻毒素分布和积累[24],甚至当地渔民也被发现体内的血清浓度超标和肝细胞损伤[25].可见,开展巢湖MCs实时监测及对水环境健康危害的研究已刻不容缓.由于MCs各异构体生理毒性存在差异,它们在不同环境条件下的相互转化直接反映了水体受MCs污染的程度和毒性水平.因此,了解关键环境因子对巢湖MCs异构体时空动态变化的影响对于水环境管理和降低水体MCs危害有重要意义.
因此,本研究以巢湖为研究对象,对水体中MCs的异构体进行春、夏、秋、冬四季的调查分析,研究胞内微囊藻毒素(intracellular microcystins,IMCs)和胞外微囊藻毒素(extracellular microcystins,EMCs)异构体浓度和组成比例的时空分布特征及其关键影响因子,以探究MCs不同异构体的变化对湖泊水环境安全的影响,为饮用水源地MCs的生态风险评估提供理论依据.
1 材料和方法 1.1 采样点布设和采样方法本研究从东向西依次设置了9个采样点(图 1),其中采样点1~3位于东湖区(东),采样点4~6位于湖心区(中),采样点7~9位于西湖区(西).期间共进行了4次采样,时间为2012年夏季(8月)和秋季(11月),2013年冬季(2月)和春季(5月).采样过程中用GPS系统准确定位,采用2.5 m长的PVC管采集水柱的混合水样5 L,混合均匀,每个采样点采集3个平行样.现场每采样点各取500 ml水样,用1 %比例的鲁哥试剂固定液现场固定,用于浮游植物的鉴定.其余所有样品保存在无菌瓶冷藏带回实验室.采用多功能水质参数仪(Yellow Spring Instruments, YSI 6600, USA)原位测定水温(Water temperature)、溶解氧(DO)、pH和电导率(Conductivity)等指标,水体透明度(SD)用塞氏盘现场测定.
|
图 1 巢湖采样点分布 Fig.1 Distribution of sampling sites in Lake Chaohu |
样品带回实验室立即进行各指标测定的预处理.每采样点取100 ml水样用于水体营养盐的分析,水体总氮(TN,原水)和溶解性总氮(DTN,GF/F膜滤后水)浓度采用碱性过硫酸钾消解-紫外分光光度法测定;总磷(TP,原水)和溶解性总磷(DTP,GF/F膜滤后水)浓度采用碱性过硫酸钾消解-钼锑抗显色分光光度法测定;水样通过GF/F膜滤后用Skalar流动注射分析仪测定硝态氮(NO3--N)、亚硝态氮(NO2--N)、铵态氮(NH4+-N)和活性磷(PO43--P)浓度;溶解性有机碳(DOC)浓度采用500℃灼烧4 h的GF/F膜过滤100 ml水样,然后通过高温灼烧进行测定.另外,每采样点取100 ml水样过滤,采用热乙醇提取-分光光度法分析叶绿素a(Chl.a)浓度[26].
1.3 浮游植物鉴定现场固定的浮游植物样品在室内静置48 h后,吸取上清液,浓缩到30 ml,用于藻类的鉴定,鉴定参照胡鸿钧等[27]的方法.每个物种的细胞浓度乘以估计的该物种的细胞体积即为每个物种的生物体积(Biovolume,mm3/L)[28],通常假设浮游植物的密度近似为1 mg/mm3,生物体积可直接转化为生物量(mg/L).
1.4 微囊藻毒素浓度的测定根据不同季节微囊藻生物量大小,用GF/C滤膜过滤一定体积水样(500~1000 ml)用于MCs的测定.滤膜-80℃保存用于测定IMCs.滤液置于棕色玻璃瓶中,用于测定EMCs.
EMCs的测定:取C18固相萃取柱,先用10 ml甲醇和10 ml超纯水活化小柱,后与SPE固相萃取装置连接.将滤液通过固相萃取柱(流速为8~10 ml/min)进行富集,富集完毕,先后用10 ml超纯水和20 %的甲醇溶液淋洗固相萃取柱,再用10 ml甲醇(含0.1 %的三氟乙酸)作为洗脱液洗脱MCs,洗脱液收集在玻璃容器中. 40℃下氮吹浓缩至干,用1 ml甲醇溶解干物质,涡旋混合器充分混合1 min,再用小股氮气流吹干,加50 %的甲醇溶液(V/V)定容至150 μl,待测.
IMCs的测定:冻干滤膜剪碎至2 ml离心管中,加入0.5 mm硅珠,1 ml 5 %的乙酸溶液,FastPrep©-24样品快速制备仪破碎细胞.破碎样品加入10 ml 5 %的乙酸溶液,混匀,振荡30 min后,高速9500转/min离心10 min,分离上清液.残渣再加入20 ml 80 %的甲醇溶液按上述方法提取2次[29],合并上清液,GF/C滤膜过滤.滤液按照1 :5的比例用蒸馏水稀释,然后按照上述测定EMCs的方法通过固相萃取柱富集和氮吹浓缩,最终得到150 μl浓缩液,待测.
高效液相色谱(HPLC)法测定:MCs检测采用美国安捷伦公司Agilent HPLC1200高效液相色谱仪,该色谱仪配有DAD检测器.色谱柱为Ageilent Eclipse XDB-C18(5 μm,4.6×150 mm),检测波长238 nm,柱温25℃,进样量20 μl,流速1 ml/min.流动相A为含0.04 %三氟乙酸的超纯水;流动相B为乙腈,浓度梯度起始值为70 %流动相A+30 %流动相B,时间为10 min;60 %流动相A+40 %流动相B,时间为15 min.总MCs的浓度是MC-LR、MC-RR和MC-YR 3种异构体微囊藻毒素浓度的总和. MC-LR、MC-RR和MC-YR标准品购买于Sigma公司,溶于甲醇中,-20℃冷冻保存备用.
1.5 数据分析与统计本研究中除pH和水温,其他环境和生物因子、蓝藻(微囊藻和鱼腥藻)生物量数据都经过log10(x+1)转换.数据统计分析由SPSS16.0软件包完成.采用单因素方差分析环境因子、蓝藻生物量和MCs浓度的时空差异,并通过相关性分析巢湖MCs、蓝藻生物量与环境因子的关系.使用Origin8.5软件绘图.
2 结果 2.1 巢湖环境因子的变化监测期间,水温变化明显,夏季最高为30.75℃,冬季最低为3.31℃. Chl.a浓度呈现时空分布特征:季节上,最大值(88.54 μg/L)出现在夏季,最小值(4.30 μg/L)出现在冬季(图 2);空间上,表现为西湖区>湖心区>东湖区(P<0.05)(表 1). pH值变化范围为7.01~9.40,最大值出现在夏季,最小值出现在冬季(图 2);空间上,表现为西湖区>湖心区>东湖区(P<0.05)(表 1);而DO浓度与pH相反,其变化范围为4.47~13.58 mg/L,最高值出现在冬季,最低值出现在夏季(图 2);空间上,表现为东湖区>湖心区>西湖区(P<0.05)(表 1).
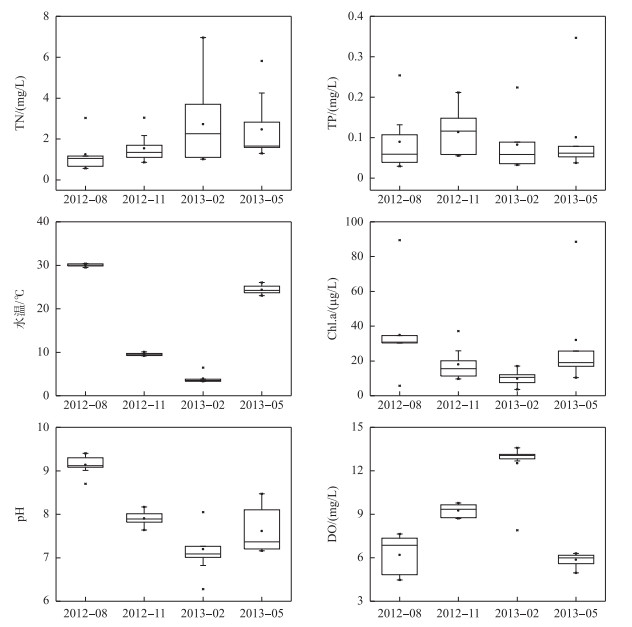
|
图 2 巢湖理化因子和生物因子的季节变化 Fig.2 Seasonal changes of physicochemical and biological variables in Lake Chaohu |
| 表 1 巢湖各理化和生物因子的空间变化 Tab. 1 Spatial change of physicochemical and biological variables in Lake Chaohu |
巢湖营养盐浓度呈明显的时空分布特征(图 2):季节上,TN浓度为0.56~6.96 mg/L,最大值出现在冬季,最小值出现在夏季;DTN、NH4+-N、NO3--N和NO2--N浓度都呈现相似的冬、春季节高于夏、秋季节的变化规律. TP浓度为0.03~0.35 mg/L, 最大值出现在春季,最小值出现在夏季;DTP浓度为0.01~0.11 mg/L,最大值出现在春季,最小值出现在秋季;PO43--P浓度为0.0001~0.0910 mg/L,最大值出现在夏季,最小值出现在冬季.空间上,营养盐浓度自东向西逐渐增加,即:西湖区>湖心区>东湖区(P<0.05). DOC和电导率也呈现出类似于营养盐的空间特征,而SD则表现出相反的特征(表 1).
2.2 蓝藻优势属的生物量变化根据4个季度9个采样点的平均生物量,鱼腥藻为第1优势属,占蓝藻总生物量的88.21 %,微囊藻为第2优势属,占11.20 %,束丝藻占0.39 %,其他属则占比较低(图 3).可见,鱼腥藻和微囊藻为巢湖蓝藻的主要优势属,且两优势属呈不同的时空变化:季节上,微囊藻生物量在夏季最高,为20.24 mg/L,冬季最低,为0.04 mg/L;鱼腥藻在秋季和春季生物量较高,平均生物量分别为73.23和89.22 mg/L,而冬季最低,为5.95 mg/L.空间上,微囊藻最高生物量集中在西湖区;而鱼腥藻夏季最高生物量出现在湖心区,秋季集中在东部湖区,冬、春季又多集中在西部湖区(图 4).
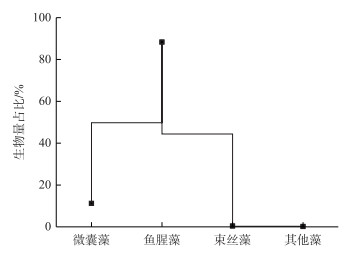
|
图 3 巢湖蓝藻主要属的平均生物量占比 Fig.3 Percentage of average biomass of the main genera of cyanobacteria community in Lake Chaohu |
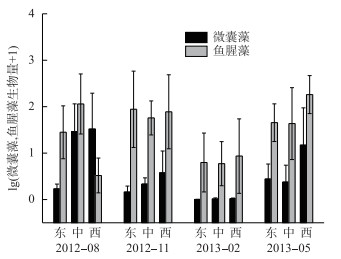
|
图 4 微囊藻和鱼腥藻的时空变化 Fig.4 Temporal and spatial variation of Microcystis and Dolichospermum |
研究期间,9个采样点藻毒素浓度检出率为100 %,且不同湖区的MCs存在明显的动态变化.总MCs浓度范围为0.28~17.61 μg/L,最高值出现在夏季的西湖区,最小值出现在冬季的东湖区(图 5).

|
图 5 巢湖不同湖区胞内和胞外微囊藻毒素浓度变化 Fig.5 Variation of IMCs and EMCs concentrations in different parts of Lake Chaohu |
构成总MCs的IMCs和EMCs表现出相同的季节变化:夏季IMCs平均浓度最高,为6.45 μg/L,秋季和冬季分别降至2.06和0.12 μg/L,而春季又升至4.45 μg/L.夏、秋、冬和春季4个季度EMCs平均浓度分别为1.92、1.27、0.69和0.87 μg/L.同时,IMCs和EMCs浓度存在明显的交替变化,夏、秋和春季的IMCs平均浓度均明显高于EMCs(P<0.05),而冬季IMCs平均浓度低于EMCs(P<0.05)(图 5).
空间上,IMCs和EMCs均呈现出西湖区>湖心区>东湖区(P<0.05)的分布特征,东湖区IMCs和EMCs浓度变化范围分别为0.10~2.75和0.17~1.13 μg/L;湖心区分别为0.91~13.24和0.31~3.15 μg/L;西湖区分别为0.14~15.91和1.02~3.19 μg/L. IMCs和EMCs的最大值15.91和3.19 μg/L分别出现在春季和夏季的西湖区,最低值0.10和0.17 μg/L均出现在冬季的东湖区(图 5).
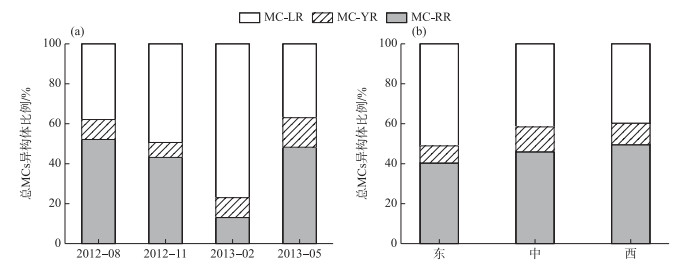
2.4 微囊藻毒素异构体的时空变化研究结果显示巢湖MCs主要含有MC-LR、MC-RR和MC-YR 3种异构体. 3种异构体的平均浓度分别为1.81、2.07和0.47 μg/L.其中,MC-RR所占比例最大(47.46 %),其次为MC-LR (41.66 %),MC-YR占比最小(10.88 %). MC-LR和MC-RR是巢湖水体中最主要的异构体(图 6).
|
图 6 巢湖总微囊藻毒素异构体组成的时间(a)和空间(b)变化 Fig.6 Temporal (a) and spatial (b) variation of total MCs variants composition in Lake Chaohu |
3种异构体组成比例呈现明显的时空差异.季节上,MC-LR所占比例为冬季(77.02 %)>秋季(49.36 %)>春季41.66 % >夏季(37.91 %)(P<0.05),MC-RR则相反,为夏季(52.11 %)>春季(48.27 %)>秋季(43.14 %)>冬季(13.03 %)(P<0.05),MC-YR为春季(14.74 %)>夏季(9.97 %)>冬季(9.94 %)>秋季(7.50 %)(P<0.05)(图 6a).空间上,MC-LR的分布规律为东湖区(51.05 %)>湖心区(41.58 %)>西湖区(39.83 %)(P<0.05),MC-RR为西湖区(49.54 %)>湖心区(46.01 %)>东湖区(40.40 %)(P<0.05),而MC-YR呈现出湖心区(12.40 %)>西湖区(10.62 %)>东湖区(8.55 %)(P<0.05)的分布特征(图 6b).
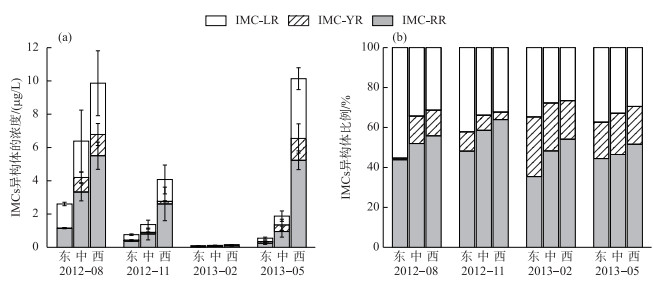
IMCs的3种异构体的浓度呈现时空变化.季节上,3种异构体均呈夏季最高,秋季降低,冬季最低,随后春季又升高的变化趋势.空间上, 均为西湖区>湖心区>东湖区(P<0.05).就各湖区均值而言,IMC-LR的最大值(3.59 μg/L)出现在春季的西湖区,最小值(0.03 μg/L)出现在冬季的东湖区. IMC-RR最大值(8.12 μg/L)出现在夏季的西湖区,最小值(0.25 μg/L)出现春季的东湖区. IMC-YR的最大值(1.31 μg/L)出现在春季的西湖区,最小值(0.02 μg/L)出现在夏季的东湖区(图 7a). 3种异构体所占比例变化也呈不同的时空特征:IMC-LR在8、11、2和5月的平均比例分别为40.27 %、36.06 %、29.62 %和33.19 %,呈现从夏季到秋、冬季降低,而春季升高的趋势. IMC-RR在8、11、2和5月的平均比例分别为50.55 %、56.89 %、45.93 %和48.83 %,呈现从夏季到秋季升高、秋季到冬季降低,春季又增高的趋势. IMC-YR在8、11、2和5月的平均比例分别为9.18 %、7.04 %、24.45 %和19.31 %,呈现出夏、秋季低,而冬、春季高的趋势.空间上,IMC-LR所占比例为东湖区>湖心区>西湖区(P < 0.05),IMC-RR所占比例为西湖区>湖心区>东湖区(P < 0.05),而IMC-YR所占比例在5和8月为湖心区>西湖区>东湖区(P < 0.05),11和2月为东湖区>湖心区>西湖区(P < 0.05)(图 7b).结果显示胞内异构体IMC-RR平均比例最高,为胞内优势毒素种类.
|
图 7 胞内微囊藻毒素异构体浓度(a)及其组成比例(b)的时空分布 Fig.7 Temporal and spatial variations in the concentrations of IMCs variants (a) and their composition (b) |
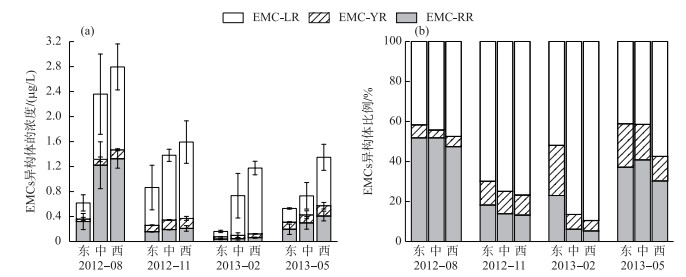
EMCs的3种异构体的时空变化不同于IMCs.季节上,3种异构体平均浓度的变化趋势不完全一致,EMC-LR平均浓度在夏季至秋季增加,秋季达到最高,而冬、春季降低,春季达到最低. EMC-RR平均浓度在夏季最高,秋、冬季降低,冬季降至最低,而春季又升高. EMC-YR平均浓度呈现从夏季至秋季增加,秋季最高,而冬季降至最低,春季又升高的趋势.空间上,3种异构体均为西湖区>湖心区>东湖区(P<0.05).就各湖区均值而言,EMC-LR和EMC-RR的最大值(1.33和1.32 μg/L)均出现在夏季的西湖区,最小值(0.08和0.04 μg/L)均出现在冬季的东湖区,而EMC-YR的最大值(0.17 μg/L)出现在春季的西湖区,最小值(0.04 μg/L)出现在夏季的东湖区(图 8a). 3种异构体的所占比例也表现出不同的时空分布特征:EMC-LR在8、11、2和5月的平均比例分别为44.44 %、73.83 %、75.94 %和46.65 %,呈现从夏季到冬季升高,春季又降低的趋势. EMC-RR在8、11、2和5月的平均比例分别为50.34 %、15.05 %、11.48 %和36.06 %,呈现从夏季到秋、冬季降低,春季又升高的趋势. EMC-YR在8、11、2和5月的平均比例分别为5.22 %、11.10 %、12.58 %和17.28 %,呈现从夏季到来年春季逐渐升高的趋势. EMCs异构体中EMC-LR所占比例较高,为最主要异构体,尤其在秋、冬季节.空间上,EMC-LR所占比例为西湖区>湖心区>东湖区(P < 0.05),EMC-RR所占比例为东湖区>湖心区>西湖区(P < 0.05),EMC-YR所占比例为东湖区>湖心区>西湖区(P < 0.05)(图 8b).
|
图 8 胞外微囊藻毒素异构体浓度(a)及其组成比例(b)的时空分布 Fig.8 Temporal and spatial variations in the concentrations of EMCs variants (a) and their composition (b) |
相关分析结果(表 2)表明:IMCs的3种异构体浓度与微囊藻生物量、Chl.a浓度、水温、TP浓度均呈极显著正相关(P<0.01). IMCs的3种异构体中仅有IMC-RR与鱼腥藻生物量呈显著相关(P<0.05),但明显低于其与微囊藻的相关性.而EMCs的3种异构体浓度与环境因子的相关关系却不一致:EMC-LR浓度与微囊藻生物量、Chl.a、TN、TP、PO43--P和DOC浓度呈极显著正相关(P<0.01);EMC-RR浓度与微囊藻生物量、Chl.a浓度、水温、TP浓度呈显著正相关(P<0.01);EMC-YR浓度与TN、TP、各形态N、各形态P、DOC浓度呈显著正相关(P<0.05). IMCs和EMCs 3种异构体所占比例与环境因子的相关关系也各不同:IMC-LR %与水温呈极显著正相关(P<0.01),而与TN、TP、各形态N、各形态P浓度呈显著负相关(P<0.01);IMC-RR %与微囊藻生物量、Chl.a、TN、TP、PO43--P和DOC浓度呈显著正相关(P<0.05);IMC-YR %仅与DOC浓度呈显著负相关(P<0.05). EMC-LR %与微囊藻生物量、Chl.a浓度和水温呈显著负相关(P<0.05),而与TN、DTN、NH4+-N、NO2--N、TP、PO43--P浓度呈显著正相关(P<0.05);EMC-RR %与微囊藻生物量、Chl.a浓度和水温呈极显著正相关(P<0.01),而与TN、各形态N、TP浓度呈显著负相关(P<0.05);EMC-YR %仅与TP浓度呈显著负相关(P<0.05).
| 表 2 巢湖藻毒素异构体浓度及其组成比例与生物和环境因子的关系 Tab. 2 Pearson correlations between the concentrations and composition of MCs variants, biological and environmental factors |
本研究结果显示,微囊藻和鱼腥藻是巢湖水华蓝藻优势属,且呈不同的时空演替模式.夏季微囊藻为优势属,秋、冬和春季鱼腥藻为优势属;微囊藻主要分布在西湖区,而鱼腥藻在不同季节、不同湖区都有分布.这与Zhang等[30]对巢湖的研究结果相一致.微囊藻和鱼腥藻是蓝藻中产生MCs的主要属[4],虽然研究发现巢湖鱼腥藻的平均生物量明显高于微囊藻(图 4),但其与MCs浓度的相关性较低,且只与IMC-RR异构体浓度相关(r = 0.371, P < 0.05),而微囊藻生物量却与MCs浓度呈极显著相关(r = 0.847,P < 0.01).尤其在蓝藻水华期间,微囊藻生物量最高,而此时的MCs浓度也是全年最高的(图 4、5).可见,巢湖微囊藻是MCs的主要贡献者[31],但不排除生物量占优势的鱼腥藻对MCs的影响.
3.2 IMCs和EMCs异构体浓度变化的影响因子蓝藻水华期间IMCs浓度明显高于EMCs浓度,而冬季则呈现EMCs浓度高于IMCs浓度的反向变化关系(图 5).这与蔡金傍等[23]对水库MCs的研究结果相一致,原因主要与产毒蓝藻生物量和MCs的合成与释放有关. MCs为细胞内合成毒素,春、夏季蓝藻水华期间微囊藻处于对数生长期,生物量逐渐增加,胞内合成MCs增多;待微囊藻生物量趋于峰值时,MCs浓度也达到最大值,而此时微囊藻细胞以合成IMCs为主,释放入水体的EMCs较少,故而IMCs浓度高于EMCs浓度;而进入秋、冬季节,微囊藻生物量显著降低,加之藻细胞逐渐衰亡裂解,毒素大量释放到水体中,当释放量大于水体MCs吸附量和降解量时,即呈现水体中EMCs浓度高于IMCs浓度的现象.
本研究显示巢湖IMCs和EMCs的常见异构体为MC-LR、MC-RR和MC-YR,但整个研究期间MC-YR浓度较低,而MC-RR和MC-LR所占比例较大,为主要的异构体.李印霞[32]的研究也得到过相同结论,而杨华等[31]对巢湖的调查却表明MCs以MC-LR为主,MC-RR仅在6 -9月出现.这可能与不同时间不同采样点调查导致的差异有关.整个研究期间,IMCs和EMCs的3种异构体呈不同的时空分布特征(图 7、8).前人研究表明水温、光和营养盐等会影响MCs的合成[33-35],但由于地理距离和湖泊环境条件的不同,结论各不一致.而本研究相关分析则表明微囊藻生物量、Chl.a浓度、水温和TP浓度是影响MCs浓度变化的关键因子.
水温是影响蓝藻生长和MCs合成的重要驱动因子[36-37],微囊藻最适宜生长水温为25℃以上[38].水温的升高不仅促进微囊藻的生长,而且有助于MCs的增加[37].本研究夏季(8月)平均水温为30℃,适宜产毒微囊藻生长,微囊藻生物量和Chl.a浓度增加,胞内合成的各异构体浓度也升高.进入秋季水温降低,不再适合微囊藻生长,其生物量和Chl.a浓度随之下降,各异构体浓度也逐渐下降,至冬季(2月)最低水温为3.86℃,生物量最低,3种异构体浓度也达到最低值,但至春季5月水温回升,3种异构体的浓度又升高.可见,水温可能是通过影响微囊藻生物量进而影响MCs浓度的变化.微囊藻生物量与IMCs的3种异构体浓度的极显著正相关也说明了此关系(表 2).同样是蓝藻水华暴发严重的太湖,调查也显示水温与微囊藻生物量和MCs浓度呈显著正相关[39].这些结果预示未来气候变暖将会增加产毒微囊藻水华的强度和MCs浓度[38].然而与IMCs不同,EMCs异构体中仅EMC-RR浓度与水温呈极显著相关,而EMC-LR和EMC-YR浓度与水温没有显著相关性(表 2).究其原因,可能是由于EMC-RR浓度与水温季节变化存在一致性,而EMC-LR和EMC-YR浓度变化则不同(图 8).另外,自然条件下EMCs的释放过程同时伴随着降解或转化过程,较为复杂[40-41],各种异构体对不同环境因子的响应也有所不同,因而IMCs比EMCs的变化更具有规律性.
磷通常是湖泊中的限定因子,磷浓度的较小变化就能影响蓝藻生长和MCs的合成[42-43],Rinta-Kanto等[44]对Erie湖的MCs和环境因子监测发现,磷浓度和MCs浓度呈极显著正相关. Kotak等[45]对加拿大的富营养化湖泊调查显示磷浓度的升高能促进产毒蓝藻水华发生和MCs浓度的升高.而本研究结果也显示IMCs和EMCs的各异构体浓度均与TP浓度呈极显著正相关,表明TP是影响IMCs和EMCs各异构体变化的关键驱动因子,而这个驱动的机制主要表现在对MCs空间差异的影响.由于巢湖西部水域承接了来自南淝河、十五里河、派河和塘西河等河流大量的生活污水、工业废水以及农业面源污染,同时该区域环境背景磷浓度受磷矿影响明显偏高,所以西湖区较高的磷浓度提供了产毒蓝藻水华发生的重要物质基础,致使产毒微囊藻水华呈现西湖区明显高于湖心和东湖区的趋势.相应地,IMCs和EMCs各异构体浓度的空间分布也呈现相同的变化特征.虽然TP浓度的影响较为显著,但MCs是一种富含氮的氨基酸组成的七肽化合物,提高氮浓度会促进产毒微囊藻的生长和MCs的合成与释放[46].本研究的相关分析也表明EMC-LR和EMC-YR浓度与TN浓度呈显著正相关,尤其是EMC-YR浓度与不同形态氮浓度均呈极显著正相关(表 2).另外,在本研究中DOC浓度与IMCs、EMCs的不同异构体浓度呈显著正相关,表明DOC也会影响MCs的合成和异构体的种类. Su等[47]对太湖的MCs研究也显示DOC是影响MCs不同异构体浓度变化的因子之一.
3.3 IMCs和EMCs异构体组成比例变化的影响因子巢湖总MCs异构体组成呈明显的时空演替模式,主要异构体MC-LR和MC-RR所占比例呈反向变化(图 6),这与IMCs和EMCs异构体的组成变化密切相关. IMCs异构体平均比例为IMC-RR>IMC-LR>IMC-YR,而EMCs异构体平均比例为EMC-LR>EMC-RR>EMC-YR,且3种异构体呈现不同的时空差异.相关分析表明水温和氮、磷营养盐浓度是影响3种异构体所占比例时空分布的关键因子,但又有所不同(表 2).
水温是影响不同MCs异构体组成的重要因子,水温低于25℃时主要合成MC-LR,高于25℃时主要产生MC-RR[19].本研究中夏季(8月)水温高于25℃,有利于合成MC-RR,此时IMC-RR平均比例明显高于IMC-LR和IMC-YR(图 7).进入秋、冬季水温低于25℃,有利于合成IMC-LR,但此时IMC-LR并未占优势,仍是IMC-RR占有较高比例.这可能与秋、冬季节藻细胞衰亡裂解并向水体释放MCs,而IMC-RR由胞内向胞外释放有较长的滞后期有关[48].至春季5月,水温上升至25℃,胞内又偏向合成IMC-RR,因而IMC-RR在整个研究期间一直维持较高比例. IMC-LR比例变化与水温呈极显著正相关(r = 0.594,P < 0.01),表明其与水温变化相一致,本研究结果也显示夏季的IMC-LR比例明显高于其他季节.而IMC-YR比例则与水温没有任何相关性(r = -0.301,P>0.05). EMCs异构体中EMC-RR和EMC-LR所占比例在季节上呈反向变化,因此水温与EMC-RR呈极显著正相关(r = 0.836,P < 0.01),与EMC-LR(r = -0.763,P < 0.01)呈极显著负相关,而EMC-YR所占比例与水温却没有显著相关性(r = -0.094,P>0.05)(表 2). EMCs异构体中EMC-LR平均比例较高,尤其以冬季(2月)最高.可能与MCs由胞内释放到胞外,MC-LR异构体释放的速度要明显高于MC-RR有关[49].然而,本研究中夏季(8月)EMC-RR却占有较高的比例,可能是因为正值水华蓝藻生长期,以胞内合成MCs为主,释放到水体中的毒素较少[50],此时水中EMCs浓度的贡献较少来源于细胞的衰亡和裂解,而主要是生长期偏向合成MC-RR有毒藻株的代谢[51].另一方面,此期间富营养化水体和高温强光照条件有利于可降解MCs的微生物等的繁殖,而其对MC-RR的降解速率较低[52].进入秋、冬季节,蓝藻水华消退,藻细胞大规模衰亡裂解,毒素大量释放到水体中,尤其是MC-LR异构体的优先释放和此期间MCs的光和生物降解速度显著下降[49,53],造成秋、冬季EMC-LR比例增加明显高于夏季,且高于其他两种异构体.随着春季5月水温升高,产毒微囊藻又重新恢复生长合成MCs,释放到水体中的EMC-LR较少,使春季EMC-LR比例明显低于秋、冬季.由此可见,巢湖在秋、冬季蓝藻消退衰亡阶段水体中EMCs的危害更大.
氮、磷营养盐对MCs异构体组成比例的影响表现在空间上.相关分析表明,氮、磷营养盐浓度与IMC-RR所占比例呈显著正相关,与IMC-LR所占比例呈显著负相关(表 2),表明巢湖西湖区IMC-RR比例较高,而东湖区IMC-LR比例较高.而IMC-YR所占比例的空间分布没有一定的规律性,与氮、磷营养盐浓度没有显著相关性.研究表明相对于MC-LR,高TP浓度更有利于MC-RR的合成[54-55]. Liu等[56]研究发现氮浓度的增加也有利于MC-RR的合成.而杨华[31]的研究指出高TP浓度有利于合成MC-RR,而低TP浓度有助于合成MC-LR.本研究中,巢湖西湖区氮、磷营养盐浓度明显高于湖心区和东湖区,更有利于MC-RR异构体的合成,故西湖区IMC-RR比例明显高于湖心区和东湖区(图 7),而东湖区低氮、磷浓度有助于合成MC-LR,其比例明显高于湖心区和西湖区.因此,巢湖的东湖区更易合成较高比例的IMC-LR异构体.而有趣的是,EMCs异构体比例空间变化与IMCs相反,氮、磷浓度与EMC-RR比例呈显著负相关,与EMC-LR比例呈显著正相关(表 2).可见,EMC-RR在东湖区比例较高,而西湖区则释放较多生理毒性较强的EMC-LR异构体.
可见,巢湖IMCs和EMCs主要异构体MC-LR和MC-RR存在着动态变化过程,其组成比例的变化反映了水体中MCs的污染程度. EMCs浓度变化直接关系到水环境健康和周边居民的饮用水安全,应加强日常监测,提高对其关注度,特别是本研究发现EMCs中毒性最强的EMC-LR占有最高比例,且其浓度已经超过世界卫生组织建议的饮用水浓度的基准值(1 μg/L),巢湖MCs的污染,尤其是秋、冬季节水体EMCs的浓度已经严重威胁到饮用水安全.因此,加强野外的监测力度实时掌握有害蓝藻和MCs污染状况,有助于提前预测并降低有害蓝藻发生的规模,保障水生态系统安全.
4 结论1) 微囊藻和鱼腥藻是巢湖水华蓝藻优势属,而微囊藻是MCs的主要贡献者.
2) 巢湖MCs常见异构体为MC-RR、MC-LR和MC-YR,其中MC-RR和MC-LR比例较高,为主要异构体. IMCs和EMCs异构体及其比例变化呈现不同的时空分布特征.季节上,IMCs的3种异构体浓度均表现为夏季>春季>秋季>冬季,而EMCs的3种异构体浓度的变化趋势各不同.空间上,IMCs和EMCs的3种异构体均表现为西湖区>湖心区>东湖区. IMCs异构体组成比例为IMC-RR>IMC-LR>IMC-YR,IMC-RR为占比最高的异构体,EMCs异构体组成比例为EMC-LR>EMC-RR>EMC-YR,EMC-LR为占比最高的异构体.季节上,IMC-RR所占比例为秋季>夏季>春季>冬季,而EMC-LR所占比例为冬季>秋季>春季>夏季.空间上,IMC-RR和EMC-LR所占比例均为西湖区>湖心区>东湖区.
3) 相关分析结果显示,微囊藻生物量、水温和TP浓度是影响巢湖IMCs和EMCs异构体浓度及组成比例的关键因子.
| [1] |
Paerl HW, Rd FR, Moisander PH et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria. The Scientific World Journal, 2001, 1(1): 76. |
| [2] |
Falconer IR. Tumor promotion and liver injury caused by oral consumption of cyanobacteria. Environmental Toxicology, 2010, 6(2): 177-184. |
| [3] |
Li XY. Toxicological research of microcystins. Beijing: Science Press, 2007: 112-116. [李效宇. 微囊藻毒素及其毒理学研究. 北京: 科学出版社, 2007: 112-116.]
|
| [4] |
Chorus I, Bartram J, Chorus I et al. Toxic cyanobacteria in water:a guide to their public health consequences, monitoring and management. Limnology & Oceanography, 2000, 45(5): 255-258. |
| [5] |
Dittmann E, Neilan BA, Erhard M et al. Insertional mutagenesis of a peptide synthetase gene that is responsible for hepatotoxin production in the cyanobacterium Microcystis aeruginosa PCC 7806. Molecular Microbiology, 2010, 26(4): 779-787. |
| [6] |
Stachelhaus T, Marahiel MA. Modular structure of genes encoding multifunctional peptide synthetases required for non-ribosomal peptide synthesis. FEMS Microbiology Letters, 1995, 125(1): 3. DOI:10.1111/fml.1995.125.issue-1 |
| [7] |
Carmichael WW. Cyanobacteria secondary metabolites-the cyanotoxins. Journal of Applied Bacteriology, 2010, 72(6): 445-459. |
| [8] |
Jochimsen EM, Carmichael WW, An JS et al. Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil. New England Journal of Medicine, 1998, 338(13): 873-878. DOI:10.1056/NEJM199803263381304 |
| [9] |
Song LR, Chen W. Production of microcystins in bloom-forming cyanobacteria and their environment fates:a review. J Lake Sci, 2009, 21(6): 749-757. [宋立荣, 陈伟. 水华蓝藻产毒的生物学机制及毒素的环境归趋研究进展. 湖泊科学, 2009, 21(6): 749-757. DOI:10.18307/2009.0601] |
| [10] |
Pearson LA, Mihali TK, Moffitt MC et al. On the chemistry, toxicology and genetics of the cyanobacterial toxins, microcystin, nodularin, saxitoxin and cylindrospermopsin. Marine Drugs, 2010, 8(5): 1650-1680. DOI:10.3390/md8051650 |
| [11] |
Messineo V, Mattei D, Melchiorre S et al. Microcystin diversity in a Planktothrix rubescens population from Lake Albano (Central Italy). Toxicon Official Journal of the International Society on Toxinology, 2006, 48(2): 160-174. DOI:10.1016/j.toxicon.2006.04.006 |
| [12] |
Neilan BA, Pearson LA, Moffitt MC et al. The genetics and genomics of cyanobacterial toxicity. Oxygen Transport to Tissue XXXⅢ, 2008, 619(5): 417-452. |
| [13] |
Vijayaraghavan R. Comparative toxicity evaluation of cyanobacterial cyclic peptide toxin microcystin variants (LR, RR, YR) in mice. Toxicology, 2003, 188(2): 285-296. |
| [14] |
Harke MJ, Gobler CJ. Daily transcriptome changes reveal the role of nitrogen in controlling microcystin synthesis and nutrient transport in the toxic cyanobacterium, Microcystis aeruginosa. BMC Genomics, 2015, 16(1): 1068. DOI:10.1186/s12864-015-2275-9 |
| [15] |
Mowe MA, Porojan C, Abbas F et al. Rising temperatures may increase growth rates and microcystin production in tropical Microcystis species. Harmful Algae, 2015, 50: 88-98. DOI:10.1016/j.hal.2015.10.011 |
| [16] |
Yu L, Kong FX, Zhang M et al. The dynamics of Microcystis genotypes and microcystin production and associations with environmental factors during blooms in Lake Chaohu, China. Toxins, 2014, 6(12): 3238-3257. DOI:10.3390/toxins6123238 |
| [17] |
Shi K, Zhang YL, Xu H et al. Long-term satellite observations of microcystin concentrations in Lake Taihu during cyanobacterial bloom periods. Environmental Science & Technology, 2015, 49(11): 6448-6456. |
| [18] |
Sivonen K, Evans WR, Carmichael WW et al. Hepatotoxic microcystin diversity in cyanobacterial blooms collected in portuguese freshwaters. Water Research, 1996, 30(10): 2377-2384. DOI:10.1016/0043-1354(96)00152-2 |
| [19] |
Rapala J, Sivonen K, Lyra C et al. Variation of microcystins, cyanobacterial hepatotoxins, in Anabaena spp. as a function of growth stimuli. Applied and Environment Microbiology, 1997, 63(6): 2206-2212. |
| [20] |
Tonk L, Visser PM, Christiansen G et al. The microcystin composition of the cyanobacterium Planktothrix agardhii changes towards a more toxic variant with increasing light intensity. Applied and Environment Microbiology, 2005, 71(9): 5177-5181. DOI:10.1128/AEM.71.9.5177-5181.2005 |
| [21] |
Van DB, Ferreruela G, Tonk L et al. Pulsed nitrogen supply induces dynamic changes in the amino acid composition and microcystin production of the harmful cyanobacterium Planktothrix agardhii. FEMS Microbiology Ecology, 2010, 74(2): 430-438. DOI:10.1111/fem.2010.74.issue-2 |
| [22] |
Oh HM, Lee SJ, Jang MH et al. Microcystin production by Microcystis aeruginosa in a phosphorus-limited chemostat. Applied and Environment Microbiology, 2000, 66(1): 176-179. DOI:10.1128/AEM.66.1.176-179.2000 |
| [23] |
Cai JB, Li WQ, Pang Y et al. Relationship between extra-cellular microcystin and intra-cellular microcystin. Journal of Hydraulic Engineering, 2009, 40(3): 328-334. [蔡金傍, 李文奇, 逢勇等. 水体中溶解性微囊藻毒素与藻类细胞内微囊藻毒素的关系研究. 水利学报, 2009, 40(3): 328-334. DOI:10.3321/j.issn:0559-9350.2009.03.011] |
| [24] |
Chen J, Xie P. Accumulation of hepatotoxic microcystins in freshwater mussels, aquatic insect larvae and oligochaetes in a large, shallow eutrophic lake (Lake Chaohu) of subtropical China. Fresenius Environmental Bulletin, 2008, 17(7A): 849-854. |
| [25] |
Chen J, Xie P, Li L et al. First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage. Toxicological Sciences, 2009, 108(1): 81-89. DOI:10.1093/toxsci/kfp009 |
| [26] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [27] |
Hu HJ, Wei XY. Freshwater algae in china:system, classification and ecology. Beijing: Science Press, 2006. [胡鸿钧, 魏印心. 中国淡水藻类:系统、生态及分类. 北京: 科学出版社, 2006.]
|
| [28] |
Hillebrand H, Dürselen CD, Kirschtel D et al. Biovolume calculation for pelagic and benthic microalgae. Journal of Phycology, 2010, 35(2): 403-424. |
| [29] |
Barco M, Lawton LA, Rivera J et al. Optimization of intracellular microcystin extraction for their subsequent analysis by high-performance liquid chromatography. Journal of Chromatography A, 2005, 1074(1): 23-30. |
| [30] |
Zhang M, Zhang YC, Yang Z et al. Spatial and seasonal shifts in bloom-forming cyanobacteria in Lake Chaohu:Patterns and driving factors. Phycological Research, 2016, 64(1): 44-55. DOI:10.1111/pre.2016.64.issue-1 |
| [31] |
Yang H. Ecological studies on microcystins in Lakes Chaohu and Taihu[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academic of Science, 2006. [杨华.巢湖和太湖微囊藻毒素的生态学研究[学位论文].武汉: 中国科学院水生生物研究所, 2006. ]
|
| [32] |
Li YX. Succession of Microcystis blooms in lake Chaohu and competition between different bloom-forming cyanobacterial strains[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academic of Science, 2013. [李印霞.巢湖微囊藻水华演替及不同水华蓝藻竞争的研究[学位论文].武汉: 中国科学院水生生物研究所, 2013. ]
|
| [33] |
Graham JL, Jones JR, Jones SB et al. Environmental factors influencing microcystin distribution and concentration in the midwestern United States. Water Research, 2004, 38(20): 4395-4404. DOI:10.1016/j.watres.2004.08.004 |
| [34] |
Davis TW, Berry DL, Boyer GL et al. The effects of temperature and nutrients on the growth and dynamics of toxic and non-toxic strains of microcystis during cyanobacteriablooms. Harmful Algae, 2009, 8(5): 715-725. DOI:10.1016/j.hal.2009.02.004 |
| [35] |
Ni WM, Zhang JY, Ding TD et al. Environmental factors regulating cyanobacteria dominance and microcystin production in a subtropical lake within the Taihu Watershed, China. Journal of Zhejiang University-Science A:Applied Physics & Engineering, 2012, 13(4): 311-322. |
| [36] |
Naoshi F, Yuhei I, Norio S et al. Effects of temperature change on algal growth. Environmental Technology, 1994, 15(5): 497-500. DOI:10.1080/09593339409385455 |
| [37] |
O'Neil JM, Davis TW, Burford MA et al. The rise of harmful cyanobacteria blooms:The potential roles of eutrophication and climate change. Harmful Algae, 2012, 14(1): 313-334. |
| [38] |
Paerl HW, Huisman J. Climate. Blooms like it hot. Science, 2008, 320(5872): 57-58. DOI:10.1126/science.1155398 |
| [39] |
Li DM, Yu Y, Yang Z et al. The dynamics of toxic and nontoxic Microcystis during bloom in the large shallow lake, Lake Taihu, China. Environmental Monitoring & Assessment, 2014, 186(5): 3053-3062. |
| [40] |
Song LR, Chen W. Production of microcystins in bloom-forming cyanobacteria and their environment fates:a review. J Lake Sci, 2009, 21(6): 749-757. [宋立荣, 陈伟. 水华蓝藻产毒的生物学机制及毒素的环境归趋研究进展. 湖泊科学, 2009, 21(6): 749-757. DOI:10.18307/2009.0601] |
| [41] |
Chen W, Song LR, Peng L et al. Reduction in microcystin concentrations in large and shallow lakes:water and sediment-interface contributions. Water Research, 2008, 42(3): 763-773. DOI:10.1016/j.watres.2007.08.007 |
| [42] |
Xie LQ, Xie P, Li SX et al. The low TN:TP ratio, a cause or a result of Microcystis blooms?. Water Research, 2003, 37(9): 2073-2080. DOI:10.1016/S0043-1354(02)00532-8 |
| [43] |
Vézie C, Rapala J, Vaitomaa J et al. Effect of nitrogen and phosphorus on growth of toxic and nontoxic Microcystis strains and on intracellular microcystin concentrations. Microbial Ecology, 2002, 43(4): 443-454. DOI:10.1007/s00248-001-0041-9 |
| [44] |
Rinta-Kanto JM, Konopko EA, Debruyn JM et al. Lake Erie Microcystis:Relationship between microcystin production, dynamics of genotypes and environmental parameters in a large lake. Harmful Algae, 2009, 8(5): 665-673. DOI:10.1016/j.hal.2008.12.004 |
| [45] |
Kotak BG, Lam AK, Prepas EE et al. Role of chemical and physical variables in regulating microcystin-LR concentration in phytoplankton of eutrophic lakes. Canadian Journal of Fisheries & Aquatic Sciences, 2000, 57(8): 1584-1593. |
| [46] |
Davis TW, Harke MJ, Marcoval MA et al. Effects of nitrogenous compounds and phosphorus on the growth of toxic and non-toxic strains of Microcystis during cyanobacterial blooms. Aquatic Microbial Ecology, 2010, 61(2): 149-162. |
| [47] |
Su X, Xue Q, Steinman AD et al. Spatiotemporal dynamics of microcystin variants and relationships with environmental parameters in Lake Taihu, China. Toxins, 2015, 7(8): 3224-3244. DOI:10.3390/toxins7083224 |
| [48] |
Zheng L, Xie P, Li YL et al. Variation of intracellular and extracellular microcystins in a shallow, hypereutrophic subtropical chinese lake with dense cyanobacterial blooms. Bulletin of Environmental Contamination and Toxicology, 2004, 73(4): 698-706. |
| [49] |
Zhang W, Lin YQ, Guo DF et al. Influence of different nitrogen and phosphorus concentrations on growth, photosynthesis and microcystin production of Microcystis aeruginosa. Acta Hydrobiological Sinica, 2006, 30(3): 318-322. [张玮, 林一群, 郭定芳等. 不同氮、磷浓度对铜绿微囊藻生长、光合及产毒的影响. 水生物学报, 2006, 30(3): 318-322.] |
| [50] |
Wang JX, Xie P, Guo NC. Effects of nonylphenol on the growth and microcystin production of Microcystis strains. Environmental Research, 2007, 103(1): 70-78. DOI:10.1016/j.envres.2006.05.013 |
| [51] |
Wang FF, Tong C, Yang F et al. Spatial and temporal distribution of microcystins in the Fuzhou Shanzai Reservoir. Acta Scientiae Circumstantiae, 2011, 31(3): 533-546. [王菲凤, 仝川, 杨芳等. 福州山仔水库水华微囊藻毒素时空分布特征. 环境科学学报, 2011, 31(3): 533-546.] |
| [52] |
Yang F, Zhou Y, Sun R et al. Biodegradation of microcystin-LR and-RR by a novel microcystin-degrading bacterium isolated from Lake Taihu. Biodegradation, 2014, 25(3): 447-457. DOI:10.1007/s10532-013-9673-y |
| [53] |
Zhang RF, Deng ZR, Wu CT et al. Characteristic of the temporal distribution of dissolved microcystins and its relationships with environmental factors in a typical freshwater shrimp aquaculture pond in South Taihu Area. Freshwater Fisheries, 2018, 48(5): 41-47. [张荣飞, 邓泽融, 吴陈涛等. 南太湖地区一典型青虾养殖池塘中微囊藻毒素浓度与环境因子间的相关性. 淡水渔业, 2018, 48(5): 41-47. DOI:10.3969/j.issn.1000-6907.2018.05.007] |
| [54] |
Yang H, Xie P, Xu J et al. Seasonal variation of microcystin concentration in Lake Chaohu, a shallow subtropical lake in the People's Republic of China. Bulletin of Environmental Contamination & Toxicology, 2006, 77(3): 367-374. |
| [55] |
Zhang M. The space-time distribution characteristics, causes and degradtion technology research of microcystin in Taoranting lake[Dissertation]. Dalian: Dalian Ocean University, 2014. [张默.陶然亭湖微囊藻毒素时间分布特征、成因及降解技术研究[学位论文].大连: 大连海洋大学, 2014. ]
|
| [56] |
Liu J, Van OE, Faassen EJ et al. Elevated pCO2 causes a shift towards more toxic microcystin variants in nitrogen limited Microcystis aeruginosa. FEMS Microbiology Ecology, 2015, 92(2). DOI:10.1093/femsec/fiv159 |
 2019, Vol. 31
2019, Vol. 31 

