(2: 中国科学院水生生物研究所, 武汉 430072)
(2: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
重金属污染是云南地区湖泊和水库面临的主要环境压力之一[1-2].由于重金属在自然环境中较难降解,并且具有普遍的生物毒性、生物累积性和生物放大作用,因此水体的重金属污染会对水资源安全与生态系统健康产生持续的危害.砷是一种毒性较高且致癌、致畸的类金属污染物,在水体中的停留时间长达50年[3].工业排放等人类活动将大量的砷释放到环境中,增大了砷在水体中的分布范围和浓度,同时威胁着水体水质和人类健康[4-5].阳宗海是云南九大高原湖泊之一,于2008年暴发了严重的砷污染事件,湖水中砷浓度在12月高达176.9 μg/L[6].经过多年的综合治理和生态修复,水体中的砷浓度呈现下降且相对平稳的趋势,但是仍然超过10 μg/L的生活饮用水卫生标准[5-7].因此,阳宗海水体中较高的砷浓度对湖泊生态系统健康和社会经济持续发展构成长期的潜在危害.
浮游植物是淡水生态系统的重要组分和湖泊食物网的关键环节,在物质循环和能量流动中起着重要的作用[8].浮游植物的种类组成和生物量在不同的水生生态系统中均存在着较大的差异[9],其群落结构和功能特征与水体光照、营养盐、水深等环境因子关系密切,环境条件的变化会影响浮游植物的结构组成、优势种及生物量等群落特征[10].已有研究表明,砷污染会造成浮游植物优势种发生转变并引起群落结构的变化[11-12],同时重金属污染物可经浮游植物等初级生产者通过食物链改变生态系统的结构和功能,从而导致湖泊生物多样性的降低和生态系统稳定性的下降[13].如对阳宗海硅藻群落沉积物记录的调查发现,随着砷污染的出现,部分藻类物种数量大量减少,而耐砷污染的硅藻迅速转变为优势种,同时浮游动物生物量出现10倍以上的下降,湖泊生态系统出现了灾难性的转变[14].因此,阳宗海重金属污染可能导致浮游植物群落结构发生改变进而对湖泊食物链结构和生态系统稳定性产生重要影响.
阳宗海浮游植物的现代调查始于1950s,已有结果反映了藻类优势种属和群落结构存在显著的季节变化和长期演替特征. 1957年的调查显示,阳宗海浮游植物主要包括菱形圆盘硅藻(Cyclotella rhomboideo-elliptica)(硅藻门)、蓝隐藻(Chroomonas sp.)(隐藻门)、飞燕角甲藻(Ceratium hirundinella)(甲藻门)、勃氏黄被藻(Botryococcus)(黄藻门)和伸臂角星鼓藻(Staurastrum paradoxom)(绿藻门)[15].在2005-2006年期间,浮游植物优势种全年以微囊藻属(Microcystis sp.)(蓝藻门)为主[16]. 2007和2008年的调查发现,藻类优势种出现了明显的季节波动,如在3月份以卵囊藻属(Oocystis sp.)(绿藻门)为主,而7月和11月分别以脆杆藻属(Fragilaria sp.)(硅藻门)、并联藻属(Quadrigula sp.)(绿藻门)和微囊藻属为主[17].随着砷污染的出现与持续,阳宗海浮游植物优势种均为蓝藻门,微囊藻、拟鱼腥藻(Anabaenopsis sp.)、尖头藻(Raphidiopsis sp.)和束丝藻(Aphanizomenon sp.)交替出现成为2009-2010年的优势种[18],而席藻(Phormidium sp.)则在2011年全年占优[17]. 2013年的调查发现,阳宗海浮游植物的优势种群为蓝藻门的拟鱼腥藻和泽丝藻(Limnothrix sp.)[19].总之,阳宗海在砷污染之前浮游植物呈现门类多样的特征且优势属种呈现明显的季节变化,而随着砷污染的出现与持续,浮游植物以蓝藻门占绝对优势,而其他门类的数量大量减少.目前对阳宗海砷污染的环境治理已有多年但水体污染问题仍然持续,急需系统识别阳宗海浮游植物群落的时空变化特征,并甄别水体砷污染持续的背景下驱动浮游植物群落构建的关键因子.
本研究以云南典型砷污染湖泊阳宗海为对象,于2015年4月2016年2月对浮游植物及主要环境因子进行系统调查,通过分析阳宗海浮游植物群落结构、生物量和优势种的时空变化并对其变化的驱动因子进行解析,评价砷在胁迫环境中的生态作用,以期为有效开展污染湖泊的环境治理和生态修复提供科学依据.
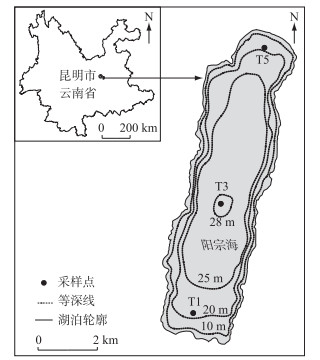
1 材料与方法 1.1 研究区域概况及采样点设置阳宗海(24°01′~24°58′ N,102°59′~103°02′ E)地跨宜良、澄江、呈贡三县,两端略宽,中间稍窄;平均水位1770.6 m时,南北平均长12 km,东西平均宽2.7 km,湖岸线长32.3 km,湖区面积31.7 km2,最大水深30 m,平均水深19.5 m,蓄水量6.04×108 m3,流域面积192 km2[20].阳宗海是典型的高原构造型亚热带石灰岩淡水深水湖泊,属珠江流域南盘江水系,该流域属北亚热带季风气候,受西南季风影响明显,多年平均气温14.5℃,平均降水量963.5 mm,6-10月降水量占年降水量的87 %.主要入湖河流有南部的阳宗河、七里河以及东西两侧的暂时性溪流,东北部的汤池河为该湖唯一的出水口[20-21].阳宗海周边分布着多个泉眼,地下水补给是该湖重要的补给方式[22]. 2006年之前,阳宗海水体砷浓度不足2 μg/L[23],2007年9月略有升高,但未超过6 μg/L的水平[24]. 2008年10-12月阳宗海湖水中平均砷浓度为167 μg/L[25],12月高达176.9 μg/L,2009年平均砷浓度为155.9 μg/L[6].同时对阳宗海沉积物的研究显示,沉积物中砷浓度背景值(如1950年以前)约为34.4 μg/g,在1990s初开始逐渐增加,并且在2007-2008年附近达到最高值479 μg/g,与1950年前的背景时期相比阳宗海沉积物的砷浓度升高了将近14倍,与湖泊监测记录反映的湖泊污染历史一致[14].随着湖泊治理的开展,湖水砷浓度呈现下降的趋势,2010年4月阳宗海平均砷浓度为82.7 μg/L[5],2013年水体的砷浓度为54.3 μg/L,是生活饮用水卫生标准的5倍以上[7].
根据阳宗海湖泊形态设置南、中、北3个采样点,分别为T1(24°52′11″ N,102°59′29″ E)、T3(24°54′24″ N,103°00′20″ E)和T5(24°57′31″ N,103°00′59″ E),如图 1所示.本次调查采样时间为2015年4月-2016年2月,每2月采集一次,共计6次采样.
|
图 1 阳宗海采样点分布 Fig.1 Distribution of sampling sites in Yangzong Lake |
浮游植物定性样品用孔径为20 μm的浮游生物网在水面下约0.5 m处采集,将采集的样品装入60 ml样品瓶中,加入鲁哥和甲醛摇匀,带回实验室用Leica光学显微镜在400倍下进行鉴定.将样品经酸处理后制成固定玻片在1000倍油镜下进行硅藻的鉴定.定量样品用5 L的有机玻璃采水器采集表层以下0.5 m处的水样,取1 L水样现场加入鲁哥和甲醛摇匀之后带回实验室静置48 h,用虹吸管吸取上清液,浓缩至30 ml,完全摇匀后,取0.1 ml藻液到浮游生物计数框中,在光学显微镜下计数,采用形态相似的几何体积的方法计算出浮游植物的体积,从而转换为生物量[26-27].
采用YSI 6600现场测定水温、pH、溶解氧和电导率,用塞氏盘测定水体透明度.总磷和总氮浓度的测定方法参照《水与废水监测分析方法》(第四版)进行[28].水体中的砷、镁、钠、钙、钾、铅、铁和锰的浓度根据国家环境保护标准(GB7475-1987、GB7477-1987、GB7485-1987、GB11904-1989、GB11911-1989、HJ/T342- 2007、HJ/T343-2007)进行测定.
1.3 数据分析阳宗海浮游植物优势度(Y)的计算公式为:
| $ Y = \left( {{n_i}/N} \right){f_i} $ | (1) |
式中,ni为第i种物种的个体数,N为所有物种的总个体数,fi为第i种物种出现的频率.物种优势度Y ≥ 0.02定为优势种.
本研究采用Pearson相关分析分析阳宗海浮游植物的生物量与环境因子的相互关系,利用相似性分析(analysis of similarities,ANOSIM)检验浮游植物群落结构在时空上的差异性,利用方差分析(analysis of variance,ANOVA)分析浮游植物生物量及环境因子的时空差异,利用冗余分析(redundancy analysis,RDA)研究浮游植物群落结构与环境因子的相互关系:首先对群落结构百分比数据进行去趋势对应分析(detrended correspondence analysis,DCA),结果显示梯度长度最大为1.34,因此选择线性分析中的冗余分析方法;其次对各物种的生物量百分比数据进行平方根转换,提高稀有种在群落结构中的百分比;对各环境因子进行正态分布检验,并且进行不同的转换使其趋于正态分布;最后将转换后的环境数据进行独立的RDA分析,将显著的环境因子(P < 0.05)与浮游植物生物量百分比进行RDA排序.将P < 0.05的环境因子进行方差膨胀因子的检验(Variance inflation factor,VIF),剔除膨胀系数大于20的环境因子之后对剩余的环境因子进行简约模型分析,最后得到最为显著地解释浮游植物变化的环境因子[29],并将显著的环境因子和群落数据进行方差分解(Variation Partitioning).
本文的数据分析在Excel、Origin8.0及R (3.2.2)软件中的vegan、multcomp和psych软件包中进行.
2 结果 2.1 浮游植物群落结构及优势种本次研究共鉴定出浮游植物7门44属68种,其中绿藻门种类最多,有15属23种,占总种类数的33.82 %;硅藻门11属22种,占32.35 %;蓝藻门12属13种,占19.12 %;隐藻门2属4种,占5.88 %;甲藻门2属4种,占5.88 %;金藻门和裸藻门1属1种,各占1.47 %.
采样期间蓝藻门生物量基本占绝对优势,其次为甲藻门,甲藻门生物量百分比在冬春季节相对高;硅藻门生物量百分比在2015年10月开始增加,到12月达到最大;其他门类的藻类所占百分比全年均较低(图 2).蓝藻门的伪鱼腥藻(Pseudoanabaena sp.)、浮丝藻(Planktothrix sp.)和束丝藻为全年的优势种,棒胶藻(Rhabdogloea sp.)在2015年4-12月为主要优势种,中华小尖头藻(Merismopedia sinica)在6、8和10月为优势种,弯形小尖头藻(Raphidiopsis curvata)在6、8和2月为优势种.绿藻门、硅藻门和隐藻门的个别物种在某些月份成为优势种,如微小四角藻(Tetraedron minimum)、小环藻(Cyclotella spp.)、脆杆藻(Fragilaria spp.)及蓝隐藻(Chroomonas sp.)在2月成为优势种;极小曲壳藻(Achnanthes minutissima)为10和12月的优势种. 2016年2月的优势种种类最多,4月种类最少(表 1). AONSIM结果显示阳宗海浮游植物群落结构在时间上差异显著(r=0.55,P < 0.01);空间上,南、中、北3个湖区差异不显著(r=-0.12,P=0.97).

|
图 2 阳宗海浮游植物群落结构的时空变化 Fig.2 Spatio-temporal variation of phytoplankton community structure by biomass in Yangzong Lake |
| 表 1 阳宗海各月份浮游植物优势种及优势度对比 Tab. 1 Summary of dominant algal taxa and their dominance in Yangzong Lake |
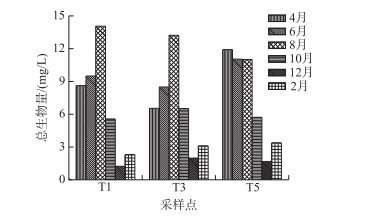
阳宗海南部和中部湖区浮游植物总生物量在时间上呈现显著的季节性变化趋势,即从2015年4-8月逐渐升高,8月达到最高, 之后8-12月出现显著下降,2016年2月又相对上升.北部湖区浮游植物生物量在4月最高,6和8月略有下降,而在其他月份与南部和中部湖区的变化趋势一致.总生物量最大值出现在南部湖区的8月(14.06 mg/L),最小值出现在南部湖区的12月(1.23 mg/L)(图 3).浮游植物、蓝藻门和硅藻门生物量在时间上存在显著差异(ANOVA,n=18,P < 0.001),而其他门类的藻类生物量在时间上的差异不显著;空间上,阳宗海南、中、北部湖区浮游植物和各门类的生物量差异均不显著(ANOVA,n=18,P>0.05).
|
图 3 阳宗海浮游植物生物量的时空分布 Fig.3 Spatio-temporal distribution of phytoplankton biomass in Yangzong Lake |
阳宗海水体主要环境指标显示(表 2),除铁的浓度外,其他环境因子在时间尺度上均存在着显著的差异(n=18,P < 0.05);对3个湖区各环境指标的差异进行ANOVA检验,结果显示各环境指标的空间变化差异不显著(n=18,P>0.05).
| 表 2 阳宗海水体主要环境指标特征 Tab. 2 Summary of environmental factors of Yangzong Lake |
在阳宗海浮游植物总生物量与环境因子的相关关系上,浮游植物总生物量与水温和pH呈显著正相关(P < 0.001);与砷、锰、透明度(P < 0.001)及钠、钾和总磷(P < 0.05)呈显著负相关.由于蓝藻和硅藻生物量对浮游植物群落结构的贡献较大且在时间上具有显著的差异,故将两者分别与环境因子进行相关性分析.结果显示,蓝藻生物量与水温、pH(P < 0.001)及铅(P < 0.05)呈显著正相关;与砷、锰、透明度(P < 0.001)及钠、总磷(P < 0.05)呈显著负相关.硅藻生物量与总磷(P < 0.001)以及锰、电导和总氮(P < 0.05)呈显著正相关,而与钙(P < 0.01)及水温、pH、溶解氧(P < 0.05)呈显著负相关(附录Ⅰ).
| 附录Ⅰ 阳宗海浮游植物生物量与各环境因子的Pearson相关性分析 Appendix Ⅰ Summary of the Pearson correlations between phytoplankton biomass and each environmental factor in Yangzong Lake |
进一步采用RDA综合判别阳宗海藻类群落结构与环境因子之间的关系.首先对各环境因子进行独立的RDA分析,结果表明水温、钙、锰、砷、pH和钾是影响浮游植物群落结构的6个显著环境因子(P < 0.05).浮游植物的变化也直接影响了水体pH水平,故选取其他5个显著的环境因子开展RDA的进一步分析,5个环境因子共同解释了浮游植物群落结构变化的57.18 %.选取物种得分大于0.6的物种与显著的环境因子生成RDA排序图(图 4),图中主轴1和主轴2共解释了浮游植物群落结构变化的41.42 %,其中主轴1解释了26.77 %,主轴2解释了14.65 %.结果表明阳宗海浮游植物群落结构在时间上的变化幅度明显大于空间上.从季节性分布来看,2015年4-12月的浮游植物群落样点主要沿主轴2变化,同时2016年2月的浮游植物分布沿主轴1变化,与其他5个月的分布特征明显不同. 2016年2月的样点分布在主轴1的负半轴,个别绿藻和硅藻的出现与水体中较高的砷、钾、锰浓度相关且受到水温总体偏低的影响. 2015年6、8、10月样点主要位于主轴1和主轴2的正半轴,蓝藻门的束丝藻、尖头藻和棒胶藻的生物量百分比较高,这与较高的水温和较低的砷、钾和锰浓度有关.而2015年4和12月的样点都位于主轴2的负半轴,表明其群落结构主要受水体中较高的钙、锰和砷浓度影响.

|
图 4 阳宗海浮游植物群落结构与5个显著环境因子的RDA排序图 (符号方框、圆圈和三角形分别表示采样点T1、T3和T5;物种名:APHA束丝藻、RAPH尖头藻、RHAB棒胶藻、NOST念珠藻、CYCL小环藻、FRAG脆杆藻、CLOS新月藻、TREU四棘藻、OOCY卵囊藻、CART四鞭藻、ANKI纤维藻;环境因子:WT水温、Ca钙、Mn锰、As砷、K钾) Fig.4 RDA triplot showing phytoplankton community structure and five significant environmental factors in Yangzong Lake |
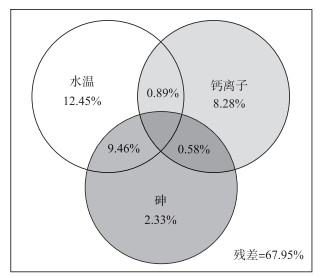
经VIF检验和简约模型分析后,从上述5个显著的环境因子中进一步选出水温、钙和砷3个环境指标,与浮游植物群落结构数据结合进行方差分解分析.结果显示,水温、钙和砷共同解释了浮游植物群落结构变化的32.05 %,水温、钙和砷分别单独解释了浮游植物群落结构变化的12.45 %、8.28 %和2.33 %,水温和砷共同解释了浮游植物变化的9.46 %,水温和钙共同解释了浮游植物变化的0.89 %,钙和砷共同解释了浮游植物变化的0.58 % (图 5).
|
图 5 阳宗海浮游植物群落结构与环境因子的方差分析 Fig.5 Variation partitioning results showing the explanatory powers of water temperature, calcium and arsenic in accounting for phytoplankton community changes in Yangzong Lake |
本研究共鉴定出浮游植物7门44属68种,其中绿藻门种类最多,硅藻门和蓝藻门次之,其他门类种类较少.蓝藻门为主要优势种,这与阳宗海砷污染以来浮游植物优势种的变化特征一致[17-19].本次调查结果显示,大部分点位的蓝藻生物量占浮游植物总生物量的70 %以上(图 2),反映了蓝藻对砷胁迫可能具有较强的耐受性[30].近几十年来,阳宗海周边大力发展旅游业,并且新建了大量的工矿企业,同时流域土地利用强度的增加都导致了湖区承载的污染物总量逐渐增加[7],阳宗海面临着富营养化的长期影响,这也可能导致蓝藻生物量在全年占优.此外,蓝藻与其他藻类相比具有较强的竞争优势,蓝藻种类的大量繁殖往往会分泌化感物质抑制其他藻类的生长,从而降低其他藻类的生物量[31].甲藻门生物量所占比例仅次于蓝藻门,尤其在冬春季具有较高的水平;阳宗海出现的甲藻为飞燕角甲藻和多甲藻,由于其个体体型大且在全年均有出现,故生物量百分比在全年占有较大比例.已有研究表明甲藻适宜生长的温度范围是10~20℃[32],阳宗海冬春季节水体温度在10~20℃的范围内,有利于甲藻的生长;在冬春季节适宜的温度条件下,多数甲藻能通过自身调节,进行垂直迁移获取光照和营养盐,从而具有更大的竞争优势[33-34];此外,阳宗海冬春季节甲藻相对较多可能与冬春季水体混合,把底层部分大个体的甲藻带到表层,使表层甲藻生物量增加有关.硅藻的生长对于水体温度的要求相对于蓝藻低[35-36],同时高原湖泊较强的光照强度和水体营养盐浓度的上升可能有利于个体较小的中心纲硅藻生长[37],并且冬春季节水体混合强度的增加也会促进硅藻含量增加[38],这些都可能导致阳宗海硅藻生物量在12和2月相对较高.
3.2 阳宗海浮游植物驱动因子解析RDA和方差分解的分析结果表明,水温是影响阳宗海浮游植物群落结构季节变化的显著因子.水温是影响浮游植物个体生长的关键环境因子之一,影响着浮游植物组成及时空分布[39].水温可以通过对浮游植物光合作用与呼吸代谢速率的控制而影响藻类含量[40],同时大多数藻类随着水温的升高而快速生长和繁殖,而水温的下降将导致藻类生长变缓或者停滞[41].阳宗海浮游植物总生物量与水温呈显著正相关(附录Ⅰ).阳宗海6、8和10月浮游植物生物量较高,平均水温分别为23.8、24.3和20.4℃.而4、12月和2016年2月表层平均水温均低于20℃,浮游植物的生长相对受到抑制,生物量较低. Paerl等的研究进一步表明,当水体温度大于25℃时,蓝藻的生长相对于硅藻和绿藻更具优势[35-36];而李媂等的研究显示当平均水温大于20℃时有利于蓝藻生长[42].阳宗海浮游植物群落结构显示,束丝藻、尖头藻和棒胶藻等喜高温的蓝藻含量在6、8和10月相比其他季节增加.而阳宗海冬季水温相对其他季节低,特别是2月平均水温仅为11.5℃,同时群落结构出现了较大的变化,反映了蓝藻的生长相对受到抑制而硅藻和绿藻的生物量百分比有所增加.
国内外研究表明,砷对浮游植物的细胞生长和光合活性均具有重要影响[43-44].不同种类的藻对不同形态及不同浓度砷的敏感性和耐受程度不同[14, 30],因此水体砷浓度的变化对浮游植物群落组成的构建可能产生差异性的影响[4, 11].研究显示长期砷胁迫能够改变浮游植物的物种组成,导致对砷敏感的种类数量减少甚至消失,浮游植物优势种向能够获得竞争优势的抗砷种类转变[11-13].与海洋藻类相比,淡水藻类对砷的响应更加敏感,如在营养盐限制的淡水环境中自然本底的砷浓度可以影响微藻群落的构建[12].研究显示不同营养条件下砷对不同株系铜绿微囊藻(蓝藻)的影响不同,如无磷或者磷限制(约31 μg/L)条件下,铜绿微囊藻FACHB 905对砷的耐受阈值是7.5 μg/L[45];75 μg/L的砷在无磷、磷限制、磷富集(310 μg/L)以及磷过量(5425 μg/L)的条件下都能对铜绿微囊藻FACHB 905产生抑制作用,且抑制作用随着磷浓度的增加而减小[46];而铜绿微囊藻PCC7806和TY-1对高达7500 μg/L的砷耐受,且耐受性与胞外磷含量无关[47-48].调查期间阳宗海水体砷浓度范围为7.0~78.2 μg/L(平均砷浓度为48.2 μg/L),磷浓度的范围为30.0~53.4 μg/L,平均值为41.6 μg/L(表 2).相关分析结果表明,阳宗海浮游植物总生物量和蓝藻生物量与砷浓度均呈显著负相关(附录Ⅰ).在上述的水体磷浓度范围内,阳宗海砷污染对藻类特别是蓝藻的生长可能产生抑制作用,与龚艳等[45]和Guo等[46]的结果一致.同时,在水体营养水平较高的背景下(表 2),阳宗海砷污染水体中蓝藻优势的维持机制以及其受砷与营养盐的驱动作用还有待于室内控制实验等研究的进一步开展.
本研究中水体砷浓度的季节变化与水温呈显著负相关(附录Ⅰ),方差分解的结果显示砷浓度仅独立解释了浮游植物群落结构变化的2.33 %,而砷和水温共同解释了群落结构变化的9.46 %.阳宗海为亚热带深水湖泊,其水温具有较强的季节性变化,热力分层也呈现出季节性特征[49].阳宗海夏季水温较高,湖泊产生强烈的热力分层阻碍上下水体的交换,湖上层和湖下层的溶解氧、pH、电导率、氧化还原电位等产生显著的变化[21, 50],并且可能使水体底部内源释放的砷无法带到湖上层,出现了湖泊表层水体相对较低的砷浓度,而在冬季,湖泊水体温度梯度小、热力混合强度增加,导致了水体物理与化学环境特征在垂直分布上趋于同质化,同时内源释放的砷等污染物进入水体表层导致水体砷浓度升高[49-50],故阳宗海表层砷浓度存在较强的季节性变化特征(表 2).因此,我们推测在长期砷污染湖泊中,水温的季节性波动导致了湖泊热力分层的变化并改变了表层水体中的砷浓度,从而可能对浮游植物生物量和群落结构的季节变化产生影响.
云贵高原具有广泛分布的喀斯特地貌,大量分布的石灰岩、白云岩和泥灰岩中钙、钾、镁和钠等阳离子含量较高[51].钙作为藻类生长的一种必需的营养元素,是藻类生长发育的重要调节因子,能够维持细胞壁、细胞膜及膜结合蛋白的稳定性,还可作为第二信使调节植物的多种代谢过程.一定浓度的外源钙对重金属胁迫下藻类的生长发育、生理代谢、抗氧化系统、超微结构等均具有明显的改善作用,从而增强藻类对重金属毒害环境的适应性[52].部分研究表明,水体中钙离子浓度的降低将降低藻类的生长速率、最大光电子传递速率及水体的叶绿素浓度,但过高浓度的钙离子也会抑制藻类的生长[53-54].另外,研究显示不同门类的浮游植物对于水体中不同钙离子浓度的响应不同[55-56],故钙离子对于浮游植物群落结构的构建在一定程度上起到了调节作用.本次调查中,钙离子的浓度变化范围较大(7.4~52.9 mg/L),同时RDA结果表明钙离子浓度与阳宗海4和12月浮游植物群落结构显著相关,方差分解结果也显示钙离子能够解释浮游植物群落结构变化的9.75 %.因此在喀斯特地质背景下,钙离子浓度等水体化学特征是云贵高原地区湖泊中浮游植物群落构建的重要影响因子.
4 结论1) 采样期间阳宗海浮游植物以蓝藻门占绝对优势,其中伪鱼腥藻、浮丝藻、束丝藻为全年优势种,且优势度较大.
2) 阳宗海浮游植物生物量整体上在春夏季高,秋冬季低.除铁离子以外各环境指标和浮游植物生物量均在时间上存在显著差异,而空间差异不显著.水温、pH、砷、透明度、锰、钠、钾和总磷浓度是影响浮游植物总生物量变化的主要环境因子.
3) 水温、钙和砷是影响阳宗海浮游植物群落结构季节变化的重要环境因子.我们推测砷主要通过水温的变化对浮游植物群落产生作用,在较低水温的情况下,湖泊水体在垂直方向上的季节性混合促进了砷的内源释放,表层水体砷浓度的升高可能对浮游植物群落的构建产生直接影响.本研究结果可以为胁迫环境中砷的生态作用评价以及砷污染湖泊的综合治理提供一定的数据支持和理论基础.
致谢:感谢高原地理过程与环境变化省重点实验室各位老师和同学在野外采样和室内分析中给予的帮助.
5 附录附录见电子版(DOI:10.18307/2019.0114).
| [1] |
Lui ZT, Li CH, Zhang GY. Application of principal component analysis to the distributions of heavy metals in the water of lakes and reservoirs in Yunnan Province. Research of Environmental Sciences, 2010, 23(4): 459-466. [刘总堂, 李春海, 章钢娅. 运用主成分分析法研究云南湖库水体中重金属分布. 环境科学研究, 2010, 23(4): 459-466.] |
| [2] |
Xing W, Bai G, Wu H et al. Effect of submerged macrophytes on metal and metalloid concentrations in sediments and water of the Yunnan Plateau lakes in China. Journal of Soils & Sediments, 2017, 17(10): 1-10. |
| [3] |
Klein DH. Fluxes, residence times, and sources of some elements to Lake Michigan. Water Air & Soil Pollution, 1975, 4(1): 3-8. |
| [4] |
Knauer K, Behra R, Hemond H. Toxicity of inorganic and methylated arsenic to algal communities from lakes along an arsenic contamination gradient. Aquatic Toxicology, 1999, 46(3/4): 221-230. |
| [5] |
Zhang YX, Xiang XP, Zhang Y et al. Distribution and Sources in Yangzonghai Lake, China. Environmental Science, 2012, 33(11): 3768-3777. [张玉玺, 向小平, 张英等. 云南阳宗海砷的分布与来源. 环境科学, 2012, 33(11): 3768-3777.] |
| [6] |
Wang ZH, He B, Pan XJ et al. Levels, trends and risk assessment of arsenic pollution in Yangzonghai Lake, Yunnan Province, China. Science China Chemistry, 2010, 53(8): 1809-1817. DOI:10.1007/s11426-010-4039-3 |
| [7] |
Tao JS, Chen GJ, Chen XL et al. Long-term pattern of diatom community responses to water pollution and hydrological regulation in Yangzong Lake. Geographical Research, 2016, 35(10): 1899-1911. [陶建霜, 陈光杰, 陈小林等. 阳宗海硅藻群落对水体污染和水文调控的长期响应模式. 地理研究, 2016, 35(10): 1899-1911.] |
| [8] |
Reynolds CS. The ecology of freshwater phytoplankton. Cambridge: Cambridge University Press, 2006.
|
| [9] |
Lu N, Yin HB, Deng JC et al. Spring community structure of phytoplankton from Lake Chaohu and its relationship to environmental Factors. J Lake Sci, 2010, 22(6): 950-956. [路娜, 尹洪斌, 邓建材等. 巢湖流域春季浮游植物群落结构特征及其与环境因子的关系. 湖泊科学, 2010, 22(6): 950-956. DOI:10.18307/2010.0620] |
| [10] |
Suikkanen S, Laamanen M, Huttunen M. Long-term changes in summer phytoplankton communities of the open northern Baltic Sea. Estuarine Coastal & Shelf Science, 2007, 71(3/4): 580-592. |
| [11] |
Sanders J, Cibik. Adaptive behavior of euryhaline phytoplankton communities to arsenic stress. Marine Ecology Progress, 1985, 22: 199-205. DOI:10.3354/meps022199 |
| [12] |
Wängberg S, Heyman U, Blanck H. Long-term and short-term arsenate toxicity to freshwater phytoplankton. Canadian Journal of Fisheries & Aquatic Sciences, 1991, 48(2): 173-182. |
| [13] |
Sanders JG. Direct and indirect effects of arsenic on the survival and fecundity of estuarine zooplankton. Canadian Journal of Fisheries & Aquatic Sciences, 1986, 43(3): 694-699. |
| [14] |
Chen GJ, Shi HB, Tao JS et al. Industrial arsenic contamination causes catastrophic changes in freshwater ecosystems. Scientific Reports, 2015, 5: 17419. DOI:10.1038/srep17419 |
| [15] |
Li SH, Yu MJ, Li GZ et al. Limnological survey of the lakes of Yunnan Plateau. Oceanologia et Limnologia sinica, 1963, 5(2): 87-114. [黎尚豪, 俞敏娟, 李光正等. 云南高原湖泊调查. 海洋与湖沼, 1963, 5(2): 87-114.] |
| [16] |
Li YP, Yan X. Changes of phytoplankton biomass of Yangzonghai Lake from 2005 to 2007. Environmental Science Survey, 2015(s1): 8-10. [李娅萍, 颜翔. 2005-2007年阳宗海浮游植物生物量变化特征分析. 环境科学导刊, 2015(s1): 8-10.] |
| [17] |
Xu YM. Arsenic concentration and phytoplankton change in Lake Yangzong. Environmental Science Survey, 2013, 32(5): 62-64. [徐永梅. 阳宗海砷浓度与浮游植物的变化分析. 环境科学导刊, 2013, 32(5): 62-64. DOI:10.3969/j.issn.1673-9655.2013.05.017] |
| [18] |
Li CY, Yang ZL. Phytoplankton community and nutritional status evaluation in Yangzonghai Lake. Pearl River, 2013, 3(6): 20-23. [李春永, 杨中兰. 阳宗海浮游植物群落与营养状态评价. 人民珠江, 2013, 3(6): 20-23.] |
| [19] |
Xie YH, Li CY, Yang ZL. Research on plankton community structure of Yangzonghai Lake. Water Resources Protection, 2015, 31(4): 47-51. [谢永红, 李春永, 杨中兰. 阳宗海浮游生物群落结构研究. 水资源保护, 2015, 31(4): 47-51.] |
| [20] |
Wang SM, Dou HS. Records of lakes in China. Beijing: Science Press, 1998. [王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998.]
|
| [21] |
Yuan LN, Yang CL, Li XM et al. Effect of daily thermal stratification on dissolved oxygen, pH, total phosphorus concentration, phytoplankton and algae density of a deep plateau lake:A case study of Lake Yangzonghai, Yunnan Province. J Lake Sci, 2014, 12(1): 161-168. [袁琳娜, 杨常亮, 李晓铭等. 高原深水湖泊水温日成层对溶解氧、酸碱度、总磷浓度和藻类密度的影响:以云南阳总海为例. 湖泊科学, 2014, 12(1): 161-168. DOI:10.18307/2014.0120] |
| [22] |
Zhu XH, Lyu SS, Zhang PP et al. Heavy metal contamination in the lacustrine sediment of a plateau lake:influences of groundwater and anthropogenic pollution. Environmental Earth Sciences, 2016, 75(2): 1-14. |
| [23] |
Li RF, Li XM, Xu Q et al. Identification of arsenic sources and pollution control in Yangzonghai Lake. Environmental Science Survey, 2015(5): 27-31. [李发荣, 李晓铭, 徐琼等. 阳宗海湖泊砷污染来源解析与防治. 环境科学导刊, 2015(5): 27-31. DOI:10.3969/j.issn.1673-9655.2015.05.008] |
| [24] |
Yin HW. Arsenic Pollution in Yangzong Lake has received extensive attention. South Reviews, 2009, 25(4): 46-49. [尹鸿伟. 阳宗海砷污染迷雾不散. 南风窗, 2009, 25(4): 46-49.] |
| [25] |
Qi JY, Xu ZC, Li XP et al. Study on source and speciation distribution characteristics of arsenic in Yangzonghai Lake waters. Journal of Anhui Agricultural Science, 2010, 38(20): 10789-10792. [齐剑英, 许振成, 李祥平等. 阳宗海水体中砷的形态分布特征及来源研究. 安徽农业科学, 2010, 38(20): 10789-10792. DOI:10.3969/j.issn.0517-6611.2010.20.119] |
| [26] |
Ma J, Wang J. Phytoplankton collection, counting and quantitative methods. Journal of Hydroecology, 1982(4): 58-63. [马骥, 王建. 浮游植物的采集、计数与定量方法. 水生态学杂志, 1982(4): 58-63.] |
| [27] |
Hillebrand H, Dürselen C, Kirschtel D et al. Biovolume calculation for pelagic and benthic microalgae. Journal of Phycology, 1999, 35(2): 403-424. DOI:10.1046/j.1529-8817.1999.3520403.x |
| [28] |
Editorial board of "water and wastewater monitoring and analysis method", Ministry of Environmental Protection of the People's Republic of China. Minitoring and analysis methods of water and wastewater:fourth edition. Beijing: China Envirinmental Science Press, 2002: 243-285. [国家环境保护局《水与废水监测分析方法》编委会. 水和废水监测分析方法:第四版. 北京: 中国环境科学出版社, 2002: 243-285.]
|
| [29] |
Jiang YN, Zhang T, Chen L et al. Identification of phytoplankton community changes and environmental factors during the winter-spring transition in Fuxian Lake. Transactions of Oceanology and Limnology, 2016(6): 87-98. [蒋伊能, 张涛, 陈丽等. 抚仙湖冬-春季浮游植物群落结构变化及其影响因子识别. 海洋湖沼通报, 2016(6): 87-98.] |
| [30] |
Ferrari SG, Silva PG, González DM et al. Arsenic tolerance of cyanobacterial strains with potential use in biotechnology. Revista Argentina de Microbiologia, 2013, 45(3): 174-179. DOI:10.1016/S0325-7541(13)70021-X |
| [31] |
Yang B, Dong JD, W J et al. Allelopathy in phytoplankton. Acta Ecologica Sinica, 2007, 27(4): 1619-1626. [杨斌, 董俊德, 吴军等. 浮游植物的化感作用. 生态学报, 2007, 27(4): 1619-1626. DOI:10.3321/j.issn:1000-0933.2007.04.042] |
| [32] |
Yao XJ, Liu DF, Yang ZJ et al. Preliminary studies on the mechanism of winter dinoflagellate bloom in Xiangxi Bay of the Three Gorges Reservoir. Research of Environmental Sciences, 2012, 25(6): 645-651. [姚绪姣, 刘德富, 杨正健等. 三峡水库香溪河库湾冬季甲藻水华生消机理初探. 环境科学研究, 2012, 25(6): 645-651.] |
| [33] |
Xu Y, Cai Q, Wang L et al. Diel vertical migration of Peridiniopsis niei, Liu et al, a new species of dinoflagellates in an eutrophic bay of Three-Gorge Reservoir, China. Aquatic Ecology, 2010, 44(2): 387-395. DOI:10.1007/s10452-009-9298-8 |
| [34] |
Ross ON, Sharples J. Swimming for survival:A role of phytoplankton motility in a stratified turbulent environment. Journal of Marine Systems, 2008, 70(3/4): 248-262. |
| [35] |
Paerl HW, Huisman J. Blooms like it hot. Science, 2008, 320(5872): 57-58. DOI:10.1126/science.1155398 |
| [36] |
Johnk K, Huisman J, Sharples J et al. Summer heatwaves promote blooms of harmful cyanobacteria. Global Change Biology, 2008, 14(3): 495-512. DOI:10.1111/gcb.2008.14.issue-3 |
| [37] |
Rolland A, Bertrand F, Maumy M et al. Assessing phytoplankton structure and spatio-temporal dynamics in a freshwater ecosystem using a powerful multiway statistical analysis. Water Research, 2009, 43(13): 3155. DOI:10.1016/j.watres.2009.03.049 |
| [38] |
Yang D, Gao Z, Sun P et al. Mechanism of nutrient silicon and water temperature influences on phytoplankton growth. Marine Science Bulletin, 2006, 8(2): 49-59. |
| [39] |
Lopes MRM, Bicudo CEDM, Ferragut MC. Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, southeast Brazil. Hydrobiologia, 2005, 542(1): 235-247. DOI:10.1007/s10750-004-8332-z |
| [40] |
Jin JP, Yu X, Bao YX et al. Study on the relationship between the cyanobacteria density and the previous environmental factors in the east part of the Yangcheng Lake. Urban Meteorology Forum-Urban and Environmental Meteorology, 2014, 324-331. [金建平, 于鑫, 包云轩等. 阳澄湖东湖蓝藻密度与前期环境因子的关系. 城市气象论坛-城市与环境气象, 2014, 324-331.] |
| [41] |
Tan X, Kong FX, Yu Y et al. Effects of enhanced temperature on algae recruitment and phytoplankton community succession. China Environment Science, 2009, 29(6): 578-582. [谭啸, 孔繁翔, 于洋等. 升温过程对藻类复苏和群落演替的影响. 中国环境科学, 2009, 29(6): 578-582. DOI:10.3321/j.issn:1000-6923.2009.06.004] |
| [42] |
Li D, Li XW, Niu ZC et al. Structure of phytoplankton community and relationship between phytoplankton community and water quality in Taihu Lake. Ecology and Environmental Sciences, 2014, 23(11): 1814-1820. [李媂, 李旭文, 牛至春等. 太湖浮游植物群落结构及其与水质指标间的关系. 生态环境学报, 2014, 23(11): 1814-1820. DOI:10.3969/j.issn.1674-5906.2014.11.014] |
| [43] |
Sorsa KK. Culture studies on arsenic (As Ⅲ, As Ⅴ, MMAA) interaction with three freshwater algae (Microcystis aeruginosa, Actinastrum hantzschii and Asterionella formosa). Madison: Univ of Wisconsin Madison Wi, 1983.
|
| [44] |
Wang S, Zhang D, Pan X. Effects of arsenic on growth and photosystem Ⅱ (PSⅡ) activity ofMicrocystis aeruginosa. Ecotoxicology & Environmental Safety, 2012, 84(7): 104. |
| [45] |
Gong Y, Wu XQ, Xiao BD et al. Response of Microcystis aeruginosa under different phosphate regimes. Acta Hydrobiologica Sinica, 2009, 33(5): 890-895. [龚艳, 吴幸强, 肖邦定等. 铜绿微囊藻在不同供磷水平下对砷胁迫的响应. 水生生物学报, 2009, 33(5): 890-895.] |
| [46] |
Guo P, Gong Y, Wang C et al. Arsenic speciation and effect of arsenate inhibition in a Microcystis aeruginosa culture medium under different phosphate regimes. Environmental Toxicology & Chemistry, 2011, 30(8): 1754-1759. |
| [47] |
Gong Y, Chou HN, Tu CD et al. Effects of arsenate on the growth and microcystin production of Microcystis aeruginosa, isolated from Taiwan as influenced by extracellular phosphate. Journal of Applied Phycology, 2009, 21(2): 225-231. DOI:10.1007/s10811-008-9353-1 |
| [48] |
Gong Y, Song L, Wu X et al. Effects of arsenate on microcystin content and leakage of Microcystis Strain PCC7806 under various phosphate regimes. Environmental Toxicology, 2009, 24(1): 87-94. DOI:10.1002/tox.v24:1 |
| [49] |
Li ZY. Distribution, morphology and structure of arsenic in Yangzong Lake and its stability in sediments[Dissertation]. Kunming: Yunnan University, 2014. [李智圆.阳宗海湖泊砷的分布、形态结构及其在沉积物中的稳定性[学位论文].昆明: 云南大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2695543 ]
|
| [50] |
Yang CL. Migration and transformation of arsenic in sediments of Yangzong Lake under accelerated sedimentation conditions[Dissertation]. Kunming: Yunnan University, 2014. [杨常亮.人为加速沉积条件下阳宗海沉积物中砷的迁移转化规律[学位论文].昆明: 云南大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2736818 ]
|
| [51] |
Chen XL. Research of lake diatom community and biodiversity distribution feature in Yunnan[Dissertation]. Kunming: Yunnan Normal University, 2015. [陈小林.云南高原湖泊硅藻群落与生物多样性的分布特征研究[学位论文].昆明: 云南师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10681-1015808824.htm ]
|
| [52] |
Min HL, Cai SJ, Xu QS et al. Effects of exogenous calcium on resistance of Hydrilla verticillata (L.f.) Royle to cadmium stress. Acta Ecological Sinica, 2012, 32(1): 256-264. [闵海丽, 蔡三娟, 徐勤松等. 外源钙对黑藻抗镉胁迫能力的影响. 生态学报, 2012, 32(1): 256-264.] |
| [53] |
Shi J, Wu Z, Song L. Physiological and molecular responses to calcium supplementation in Microcystis aeruginosa (Cyanobacteria). New Zealand Journal of Marine & Freshwater Research, 2013, 47(1): 51-61. |
| [54] |
El-Zahraa F, Zaki T. Effect of boron and calcium on growth and nitrogen fixation of the blue-green alga Calothrix parietina. Folia Microbiologica, 1999, 44(2): 201-204. DOI:10.1007/BF02816243 |
| [55] |
Ding L, Zhi CY. Environmental effects on diatom and its monitor of environment. Journal of Guizhou Normal University:Natural Sciences, 2006, 24(3): 13-16. [丁蕾, 支崇远. 环境对硅藻的影响及硅藻对环境的监测. 贵州师范大学学报:自然版, 2006, 24(3): 13-16.] |
| [56] |
Tao ZY, Chen WJ, Yu ZJ et al. Correlation analysis of phytoplankton community structure and environmental factors in Taibo Lake. Journal of Anhui Agricultural Sciences, 2017, 45(13): 63-67. |
 2019, Vol. 31
2019, Vol. 31 

