(2: 江西师范大学地理与环境学院, 南昌 330022)
(2: School of Geography and Environment, Jiangxi Normal University, Nanchang 330022, P. R. China)
细菌是生态系统的重要组成部分,是能量流动和营养物质交换的重要环节.河流水体细菌多样性是水质评价的重要指标,能够体现水体受污染程度和污染物在河水中的迁移转化规律[1].高通量测序技术能够同时对稀有、优势物种进行深度测序,已成为检测细菌群落的常用工具[2-3].
河流细菌群落结构组成受多种因素的影响.水体滞留时间[4]、营养盐浓度[5-8]、溶解有机碳(DOC)[9-11]和河流的补给来源[12]等都会影响细菌群落结构组成,但不同研究得到的结论有较大差异:多次采样研究中得到的细菌群落结构组成主要影响因素往往是水文气象因素[13-15];单次采样中得到影响细菌群落结构组成的主要因素往往是水化学指标[5-8, 16].这主要是由于单次采样难以分析气温、流量等水文气象因素的变化.城市废水的排放会导致污水细菌直接进入河流,这些污染菌株类型主要为Proteobacteria、Actinobacteria、Firmicutes和Bacteroidtes[17-19],此外废水排放也可能通过改变河水物理化学参数影响细菌群落[20].
赣江是江西省最大的河流,也是长江的第二大支流.随着流域内人口增加和社会经济发展,赣江水环境存在恶化的趋势[21-22].目前赣江流域水环境研究主要集中于氮磷时空分布[23]、非点源污染负荷[24]、土地利用方式对水质的影响[25]和重金属分布[26]等方面.赣江水体细菌群落的研究较少,细菌群落结构组成特征及其影响因素尚不清楚.赣江经南昌后分成3支注入鄱阳湖,是鄱阳湖水体的主要补给源,阐明赣江南昌段的细菌群落特征和影响因素对南昌市饮用水安全及鄱阳湖水环境保护具有重要意义.本次研究基于每月采样(2015年4月-2016年3月),分析赣江南昌段细菌群落结构组成特征及影响因素.主要研究目的为:(1)赣江南昌段水体细菌群落结构组成特征;(2)确定河水中影响细菌群落结构组成主要环境变量,比较水文气象因素(气温和流量)与水化学指标(营养盐、水化学离子和重金属元素)对细菌群落结构组成的影响差异;(3)量化南昌城区对河流细菌群落结构组成的影响.
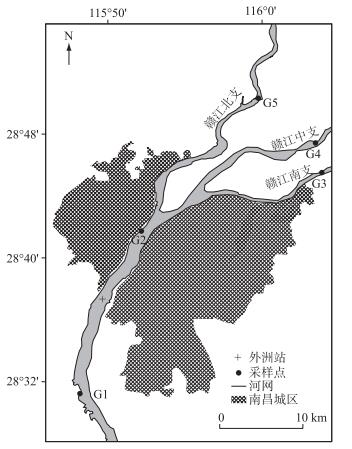
1 材料与方法 1.1 样品收集和水化学分析赣江流域面积占鄱阳湖流域面积的50.60 %.流域内平均气温为17.60℃,年平均降水量为1524.60 mm.降水丰沛但不均,4-6月份多年平均降水量占全年降水的41 % ~51 %.赣江进入南昌城区后分为南支、中支、北支3条支流注入鄱阳湖(图 1).南支环绕老城区和高新技术开发区,中支主要流经郊区农田,北支流经新城区和城郊农业.
|
图 1 赣江南昌段采样点位置 Fig.1 Location of sampling sites in the Nanchang section of the Ganjiang River |
本次采样点(G1~G5)设置为:G1位于赣江进入城区前,G2位于城区中心,G3~G5分别位于城区下游的赣江南支、中支和北支.在2015年4月-2016年3月,每月中旬在河道中心约50 cm深度采集水样,共计60个.使用便携式电导率仪(哈纳,HI98360)现场测定电导率(EC);使用全自动间断分析仪(Smartchem 200 Brookfield,美国)测定铵态氮(NH4+-N)和总磷(TP)浓度;使用TOC分析仪(Shimadzu TOC-L CPH,日本)测定DOC浓度;使用等离子体发射仪(Optima 800PerkinElmer,美国)测定K+、Na+、Mg2+浓度;采用ICS-2100离子色谱系统测定Cl-、NO3-、SO42-浓度;采用酸碱指示剂滴定法测定HCO3-浓度;采用电感耦合等离子体制谱(X series Ⅱ, Thermo, 美国)测定重金属Mn、Cd、Cr、Pb、Cu、As、Ba、Fe浓度.用于测定NH4+-N和DOC浓度的水样通过0.45 μm滤膜过滤(新亚,中国).用于细菌高通量测序的水样(3 L)先通过5 μm滤膜过滤悬浮杂质,然后再通过0.22 μm滤膜过滤,将滤膜于-80℃下保存待用.
以外洲站(图 1)早8:00时的流量(南昌信息水文网http://www.jxncsw.com/list.jsp?classid=19)作为采样日赣江流量,同时记录采样日的气温. 2015-2016年是超强“厄尔尼诺”年,降水异常[27],11、12和1月采样前出现连续性降水,导致流量较往年偏高;相比于研究区正常年份下雨热同期的季风气候,本次研究中较低气温月份异常及较大流量月份异常的出现有利于区分气温与流量对细菌群落的影响.
1.2 DNA的提取和测序利用E.Z.N.A. ®Soil DNA Kit(Omega Bio-tek, Norcross, GA, U.S.)提取基因组DNA,利用1 %琼脂糖凝胶电泳检测抽提DNA.利用引物扩增16S rRNA基因的V3~V4高变区,引物序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′). PCR扩增条件为:95℃,2 min;(95℃,30 s;55℃,30 s;72℃,30 s),60个循环;72℃,5 min.获得扩增产物后,使用AxyPrepDNA凝胶回收试剂盒(Axygen公司)切胶纯化,混合后用TrisHCl洗脱.进一步通过2 %琼脂糖电泳检测PCR产物纯化效果,测定纯化后PCR产物的浓度.参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合.在上海美吉生物医药科技有限公司Illumina MiseqPE300平台进行测序.原始序列数据提交至NCBI SRA数据库(登陆号:SRP074362和SRP113212).
1.3 统计分析本文利用FLASH和Trimmomatic软件对原始DNA序列进行过滤处理,去除嵌合体,得到优化序列.利用UPARSE软件按照97 %相似性将优化序列划分可操作分类单元(OTU, Operational Taxonomic Units).采用RDP classifier贝叶斯算法对照Silva数据库以70 %置信度对OTU代表序列进行物种分类.为避免各样品微生物量的差异,按最小样本序列数进行样本序列抽平处理,得到标准化数据进行后续统计分析.
通过Chao1丰度指数和Shannon多样性指数分析α多样性.通过OTUs表生成的Bray-Curtis[28]距离矩阵分析β多样性.采用单因素方差分析判断不同月份、不同采样点多样性指数和门、属水平分类细菌丰度的差异.使用Bray-Curtis距离矩阵对OTUs数据进行非度量多维尺度(NMDS,Nonmetric Multidimensional Scaling)分析,分析不同条件下细菌群落结构组成的差异性.
使用R语言“Vegan”[29]包中的“Bioenv”[30]程序确定不同环境因子(包括水文气象指标:气温和流量;水化学指标:营养盐、水化学离子和重金属元素)对细菌群落的影响.使用冗余分析(RDA,Redundancy analysis)探讨门分类细菌与环境因子之间的关系.使用SourceTracker[31]模型估测南昌城区对细菌群落的影响,SourceTracker模型是基于Bayesian统计方法定量计算微生物群落来源混合比例的模型,已成功应用于估算水体微生物中粪便来源比例[32-33]和不同来源对水体细菌群落动态扩散的影响差异[34].本次研究中将G1(入城前)水体细菌视为G2~G5处水体细菌的来源,利用SourceTracker模型计算G2~G5处水体细菌群落相对于G1的改变,将这种改变视为南昌城区对赣江细菌群落的影响.
Newton等[33]研究发现Acinetobacter、Arcobacter和Trichococcus是城市污水的指示细菌,Ye等[17]发现Mycobacterium和Vibrio在城市污水中广泛存在;以上5种细菌在本次研究中检测出Acinetobacter(Proteobacteria)、Arcobacter(Proteobacteria)和Mycobacterium(Actinobacteria),选择以上3种细菌作为本次研究的污水指示细菌;污水指示细菌的丰度可以体现城区对细菌群落的影响,通过不同采样点污水指示菌的变化验证SourceTracker模型的计算结果.
2 结果与分析 2.1 水化学特征与水文特征不同月份采样日赣江流量差异很大,从4月的1060 m3/s到5月的8260 m3/s.在5月份采样日之前,整个赣江流域持续一周大雨,流量达到最大值.采样日的平均气温为21.50℃(4月)至33℃(6月). EC、NH4+-N、HCO3-、NO3-、SO42-、Na+、K+、Mg2+等指标在4月的G3采样点出现最大值. K+、EC、SO42-、NH4+-N、Ba和Fe等指标在G1采样点出现最小值. DOC、Cl-、K+、Cr、As、Ba和Fe等指标在不同采样点间没有显著差异. TP、NH4+-N、SO42-、Pb、EC等指标在G3采样点显著高于其他采样点. G3采样点的HCO3-、NO3-、Na+、Mg2+和Cu浓度显著高于G4采样点. G1采样点的Cd浓度显著高于G4和G3采样点. G5采样点的Mn浓度显著高于G3、G1、G4和G2采样点(表 1).
| 表 1 赣江水体水化学指标* Tab.1 Water chemistry index in the Ganjiang River |
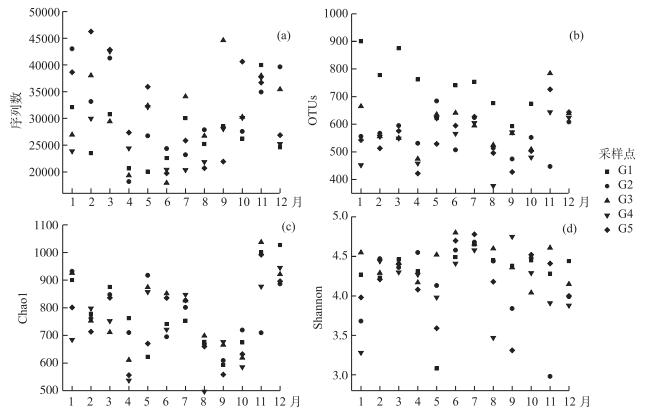
单个样品序列数范围为17949~46264(图 2a),抽平处理后得到的OTU数量范围为377~784(图 2b),Chao1丰度指数范围为497~1037(图 2c),Shannon多样性指数范围为2.98~4.80(图 2d).单因素方差分析显示Chao1丰度指数、Shannon多样性指数和样品序列数在不同采样点间没有显著差异(P=0.790;P=0.393;P=0.445),但在采样月份之间差异显著(P<0.001;P=0.031;P<0.001).抽平处理后得到的OTU数量在不同采样点间有显著差异(P<0.001),但在采样月份之间没有显著差异(P=0.187). Chao1丰度指数与Mn、EC、HCO3-、Cl-、NO3-、SO42-、Na+、K+、Mg2+和气温均呈显著负相关;与DOC和流量均呈正相关. Shannon多样性指数与NO3-、SO42、NH4+-N均呈正相关,与TP和流量均呈负相关.
|
图 2 样品序列数(a)、抽平处理后得到的OTU数量(b)和细菌群落结构组成多样性指数(Chao1丰度指数(c);Shannon多样性指数(d))分布(1-3月为2016年采样数据;4-12月为2015年采样数据) Fig.2 The number of sample sequences (a), OTUs (b) and bacterial community abundance and diversity index(Chao1 abundance index (c); Shannon diversity index (d)) |
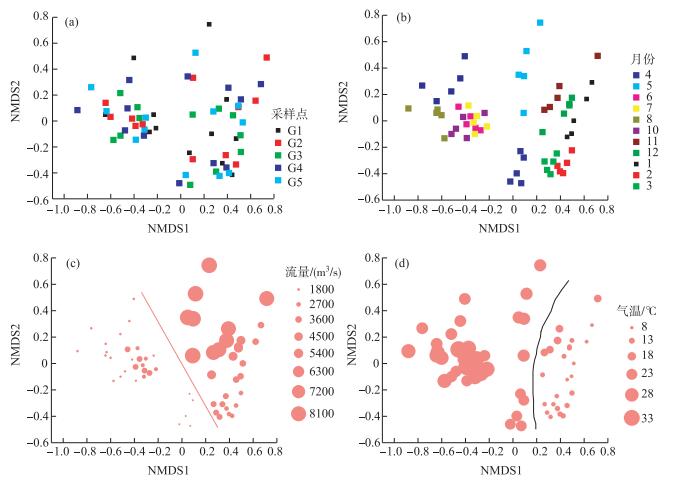
NMDS分析(图 3a、b)表明,赣江不同采样点间细菌群落结构组成没有明显差异,相同月份的采样点具有类似的细菌群落结构组成. 6、7和10月细菌群落结构组成较为类似,2和3月的细菌群落结构组成也具有相似性,而1、4、5、8、9、11和12月差异较大.径流量较大时与径流量较小时的细菌群落结构组成有明显差异(图 3c),气温较低时与气温较高时细菌群落结构组成也有明显差异(图 3d).
|
图 3 基于Bray-Curtis距离非度量多维尺度(NMDS)分析:细菌群落结构组成在采样点之间的差异性(a);细菌群落结构组成在月份之间的差异性(b);流量对细菌群落结构组成的影响(c);气温对细菌群落结构组成的影响(d) Fig.3 Nonmetric Multidimensional Scaling (NMDS) plots derived from Bray-Curtis dissimilarity between water samples: bacterial community between sample ID (a); bacterial community between months (b); the influence of flow rate on bacterial community (c); the influence of temperature on bacterial community (d) |
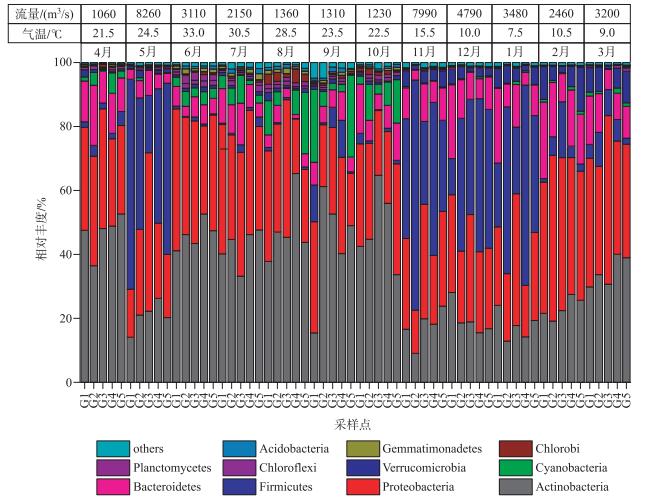
细菌群落的门水平分类中相对丰度最高的是放线菌门(Actinobacteria,34.05 %),第2大门是变形菌门(Proteobacteria,31.59 %),其次是厚壁菌门(Firmicutes,15.49 %)、拟杆菌门(Bacteroidetes,9.12 %)和蓝细菌门(Cyanobacteria,3.43 %). Proteobacteria中Betaproteobacteria相对丰度最高,占细菌总序列数的15.24 %,其次是Alphaproteobacteria(10.42 %)、Gammaproteobacteria(7.30 %)、Deltaproteobacteria(4.31 %)和Epsilonproteobacteria(0.95 %). Firmicutes的相对丰度在流量较大的5月(44.05 %)、11月(42.34 %)、12月(36.01 %)和1月(38.42 %)很高,尤其是在流量最大的5月份成为水样中相对丰度最高的门(图 4).单因素方差分析表明,除Proteobacteria(P=0.016)外,其余门的细菌相对丰度在5个采样点之间不存在显著差异.
|
图 4 赣江水体细菌门水平分类 Fig.4 The bacterial phyla during the water of the sample ID in the Ganjiang River |
细菌群落的属水平分类中相对丰度最高的是hgcI_clade(Actinobacteria,13.29 %),其次是Sporichthyaceae_unclassified(6.97 %)、CL500-29_marine_group(Actinobacteria,6.21 %)、Limnohabitans(Proteobacteria,6.12 %)、Bacillus(Firmicutes,5.64 %)和Lactococcus(Firmicutes,5.29 %). Bacillus丰度只在11、12和1月(5.90 % ~34.73 %)较高,其他月份低于7.87 %;Lactococcu丰度只在5月(14.54 % ~52.05 %)较高,其他月份低于10.16 % (图 5).单因素方差分析表明,除Pseudarcicella(P=0.004)外,其余属的细菌相对丰度在5个采样点之间不存在显著差异.
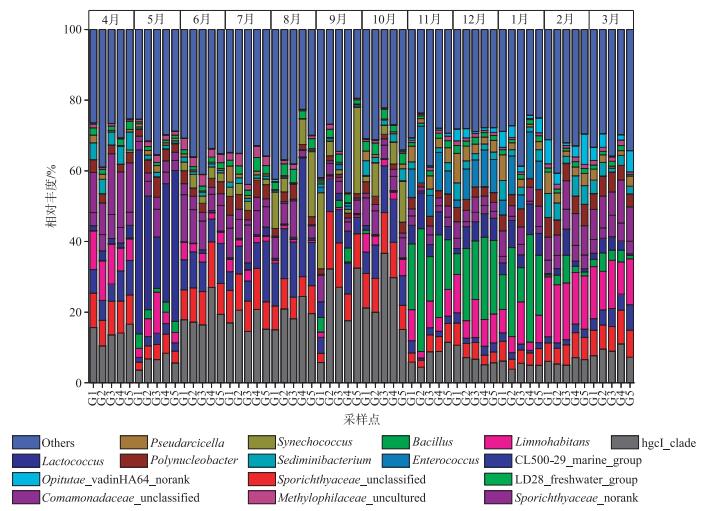
|
图 5 赣江水体细菌属水平分类(others表示平均丰度低于1 %的部分;norank表示位于分类学数据库分类学谱系的中间等级没有科学名称;uncultured表示未培养细菌;unclassified表示属分类级别分值较低) Fig.5 The bacterial genera during the water of the sample ID in the Ganjiang River |
表 2为不同环境因子组合对OTU分类水平和门分类水平细菌群落结构组成的影响(OTU可视为细菌群落结构组成的最小分类单元,门分类为细菌群落结构组成的最大分类单元).解释OTU水平细菌群落结构组成的最佳单参数是气温(相关系数=0.5738),而解释门分类水平细菌群落结构组成的最佳单参数是流量(相关系数=0.5111).气温、流量、EC和DOC是影响OTU水平细菌群落结构组成的最佳环境因子组合(相关系数=0.6249);气温、流量和DOC是影响门水平细菌群落结构组成最佳环境因子组合(相关系数=0.5932).
| 表 2 细菌群落与不同环境因子组合的相关关系 Tab.2 Correlations between different combinations of environmental variables and bacterial community |
通过环境因子对主要门分类种群(平均丰度大于0.50 %)的RDA分析发现,第1个维度解释了细菌群落结构组成变异程度的60.60 %,第2个维度解释了7.30 %,两者共解释了67.90 %.对细菌群落-环境关系显著贡献的环境变量是流量(P=0.002)、气温(P=0.002)、Cl-(P=0.002)和EC(P=0.004). NH4+-N和DOC的影响显著性P值大于0.050.所以流量、气温、Cl-和EC是影响主要门分类细菌的显著环境因子.除Firmicutes、Verrucomicrobia、Bacteroidetes和Proteobacteria,其他门与气温呈正相关. Firmicutes和Verrucomicrobia与流量呈正相关.相对丰度最高的Actinobacteria与流量呈负相关,与气温呈正相关;Proteobacteria是唯一与气温和流量都呈负相关的门;Firmicutes与流量呈明显正相关,Bacteroidetes与气温呈负相关,但与流量的相关性较弱(图 6).
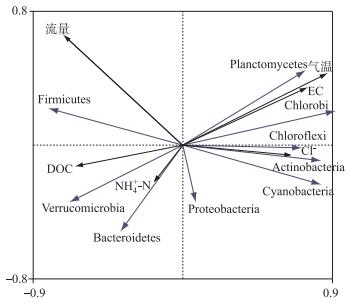
|
图 6 细菌门分类群落与环境因子的RDA分析 Fig.6 RDA biplot of bacterial phyla and environmental factors |
SourceTracker模型计算得到南昌城区对赣江河水细菌群落结构组成的影响范围为6.33 % ~34.67 %.城市对细菌群落的影响在月份之间没有显著差异(P=0.950),但在采样点之间差异显著(P=0.013).南昌城区对采样点G3(19.67 %)的影响显著高于G2(14.50 %,P=0.028)、G4(13.03 %,P=0.005)和G5(12.69 %,P=0.004);对采样点G2、G4和G5的影响没有显著差异(图 7a).模型结果表明南昌城区对赣江南支的细菌群落影响更明显.
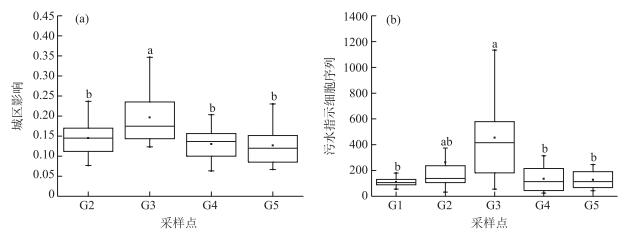
|
图 7 城区对赣江水体细菌群落结构组成的影响(a)及不同采样点3种污水指示细菌序列数(b)箱线图(图中不同字母表示采样点间显著性(LSD检验,P<0.05)) Fig.7 Effects of urban area on bacteria community (a) and sequence number of sewage indicator bacteria in different sample IDs (b) (Different letters indicate significant differences among sample IDs (LSD test, P < 0.05)) |
不同采样点3种污水指示细菌Acinetobacter、Arcobacter和Mycobacterium在G3采样点的相对丰度最高(41.67 %),其次为G2(24.09 %)、G4(12.38 %)、G5(11.64 %)和G1 (10.21 %). G3采样点污水细菌数显著高于G1(P=0.030)、G4(P=0.024)和G5(P=0.021),但不显著高于G2(P=0.320)(图 7b).不同采样点污水细菌序列数差异与SourceTracker结果相近,表明SourceTracker模型的计算结果是可靠的.
3 讨论本次研究中河水中最丰富的门是Actinobacteria(34.05 %)和Proteobacteria(31.59 %),两者占总基因序列的比例达到了65.64 %.这和以前多数研究结果一致(表 3)[6, 15, 35-36].但与以前研究中Firmicutes丰度较低[5, 12, 15]不同,在本次研究中发现Firmicutes在流量较大的月份丰度明显升高,5月暴雨后甚至成为河水丰度最高的门类(44.05 %). Lactococcus在5月占Firmicutes的79.43 %,而Bacillus在11、12和1月分别占48.89 %、48.35 %和48.00 %.因此Lactococcus和Bacillus的增多是Firmicutes比例增大的主要原因. Lactococcus广泛存在于植物和动物的表层[37],5月份水热组合好,动植物生命力强,Firmicutes比例增大可能是暴雨将大量动植物表层的Lactococcus冲入河中导致的. Bacillus主要以腐质物为食,对低温环境具有较强的抵抗力[38],在气温较低的11、12、1月份取代Lactococcus成为暴雨洪水中Firmicutes的主要组成.
| 表 3 国内外河流基于16S rRNA方法的细菌群落及影响因子研究结果 Tab.3 Bacteria communities and the influencing factors in domestic and oversea rivers based on 16S rRNA |
河水细菌群落受多种环境因子的影响,不同研究中得到结论差别较大(表 3).单次采样往往得到水化学指标是影响河水细菌群落结构组成的主要因素,如Liu等[6]对东江研究发现氮营养盐是影响细菌群落的主要因素.唐婧等[5]对南明河研究发现细菌群落的主要影响因子是总氮和总磷.但多次采样往往发现水文气象因素是细菌群落结构组成的主要影响因素[13-15].本次研究重点对比水文气象条件(气温和流量)和水化学指标的影响.研究中尽可能多地检验了水化学指标,包括营养盐(DOC、TP和NH4+-N)、水化学离子(HCO3-、Cl-、NO3-、SO42-、Na+、K+和Mg2+)和重金属元素(Mn、Cd、Cr、Pb、Cu、As、Ba和Fe);结果显示气温和流量对细菌群落的影响大于水化学指标.气温影响细菌的生长速度[39],对河流细菌群落有着重要影响;流量影响河水补给来源和细菌的运动能力[4, 12],对某些类型细菌如Firmicutes影响明显. Proteobacteria是唯一与气温和流量都呈负相关的门,Proteobacteria是城市污水的指示细菌之一[18, 33],2015-2016年是超强“厄尔尼诺”年,降水异常[27],流量较往年偏高.流量大对城市排放污水的稀释作用强,Proteobacteria丰度低. Proteobacteria对气温具有敏感性,对低温的适应能力强,相对丰度与气温呈负相关关系[40-41].
城市废水的排放会导致污水细菌直接进入河流[33]或通过河水物理化学参数而影响细菌群落[20].本次研究中,除Proteobacteria(P=0.016)外,其余门的细菌相对丰度在5个采样点之间不存在显著差异,南昌城区对赣江细菌群落没有明显改变. SourceTracker模型结果表明,南昌城区对G3采样点细菌群落的影响最大(19.67 %),其次为G2(14.50 %)、G4(13.03 %)和G5(12.69 %)采样点. G3采样点位于流经老城区和高新技术开发区的赣江南支,流经城区长度最长,受城区影响也最大.污水指示细菌丰度也表明赣江南支受城区影响最大.
4 结论1) 赣江南昌段的优势菌门为Actinobacteria(34.05 %)和Proteobacteria(31.59 %),其次为Firmicutes(15.49 %)和Bacteroidetes(9.12 %). Firmicutes在流量较大的月份丰度明显升高,5月暴雨后甚至成为河水丰度最高的门类(44.05 %). Lactococcus和Bacillus的增多是Firmicutes比例增大的主要原因.
2) 气温和流量是河流细菌群落主要影响因子,其中气温是影响OTU丰度的最佳单参数,流量是影响门丰度的最佳单参数.水文气象条件(气温和流量)对河流细菌群落的影响大于水化学指标,包括营养盐(DOC、TP和NH4+-N)、水化学离子(HCO3-、Cl-、NO3-、SO42-、Na+、K+和Mg2+)和重金属元素(Mn、Cd、Cr、Pb、Cu、As、Ba和Fe).
3) 南昌城区对细菌群落的影响较小(6.33 % ~34.67 %).除Proteobacteria(P=0.016)外,其余门的细菌相对丰度在5个采样点之间不存在显著差异,南昌城区对赣江细菌群落没有明显改变. SourceTracker模型结果表明南昌城区对赣江南支的细菌群落改变显著高于其他河段,主要的影响门类为Proteobacteria.
| [1] |
Findlay S. Stream microbial ecology. Journal of the North American Benthological Society, 2010, 29(1): 170-181. DOI:10.1899/09-023.1 |
| [2] |
Caporaso JG, Lauber CL, Walters WA et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences, 2011, 108(1): 4516-4522. |
| [3] |
Glenn TC. Field guide to next-generation DNA sequencers. Molecular Ecology Resources, 2011, 11(5): 759-769. DOI:10.1111/j.1755-0998.2011.03024.x |
| [4] |
Read DS, Gweon HS, Bowes MJ et al. Catchment-scale biogeography of riverine bacterioplankton. Isme Journal, 2015, 9(2): 516-526. DOI:10.1038/ismej.2014.166 |
| [5] |
Tang J, Xu XR, Shang CY et al. Association of bacterial diversity in city area of Nanming river with environmental factors. Acta Microbiologica Sinica, 2015, 55(8): 1050-1059. [唐婧, 徐小蓉, 商传禹等. 南明河城区河段细菌多样性与环境因子的关系. 微生物学报, 2015, 55(8): 1050-1059.] |
| [6] |
Liu Z, Huang S, Sun G et al. Phylogenetic diversity, composition and distribution of bacterioplankton community in the Dongjiang River, China. FEMS Microbiology Ecology, 2012, 80(1): 30-44. DOI:10.1111/j.1574-6941.2011.01268.x |
| [7] |
Shen S, Yang CM, Cheng SP. Spatial characteristics analysis by PCR-DGGE for bacterial communities in surface sediments of Tangxi River, Hefei City. Chinese Journal of Applied and Environmental Biology, 2015, 21(1): 80-87. [沈烁, 杨长明, 成水平. PCR-DGGE分析合肥市塘西河表层沉积物细菌群落结构空间分布特征. 应用与环境生物学报, 2015, 21(1): 80-87.] |
| [8] |
Sun HM, Bai JJ, Sun WL et al. Quantitative and qualitative analysis of total bacteria and ammonia-oxidizing bacteria in Buji River in wet Season. Environmental Science, 2012, 33(8): 2691-2700. [孙海美, 白姣姣, 孙卫玲等. 布吉河丰水期总细菌和氨氧化细菌的定性和定量研究. 环境科学, 2012, 33(8): 2691-2700.] |
| [9] |
Fortunato CS, Eiler A, Herfort L et al. Determining indicator taxa across spatial and seasonal gradients in the Columbia River coastal margin. Isme Journal, 2013, 7(10): 1899-1911. DOI:10.1038/ismej.2013.79 |
| [10] |
Xia N, Xia X, Liu T et al. Characteristics of bacterial community in the water and surface sediment of the Yellow River, China, the largest turbid river in the world. Journal of Soils and Sediments, 2014, 14(11): 1894-1904. DOI:10.1007/s11368-014-0974-5 |
| [11] |
Staley C, Gould TJ, Wang P et al. Bacterial community structure is indicative of chemical inputs in the Upper Mississippi River. Frontiers in Microbiology, 2014, 5(8): 524. |
| [12] |
De Oliveira LF, Margis R. The Source of the river as a nursery for microbial diversity. PLoS One, 2015, 10(3): e0120608. DOI:10.1371/journal.pone.0120608 |
| [13] |
Zhang W, Bougouffa S, Wang Y et al. Toward understanding the dynamics of microbial communities in an Estuarine System. PloS One, 2014, 9(4): e94449. DOI:10.1371/journal.pone.0094449 |
| [14] |
Zhang M, Yu N, Chen L et al. Structure and seasonal dynamics of bacterial communities in three urban rivers in China. Aquatic Sciences, 2012, 74(1): 113-120. DOI:10.1007/s00027-011-0201-z |
| [15] |
Staley C, Gould TJ, Wang P et al. Species sorting and seasonal dynamics primarily shape bacterial communities in the Upper Mississippi River. Science of the Total Environment, 2015, 505: 435-445. DOI:10.1016/j.scitotenv.2014.10.012 |
| [16] |
Kolmakova OV, Gladyshev MI, Rozanov AS et al. Spatial biodiversity of bacteria along the largest Arctic river determined by next-generation sequencing. Fems Microbiology Ecology, 2014, 89(2): 442-450. DOI:10.1111/fem.2014.89.issue-2 |
| [17] |
Ye L, Zhang T. Bacterial communities in different sections of a municipal wastewater treatment plant revealed by 16S rDNA 454. pyrosequencing. Applied Microbiology and Biotechnology, 2013, 97(6): 2681-2690. DOI:10.1007/s00253-012-4082-4 |
| [18] |
Shanks OC, Newton RJ, Kelty CA et al. Comparison of the microbial community structures of untreated wastewaters from different geographic locales. Applied and Environmental Microbiology, 2013, 79(9): 2906-2913. DOI:10.1128/AEM.03448-12 |
| [19] |
Lin Y, Li D, Zeng S et al. Changes of microbial composition during wastewater reclamation and distribution systems revealed by high-throughput sequencing analyses. Frontiers of Environmental Science and Engineering, 2016, 10(3): 539-547. DOI:10.1007/s11783-016-0830-5 |
| [20] |
Paul M, Meyer J. Streams in the urban landscape. Urban ecology: An international perspective on the interaction between humans and nature. Springer US, 2008: 207-231.
|
| [21] |
Ji Y, Zhang J, Huang X et al. Investigation and assessment of heavy metals in surface sediments of Ganjiang River, China. Journal of Environmental Biology, 2014, 35(6): 1173-1179. |
| [22] |
Li X, Zhang L, Yang G et al. Impacts of human activities and climate change on the water environment of Lake Poyang Basin, China. Geoenvironmental Disasters, 2015, 2(1): 22. DOI:10.1186/s40677-015-0029-2 |
| [23] |
Wang P, Chen DD, Chen B. The distribution characters and pollution sources of nitrogen and phosphorus nutrients in Ganjiang River. Journal of Jiangxi Normal University:Natural Science, 2015, 39(4): 435-440. [王鹏, 陈多多, 陈波. 赣江水体氮磷营养盐分布特征与污染来源. 江西师范大学学报:自然科学版, 2015, 39(4): 435-440.] |
| [24] |
Xu LK, Wang QJ, Xiang SL et al. On impact of non-point source pollution in Ganjiang downstream. Journal of East China Jiaotong University, 2012, 29(1): 48-53. [徐刘凯, 王全金, 向速林等. 赣江下游地区各类非点源污染源的影响研究. 华东交通大学学报, 2012, 29(1): 48-53.] |
| [25] |
Wang P, Qi SH, Chen B. Influence of land use on river water quality in the Ganjiang basin. Acta Ecologica Sinica, 2015, 35(13): 4326-4337. [王鹏, 齐述华, 陈波. 赣江流域土地利用方式对河流水质的影响. 生态学报, 2015, 35(13): 4326-4337.] |
| [26] |
Zhang BJ, Zhu MM, Wang P et al. Spatial and temporal distribution of dissolved cadmium in and water quality assessment of the water body of the Ganjiang River catchment. Journal of Ecology and Rural Environment, 2014, 30(4): 495-499. [张宝军, 朱蒙曼, 王鹏等. 赣江流域水体中可溶态镉的时空分布特征及水质评价. 生态与农村环境学报, 2014, 30(4): 495-499.] |
| [27] |
Li QQ, Mi QY. Dialogue Zhang Renhe:China Southern heavy rainfall and super El Niño in the first half of 2016. Chinese Science Bulletin, 2016, 61(24): 2659-2662. [李清泉, 闵庆烨. 对话张人禾:2016年上半年中国南方强降水与超强厄尔尼诺. 科学通报, 2016, 61(24): 2659-2662.] |
| [28] |
Bray JR, Curtis JT. An ordination of the upland forest communities of Southern Wisconsin. Ecological Monographs, 1957, 27(4): 326-349. |
| [29] |
Oksanen J, Kindt R, Legendre P et al. Vegan: community ecology package: R package version 1. 13-1. R Foundation for Statistical Computing, Vienna. Http://vegan.r-forge.r-project.org/.
|
| [30] |
Clarke KR, Ainsworth M. A method of linking multivariate community structure to environmental variables. Marine Ecology Progress, 1993, 92(3): 205-219. |
| [31] |
Knights D, Kuczynski J, Charlson ES et al. Bayesian community-wide culture-independent microbial source tracking. Nature Methods, 2011, 8(9): 761-763. DOI:10.1038/nmeth.1650 |
| [32] |
Sun H, He X, Ye L et al. Diversity, abundance, and possible sources of fecal bacteria in the Yangtze River. Applied Microbiology and Biotechnology, 2017, 101(5): 2143-2152. DOI:10.1007/s00253-016-7998-2 |
| [33] |
Newton RJ, Bootsma MJ, Morrison HG et al. A microbial signature approach to identify fecal pollution in the waters off an urbanized coast of Lake Michigan. Microbial Ecology, 2013, 65(4): 1011-1023. DOI:10.1007/s00248-013-0200-9 |
| [34] |
Comte J, Berga M, Severin I et al. Contribution of different bacterial dispersal sources to lakes:Population and community effects in different seasons. Environmental Microbiology, 2017, 19(6): 2391-2404. DOI:10.1111/emi.2017.19.issue-6 |
| [35] |
Savio D, Sinclair L, Ijaz UZ et al. Bacterial diversity along a 2600 km river continuum. Environmental Microbiology, 2015, 17(12): 4994-5007. DOI:10.1111/1462-2920.12886 |
| [36] |
Ding C, Chang YM, Yang Q et al. Bacterial biodiversity in the river in Northeast China during the freezing seasons:A case in Songhua River. Acta Scientiae Circumstantiae, 2012, 32(6): 1415-1423. [丁珵, 常玉梅, 杨琦等. 我国东北典型河流冰封期细菌多样性的研究——以松花江为例. 环境科学学报, 2012, 32(6): 1415-1423.] |
| [37] |
Kim W ed. The genus Lactococcus. Lactic Acid Bacteria: Biodiversity and Taxonomy, John Wiley and Sons, Ltd, 2014: 429-443.
|
| [38] |
Dolin'Ska M, Berthold A. Characteristics of the temperature growth of the Bacillus cereus isolated from different environments. Medycyna Weterynaryjna, 2008, 64(8): 1016-1018. |
| [39] |
Sieburth JM. Seasonal selection of estuarine bacteria by water temperature. Journal of Experimental Marine Biology and Ecology, 1967, 1(1): 98-121. DOI:10.1016/0022-0981(67)90009-3 |
| [40] |
Eronenrasimus E, Lyra C, Rintala JM et al. Ice formation and growth shape bacterial community structure in Baltic Sea drift ice. Fems Microbiology Ecology, 2015, 91(2): 1-13. |
| [41] |
Wu J, Xiong J, Hu C et al. Temperature sensitivity of soil bacterial community along contrasting warming gradient. Applied Soil Ecology, 2015, 94: 40-48. DOI:10.1016/j.apsoil.2015.04.018 |
 2018, Vol. 30
2018, Vol. 30 

