(2: 武汉市环境监测中心, 武汉 430015)
(2: Wuhan Environmental Monitoring Center, Wuhan 430015, P. R. China)
在河流生态系统中,藻类能进行光合作用,对污染物反应灵敏,且群落结构组成变化随着水体生态环境变化而变化,常被用于水质监测和评价[1].传统研究常根据形态学水平划分不同的类群,不同生境下浮游植物群落往往高度多样化且大多数物种的发生难以预测,因此,不能很好体现出河流生态环境特征.为了弥补传统分类方法在应用方面的不足,Reynolds依据浮游植物生理、生态、形态特点等综合特征提出了相对完整的浮游藻类功能群理论[2],并依据浮游植物对不同环境因子的耐受性及个体形态差异将浮游植物划分出31个功能群[3]. Padisák在Reynolds的基础上,依据在功能上适应性较强的物种,更能耐受因子缺失的限制条件和在受光照、P、C、N或其他因子限制的生境更有可能生存等特征,进一步将功能群归纳整理为包括A、B、D、MP、TB等39个功能群[4-6].近些年来,该理论被广泛应用于国内外浮游植物的研究[7],如Becker等[3]对巴西亚热带深水水库、Crossetti等[8]对Mangueira湖、Devercelli等[9]对Salado河、Xiao等[10]对流溪河水库及李磊等[11]对阿哈水库等开展了相应的研究.然而,对硅藻功能群的研究相对较少.硅藻是食物链中的主要初级生产者,具有繁殖快、生长周期短且对水体理化环境的变化反应迅速、敏锐的特点,被广泛关注[12-13].特别是底栖硅藻具有分布广泛,便于采集和对水体生态变化的敏感性强的优点,常被用于水体监测[14].
自三峡大坝建成蓄水后,水位升高,水流减缓,水体扩散能力减弱,支流水体富营养化问题严重,局部地区水华频繁发生,对水质健康状况产生严重威胁[15].汝溪河是三峡库区重要支流之一,发源于万州,流经忠县汝溪镇,最后经涂井乡汇入长江.全流域面积720 km2,主河道长54.5 km,在忠县的流域面积为272.9 km2,主河道长25.4 km.库区蓄水后,在忠县区域形成长15 km的回水区[16].目前,关于汝溪河底栖硅藻的研究较少,而对汝溪河底栖硅藻功能群的特征以及其与环境之间的关系未见相关报道,为了揭示人为活动影响下汝溪河底栖硅藻群落结构及功能群变化,本研究主要对汝溪河上游区域开展底栖硅藻功能群季节演替特征以及季节演替的驱动因子的研究,为汝溪河及相应流域的水生生态系统保护和管理提供一定依据.
1 材料与方法 1.1 样点设置本实验对汝溪河忠县段(30°27′~30°31′N,108°1′~108°6′E)的汝溪镇至涂井乡设置了9个样点(图 1).在汝溪镇至涂井乡自上而下分布有桐油滩、长溪、高洞梁和鑫家源等4个水电站. S1为控制样点,距最上游的桐油滩水电站1000 m左右,基本不受梯级电站的影响,样点S2、S4、S6、S8分别为桐油滩水电站、长溪水电站、高洞梁水电站以及鑫家源水电站上游样点,而样点S3、S5、S7、S9为4个电站下游的样点.根据对汝溪河长期的监测(2011—2013年),于2013年4月(丰水期)、8月(平水期)和12月(枯水期)进行样品采集与理化指标的测定和分析.
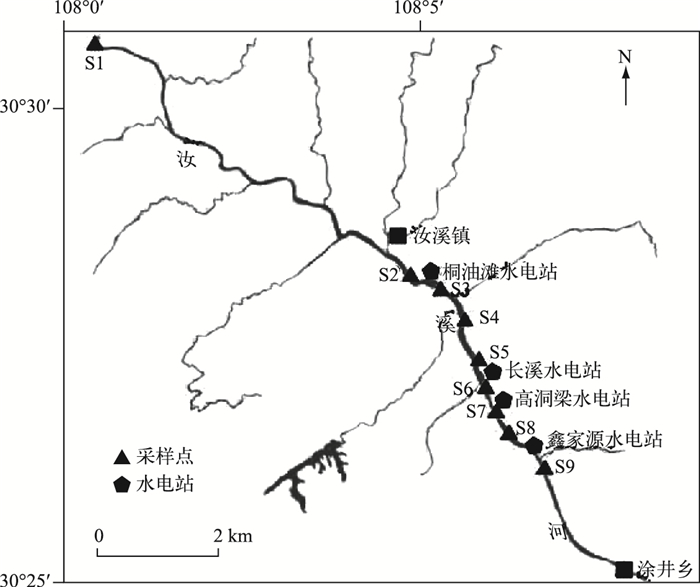
|
图 1 汝溪河样点分布 Fig.1 Distribution of sampling sites in Ruxi River |
附石藻的采集依据EPA[17]的采样方法,每个样点随机选取3~5块石头,在石头上选取R=2.7 cm的固定表面积,共取5个圆形样方,刷取圆内的藻.记录刷液体积,等量分装为3份,一份抽滤后测定叶绿素a浓度,一份加鲁哥氏剂固定,一份加甲醛固定.带回实验室经处理后,鲁哥氏剂固定的藻液用于定量分析,甲醛固定的藻液用于固定标本玻片的制作以及优势种的确定.用多参数水质分析仪DS5(Hydrolab, 美国)现场测定水体理化指标:流速(V)、透明度(SD)、温度(T)、水下光照(PAR)、pH、氧化还原电位(ORP)、电导率(SPC)、溶解氧(DO)、浊度(Tur).水样带回实验室,参照《水和废水监测分析方法》[18]测定营养盐指标:总氮(TN)、硝酸盐(NO3--N)、亚硝酸盐(NO2--N)、铵盐(NH4+-N)、总磷(TP)、溶解性磷酸盐(PO43--P)、可溶性硅酸盐(SiO2)、高锰酸盐指数(CODMn)、总碱度(CaO).
1.3 数据处理及分析功能群分类参照Reynolds和Padisák[4-5, 19]等分类体系进行划分.用Excel整理数据,SPSS 22.0软件进行多元逐步回归分析,其中以环境因子为自变量,不同功能类群藻密度为因变量,根据P值和F值逐步筛选出主要影响环境因子,得到回归方程和相关系数.采用Canoco 5.0软件进行排序分析[20].排序分析前,先将物种数据进行除趋势对应分析(DCA),4个轴最大梯度大于4.0,选用典范对应分析(CCA),如果小于3.0,选用冗余分析(RDA).本文4个轴最大梯度均小于3.0,故选用RDA分析,除pH外其余数据均进行lg(x+1)转换,进行RDA分析前,用SPSS软件对环境因子进行Pearson相关分析.
2 结果 2.1 汝溪河底栖硅藻的群落结构及功能群在丰水期、平水期、枯水期3个时期,对汝溪河9个样点底栖硅藻进行采样,结果表明9个样点中共鉴定出硅藻门8科27属168种,其中中心纲和羽纹纲所占比例分别为6.55 %和93.45 %,舟形藻属(28种)、菱形藻属(23种)和异极藻属(21种)为主要优势属,分别占总种数的16.7 %、13.7 %和12.5 %.依据生境的不同,对168种硅藻进行功能群划分,结果发现168种硅藻可划分为8个功能类群(表 1),分别为B、C、D、LO、MP、P、TB、X3.从种类组成(图 2)来看,所占种数比例最大的是MP类群(62种),其次为D(29种),最少的为C (2种)和TB(3种).丰水期底栖硅藻功能类群的种类比例分布为MP(53.45 %)最大,其次为D(19.83 %),C(0.86 %)最小;平水期的种类比例分布为MP(45.95 %)最大,其次为D(20.30 %),C(1.35 %)最小;枯水期的功能群种类比例为MP(48.60 %)最大,其次为D(27.10 %),而B、LO、C(各占1.87 %)最小.从藻密度来看,丰水期MP类群占绝对优势(7703.5 cells/cm2),其次为C(2994.7 cells/cm2);平水期MP类群占绝对优势(2891.8 cells/cm2),其次为P(776.1 cells/cm2); 枯水期MP类群占绝对优势(12226.3 cells/cm2),其次为D(3107.5 cells/cm2).
| 表 1 汝溪河底栖硅藻功能群组成 Tab.1 Benthic diatom functional group composition in Ruxi River |

|
图 2 汝溪河不同水情期底栖硅藻功能类群的组成 Fig.2 The functional groups composition of benthic diatoms in Ruxi River during different hydrological periods |
为了寻找不同时期功能类群与环境因子之间的关系,应用逐步回归分析不同水文时期特征,结果表明(表 2),丰水期,除D、LO外,其余功能群均筛选出主要影响的环境因子. C与环境因子(TN、PO43--P、CaO)、P与环境因子(NO2--N、SD、CODMn)、TB与pH的相关系数分别为0.999、0.978、0.891,P均小于0.005. MP与环境因子(SD、CaO)、B与NO2--N、X3与SiO2的相关系数分别为0.875、0.710、0.676,P均小于0.05. MP与C类群共同的主要影响环境因子为CaO,MP与P类群共同的主要影响环境因子为SD,B与P类群共同的主要影响环境因子为NO2--N.
| 表 2 不同水情期汝溪河底栖硅藻功能类群藻密度与环境因子的逐步回归分析 Tab.2 Stepwise multiple regression between densities of benthic diatom functional classification and environmental factors in Ruxi River during different water periods |
平水期,除LO、TB外,其余功能群均筛选出主要影响的环境因子. MP与环境因子(SPC、TN、TP、NO2--N、SiO2)、B与环境因子(SD、NH4+-N)、P与环境因子(DO、NO3--N、ORP)的相关系数分别为1.000、0.990、0.989,P均小于0.001. X3与环境因子(Tur、PO43--P、CODMn)、C与PO43--P的相关系数分别为0.958、0.811,P均小于0.01. D与环境因子T的相关系数为0.735,P小于0.05. C与X3共同的主要影响环境因子为PO43--P (表 2).
枯水期,除LO、B、C、P外,其余功能群均筛选出主要影响的环境因子. TB与环境因子(T、NO3--N、PAR、pH、SD、CODMn)、MP与环境因子NO2--N的相关系数分别为1.000、0.929,P均小于0.001. X3与环境因子ORP、D与环境因子PAR的相关系数为0.729、0.750,P均小于0.05. TB与D共同的主要影响环境因子为PAR(表 2).
方差分析结果(表 3)显示,在丰水期,B、C、MP、P、TB、X3类群的F值范围为5.892~37.122,6个类群受环境因素的影响较大;在平水期,B、C、D、MP、P、X3类群的F值范围为8.229~795.697,受环境因素的影响较大;在枯水期,D、MP、TB、X3类群的F值范围为7.926~15589.766,4个类群受环境因素的影响较大.
| 表 3 不同时期汝溪河底栖硅藻功能群藻密度受环境因子影响的单因素方差分析统计结果 Tab.3 ANOVA for effects of environmental factors on the densities of benthic diatom functional classifications in Ruxi River during different hydrological periods |
为了分析环境因子对不同时期功能群生物量的影响,利用RDA分析了不同时期功能群藻密度与环境因子的相关性.结果发现,丰水期时,RDA分析结果是种类与环境因子排序轴的相关性系数为1,前两轴特征值分别为0.605、0.212,物种—环境关系的累积百分率为81.7 % (表 4).在排序图中(图 3),与轴1相关性最大的正相关因子是SPC,相关系数为0.5657;与轴1相关性最大的负相关因子是NO2--N,相关系数为-0.6202.与轴2相关性最大的正相关因子是TN,相关系数为0.6368;与轴2相关性最大的负相关因子是V,相关系数为-0.6519.功能群B、C、D、MP、P、TB、X3的藻密度与环境因子NO2--N、TN呈正相关,与环境因子SPC、V呈负相关; 功能群LO的藻密度与环境因子SPC、V呈正相关,与环境因子NO2--N、TN呈负相关.
| 表 4 不同时期汝溪河底栖硅藻功能类群藻密度与主要环境因子间的RDA分析 Tab.4 The major environmental factors affecting densities of benthic diatom functional classification by RDA analysis in Ruxi River during different water periods |

|
图 3 不同时期功能群藻密度与环境因子RDA排序图:(a)丰水期;(b)平水期;(c)枯水期 Fig.3 The RDA diagrams between environmental factors and densities of benthic diatoms functional classifications in Ruxi River during different water periods: (a) high water period; (b) level water period; (c) low water period |
平水期, RDA分析结果是种类与环境因子排序轴的相关性系数为1,前两轴特征值分别为0.344、0.296,物种—环境关系的累积百分率为64.0 %.在排序图中,与轴1相关性最大的正相关因子是PO43--P,相关系数为0.6941;与轴1相关性最大的负相关因子是CaO,相关系数为-0.6267.与轴2相关性最大的正相关因子是CODMn,相关系数为0.7741;与轴2相关性最大的负相关因子是NH4+-N,相关系数为-0.7329.功能群TB、X3、LO的藻密度与PO43--P、NH4+-N呈正相关,与环境因子呈负相关CODMn、CaO; 功能群C、MP的藻密度与CaO、NH4+-N呈正相关,与PO43--P、CODMn呈负相关.功能群D、P的藻密度与CaO、CODMn呈正相关,与PO43--P、NH4+-N呈负相关; 功能群B的藻密度与PO43--P、CODMn呈正相关,与CaO、NH4+-N呈负相关.
枯水期,RDA分析结果是种类与环境因子排序轴的相关性系数为1,前两轴特征值分别为0.279、0.253,物种—环境关系的累积百分率为53.2 %.在排序图中,与轴1相关性最大的正相关因子是SPC,相关系数为0.5880;与轴1相关性最大的负相关因子是DO,相关系数为-0.5515.与轴2相关性最大的正相关因子是PO43--P,相关系数为0.4794;与轴2相关性最大的负相关因子是SD,相关系数为-0.5574.功能群B、MP、X3的藻密度与环境因子DO、PO43--P呈正相关,与环境因子SPC、SD呈负相关; 功能群LO、TB的藻密度与环境因子SPC、SD呈正相关,与环境因子DO、PO43--P呈负相关; 功能群C、D的藻密度与环境因子DO、SD呈正相关,与环境因子SPC、PO43--P呈负相关; 功能群P藻密度与环境因子SPC、PO43--P呈正相关,与环境因子DO、SD呈负相关.
3 讨论由于许多物种往往代表着一定的生境类型,因此基于传统藻类分类单元进行水体生态学的研究已经被广泛应用[21].然而,藻类对环境的反应往往依赖于地理环境或栖息地特征,Kelly认为由于地理环境或栖息地的变化可能导致相同的物种出现不一样的结果[22],甚至同一物种生态型出现不同的生态特征[23].因此,基于传统的藻类分类单元研究水生生态系统一直受到质疑[22].而功能性状特征能够反映真实的生态环境条件,近年来在国外水体生态系统评价中经常被报道,如:Passy提出的“guild”功能群[24],Reynolds提出的“function group”[2]. “guild”和“function group”是同义词,本质上都是基于功能性状提出的分类单元,两者区别在于前者强调资源共用,而后者强调生态功能相似.由于Blondel认为“guild”更多应用在动物方面[25],因此,功能群“function group”常被用于藻类学. Becker利用浮游植物功能群对地中海水库的浮游植物驱动特征进行研究,证实了浮游植物功能群具有潜在用途,能够为了解藻类生长的策略、适应和耐受等特性以及水库浮游植物动力学提供信息[3].先前功能群的研究主要基于浮游植物提出的浮游植物功能群的概念,却很少用于底栖藻类,特别是底栖硅藻的研究.然而,底栖硅藻分布广泛、便于采集, 繁殖快、生长周期短且对水体中理化环境的变化反应迅速、能快速敏锐地做出反应的特点[12-13],如果能更好地确定功能特性与环境因子相关性,用其作为水生生态系统研究将具有很好的应用价值[21].本文利用功能群对汝溪河开展了研究,发现汝溪河中有近缘桥弯藻(Cymbella affinis)、披针形舟形藻(Navicula lanceolata)等为优势种,均属于功能群中的MP类群;通过汝溪河3个水情期环境因子分析得到,透明度均值为0.59 m、流速均值为0.11 m/s,这与MP类群的生境特征相符. Reynolds[2]研究表明,由于物种的选择性,比表面积大且能耐受低光照的硅藻(如MP类群为典型代表)利于生活在水体浑浊环境中.受三峡库区周期性蓄水变动的影响,库区支流水体悬浮颗粒物搅拌频繁,因此,汝溪河3个水情期底栖硅藻功能群中均以MP占主(表 1).这一结果也支持了闵文武等[26]对渭河流域不同时期浮游植物功能群的研究结论.
电导率是天然水体中总离子浓度指数,是影响底栖硅藻群落组成与分布的一个重要因素[26-27],本次研究发现丰水期和枯水期不同功能群的藻密度与电导率均有相关性(表 2),其中占优势地位的MP类群藻密度与电导率呈正相关(图 3). Leira等研究发现水体中电导率变化与营养物质浓度呈正相关[29],即电导率越高,营养物质浓度越高,水体越浑浊,MP类群喜好生长于频繁搅动、浑浊水体,伴随电导率的升高,该生境更利于MP类群生长,这一结果也支持了功能群能够很好地应用于底栖硅藻的研究. Stevenson等[30]研究指出水体pH与硅藻群落组成间有一定的相关性.本次研究测定3个水情时期pH变化区间在7.93~10.11之间,水体呈碱性,跨度变化在碱性区间,逐步回归分析发现丰水期时TB类群与pH呈正相关,(表 2),这表明汝溪河流域中底栖硅藻功能群TB对pH耐受较强[31].温度也是影响硅藻分布的因素之一[32],本研究发现D功能群(表 2)与水温有相关性,李磊等[11]对阿哈水库的研究中也发现D功能群与温度有关,在一定温度范围,温度升高,光照增加,从而促进光合作用,利于D功能群生长繁殖. N和P被视为影响硅藻群落的因素之一[33],同时也是水体生态质量的重要指标,本次研究中,平水期(8月份)NO2--N浓度范围为0.0072~0.0197 mg/L,普遍低于丰水期和枯水期,MP的藻密度也较丰水期和枯水期小. Becker等[3]研究表明功能群C与水体中可溶性磷浓度呈负相关,本次研究中,平水期与枯水期的排序分析(图 3)和逐步回归分析(表 2)均表明, 汝溪河底栖硅藻功能群C的藻密度与PO43--P浓度呈负相关,PO43--P浓度越高,该栖息地的功能群C的藻密度越小,反之则越大,这与Becker等[3]的研究结果一致.
4 结论1) 汝溪河流域中共鉴定出硅藻168种,划分出8个功能群,在种类水平上,3个时期均以MP类群占主导地位,其次为D类群;在藻密度水平上,丰水期中MP类群占绝对优势,其次为C类群,平水期中MP类群占绝对优势,其次为P类群,枯水期中MP类群占绝对优势,其次为D类群,总体来看3个时期均以MP类群占主导优势地位.
2) 通过分析结果得到,NO2--N、SPC、PO43--P、CODMn、T是影响汝溪河底栖硅藻不同功能群的主要环境因子,其中功能群MP主要受到NO2--N、SPC的影响,功能群C主要受到PO43--P的影响,功能群D主要受到T的影响.
致谢: 感谢许金铸师兄、杨燕君师姐和徐沙师姐对本次野外实验和室内藻类鉴定的辛苦付出.| [1] |
Li Guocheng, Liu Lusan, Li Li et al. Applications of diatom in river health assessment:A review. Chinese Journal of Applied Ecology, 2012, 23(9): 2617-2624. [李国忱, 刘录三, 李黎等. 硅藻在河流健康评价中的应用研究进展. 应用生态学报, 2012, 23(9): 2617-2624.] |
| [2] |
Dong Jing, Li Yanhui, Li Genbao et al. Seasonal dynamics characteristics and affecting physical factors of phytoplankton functional groups in Dongjiang River. Acta Hydrobiologica Sinica, 2013, 37(5): 836-843. [董静, 李艳晖, 李根保等. 东江水系浮游植物功能群季节动态特征及影响因子. 水生生物学报, 2013, 37(5): 836-843. DOI:10.7541/2013.107] |
| [3] |
Becker V, Caputo L, Ordóñez J et al. Driving factors of the phytoplankton functional groups in a deep Mediterranean reservoir. Water Research, 2010, 44(11): 3345-3354. DOI:10.1016/j.watres.2010.03.018 |
| [4] |
Reynolods CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24: 417-428. DOI:10.1093/plankt/24.5.417 |
| [5] |
Hu Ren, Lan Yuqian, Xiao Lijuan et al. The concepts classification and application of freshwater phytoplankton functional groups. J Lake Sci, 2015, 27(1): 11-23. [胡韧, 蓝于倩, 肖利娟等. 淡水浮游植物功能群的概念、划分方法和应用. 湖泊科学, 2015, 27(1): 11-23. DOI:10.18307/2015.0102] |
| [6] |
Padisák J, Crossetti LO, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification:A critical review with updates. Hydrobiologia, 2009, 621(1): 1-19. DOI:10.1007/s10750-008-9645-0 |
| [7] |
Chen Xiaojiang, Yang Ji, Liu Bo et al. Relationships between environmental variables and seasonal succession in phytoplankton functional groups in the Guanting Reservoir. Environmental Monitoring in China, 2016, 32(3): 74-81. [陈晓江, 杨劼, 刘波等. 官厅水库浮游植物功能群季节演替及其驱动因子. 中国环境监测, 2016, 32(3): 74-81.] |
| [8] |
Crossetti LO, Becker V, Cardoso LDS et al. Is phytoplankton functional classification a suitable tool to investigate spatial heterogeneity in a subtropical shallow lake?. Limnologica-Ecology and Management of Inland Waters, 2013, 43(3): 157-163. DOI:10.1016/j.limno.2012.08.010 |
| [9] |
Devercelli M, Farrell IO. Factors affecting the structure and maintenance of phytoplankton functional groups in a nutrient rich lowland river. Limnologica-Ecology and Management of Inland Waters, 2013, 43(2): 67-78. DOI:10.1016/j.limno.2012.05.001 |
| [10] |
Xiao LJ, Wang T, Hu R et al. Succession of phytoplankton functional groups regulated by monsoonal hydrology in a large canyon-shaped reservoir. Water Research, 2011, 45(16): 5099-5109. DOI:10.1016/j.watres.2011.07.012 |
| [11] |
Li Lei, Li Qiuhua, Jiao Shulin et al. Spatial and temporal distribution characteristics of phytoplankton functional groups in Aha Reservoir and their influencing factors. Acta Scientiae Circumstantiae, 2015, 35(11): 3604-3611. [李磊, 李秋华, 焦树林等. 阿哈水库浮游植物功能群时空分布特征及其影响因子分析. 环境科学学报, 2015, 35(11): 3604-3611.] |
| [12] |
O'Driscoll C, Eyto ED, Rodgers M et al. Diatom assemblages and their associated environmental factors in upland peat forest rivers. Ecological Indicators, 2012, 18: 443-451. DOI:10.1016/j.ecolind.2011.12.008 |
| [13] |
Benito X, Trobajo R, Ibáñez C. Benthic diatoms in a Mediterranean delta:ecological indicators and a conductivity transfer function for paleoenvironmental studies. Journal of Paleolimnology, 2015, 54(2/3): 171-188. |
| [14] |
Delgado C, Pardo I, García L. Diatom communities as indicators of ecological status in Mediterranean temporary streams (Balearic Islands, Spain). Ecological Indicators, 2012, 15(1): 131-139. DOI:10.1016/j.ecolind.2011.09.037 |
| [15] |
Qiu Guangsheng, Hu Sheng, Ye Dan et al. Investigation on the present situation of eutrophication and water bloom in the branches of Three Gorges Reservior. Resources and Environment in the Yangtze Basin, 2011, 20(3): 311-316. [邱光胜, 胡圣, 叶丹等. 三峡库区支流富营养化及水华现状研究. 长江流域资源与环境, 2011, 20(3): 311-316.] |
| [16] |
Li Renfang, Zhang Xinwei. Investigation on water quality of the Ruxi River in the Zhong County of Chongqing Municipality. Environment and Ecology in the Three Gorges, 2011, 33(2): 10-12. [李仁芳, 张信伟. 忠县汝溪河流域水质现状调查. 三峡环境与生态, 2011, 33(2): 10-12.] |
| [17] |
Delgado C, Pardo I. Comparison of benthic diatoms from Mediterranean and Atlantic Spanish streams:Community changes in relation to environmental factors. Aquatic Botany, 2015, 120: 304-314. DOI:10.1016/j.aquabot.2014.09.010 |
| [18] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and Wastewater Monitoring and Analysis Methods:4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.]
|
| [19] |
Liu Zugen, Zhang Zhu, Zhang Meng et al. Classsification of functional groups and community structure of phytoplankton in the Ganjiang River. Resources and Environment in the Yangtze Basin, 2012, 21(3): 375-384. [刘足根, 张柱, 张萌等. 赣江流域浮游植物群落结构与功能类群划分. 长江流域资源与环境, 2012, 21(3): 375-384.] |
| [20] |
Jan L, Peter S. Multivariate analysis of ecological data using Canoco. Cambridge: Cambridge University Press, 2003.
|
| [21] |
Tapolczai K, Bouchez A, Stenger-Kovenger-Kovács C et al. Trait-based ecological classifications for benthic algae:Review and perspectives. Hydrobiologia, 2016, 776(1): 1-17. DOI:10.1007/s10750-016-2736-4 |
| [22] |
Kelly M. Data rich, information poor? Phytobenthos assessment and the Water Framework Directive. European Journal of Phycology, 2013, 48: 437-450. DOI:10.1080/09670262.2013.852694 |
| [23] |
Neilan BA, Jacobs D, Goodman AE. Genetic diversity and phylogeny of toxic cyanobacteria determined by DNA polymorphisms within the phycocyanin locus. Applied and Environmental Microbiology, 1995, 61: 3875-3883. |
| [24] |
Passy SI. Diatom ecological guilds display distinct and predictable behavior along nutrient and disturbance gradients in running waters. Aquatic Botany, 2007, 86: 171-178. DOI:10.1016/j.aquabot.2006.09.018 |
| [25] |
Blondel J. Guilds or functional groups:does it matter?. Oikos, 2003, 100: 223-231. DOI:10.1034/j.1600-0706.2003.12152.x |
| [26] |
Min Wenwu, Wang Peipei, Li Lijuan et al. Relationship between phytoplankton functional groups and environmental factors in the Wei River Basi. Research of Environmental Sciences, 2015, 28(9): 1397-1406. [闵文武, 王培培, 李丽娟等. 渭河流域浮游植物功能群与环境因子的关系. 环境科学研究, 2015, 28(9): 1397-1406.] |
| [27] |
Dalu T, Richoux NB, Froneman PW. Distribution of benthic diatom communities in a permanently open temperate estuary in relation to physico-chemical variables. South African Journal of Botany, 2015, 107: 31-38. |
| [28] |
Urrea G, Sabater S. Epilithic diatom assemblages and their relationship to environmental characteristics in an agricultural watershed (Guadiana River, SW Spain). Ecological Indicators, 2009, 9(4): 693-703. DOI:10.1016/j.ecolind.2008.09.002 |
| [29] |
Leira M, Sabater S. Diatom assemblages distribution in catalan rivers, NE Spain, in relation to chemical and physiographical factors. Water Research, 2005, 39(1): 73-82. DOI:10.1016/j.watres.2004.08.034 |
| [30] |
Liu S, Xie G, Wang L et al. Different roles of environmental variables and spatial factors in structuring stream benthic diatom and macroinvertebrate in Yangtze River Delta, China. Ecological Indicators, 2016, 61: 602-611. DOI:10.1016/j.ecolind.2015.10.011 |
| [31] |
Zhang Meng, Deng Daogui, Huang Dan et al. Functional group diversity of planktonic diatoms and the driving pattern of water-period guild succession in Ganjiang River Basin. Research of Environmental Sciences, 2016, 29(5): 680-691. [张萌, 邓道贵, 黄丹等. 赣江流域浮游硅藻功能群多样性及其水期演替的驱动特征. 环境科学研究, 2016, 29(5): 680-691.] |
| [32] |
Patil JS, Anil AC. Temporal variation of diatom benthic propagules in a monsoon-influenced tropical estuary. Continental Shelf Research, 2008, 28(17): 2404-2416. DOI:10.1016/j.csr.2008.06.001 |
| [33] |
Zhang Y, Huo S, Li R et al. Diatom taxa and assemblages for establishing nutrient criteria of lakes with anthropogenic hydrologic alteration. Ecological Indicators, 2016, 67: 166-173. DOI:10.1016/j.ecolind.2016.02.048 |
 2017, Vol. 29
2017, Vol. 29 

