(2: 中国科学院大学, 北京 100049)
(3: 江苏省区域现代农业与环境保护协同创新中心, 淮阴 223300)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Collaborative Innovation Center of Modern Agriculture and Environmental Protection in Jiangsu Province, Huaiyin 223300, P. R. China)
由于化石燃料的大量使用,大气CO2浓度已经从工业化前的280 ppm上升到400 ppm,预计到21世纪末将会上升到700~1000 ppm[1].大气CO2浓度升高会导致水体碳化学发生一系列的变化,如pH值下降、溶解性CO2和HCO3-浓度升高[2].与海洋相比,淡水生态系统如湖泊和河流等具有更小的碱度和缓冲能力,大气CO2浓度增加对于淡水水体碳化学环境的影响将更大[3]. CO2的水气扩散速度通常小于浮游植物对CO2的固定速度[4],作为自然水体中浮游植物的直接碳源,CO2是浮游植物生长的限制因素之一,水体碳化学环境改变会影响浮游藻类的生理生态特性和生活史, 因此CO2浓度升高会对浮游藻类有重要的影响[5].
浮游藻类在全球生物地球化学循环中具有重要的作用,其化学计量值已经引起人们的广泛关注[6].浮游藻类的C、N、P营养元素比例决定了浮游藻类作为浮游动物的食物质量,从而对水生态系统中食物网的结构和功能产生级联效应(cascading effects)[7].浮游藻类元素化学计量值对CO2水平上升的响应可能与生态系统的营养状况有关.已有研究表明CO2上升仅仅在低营养盐水平下会改变浮游藻类化学计量值[8],也有研究表明C、N、P元素比值会随着CO2水平的升高而升高[9],但在低营养水平下升高的程度更明显[10],因此仍需要更多的研究进一步探究这个问题.
目前已有一些纯培养的实验来研究CO2浓度变化对浮游藻类化学计量值的影响[7, 9-11],但这些结果很难被推广到自然生态系统中.在全球气候变化和富营养化的背景下,理解并预测多个因素的多重影响,如CO2浓度和营养盐浓度升高对水生生态系统的影响显得尤为迫切.本研究在梅梁湾和东太湖2个营养水平有差异的太湖湖区,进行不同CO2水平的原位培养实验,揭示CO2浓度变化对不同营养水平环境中浮游藻类元素化学计量值的影响,为准确预测未来湖泊生态系统演变机制和过程提供科学依据.
1 材料与方法 1.1 原位实验四季原位模拟实验分别在太湖生态系统研究站(2012年4、7、9、12月)和东山站(2013年8、11月和2014年1、4月)进行.将预先通过80 μm筛网(去除大型浮游动物)的梅梁湾和东太湖的湖水,置于200 L的聚乙烯实验大桶内,并将其分别放置在太湖站和东山站附近的人工水池内,保证实验期间水温和光照条件与太湖一致.设置3个CO2浓度:270 ppm(工业化前水平),由当地空气通过碳酸钠溶液吸收获取;380 ppm(现有水平),直接鼓入空气;750 ppm(预测2100年将要达到的水平),用CO2加富器(CO2 enrichlor CE-300, China)将空气和纯CO2混合制备而成.3种CO2浓度的空气通过气石从大桶底部鼓入水体,每个CO2浓度梯度设置3个平行.用CO2分析仪(Testo 535,Germany,仪器的误差范围±50 ppm)跟踪并及时修正CO2浓度(CO2浓度变化幅度低于5 %),鼓气速率为1.0 L/min.实验期间每日在桶内添加营养盐(KH2PO4、NH4Cl和NaNO3的溶液)确保桶内和太湖水体的营养盐水平基本一致.实验期间每日采样测定水体理化和营养盐参数,每隔3 d采样测定元素组成和浮游藻类组成,样品为实验装置内的混合样.
1.2 水样测定与分析现场用多参数水质分析仪(Model 6600; Yellow Spring Instruments, USA)测定水体pH值、水温、溶解氧和电导率等水体理化参数.铵态氮(NH4+-N)、硝态氮(NO3--N)、磷酸盐(PO43--P)浓度用连续流动漂流仪(Skalar SA1000, Breda, Netherlands)测定.总氮(TN)、总磷(TP)、总溶解性氮(TDN)和总溶解性磷(TDP)浓度用过硫酸钾氧化法测定[12].
1.3 元素组成分析取1 L水样过滤到预先称重过的GF/F玻璃纤维滤膜(Whatman,马弗炉中500℃灼烧12 h)上,用5 ml 0.17 mol/L Na2SO4溶液冲洗滤膜3次,保存于-20℃.颗粒性有机碳(POC)和颗粒性有机氮(PON)浓度用元素分析仪测定:将滤膜置于含浓盐酸蒸气的干燥器中熏蒸8 h以上, 以去除其中的无机碳.取出滤膜, 置于电热恒温箱中, 45℃温度下烘干, 将烘干后的膜研磨,在元素分析仪(EA3000,Italy)上测定POC、PON浓度.总颗粒性磷(TPP)与TP浓度测定方法一致,1 %过硫酸钾溶液消解后,采用钼酸铵分光光度法测定(GB11893-1989).
1.4 浮游藻类分析取500 ml水样用鲁哥试剂(终浓度1 %)固定,在显微镜下观察计数.计数时仅关注优势种,且只鉴别到属的水平.
1.5 数据分析用SPSS16.0和Origin 8.0软件进行统计分析和绘图.其中统计学检验(t-test,ANOVA)中P < 0.05表示存在显著性差异.所有参数均表示为算数平均值±标准差(SD).
2 结果梅梁湾湖区春季浮游藻类主要是绿藻门、硅藻门、蓝藻门,优势属分别是转板藻(Mougeotia)、针杆藻(Synerdra)和微囊藻(Microcystis),其他3个季节微囊藻的细胞丰度对总浮游藻类的贡献率均超过了90 %.东太湖春、夏、秋季的浮游藻类主要是蓝藻和绿藻,其中鱼腥藻(Anabaena)、微囊藻、栅藻(Scenedesmus)、小球藻(Chlorella)和空星藻(Coelastrum)是主要的优势属,冬季浮游藻类主要是硅藻门和金藻门,其中小环藻和金粒藻(Chrysococsus)是优势属.
太湖梅梁湾水体的TDN和TN浓度显著高于东太湖,特别是NH4+-N浓度相对较高,冬季为0.70 mg/L,其他季节也在0.30 mg/L左右,而东太湖水体TDN主要由NO3--N组成,全年浓度在0.35~0.58 mg/L之间,其中春季浓度最高.此外梅梁湾水体TP浓度也基本高于东太湖水体,但东太湖TDP和PO43--P浓度在春、夏、秋季略高于梅梁湾,东太湖PO43--P浓度在0.075~0.140 mg/L之间,梅梁湾PO43--P浓度处于0.02~0.14 mg/L之间(图 1).
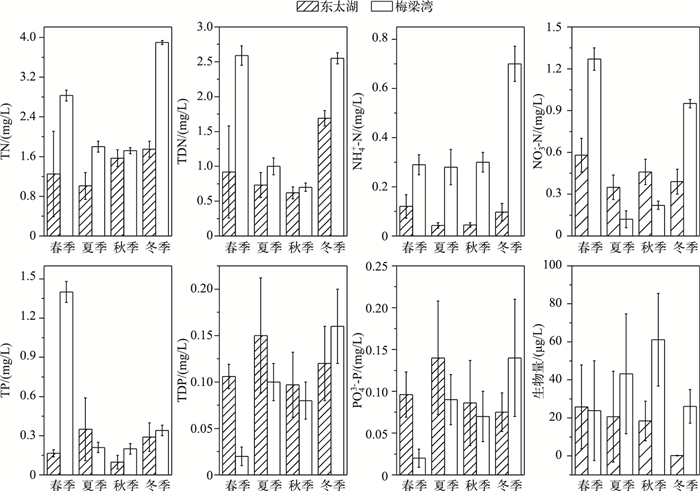
|
图 1 东太湖和梅梁湾原位实验中营养盐浓度和生物量季节变化 Fig.1 Nutrient concentrations and biomass in microcosms of East Taihu and Meiliang Bay |
梅梁湾原位实验中,浮游藻类C含量季节差异较大,秋季达到最大值400 mg/g(DW),冬季则低于检测限,春、夏季浮游藻类C含量在750 ppm CO2浓度下显著高于其他两组处理(图 2).东太湖原位实验中浮游藻类C含量全年差异性较小,普遍高于梅梁湾(秋季除外),处于50~300 mg/g(DW)之间.梅梁湾原位实验中浮游藻类N含量在秋季达到最高值(47 mg/g(DW)),冬季低于检测极限,普遍低于东太湖浮游藻类N含量.此外750 ppm CO2浓度时梅梁湾浮游藻类N含量在夏、秋季有所升高,而东太湖浮游藻类N含量在冬季则有所下降(图 2).梅梁湾原位实验中,浮游藻类P含量最高出现在夏季,达到1.94 mg/g(DW),春季最低,为0.78 mg/g(DW),东太湖春、夏、秋季实验中浮游藻类P含量平均水平均在15 mg/g(DW)左右,冬季下降到0.78 mg/g(DW),明显高于梅梁湾实验中浮游藻类P含量.此外除了东太湖春季实验,CO2水平升高没有改变浮游藻类P含量(图 2).
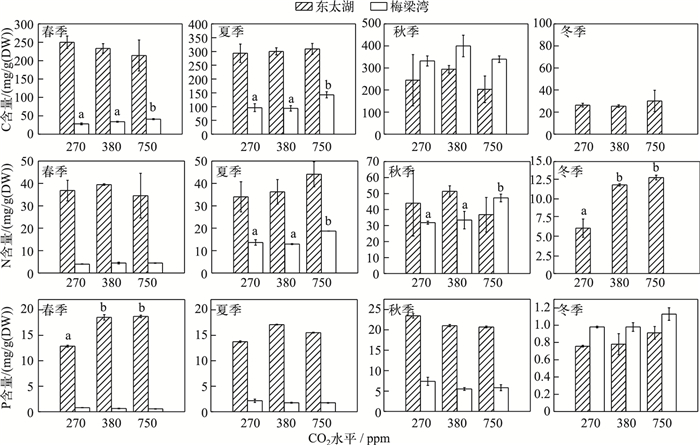
|
图 2 东太湖和梅梁湾浮游藻类C、N、P含量 Fig.2 C, N, P contents of phytoplankton in East Taihu and Meiliang Bay |
浮游藻类元素计量值C :P比在梅梁湾培养实验中处于86~211之间,而在东太湖原位实验中处于25~98之间,梅梁湾四季浮游藻类C :P比均高于东太湖浮游藻类C :P比.此外随着CO2浓度的升高,梅梁湾浮游藻类C :P比在春、夏、秋季均有升高,其中春季的升高程度最大,东太湖浮游藻类C :P比在春季随着CO2浓度的升高有所下降,而在其它季节无显著变化.梅梁湾实验中浮游藻类N :P比在春、夏、秋季处于9~24之间,季节间差异不大,而东太湖原位实验中浮游藻类N :P比在春、夏、秋季相对较低,比值为5左右,冬季则上升到最高值(34).另外随着CO2水平的上升,梅梁湾浮游藻类N :P比在春、夏、秋季也随之升高,然而东太湖浮游藻类N :P比仅在春季略有下降,其他季节没有明显的变化(图 3).

|
图 3 东太湖和梅梁湾浮游藻类C :P比和N :P比 Fig.3 The ratios of C :P and N :P of phytoplankton in East Taihu and Meiliang Bay |
梅梁湾是重污染湖区,水体浊度高,从春末到初秋蓝藻水华频频发生[13], 而太湖东部湖区是草型湖区,水质较清,无脊椎动物和鱼类多样性丰富[14],因此这2个湖区生态环境差异较大.水体营养盐的测定结果表明,梅梁湾水体营养盐浓度在全年均高于东太湖,只有可溶性磷和PO43--P浓度在某些季节低于东太湖水体.特别是夏、秋季水华期间,由于较强的反硝化作用[15],梅梁湾水体NH4+-N浓度相对较高. NH4+-N比NO3--N更有利于蓝藻的生长[16-17], 这可能是梅梁湾湖区微囊藻占优势的原因之一.
虽然梅梁湾水体营养浓度较高,但由于浮游藻类生物量大,需要大量的营养盐支持其生长和生物量的维持,因此浮游藻类仍然受到营养盐的限制.已有研究表明[18]梅梁湾浮游藻类在春、冬季主要是P限制,夏、秋季受N和P的双重限制.虽然东太湖营养水平低于梅梁湾,但浮游藻类生物量也相对较低,因此N、P等营养盐可能不是其限制因子. Xu等[19]的研究结果表明,东太湖浮游藻类的主要限制因子是铁,添加N或(和)P都没有影响藻类生长.本研究结果表明,东太湖浮游藻类营养盐元素含量普遍高于梅梁湾浮游藻类营养盐元素含量(图 1),进一步验证了虽然梅梁湾水体中营养盐浓度高,但浮游藻类的营养限制程度更高.此外,与东太湖相比,梅梁湾湖区的颗粒性C、N、P含量表现出较高的季节差异.由于水体营养盐环境能满足浮游藻类生长的程度有很大差别,通常淡水生态系统中颗粒态元素组成差异性大[20].由于受N或P限制的影响,浮游藻类细胞内的N、P含量可能会在几个数量级内变化[3].因此梅梁湾浮游藻类元素含量季节差异大进一步说明该湖区的浮游藻类在不同季节受到的限制因子有所不同,而东太湖浮游藻类元素含量相对变化小,也说明该湖区浮游藻类受C、N、P的限制更小.
3.2 CO2浓度升高对浮游藻类元素计量值的影响现有研究结果表明浮游藻类元素化学计量值对CO2浓度上升的响应趋势和程度与水体营养状态有很大关系[10]. CO2浓度升高会使浮游藻类C :N比或C :P比升高[3, 11], 特别是在低营养状态下升高程度更大[8, 21].但也有研究表明CO2浓度变化没有影响元素化学计量值[11, 22].本研究选取梅梁湾和东太湖两个营养状态不同的湖区.梅梁湾原位实验结果表明,CO2浓度升高使浮游藻类C :P比明显升高,N :P比略有增加,而在东太湖原位实验中浮游藻类元素化学计量值没有明显的变化.虽然东太湖水体营养盐浓度普遍低于梅梁湾水体营养盐浓度,但CO2浓度升高并没有对东太湖浮游藻类元素计量值有很大的影响,相反的,梅梁湾浮游藻类元素计量值对CO2浓度升高的响应更明显.由于梅梁湾湖区浮游藻类受N、P限制的程度高于东太湖浮游藻类,因此本研究结果表明,当浮游藻类的生长受水体营养盐浓度限制时,浮游藻类元素化学计量值对CO2浓度变化的响应更大,而与水体营养盐浓度的绝对值没有太大关系.
此外藻细胞内的营养盐比例可以反映其生存环境下的营养盐比例[23].梅梁湾湖区水体中TDN :TDP比相对较高,因此梅梁湾原位实验中浮游藻类N :P比普遍高于东太湖.浮游藻类的N :P比一方面受水体N :P比的影响,另一方面也受藻生长速率的影响.通常藻的N :P比与水体N :P比呈显著正相关,但当藻的生长速率比较高时,藻的N :P比与水体N :P比的关系不大[24]. Reinfelder[25]认为水体颗粒态物质元素计量值,如C :N比、C :P比和N :P比随CO2浓度的升高而升高,更多的是因为颗粒态N或P含量会随CO2浓度的变化而变化,而不是因为C含量发生变化.太湖梅梁湾的实验结果表明,元素比值(C :N比、C :P比和N :P比)随着CO2浓度的升高而上升,可以归因于藻细胞内C和/或N含量的变化.
梅梁湾湖区春季浮游藻类多样性最高,主要是绿藻门、硅藻门、蓝藻门,优势属分别是转板藻、针杆藻和微囊藻,其他3个季节微囊藻的细胞丰度对总浮游藻类的贡献率均超过了90 %,CO2浓度升高没有对微囊藻的数量有显著影响[26].东太湖春、夏、秋季的浮游藻类主要是蓝藻门和绿藻门,其中鱼腥藻、微囊藻、栅藻、小球藻和空星藻是主要的优势属,冬季浮游藻类主要是硅藻门和金藻门,其中小环藻和金粒藻是优势属.结果表明CO2浓度升高对藻的影响非常复杂,存在种间或种内的差异. CO2浓度升高有利于蓝藻门鱼腥藻和绿藻门空星藻的生长[26].不同种类的浮游藻类其细胞内的元素组成存在很大的差异,当水体营养盐不足以满足浮游藻类生长的条件下,浮游藻类元素计量值的可变化幅度在一定程度上决定了该藻的生存和生长能力,变化幅度大的藻比变化幅度小的藻更具有竞争力[23, 27].此外随着CO2浓度的变化,不同种类藻对胞内元素含量的调整策略存在差异,例如CO2浓度的上升可使绿藻纲,如衣藻(Chlamydomonas)和小球藻(Chlorella)细胞内蛋白质含量或N含量升高[28],但颗石藻(Emiliania huxleyi)的元素化学计量值并没有随CO2浓度的变化发生改变[9].梅梁湾原位实验中,春季和夏季随着CO2浓度的上升,浮游藻类C :P比有明显的增加,也可能是春、夏季梅梁湾主要优势属转板藻和微囊藻,对CO2浓度变化的响应更大,但目前还没有CO2升高对转板藻元素计量值影响的研究,而室内CO2浓度升高对微囊藻的影响也只是聚焦在对微囊藻生长和光合活性的影响.
致谢: 感谢中国科学院太湖生态系统研究站提供的实验平台;也感谢赵旭辉和魏利军在实验期间给予的帮助.| [1] |
IPCC. Summary for Policymakers of Climate Change 2007:The Physical Science Basis, Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press, 2007.
|
| [2] |
Godbold JA, Calosi P. Ocean acidification and climate change:advances in ecology and evolution. Philosophical Transactions of the Royal Society B, 2013, 368(1627): 1-5. |
| [3] |
Fu FX, Warner ME, Zhang Y et al. Effects of increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (Cyanobacteria). Journal of Phycology, 2007, 43(3): 485-496. DOI:10.1111/jpy.2007.43.issue-3 |
| [4] |
Papista E, Acs E, Boeddi B. Chlorophy-a determination with ethanol-A critical test. Hydrobiologia, 2002, 485: 191-198. DOI:10.1023/A:1021329602685 |
| [5] |
Riebesell U, Wolfgladrow DA, Smetacek V. Carbon-dioxide limitation of marine-phytoplankton growth rates. Nature, 1993, 361(6409): 249-251. DOI:10.1038/361249a0 |
| [6] |
Klausmeier CA, Litchman E, Daufresne T et al. Phytoplankton stoichiometry. Ecological Research, 2008, 23(3): 479-485. DOI:10.1007/s11284-008-0470-8 |
| [7] |
Burkhardt S, Zondervan I, Riebesell U. Effect of CO2 concentration on C:N:P ratio in marine phytoplankton:A species comparison. Limnology and Oceanography, 1999, 44: 683-690. DOI:10.4319/lo.1999.44.3.0683 |
| [8] |
Li W, Gao K, Beardall J. Interactive effects of ocean acidification and nitrogen-limitation on the diatom Phaeodactylum tricornutum. PLoS ONE, 2012, 7(12): 1-8. DOI:10.1371/journal.pone.0051590 |
| [9] |
Verschoor AM, Van Dijk MA, Huisman J. Elevated CO2 concentrations affect the elemental stoichiometry and species composition of an experimental phytoplankton community. Freshwater Biology, 2013, 58(3): 597-611. DOI:10.1111/fwb.2013.58.issue-3 |
| [10] |
Verspagen JMH, Van de Waal DB, Finke JF. Contrasting effects of rising CO2 on primary production and ecological stoichiometry at different nutrient levels. Ecology Letters, 2014, 17(8): 951-960. DOI:10.1111/ele.12298 |
| [11] |
Engel A, Zondervan I, Aerts K et al. Testing the direct effect of CO2 concentration on a bloom of the coccolithophorid Emiliania huxleyi in mesocosm experiments. Limnology and Oceanography, 2005, 50(2): 493-507. DOI:10.4319/lo.2005.50.2.0493 |
| [12] |
Ebina J, Tsutsui T, Shirai T. Simultaneous determination of total nitrogen and total phosphorus in water using peroxodisulfate oxidation. Water Research, 1983, 17(12): 1721-1726. DOI:10.1016/0043-1354(83)90192-6 |
| [13] |
Liu X, Lu X, Chen Y. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China:An 11-year investigation. Harmful Algae, 2011, 10(3): 337-343. DOI:10.1016/j.hal.2010.12.002 |
| [14] |
Gu Xiaohong, Zhang Shengzhao, Bai Xiuling et al. Evolution of community structure of aquatic macrophytes in East Taihu Lake and its wetlands. Acta Ecologica Sinica, 2005, 25: 1541-1548. [谷孝鸿, 张圣照, 白秀玲等. 东太湖水生植物群落结构的演变及其沼泽化. 生态学报, 2005, 25(7): 1541-1548.] |
| [15] |
McCarthy MJ, Lavrentyev PJ, Yang L et al. Nitrogen dynamics and microbial food web structure during a summer cyanobacterial bloom in a subtropical, shallow, well-mixed, eutrophic lake (Lake Taihu, China). Hydrobiologia, 2007, 581: 195-207. DOI:10.1007/s10750-006-0496-2 |
| [16] |
Blomqvist P, Pettersson A, Hyenstrand P. Ammonium-nitrogen:A key regulatory factor causing dominance of non-nitrogen-fixing cyanobacteria in aquatic systems. Archiv für Hydrobiologie, 1994, 132(2): 141-164. |
| [17] |
Hyenstrand P, Blomqvist P, Pettersson A. Factors determining cyanobacterial success in aquatic systems:A literature review. Ergebnisse der Limnologie, 1998, 51: 41-62. |
| [18] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [19] |
Xu H, Zhu GW, Qin BQ et al. Growth response of Microcystis spp. to iron enrichment in different regions of Lake Taihu, China. Hydrobiologia, 2013, 700(1): 187-202. DOI:10.1007/s10750-012-1229-3 |
| [20] |
Hecky RE, Campbell P, Hendzel LL. The stoichiometry of carbon, nitrogen, and phosphorus in particulate matter of lakes and oceans. Limnology and Oceanography, 1993, 38(4): 709-724. DOI:10.4319/lo.1993.38.4.0709 |
| [21] |
Gervais F, Riebesell U. Effect of phosphorus limitation on elemental composition and stable carbon isotope fractionation in a marine diatom growing under different CO2 concentrations. Limnology and Oceanography, 2001, 46(3): 497-504. DOI:10.4319/lo.2001.46.3.0497 |
| [22] |
Montechiaro F, Giordano M. Compositional homeostasis of the dinoflagellate Protoceratium reticulatum grown at three different pCO2. Journal of Plant Physiology, 2010, 167(2): 110-113. DOI:10.1016/j.jplph.2009.07.013 |
| [23] |
Sterner RW, Elser JJ. Ecological stoichiometry:The biology of elements from molecules to the biosphere. Princeton: Princeton University Press, 2002.
|
| [24] |
Bi R, Arndt C, Sommer U. Stoichiometric responses of phytoplankton species to the interactive effect of nutrient supply ratios and growth rates. Journal of Phycology, 2012, 48(3): 539-549. DOI:10.1111/j.1529-8817.2012.01163.x |
| [25] |
Reinfelder JR. Carbon dioxide regulation of nitrogen and phosphorus in four species of marine phytoplankton. Marine Ecology Progress Series, 2012, 466: 57-67. DOI:10.3354/meps09905 |
| [26] |
Shi X, Zhao X, Zhang M et al. The effect of elevated CO2 on aphytoplankton communities to show seasonal variations in the highly eutrophic Lake Taihu. Canadian Journal of Fisheries and Aquatic Sciences, 2016, 73: 1-10. DOI:10.1139/cjfas-2015-0274 |
| [27] |
Talmy D, Blackford J, Hardman-Mountford N et al. Flexible C:N ratio enhances metabolism of large phytoplankton when resource supply is intermittent. Biogeosciences Discuss, 2014, 11(4): 5179-5214. DOI:10.5194/bgd-11-5179-2014 |
| [28] |
Xia JR, Gao KS. Impacts of elevated CO2 concentration on biochemical composition, carbonic anhydrase, and nitrate reductase activity of freshwater green algae. Journal of Integrative Plant Biology, 2005, 47(6): 668-675. DOI:10.1111/jipb.2005.47.issue-6 |
 2017, Vol. 29
2017, Vol. 29 

