蓝藻水华是危害公共健康和环境安全的全球性问题.微囊藻(Microcystis)是在湖泊和水库中形成蓝藻水华的最常见藻类[1].在自然界中微囊藻多以群体形态存在,群体的形成有利于微囊藻垂直迁移和抵御浮游动物的摄食,群体微囊藻比单细胞微囊藻具有更高的生存竞争优势,群体的形成是微囊藻形成优势并暴发水华的关键机制之一[1-2].
附生细菌附着在微囊藻群体中生长,包括变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)等,其菌群组成不同于周围水体中的游离细菌菌群[3-5].附生细菌可能促进或者抑制微囊藻生长,诱导微囊藻群体的形成,一些附生细菌能降解微囊藻毒素,因此附生细菌在微囊藻水华暴发过程中可能发挥了重要作用[6-8].但是,很少有关于微囊藻附生细菌特性的研究报道,这阻碍了对附生细菌生态学功能的深入理解.为了探讨附生细菌定殖于微囊藻群体的机制,本文从微囊藻群体中分离附生细菌,并分析其组成、生化特性、趋化性、细胞表面疏水性以及自聚(autoaggregation)和共聚(coaggregation)能力.
1 材料与方法 1.1 微囊藻的培养与附生细菌的分离惠氏微囊藻NJ-24(M. wesenbergii)、坚实微囊藻NJ-54(M. firma)、铜绿微囊藻NJ-177(M. aeruginosa)和水华微囊藻NJ-159(M. flos-aquae)于2011年8月从太湖采集和分离.在50 ml三角瓶中加入无菌BG-11培养基进行培养[9],4株微囊藻在实验室培养过程中一直呈现群体形态,培养温度为25℃,光照强度为2500 lux,光暗周期为12 h:12 h.
实验室中培养一年后,在超净台中将微囊藻群体放在无菌的尼龙筛(孔径20 μm)上,用无菌BG-11培养基冲洗10次,然后将群体微囊藻涂布在R2A固体培养基上[10],30℃恒温培养,根据固体培养基上的菌落数量计算各菌株在总菌落数中所占比例.选取不同形态的菌落通过在R2A平板上划线纯化.
1.2 附生细菌的分子鉴定参考Tillett等的方法提取细菌DNA[11].采用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)扩增附生细菌的16S rRNA基因部分序列.PCR扩增条件如下:94℃预变性1 min,接着为20个循环反应(94℃ 30 s,50℃ 30 s,72℃ 2 min),最后在72℃下延伸7 min.PCR产物由南京金斯瑞生物科技有限公司完成测序,所得DNA序列提交到GenBank中,并用BLAST找到最相似的序列.
1.3 附生细菌的生化特性收集对数期的细菌,用0.85 % NaCl溶液洗涤3次,并重悬于0.85 % NaCl溶液中至OD600≈0.1,取150 μl的细菌悬液,接种到BIOLOG生态板(EcoPlates 1506,美国BIOLOG公司)中,用150 μl的0.85 % NaCl溶液作对照,30℃下恒温培养. BIOLOG板的每个孔中含有不同的碳源,当细菌能利用碳源时BIOLOG板的孔中呈现紫色,否则,就保持无色[12],每个菌株进行3次以上重复验证.
1.4 附生细菌的趋化性采用平板法检测细菌对于葡萄糖和氨基酸的趋化性[13-14].固体培养基包含1×10-2 mol/L的K2HPO4、1×10-3 mol/L的MgSO4、1×10-3 mol/L的(NH4)2SO4、1×10-4 mol/L的EDTA、3×10-5 mol/L的蛋氨酸、1×10-5mol/L的D-葡萄糖和0.2 %琼脂, pH值调至7.0.收集培养到对数期的细菌,用0.85 % NaCl溶液连续洗涤3次,重悬细菌.将吸取10 μl重悬菌液的枪头垂直插入固体培养基,菌液慢慢渗入琼脂培养基中.30℃下恒温培养,细菌从接种点为中心向外圆形扩散生长,以4天后检测的圆形直径大小来反映细菌的趋化性强弱,每种细菌重复3次实验.
1.5 附生细菌的细胞表面疏水性采用MATH法来测定细胞疏水性[15],收集培养48 h的细菌,用无菌磷酸盐缓冲液(PBS,0.01mol/L,pH 7.0)洗涤3次并重悬于PBS中至OD600≈1.0,取4 ml洗涤后的细菌悬浮液加4 ml正十六烷于试管中涡旋混合1 min,静置10 min,测定下层水相OD600值.
| $ 细菌细胞表面疏水性\left( {{\rm{ }}\% {\rm{ }}} \right) = \frac{{\left( {{\rm{O}}{{\rm{D}}_{\rm{i}}} - {\rm{O}}{{\rm{D}}_{\rm{f}}}} \right)}}{{{\rm{O}}{{\rm{D}}_{\rm{i}}}}} \times 100\% $ | (1) |
式中,ODi是初始细菌悬液的OD600值,ODf是与十六烷混合后下层水相的OD600值,每种细菌做3次重复实验.
1.6 附生细菌的自聚和共聚能力采用分光光度法分析细菌的自聚和共聚能力[16].收集培养48 h的细菌,PBS洗涤3次并重悬细菌至OD600≈1.0,每种菌液取4 ml加入到比色皿中,室温下静置0、1、4和24 h后检测细菌悬浮液的OD600值.
| $ 自聚能力\left( {{\rm{ }}\% {\rm{ }}} \right) = \frac{{\left( {{A_0} - {A_{\rm{t}}}} \right)}}{{{A_{\rm{t}}}}} \times 100\% $ | (2) |
式中,A0是细菌悬浮液的初始OD600值,At是静置后细菌悬浮液的OD600值.
共聚能力分析时细菌悬液的制备同上,同种微囊藻中分离得到的附生细菌每两株一组,各取2 ml细菌悬浮液加入到同一比色皿中混匀,同时每种细菌各取4 ml分别加入到一个比色皿中作为对照,室温静置1、4、24 h后,检测混合菌液和单个菌液的OD600值.
| $ 共聚能力\left( {{\rm{ }}\% {\rm{ }}} \right) = \frac{{\left[ {({A_{\rm{x}}} + {A_{\rm{y}}}) - 2 \times {A_{{\rm{xy}}}}} \right]}}{{\left( {{A_{\rm{x}}} + {A_{\rm{y}}}} \right)}} \times 100\% $ | (3) |
式中,Ax和Ay分别是两种细菌在对照比色皿中的OD600值,Axy是两种细菌混合液的OD600值.
2 实验结果 2.1 附生细菌的分子鉴定从4种群体微囊藻(NJ-24、NJ-54、NJ-159和NJ-177)中分离得到18株附生细菌,其中α-变形菌纲(Alpha proteobacterium)7株,β-变形菌纲(Beta proteobacterium)1株,γ-变形菌纲(Gamma proteobacterium)2株,放线菌纲(Actinobacteria)4株,纤维粘网菌纲(Cytophagia)2株,黄杆菌纲(Flavobacteriia)2株.从惠氏微囊藻、坚实微囊藻、水华微囊藻和铜绿微囊藻分离得到的附生细菌种类有差异,分别得到了4、6、7和8株细菌,其中α-变形菌在4种微囊藻中都存在,附生β-变形菌只存在于铜绿微囊藻.惠氏微囊藻和坚实微囊藻中未发现附生放线菌,水华微囊藻中未发现附生纤维粘网菌,而铜绿微囊藻中未发现附生黄杆菌(表 1).
| 表 1 群体微囊藻附生细菌的分子鉴定* Tab.1 Molecular identification of bacteria associated with colonial Microcystis based on partial 16S rRNA gene sequences |
从18种附生细菌利用碳源的种类数(图 1)来看,仅有3株细菌(α-变形菌纲中的HJX5和HJX9,以及放线菌纲中的HJX8)只能利用5种碳源,利用碳源的范围较窄,其他细菌利用碳源的范围较广,都能够利用10种以上的碳源,有11株细菌能利用20种以上的碳源,包括5株α-变形菌(HJX3、HJX11、HJX18、HJX16和HJX15)、1株β-变形菌HJX14、2株放线菌(HJX17和HJX19)、1株纤维粘网菌HJX10以及2株黄杆菌(HJX1和HJX21).从表 1和图 1可以发现,在能够利用20种以上的碳源的附生细菌中,惠氏微囊藻中有两株细菌(HJX3和HJX1),坚实微囊藻中有4株(HJX1、HJX3、HJX10和HJX11),水华微囊藻中有2株(HJX18和HJX21),铜绿微囊藻中有5株(HJX16、HJX15、HJX14、HJX19和HJX17),每种微囊藻群体中都含有2株以上代谢潜力很高(能利用20种以上碳源)的细菌.每种微囊藻中的大多数附生细菌都能利用10种以上的碳源,也就是说,每种微囊藻中的大多数附生细菌种类都能利用较多的有机碳源.
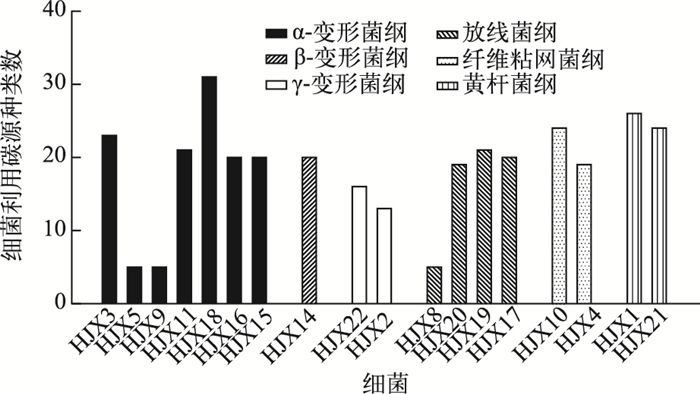
|
图 1 每个细菌在BIOLOG板上利用碳源的数量 Fig.1 The number of carbon sources utilized by each bacterial isolate in the BIOLOG system |
从能够利用每种碳源的细菌种类数(图 2)来看,六大类碳源中的碳水化合物、氨基酸、羧酸、多聚物、酚酸类和胺类均可以被附生细菌所利用.31种碳源中有21种碳源都能被10种以上细菌利用,其中利用丙酮酸甲酯的细菌数量最多,达到了17种,有5种碳源(D-半乳糖醛酸、D-半乳糖-γ-内酯、肝糖、4-羟基苯甲酸、腐胺)能够被5~9种细菌利用,有5种碳源(D, L-α-磷酸甘油、衣康酸、γ-羟基丁酸、2-羟基苯甲酸、苯乙基胺)只能被1~3种细菌利用,其中2-羟基苯甲酸只能被一种细菌利用.
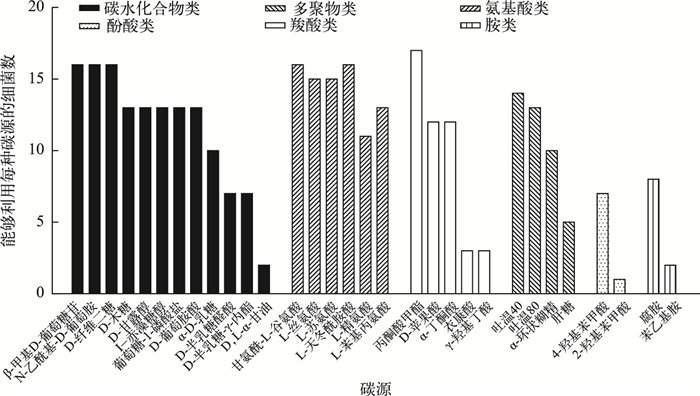
|
图 2 能够利用BIOLOG板上每种碳源的细菌数 Fig.2 The number of bacterial isolates capable of utilizing each carbon source in the BIOLOG system |
18种附生细菌中有12种具有趋化性(表 2),六大类群的附生细菌中均存在具趋化性的种类.在具趋化性的细菌中,γ-变形菌纲的细菌HJX22趋化性最强,其趋化环直径达到43.1 mm,α-变形菌纲细菌HJX16和HJX18以及黄杆菌纲细菌HJX1的较强,其趋化环直径超过了20 mm,而β-变形菌纲细菌HJX14的最弱,其趋化环直径只有4.7 mm.不具有趋化性的细菌包括3株α-变形菌(HJX5、HJX9和HJX15)、2株放线菌(HJX8和HJX20)以及1株黄杆菌(HJX21).趋化直径超过20 mm的附生细菌在惠氏微囊藻和坚实微囊藻中都只有1株细菌(HJX1),水华微囊藻中有2株(HJX18和HJX22),铜绿微囊藻中有1株(HJX16)(表 1、2).水华微囊藻的7株附生细菌中有4株不具有趋化性,惠氏微囊藻附生细菌都具有趋化性,坚实微囊藻和铜绿微囊藻附生细菌中大多数种类都具有趋化性(表 3).
| 表 2 细菌的趋化性、疏水性与自聚能力* Tab.2 Chemotaxis, hydrophobicity and autoaggregation of bacterial isolates |
| 表 3 4种微囊藻中附生细菌特性的比较分析 Tab.3 Comparative analysis of characterizations of bacteria associated with four species of Microcystis |
18种附生细菌中有12种显示疏水性(表 2),α-变形菌纲的细菌HJX15和放线菌纲的细菌HJX17疏水性最强,分别达到79.0 %和78.4 %,α-变形菌纲的细菌HJX18和放线菌纲的细菌HJX19疏水性也较强,分别为52.0 %和58.5 %.6种附生细菌疏水性数值都为0,表现出亲水性,包括α-变形菌纲的细菌HJX11和HJX16、γ-变形菌纲的细菌HJX22、纤维粘网菌纲的细菌HJX10以及黄杆菌纲的细菌HJX1和HJX21.在惠氏微囊藻和坚实微囊藻中都没有疏水性大于50 %的附生细菌,而在水华微囊藻中有1株(HJX18),在铜绿微囊藻中有3株(HJX15、HJX19和HJX17)(表 1、2).每种微囊藻附生细菌中的大多数种类都具有疏水性(表 3).
2.4 附生细菌的聚集特性在自聚实验过程中肉眼观察到14种附生细菌悬浮液中具有细菌聚集后下沉的现象,显示具有自聚能力(表 2).α-变形菌纲中的细菌HJX5和HJX9自聚能力最强,静置1 h后就分别达到了50.8 %和48.0 %,在静置4 h和24 h的自聚能力也都高于其他细菌. α-变形菌纲的细菌HJX16、放线菌纲的细菌HJX8和纤维粘网菌纲的细菌HJX10自聚能力也较强,静置24 h后都达到了45 %以上.在实验过程中,α-变形菌纲的细菌HJX3、γ-变形菌纲的细菌HJX22、纤维粘网菌纲的细菌HJX4和黄杆菌纲的细菌HJX1没有观察到细菌聚集现象,不具有自聚能力.在惠氏微囊藻中没有24 h自聚能力超过40 %的附生细菌,在坚实微囊藻中有1株(HJX10),水华微囊藻中有3株(HJX5、HJX9和HJX8),铜绿微囊藻中有1株(HJX16)(表 1、2).惠氏微囊藻的4株附生细菌只有1株具有自聚能力,而坚实微囊藻、水华微囊藻和铜绿微囊藻附生细菌中的大多数种类都具有自聚能力(表 3).
共聚分析实验发现共计有9组细菌表现出共聚能力(表 4),其他组合未发现有共聚能力,每种微囊藻都至少包含一组细菌具有自聚能力.来自水华微囊藻的两组细菌HJX18和HJX5以及HJX9和HJX5显示了最高的共聚能力,静置4 h后分别达到了42.3 %和39.4 %.
| 表 4 附生细菌的共聚能力* Tab.4 Coaggregation of bacteria associated with colonial Microcystis |
自然界中附生细菌附着于微囊藻群体生长,其营养来源除了藻细胞产生的有机物以外,还可能包含水中的其他有机物.本研究从实验室培养的微囊藻群体中分离得到的附生细菌生长完全依赖于藻细胞产生的有机物,避免了自然环境中其他来源有机物的干扰.
分离得到的18株细菌中有10株属于变形菌门,而且4种微囊藻的附生细菌群中都包含变形菌,这与已经报道的野外生长的微囊藻群体附生细菌群中变形菌占优势是一致的[4-6].除了变形菌以外,本研究中还分离得到了放线菌纲、纤维粘网菌纲和黄杆菌纲的细菌,以前的报道也显示微囊藻群体附生细菌群中包含这些细菌[4-7].纤维粘网菌纲和黄杆菌纲细菌被认为可能参与了微囊藻产生的高分子化合物的降解[7].附生细菌HJX9是鞘氨醇单胞菌(Sphingomonas sp.),Park等报道鞘氨醇单胞菌能够降解微囊藻毒素[17].附生细菌HJX22是假单胞菌(Pseudomonas sp.),有报道显示假单胞菌与微囊藻细胞之间有磷的转移,被认为是微囊藻生长的磷库[18].
BIOLOG板分析显示,18种附生细菌中有15种细菌利用碳源的范围较广,能够利用10种以上碳源,BIOLOG板中的碳水化合物、氨基酸、羧酸、多聚物、酚酸类、胺类六大类碳源都能被附生细菌所利用,31种碳源中有21种碳源都能被10种及以上细菌利用.这说明群体微囊藻的附生细菌群代谢旺盛,具有利用藻细胞产生的各类化合物的潜力.
3.2 附生细菌的趋化性、细胞疏水性和聚集特性及其对细菌附着能力的影响铜绿假单胞菌(Pseudomonas aeruginosa)具有对氨基酸的趋化性,这有利于其与鱼腥藻(Anabaena sp.)建立共生关系[19].研究发现18种附生细菌中有12种具有趋化性,这一特性有利于附生细菌在微囊藻群体上的附着生长.Prasad等研究发现,北极蓝藻附生细菌群中也包含一些不具有趋化性的种类[14],18种附生细菌中也包含6种不具有趋化性的细菌,这说明虽然趋化性有利于细菌与蓝藻建立附生关系,但是蓝藻附生细菌群中也会包含不具有趋化性的细菌.
细胞表面疏水性是反映细菌粘附能力的一个指标[2], 自聚是指遗传特性相同的同种细菌之间的相互粘附,而共聚是指遗传特性不同的不同种细菌之间的粘附[20].细菌的疏水性、自聚能力和共聚能力都有利于细菌聚集形成群体以及粘附于生物和非生物界面[20-21].微囊藻群体是由藻细胞和更多的细菌聚集形成的,细菌数量与藻细胞的数量比率为10~50[3].细胞疏水性已经被证明在微囊藻细胞粘附而形成群体过程中发挥了重要作用[2].分离得到的18种细菌中有12种细菌显示疏水性,14种细菌显示自聚能力,每种微囊藻中也至少有一组细菌表现出共聚能力,这显示附生细菌的疏水性、自聚能力和共聚能力在细菌参与微囊藻群体形成过程中可能发挥了作用.
Shi等的研究发现微囊藻附生细菌群组成不同于水中的游离菌群[4],这说明细菌会有选择性地附生于微囊藻群体.细菌的旺盛代谢潜力、趋化性、疏水性、自聚能力和共聚能力可能有利于附生细菌定殖于微囊藻群体.3株细菌(HJX5、HJX9和HJX8)利用有机物种类最少,也不具有趋化性,这两个方面不利于其附着生长,但是这3株细菌都具有最高的自聚能力,高自聚能力有利于附着生长.此外,6株细菌(HJX5、HJX9、HJX15、HJX8、HJX20和HJX21)不具有趋化性,6株细菌(HJX11、HJX16、HJX22、HJX10、HJX1和HJX21)都是亲水性的,而4株细菌(HJX3、HJX22、HJX4和HJX1)都不具有自聚能力,这些方面都不利于细菌附着生长.但是,在趋化性、疏水性和自聚能力方面所有这些细菌都至少有一个方面的数值是不为0的,也就是说,这些细菌至少拥有一个有利于附着生长的特性.
4株细菌(HJX3、HJX5、HJX14和HJX4)是所占比例最低的细菌(表 1),细菌HJX3和HJX4的自聚能力为0,细菌HJX5不具趋化性而且只能利用很少种类的有机碳源,细菌HJX14的趋化性能很低,这些方面应该是导致这4株细菌比例低的部分因素.3株细菌(HJX18、HJX15和HJX2)是所占比例最高的细菌(表 1),3株细菌都能利用较多种类的有机碳源,细菌HJX15具有最高的疏水性,细菌HJX18和HJX2的趋化性、疏水性和自聚能力都不为0,这些方面应该是导致这3株细菌比例高的部分因素.
| [1] |
Kong Fanxiang, Ma Ronghua, Gao Junfeng et al. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu. J Lake Sci, 2009, 21(3): 314-328. [孔繁翔, 马荣华, 高俊峰等. 太湖蓝藻水华的预防、预测和预警的理论与实践. 湖泊科学, 2009, 21(3): 314-328. DOI:10.18307/2009.0302] |
| [2] |
Yang HL, Cai YF, Xia M et al. Role of cell hydrophobicity on colony formation in Microcystis (Cyanobacteria). International Review of Hydrobiology, 2011, 96(2): 141-148. DOI:10.1002/iroh.v96.2 |
| [3] |
Brunberg AK. Contribution of bacteria in the mucilage of Microcystis spp. (Cyanobacteria) to benthic and pelagic bacterial production in a hypereutrophic lake. FEMS Microbiology Ecology, 1999, 29(1): 13-22. DOI:10.1111/fem.1999.29.issue-1 |
| [4] |
Shi LM, Cai YF, Kong FX et al. Specific association between bacteria and buoyant Microcystis colonies compared with other bulk bacterial communities in the eutrophic Lake Taihu, China. Environmental Microbiology Reports, 2012, 4(6): 669-678. |
| [5] |
Shi LM, Cai YF, Wang XY et al. Community structure of bacteria associated with microcystis colonies from cyanobacterial blooms. Journal of Freshwater Ecology, 2010, 25(2): 193-203. DOI:10.1080/02705060.2010.9665068 |
| [6] |
Shi LM, Cai YF, Li PF et al. Molecular identification of the colony-associated cultivable bacteria of the cyanobacterium Microcystis aeruginosa and their effects on algal growth. Journal of Freshwater Ecology, 2009, 24(2): 211-218. DOI:10.1080/02705060.2009.9664285 |
| [7] |
Maruyama T, Kato K, Yokoyama A et al. Dynamics of microcystin-degrading bacteria in mucilage of Microcystis. Microbial Ecology, 2003, 46(2): 279-288. DOI:10.1007/s00248-002-3007-7 |
| [8] |
Shen H, Niu Y, Xie P et al. Morphological and physiological changes in Microcystis aeruginosa as a result of interactions with heterotrophic bacteria. Freshwater Biology, 2011, 56(6): 1065-1080. DOI:10.1111/fwb.2011.56.issue-6 |
| [9] |
Rippka R. Isolation and purification of cyanobacteria. Methods in Enzymology, 1988, 167: 3-27. DOI:10.1016/0076-6879(88)67004-2 |
| [10] |
Reasoner DJ, Geldreich EE. A new medium for the enumeration and subculture of bacteria from potable water. Applied and Environmental Microbiology, 1985, 49(1): 1-7. |
| [11] |
Tillett D, Neilan BA. Xanthogenate nucleic acid isolation from cultured and environmental cyanobacteria. Journal of Phycology, 2000, 36(1): 251-258. DOI:10.1046/j.1529-8817.2000.99079.x |
| [12] |
More TT, Yan S, John RP et al. Biochemical diversity of the bacterial strains and their biopolymer producing capabilities in wastewater sludge. Bioresource Technology, 2012, 121: 304-311. DOI:10.1016/j.biortech.2012.06.103 |
| [13] |
Mesibov R, Adler J. Chemotaxis toward amino acids in Escherichia coli. Journal of Bacteriology, 1972, 112(1): 315. |
| [14] |
Prasad S, Pratibha MS, Manasa P et al. Diversity of chemotactic heterotrophic bacteria associated with arctic cyanobacteria. Current Microbiology, 2013, 66(1): 64-71. DOI:10.1007/s00284-012-0243-z |
| [15] |
Rosenberg M. Bacterial adherence to polystyrene-A replica method of screening for bacterial hydrophobicity. Applied and Environmental Microbiology, 1981, 42(2): 375-377. |
| [16] |
Kos B, Suskovic J, Vukovic S et al. Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92. Journal of Applied Microbiology, 2003, 94(6): 981-987. DOI:10.1046/j.1365-2672.2003.01915.x |
| [17] |
Park HD, Sasaki Y, Maruyama T et al. Degradation of the cyanobacterial hepatotoxin microcystin by a new bacterium isolated from a hypertrophic lake. Environmental Toxicology, 2001, 16(4): 337-343. DOI:10.1002/(ISSN)1522-7278 |
| [18] |
Jiang LJ, Yang LY, Xiao L et al. Quantitative studies on phosphorus transference occuring between Microcystis aeruginosa and its attached bacterium (Pseudomonas sp.). Hydrobiologia, 2007, 581(1): 161-165. DOI:10.1007/s10750-006-0518-0 |
| [19] |
Gallucci KK, Paerl HW. Pseudomonas aeruginosa chemotaxis associated with blooms of N2-fixing blue-green-algae (cyanobacteria). Applied and Environmental Microbiology, 1983, 45(2): 557-562. |
| [20] |
Rickard AH, Gilbert P, High NJ et al. Bacterial coaggregation: An integral process in the development of multi-species biofilms. Trends in Microbiology, 2003, 11(2): 94-100. DOI:10.1016/S0966-842X(02)00034-3 |
| [21] |
Garcia-Cayuela T, Korany AM, Bustos I et al. Adhesion abilities of dairy Lactobacillus plantarum strains showing an aggregation phenotype. Food Research International, 2014, 57(1): 44-50. |
 2017, Vol. 29
2017, Vol. 29 
