(2: 安庆师范学院资源环境学院, 安庆 246000)
(3: 安庆师范学院水生生物保护与水生态修复安徽省高等学校工程技术研究中心, 安庆 246000)
(2: School of Resources and Environment, Anqing Normal University, Anqing 246000, P. R. China)
(3: Research Center of Aquatic Organism Conservation and Water Ecosystem Restoration of Anhui Education Department, Anqing Normal University, Anqing 246000, P. R. China)
鱼类作为河流生态系统中的高等动物类群,它们的出生、生长、繁殖和死亡等生活史事件都是在河流中完成的,河流的生境特征对鱼类多样性及其群落结构有着重要影响.同时由于鱼类对河流生态系统的食物网动态、营养和物质循环、生态系统的恢复能力等具有重要的调节作用,因此鱼类多样性对于维持稳定的河流生态系统结构和功能有着十分重要的作用.自然河流的环境呈现的是一种连续的线性梯度变化过程,河流鱼类的物种分布、丰富度和群落结构会随环境梯度的变化而变化[1],但当这种环境梯度被中断(如水利工程[2])时,河流自然流态机制将随之而改变,使鱼类难以正常完成生活史循环;此外受农业灌溉、水体污染[3 — 4]、土地利用[5]等的影响,河流鱼类多样性和物种丰富度也正在逐渐下降和减少,鱼类群落的空间格局也随之改变[6 — 8].通过观测鱼类群落空间格局的变化,可以了解河流生态系统的变化情况[9].
在诸多影响鱼类群落变化的因素中,水坝无疑是最普遍、最典型的一种人为干扰形式[10].水坝又可分为高头坝(high-headdam)和低头坝(low-headdam),其本质区别在于前者坝头较高并能完全截流,后者坝头较低因而不能完全截流[11].目前,国内外对水坝生态学效应的研究大多数聚焦于大型水坝,仅有少量研究有关低头坝对河流鱼类群落结构及其多样性的影响,如在鱼类多样性上,Tiemann等发现紧邻水坝局部河段中的鱼类多度、密度和均匀度受到低头坝的显著影响,而鱼类物种丰富度无显著变化[12];Dodd等则发现,坝下冲刷区的物种丰富度显著高于其它河段[13].从鱼类群落结构水平看,虽然低头坝显著影响了少数物种的优势度,而鱼类群落结构却没有显著变化[13 — 14];但Gillette等[15]、Poulet[16]和Yan等[17]则观察到与远离水坝的河段相比,蓄水区的急流性鱼类显著减少且缓流性或静水性鱼类显著增多; 而Yan等更进一步发现低头坝减弱了鱼类群落在河流网络中的空间自相关性[18],并且与本地入侵种(nativeinvaders)鱼类的多样性增加有较大相关[19].上述有关低头坝对鱼类群落影响的研究结果之间尚存很大争议和分歧[15-17, 20-21],推测低头坝产生的生态学效应很可能与水坝自身的属性、人为干扰程度以及数量累积效应密切相关[11, 18, 22].
为此,本研究以某低头坝拦河养殖的河段为对象,连续2年调查了其上、下游的坝下冲刷区(plungearea)的鱼类群落特征,旨在确定该河段鱼类群落的组成与时空格局动态变化,解析用于养殖目的的低头坝对上下游鱼类群落的影响,从而为区域内鱼类资源的保护和河流的科学管理提供参考依据,也为生态水利学的相关研究积累资料.
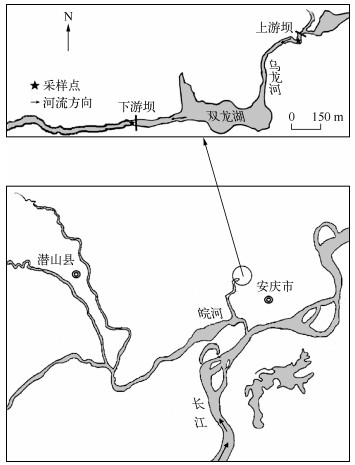
1 材料与方法 1.1 研究区域概况研究样点位于乌龙河,该河汇入石门湖后经皖河入长江,属亚热带长江中下游地区的小型河流,该河段已修筑2座低头坝拦河形成人工湖泊(图 1所示双龙湖),用于养殖,常年饲喂鲢、鳙、鲫,湖中也有少量野生、麦穗鱼、鳑鲏和鲇等.其上游坝高约0.9m,下游坝高约1.0m,两坝之间无其他阻隔,相距1.2km.研究于2013年4、7、11月和2014年4、7、10月分6次对上游坝和下游坝的冲刷区共进行12样次的采集工作(图 1).研究河段周边地区实行封闭管理,绝无酷渔滥捕等现象.
|
图 1 研究样点位置 Fig.1 Location of study area |
采集工具为背负式超声波捕鱼器(CWB-5000P),采取“之”字形捕捞路线,一人电鱼,两人以捞网(网目为0.2cm)尾随捕捞,采样河道长30m,采样时间20min,每样点均采用相同捕捞努力.为避免小生境差异对鱼类群落的影响,样点尽可能包括该河段的各类生境(岸边、河中央、静水、流水).所获标本在新鲜状态下进行常规鉴别、称重,疑难种以10 %甲醛溶液固定后,带回实验室鉴别,其余活体全部放归[23].
1.3 现场环境因子观察与测量现场观察水色、气味和沿岸植被情况.
在每个样点的3个等距截面上测量水宽(WW)、透明度(SD),于各截面的3个等距点分别测量水深(WD)、水温(Tem)、溶解氧(DO,雷磁JPB-607A型)、电导率(Cond,雷磁DDBJ-350型)和pH值(雷磁PHB-4型),水深60 %处测量流速(Speed,荣圣MT-A型).所得数据全部取平均值,作为该样次的环境因子数据.
2 数据分析样点的物种多样性指数采用Shannon-Wiener指数(H′):
| $ {H^\prime }{\rm{ = }}-\sum {P_i}\cdot\ln {P_i} $ | (1) |
相关的鱼类多样性指标密度(D)、频率(F)、相对多度(P)和重要值指数(IVI)[24 — 25]的计算公式分别为:
| $ {D_i} = {N_i}/A $ | (2) |
| $ {F_i} = 100\% \left( {{S_i}/S} \right) $ | (3) |
| $ {P_i} = 100\% ({N_i}/N) $ | (4) |
| $ IV{{I}_{i}}={{10}^{4}}{{F}_{i}}\cdot {{P}_{i}}~ $ | (5) |
式中,Si和Ni分别代表物种i的采到次数和累计个体数,S、N和A分别代表全部采样次数、全部鱼类个体数和采样的水面积.
利用t-test检验各样点的多样性、密度和捕获量数据的差异显著性.
为提高数据的正态性和方差齐性,降低极端数值的负面影响,将相关鱼类数据和栖息地变量数据进行对数lg(x+1)转化,在PRIMER5.0软件中,运用单因素相似性分析(one-way crossed ANOSIM),分别检验空间因素和时间因素对鱼类群落结构的影响;运用非参数多变量排序(nonmetric multidimensional scaling,NMS)方法,构建鱼类群落结构的二维双标图;最后,运用相似性百分比(SIMPER)分析,解析形成群落差异的关键贡献物种[19].
利用CANOCO4.5软件的典范对应分析(CCA)解析栖息地变量对鱼类群落结构的影响,此外对稀有种(出现样点数不超过2次的物种)不予以典范对应分析,以降低稀有物种的权重[23, 26].
3 结果与分析 3.1 栖息地环境观察调查期间内,上游坝水色为澄清,无味,岸边有菰(Zizania latifolia)、菖蒲(Acorus calamus)、芦苇(Phragmites australis),河岸及河中央有苦草(Vallisneria natans)、金鱼藻(Ceratophyllum demersum)、狐尾藻(Myriophyllum)等水下植物;下游坝水色为深绿色,有臭味,岸边有狗牙根(Cynodon dactylon)、水花生(Alternanthera philoxeroides)、水蓼(Polygonum hydropiper),河岸水下有黑藻(Hydrilla),河中央无沉水植物.
3.2 物种组成与分布12样次共捕获标本626尾,隶属5目10科21属24种.以鲤形目最多(15种),占总数的62.5 %,鲈形目有5种,占总数的20.8 %;全部10科中,鲤科鱼类最多(14种),分布于6个亚科,占总数的58.3 %,其次是塘鳢科鱼类2种,占8.3 %,其他各科鱼类总计占33.4 %;所捕获的24种鱼类都属于定居型物种,无洄游性或半洄游性物种.
上游坝常见种为宽鳍鱲、马口鱼、、油、飘鱼、细鳞鲴、大鳍鱊、兴凯鱊、中华鳑鲏、棒花鱼、麦穗鱼、亮银鮈、银鮈、鲫、泥鳅、子陵吻鰕虎鱼、刺鳅、黄黝鱼、沙塘鳢等19种(F>40 %),鲇、圆尾拟鲿、乌鳢、黄鳝为偶见种(10 %<F≤40 %),未见稀有种(F≤10 %);优势鱼类有14种:宽鳍鱲、马口鱼、、飘鱼、细鳞鲴、大鳍鱊、兴凯鱊、中华鳑鲏、棒花鱼、银鮈、鲫、泥鳅、子陵吻鰕虎鱼、沙塘鳢(IVI>100);其中宽鳍鱲、马口鱼、亮银鮈、银鮈、沙塘鳢5种均为喜流性鱼类,其余18种为静水性鱼类[23].
下游坝常见种为鲫、泥鳅、食蚊鱼3种(F>40 %),麦穗鱼为偶见种(10 %<F≤40 %),未见稀有种(F≤10 %),优势鱼类有鲫、泥鳅、食蚊鱼3种(IVI>100)(表 1),均为静水性鱼类[23].
| 表 1 乌龙河鱼类分布及其频率、相对多度和重要值指数 Tab.1 Distribution, frequency of occurrence, relative abundance and importance value index for fishes collected in the Wulong River |
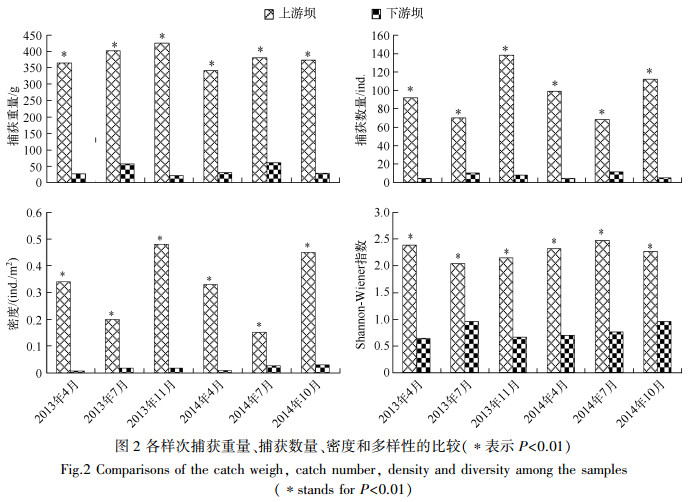
统计2年各样点数据,发现下游坝鱼类的捕获重量、捕获数量、密度和多样性(Shannon-Wiener指数)水平低于上游坝的水平;同时上游坝每年秋季(10、11月)的捕获量和密度均为最大.而下游坝在7月捕获量和密度均为最大(图 2).
|
图 2 各样次捕获重量、捕获数量、密度和多样性的比较 Fig.2 Comparisons of the catch weigh, catch number, density and diversity among the samples (*表示P<0.01) (*stands forP < 0.01) |
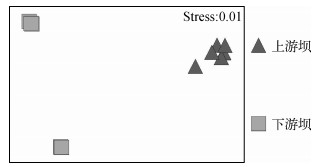
运用ANOSIM检验空间因素(样点)和时间因素(季节)对鱼类群落结构的影响,结果表明,在整体上,鱼类群落结构无显著的季节变化(Global R=-0.45,P<0.05)和显著的空间变化(Global R=1,P<0.05).而非参数多变量排序(NMS)也表明上游坝和下游坝的鱼类群落结构明显不同,聚为两大区域(图 3).
|
图 3 鱼类群落结构的空间变化非度量多维标度排序 Fig.3 Spatial variations of fish assemblages based on non-metric multi-dimensional scaling |
由于上游坝和下游坝间的鱼类群落结构存在显著差异,运用相似性百分比(SIMPER)分别解析维持上游坝和下游坝鱼类群落内不相似性的关键贡献物种.结果显示造成上游坝和下游坝群落结构差异的主要物种为中华鰟鲏、、棒花鱼、大鳍鱊、马口鱼、宽鳍鱲、兴凯鱊、飘鱼、子陵吻鰕虎鱼、细鳞鲴、食蚊鱼、银鮈、沙塘鳢、刺鳅、麦穗鱼(累积贡献率>90 %);其中上游坝样点关键物种是中华鰟鲏、、棒花鱼,大鳍鱊(贡献值>7 %),下游坝样点为食蚊鱼(表 2).
| 表 2 关键物种对上、下游样点鱼类群落结构差异的贡献 Tab.2 Species-specific contributions to the difference of fish assemblages between sites in the upstream and downstream |
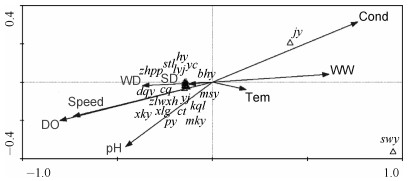
CCA分析发现3个栖息地变量(溶解氧、电导率和流速)对鱼类群落结构具有显著影响(P<0.05).溶解氧、电导率和流速均主要与轴1相关,其中溶解氧、流速与轴1、轴2均呈负相关,而电导率与轴1、轴2均呈正相关(图 4).
|
图 4 CCA所得鱼类群落结构与环境因素的关系图 Fig.4 Correlations between fish assemblages and habitat variables after CCA |
水坝是人为干扰河流常见形式之一,由于水坝的修建使得河流流速减缓、大面积的静水水体出现在水坝上、下游,并导致下游水量减少;河段鱼类产卵场缩小,产漂流性卵鱼类发育受限,繁殖季节滞后.此外,水坝的建立对河流生态系统中的理化环境与生物成分也产生较大的影响,由于坝上蓄水区(impoundmentarea)流速变缓,水体对于污染物的稀释、扩散、迁移和净化能力将下降.坝下流水的流速趋于平稳或者减小,水位大幅度下降甚至断流,河底泥沙淤积,减弱了水体的扩散稀释污染物的能力,影响了河流的自净功能[27],并因此导致河流水质的恶化.特别是在人为干扰较大地区,水坝除了导致河流自然流态的变化外,由于其所承载的社会服务功能较山区水坝多,其鱼类群落特征变化也更为明显.近年来各地湿地资源日益枯竭,湖泊面积逐渐减少[28],自然渔业资源受到严重威胁,淡水养殖业开始日益发展.而《中华人民共和国渔业法》第十条也规定“国家鼓励全民所有制单位、集体所有制单位和个人充分利用适于养殖的水域、滩涂发展养殖业”.很多地方开始利用河流进行渔业养殖,但是养殖过程产生的残饵、化肥以及未经处理就直接排放的农药易引起水质中的氮和磷超标,滋生病原;特别是河流养殖中,大量增加的人工设施会使下游流速降低,影响了河流营养物质的输入和输出,使陆源污染物得不到及时的稀释扩散,从而导致河流水质受到不同程度的污染,并有继续发展的趋势[23].人们也意识到随着养殖年限增加,养殖水体的富营养化程度也逐渐加重[29],导致养殖水体中污染物蓄积,从而严重危害到下游鱼类的生存[30].因此在诸多河流养殖形式中,利用低头坝拦截河流进行养鱼,会对河段上下游自然鱼类群落造成较大影响.
鱼类群落的动态变化受到内源性和外源性因素联合影响[31].内源性因素一般指鱼类自身繁殖或洄游导致的种群数量和群落结构的变化[32];外源性因素主要是引起栖息地稳定性及其有效性的显著性季节动态,从而导致溪流鱼类群落的物种组成及数量发生相应的变化[33 — 34].Yan等通过对青弋江3座低头坝的调查发现低头坝对鱼类的影响主要体现在:1)与上下游1km的参考点相比,坝上蓄水区的喜静水鱼类增加导致物种多样性和密度增加;2)坝下冲刷区鱼类组成情况则与上下游1km处参考点的物种组成和群落结构相差不大;3)导致各样点鱼类群落差异的主要原因不是季节因素,而是低头坝造成水文条件改变,其中水宽、水深、流速以及底质类型对鱼类群落有较大影响[35].
本研究中所得结果表明,通过ANOSIM检验认为鱼类群落结构无显著性的季节变化(GlobalR=-0.45,P<0.05),但具有显著的空间变化(Global R=1,P<0.05),所以养殖河段上下游的鱼类群落差异也主要由空间位置(上游坝、下游坝)引起,因此低头坝的作用明显(图 3).
此外,上游坝的鱼类数量相对多度排列顺序为:中华鳑鲏(27.81 %)>(10.71 %)>鲫(9.67 %)>棒花(9.5 %),下游坝为鲫(57.14 %)>食蚊鱼(23.81 %)>泥鳅(16.67 %)>麦穗鱼(2.38 %).与表 1中所示顺序不同,相似性百分比(SIMPER)显示上游坝的中华鰟鲏、、棒花鱼、大鳍鱊,下游坝的食蚊鱼对上、下游鱼类群落的空间变化贡献值较大.
由于鱼类物种组成的空间变化与物种的栖息地选择密切联系[36],上游坝中的大鳍鱊(产卵需较高的水体溶解氧浓度)以及下游坝中的食蚊鱼(喜食耐污、好低氧的孑孓)在上、下游坝样点的平均多度较高(表 2),提示下游坝较上游坝的水体溶解氧浓度低,污染程度大[23, 36],是导致比食蚊鱼和大鳍鱊相对多度大的鲫(表 1)却对上、下游的鱼类群落空间差异的贡献较小的原因.
同样, CCA分析结果表明,该河段中鱼类(除食蚊鱼和鲫外)基本集中在轴1和轴2交叉点的左部(图 4),表明这些物种生境需求基本类似,种间竞争激烈,且生态幅较小,无论环境中流速、溶解氧浓度增加和减少,均不利于这些鱼类生存,说明该河段中的鱼类群落对外界环境的变化也应较为敏感,生境较脆弱[35];而鱼类分布差异主要受溶解氧浓度、电导率和流速3个环境因素影响,特别是食蚊鱼和鲫,这两种较耐受不良环境的鱼,远离其他鱼类聚集的区域,喜温度较高、电导率较高的环境(图 4);在鱼类组成种类上,上游坝共有23种鱼,其中宽鳍鱲、马口鱼、亮银鮈、银鮈、沙塘鳢5种为喜流性鱼类,其余18种为静水性鱼类;而下游坝的鱼类群落仅有麦穗鱼、鲫、泥鳅和食蚊鱼,并且3种优势种均为耐污生命力强的静水性鱼类[23].这与Yan等发现的坝下冲刷区与参考区域的鱼类(喜静水、喜流水均有)群落组成相差不大的结论有明显的不同[35].以上结果表明上下坝冲刷区环境条件的改变造成了各样点间不同的鱼类群落组成特点[19, 35].
同时发现在上游样点各月份的捕获重量、捕获数量、密度和多样性均高于下游样点,且上游样点自身秋季(10、11月)的捕获重量、捕获数量、密度和多样性高于4月(图 2).一般认为亚热带地区的平水期(4月)和枯水期(10、11月)恰为鱼类的繁殖前期和非繁殖期,而冬季普遍温度低且降雨量极小,非常不利于鱼类的生存,因此经过越冬后,4月份鱼类种群数量、生物量均出现下降,而秋季(10、11月)因为有当年生的幼体补充,鱼类种群数量和密度反而增加(图 2).这与在同一地区的青弋江、秋浦河观察到的结果相似[23, 36].同时与在秋浦河观察的结果一致[36],相对于4月,上游坝采样地7月份的渔获物数量和密度降低(图 2),而多样性指数则有降(2013年)有升(2014年)(图 2),这很可能与丰水期间雨量充沛,鱼类栖息地面积增加,电捕器的捕获效率下降,导致偶然误差较多有关.同时观察到在下游采样点7月份的捕获重量、捕获数量、密度和多样性指数均较其他月份出现增高的趋势(图 2),这很可能与下游坝在夏季水量较大,水体环境得到改善,下游鱼类上溯有关.
总之,与上游坝冲刷区相比,用于养殖目的的低头坝对下游坝冲刷区的局域栖息地及鱼类群落结构具有较显著的影响,其中3个栖息地变量(溶解氧、电导率和流速)均对鱼类群落特征具有显著影响,并且出现鱼类物种多样性、捕获数量和重量、密度显著减少等特点,而这些变化与季节无显著相关性.推测下游低溶解氧浓度、高污染是造成上游中华鰟鲏、、棒花鱼、大鳍鱊和下游食蚊鱼对鱼类群落空间差异贡献较大的主要原因.因此,今后在探讨低头坝对鱼类分类群影响时,不能仅就其蓄水区和冲刷区鱼类分类群进行分析,还需对低头坝自身用途以及鱼类功能群(栖息地、营养、繁殖)组成等因素加以考虑.
当前,随着我国经济建设的快速发展,河流所承担的服务功能将越来越多,由此导致的一系列的栖息地退化,水体污染和入侵种威胁的危险也随之增加[37 — 38].因此,本文所得结果将有助于人们了解水利工程对河流生态系统的影响,为科学利用河流与河流生态系统健康、水生生物的保护等相关研究提供科学参考.
致谢: 衷心感谢原中国科学院南京地理与湖泊研究所朱松泉研究员亲自指点鱼类鉴别工作,安庆师范学院生命科学学院陶峰、李家磊同学的辛苦采样工作.| [1] |
Vannote RL, Minshall GW, Cumins KW et al. The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1): 130-137. DOI:10.1139/f80-017 |
| [2] |
March JG, Benstead JP, Pringle CM et al. Damming tropical island streams:problems, solutions, and alternatives. BioSicence, 2003, 53(11): 1069-1078. DOI:10.1641/0006-3568(2003)053[1069:DTISPS]2.0.CO;2 |
| [3] |
Allan JD. Landscapes and riverscapes:the influence of land use on stream ecosystems. Annual Review of Ecology, Evolution & Systematics, 2004, 35: 257-284. |
| [4] |
Lima-Junior SE, Cardone IB, Goitein R. Fish assemblage structure and aquatic pollution in a Brazilian stream:some limitations of diversity indices and models for environmental impact studies. Ecology of Freshwater Fish, 2006, 15(3): 284-290. DOI:10.1111/eff.2006.15.issue-3 |
| [5] |
Harding JS, Benfield EF, Bolstad PV et al. Stream biodiversity:the ghost of land use past. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(25): 14843-14847. DOI:10.1073/pnas.95.25.14843 |
| [6] |
Bonner TH, Wilde GR. Changes in the Canadian River fish assemblage associated with reservoir construction. Journal of Freshwater Ecology, 2000, 15(2): 189-198. DOI:10.1080/02705060.2000.9663736 |
| [7] |
Meldgaard T, Nielsen EE, Loeschcke V. Fragmentation by weirs in a riverine system:a study of genetic variation in time and space among populations of European grayling (Thymallus thymallus) in a Danish river system. Conservation Genetics, 2003, 4(6): 735-747. DOI:10.1023/B:COGE.0000006115.14106.de |
| [8] |
Galat DL, Berry CR, Garaner WM et al. Spatiotemporal patterns and changes in Missouri River fishes. American Fisheries Society Symposium, 2005, 45: 249-291. |
| [9] |
Karr JR, Fausch KD, Angermeier PL et al. Assessing biological integrity in running waters:A method and its rationale. Champaign:Illinois Natural History Survey(Special Publication), 1986, 1-31. |
| [10] |
Rosenberg DM, Berks F, Boadaly RA et al. Large-scale impacts of hydroelectric development. Environmental Reviews, 1997, 5(1): 27-54. DOI:10.1139/a97-001 |
| [11] |
Poff NL, Hart DD. How dams vary and why it matters for the emerging science of dam removal. BioScience, 2002, 52(8): 659-668. DOI:10.1641/0006-3568(2002)052[0659:HDVAWI]2.0.CO;2 |
| [12] |
Tiemann JS, Gillette DP, Wildhaber ML et al. Effects of lowhead dams on riffle-dwelling fishes and macro invertebrates in a Midwestern river. Transactions of American Fisheries Society, 2004, 133(3): 705-717. DOI:10.1577/T03-058.1 |
| [13] |
Dodd HR, Hayes DB, Baylis JR et al. Low-head sea lamprey barrier effects on stream habitat and fish communities in Great Lakes basin. Journal of Great Lakes Research, 2003, 29(Suppl. 1): 386-402. |
| [14] |
Raborn SW, Schramm SW. Fish assemblage response to recent mitigation of a channelized warmwater stream. River Research and Applications, 2003, 19(4): 289-301. DOI:10.1002/(ISSN)1535-1467 |
| [15] |
Gillette DP, Tiemann JS, Edds DR et al. Spatiotemporal patterns of fish assemblage structure in a river impoundment by low-head dams. Copeia, 2005, 3: 539-549. |
| [16] |
Poulet N. Impact of weirs on fish communities in a piedmont stream. River Research and Applications, 2007, 23(9): 1038-1047. DOI:10.1002/(ISSN)1535-1467 |
| [17] |
Yan YZ, Wang H, Zhu R et al. Influences of low-head dams on the fish assemblages in the headwater streams of the Qingyi watershed, China. Environmental Biology of Fishes, 2013, 96(4): 495-506. DOI:10.1007/s10641-012-0035-0 |
| [18] |
Yan YZ. Influences of low-head dams on fish assemblages in the headwater streams of the Qingyi River, China. 144th Annual Meeting of the American Fisheries Society. Afs, 2014. |
| [19] |
Chu L, Wang W, Zhu R et al. Variation in fish assemblages across impoundments of low-head dams in headwater streams of the Qingyi River, China:effects of abiotic factors and native invaders. Environmental Biology of Fishes, 2014, 98(1): 101-112. |
| [20] |
Cummings GS. The impact of low-head dams on fish species richness in Wisconsin, USA. Ecological Applications, 2004, 14(5): 1495-1506. DOI:10.1890/03-5306 |
| [21] |
Helms BS, Werneke DC, Gangloff MM et al. The influence of low-head dams on fish assemblages in streams across Alabama. Journal of the North American Benthological Society, 2011, 30(4): 1095-1106. DOI:10.1899/10-093.1 |
| [22] |
Ward JV, Stanford JA. The serial discontinuity concept of lotic ecosystems. In:Fontaine TD, Bartell SM eds. Dynamics of lotic ecosystems, Ann Arbor Science, Ann Arbor, MI, 1983:29-42.
|
| [23] |
王红. 低头坝对青弋江河源溪流局域栖息地, 鱼类多样性及其群落结构的影响[学位论文]. 合肥: 安徽师范大学, 2012.
|
| [24] |
祁继英, 阮晓红. 大坝对河流生态系统的环境影响分析. 河海大学学报: 自然科学版, 2005, 33(1): 37-40.
|
| [25] |
郑奕, 刘新春, 杨金龙等. 塔里木河上游地区阿拉尔段天然退化生态系统植物群落物种多样性特征分析. 水土保持研究, 2005, 12(2): 131-134. |
| [26] |
周劲风, 温琰茂, 梁志谦. 珠江三角洲密养池塘的水质特点分析. 水产科学, 2005, 23(12): 13-17. |
| [27] |
陈生熬, 童华文, 霍佳佳等. 塔里木河流域淡水养殖业可持续发展思考. 塔里木大学学报, 2008, 19(4): 103-106. |
| [28] |
安树青, 李哈滨, 关保华等. 中国的天然湿地:过去的问题, 现状和未来的挑战. AMBIO-人类环境杂志, 2007, 36(4): 317-324. |
| [29] |
邓朝阳, 朱仁, 严云志. 长江芜湖江段鱼类多样性及其群落结构的时空格局. 淡水渔业, 2013, 43(1): 28-36. |
| [30] |
Gauch HG. Multivariate analysis in community ecology. New York: Cambridge University Press, 1982, 23.
|
| [31] |
Belyea LR, Lancaster J. Assembly rules within a contingent ecology. Oikos, 1999, 86(3): 402-416. DOI:10.2307/3546646 |
| [32] |
Welcomme RL. The biology and ecology of the fishes of a small tropical stream. Journal of Zoology, 1969(4): 485-529. |
| [33] |
Grossman GD, Moyle PB, Whitaker Jr JR. Stochasticity in structural and functional characteristics of an Indiana stream fish assemblage:a test of community theory. The American Naturalist, 1982, 120(4): 423-454. DOI:10.1086/284004 |
| [34] |
Matthews WJ. Fish faunal "breaks" and stream order in the eastern and central United States. Environmental Biology of Fishes, 1986, 17(2): 81-92. DOI:10.1007/BF00001739 |
| [35] |
Yan YZ, Xiang XY, Chu L et al. Influences of local habitat and stream spatial position on fish assemblages in a dammed watershed, the Qingyi Stream, China. Ecology of Freshwater Fish, 2011, 20(2): 199-208. DOI:10.1111/eff.2011.20.issue-2 |
| [36] |
王文剑, 储玲, 司春等. 秋浦河源国家湿地公园溪流鱼类群落的时空格局. 动物学研究, 2013, 34(4): 417-428. |
| [37] |
Fu CZ, Wu JH, Chen JK et al. Freshwater fish biodiversity in the Yangtze River basin of China:patterns, threats and conservation. Biodiversity and Conservation, 2003, 12(8): 1649-1685. DOI:10.1023/A:1023697714517 |
| [38] |
Kang B, He DM, Perrett L et al. Fish and fisheries in the Upper Mekong:current assessment of the fish community, threat and conservation. Reviews in Fish Biology and Fisheries, 2009, 19(4): 465-480. DOI:10.1007/s11160-009-9114-5 |
 2016, Vol. 28
2016, Vol. 28 


 Hemiculter leucisculus (ct)
Hemiculter leucisculus (ct)