(2: 广东省水库蓝藻水华防治中心, 广州 510632)
(2: Guangdong Center for Protection and Control of Cyanobacterial Blooms in Reservoirs, Guangzhou 510632, P. R. China)
浮游植物是水域生态系统中重要组成部分,其数量与种类多样性是水质监测和评价的重要指标[1-3].在每种浮游植物具有相同物理性质情况下,理论上我们从采集一定体积的水样经固定浓缩后在显微镜下计数,然后根据浮游植物细胞的形态按最近似的几何形态测量必要的量度,可以较为准确地计算出浮游植物的体积和生物量,这正是传统浓缩法的原理[4-6].然而由于不同种类的浮游植物具有相同物理性质这一假设通常难以满足,特别是对于贫营养水体的种类多样性很高时,浮游植物的个体之间细胞大小、形态与比重相差很大,计数过程中的随机取样具有偏向性,导致最终计算的浮游植物细胞密度与生物量有很大偏差,种类丰富度和多样性指数也存在明显的偏差,当这些数据用于群落分析与水质比较时难以保障结论的可靠性[7].陈纯等系统地分析了浮游植物定量过程中生物量计算可能产生的误差[8],Zarauz等比较分析了活体样品与加固定剂样品在生物量上的差别[9].样品浓缩法经过沉淀、浓缩、再随机取样镜检等多个步骤方能完成计数工作,每一步骤都会产生误差,并耗时较长.针对传统的样品浓缩法存在的问题,Utermhl提出了倒置显微镜计数方法,也称为沉淀杯方法或Utermhl计数法[10].从1978年起联合国教科文组织将倒置显微镜计数方法编入浮游植物手册,该方法已成为国际上浮游植物计数和种类调查的常规方法.在理论上,倒置显微镜计数方法是对原水进行显微镜计数,减少了浓缩过程的损失,可提供较好的数据质量.由于需要倒置显微镜和特殊的沉淀杯等限制,多数发展中国家仍以传统的浓缩法为主[11].由于对倒置显微镜法的使用还十分有限,多数计数人员对该方法及基于该方法所获得的数据可靠性缺少了解,也是限制该方法在我国推广的一个因素.
在倒置显微镜计数方法中,通过在计数杯中直接沉淀达到浓缩的目的.先将鲁哥试剂固定的水样摇匀后注入沉降管中,盖好盖玻片静置沉淀,静置时间在24 h以上[12-13],或根据使用的沉降管的高度选择静置时间,确保藻细胞完全沉降,静水状态下微小浮游植物下沉1cm需要4h[14].再将沉淀好的水样上清液移除,盖好盖玻片(不能有气泡),在倒置显微镜下计数沉淀在计数杯底座载玻片上的浮游植物[10].Lund等针对沉淀杯体积建议了沉淀时间:100ml需沉淀18h,10ml需沉淀3h,1ml需沉淀1h[14].而Willén推荐的沉淀时间则较长[15].
本研究的水样采集于3座不同营养水平水库的敞水区以及3种不同处理组的实验围隔,这些样品提供了多样化的浮游植物群落类型.本文对沉淀浓缩过程在浮游植物定量结果中的影响进行分析,为采用倒置显微镜法的人员和实验室了解和掌握该方法在沉淀体积、沉淀时间、计数个体数等具体操作以及改善数据可靠性等方面提供参考.
1 材料与方法 1.1 采样地点与采样方法浮游植物定量样品采集于3个不同营养水平的大型水库及3组不同处理的实验围隔,3座水库分别为广东省广州市从化区处于贫中营养水平的流溪河水库(23°45′N,113°46′E)、广东省茂名市处于中营养水平的高州水库(22°2′N,111°1′E)和广东省江门市处于富营养水平的大沙河水库(22°30′N,112°21′E)[16].实验围隔3个处理组分别为添加营养盐组、添加鱼类组和1个对照组,每个处理组均有5个平行,每个实验围隔的体积为90m3[17].
于2013年5月对3座水库进行一次性定量分析样品的采集,同时测定了水体的相关理化指标及叶绿素a浓度[18].3座水库浮游植物定量分析样品用采水器在敞水区表层0.5m处采得,采集水样的体积为10L,混合均匀后分装350ml和1000ml聚乙烯塑料瓶各5个.350ml的5瓶水样编号为a、b、c、d、e,每瓶加3.5ml鲁哥试剂固定,采用倒置显微镜法进行定量计数;5个1000ml水样加福尔马林试剂固定,采用样品浓缩法进行定量计数.2013年7月对15个实验围隔进行一次性采样,每个围隔在表层0.5m处采集350ml水,每瓶水样加3.5ml鲁哥试剂固定,以待下一步的沉淀浓缩和镜检.
鲁哥试剂配方:20g KI和10g I2溶于200ml蒸馏水[10].
1.2 样品处理及计数方法所有水样的处理和计数方法保持一致.根据水库的营养水平选择沉淀杯体积:流溪河水库的样品选择50ml沉淀杯,静置沉降15h;高州水库的样品选择10ml沉淀杯,静置沉淀3h;大沙河水库的样品选择3ml沉淀杯,静置沉淀1.5h;围隔样品选择10ml沉淀杯,静置沉淀3h.通过静置沉淀浓缩后,移去沉降管及里面的清液,将浓缩在计数框底座载玻片上的浮游植物在倒置显微镜下进行计数.
将计数框底座载玻片置于倒置显微镜下进行浮游植物镜检和计数.首先在10×10倍镜下对载玻片上所有体积较大的浮游植物(>20μm)进行计数;然后在10×40倍镜下对较小浮游植物(2~20μm)进行计数,计数的视野数量以能计数500个个体为止,同时计数时将这500个个体分为5个100的计数段,且保证视野在载玻片上均匀分布[9].在计数过程中,如碰到某些个体一部分在视野中,部分在视野外,可只对出现在视野上半圈的浮游植物计数,而出现在下半圈的浮游植物不计数,如全部计数会导致定量结果偏高[5].采用5种个体计数等级:1代表 100个个体计数量,即从用上述方法在10×40倍下计数的5个100的计数段中随机抽取一个计数段的个体;2代表 200个个体计数量,即从用上述方法在10×40倍镜下计数的5个100的计数段中随机抽取2个计数段的个体;3代表 300个个体计数量,即从用上述方法在10×40倍镜下计数的5个100的计数段中随机抽取3个计数段的个体;4代表 400个个体计数量,即从用上述方法在10×40倍镜下计数段中随机抽取4个计数段的个体;5代表 500个个体计数量,即从用上述方法在10×40倍镜下计数5个计数段的个体.在10×40倍下计数的个体计算出密度加上在10×10倍镜下进行整片计数的细胞密度即样品的细胞密度,每个样品有5种计数等级产生的细胞密度值,即a1~a5、b1~b5、c1~c5、d1~d5、e1~e5.
1.3 浮游植物鉴定和群落细胞密度、群落生物量及辛普森多样性指数计算浮游植物种类鉴定主要参照有关文献的描述及图鉴[19].
基于倒置显微镜法,每个样品分别镜检5个计数段的浮游植物,并分别计算镜检每个计数段所对应的细胞密度.藻细胞密度计算公式为:
| $ N = \frac{{C\cdot{D^2}}}{{V{\cdot}n\cdot{d^2}}} $ | (1) |
式中,N为原水的藻细胞密度(cells/ml),V为沉降水样的体积(ml),D为载玻片直径(mm),d为计数镜头直径(mm),n为计数镜头数,C为计数细胞数(cells).
在常见的浮游植物生物量计算方法中,可归纳为4种不同的生物量计算方法:标准法、细分法、粗分法和资料法[20-21].粗分法克服了细分法繁琐耗时的缺陷,在保证数据具有较高可靠性的前提下有效节省了时间和人力,是计算浮游植物生物量的高效方法,所以在本研究中两种定量方法均采用粗分法进行生物量计算[8].
计算镜检每个计数段所对应的浮游植物群落辛普森多样性指数(Simpson's diversity index,D),测定各水库中镜检每个计数段所对应的浮游植物群落物种多样性.计算公式为:
| $ D = 1 - \sum {\left( {\frac{{{N_i}}}{N}} \right)^2} $ | (2) |
式中,Ni为i物种的个体数,N为总个体数[22].
1.4 浮游植物定量数据的均值及偏差计算用随机选择a1有C51即5种结果,选取其中4个值计算a1的均值和偏差,同理计算a2~a4的均值和偏差.得出各1、2、3、4计数段对应的各定量数据的平均值及偏差.采用群落多样性稀疏方法(rarefaction)提供对不同平行样品(a~e)所代表的群落结构进行比较.所有计算在R语言中实现[23].
2 结果与分析 2.1 不同计数量的浮游植物细胞密度、生物量与群落多样性对计数量为随机化抽取的a1、a2、a3、a4、a5定量数据进行比较,发现浮游植物细胞密度随着计数个体数的增加趋于稳定,偏差减小(图 1).计数a4的生物量数据基本趋于稳定,且偏差相对a1、a2、a3、平行所得数据偏差较小(图 1).计数量与浮游植物种类数偏差呈负相关性,即随计数量的增加,浮游植物种类数偏差降低(图 2).
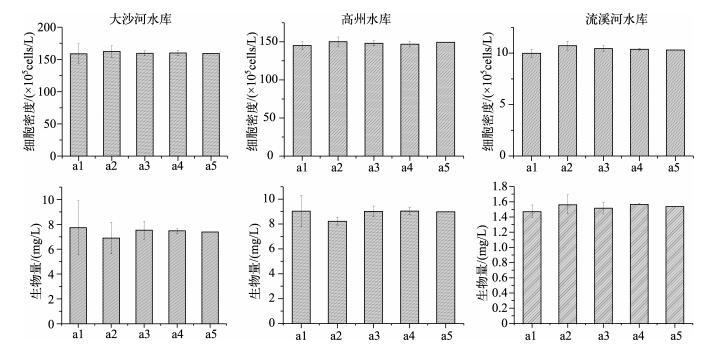
|
图 1 不同计数量下浮游植物丰度与生物量的比较 Fig.1 Cell density and biomass of phytoplankton under different counting individuals |
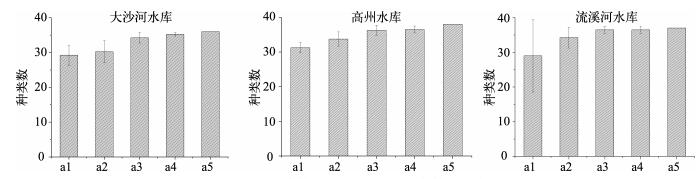
|
图 2 不同计数量下浮游植物种类数的比较 Fig.2 Observed species richness of phytoplankton under different counting individuals |
根据2.1节数据分析,每个水样计数4个计数段时生物量、细胞密度和种类丰富度接近计数5个计数段个体下的值,并且数据偏差比计数1、2、3个计数段的偏差小.因此,在Lund等推荐的这一计数量(400个体)下,进行不同水库同一采样点的平行水样定量结果比较(图 3),3座水库的5个平行样品之间的细胞密度、生物量、辛普森指数都有较大差别.单个(瓶)浮游植物样品的细胞密度与5个(瓶)浮游植物样品的平均细胞密度之间最大相差24.36%;单个(瓶)浮游植物样品的生物量与5个(瓶)浮游植物样品的平均生物量之间最大相差70.38%;浮游植物群落辛普森指数最大相差37.13%.
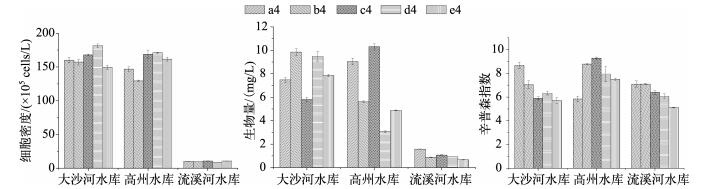
|
图 3 每个样品计数400个个体下各水库的5个平行样品中浮游植物细胞密度、生物量、辛普森指数 Fig.3 Cell density, biomass and Simpson index of phytoplankton from three reservoirs under counting 400 units |
图 4给出了3座水库各自计数4个计数段及计数5个计数段所对应的浮游植物群落种类稀疏曲线,它们提供不同样品所对应群落结构的比较.计数细胞数不同时,观测到的浮游植物种类不同.两座营养水平较高的水库(大沙河水库和高州水库)计数4个计数段和计数5个计数段所观测到的种类数基本达到稳定,而营养水平较低的流溪河水库中计数4个计数段和计数5计数段所观测到的种类数均未达到渐进线.
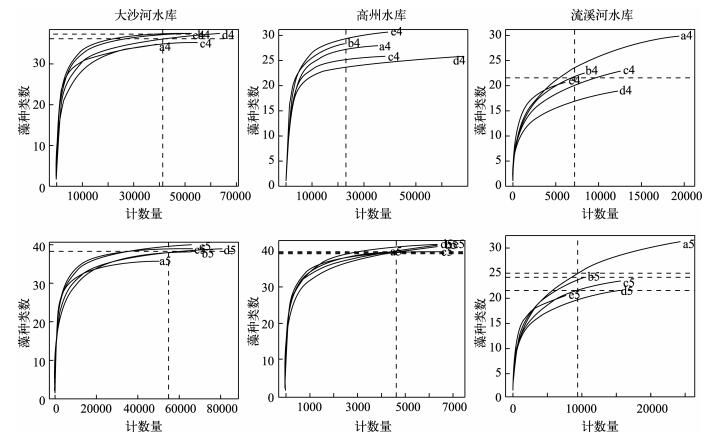
|
图 4 3座水库平行水样分别计数400个体(a4~e4)及计数500个体(a5~e5)时所对应的浮游植物群落种类稀疏曲线 Fig.4 Rarefaction curves of species richness in five repeated water samples from three reservoirs with distinct trophic states under counting 400 (a4-e4) and 500 individuals (a5-e5) |
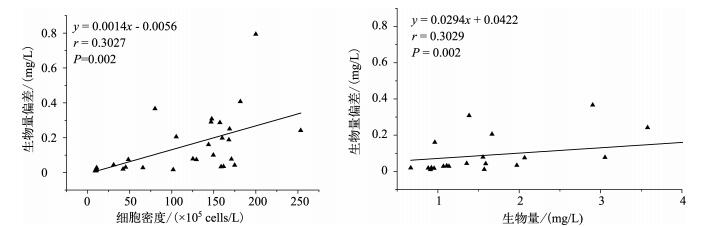
对计数400个个体的浮游植物定量数据进行偏差分析,以了解浮游植物细胞密度和生物量对定量数据偏差的影响分析.生物量偏差与浮游植物细胞密度、生物量之间均有显著相关性(图 5).水体浮游植物细胞密度的高低对定量计数结果的稳定性有着较为明显的影响,细胞密度越高,定量计数结果数据稳定性越低.浮游植物生物量与生物量偏差有显著正相关性,说明浮游植物生物量越高,定量计数结果的稳定性越低.
|
图 5 浮游植物生物量偏差与样品细胞密度及生物量的回归关系 Fig.5 Relationships between data quality (standard deviation) and the total counting cell density and biomass |
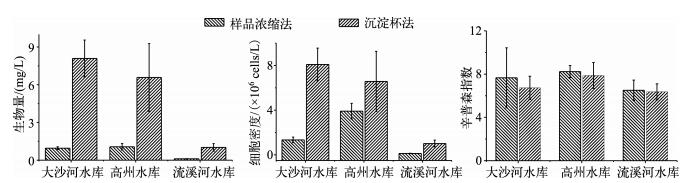
根据样品浓缩法相关文献及上文结论,对倒置显微镜法计数400个个体及样品浓缩法计数4片平行的定量数据进行对比分析(one-way ANOVA),两种定量计数方法所得的生物量数据有显著差异(P流溪河水库<0.001,P高州水库<0.001,P大沙河水库<0.001);两种定量数据方法所得的浮游植物细胞密度数据有显著差异(P流溪河水库<0.001,P高州水库<0.005,P大沙河水库<0.001);两种定量方法所得的辛普森指数无显著差异(P流溪河水库=0.551,P高州水库=0.601,P大沙河水库=0.812).样品浓缩法所得的浮游植物生物量和细胞密度要小于倒置显微镜法计算所得的生物量和细胞密度,但两种方法得到的辛普森指数相近(图 6).
|
图 6 两种定量计数方法所得的浮游植物生物量、细胞密度及辛普森指数对比 Fig.6 Comparison of biomass,cell density and Simpson index of three phytoplankton communities counted by two methods |
倒置显微镜法的计数量控制为在10×40倍镜下镜检不少于400个个体即可[24].本研究采用的是10×10倍下镜检整片浮游植物计数板,10×40倍镜下随机选取视野镜检多于400个个体.10×10倍镜下镜检整片浮游植物计数板可以减少大个体浮游植物及稀有种无法被镜检的概率,稀有种对定量结果影响较大,因此10×10倍下镜检整片浮游植物计数板非常必要[8].
在本文计数方法下,浮游植物计数个体数的增加对定量数据的影响并不明显,但在一定范围内随计数个体数的增加可检出更多种类,浮游植物细胞密度和生物量偏差均减小,所以镜检计数的个体数增加可使定量结果更加接近真实值并提高定量结果的可信度.但本文数据分析表明,一般情况下计数400个个体即可使细胞密度、生物量的偏差较小,从而保证数据的稳定性和可靠性.
3.2 平行样品数与浮游植物定量偏差的关系在实际研究中经常出现不同研究人员在相同时间、同一水体、同一地点采样测得的数据有较大偏差的现象.造成这种偏差的原因可能有多方面,其中计数方法和样品平行性差异被认为是主要的.浮游植物群落的特点,如密度、生物量也是影响生物量偏差的重要因素.密度和总生物量的提高会增加这类偏差,说明浮游植物密度越高的水体由单个样品计数计算出的浮游植物定量数据不稳定性也越高.倒置显微镜法所镜检的样品未经虹吸浓缩和浓缩液转移处理,理论上所得的定量数据能够相对准确地反映出浮游植物现存量.但在浮游植物种类较多的情况下,倒置显微镜法所鉴定出的浮游植物种类数可能会低于样品浓缩法所鉴定出的种类数.倒置显微镜法对一些自然水体中稀有浮游植物种类的检测不够,倒置显微镜法一次镜检的最大水样体积是100ml,并且根据营养水平的增加减少沉淀镜检样品体积,这样会造成镜检到稀有种的概率降低[14].稀疏曲线提供分析和比较不同样品种类数的方法,这种方法在开展多样性分析时更为有效.从我们对采样水库平行样品之间的比较来看,样品的可重复性因水体的性质变化而变化,贫营养水体样品重复性相对较低.导致平行样品定量数据之间存在差别的原因,一方面与水样之间的可重复性有关,另一方面与沉淀过程的可重复性有关.为此可以通过增加镜检平行样品的方法来弥补种类多样性方面研究的不足.为提高浮游植物定量数据的可靠性,在条件允许的情况下采集平行样品是必要的,可靠的水质等级评价和划分更需要以足够的平行水样来保证数据质量和评价结果的可靠性.
3.3 沉淀体积及时间的确定为保证不影响正常镜检,避免藻类重叠而影响计数,倒置显微镜法的沉淀体积需根据待检测水样的营养水平及藻细胞密度而定,寡中营养水平水体沉淀50ml(如流溪河水库),中营养水平水体沉淀10ml(如高州水库),中富营养水平水体沉淀3ml(如大沙河水库).为了避免计数框高沉降柱对浮游植物细胞的黏附作用引起的误差,尽量减少使用100ml的高沉降柱(20cm高),可通过增加计数个体数来提高数据质量.
Lund等推荐的沉淀时间为:100ml沉淀18h,10ml沉淀3h,1ml沉淀1h[14].而Willén则推荐:10ml沉淀8h,50ml或100ml沉淀48h[15].但对于不同水体强行要求沉淀时间并不合适,应根据观测目的和水样的不同适当调整沉降时间[10].另外,通过鲁哥试剂染色的浮游植物细胞重量会增加,沉降速率也有所增加,可适当减少沉降时间以便提高监测效率.
3.4 样品浓缩法及倒置显微镜法的对比两种定量计数方法计算所得的辛普森指数无显著差异,说明两种方法所得结果均能反映浮游植物群落结构的整体指标.但样品浓缩法通过沉淀、浓缩、再随机取样镜检等多个步骤方能完成计数工作,每一步都有误差产生.样品浓缩法一般取1000ml样品在聚乙烯瓶中静置沉淀后再进行虹吸浓缩,1000ml聚乙烯瓶的内壁面积及沉淀高度远高于沉淀杯的沉降柱内壁面积及沉淀高度,因此样品浓缩法在沉降过程、虹吸过程无法避免浮游植物的损失,使通过样品浓缩法所得的浮游植物群落生物量及细胞密度与倒置显微镜法相比偏小.
倒置显微镜法中使用的Utermhl计数框密封性较好,水分蒸发对浮游植物计数的准确性基本无影响.对样品浓缩法而言,为避免水分蒸发的影响,则要求计数者对每片样品的计数在1h内完成.浓缩法监测规范通常要求计数2片平行,但4片平行才能保证定量结果的稳定性[7],然而采用倒置显微镜法计数400个体通常需要2h左右.由此可见,倒置显微镜法与传统样品浓缩法相比,沉淀及计数时间都较短,更适合用于水华暴发等临时性应急水质监测.
4 结论1) 倒置显微镜法对原水样进行镜检时,减少了浓缩及取样过程中产生的误差,能够较准确地计数.倒置显微镜法计数通过增加计数个体数可提高定量数据的稳定性,计数400个个体时数据基本稳定.
2) 浮游植物样品的沉淀体积要根据水体的营养水平及浮游植物细胞密度而定,为不影响镜检计数可行性和减少高沉降柱带来的误差,建议寡营养水体选择50ml沉淀杯,中营养水体选择10ml沉淀杯,富营养水体选择3ml沉淀杯.
3) 倒置显微镜法与传统样品浓缩法相比,沉淀及计数时间都较短,更适合用于水华暴发等临时性应急水质监测.
4) 相比传统的浓缩法,倒置显微镜法采用了统一的计数量,这为方法的统一与标准提供了定量控制,也为长期观测数据的可比性奠定了基础.
| [1] |
Bianchi F, Acri F, Aubry FB et al. Can plankton communities be considered as bio-indicators of water quality in the Lagoon of Venice?. Marine Pollution Bulletin, 2003, 46: 964-971. DOI:10.1016/S0025-326X(03)00111-5 |
| [2] |
Reynolds CS. Ecology of Plankton. Cambridge: Cambridge University Press, 2006.
|
| [3] |
Richardson TL, Gibson CE, Heaney SI et al. Temperature, growth and seasonal succession of phytoplankton in Lake Baikal, Siberia. Freshwater Biology, 2000, 44: 431-40. DOI:10.1046/j.1365-2427.2000.00581.x |
| [4] |
王冀, 王建. 浮游植物的采集、计数与定量方法. 水库渔业, 1982, 4: 58-63. |
| [5] |
孙军, 刘东艳, 钱树本. 浮游植物生物量研究Ⅰ.浮游植物生物量细胞体积转化法. .海洋学报, 1999, 1(2): 75-85. |
| [6] |
Sun J, Liu D. Geometric models for calculating cell biovolume and surface area for phytoplankton. Journal of Plankton Research, 2003, 25(11): 1331-1346. DOI:10.1093/plankt/fbg096 |
| [7] |
牛海玉, 陈纯, 韩博平. 基于浓缩法的浮游植物定量数据稳定性与可靠性分析. 湖泊科学, 2015, 27(5): 776-782. DOI:10.18307/2015.0503 |
| [8] |
陈纯, 李思嘉, 胡韧等. 四种浮游植物生物量计算方法的比较分析. 湖泊科学, 2013, 25(6): 927-935. DOI:10.18307/2013.0617 |
| [9] |
Zarauz L, Irigoien X. Effects of Lugol's fixation on the size structure of natural nano-microplankton samples, analyzed by means of an automatic counting method. Journal of Plankton Research, 2008, 30(11): 1297-1303. DOI:10.1093/plankt/fbn084 |
| [10] |
Edler L, Elbrächter M. The Utermöhl method for quantitative phytoplankton analysis. In:Karlson B, Cusack C, Bresnan E eds. Microscopic and molecular methods for quantitative phytoplankton analysis. Paris:UNESCO, 2010:110.
|
| [11] |
金相灿. 湖泊富营养化调查规范. 第2版. 北京: 中国环境科学出版社, 1990, 239-245.
|
| [12] |
McDermott G, Raine R. Settlement bottle method for quantitative phytoplankton analysis. Microscopic and molecular methods for quantitative phytoplankton analysis. Paris:UNESCO, 2010:21-24.
|
| [13] |
Rott E, Salmaso N, Hoehn E. Quality control of Utermöhl-based phytoplankton counting and biovolume estimates-an easy task or a Gordian knot?. Hydrobiologia, 2007, 578(1): 141-146. DOI:10.1007/s10750-006-0440-5 |
| [14] |
Lund JWG, Kipling C, LeCren ED. The inverted microscope method of estimating algal numbers and the statistical basis of estimations by counting. Hydrobiologia, 1958, 11(2): 143-170. DOI:10.1007/BF00007865 |
| [15] |
Willén E. A simplified method of phytoplankton counting. British Phycological Journal, 1976, 11(3): 265-278. DOI:10.1080/00071617600650551 |
| [16] |
林秋奇, 胡韧, 段舜山等. 广东省大中型供水水库营养现状及浮游生物的响应. 生态学报, 2003, 23(6): 1102-1108. |
| [17] |
陈晓玲, 程丹, 李慧明等. 南亚热带水库中盔形溞牧食对浮游植物群落影响的围隔试验. 水生态学杂志, 2012, 33(3): 20-26. |
| [18] |
林少君, 贺立静, 黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11. |
| [19] |
胡鸿钧, 魏印心. 中国淡水藻类:系统分类及生态. 北京: 科学出版社, 2006.
|
| [20] |
Hillebrand H, Dürselen CD, Kirschtel D et al. Biovolume calculation for pelagic and benthic microalgae. Journal of Phycology, 1999, 35(2): 403-424. DOI:10.1046/j.1529-8817.1999.3520403.x |
| [21] |
王骥, 王建. 浮游植物的叶绿素含量、生物量、生产量相互换算中的若干问题. 武汉植物学研究, 1984, 2(2): 249-258. |
| [22] |
Heip C, Engels P. Comparing species diversity and evenness indices. Journal of the Marine Biological Association of the United Kingdom, 1974, 54(3): 559-563. DOI:10.1017/S0025315400022748 |
| [23] |
R Development Core Team. R:A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. 2008, ISBN 3-900051-07-0, URL http://www.R-project.org.
|
| [24] |
孙军, 刘东艳, 钱树本. 一种海洋浮游植物定量研究分析方法Utermöhl方法的介绍及其改进. 黄渤海海洋, 2002, 20(2): 105-112. |
 2016, Vol. 28
2016, Vol. 28 

