(2: 南京师范大学地理科学学院, 江苏省环境演变与生态建设重点实验室, 南京 210023)
(3: 中国科学院南京地理与湖泊研究所, 南京 210008)
(2: College of Geographical Science, Nanjing Normal University, Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Nanjing 210023, P. R. China)
(3: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
磷是影响湖泊富营养化的关键性限制因素之一[1-2],同时也是植物生长发育的必需元素.近年来恢复及重建水生植物的生态修复方法成为修复湖泊生态系统的重要途径[3-5],而沉水植物的恢复和重建是修复湖泊生态系统的重点和难点[6-9].沉水植物作为水生生态系统的初级生产者,对整个水体生态系统的结构与功能和系统稳定性有决定性的影响[10-11].在生境条件得到有效改善后,沉水植物会大量繁殖[12],其在生长过程中可以通过根系和茎叶吸收沉积物和水中的氮、磷[13-14].然而,沉水植物的生长具有一定的周期性,多数在7-8月生物量达到最大,秋、冬季植株死亡并逐渐腐败分解,向水体和沉积物释放营养盐,该过程对水体水质及气候回暖后水体环境状况具有很大的影响[15-18].湖泊水生植物腐烂分解作为湖泊生态系统物质循环和能量流动的关键环节,是维持湖泊生态系统功能的主要过程之一[19-20].目前,关于沉水植物衰亡腐烂分解的研究较多,主要集中在沉水植物的分解时间、分解速率、释放多少氮磷等方面,而对其体内磷在上覆水和沉积物之间的迁移转化规律及影响因素等机制研究较少.本研究在实验室模拟的条件下,研究根系发达的沉水植物苦草(Vallisnerianatans)衰亡过程中对上覆水和沉积物中各形态磷的影响,以期为湖泊内源磷的控制和治理提供理论依据.
1 实验材料与设计 1.1 实验设计沉积物利用彼得森采泥器采自南京典型富营养化水华暴发水体——月亮湾(32°06′10″N,118°54′14″E).采集的样品低温风干后过100目筛,去除粗粒及动植物残体,然后充分混匀.将混匀后的沉积物置入高密度聚乙烯桶(顶直径×底直径×高=55 cm×45 cm×75 cm,实验桶预先经过5 %的HCl处理后用蒸馏水冲洗干净),沉积物平均厚度为10 cm,干重为4821.00g.然后缓慢注入暴晒3d后的自来水100L(总磷(TP)浓度为0.02 mg/L).
沉水植物苦草采自南京固城湖(31°14′N,118°53′E),并经驯化培养2个月,实验所种植的为形状均一的苦草幼苗.
1.2 实验方法实验设置3个沉水植物苦草组和3个不种植沉水植物的对照组,苦草每桶种植鲜重为835±25 g.实验时间为10月至次年1月.实验桶内部冬季晴天和阴天平均光照强度分别为108和85 μmol/(m2·s),测定时间为13:00.水温控制在5~25℃(必要时采用3个空调调节室内温度),各桶间水温差异小于2℃.
1.3 取样与分析水样采集采用虹吸管抽取的方式,每次采集水面以下5、20和45 cm处的等体积水(50 ml)混匀.并每隔30 d补充一定量的无磷水,以弥补蒸发和采样带来的水量损耗.直接采用过硫酸钾氧化法测定上覆水TP浓度;将水样预先过0.45 μm孔径的醋酸纤维滤膜,而后用过硫酸钾氧化法测定可溶性总磷(DTP)浓度;将水样预先过0.45 μm孔径的醋酸纤维滤膜,而后用钼-锑-钪比色法测定溶解性活性磷(SRP)浓度.用Skalar(荷兰)流动分析仪测定磷浓度.颗粒磷(PP)浓度为TP与DTP浓度之差,可溶性有机磷(DOP)浓度为DTP与SRP浓度之差.每个样品均重复测定3次.
沉积物样品采用微型柱状采泥器采集,每次均匀采集5个微型柱状样,采集后的样品低温风干,然后对风干前后的样品称重以计算由采样带来的TP和水量的损耗.将风干后的沉积物样品与植物根系分离,过100目筛后充分混匀,然后进行沉积物中各形态磷的分析.采集沉积物样品的同时采集植物样品,测定生物量,并分析植物中磷含量.沉积物样品磷形态分析采用国际通用的SMT法[21-22].植物和上覆水中磷浓度参照文献[23]进行分析.
间隙水采用陶土头渗滤装置进行采集,在采集上覆水的同时采集间隙水.上覆水中物理指标溶解氧(DO)、pH值、温度采用在线监测YSI(美国)6820-C-O型多参数水质测定仪测定.氧化还原电位(Eh)采用上海雷磁铂电极测定.光照强度采用LT/G光照度传感器(北京前景惠邦温室控制技术有限公司)在线监测.
1.4 生物量统计在沉水植物苦草衰亡期,统计沉水植物苦草衰亡阶段的叶片长度(X1,单位为cm).苦草根系相对较发达,对地下根系总数进行统计,用地下根系总数除以地上叶片总数的方法,将根系均匀分配到叶片之中,然后统计其平均长度,折算成苦草的总长度.同时,统计苦草的叶片宽度(X2,单位为cm),通过统计建立不同植物生物量(W,单位为g)和叶片之间的函数关系,以推算沉水植物在生长过程中的生物量,生物量为植物湿重[24].沉水植物苦草衰亡期的生物量函数推算关系为:
| $ {W_{苦草}} = 0.0202{X_1} + 0.1862{X_2} - 0.2235({R^2} = 0.83,P < 0.05) $ | (1) |
实验所得数据采用SPSS13.0统计软件进行分析,P<0.05表示差异显著,P<0.01表示差异极显著,实验数据采用平均值±标准差表示.
2 实验结果 2.1 苦草衰亡期上覆水各形态磷浓度的变化在本实验条件下,苦草组在衰亡过程中上覆水中各形态磷浓度的变化相对较平稳,与对照组相比均无显著差异(P>0.05).苦草组上覆水中TP浓度先降低后上升,然后保持在相对稳定水平,在实验第20 d达到最小值(0.037 mg/L),在第40 d缓慢上升,在第50 d时,上覆水中TP浓度达到0.059 mg/L,较实验初始时上升了0.018 mg/L,然后在实验第70~110 d期间,上覆水中TP浓度均保持在0.057 mg/L,保持在相对稳定的水平,且在实验期间苦草组上覆水中TP浓度相对低于对照组.苦草组其他各形态磷浓度在衰亡过程中变化也相对较平稳,在实验结束时上覆水中DTP、SRP、PP、DOP浓度分别为0.046、0.007、0.011和0.040 mg/L,较实验初始值分别上升了0.013、0.0026、0.0030和0.011 mg/L,且在实验期间苦草组上覆水中DTP和DOP浓度相对低于对照组(图 1).因此,苦草在其衰亡过程中并没有引起上覆水中各形态磷浓度的显著升高.
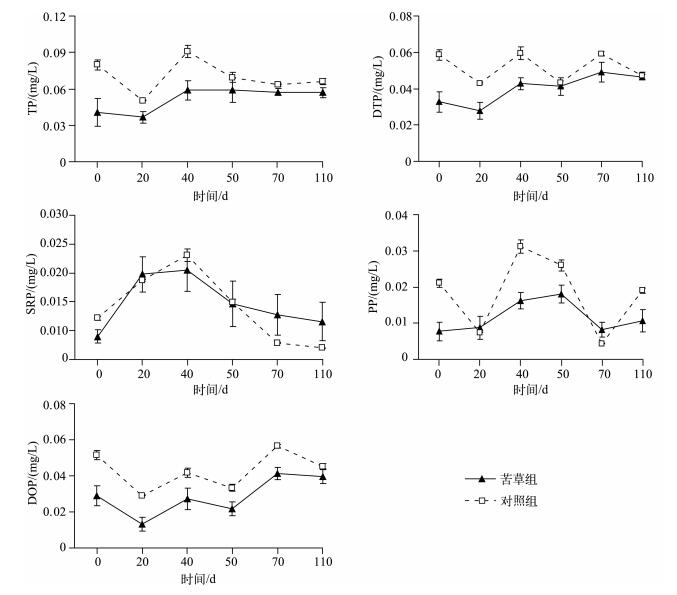
|
图 1 实验期间上覆水中各形态磷浓度的变化(数据为平均值±标准偏差, n=9) Fig.1 Changes of different phosphorus concentrations in overlying water during the experiment course |
在本实验条件下,苦草组在衰亡过程中间隙水中各形态磷浓度均呈明显的下降趋势,苦草组各形态磷浓度均显著低于对照组(P<0.05).在实验第70 d时,苦草组间隙水中DTP、SRP、DOP浓度均达到最低值,分别为0.20、0.13和0.060 mg/L,较实验初始值分别降低了0.29、0.20和0.11 mg/L.在实验结束时(第110 d),苦草组间隙水中DTP和DOP浓度较第70d时出现小幅上升,分别达到0.23和0.10 mg/L.在整个实验过程中,对照组间隙水中各形态磷浓度均保持在相对平稳的水平(DTP:0.55 mg/L;SRP:0.32 mg/L;DOP:0.23 mg/L),在实验第110 d时,对照组间隙水DTP和DOP浓度较第70d时出现小幅上升,分别上升了0.08和0.11 mg/L(图 2).因此,苦草在其衰亡过程中并未使得间隙水中各形态磷浓度升高,反而使得间隙水中各形态磷浓度呈显著下降趋势.

|
图 2 实验期间间隙水中各形态磷浓度的变化(n=9) Fig.2 Changes of different phosphorus concentrations in pore water during the experiment course(n=9) |
在本实验条件下,苦草组在衰亡过程中沉积物中各形态磷含量均呈小幅度上升趋势,但是苦草组和对照组各形态磷含量差异性均不显著(P>0.05).在实验结束时苦草组沉积物中TP、氢氧化钠提取磷(NaOH-P)、盐酸提取磷(HCl-P)、无机磷(IP)和OP含量分别为719.27、239.82、296.70、465.31和212.13 mg/kg,和实验开始时初始值相比较,分别上升了14.68、7.05、4.29、12.06和2.20 mg/kg(图 3).在实验结束时,NaOH-P和HCl-P升高量分别占IP升高量的58.46 %和35.57 %;IP和OP升高量分别占TP升高量的82.15 %和14.99 %.实验结果表明,苦草在衰亡过程中能使沉积物中各形态磷含量出现不同程度的升高,然而苦草组在衰亡过程中沉积物中各形态磷含量上升幅度较小,且与对照组各形态磷含量无显著差异,说明苦草衰亡过程对沉积物中各形态磷含量并未出现显著影响.
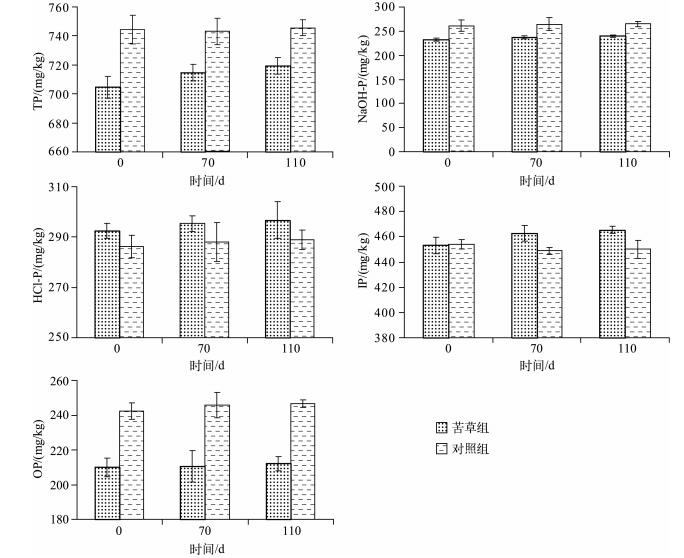
|
图 3 实验期间沉积物中各形态磷含量的变化(n=9) Fig.3 Changes in different phosphorus contents in sediment during the experiment course(n=9) |
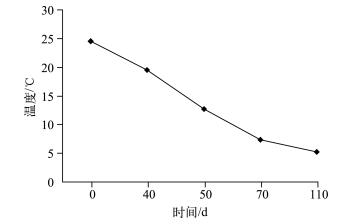
水生植物分解是一个复杂的生物物理化学过程,受到众多因素的影响[25].周边环境条件对水生植物的分解影响很大,例如温度、营养环境以及周边微生物的分布等均会对水生植物的分解产生很大的影响[26].温度是影响水生植物分解速率的重要环境因子之一,温度升高使微生物的活动变得活跃,从而加快植物分解的速率.Melillo等[27]比较了不同季节水生植物腐烂分解速率的变化,发现夏季水生植物残体分解速率明显高于冬季.叶春等[28]研究表明,随着温度的升高,黑藻分解速率也明显加快.由于植物自身的结构特点,不同沉水植物在衰亡期分解速率存在较大的差异,顶冠蓬伞状黑藻和菹草在衰亡期分解速率相对较高,而苦草则相对较低[24].根据本实验条件下苦草衰亡的实际进展,分别于实验开始后的第0、40、70、110 d统计苦草的生物量指标,计算出苦草在其衰亡过程中生物量的变化过程(图 4).在本实验条件下,苦草分解速率在实验前40d最大,平均为2.29 g/d;在第40~70 d时,苦草分解速率平均为1.96 g/d;在第70~110 d时,苦草分解速率达到最低,平均为0.63 g/d.在整个实验过程中,温度持续下降(图 5),使得苦草分解速率保持在相对较低的水平,平均为1.60 g/d,实验期间苦草较低的分解速率给沉积物以充足的缓冲时间,从而影响上覆水中的磷浓度,使得苦草组上覆水中的磷浓度无明显波动,这可能是导致实验期间苦草组上覆水中TP及其他各形态磷浓度变化相对平稳且较低的主要原因.
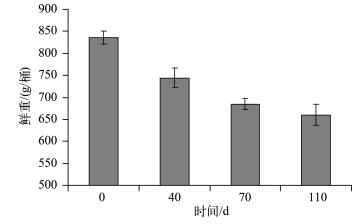
|
图 4 实验期间苦草生物量的变化(n=3) Fig.4 Changes in biomass of V.natans during the experiment course(n=3) |
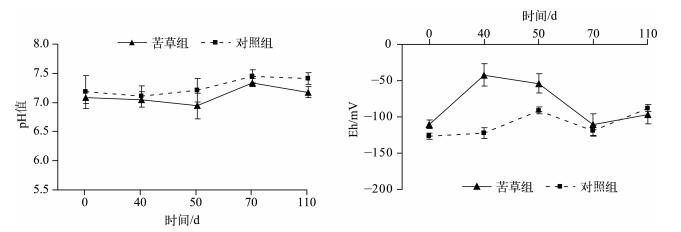
沉水植物在生长发育、衰亡及季相交替过程中,通过光合、呼吸、残体分解等作用,可以对上覆水的pH值、DO浓度、Eh等产生复杂的影响,并通过这些影响因子的变化进而影响到磷素的迁移转化[29-32].研究表明:pH值近中性范围内,磷酸盐主要以HPO42-和H2PO4-形态存在,最易与底泥中的金属元素结合而被底泥吸附,TP吸附量最大,而成为水体的“汇”;当pH值降低,在酸性条件下,磷主要以H2PO4-形态存在,Ca-P态化合物溶解度增加,导致磷的释放量增大[29],此时,沉积物成为水体的“源”;当pH值升高,在弱碱条件下,沉积物轻微吸收磷,吸收量和吸收速率随pH值升高而升高;但在强碱范围时,pH值升高,磷主要以HPO42-的形态存在,铁对磷的固定性减弱,磷酸盐的解析过程增强,使沉积物中更多内源磷释放到上覆水中,出现磷的二次释放[29, 33].在本实验条件下,在苦草衰亡实验中,苦草组上覆水中pH值变化平稳,几乎没有明显波动,pH值在实验期间呈弱碱性,与对照组无明显差异(P>0.05)(图 6).因此可认为苦草在其衰亡过程中对上覆水中pH值的影响不显著.但是上覆水还处于碱性环境中,由于碱性环境下有利于沉积物磷的释放,所以在苦草衰亡过程中pH值的改变促进了沉积物磷的释放.
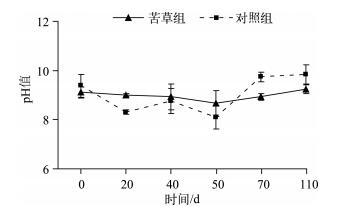
|
图 6 实验期间上覆水pH值的变化(n=9) Fig.6 Changes of pH in overlying water during the experiment course(n=9) |
水体环境因子的改变影响着沉积物对水体中磷的吸收与释放过程,研究表明较高的DO浓度和Eh有利于沉积物对磷的吸收[34-36].苦草组上覆水中DO浓度和Eh的变化在衰亡期间一直处于平稳上升趋势,无明显的下降(图 7).苦草组DO浓度和Eh和对照组无显著差异(P>0.05),因此,苦草在衰亡腐败过程中对上覆水中DO浓度和Eh的影响不显著.

|
图 7 实验期间上覆水DO浓度和Eh的变化(n=9) Fig.7 Changes of DO and Eh in overlying water during the experiment course(n=9) |
苦草组上覆水中各形态磷浓度与环境因子pH值、DO浓度、Eh均无显著相关(表 1).在苦草衰亡期,虽然上覆水中环境因子的改变会对上覆水中各形态磷浓度有一定的影响,但是其影响的幅度及范围偏小,不足以显著影响上覆水中各形态磷浓度.
| 表 1 上覆水中各形态磷浓度与环境因子之间Pearson相关系数矩阵 Tab.1 Pearson correlation coefficient matrix between phosphorus in overlying water and environmental factors |
间隙水和上覆水之间磷存在相互扩散过程,扩散的主要动力来自于间隙水和上覆水之间的磷浓度梯度[37].由于间隙水和上覆水之间的相互扩散,上覆水各形态磷浓度受间隙水中各形态磷浓度及间隙水与上覆水磷浓度梯度的共同影响.沉水植物通过根系吸收沉积物中的生物有效磷,有效减少沉积物间隙水中的磷向上覆水的扩散量;沉水植物还通过茎叶拦截、吸附水中的颗粒物质并且通过颗粒物质吸附水中的可溶性磷,有效地降低水中的磷及颗粒物负荷,沉水植物腐烂后沉积到沉积物中释放磷[38].在沉水植物生长过程中通过吸收上覆水中磷,使上覆水与沉积物间隙水之间磷浓度存在浓度梯度,从而使沉积物及间隙水中的磷向上覆水扩散[39].研究表明,环境温度下降导致沉积物释放磷量减少,从而使间隙水中各形态磷浓度表现为下降趋势[40].王圣瑞等[7]研究沉水植物黑藻对上覆水中各形态磷浓度的影响表明,7月和8月中国环境科学研究院池塘底泥间隙水中TP、SRP和DTP浓度呈升高趋势,并在8月初达到峰值,而后为下降趋势,间隙水对上覆水各形态磷浓度的影响主要与沉水植物吸收和环境温度等影响因素有关.在本实验条件下,温度变化呈明显的下降趋势,温度降低抑制沉积物向上覆水释放磷,从而使得间隙水中各形态磷浓度出现下降趋势,这可能是导致苦草衰亡过程中间隙水中各形态磷浓度呈明显下降趋势的主要原因之一.
在实验期间,苦草组上覆水各形态磷的浓度与间隙水中各形态磷的浓度呈不同程度的负相关,上覆水各形态磷浓度与间隙水和上覆水DTP浓度差、SRP浓度差呈负相关.上覆水中TP浓度受间隙水DTP和SRP浓度的影响显著;间隙水与上覆水DTP和SRP浓度差对上覆水DTP和SRP浓度具有显著影响(表 2).
| 表 2 苦草组上覆水与间隙水之间各形态磷Pearson相关系数矩阵 Tab.2 Pearson correlation coefficient matrix between phosphorus in overlying water and pore water of group V.natans |
沉积物环境因子的变化对湖泊中水和沉积物直接磷的迁移转化有着重要作用,将直接影响到沉积物对磷的释放与吸收过程.方差分析结果表明在沉水植物苦草衰亡实验过程中苦草组沉积物中pH值和Eh均与对照组无显著差异.在苦草衰亡腐败过程中沉积物pH值在7.0~7.5之间波动,属于中性范围(图 8).pH值是湖泊水环境的重要指标,对水环境的各种物理化学反应均有重要影响[41].pH值近中性范围内,沉积物颗粒和上覆水及间隙水界面中正磷酸盐主要以HPO42-和H2PO4-形态存在,最易与底泥中的金属元素结合而被底泥吸附,磷吸附量最大,因而,中性的沉积物环境有利于吸收磷,这可能是导致上覆水中磷浓度在实验后期一直呈降低趋势而沉积物各形态磷含量呈上升趋势的主要原因之一.
|
图 8 实验期间沉积物中pH值和Eh的变化(n=9) Fig.8 Changes of pH and Eh in sediment during the experiment course(n=9) |
Eh主要通过影响铁氧化物、锰氧化物、硫的氧化还原以及微生物新陈代谢来影响沉积物释磷作用.磷释放对表层沉积物Eh的变化非常敏感,沉积物中磷的释放和吸附都会因为表层沉积物Eh的变化而产生变化.在苦草衰亡实验过程中,苦草组Eh一直保持在相对较高的水平(图 8),较高的Eh可以增强沉积物对上覆水磷的吸附能力.这可能是导致实验后期上覆水中磷浓度呈降低趋势而沉积物各形态磷含量呈上升趋势的另一个主要原因.
温度对沉积物磷的迁移转换具有重要的影响.沉积物对磷的释放随温度升高而增强[42-43].研究表明,随温度的升高,磷释放过程中的物理化学反应平衡向溶解、解析的吸热方向移动,同时也提高了反应速率以及扩散速率;另一方面,温度升高促进了沉积物中的生物活动,特别是微生物的活性增强,耗氧增多,溶解氧减少,从而使氧化还原电位降低,使Fe3+还原为Fe2+,磷从正磷酸铁和Fe(OH)3沉淀物中释放出来[44-45].王庭健[46]对南京玄武湖沉积物磷释放的模拟实验表明,35℃比25℃时磷的释放率提高了1倍;Boers等[47]分别采集夏、冬季湖泊沉积物, 并分别在20、13、5℃模拟磷释放实验, 研究发现冬季样品的释放率没有明显的变化,而夏季样品则对温度十分敏感,每提高10℃磷释放率平均提高2倍;Liikanen[48]的实验也证明,无论好氧与厌氧,磷的释放都随温度升高而增加,温度升高1~3℃,沉积物中TP的释放增加9 % ~57 %.实验期间温度一直处于下降趋势(图 5),抑制沉积物中的磷向上覆水中释放,这可能是导致在实验后期上覆水中磷浓度呈降低趋势而沉积物各形态磷含量呈上升趋势的另一个主要原因.
|
图 5 实验期间温度变化 Fig.5 Changes of temperature during the experiment course |
植物体腐烂会导致有机质矿化[49-51].有机质本身是沉积物中主要磷库之一,同时又可以通过吸附影响磷的释放.有机质含量是影响沉积物吸附磷非常重要的原因之一.沉积物中有机质大部分与沉积物中的无胶体结合在一起,形成有机无机复合胶体.其中腐殖质能和铁、铝形成有机无机复合体,提供重要的磷酸盐吸附位点,从而增强沉积物对磷的吸附[52].也有研究表明有机质释放出的H+可使矿物表面基团质子化而有利于磷的吸附.有机质还能抑制无定性铝和铁氧化物的晶质化过程,提高其对磷酸盐的吸附能力[53].在苦草衰亡实验中,苦草衰亡腐败分解过程中植株腐败分解使得沉积物中各形态磷含量略升高,然而幅度较小,且与对照组各形态磷含量无显著差异.在实验结束时,苦草组IP含量较实验开始时上升了2.67 %,其中,NaOH-P和HCl-P升高量分别占IP升高量的58.46 %和35.57 %.由于各形态磷的不同组成及结合特点,导致各形态磷升高的原因也存在较大差异.在IP含量的变化中,NaOH-P含量变化幅度大于HCl-P,这主要和沉积物磷的结合性质有关.NaOH-P是与沉积物中易发生还原作用的铁、铝氧化物或氢氧化物结合的磷.通常认为这部分磷是较易于释放的,同时被认为是可被生物利用的磷[34, 54-55],在NaOH-P中磷主要以化学吸附的方式吸附于沉积物表面,因此在沉水植物苦草衰亡期沉积物中NaOH-P的升高主要是由于沉积物Fe、Al吸附水体中活性磷所导致的.HCl-P主要指与自生磷灰石、沉积碳酸钙以及生物骨骼等的含磷矿物有关的沉积磷存在形态,主要来自于生物颗粒的沉积和早期成岩作用形成的氟磷灰石[56],它是沉积物中较为稳定的磷形态,较难为植物所利用,因此,在实验结束时沉积物中HCl-P增长幅度较小.在实验结束时苦草组OP含量较实验开始时无显著差异,OP包括由陆源性排放物质组成的难降解性有机磷部分和由死亡的水生生物尸体组成的可降解性有机磷部分.其中可降解有机磷部分可以在早期成岩过程中随有机质的降解而释放,甚至向其它结合态磷转化[57-60].湖泊沉积物中OP具有部分活性,但是OP结构相对较稳定,植物利用相对较难.因此,在本实验条件下,沉水植物苦草在衰亡期对沉积物中各形态磷含量并未出现显著影响.
4 结论1) 沉水植物苦草在其衰亡过程中分解速率相对较低.
2) 沉水植物苦草衰亡对上覆水中各形态磷浓度影响均不显著,与对照组相比均无显著差异;对沉积物中各形态磷含量的影响均不显著,与对照组相比均无显著差异.
3) 通过室内模拟的方法研究沉水植物苦草衰亡对水-沉积物之间磷迁移的影响,由于实验条件的限制仅采用沉水植物苦草进行研究,不同沉水植物在衰亡期分解速率存在较大的差异,这方面的机理尚需要进一步探讨.不同沉水植物在衰亡期对水和沉积物之间磷迁移的影响也需要进一步研究.
| [1] |
Isemann K. Share of agriculture in nitrogen and phosphorous emissions into surface waters of western Europe against the background of their eutrophication. Fertilizer Research, 1990, 26: 253-269. DOI:10.1007/BF01048764 |
| [2] |
David LC. The role of phosphorus in the eutrophication of receiving water:a review. Journal of Environment Quality, 1998, 27: 261-266. |
| [3] |
王国祥, 濮培民, 张圣照等. 人工复合生态系统对太湖局部水域水质的净化作用. 中国环境科学, 1998, 18(5): 410-414. |
| [4] |
颜昌宙, 许秋瑾, 赵景柱等. 五里湖生态重建影响因素及其对策探讨. 环境科学研究, 2004, 17(3): 44-47. |
| [5] |
秦伯强, 高光, 胡维平等. 浅水湖泊生态系统恢复的理论与实践思考. 湖泊科学, 2005, 17(1): 9-16. |
| [6] |
文明章, 李宽意, 王传海. 水体的营养水平对苦草(Vallisneria natans)生长的影响. 环境科学研究, 2008, 21(1): 74-77. |
| [7] |
王圣瑞, 金相灿, 赵海超等. 沉水植物黑藻对上覆水中各形态磷浓度的影响. 地球化学, 2006, 35(2): 179-186. |
| [8] |
徐会玲, 唐智勇, 朱端卫等. 菹草、伊乐藻对沉积物磷形态及其上覆水水质的影响. 湖泊科学, 2010, 22(3): 437-444. DOI:10.18307/2010.0318 |
| [9] |
Hilt S, Gross EM, Hupfer M et al. Restoration of submerged vegetation in shallow eutrophic lakes-A guideline and state of the art in Germany. Limnologica-Ecology and Management of Inland Waters, 2006, 36(3): 155-171. DOI:10.1016/j.limno.2006.06.001 |
| [10] |
Ellen VD, Wouter JB. Impact of submerged macrophytes including charophytes on phyto-and zooplankton communities:allelopathy versus other mechanisms. Aquatic Botany, 2002, 72: 261-274. DOI:10.1016/S0304-3770(01)00205-4 |
| [11] |
Wang F, Liang LL, Zhang YS et al. Eco-hydrological model and critical conditions of hydrology of the wetland of Erdos Larus Relictus Nature Reserve. Acta Ecologica Sinica, 2009, 29(5): 307-313. DOI:10.1016/j.chnaes.2009.09.009 |
| [12] |
吴振斌, 邱东茹, 贺锋等. 沉水植物重建对富营养水体氮磷营养水平的影响. 应用生态学报, 2003, 14(8): 1351-1353. |
| [13] |
王立志, 王国祥, 俞振飞等. 苦草(Vallisneria natans)生长期对沉积物磷形态及迁移的影响. 湖泊科学, 2011, 23(5): 753-760. DOI:10.18307/2011.0513 |
| [14] |
俞振飞, 王国祥, 王立志等. 苦草(Vallisneria natans)和黑藻(Hydrilla verticillata)对沉积物各形态磷垂直分布的影响. 湖泊科学, 2012, 24(3): 378-383. DOI:10.18307/2012.0308 |
| [15] |
李文朝, 陈开宁, 吴庆龙等. 东太湖水生植物生物质腐烂分解实验. 湖泊科学, 2001, 13(4): 331-336. DOI:10.18307/2010.0407 |
| [16] |
潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律. 环境科学研究, 2008, 21(1): 64-68. |
| [17] |
Gao J, Xiong Z, Zhang J et al. Phosphorus removal from water of eutrophic Lake Donghu by five submerged macrophytes. Desalination, 2009, 242(1/3): 193-204. |
| [18] |
Asaeda T, Trung VK, Manatunge J. Modeling the effects of macrophyte growth and decomposition on the nutrient budget in Shallow Lakes. Aquatic Botany, 2000, 68(3): 217-237. DOI:10.1016/S0304-3770(00)00123-6 |
| [19] |
Hoorens B, Aerts R, Stroetenga M. Does initial litter chemistry explain litter mixture effects on decomposition. Oecologia, 2003, 137: 578-586. DOI:10.1007/s00442-003-1365-6 |
| [20] |
成小英, 王国祥, 濮培民等. 凤眼莲腐烂分解对湖泊水质的影响. 中国环境科学, 2004, 24(3): 303-306. |
| [21] |
朱梦圆, 朱广伟, 钱君龙等. SMT法插标分析沉积物中磷的地球化学形态. 中国环境科学, 2012, 32(8): 1502-1507. |
| [22] |
俞振飞, 王国祥, 钱君龙等. SMT法测定沉积物标准样品有机磷形态分析方法探究. 中国环境监测, 2013, 29(3): 117-122. |
| [23] |
Jensen HS, Anderson FO. Importance of temperature, nitrate, and pH for phosphate release from aerobic sediments of four shallow, eutrophic lakes. Limnology and Oceanography, 1992, 37(3): 577-589. DOI:10.4319/lo.1992.37.3.0577 |
| [24] |
Wang LZ, Wang GX. Influence of submerged macrophytes on phosphorus transference between sediment and overlying water in decomposition period. Acta Ecologica Sinica, 2013, 33(17): 5426-5437. DOI:10.5846/stxb |
| [25] |
Kocy M, Wilson SD. Litter decomposition and nitrogen dynamics in Aspen forest and mixed-grass prairie. Ecology, 1997, 78(7): 732-739. |
| [26] |
Jansson PE, Berg B. Temporal variation of litter decomposition in relation to simulated soil climate:Long-termd ecom position in a Scots pine forest. Canadian Journal of Botany, 1985, 63(4): 1008-1016. |
| [27] |
Melillo JM, Naiman RJ, Aber JD et al. Factors controlling mass loss and nitrogen dynamics of plant litter decaying in northern streams. Bulletin of Marine Science, 1984, 35: 341-356. |
| [28] |
叶春, 王博. 沉水植物黑藻早期分解过程及影响因素研究. 中国农学通报, 2009, 25(17): 260-264. |
| [29] |
Wang SR, Jin XC, Bu QY et al. Effects of dissolved oxygen supply level on phosphorus release from lake sediments. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008, 316(1/3): 245-252. |
| [30] |
Li YF, Luo AC, Wei XH et al. Changes in phosphorus fractions, pH, and phosphorus activity in rhizosphere of two rice genotupes. Pedosphere, 2008, 18(6): 785-794. DOI:10.1016/S1002-0160(08)60074-0 |
| [31] |
Horppila J, Nurminen L. Effects of different macrophyte growth forms on sediment and P resuspension in a shallow lake. Hydrobiologia, 2005, 545(1): 167-175. DOI:10.1007/s10750-005-2677-9 |
| [32] |
Hang W, Joseph H, Kandice S et al. Phosphorus fiuxes at the sediment-water interface in subtropical wetlands subjected to experimental warming:A microcosm study. Chemosphere, 2013, 90: 1794-1804. DOI:10.1016/j.chemosphere.2012.08.044 |
| [33] |
Jiang X, Jin XC, Yao Y et al. Effects of biological activity, light, temperature and oxygen on phosphorus release processes at the sediment and water interface of Taihu Lake, China. Water Research, 2008, 42: 2251-2259. DOI:10.1016/j.watres.2007.12.003 |
| [34] |
Wang SR, Jin XC, Zhao HC et al. Phosphorus fractions and its release in the sediments from the shallow lakes in the middle and lower reaches of Yangtze River area in China. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2006, 273(1/2/3): 109-116. |
| [35] |
Sun SJ, Huang SL, Sun XM et al. Phosphorus fractions and its release in the sediments of Haihe River, China. Journal of Environmental Sciences, 2009, 21(3): 291-295. DOI:10.1016/S1001-0742(08)62266-4 |
| [36] |
Kleeberg A, Kozerski H. Phosphorus release in Lake Groger Muggelsee and its implications for lake restoration. Hydrobiologia, 1997, 342(1): 9-26. |
| [37] |
Haygarth PM, Condron LM, Heathwaite AL et al. The phosphorus transfer continuum:Linking source to impact with an interdisciplinary and multi-scaled approach. Science of the Total Environment, 2005, 344(1/2/3): 5-14. |
| [38] |
Carpenter SR, Lodge DM. Effects of submersed macrophytes on ecosystem processes. Aquatic Botany, 1986, 26: 341-370. DOI:10.1016/0304-3770(86)90031-8 |
| [39] |
Jin XC, Wang SR, Pang Y. The adsorption of phosphate on different trophic lake sediments. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2005, 254: 241-248. |
| [40] |
Kim LH, Choi E, Stenstrom MK. Sediment characteristics, phosphorus types and phosphorus release rates between river and lake sediments. Chemosphere, 2003, 27: 261-266. |
| [41] |
Gao L. Phosphorus release from the sediments in Rongcheng Swan Lake under different pH conditions. Procedia Environmental Sciences, 2012, 13: 2077-2084. DOI:10.1016/j.proenv.2012.01.197 |
| [42] |
王晓蓉, 华兆哲, 徐菱等. 环境条件变化对太湖沉积物磷释放的影响. 环境化学, 1996, 15(1): 15-19. |
| [43] |
刘浏, 刘晓端, 徐清等. 密云水库沉积物中磷的形态和分布特征. 岩矿测试, 2003, 22(2): 81-85. |
| [44] |
李晖, 周琪, 安淼. 周庄水体内源磷负荷释放规律及其稳定性研究. 上海环境科学, 2003, 22(12): 943-947. |
| [45] |
汪家权, 孙亚敏, 钱家忠等. 巢湖底泥磷的释放模拟实验研究. 环境科学学报, 2002, 22(6): 738-742. |
| [46] |
王庭健. 城市富营养化湖泊沉积物中磷负荷及其释放对水质的影响. 环境科学研究, 1994, 7(4): 12-20. |
| [47] |
Boers PCM, Van HO. Phosphorus release from the peaty sediments of the Loosdrecht lakes(the Netherlands). Water Research, 1988, 22(3): 355-363. DOI:10.1016/S0043-1354(88)90240-0 |
| [48] |
Liikanen ANU. Effects of temperature and oxygen availability on greenhouse gas and nutrient dynamics in sediment of a eutrophic mid-boreal lake. Biogeochemistry, 2002, 59: 269-286. DOI:10.1023/A:1016015526712 |
| [49] |
Longhi D, Bartoli M, Viaroli P. Decomposition of four macrophytes in wetland sediments:Organic matter and nutrient decay and associated benthic processes. Aquatic Botany, 2008, 89(3): 303-310. DOI:10.1016/j.aquabot.2008.03.004 |
| [50] |
Chimney MJ, Pietro KC. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA). Ecological Engineering, 2006, 27(4): 301-321. DOI:10.1016/j.ecoleng.2006.05.016 |
| [51] |
Rogers KH, Breen CM. Decomposition of Potamogeton crispus L:The effects of drying on the pattern of mass and nutrient loss. Aquatic Botany, 1982, 12: 1-12. DOI:10.1016/0304-3770(82)90002-X |
| [52] |
Gerlce J, Hemnmn R. Adsorption of orthophosphate to humic-Fe-complexes and to amorphous Fe-oxide. Zeitschrift für Pflanzenernährung und Bodenkunde, 1992, 155: 233-236. DOI:10.1002/(ISSN)1522-2624 |
| [53] |
Torrent J, Schwertmann U, Barron V. Phosphate sorption by natural hematites. European Journal of Soil Science, 1994, 45(1): 45-51. DOI:10.1111/ejs.1994.45.issue-1 |
| [54] |
Wang SG, Jin XC, Pang Y et al. Phosphorus fractions and phosphate sorption characteristics in relation to the sediment compositions of shallow lakes in the middle and lower reaches of Yangtze River region, China. Journal of Colloid and Interface Science, 2005, 289(2): 339-346. DOI:10.1016/j.jcis.2005.03.081 |
| [55] |
Zhang RY, Wu FC, Liu CQ et al. Characteristics of organic phosphorus fractions in different trophic sediments of lakes from the middle and lower reaches of Yangtze River region and Southwestern Plateau, China. Environmental Pollution, 2008, 152(2): 366-372. DOI:10.1016/j.envpol.2007.06.024 |
| [56] |
Kaiserli A, Voutsa D, Samara C. Phosphorus fractionation in lake sediments-Lakes Volvi and Koronia. N Greece Chemosphere, 2002, 46: 1147-1155. |
| [57] |
Benitez NCR, O'Neill Madden LP, Styles RM et al. Inorganic and organic sinking particulate phosphorus fluxes across the oxic/anoxic water column of Cariaco Basin, Venezuela. Marine Chemistry, 2007, 105(1/2): 90-100. |
| [58] |
Jin XC, Wang SR, Chu JZ et al. Organic phosphorus in shallow lake sediments in middle and lower reaches of the Yangtze River area in China. Pedosphere, 2008, 18(3): 394-400. DOI:10.1016/S1002-0160(08)60030-2 |
| [59] |
Turner BL. Organic phosphorus in Madagascan rice soils. Geoderma, 2006, 136(1/2): 279-288. |
| [60] |
Turner BL, Cade-Menun BJ, Condron LM et al. Extraction of soil organic phosphorus. Talanta, 2005, 66(2): 294-306. DOI:10.1016/j.talanta.2004.11.012 |
 2016, Vol. 28
2016, Vol. 28 

